Behandeling miskraamrest
Uitgangsvraag
- Verdient een expectatieve of een medicamenteuze behandeling van een miskraamrest de voorkeur?
- Verdient een expectatieve of een chirurgische behandeling van een miskraamrest de voorkeur?
- Verdient een chirurgische of een medicamenteuze behandeling van een miskraamrest de voorkeur?
Aanbeveling
Bespreek met een patiënt met een zwangerschapsrest na een miskraam de opties expectatief, medicamenteus en chirurgisch met de voor- en nadelen en laat de patiënt meebeslissen over de keuze van het beleid (Shared Decision Making).
Adviseer expectatieve of medicamenteuze behandeling bij een zwangerschapsrest na een miskraam.
Bespreek dat expectatief beleid en medicamenteuze behandeling opties zijn die een lager succespercentage hebben maar niet duidelijk vaker leiden tot alsnog een operatie, niet meer complicaties laten zien en leiden tot goede patiënttevredenheid.
Verricht een chirurgische ingreep bij risicofactoren (bijvoorbeeld hemodynamisch instabiele patiënt), na falen van de eerdere behandelopties of bij een duidelijke wens van de patiënt.
Verricht bij een septisch zwangerschapsrest (en toedienen van antibiotica) een chirurgische ingreep.
Overwegingen
De onderstaande overwegingen en aanbevelingen gelden voor het overgrote deel van de populatie waarop de uitgangsvraag betrekking heeft.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Een deel van de miskramen verloopt afwijkend en is incompleet; dan blijkt er sprake van een zwangerschapsrest waarbij besloten dient te worden hoe deze het best te behandelen. Er is praktijkvariatie tussen afwachten, medicamenteus behandelen of chirurgisch behandelen. Bij een deel van de patiënten zal de uterus met meer tijd de rest zelf afstoten en is aanvullende behandeling niet nodig. Welke patiënt wel extra behandeling nodig heeft is op basis van bestaande evidence niet goed duidelijk; wanneer en óf er een echoscopisch onderzoek gedaan moet worden en wanneer en óf er aanvullende behandeling dient plaats te vinden. De keuze wordt gemaakt op basis van klinische symptomen bij presentatie, de ervaring / voorkeur van de arts en de wens van de patiënt (informed choice). Hiervoor is het belangrijk te weten wat de kansen op succes zijn en wat de kansen zijn op complicaties die kunnen optreden.
Als er sprake blijkt van een klinisch acute situatie (acuut bloedend en/of hemodynamisch instabiel) dan is er een directe indicatie voor een chirurgische behandeling. Ook indien er sprake is van een geïnfecteerde rest na miskraam zal een behandeling met antibiotica worden overwogen met daarna een chirurgische interventie. Er worden hier geen criteria voor gegeven aangezien dit niet onder deze module valt, echter wordt het door de werkgroep wel als een waardevolle aanvulling bij de richtlijn gezien.
De behandeling van een niet-acuut presenterende patiënt met een zwangerschapsrest na miskraam kan op verschillende manieren worden gedaan. Zowel expectatief beleid, medicamenteus (misoprostol) en chirurgisch (chirurgische behandeling of hysteroscopische resectie) worden in Nederland aangeboden. Er zijn voor de verschillende behandelmethodes RCT’s gedaan waarbij de drie onderdelen met elkaar worden vergeleken. Echter de (sub) groepen in deze RCT’s zijn relatief klein en er is een relatief korte follow up om de complicaties en risico’s op de lange termijn (volgende zwangerschap) goed te kunnen inschatten.
De chirurgische behandeling van een zwangerschapsrest na miskraam lijkt vaker succesvol vergeleken met zowel een expectatief - als een medicamenteus beleid (lage Grade). De verschillen zijn klein. Daarnaast is het onduidelijk of er sprake is van minder re-interventies, complicaties of een verschil in patiënttevredenheid. Er worden verschillende definities gehanteerd voor een miskraamrest en bij een rest na (ook na een chirurgische behandeling) wordt soms alsnog een afwachtend beleid gevolgd. Door de korte follow-up is er ook niets bekend over de opvolgende zwangerschappen. Dit maakt het advies hierover ingewikkeld en is de klinische betekenis hiervan onduidelijk. Mogelijk is het succes wat men meet meer een ‘echoscopisch succes’ dan een ‘klinisch succes’.
Er is gekeken naar een subgroep patiënten die initieel werden behandeld met misoprostol voor een miskraam, bij wie er nadien een verdenking was op een incomplete evacuatie. Chirurgische behandeling van een rest na misoprostol was vaker succesvol dan expectatief beleid. De evidence wordt als laag gegradeerd. Ook hierbij valt op dat er geen duidelijk verschil is tussen beide groepen t.a.v. re-interventie ingrepen, complicaties en fertiliteit op de langere termijn. Een aantal patiënten kregen een chirurgische interventie en een aantal uit de expectatieve groep hadden ondanks de echoscopische verdenking op een persisterende rest uiteindelijk toch geen interventie nodig. Dit maakt een hard advies hierover daarom ook lastig. Mogelijk zijn de aantallen te klein, de follow-up te kort of is ook hier het een niet klinisch significant succes (dus echoscopisch succesvol en niet klinisch succesvol) omdat er geen verdere behandeling nodig is en de uitkomst vergelijkbaar is.
Alle studies laten een relatief lage kans zien op korte termijn complicaties, het grootste risico is een (spoed/niet geplande) chirurgische behandeling na een afwachtend beleid. De kans op een infectie is vergelijkbaar in de drie groepen. Van belang is de klinische significantie van de complicaties zoals levensbedreigende bloeding, Asherman syndroom, subfertiliteit, vroeggeboorte, uterus- of placentaproblemen in een volgende zwangerschap. Deze zijn relatief zeldzaam maar kunnen forse impact hebben op het leven van de vrouw en de zorg (o.a. kosten). Hiervoor zijn de studies ‘underpowered’ en kan er dus geen uitspraak over gedaan worden.
Van belang is dat een chirurgische behandeling als primaire behandeling voor een niet-vitale zwangerschap (miskraam) meer kans geeft op vroeggeboorte in een volgende zwangerschap in vergelijking met medicamenteuze behandeling. Mogelijk is dit te wijten aan de cervixdilatatie die gebeurt bij een chirurgische behandeling (Lemmers, 2016). Er zijn geen gegevens hierover ten aanzien van een chirurgische behandeling in verband met een miskraamrest.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Opvallend is dat de patiënttevredenheid in alle groepen vergelijkbaar was. Hieruit zou je kunnen opmaken dat, ongeacht dat een vrouw voor een specifieke behandeling heeft gekozen, zij daar achteraf toch blij mee is. Of dat elke behandeling voor een patiënt dezelfde tevredenheid geeft. Een goede counseling met informed choice is belangrijk in de keuze en tevredenheid tot behandeling bij een zwangerschapsrest na miskraam.
Er werd meer misselijkheid, braken en diarree gerapporteerd in de misoprostolgroep in vergelijking met de chirurgische groep. Er is niet beschreven wat de patiënten aan anti-emetica en pijnstillers kregen voorgeschreven in zowel de medicamenteuze en chirurgische groep. Mogelijk kregen de patiënten bij hun geplande chirurgie (bijvoorbeeld algehele anesthesie) routinematig anti-emetica en extra (sterkere) pijnstillers toegediend. De verwachting is dat patiënten die misoprostol kregen dit niet gelijkwaardig routinematig kregen voorgeschreven. Het is niet duidelijk of deze bijwerkingen minder gerapporteerd zouden zijn als patiënten naast de misoprostol ook routine anti-emetica en extra sterke pijnstillers zouden krijgen. Ondanks toename van deze bijwerkingen beoordeelde de patiënten hun tevredenheid alsnog als hoog na de misoprostol (en niet verschillend met de chirurgische groep). Wel is het van belang dit in de counseling mee te nemen zodat dit bij de beslissing tot de keuze van behandeling kan worden meegenomen door de patiënt.
De gevonden studies (RCT’s, meta-analyses) laten zien dat de verschillende behandel opties vergelijkbaar zijn t.a.v. succesvolle behandeling, complicaties, re-interventies, patiënttevredenheid, echter dat de bewijslast voor alle onderdelen laag of zeer laag is.
Er lijkt een voorkeur voor de chirurgische behandeling (niet gespecificeerd welke) met meer succespercentage (lage grade) zonder duidelijk klinische consequenties (vergelijkbare re-interventies, complicaties of patiënttevredenheid). Maar onduidelijk wat de consequenties op langere termijn bij een volgende zwangerschap zijn.
Kosten (middelenbeslag)
De kosten mogen worden meegenomen in de beslissing van de behandeling. Chirurgisch zal de duurste optie zijn, maar als deze vaker succesvol is met minder poliklinische afspraken dan kan dit uiteindelijk de beste optie zijn. Het expectatieve beleid zal in beginsel de goedkoopste zijn, maar indien er vaker poliklinische vervolgafspraken met echoscopie nodig is met vaker een (spoed)opname en chirurgische behandeling, dan kan het duurder uitvallen dan een primair opgezette chirurgische behandeling. Dit zelfde geldt voor de medicamenteuze behandeling. Misoprostol is goedkoop, maar ook dan is mogelijk dat vaker poliklinische vervolgafspraken met echoscopie nodig zijn met kans op een (spoed)opname met chirurgische behandeling, en kan het duurder uitvallen dan een primair opgezette chirurgische behandeling. Indien er op de langere duur (volgende zwangerschap, vroeggeboorte, placentaproblemen) meer complicaties optreden kan dit ook een effect hebben op de totale kosten, maar hier zijn geen gegevens over.
Aanvaardbaarheid voor de overige relevante stakeholders
Geen bijzonderheden op dit domein.
Haalbaarheid en implementatie
Geen bijzonderheden op dit domein.
Rationale/ balans tussen de argumenten voor en tegen de interventie
De werkgroep is van mening dat er met de patiënt samen, per casus, een afweging gedaan kan worden tot welke behandeling besloten wordt. Bij een zwangerschapsrest na miskraam heeft een chirurgische ingreep op korte termijn het hoogste succespercentage, maar expectatief beleid en medicamenteuze behandeling (succespercentages +/- 5%) zijn effectieve opties die niet duidelijk vaker leiden tot alsnog een operatie, niet meer complicaties laten zien en die ook leiden tot goede patiënttevredenheid. Het advies is daarom in beginsel te kiezen voor expectatief of medicamenteuze behandeling bij een zwangerschapsrest na miskraam. Verricht een chirurgische ingreep bij risicofactoren of na falen van de eerdere opties of bij een duidelijke wens hiervoor van de patiënt na counseling.
Voor de langere termijn effecten, zeldzame maar klinisch significante zwangerschapscomplicaties, is meer onderzoek noodzakelijk met grotere patiëntgroepen.
Onderbouwing
Achtergrond
Indien er sprake is van een rest na het doormaken van een miskraam (zwangerschapsrest) is het onduidelijk wat het beste beleid is. Er bestaat in Nederland, maar ook in de rest van de wereld, vooralsnog geen consensus. De definitie van een zwangerschapsrest na miskraam is niet goed omschreven (welke criteria) en dit bemoeilijkt de consensus en beleidsvorming. In het algemeen wordt er gesproken van een rest indien er een miskraam geweest is en er sprake is van aanhoudende pijn, vaginaal bloedverlies met daarbij op de echo aanwijzingen voor een rest in utero. De afkapwaardes van de afmetingen van de rest in utero worden wisselend gedefinieerd. Uiteraard zal de behandeling anders zijn indien er sprake is van een acute situatie met veel bloedverlies, al dan niet met hemodynamische consequenties. Er zal dan in de regel gekozen worden voor een operatieve ingreep (chirurgische behandeling in acute setting).
Deze deelvragen van de richtlijn gaan over de niet-acute situatie met een niet-ernstig bloedende vrouw met verdenking miskraamrest die hemodynamisch stabiel is, mogelijk zelfs geen bloedverlies meer heeft. In de praktijk is er veel variatie tot welke behandeling er besloten wordt: expectatief, medicamenteus of operatief (chirurgische behandeling of hysteroscopie). Alle opties kennen voor- en nadelen en risico’s en de patiënt kan ook een voorkeur hebben. Een complicatie van een zwangerschapsrest is een (forse) bloeding of een infectie resulterend in een mogelijke opname en (spoed)operatie.
Een deel van de patiënten met een miskraamrest behoeft wellicht geen operatieve interventie en medicatie zou de uterus kunnen stimuleren om de rest uit te drijven om zo een langer beloop en/of complicatie te voorkomen. Maar ook dan blijft de kans dat er alsnog een complicatie optreedt, dan wel een operatie nodig is, bestaan. Het inplannen van een chirurgische ingreep (chirurgische behandeling of hysteroscopie) kan zo'n complicatie voorkomen met als nadeel een kans op uterusperforatie, intra-uteriene adhesies (onder andere het syndroom van Asherman) en nadelige zwangerschapsuitkomsten in een volgende zwangerschap (vroeggeboorte).
Het doel van deze uitgangsvraag is om consensus te bereiken of er behandeling nodig is indien er sprake is van een zwangerschapsrest bij een niet-acute situatie en zo ja, welke behandeling de voorkeur heeft (met de minste complicaties en het grootste succespercentage).
Conclusies / Summary of Findings
Vergelijking 1 Medicamenteus versus expectatief
1.1 Uitkomstmaat Succesvolle behandeling (cruciaal)
|
Zeer laag GRADE |
Het is onduidelijk of er een verschil is in succesvolle behandeling tussen behandeling met misoprostol of expectatief beleid bij patiënten met een incomplete miskraam
Bron (Kim, 2017) |
1.2 Uitkomstmaat Re-interventie (cruciaal)
|
Laag GRADE |
Er is mogelijk geen verschil in re-interventies (chirurgische ingreep) na behandeling met misoprostol of expectatief beleid bij patiënten met een incomplete miskraam.
Bron (Kim, 2017) |
Vergelijking 2 Chirurgisch versus expectatief
2.1 Uitkomstmaat Succesvolle behandeling (cruciaal)
|
Laag GRADE |
Mogelijk leidt chirurgische behandeling vaker tot succesvolle behandeling dan expectatief beleid bij patiënten met een incomplete miskraam.
Bronnen (Al-Ma’ani, 2014; Nadarajah, 2014; Dangalla, 2012; Lemmers, 2016, Lemmers 2017a) |
2.2 Uitkomstmaat Re-interventie (cruciaal)
|
Zeer laag GRADE |
Het is onduidelijk of er een verschil is in re-interventies na chirurgische behandeling vergeleken met expectatief beleid bij patiënten met een incomplete miskraam.
Bron (Dangalla, 2012; Lemmers, 2016, Lemmers, 2017a) |
2.3 Uitkomstmaat Complicaties (cruciaal)
|
Zeer laag GRADE |
Het is onduidelijk of er een verschil in complicaties is tussen patiënten die chirurgisch of expectatief behandeld zijn voor een incomplete miskraam.
Bron (Dangalla, 2012; Lemmers, 2016) |
2.4 Uitkomstmaat Tevredenheid (belangrijk)
|
Zeer laag GRADE |
Het is onduidelijk of er een verschil is in tevredenheid tussen patiënten chirurgisch of expectatief behandeld voor een incomplete miskraam.
Bron (Dangalla, 2012) |
2.5 Uitkomstmaat Fertiliteit (belangrijk)
|
Zeer laag GRADE |
Het is onduidelijk of er een verschil is in fertiliteit na chirurgische behandeling versus expectatief beleid bij patiënten met een incomplete miskraam na eerdere behandeling met misoprostol.
Bron (Lemmers, 2017b) |
Vergelijking 3 Medicamenteus versus chirurgisch
3.1 Uitkomstmaat Succesvolle behandeling (cruciaal)
|
Zeer laag GRADE |
Het is onduidelijk of er verschil is in succesvolle behandeling na behandeling met misoprostol of chirurgische behandeling bij patiënten met een incomplete miskraam.
Bronnen (Kim, 2017; Shokry, 2014) |
3.2 Uitkomstmaat Re-interventie (cruciaal)
|
Laag GRADE |
Er zijn mogelijk meer ongeplande chirurgische ingrepen (re-interventies) na behandeling met misoprostol vergeleken bij chirurgische behandeling van patiënten met een incomplete miskraam.
Bron (Kim, 2017) |
3.3 Uitkomstmaat Complicaties- ontsteking in het bekken <14 dagen (cruciaal)
|
Laag GRADE |
Er lijkt geen verschil te zijn in ontstekingen in het kleine bekken na behandeling met misoprostol in vergelijking met chirurgische behandeling van patiënten met een incomplete miskraam.
Bron (Kim, 2017) |
3.4 Uitkomstmaat Complicaties – beschadigingen aan de cervix (cruciaal)
|
Zeer laag GRADE |
Het is onduidelijk of er een verschil is in beschadiging aan de cervix na behandeling met misoprostol in vergelijking tot chirurgische behandeling van patiënten met een incomplete miskraam.
Bron (Kim, 2017) |
3.5 Uitkomstmaat Bijwerkingen- misselijkheid (cruciaal)
|
Laag GRADE |
Mogelijk komt de bijwerking misselijkheid meer voor bij behandeling met misoprostol in vergelijking met chirurgische behandeling bij patiënten met een incomplete miskraam.
Bron (Kim, 2017) |
3.6 Uitkomstmaat Bijwerkingen – diarree (cruciaal)
|
Redelijk GRADE |
Waarschijnlijk komt de bijwerking diarree meer voor bij behandeling met misoprostol in vergelijking met chirurgisch behandelde patiënten met een incomplete miskraam.
Bron (Kim, 2017) |
3.7 Uitkomstmaat Bijwerkingen – braken (cruciaal)
|
Redelijk GRADE |
Waarschijnlijk komt de bijwerking braken meer voor bij behandeling met misoprostol in vergelijking met chirurgisch behandelde patiënten met een incomplete miskraam.
Bron (Kim, 2017) |
3.8 Uitkomstmaat Tevredenheid (belangrijk)
|
Redelijk GRADE |
Er is waarschijnlijk geen verschil in tevredenheid over de behandeling bij patiënten met een incomplete miskraam na behandeling met misoprostol in vergelijking met chirurgische behandeling.
Bronnen (Kim, 2017; Shokry, 2014) |
Samenvatting literatuur
Vergelijking 1: Leidt bij patiënten met een verdenking op een zwangerschapsrest na miskraam (na spontane miskraam of na medicamenteuze behandeling voor een miskraam) een (2e) medicamenteuze behandeling of een expectatieve behandeling tot de beste uitkomsten?
Beschrijving studies
Voor deze vergelijking werd één studie geïncludeerd (Kim, 2017). De studie van Kim (2017) is een systematische review en includeerde 24 studies met 5577 patiënten die werden behandeld voor incomplete miskraam. Patiënten hadden een incomplete miskraam vastgesteld op basis van echo of klinische diagnose. Studies naar patiënten met niet-vitale graviditeit (miskraam nog niet in gang) en zwangerschapsbeëindiging (abortus provocatus) werden niet geïncludeerd. Deze systematische review vergeleek medicamenteuze behandeling met expectatieve behandeling en chirurgische behandeling en resultaten uit deze studie zullen daarom ook bij vergelijking 1 en vergelijking 3 worden meegenomen. In de systematische review van Kim (2017) werd behandeling met misoprostol vergeleken met expectatieve behandeling bij patiënten met een incomplete miskraam (zwangerschapsduur <13wk). Voor deze vergelijking werden drie studies (n=335 patiënten) in de systematische review geïncludeerd (Blohm, 2005; Shelley, 2005; Trinder, 2006). Alle geïncludeerde studies vergeleken vaginale misoprostol met afwachtend beleid.
Resultaten
1.1 Uitkomstmaat Succesvolle behandeling (complete miskraam) (cruciaal)
Twee van de drie studies in Kim (2017) rapporteerden de uitkomstmaat succesvolle behandeling (=complete miskraam) (Blohm, 2005; Shelley, 2005) (n=150). In de medicamenteuze groep was het aantal succesvolle behandelingen 60/74 en in de expectatieve groep met afwachtend beleid was het aantal succesvolle behandelingen 44/76. Er is statistisch geen verschil tussen de groep behandeld met misoprostol (vaginaal misoprostol in beide studies) en de groep expectatief beleid (gepoolde RR 1,23, 95%BI 0,72 tot 2,10) (figuur 1). De heterogeniteit in de uitkomst in de groep expectatief beleid was hoog (I2=81%), mogelijke verklaring hiervoor is het verschil in follow-upduur. Blohm (2005) rapporteerde succesvolle behandeling na één week (52%) en Shelley (2005) na twee weken (85%). Het gevonden verschil is niet klinisch relevant.
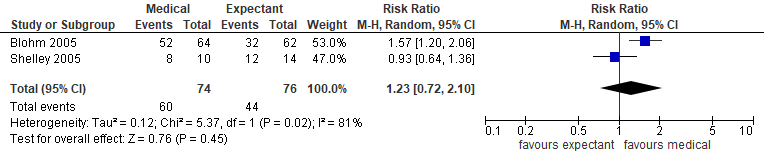
Figuur 1. Succesvolle behandeling medicamenteus versus expectatief (bron Kim, 2017)
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat succesvolle behandeling is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias, slechts een van de twee studies geblindeerd), heterogeniteit van de resultaten en het geringe aantal patiënten (n=150, imprecisie) naar ‘zeer laag’.
1.2 Uitkomstmaat Re-interventie- noodzaak tot verdere interventie (cruciaal)
Twee van de drie studies in Kim (2017) rapporteerden de uitkomstmaat ongeplande chirurgische interventie (Blohm, 2005; Trinder, 2006) (n=308). In de medicamenteuze groep was het aantal re-interventies 34/154 en in de expectatieve groep 48/154. Er is geen klinisch relevant verschil in ongeplande chirurgische ingrepen tussen de groepen behandeld met misoprostol of een afwachtend beleid (gepoolde RR 0,62 95%BI 0,17 tot 2,26) (figuur 2).
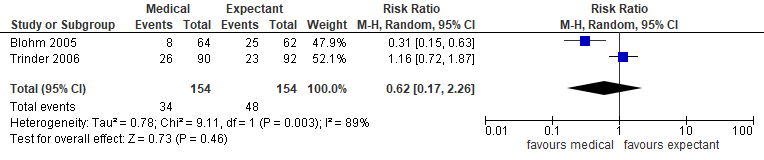
Figuur 2. Re-interventie medicamenteus versus expectatief (bron Kim, 2017)
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat re-interventie is met twee niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (risk of bias) en de grote mate van heterogeniteit (inconsistentie) naar ‘laag’.
1.3 Uitkomstmaat Patiënttevredenheid (belangrijk)
Geen van de studies rapporteerden de uitkomstmaat patiënttevredenheid
Bewijskracht van de literatuur
Voor de uitkomstmaat patiënttevredenheid werd geen GRADE beoordeling uitgevoerd vanwege het ontbreken van data.
1.4 Uitkomstmaat Lange termijn Fertiliteit (belangrijk)
Geen van de studies rapporteerden de uitkomstmaat fertiliteit.
Bewijskracht van de literatuur
Voor de uitkomstmaat fertiliteit werd geen GRADE beoordeling uitgevoerd vanwege het ontbreken van data.
Vergelijking 2 Leidt bij patiënten met een verdenking op een zwangerschapsrest na miskraam (na spontane miskraam of na medicamenteuze behandeling voor een miskraam) een chirurgische behandeling of een expectatieve behandeling tot de beste uitkomsten?
Beschrijving studies
Voor deze vergelijking werden drie studies geïncludeerd die chirurgische behandeling versus expectatieve behandeling als primaire behandeling rapporteerden bij patiënten met een incomplete miskraam (Al-Ma’ani, 2014; Nadaraja, 2014; Dangalla, 2012).
De studie van Al-Ma’ani (2014) is een RCT waarin 234 patiënten werden geïncludeerd met incomplete miskraam en niet-vitale zwangerschap. De resultaten voor succesvolle behandeling na 4 weken zijn apart gerapporteerd voor de groep patiënten met een incomplete miskraam (n=93). Succesvolle behandeling na expectatief beleid was gedefinieerd als spontane complete evacuatie van de uterus binnen 4 weken na inclusie. Succesvolle behandeling na chirurgische ingreep was gedefinieerd als het niet herhalen van chirurgische behandeling binnen 4 weken.
De studie van Nadarajah (2014) is een RCT waarin 360 patiënten werden geïncludeerd met incomplete miskraam en niet-vitale zwangerschap volgens RCOG-richtlijn. De resultaten voor succesvolle behandeling na 6 weken zijn apart gerapporteerd voor de groep patiënten met een incomplete miskraam (n=152). Succesvolle behandeling was gedefinieerd als complete evacuatie van de uterus zonder enige complicaties binnen 6 weken.
De studie van Dangalla (2012) is een RCT waarin patiënten met een incomplete miskraam (15-50mm) werden geïncludeerd (n=160) en chirurgische behandeling werd vergeleken met afwachtend beleid. De uitkomstmaat succesvolle behandeling werd gerapporteerd op 1, 2, en 4 weken na behandeling.
Voor deze vergelijking werden ook drie studies geïncludeerd na initiële behandeling met misoprostol. Deze drie studies rapporteerden de resultaten van de MisoREST trial (Lemmers 2017a, 2017b, 2016) waarin chirurgisch versus expectatief beleid bij zwangerschapsrest na eerdere behandeling met misoprostol werd vergeleken.
De gerandomiseerde studie van Lemmers (2016) includeerde patiënten met een incomplete miskraam die eerder behandeld waren met misoprostol (n=59). Patiënten werden toegewezen aan chirurgische behandeling (zuigcurettage, chirurgische behandeling met stompe of scherpe chirurgische behandeling) of expectatief beleid. Gerapporteerde uitkomstmaten waren succesvolle behandeling (lege uterus na 6 weken en/of ongecompliceerd klinisch beloop na 3 maanden) en complicaties. De studie van Lemmers (2017a) is een observationele studie en rapporteert de resultaten van een cohort patiënten van de MisoREST studie (n=197) die niet gerandomiseerd werden, maar zelf kozen voor een van de behandelopties. De studie van Lemmers (2017b) rapporteerde lange termijn fertiliteitsuitkomsten van zowel de patiënten uit de RCT (Lemmers, 2016) en het cohort (Lemmers, 2017a) van de MisoREST studie (n=198).
Resultaten
2.1 Uitkomstmaat Succesvolle behandeling (cruciaal)
Drie studies rapporteerden succesvolle behandeling (Al-Ma’ani, 2014; Nadaraja, 2014; Dangalla, 2012) zonder voorbehandeling. In de interventiegroep was het aantal succesvolle behandelingen 194/203 en in de controlegroep 178/202. Dit verschil was niet klinisch relevant tussen de twee groepen(RR 1,06, 95%BI 1,00 tot 1,13) (figuur 3). Twee studies rapporteerden succesvolle behandeling na eerdere behandeling met misoprostol (Lemmers, 2016; Lemmers, 2017a). In de interventiegroep was het aantal succesvolle behandelingen 91/95 en in de controlegroep 134/161. Dit verschil was niet klinisch relevant (RR 1,15 95%BI 1,04 tot 1,28).
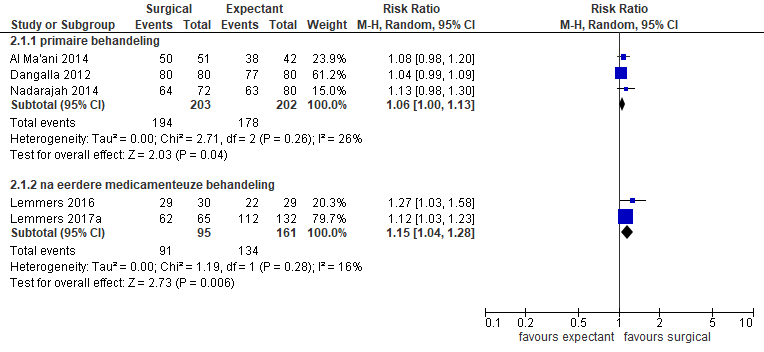
Figuur 3. Succesvolle behandeling chirurgisch versus expectatief (bron Al-Ma’ani, 2014; Nadaraja, 2014; Dangalla, 2012; Lemmers, 2016; Lemmers, 2017a)
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat succesvolle behandeling is met twee niveaus verlaagd gezien de beperkingen in onderzoeksopzet (risk of bias, geen blindering) en het beperkt aantal patiënten (imprecisie) naar ‘laag’.
2.2 Uitkomstmaat Re-interventie (cruciaal)
Dangalla (2012) rapporteerde 1/80 re-interventies in de groep behandeld met chirurgische behandeling en 3/80 in de groep expectatief behandeld (RR 0,33 95%BI 0,04 tot 3,14). Lemmers (2016) rapporteerde in de groep chirurgische behandeling 2/30 re-interventies (bij 2 patiënten (6,7%) een hysteroscopie) en in de groep expectatief beleid 7/29 re-interventie (bij 4 patiënten (13,8%) chirurgische behandelingen en 3 patiënten (10,3%) hysteroscopie) (RR 0,28 95%BI 0,06 tot 1,22). Lemmers (2017) rapporteerde 11/65 re-interventies in de groep behandeld met chirurgische behandeling (n=2 chirurgische behandeling, n=7 hysteroscopie, n=2 chirurgische behandeling + hysteroscopie) en 24/132 in de groep expectatief behandeld (n=12 chirurgische behandeling, n=7 hysteroscopie, n=5 chirurgische behandeling + hysteroscopie) (RR 0,93 95%BI 0,49 tot 1,78). Deze verschillen zijn niet klinisch relevant.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat re-interventie is met drie niveaus verlaagd gezien de beperkingen in onderzoeksopzet (risk of bias, geen blindering) en het zeer beperkt aantal patiënten (imprecisie) naar ‘zeer laag’.
2.3 Uitkomstmaat Complicaties en bijwerkingen (cruciaal)
Dangalla (2012) rapporteerde 7/80 (9%) complicaties en bijwerkingen in de groep behandeld met chirurgische behandeling (n=3, infectie; n=2 uteriene perforatie, n=2, hoofdpijn/misselijkheid) en 3/80 (4%) complicaties in de groep expectatief beleid (n= 2 infectie; n=1 bloedtransfusie).
Lemmers (2016) rapporteerde 3/30 (10%) complicaties en bijwerkingen in de groep behandeld met chirurgische behandeling (n=1 hoofdpijn; n=1 Ashermann; n=1 infectie waarvoor antibiotica) en 3/29 (10%) complicaties (n=2 spoedcurettage; n=1 infectie waarvoor antibiotica) in de groep expectatief beleid (RR 0,97 95%BI 0,21 tot 4,4). Er was geen klinisch relevant verschil tussen de behandelarmen (Figuur 3).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat complicaties is met drie niveaus verlaagd gezien de beperking in onderzoeksopzet (risk of bias, geen blindering) en het zeer beperkt aantal patiënten (imprecisie) naar ‘zeer laag’.
2.4 Uitkomstmaat Patiënttevredenheid (belangrijk)
Dangalla (2012) rapporteerde geen verschil in tevredenheid met 97,5% (78/80) tevreden in de groep chirurgische behandeling en 97,5% (78/80) tevreden in de groep expectatief beleid. Er was geen klinisch relevant verschil tussen de groepen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat tevredenheid is met drie niveaus verlaagd gezien de beperkingen in onderzoeksopzet (risk of bias, geen blindering) en het zeer geringe aantal patiënten (imprecisie, n=160, slechts één studie) naar ‘zeer laag’.
2.5 Uitkomstmaat Lange termijn fertiliteit (belangrijk)
De uitkomstmaat fertiliteit werd in geen van de studies zonder voorbehandeling gerapporteerd. Lemmers (2017b) rapporteerde van 198 patiënten die opnieuw zwanger wilde worden een succesvolle conceptie bij 92% (67/73) in de groep behandeld met chirurgische behandeling en 96% (120/125) in de groep die expectatief werd behandeld (OR 0,96, 95%BI 0,89 tot 1,03, p = 0,34). Er was sprake van een doorgaande zwangerschap bij 87% (58/67) versus 78% (94/120) (OR 1,12 95%BI 0,99 tot 1,28, p =0,226). Deze verschillen waren niet klinisch relevant.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat fertiliteit is met twee niveaus verlaagd gezien het zeer beperkt aantal patiënten (n=198, slechts 1 studie) (imprecisie) en beperkingen in de onderzoeksopzet (risk of bias) naar ‘zeer laag’.
Vergelijking 3 Leidt bij patiënten met een verdenking op zwangerschapsrest na miskraam (na spontane miskraam of na medicamenteuze behandeling voor een miskraam) een (2e) medicamenteuze behandeling of een chirurgische behandeling tot de beste uitkomsten?
Beschrijving van de studies
Er werden twee studies geïncludeerd voor de vergelijking van medicamenteuze behandeling met chirurgische behandeling (Kim, 2017; Shokry, 2014). De systematische review van Kim (2017) is hierboven reeds beschreven (vergelijking 1). Voor de vergelijking medicamenteuze behandeling met chirurgische behandeling includeerde Kim (2017) zestien studies (n=4044 patiënten) (Bique, 2007; Chigbu, 2012; Dabash, 2010; Dao, 2007; Ganguly, 2010; Montesinos, 2011; Moodliar, 2005; Patua, 2013 Sahin, 2001; Shelley, 2005; Shochet, 2012; Shwekerela 2007; Taylor, 2011; Trinder, 2006; Weeks 2005; Zhang 2005).
De studie van Shokry (2014) is een observationele studie die patiënten includeerde met een verzoek om medische behandeling voor incomplete miskraam (n=120). Patiënten kozen voor medicamenteuze behandeling (misoprostol) (n=60) of vaginale chirurgische behandeling (n=60). Gerapporteerde uitkomstmaten waren uitkomst van de behandeling, tevredenheid en complicaties.
Resultaten
3.1 Uitkomstmaat Succesvolle behandeling (cruciaal)
Succesvolle behandeling werd in de studie van Kim (2017) gedefinieerd als complete miskraam (diagnose van complete miskraam op basis van bevindingen tijdens chirurgische ingreep, echoscopie of beide na een gespecificeerde periode of het stoppen van symptomen of klinische bevinding of beide). In de studie van Kim (2017) werden minder complete miskramen gerapporteerd in de groep behandeld met misoprostol (1923/2023) ten opzichte van de groep chirurgische behandeling (1825/1839) (gepoolde RR 0,96 95% BI 0,94 tot 0,98, 15 studies; 3862 patiënten) (figuur 4). De studie van Shokry (2014) rapporteerde succesvolle uitkomst gedefinieerd als ‘medische probleem is in zijn geheel verholpen’ in de groep chirurgische behandeling van 100% (n=51) en in de groep behandeld met misoprostol 79,6% (n=43) (RR 0,80 95%BI 0,70 tot 0,92). Dit verschil was niet klinisch relevant.
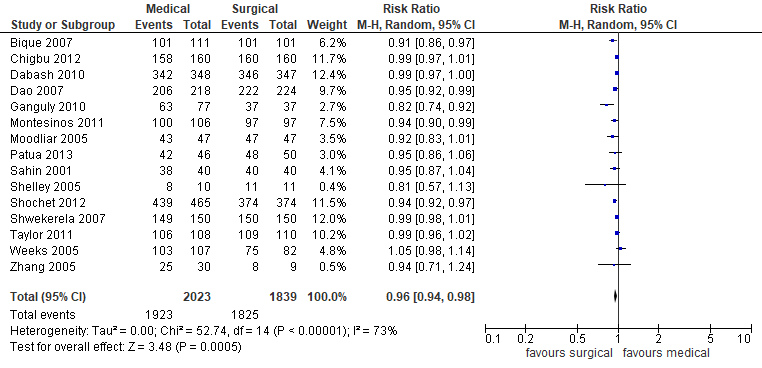
Figuur 4. Succesvolle behandeling medicamenteus versus chirurgisch (bron Kim, 2017)
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat succesvolle behandeling werd met 3 niveaus verlaagd vanwege een grote mate van heterogeniteit (inconsistentie), beperkingen in de studieopzet (risk of bias, niet-geblindeerd) en vermoeden van publicatiebias naar ‘zeer laag’.
3.2 Uitkomstmaat Re-interventie (cruciaal)
Elf studies in de systematische review van Kim (2017) rapporteerden de uitkomstmaat ongeplande chirurgische interventie (n=2690). Er werden meer ongeplande chirurgische ingrepen gerapporteerd in de groep behandeld met misoprostol (79/1371) dan in de groep chirurgisch behandeld (10/1319) (gepoolde RR 5,03 95%BI 2,71 tot 9,35) (figuur 5). Dit is een klinisch relevant verschil.
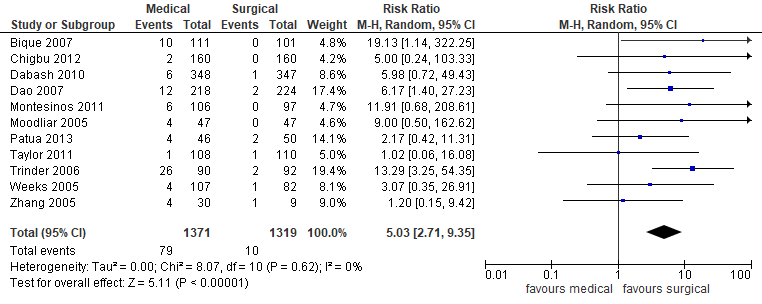
Figuur 5. Re-interventie medicamenteus versus chirurgisch (bron Kim, 2017)
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat re-interventie is met twee niveaus verlaagd gezien de beperkingen in de onderzoeksopzet (risk of bias, blinderering) en mogelijke publicatiebias naar ‘laag’.
3.3 Uitkomstmaat Complicaties– ontsteking in het bekken <14 dagen (pelvic infection) (cruciaal)
In de studie van Kim (2017) werd geen verschil in ontsteking in het kleine bekken gerapporteerd tussen de groep behandeld met misoprostol (7/475) en de groep chirurgisch behandeld (8/432) (gepoolde RR 0,70, 95%BI 0,25 tot 1,99; 7 studies, 907 patiënten) (figuur 6). Dit verschil is niet klinisch relevant.
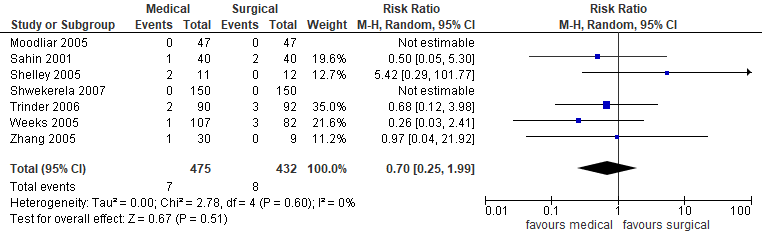
Figuur 6. Complicaties- ontsteking medicamenteus versus chirurgisch (bron Kim, 2017)
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ontsteking in het bekken is met twee niveaus verlaagd gezien de beperking in onderzoeksopzet (-1, risk of bias, geen blindering) en het passeren van de grenzen voor klinische relevantie (-1, imprecisie) naar ‘laag’.
3.4 Uitkomstmaat Complicaties – beschadigingen aan de cervix (cervical damage) (cruciaal)
In de studie van Kim (2017) werd geen verschil gerapporteerd in beschadigingen aan de cervix op basis van 1 studie. Weeks (2005) rapporteerde geen beschadigingen aan de cervix in de groep medicamenteus behandeld (0/107) en vijf in de groep chirurgisch behandeld (5/82) (RR 0,07 95%BI 0,00 tot 1,25; 1 studie, 189 patiënten). Dit verschil is niet klinisch relevant.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat beschadiging aan de cervix is met twee niveaus verlaagd gezien de beperking in onderzoeksopzet (risk of bias, geen blindering) en het zeer beperkt aantal patiënten (imprecisie, slecht één studie) naar ‘zeer laag’.
3.5 Uitkomstmaat Bijwerkingen– misselijkheid (cruciaal)
In de studie van Kim (2017) werd bij meer patiënten misselijkheid gerapporteerd in de groep behandeld met misoprostol (288/1609) dan in de groep chirurgisch behandeld (118/1406) (gepoolde RR 2,50 95%BI 1,53 tot 4,09; 11 studies, 3015 patiënten) (figuur 7). Dit verschil is klinisch relevant.
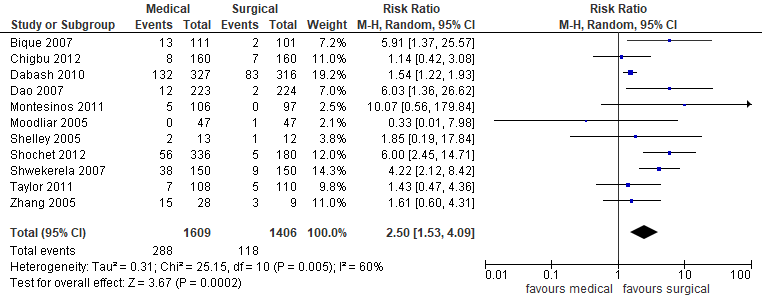
Figuur 7. Bijwerkingen- misselijkheid medicamenteus versus chirurgisch (bron Kim, 2017)
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat misselijkheid werd met twee niveaus verlaagd gezien de beperking in onderzoeksopzet (risk of bias, geen blinderering) en de hoge mate van heterogeniteit (inconsistentie) naar ‘laag’.
3.6 Uitkomstmaat Bijwerkingen – braken (cruciaal)
In de studie van Kim (2017) werd bij meer patiënten braken gerapporteerd in de groep behandeld met misoprostol (101/1581) dan in de groep chirurgisch behandeld (40/1396) (gepoolde RR 1,97 95%BI 1,36 tot 2,85; 10 studies, 2977 patiënten) (figuur 8). Dit verschil is klinisch relevant.
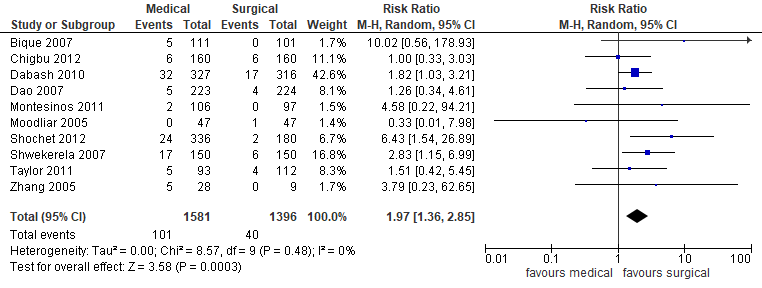
Figuur 8. Bijwerkingen- braken medicamenteus versus chirurgisch (bron Kim, 2017)
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat braken werd met één niveau verlaagd gezien de beperking in onderzoeksopzet (risk of bias, geen blindering) naar ‘redelijk’.
3.7 Uitkomstmaat Bijwerkingen – diarree (cruciaal)
In de studie van Kim (2017) werd bij meer patiënten diarree gerapporteerd in de groep behandeld met misoprostol (13/394) dan in de groep chirurgisch behandeld (0/363) (gepoolde RR 4,82, 95%BI 1,09 tot 21,32; 4 studies, n=757 patiënten) (figuur 9). Dit verschil is klinisch relevant.
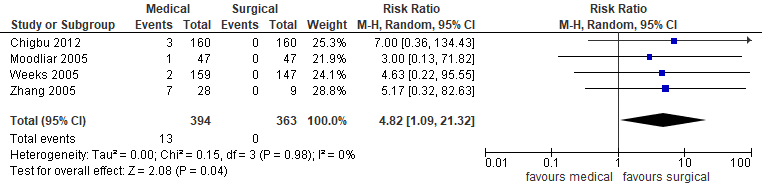
Figuur 9. Bijwerkingen- diarree medicamenteus versus chirurgisch (bron Kim, 2017)
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat diarree werd met één niveau verlaagd gezien de beperking in onderzoeksopzet (risk of bias, geen blindering) naar ‘redelijk’.
De studie van Shokry (2014) rapporteerde bijwerkingen in de groep misoprostol bij 11 patiënten (20,4%) en bij zes patiënten (11,8%) in de groep chirurgische behandeling.
3.8 Uitkomstmaat Patiënttevredenheid (belangrijk)
Tevredenheid werd gerapporteerd in de studie van Kim (2017). Tevredenheid met behandeling was hoog in beide groepen; in de groep behandeld met misoprostol was de range 91% tot 99% en in de groep chirurgische behandeling range 95% tot 100%. Er werd geen verschil gerapporteerd in de dichotome uitkomstmaat tevreden versus ontevreden (RR 1,00, 95%BI 0,99 tot 1,00; 9 studies, 3349 patiënten). Op basis van VAS scores waren er meer patiënten tevreden over de chirurgische behandeling (SMD 1,01, 95%BI 0,01 tot 2,00; 2 studies, 131 patiënten) maar het verschil is klein en niet klinisch significant. Shokry (2014) rapporteerde tevredenheid in de groep behandeld met misoprostol n=46 (85,2%) en in de groep chirurgische behandeling n=47 (92,2%) (RR 0,98, 95%BI 0,81 tot 1,19)
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat patiënttevredenheid is met één niveau verlaagd gezien de beperkingen in de onderzoeksopzet (risk of bias, blinderering) naar ‘redelijk’.
3.9 Uitkomstmaat Lange termijn fertiliteit (belangrijk)
Geen van de studies rapporteerden de uitkomstmaat fertiliteit.
Bewijskracht van de literatuur
Voor de uitkomstmaat patiënttevredenheid werd geen GRADE beoordeling uitgevoerd vanwege het ontbreken van data.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
Vergelijking 1. Leidt bij patiënten met een verdenking op een zwangerschapsrest na miskraam (na spontane miskraam of na medicamenteuze behandeling voor een miskraam) een (2e) medicamenteuze behandeling of een expectatieve behandeling tot de beste uitkomsten?
P Patiënten met een verdenking op een zwangerschapsrest na miskraam
I Medicamenteuze behandeling (Misoprostol)
C Expectatief beleid
O Succesvolle behandeling, patiënttevredenheid, re-interventie, lange termijn fertiliteit, bijwerkingen/complicaties
Vergelijking 2. Leidt bij patiënten met een verdenking op een zwangerschapsrest na miskraam (na spontane miskraam of na medicamenteuze behandeling voor een miskraam) een chirurgische behandeling of een expectatieve behandeling tot de beste uitkomsten?
P Patiënten met een verdenking op een zwangerschapsrest na miskraam
I Chirurgische behandeling
C Expectatief beleid
O Succesvolle behandeling, patiënttevredenheid, re-interventie, lange termijn fertiliteit, bijwerkingen/complicaties
Vergelijking 3. Leidt bij patiënten met een verdenking op zwangerschapsrest na miskraam (na spontane miskraam of na medicamenteuze behandeling voor een miskraam) een (2e) medicamenteuze behandeling of een chirurgische behandeling tot de beste uitkomsten?
P Patiënten met een verdenking op een zwangerschapsrest na miskraam
I Chirurgische behandeling
C Medicamenteuze behandeling
O Succesvolle behandeling, patiënttevredenheid, re-interventie, lange termijn fertiliteit, bijwerkingen/complicaties
Relevante uitkomstmaten
De werkgroep achtte succesvolle behandeling, re-interventie (operatieve ingreep) en complicaties/bijwerkingen voor de besluitvorming cruciale uitkomstmaten; en patiënttevredenheid en lange termijn gevolgen fertiliteit voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De werkgroep definieerde vooraf voor geen van de uitkomstmaten klinische (patiënt) relevante verschillen. We hanteerden daarom, indien van toepassing, de onderstaande grenzen voor klinische relevantie voor dichotome uitkomstmaten en vergeleken de resultaten met deze grenzen: RR < 0,80 of > 1,25) (GRADE recommendation) of Standardized mean difference (SMD=0,2 (klein); SMD=0,5 (matig); SMD=0,8 (groot). De interpretatie van continue uitkomstmaten is sterk context gebonden en hiervoor werden a priori geen grenzen voor klinische relevante benoemd.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (Elsevier) is op 5-12-2018 met relevante zoektermen gezocht naar studies die medicamenteuze behandeling van een zwangerschapsrest vergeleken met chirurgische behandeling of expectatief beleid.
De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 700 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- gepubliceerd in het Nederlands of Engels;
- studiedesign RCT of SR (voor uitkomstmaat lange termijn fertiliteit cohort-studies);
- studie uitgevoerd in land met vergelijkbare standaard van zorg als Nederland.
Op basis van titel en abstract werden in eerste instantie 67 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 59 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 8 studies definitief geselecteerd.
In totaal zijn acht studies opgenomen in de literatuuranalyse (Kim, 2017; Al-Ma’ani, 2014; Nadaraja, 2014; Dangalla, 2012; Shokry, 2014; Lemmers, 2016; Lemmers, 2017a; Lemmers, 2017b). De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Al-Ma'ani W, Solomayer EF, Hammadeh M. (2014). Expectant versus surgical management of first-trimester miscarriage: A randomised controlled study. Archives of Gynecology and Obstetrics. 289(5):1011-5.
- Blohm F, Friden BE, Milsom I, Platz-Christensen JJ, Nielsen S. A randomised double blind trial comparing misoprostol or placebo in the management of early miscarriage. BJOG: an international journal of obstetrics and gynaecology 2005; Vol. 112, issue 8:1090–5.
- Dangalla DP, Goonewardene IM. (2012) Surgical treatment versus expectant care in the management of incomplete miscarriage: a randomised controlled trial. The Ceylon medical journal. 57(4):140-5.
- Kim C, Barnard S, Neilson JP, Hickey M, Vazquez JC, Dou L. Medical treatments for incomplete miscarriage. Cochrane Database Syst Rev. 2017 Jan 31;1:CD007223. doi: 10.1002/14651858.CD007223.pub4. Review. PubMed PMID: 28138973; PubMed Central PMCID: PMC6464743.
- Lemmers M, Verschoor MAC, Oude Rengerink K, Naaktgeboren C, Opmeer BC, Bossuyt PM, et al. (2016). MisoREST: Surgical versus expectant management in women with an incomplete evacuation of the uterus after misoprostol treatment for miscarriage: A randomized controlled trial. Human Reproduction. 31(11):2421-7.
- Lemmers M, Verschoor MAC, Oude Rengerink K, Naaktgeboren C, Bossuyt PM, Huirne JAF, et al. (2017a). MisoREST: Surgical versus expectant management in women with an incomplete evacuation of the uterus after misoprostol treatment for miscarriage: A cohort study. European Journal of Obstetrics Gynecology and Reproductive Biology. 211:83-9.
- Lemmers M, Verschoor MAC, Overwater K, Bossuyt PM, Hendriks D, Hemelaar M, et al. (2017b). Fertility and obstetric outcomes after curettage versus expectant management in randomised and non-randomised women with an incomplete evacuation of the uterus after misoprostol treatment for miscarriage. 2017; European Journal of Obstetrics Gynecology and Reproductive Biology. 211:78-82.
- Nadarajah R, Quek YS, Kuppannan K, Woon SY, Jeganathan R. (2014). A randomised controlled trial of expectant management versus surgical evacuation of early pregnancy loss. European Journal of Obstetrics Gynecology and Reproductive Biology. 178:35-41.
- Shelley JM, Healy D, Grover S. A randomised trial of surgical, medical and expectant management of first trimester spontaneous miscarriage. Australian and New Zealand Journal of Obstetrics and Gynaecology 2005; Vol. 45:122–7.
- Shokry M, Fathalla M, Hussien M, Eissa AA. (2014). Vaginal misoprostol versus vaginal surgical evacuation of first trimester incomplete abortion: Comparative study. Middle East Fertility Society Journal. 19(2):96-101.
- Trinder J, Brocklehurst P, Porter R, Read M, Vyas S, Smith L. Management of miscarriage: expectant, medical, or surgical? Results of randomised controlled trial (miscarriage treatment (MIST) trial). BMJ 2006;332(7552):1235–40.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Kim, 2017
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to May 2016
A: Bique, 2007 B: Blohm, 2005 C: Chigbu, 2012 D: Dabash, 2010 E: Dao, 2007 F: Ganguly, 2010 G: Montesinos, 2011 H: Moodliar, 2005 I:Patua, 2013 J: Sahin, 2001 K: Shelley, 2005 L: Shochet, 2012 M: Shwekerela 2007 N:Taylor, 2011 O: Trinder, 2006 P: Weeks, 2005 Q: Zhang, 2005
Study design: RCT
Source of funding and conflicts of interest: [commercial / non-commercial / industrial co-authorship]
‘authors reports no conflicts of interest’ “no external sources of support supplied.’
|
Inclusion criteria SR: Studies: only included randomised controlled trials (RCTs).
Types of participants Participants were women being treated for spontaneous miscarriage (pregnancy loss at less than 24 weeks), either where there was ultrasound evidence of retained tissue (incomplete miscarriage) or where the diagnosis had beenmade on clinical grounds alone, and where there would be uncertainty whether the miscarriage was complete or incomplete. In communities in which termination of pregnancy was illegal or unavailable, this could have included women who had undergone unsafe abortion.
Interventions Trials were considered trials if they compared medical treatment of incomplete miscarriage with other methods (e.g. expectant management, placebo, or any other intervention including surgical evacuation, either curettage or vacuum aspiration). comparisons between different routes of administration of drugs (e.g. oral versus vaginal), or between different drugs or doses of drug, or duration or timing of treatment, if data existed.
Exclusion criteria SR: Types of studies quasi-RCTs and cross-over trials, conference proceedings and abstracts.
Participants: -women with non-viable pregnancies (i.e. where the embryo or fetus had died in utero, but in whom miscarriage had not yet occurred) as they are covered -studies on induced abortion of a live fetus and for fetal anomaly
17 studies included
Important patient characteristics at baseline: N: I/C
A:123/124 B: 64/62 C: 160/160 D: 349/348 E: 233/227 F: 77/37 G: 122/120 H: 47/47 I: 50/50 J: 40/40 K: 12/12/15 L: 480/380 M:150/150 N:113/116 O: 90/92/92 P: 160/152 Q: 30/9
|
Describe intervention:
A: oral misoprostol, 600 ug single-dose B: vaginal misoprostol 400 ug; 2 tablets of 200 ug, each self-administered at home C: Misoprostol 600 mcg orally D: misoprostol, 400 mcg sublingually E: oral misoprostol, 600 ug, single-dose F: vaginal misoprostol, 800 mcg on day 1, second dose of 800 mcg on day 3, if incomplete expulsion G: oral misoprostol, 600 ug H: vaginal misoprostol, 600 ug (plus a second dose 24 hours later if miscarriage still not complete) I: Misoprostol 400 mcg vaginal every 3 hours x 3 doses regardless of POC expulsion J: oral + vaginal misoprostol 200 ug 4 times daily after application of 200 ug intravaginal misoprostol for 5 days K: Intervention 1: vaginal misoprostol, 400u g with repeat dose 4-6 hours later if needed (= 400 ug or 800 ug) Intervention 2: surgical management, Aspiration curettage or D&C under GA L: sublingual misoprostol, Misoprostol 400 mcg sublingual x 1 dose M:oral misoprostol, 600 ug single-dose N: oral misoprostol, 600 mcg O: Intervention 1: vaginal misoprostol, 800 ug Intervention 2: surgery, Suction curettage P: oral misoprostol 600 ug Q: vaginal misoprostol 800 ug (4 x 200 ug)
|
Describe control:
A: surgery, MVA B: placebo C: Surgery, MVA D: Surgery, MVA E: Surgery, MVA F: Surgery, MVA G: Surgery, MVA H: surgery, surgical ERPC by sharp curettage following 20 U of oxytocin per litre of normal saline under GA with no prophylactic antibiotics but oral analgesics were prescribed I: surgical: traditional suction and curettage under deep sedation with 50 mg pethidine Injection J: surgical management Curettage, sometimes with general anaesthesia K: expectant care L: surgical evacuation per standard practice of each hospital (MVA or D&C) M: surgery, MVA N: surgery, MVA O: expectant care P: surgery MVA Q: surgery Vacuum aspiration
|
End-point of follow-up:
A: 1 wk B: 1 wk C: 2 wk D: - E: 1 wk F: - G: - H: - I:- J: 10 days K: 8 wk L: 2 wk M: 1 wk N: 1 wk O: 8 wk P: 1 wk Q: 8 days
For how many participants were no complete outcome data available? (intervention/control) A: • 23 women were excluded after randomisation because of a problem identified with the randomisation process as discussed by authors. • 35 women did not return at 1 week: 12 from misoprostol group and 23 from MVA group. • 10 women in misoprostol group had MVA prior to the 1 week follow-up time. These were included in the misoprostol group. • Not strictly speaking ITT analysis, but outcomes on the 23 women excluded were reported and similar to those included. Analysis was done on 212 women on whom data were available. B: There was no loss to follow-up and women received their appropriate allocation. The analysis appears to be ITT C: no loss to follow-up reported D: 2/697 women lost to follow-up. E: • Lost after randomisation and before prescription: 10 in misoprostol group and 3 in the MVA group • Exclusion after randomisation: 5 in the misoprostol group and 1 in the MVA group F: No loss to follow-up. G: 39/242 (16.1%) women did not return for assessment and were not included in analyses H: No loss of participants nor exclusions reported. I: 4 lost from the intervention group – 1 woman was detected having pre-existing jaundice. Another 1 left the hospital without intimation. 2 refused to continue treatment following administration of the first dose of misoprostol and urged for surgical clearance. All 4 of them were excluded from the study J: No losses and no exclusions were reported, but nothing is described. As there is no deviation from protocol it is assumed that analysis was by ITT K: One woman randomised to medical prescription (misoprostol) withdrew following randomisation and was not included in the analyses. Medical group: 1womanwas lost to follow-up at 10 to 14 days; 1 woman was lost to follow-up at 8 weeks Surgical group: 1woman was lost to follow-up at 8 weeks. Expectant group: 1 woman was lost to follow- up at 8 weeks. L: 15 in intervention and 6 in MVA group - no information on whether this group Is different M: No loss to follow-up and no deviations from protocol allocation reported. ITT analysis N: 11/229 women lost to follow-up. O: Loss of participants to follow-up: • loss immediately after randomisation: misoprostol = 0; surgery = 1; expectant care = 1. • loss at 14-day outcomes; misoprostol = 9 ; surgery = 8; expectant care = 5. • loss at 8-week outcomes: misoprostol = 3; surgery = 2; expectant care = 6. Exclusions after randomisation: In each of the surgical group and expectant care group, one woman with a viable pregnancy was excluded. Analysis was by ITT P: Loss of participants to follow-up from 317 women randomised was considerable and was discussed by authors. Many women in the rural communities of Uganda did not come for follow-up after discharge. • At 6 days - no loss to follow-up. • At 1-2 weeks: Misop had 53/160 (33%) lost to follow-up - leaving 107 women. • MVA had 70/157 (45%) lost to follow-up - leaving 82 women. 5 women were excluded in the MVA group (3 for self-discharge and 2 women were incorrectly excluded by the recruiter after randomisation but before treatment, 1 because she did not fit the entry criteria and 1 because nomanual vacuum aspiration kit was available) • One woman in misoprostol group and 7 in MVA group were given the wrong prescription, but were included on ITT for analysis. • Included in MVA were 6 women for whom MVA was not possible (5 amount of retained products too great and 1 the os had closed). The study was analysed by ITT based on available data. Q: One woman lost to follow-up in the surgical group. |
Medical vs expectant
Complete miscarriage (vaginal misoprostol) Studies n=2, patients n=150, Risk Ratio (M-H, Random, 95% CI) 1.23 [0.72, 2.10]
Unplanned surgical intervention (vaginal misoprostol) Studies n=2, patients n=308, Risk Ratio (M-H, Random, 95% CI) 0.62 [0.17, 2.26]
Pelvic infection < 14 days (vaginal misoprostol) Studies n= 3, patients n=333, Risk Ratio (M-H, Random, 95% CI) 2.42 [0.59, 9.98]
Medical vs surgical
Complete miscarriage Studies n=15, patients n=3862 Risk Ratio (M-H, Random, 95% CI) 0.96 [0.94, 0.98]
Unplanned surgical intervention Studies n=11, patients n=2690 Risk Ratio (M-H, Random, 95% CI) 5.03 [2.71, 9.35]
Pelvic infection < 14 days Studies n=7, patients n=907 Risk Ratio (M-H, Random, 95% CI) 0.70 [0.25, 1.99]
Cervical damage (Oral misoprostol) Studies n=1, patients n=189 Risk Ratio (M-H, Random, 95% CI) 0.07 [0.00, 1.25]
Women’s views/acceptability of method Studies n=9, patients n=3349 Risk Ratio (M-H, Random, 95% CI) 1.00 [0.99, 1.00]
Women’s views/satisfaction - continuous data (vaginal misoprostol) Studies n=2, patients n=131 Std. Mean Difference (IV, Random, 95% CI) 1.01 [0.01, 2.00]
Nausea Studies n=11, patients n=3015 Risk Ratio (M-H, Random, 95% CI) 2.50 [1.53, 4.09]
Vomiting Studies n=10, patients n=2977 Risk Ratio (M-H, Random, 95% CI) 1.97 [1.36, 2.85]
Diarrhoea Studies n=4, patients n=757 Risk Ratio (M-H, Random, 95% CI) 4.82 [1.09, 21.32]
|
|
Risk of bias assessment
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Kim, 2017 |
Yes |
Yes |
Yes |
Yes |
NA |
Yes |
Yes |
Yes |
Yes for the systematic review, no for the included studies |
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Lemmers, 2016 |
‘We randomly assigned women to either expectant management or curettage (1:1), using the web-based application ALEA 2.0 with computer generated randomization lists.’ |
Unlikely |
Likely, ‘Blinding was not possible due to the nature of the intervention.’ |
Likely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Al Ma’ani, 2014 |
‘Randomisation was done by a computer generated list of random numbers.’ |
Unlikely |
Likely |
Likely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Nadarajah, 2014 |
‘Randomisation was in blocks of ten using a computer-generated random sequence, and sequentially numbered sealed envelopes were prepared and provided by the study coordinator.’ |
Unlikely, the randomisation list was kept by an independent member of staff not involved in the trial. |
Likely, ‘no attempt was made to conceal the intervention assignment schedule from the patients or clinicians as the methods for the study groups were obviously different.’ |
Likely |
Unlikely |
unlikely |
unlikely |
Unlikely |
|
Dangalla, 2012 |
‘Sequentially numbered sealed opaque envelopes with a card mentioning the study arm were prepared earlier by the second author. After TVS, uncomplicated patients (n=160) who fulfilled the criteria (RPC between 15-50 mm in AP diameter) were randomised to two groups by block randomisation.’ |
Unlikely |
Likely |
Likely |
Unlikely |
Unlikely |
Unclear |
Unlikely |
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear)
|
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Lemmers, 2017 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Shokry, 2014 |
Unlikely |
Unlikely |
Unlikely |
Likely |
|
Tam, 2002 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Exclusietabel
|
Auteur en jaartal |
Redenen van exclusie |
|
Hooker, 2016 |
Voldoet niet aan PICO, includeerde alleen studies met chirurgische behandeling. |
|
Tam, 2015 |
Conference abstract |
|
Mark, 2015 |
Voldoet niet aan PICO (P&I) |
|
Smorgick, 2014 |
Idem Hooker, 2016, muv Goldenberg, 1997 niet vergelijkende studie |
|
Neilson, 2013 |
Kim, 2017 is update |
|
Saude, 2012 |
Narrative |
|
Russo, 2012 |
Commentary |
|
Tuncalp, 2010 |
voldoet niet aan PICO, vergelijkt verschillende chirurgische procedures |
|
Neilson, 2010 |
Kim, 2017 is update |
|
Sur, 2009 |
Narrative |
|
Blum, 2007 |
Geen systematische search |
|
Sotiriadis, 2005 |
Search 1966-2004, voor sr Kim, 2017 |
|
Graziosi, 2004 |
Includeerde studies met missed or incomplete abortion (studies met incomplete zijn opgenomen in Kim, 2017) |
|
Foma, 2001 |
Tuncalp, 2010 is update |
|
Nazim, 2018 |
Voldoet niet aan PICO, niet vergelijkende studie |
|
Lemmers, 2018 |
Economische evaluatie misorest studie |
|
Hofler, 2018 |
Pilot studie, vergelijkt chirurgische behandelingen |
|
Hentzen, 2017 |
Misorest |
|
Pawde, 2016 |
Voldoet niet aan PICO, vergelijking incomplete abortion following MMA vs spontaneous incomplete abortion |
|
Ng, 2015 |
Voldoet niet aan PICO, vergelijking inpatient vs outpatient |
|
Klingberg, 2015 |
Voldoet niet aan PICO, comparing groups per provider type |
|
Huchon, 2015 |
Studieprotocol |
|
Guedes-Martins, 2015 |
Voldoet niet aan PICO |
|
Rafi, 2014 |
Voldoet niet aan PICO, 95% missed miscarriage |
|
Verschoor, 2013 |
Studieprotocol Misorest |
|
Patua, 2013 |
In SR Kim, 2017 |
|
Kumar, 2013 |
Voldoet niet aan PICO |
|
Kong, 2013 |
Voldoet niet aan PICO |
|
Casikar, 2013 |
Voldoet niet aan PICO, vergelijkt symptomatisch met niet symptomatish |
|
Wijsinghe, 2012 |
Kwalitatieve studie |
|
Rausch, 2012 |
Voldoet niet aan PICO, Kosteneffectiviteit |
|
Montesinos, 2011 |
In SR Kim, 2017 |
|
Dabash, 2010 |
In SR Kim, 2017 |
|
Petrou, 2009 |
Voldoet niet aan PICO, uitkomst |
|
Pauleta, 2009 |
Voldoet niet aan PICO, vergelijking, induced vs spontaneous |
|
Abdelmohsen, 2009 |
Voldoet niet aan PICO |
|
Shwekerela, 2007 |
In SR Kim, 2017 |
|
Bique, 2007 |
In SR Kim, 2017 |
|
Trinder, 2006 |
In SR Kim, 2017 |
|
Petrou, 2006 |
Voldoet niet aan PICO, CEA exp/surg/med bij vrouwen met incomplete or missed |
|
Zhang, 2005 |
In SR Kim, 2017 |
|
Weeks, 2005 |
In SR Kim, 2017 |
|
Shelley, 2005 |
In SR Kim, 2017 |
|
Coughlin, 2004 |
Voldoet niet aan PICO, geen vergelijkende studie |
|
Tam, 2002 |
Voldoet niet aan PICO, geen resultaten apart gerapporteerd voor incomplete versus missed |
|
Sahin, 2001 |
In SR Kim, 2017 |
|
Chung, 1997 |
Voldoet niet aan PICO, geen resultaten apart voor incomplete en missed |
|
Chipchase, 1997 |
Voldoet niet aan PICO, uitkomstmaat |
|
Nielsen, 1996 |
Voldoet niet aan PICO, geen resultaten apart voor incomplete en missed |
|
Herschko, 2018 |
Niet vergelijkend, voldoet niet aan PICO |
|
Georgiou, 2018 |
Niet vergelijkend, voldoet niet aan PICO |
|
Ganer, 2018 |
Niet vergelijkend, voldoet niet aan PICO |
|
Shaikh, 2017 |
Voldoet niet aan PICO, vergelijkt miso versus miso in combinatie met MVA |
|
Melcer, 2016 |
Voldoet niet aan PICO, early surg. versus late surg. |
|
Ben-Ami, 2014 |
Voldoet niet aan PICO, chirurgische behandeling |
|
Ben-Ami, 2014 |
Voldoet niet aan PICO, chirurgische behandeling |
|
Chambers, 2009 |
Voldoet niet aan PICO, Rpoc na abortus, alleen medicamenteus |
|
van den Bosch, 2007 |
Voldoet niet aan PICO |
|
Maslivitz, 2004 |
Voldoet niet aan PICO, curettage voor rpoc, niet vergelijkend |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 24-07-2020
Beoordeeld op geldigheid : 24-07-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de NVOG of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVOG is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de verschillende richtlijnmodules. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module1 |
Regiehouder(s)2 |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn3 |
Frequentie van beoordeling op actualiteit4 |
Wie houdt er toezicht op actualiteit5 |
Relevante factoren voor wijzigingen in aanbeveling6 |
|
Behandeling zwangerschapsrest |
NVOG |
2020 |
2025 |
1x per 5 jaar |
NVOG |
Publicatie van nieuwe studies over dit onderwerp. |
|
[1] Naam van de module 2 Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders) 3 Maximaal na vijf jaar 4 (half)Jaarlijks, eens in twee jaar, eens in vijf jaar 5 regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft 6 Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen |
||||||
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van verschillende relevante specialismen die betrokken zijn bij de zorg voor patiënten die een miskraam hebben doorgemaakt. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Drs. E. Hink, gynaecoloog, werkzaam in het Radboudumc, Nijmegen, Nederlandse Vereniging voor Obstetrie en Gynaecologie (voorzitter).
- M.M.J. van den Berg MSc., fertiliteitsarts, werkzaam in het Academisch Medisch Centrum, Amsterdam, Vereniging van Fertiliteitsartsen.
- Dr. F.M. van Dunné, gynaecoloog, werkzaam in het Haaglanden Medisch Centrum, Den Haag, Nederlandse Vereniging voor Obstetrie en Gynaecologie.
- Prof. dr. M. Goddijn, hoogleraar Voortplantingsgeneeskunde & gynaecoloog, werkzaam in het Academisch Medisch Centrum, Amsterdam, Nederlandse Vereniging voor Obstetrie en Gynaecologie.
- M. Hermus, verloskundige, werkzaam bij Verloskundigen Oosterhout, Oosterhout, Koninklijke Nederlandse Organisatie van Verloskundigen. (tot april 2019)
- Drs. A. B. Hooker, gynaecoloog, werkzaam in het Zaans Medisch Centrum, Zaandam, Nederlandse Vereniging voor Obstetrie en Gynaecologie.
- Dr. S. Kuc, fertiliteitsarts, werkzaam in het St. Antonius Ziekenhuis, Utrecht, Vereniging van Fertiliteitsartsen.
- Dr. M. Lemmers, AIOS gynaecologie, werkzaam in het Academisch Medisch Centrum, Amsterdam, Nederlandse Vereniging voor Obstetrie en Gynaecologie.
- Dr. R.H.F. van Oppenraaij, gynaecoloog, werkzaam in het Maasstad Ziekenhuis, Rotterdam, Nederlandse Vereniging voor Obstetrie en Gynaecologie.
- A.J.Y. van Sluis, echoscopist, oa. werkzaam bij Rivas Zorggroep, Gorinchem, Beroepsvereniging Echoscopisten Nederland.
- K. Spijkers, patiëntvertegenwoordiger, Utrecht, Patiëntenfederatie Nederland.
Meelezer
- A. Beuckens, Beleidsmedewerker KNOV, Koninklijke Nederlandse Organisatie van Verloskundigen. (vanaf mei 2019)
Met ondersteuning van
- A.A. Lamberts MSc., senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
- Dr. L. Viester, adviseur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
- L.H.M. Niesink-Boerboom MSc, literatuurspecialist, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in de tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Overzicht Belangenverklaringen |
|||||||||
|
Achternaam |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie? |
|
van den Berg |
Fertiliteitsarts, Amsterdam UMC locatie AMC |
ESHRE, Bestuurslid SIG Implantation & Ectopic Pregnancy (onbetaald) Travelgrants t/m juli 2021 |
geen |
geen |
geen |
geen |
geen |
18-7-2018 |
Geen actie nodig |
|
Dunné |
Gynaecoloog, Haaglanden Medisch Centrum (HMC) te Den Haag |
Lid Werkgroep Otterlo (landelijke richtlijnen commissie Obstetrie) (onbetaald) |
geen |
geen |
geen |
geen |
geen |
9-3-2018 |
Geen actie nodig. |
|
Goddijn |
Hoogleraar Voortplantingsgeneeskunde, gynaecoloog, pijlerhoofd Voortplantingsgeneeskunde, Amsterdam UMC |
-Bestuurslid SIG Fertiliteitspreservatie NVOG (vice-voorzitter/ onbetaald) |
geen |
geen |
Onderzoeks financiering vanuit ZonMw en KWF/Pink Ribbon. Niet conflicterend met onderwerp richtlijn. |
geen |
geen |
5-3-2018 |
Geen actie nodig. |
|
Hink |
Gynacoloog perinatoloog Radboudumc te Nijmegen |
geen |
geen |
geen |
geen |
geen |
geen |
19-3-2018 |
Geen actie nodig |
|
Hooker |
Gynaecoloog, Zaans Medisch Centrum (ZMC), te Zaandam. |
Docent 2-daagse cursus Zicht op Ziekenhuizen, studiecentrum voor Bedrijf en Overheid. Onderwerp: kwaliteit en veiligheid in de zorg en veranderde positie van de medisch specialist. (betaald). |
Adviseur firma Fziomed (USA), advies bij ontwikkelen middel ter preventie intra-uteriene verklevingen (betaald). |
geen |
Was hoofdonderzoeker van de Post Abortion Prevention of Adhesion |
Zie kolom extern gefinancierd onderzoek |
geen |
12-5-2018 |
Besloten dat indien er een vraag over dit specifieke onderwerp in het raamwerk wordt opgenomen Angelo Hooker hier geen voortrekker van zal zijn. |
|
Klapwijk-Hermus |
Verloskundigen Oosterhout – eerstelijns verloskundige, eigenaar praktijk |
Promotietraject, onderwerp: evaluatie van geboortecentra in Nederland. Afrondend, (onbetaald) |
geen |
geen |
geen |
geen |
geen |
14-5-2018 |
Geen actie nodig |
|
Kuc |
Fertiliteitsarts , St. Antonius Ziekenhuis, te Nieuwegein |
Bestuurslid vereninging van fertiliteitsartsen VVf (onbetaald) |
geen |
geen |
geen |
geen |
geen |
3-5-2018 |
Geen actie nodig |
|
Lamberts |
Adviseur Kennisinstituut |
Beleidsmedewerker Kwaliteit NVKG |
geen |
geen |
geen |
geen |
geen |
2014 |
Geen actie nodig |
|
Lemmers |
AIOS Gynaecologie VUMC te Amsterdam |
Arts-onderzoeker (onbetaald). Uitvoeren Cochrane review medicamenteuze behandeling miskraam tot 20 weken. |
geen |
geen |
geen |
geen |
geen |
15-3-2018 |
Geen actie nodig. |
|
Oppenraaij |
Gynaecoloog, Maasstad Ziekenhuis, te Rotterdam |
Bestuurslid werkgroep jonge zwangerschap NVOG (onbetaald) |
geen |
geen |
Deelname ahrends studie van Bayer onderzoek naar nieuwe medicatie bij vrouwen met endometriose. Onderzoek is inmiddels gesloten zonder enige inclusie in ons ziekenhuis. |
geen |
geen |
5-5-2018 |
Geen actie nodig. |
|
Sluis |
Obstetrisch en Gynaecologisch echoscopiste bij Screeningscentrum Fara te Ede (8u per week) |
Bestuurslid BEN, (onbetaald) |
geen |
geen |
geen |
geen |
geen |
1-6-2018 |
Geen actie nodig |
|
Spijkers |
Senior Beleidsadviseur/ projectmanager Patiëntenfederatie Nederland |
Voorzitter Stichting Samen voor Duchenne, (onbetaald) |
geen |
geen |
geen |
geen |
geen |
24-5-2018 |
Geen actie nodig |
|
Viester |
Adviseur Kennisinstituut |
geen |
geen |
geen |
geen |
geen |
geen |
2018 |
Geen actie nodig |
|
Beuckens (meelezer) |
Beleidsmedewerker kwaliteit en implementatie KNOV |
Coaching/luisterend oor - betaald (minder dan 5 keer per jaar) |
geen |
geen |
geen |
geen |
geen |
2019 |
Geen actie nodig |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Patiëntenfederatie Nederland zitting te laten nemen in de werkgroep. Patiëntenverenigingen Freya en VSOP zijn eveneens gevraagd zitting te nemen in de werkgroep, zij gaven echter aan de voorkeur te hebben om alleen bij de invitational conference aanwezig te zijn en input te leveren tijdens de commentaarfase. Er is in samenwerking met de Patiëntenfederatie Nederland op 1 mei 2019 een focusgroep georganiseerd, de resultaten hiervan zijn meegenomen in de richtlijntekst. Een verslag van de bijeenkomst is als aanverwant product opgenomen bij de richtlijn. Er heeft een invitational conference plaatsgevonden aan de start van het traject waar verschillende patiëntenorganisaties voor waren uitgenodigd (Freya, VSOP, Patiëntenfederatie Nederland, Stichting Kind&Ziekenhuis). Een verslag hiervan is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. Tijdens de oriënterende zoekactie werd gezocht op literatuur naar patiëntenperspectief (zie Strategie voor zoeken en selecteren van literatuur). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de VSOP, Freya en de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
Voor deze richtlijn is waar mogelijk uitgegaan van de NICE-richtlijn ‘Ectopic pregnancy and miscarriage: Diagnosis and initial management in early pregnancy of ectopic pregnancy and miscarriage’ uit 2012. Bruikbare onderdelen zijn van een update voorzien zodat ook recente evidence is meegenomen.
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door verschillende partijen tijdens de invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur conceptuitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er is op 1 februari 2019 oriënterend gezocht naar literatuur over patiëntenvoorkeuren en patiëntrelevante uitkomstmaten (patiëntenperspectief) in de databases Medline (Ovid) & Embase (Elsevier). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende hoeveelheid studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module ‘Organisatie van Zorg’ en onder het kopje Patiëntenperspectief.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
NICE. Ectopic pregnancy and miscarriage: Diagnosis and initial management in early pregnancy of ectopic pregnancy and miscarriage. 2012. Update in 2019.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Kennisinstituut van Medisch Specialisten. Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. 2015
Zoekverantwoording
|
Uitgangsvraag: UV7a-b-c: Wat is de optimale behandeling in geval van verdenking op een zwangerschapsrest? |
|
|
Database(s): Medline, Embase |
Datum: 05-12-2018 |
|
Periode: > 1946 |
Talen: Engels |
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
1946 – december 2018
|
1 (retained products of conception or incomplete evacuation of the uterus).ti,ab,kw. or exp Abortion, Incomplete/ or ((exp Abortion, Spontaneous/ or spontaneous abortion*.ti,ab,kw.) and incomplete.ti,ab,kw.) or incomplete miscarriage*.ti,ab,kw. (1289) 2 limit 1 to english language (1118) 3 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1809029) 4 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (376480) 5 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (3081840) 6 2 and 4 (52) 7 2 and 3 (197) 8 7 not 6 (168) 9 2 and 5 (389) 10 9 not 6 not 8 (290) 11 6 or 8 or 10 (510) = 510 |
700 |
|
Embase (Elsevier) |
('retained products of conception'/exp OR 'retained products of conception':ti,ab OR 'incomplete evacuation of the uterus':ti,ab OR 'incomplete abortion'/exp OR (('spontaneous abortion'/exp OR 'spontaneous abortion*':ti,ab) AND incomplete:ti,ab) OR 'incomplete miscarriage*':ti,ab) AND [english]/lim NOT 'conference abstract':it
Gebruikte filters: Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab ORcinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematicreview'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) = 59
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/expOR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it = 233
Observationeel onderzoek: 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomizedcontrolled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) = 149 = 441 |

