Patiëntpositionering bij MIC
Uitgangsvraag
Welke voorzorgsmaatregelen kan men treffen bij het positioneren van de volwassen patiënt om het risico op een postoperatieve perifere neuropathie te reduceren?
Aanbeveling
Positioneer patiënten zodanig dat men zenuwbanen met een verhoogd risico op positioneringsgerelateerd letsel ontziet. Laparoscopische chirurgen, anesthesiologen, anesthesiemedewerkers en operatieassistenten moeten zich bewust zijn van de zenuwen die at risk zijn voor dit letsel.
Voor informatie ten aanzien van verantwoordelijkheid van de positionering verwijst de werkgroep naar de richtlijn “Perioperatief proces”.
Controleer de ligging van armen en benen bij elke positie verandering van de operatietafel.
Vermijd contact met harde oppervlakken die directe druk kunnen geven op kwetsbare perifere zenuwen. Leun niet op de patiënt.
Bespreek de positie van de armen tijdens de briefing of time-out. De positie is afhankelijk van de procedure en de voorkeur van de operateur en de anesthesioloog.
Bij het gebruik van armsteunen, mag de abductiehoek tussen de arm en romp niet meer dan 90° zijn en het hoofd van de patiënt niet naar de contralaterale zijde zijn gedraaid. Laat de patiënt beperkingen van ledematen aangeven en houdt daar bij de positionering rekening mee.
Bij gebruik van de lithotomiepositie, overweeg de patiënt in ‘French position’ (benen van de patiënt in horizontale positie geabduceerd) te positioneren, zo nodig met een (korte) bean bag.
Hou bij het gebruik van de lithotomiepositie rekening met:
- flexie van de heup 60 tot 170°;
- flexie van de knie van 90 tot 120°;
- abductie van de heup < 90°;
- minimale externe rotatie van de heup;
- steunen: gebruik laarsbeensteunen, geen klassieke beensteunen.
Overwegingen
De tekst in de aanbeveling gaat over de meest beschreven positioneringsgerelateerde neuropathieën: van de plexus brachialis en de onderste extremiteit (N. femoralis, N. cutaneus femoris lateralis, N. obturatorius, N. ischiadicus en N. peroneus). Daarnaast zijn er nog andere, meestal deels oppervlakkig gelegen, zenuwen die ‘at risk’ zijn bij de positionering, zoals de N. ulnaris, N. radialis, N. medianus, N. tibialis, N. pudendus, et cetera. Voor alle positioneringsgerelateerde neuropathieën lijkt te gelden dat deze optreden wanneer een perifere zenuw wordt blootgesteld aan rek of compressie waardoor deze ischemisch wordt. Naarmate de rek of compressie heviger is en/of van langere duur is het letsel ook ernstiger. (Winfree & Kline, 2005)
Door de armen langs het lichaam van de patiënt te positioneren kan men compressie en rek van de plexus brachialis (zie figuur 1) voorkómen.
De positie van de armen heeft echter ook invloed op de werkruimte van de operateur. De voorkeur van positionering van de armen verschilt per procedure en per voorkeur van de operateur en anesthesioloog. Het verdient aanbeveling om in samenspraak tussen de operateur en de anesthesioloog de patiënt te positioneren en eventueel verlengde infuuslijnen te gebruiken.
Figuur 1 Anatomie plexus brachialis ten opzichte van de clavicula en eerste rib (Winfree & Kline, 2005)
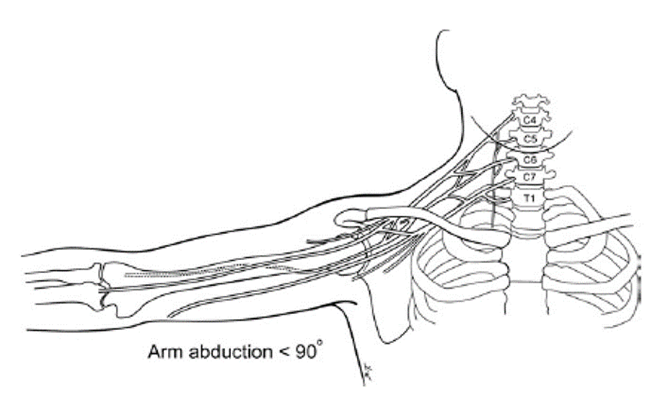
The brachial plexus. The nerves of the brachial plexus originate from the anterior nerve roots of C5-T1 and pass under the clavicle and over the fïrst rib before innervating the arm. The trunk to arm angle should be less than 90 degrees
Aan de onderste extremiteiten zijn verschillende zenuwen ‘at risk’ afhankelijk van de positionering van de benen. Posities waarbij de stand van de gewrichten erg afwijken van neutrale stand of waarbij veel druk wordt gegeven tegen een bepaald lichaamsdeel verhogen de kans op perifere neuropathie. Daardoor neemt bij langdurige operaties het risico toe. Beschermende middelen (kussens en gelpads) worden gebruikt ter preventie van drukletsel, maar deze kunnen zulk letsel niet voorkómen. (Warner, 2000) Bij chirurgische en gynaecologische laparoscopie wordt ook wel de ‘French position’ toegepast, waarbij de benen van de patiënt worden geabduceerd en in horizontale positie worden gehouden (zie figuur 2). De chirurg/assisterende heeft zodoende toegang tot instrumentarium en/of het operatieterrein. Bij deze positie zijn er minder lokale drukpunten en komen de extremiteiten niet in een extreme stand terecht.
Figuur 2 “French position”: onderste extremiteiten van de patiënt in horizontale positie. S. Veersema. Uit: Leerboek Gynaecologische laparoscopie. 2006
Bij een normale bewustzijnsstatus worden de posities van de extremiteiten beperkt door een bepaalde mate van discomfort. Een dergelijk gevoel van ongemak wordt vaak opgemerkt als ‘tintelingen’, waardoor men van positie verandert: een beschermende reactie. Onder algehele of lokale anesthesie wordt dit discomfort niet opgemerkt, waardoor rek of compressie op een perifere zenuw blijft bestaan. Wanneer men twijfelt over de positionering van een patiënt, kan het nuttig zijn te bedenken welke positie de patiënt in wakkere toestand comfortabel zou vinden.
Ten slotte wil de werkgroep benadrukken dat men zich ervan bewust moet zijn dat laparoscopische ingrepen lang kunnen duren en derhalve moet extreme positionering zo veel mogelijk worden vermeden. De combinatie van een langdurige laparoscopische ingreep met extreme positionering geeft extra risico op positioneringsgerelateerde neuropathieën.
Onderbouwing
Achtergrond
De positionering van de patiënt op de operatietafel is een belangrijk punt van aandacht voor de anesthesioloog en de operateur: zowel fysiologisch als met het oog op preventie van drukletsel. Trendelenburgpositie, been- en schoudersteunen hangen samen met een verhoogd risico op postoperatieve neuropathie. Om de kans op postoperatief zenuwletsel te minimaliseren, worden adviezen over de positionering van de patiënt en de verantwoordelijkheid geformuleerd.
Conclusies / Summary of Findings
|
Niveau 3 |
Er zijn aanwijzingen dat patiënten die een langdurige (> 2 tot 4 uur) minimaal invasieve ingreep in lithotomie positie ondergaan een verhoogd risico lopen op postoperatieve neuropathieën aan de onderste extremiteiten.
Evidence Level B: (Warner, 1994; Warner, 2000) |
|
Niveau 4 |
Het gebruik van schoudersteunen geeft in vergelijking met gebruik van een bean bag of fixatie banden een verhoogd risico op plexus brachialis neuropathieën.
Evidence Level D: (Mening van de werkgroep MIC) |
|
Niveau 4 |
Rek en compressie op perifere zenuwen kan ontstaan door positionering, wanneer sprake is van excessieve flexie, extensie, exorotatie, endorotatie, abductie of adductie van de extremiteiten.
Evidence Level D: (Mening van de werkgroep MIC) |
|
Niveau 4 |
Laars beensteunen geven een kleiner risico op positionerings gerelateerde neuropathieën van de onderste extremiteit dan andere (klassieke) beensteunen.
Evidence Level D: (Mening van de werkgroep MIC) |
Samenvatting literatuur
Er werden geen systematische reviews, meta-analyses, RCT’s of ander vergelijkend onderzoek over het onderwerp drukletsel bij laparoscopie gevonden. Onderstaande tekst is gebaseerd op evidence uit grote retrospectieve cohortstudies, casuistiek en beschrijvende reviews van de literatuur.
Achtergrond en incidentie
Zenuwletsel kan optreden tijdens laparoscopische ingrepen en kan het gevolg zijn van een verkeerde positionering waarbij er compressie of tractie op perifere zenuwen is opgetreden. Door de compressie kan de doorbloeding van de zenuwen gecompromitteerd raken, waardoor ischemie van de zenuw(en) optreedt. Door ischemische zenuwschade treedt demyelinisatie op en raakt de motorische en sensorische functie van de zenuw verstoord. In ernstige gevallen kan zelfs axonale degeneratie optreden. De klinische presentatie kan bestaan uit voorbijgaande gevoelloosheid tot irreversibel verlies van zowel sensorische als motorische functies.
De prevalentie of incidentie van positionerings-gerelateerde neuropathie bij MIC ingrepen is in de literatuur enkel beschreven in retrospectief onderzoek. Brachiale plexuslaesies zijn daarbij de meest beschreven positioneringsgerelateerde neuropathieën, gevolgd door neuropathie van de onderste extremiteit(Romanowski, Reich, McGlynn, Adelson, & Taylor, 1993; Winfree & Kline, 2005). Een incidentie van plexus-brachialis laesies van 0,16% werd beschreven in een grote retrospectieve studie van Romanowski (1993). In een prospectief observationele studie van Warner wordt beschreven dat na lithotomiepositie een incidentie van 1,5% neuropathieën van de onderste extremiteit optreedt (Warner, 2000). Het ging hier om verschillende typen gynaecologische en urologische ingrepen. Negen van de 15 patiënten bemerkten de sensibiliteitsstoornis pas bij navraag en bij 14 van de 15 casus was de klacht na 6 maanden verdwenen. De aangedane zenuwen van de onderste extremiteit betroffen de N. obturatorius, N. cutaneus femoris lateralis, N. ischiadicus en de N. peroneus.
Risicofactoren plexus brachialis laesies
Er werden vijf brachiale plexuslaesies gevonden in een retrospectief cohort van 3200 patiënten die een complexe gynaecologische laparoscopie ondergingen. (Romanowski et al., 1993) Geconcludeerd werd dat een steile trendelenburgpositie, het gebruik van schoudersteunen en abductie van de armen ≥ 90˚ leiden tot beschadiging van de brachiale plexus. Deze associaties worden ondersteund in de gevonden literatuur bestaande uit casuïstiek, beschrijvende teksten en experimentele studies (Coppieters, 2006; RAFFAN, 1950; Task force on prevention of perioperative peripheral neuropathies, 2000; Trojaborg, 1977; Winfree & Kline, 2005) Kanteling van het lichaam in trendelenburgligging is nodig om de darmen uit het kleine bekken te houden. Echter, bij kanteling van meer dan 30˚ bestaat het gevaar dat de patiënt naar beneden glijdt.(van den Hurk & Jansen, 2008) Om dit te voorkomen wordt soms gebruik gemaakt van schoudersteunen, dit geeft een risico op plexus brachialis laesies. Met een gebruik van ‘bean bag’ kan het letsel worden voorkomen. In de urologie wordt bij radicale prostaatchirurgie het lichaam van de patiënt met banden gefixeerd.(Kawakita et al., 2001)
Risicofactoren voor positionerings gerelateerde neuropathieën aan de onderste extremiteiten
Bij gynaecologische en urologische laparoscopie wordt de patiënt vaak in de steensnede (lithotomie) positie geplaatst. Uit een retro- en een prospectief cohortonderzoeken blijkt dat patiënten die langdurige (> 2 tot 4 uur) ingrepen in lithotomie positie ondergaan een verhoogd risico lopen op het postoperatief ontstaan van neuropathieën van de onderste extremiteiten. (Warner, Martin, Schroeder, Offord, & Chute, 1994; Warner, Warner, Harper, Schroeder, & Maxson, 2000) Echter, ook zenuwschade na procedures van 35 minuten is beschreven.(Warner, 1994; Warner, 2000) De zenuwen die “at risk” bij de lithotomie positie zijn: de N. femoralis, N. cutaneus femoris lateralis, N. obturatorus, N. ischiadicus en de N. peroneus communis.(Barnett, Hurd, Rogers, Jr., Williams, & Shapiro, 2007).
Voor de positionering van de benen kunnen verschillende typen steunen worden gebruikt. Er zijn geen vergelijkende trials beschreven, waarbij het risico op zenuwschade van de onderste extremiteiten bij het gebruik van verschillende beensteunen werd geëvalueerd. Op theoretische gronden wordt in de literatuur beschreven dat de ‘laars beensteunen’ (yellow fin) het minste risico op zenuwletsel geven in vergelijking met andere beensteunen., omdat de steun gelijkmatiger over het onderbeen is verdeeld en er minder flexie, abductie en exorotatie van de heup kan plaatsvinden. Bij excessieve flexie, abductie en exorotatie van de heup ontstaat er meer rek en compressie van de N. femoralis onder het ligamentum inguinale. Daarnaast is met het gebruik van laars beensteunen theoretisch de kans op N. peroneus letsel kleiner, omdat de laterale zijde van de knie ontzien wordt. Bij gebruik van ‘candy canes’ kan de laterale zijde van de knie tegen de steunpaal aan worden gedrukt en is compressie van de N. peroneus mogelijk (Barnett, 2007).
Referenties
- Barnett, J. C., Hurd, W. W., Rogers, R. M., Jr., Williams, N. L., & Shapiro, S. A. (2007). Laparoscopic positioning and nerve injuries. J.Minim.Invasive.Gynecol., 14, 664-672.
- Coppieters, M. W. (2006). Shoulder restraints as a potential cause for stretch neuropathies: biomechanical support for the impact of shoulder girdle depression and arm abduction on nerve strain. Anesthesiology, 104, 1351-1352.
- Kawakita, M., Sato, M., Oguchi, N., Muguruma, K., Murota, T., & Matsuda, T. (2001). (Transperitoneal laparoscopic radical prostatectomy with the Montsouris technique: experience in initial 5 cases). Nippon Hinyokika Gakkai Zasshi, 92, 506-512.
- Task force on prevention of perioperative peripheral neuropathies (2000). Practice advisory for the prevention of perioperative peripheral neuropathies. Anesthesiology, 92, 1168-1182.
- Trojaborg, W. (1977). Electrophysiological findings in pressure palsy of the brachial plexus. J.Neurol.Neurosurg.Psychiatry, 40, 1160-1167.
- RAFFAN, A. W. (1950). Post-operative paralysis of the brachial plexus. Br.Med.J., 2, 149.
- Romanowski, L., Reich, H., McGlynn, F., Adelson, M. D., & Taylor, P. J. (1993). Brachial plexus neuropathies after advanced laparoscopic surgery. Fertil.Steril., 60, 729-732.
- van den Hurk, P. J. & Jansen, F. W. (2008). NVOG Modelprotocol: Anesthesiologisch management en gynaecologische laparoscopie: voorwaarden voor therapeutische gynaecologische laparoscopie. NVOG Modelprotocollen.
- Warner, M. A., Martin, J. T., Schroeder, D. R., Offord, K. P., & Chute, C. G. (1994). Lower-extremity motor neuropathy associated with surgery performed on patients in a lithotomy position. Anesthesiology, 81, 6-12.
- Warner, M. A., Warner, D. O., Harper, C. M., Schroeder, D. R., & Maxson, P. M. (2000). Lower extremity neuropathies associated with lithotomy positions. Anesthesiology, 93, 938-942.
- Winfree, C. J. & Kline, D. G. (2005). Intraoperative positioning nerve injuries. Surg.Neurol., 63, 5-18.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 16-08-2021
Beoordeeld op geldigheid : 16-08-2021
Frequentie van beoordeling op actualiteit: Eens per 5 jaar
Relevante factoren voor wijziging in aanbeveling: Geen factoren bekend
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Patiënten participatie bij deze richtlijn werd medegefinancierd uit de Stichting Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten die een laparoscopie ondergaan.
Werkgroep
- Prof. dr. F.W. (Frank Willem) Jansen, gynaecoloog, Leids Universitair Medisch Centrum, Leiden, NVOG (voorzitter)
- Drs. F.H.M.P. (Fokkedien) Tummers, arts-onderzoeker gynaecologie, Leids Universitair Medisch Centrum, Leiden, NVOG
- Drs. T.A. (Tammo) Brouwer, anesthesioloog, Zorggroep Noorderbreedte, Leeuwarden, NVA
- Dr. S.F.P.J. (Sjors) Coppus, gynaecoloog, Máxima MC, Eindhoven, NVOG
- Dr. A. (Ahmet) Demirkiran, gastro-intestinaal & bariatrisch chirurg, Rode Kruis Ziekenhuis, Beverwijk, NVVH
- Dr. W.A. (Werner) Draaisma, chirurg, Jeroen Bosch Ziekenhuis, ’s-Hertogenbosch, NVEC
- Dr. B.W. (Brunolf) Lagerveld, uroloog, OLVG, Amsterdam, NVU
- Ir. E.S. (Esther) van Schrojenstein Lantman, klinisch fysicus, Albert Schweitzer ziekenhuis, Dordrecht, NVKF
- Drs. K. (Klaartje) Spijkers, senior adviseur patiëntenbelang, Patiëntenfederatie Nederland, Utrecht
Met ondersteuning van
- Dr. M. (Marleen) van Son, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf september 2020)
- Dr. L. (Laura) Viester, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf september 2020)
- Dr. J. (Julitta) Boschman, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf juli 2019 tot september 2020)
- Dr. R. (Roy) Elbers, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot juni 2019)
- Dr. E. (Elvira) den Breejen, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot juni 2019)
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Brouwer |
Anesthesioloog - werkzaam te Medisch Centrum Leeuwarden (MC) (#werkgever) |
- |
Geen |
Geen |
|
Coppus |
Gynaecoloog Maxima Medisch Centrum Eindhoven/Veldhoven |
Bestuurslid Werkgroep Gynaecologische Endoscopie (onbetaald) |
Geen |
Geen |
|
Demirkiran |
Gastro-intestinaal en bariatrisch chirurg. |
Geen |
Geen |
Geen |
|
Draaisma |
Chirurg Jeroen Bosch Ziekenhuis |
Geen |
Geen |
Geen |
|
Jansen |
Gynaecoloog LUMC Professor in Gynaecology and Minimally Invasive Surgery Leiden University |
Professor in Gynaecology and Minimally Invasive Surgery TU Delft |
Geen |
Geen |
|
Lagerveld |
Uroloog OLVG Amsterdam |
Geen |
Geen |
Geen |
|
Schrojenstein - Lantman |
Klinisch Fysicus in het Albert Schweitzer Ziekenhuis (ASZ) (0,9 fte) |
Geen |
Geen |
Geen |
|
Spijkers |
Senior adviseur patiëntenbelang |
Voorzitter Stichting Samen voor Duchenne |
Geen |
Geen |
|
Tummers |
ANIOS Gynaecologie & Verloskunde, Groene Hart Ziekenhuis Gouda |
Onderzoeker LUMC, afdeling Gynaecologie, betaald |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door participatie van een afgevaardigde van Patiëntenfederatie Nederland in de werkgroep. Deze afgevaardigde heeft de werkgroep van input voorzien bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep schriftelijk de knelpunten in de zorg voor patiënten met een indicatie voor een laparoscopie. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijn Minimaal Invasieve Chirurgie (NVOG, 2011) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door onder andere de Inspectie voor Gezondheidszorg en Jeugd, Lareb, het Nederlands Huisartsen Genootschap, de Nederlandse Vereniging voor Heelkunde, de Nederlandse Vereniging voor Klinische Fysica en de Nederlandse Vereniging voor Obstetrie en Gynaecologie. De ingebrachte knelpunten inclusief reactie van de werkgroep is opgenomen in de bijlagen.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij hanteerde de werkgroep een maximum van acht uitkomstmaten. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J (corrected to Schünemann, Holger J). PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
