Open versus gesloten techniek bij MIC
Uitgangsvraag
Welke entreetechniek heeft de voorkeur bij volwassenen met een indicatie voor laparoscopie: open of gesloten?
Aanbeveling
Kies de techniek welke de operateur geleerd heeft en waarmee hij/zij vertrouwd is, zodat door ervaring de risico’s beperkt worden.
Kijk voor speciale patiëntengroepen in de modules Speciale patiëntengroepen (obese patiënten (BMI>30), patiënten met een BMI onder de 18, zwangere patiënten en patiënten die eerder een laparoscopie hebben ondergaan).
Wees bewust van de verschillende entreetechnieken en entreelocaties. Het is belangrijk dat de operateur beschikt over de kundigheid om te wisselen van techniek indien dit nodig is.
Overwegingen
De onderstaande overwegingen gelden in principe voor het overgrote deel van de patiëntenpopulatie waarop de uitgangsvraag betrekking heeft. Voor de subgroep “obese patiënten (BMI>30), patiënten met een BMI<18, zwangere patiënten en patiënten die eerder een operatie hebben ondergaan” zijn aparte uitgangsvragen en aanbevelingen gevormd.
Rationale aanbeveling
Op basis van de cruciale uitkomstmaten lijkt er geen verschil te zijn tussen de open en de gesloten entreetechniek. Binnen de gesloten entreetechniek is het risico op vasculair letsel wellicht kleiner bij het gebruik van de directe trocar techniek ten opzichte van de Veressnaald. Voor de andere cruciale uitkomstmaten lijkt er geen verschil.
De bewijskracht van de literatuur is zeer laag. De werkgroep is van mening dat op basis van de cruciale uitkomstmaten geen aanbeveling wordt gedaan ten aanzien van een voorkeurstechniek. De werkgroep is van mening dat ervaring met een entreetechniek de risico’s op complicaties verkleind.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
In de beschreven studies worden geen sterfgevallen en geen gasembolieën gerapporteerd. Voor vasculair en visceraal letsel wordt geen klinisch relevant verschil gevonden tussen de open en de gesloten techniek in de huidige literatuur. Ook lijkt er tussen de open en de gesloten entreetechniek geen verschil in bloedingen van de insteekopening.
Binnen de gesloten entreetechniek is er wellicht minder vasculair letsel bij het gebruik van de directe trocar techniek ten opzichte van de Veressnaald. Er worden echter maar in twee van de zes studies gevallen gerapporteerd, waarbij de number needed to treat relatief hoog is (214) en de bewijskracht laag. Daarnaast is de werkgroep van mening dat ervaring met een entreetechniek de risico’s op complicaties verkleind.
De bewijskracht van de cruciale uitkomstmaten is zeer laag. De werkgroep is van mening dat op basis van de cruciale uitkomstmaten geen aanbeveling wordt gedaan ten aanzien van een voorkeurstechniek.
De gesloten techniek leidt wellicht tot minder littekenbreuken dan bij de open entreetechniek. Het risico hierop is echter klein. Ook hangt het risico op een littekenbreuk af van het wel of niet hechten van de insteekopening, wat in deze studies verschillend toegepast werd. Dit risico wordt nog apart besproken in een afzonderlijke module.
Het gebruik van de open techniek zorgt wellicht voor minder kans op het falen van toegang dan bij het gebruik van de gesloten entreetechniek. In de praktijk blijkt dit echter geen groot probleem omdat de operateur bij het falen van de gesloten entreetechniek kan wisselen naar de open entreetechniek, indien hier ervaring mee is. Daarnaast is het falen van toegang per studie verschillende beschreven, waardoor de vergelijking tussen studies lastiger is.
Er lijkt tussen de open en de gesloten entreetechniek geen verschil voor solide orgaanschade en in bloedingen van de insteekopening.
Binnen de gesloten entreetechniek is er waarschijnlijk minder extraperitoneale insufflatie en minder kans op falen van toegang bij het gebruik van de directe trocar insertie ten opzichte van de Veressnaald insertie. Er lijkt geen verschil voor solide orgaanschade binnen de gesloten entreetechniek.
De werkgroep is van mening dat er geen reden is om een richting aan de besluitvorming te geven op basis van de belangrijke uitkomstmaten. Dit komt voornamelijk door de lage bewijskracht en omdat de gevonden verschillen klein zijn en daardoor voor de patiëntveiligheid niet bepalend zijn.
Overige overwegingen
Ten aanzien van de overige overwegingen: waarden en voorkeuren van de patiënt, kosten, aanvaarbaarheid voor de overige relevante stakeholders en haalbaarheid en implementatie zijn er geen noemenswaardige bezwaren vanuit het veld, die van invloed zijn op de besluitvorming.
Onderbouwing
Achtergrond
De incidentie van complicaties bij laparoscopie is laag. Echter, inherent aan de toegepaste chirurgische techniek kunnen er complicaties optreden, zoals de entree-gerelateerde complicatie. Er zijn in hoofdlijnen drie verschillende entree technieken te onderscheiden: de open techniek, de gesloten techniek (directe trocarentree en Veressnaald insertie) en de steeds meer gebruikte hybride techniek. De gekozen techniek hangt af van de ervaring van de chirurg, de operatie-indicatie en eventuele voorgeschiedenis van de patiënt. De risico’s behorend bij elk van de technieken zijn onderzocht. In deze module worden de risico’s besproken en strategieën uiteengezet die kunnen worden gevolgd om entree-gerelateerde complicaties te voorkomen.
Conclusies / Summary of Findings
Wat is het effect van een open entreetechniek versus een gesloten entreetechniek op (ernstige) ongewenste voorvallen en complicaties?
|
Redelijk GRADE |
Er is waarschijnlijk geen verschil in mortaliteit tussen de open en de gesloten techniek.
Bronnen: (Angioli (1), 2013; Angioli (2), 2013; Channa, 2009; Cogliandolo, 1998; Jamil, 2018) |
|
Zeer laag GRADE |
Er is wellicht geen verschil in het aantal vasculaire letsels tussen de open en de gesloten techniek, maar het bewijs is zeer onzeker.
Bronnen: (Angioli (1), 2013; Akbar, 2008; Angioli (2), 2013; Channa, 2009; Cogliandoli, 1998; Jamil,2018; Kaistha, 2019; Peitgen, 1997) |
|
Zeer laag GRADE |
Er is wellicht geen verschil in het aantal viscerale letsels tussen de open en de gesloten techniek, maar het bewijs is zeer onzeker.
Bronnen: (Angioli (1), 2013; Akbar, 2008; Angioli (2), 2013; Channa, 2009; Cogliandoli, 1998; Jamil, 2018; Kaistha, 2019; Peitgen, 1997) |
|
Zeer laag GRADE |
Er is wellicht geen verschil in het aantal solide orgaanletsels tussen de open en de gesloten techniek, maar het bewijs is zeer onzeker.
Bronnen: (Kaistha, 2019) |
|
Zeer laag GRADE |
Er is wellicht minder kans op falen van toegang bij het gebruik van de open entreetechniek, maar het bewijs is zeer onzeker.
Bronnen: (Akbar, 2008; Angioli (1), 2013; Angioli (2), 2013; Jamil, 2018; Zaman, 2015; Peitgen, 1997) |
|
Zeer laag GRADE |
Er is wellicht geen verschil in extraperitoneale insufflatie tussen de open en de gesloten techniek, maar het bewijs is zeer onzeker.
Bronnen: (Angioli (1), 2013; Angioli (2), 2013; Akbar, 2008; Channa, 2009; Cogliandoli, 1998; Peitgen, 1997; Jamil, 2018; Kaistha, 2019) |
|
Zeer laag GRADE |
Er zijn wellicht minder littekenbreuken bij het gebruik van de gesloten techniek, maar het bewijs is zeer onzeker.
Bronnen: (Channa, 2009; Jamil, 2018; Kaistha, 2019; Zaman, 2015; Peitgen, 1997) |
|
Zeer laag GRADE |
Er is wellicht geen verschil in het aantal bloedingen van de insteekopening tussen de open en de gesloten techniek, maar het bewijs is zeer onzeker.
Bronnen: (Channa, 2009; Jamil, 2018; Kaistha, 2019; Zaman, 2015; Peitgen, 1997) |
Wat is het effect van verschillende gesloten entreetechnieken (directe trocar insertie versus Veressnaald) op (ernstige) ongewenste voorvallen en complicaties?
|
Redelijk GRADE |
Er is waarschijnlijk geen verschil in de mortaliteit tussen de directe trocar insertie en de Veressnaald insertie.
Bronnen: (Angioli (1), 2013; Angioli (2), 2013; Imran, 2014; Karaca, 2014) |
Laag GRADE |
Er zijn wellicht minder vasculaire letsels bij het gebruik van de directe trocar insertie.
Bronnen: (Agresta, 2004; Angioli (3), 2013; Imran, 2014; Karaca, 2014; Prieto-Diaz-Chavez, 2006; Zakherah, 2010) |
|
Zeer laag GRADE |
Er is wellicht geen verschil in het aantal viscerale letsels tussen de directe trocar insertie en de Veressnaald insertie, maar het bewijs is zeer onzeker.
Bronnen: (Agresta, 2004; Angioli (3), 2013; Imran, 2014; Karaca, 2014; Zakherah, 2010) |
|
Laag GRADE |
Er is wellicht geen verschil het aantal gasemboliën tussen de directe trocar insertie en de Veressnaald insertie
Bronnen: (Agresta, 2004; Borgatta, 1990) |
|
Zeer laag GRADE |
Er is wellicht geen verschil in het aantal solide orgaanletsels tussen de directe trocar insertie en de Veressnaald insertie, maar het bewijs is zeer onzeker.
Bronnen: (Agresta, 2004; Karaca, 2014) |
|
Laag GRADE |
Directe trocar insertie zou wellicht het falen van toegang kunnen verminderen ten opzichte van de Veressnaald insertie.
Bronnen: (Agresta, 2004; Angioli (3), 2013; Borgatta, 1990; Byron, 1993; Gunenc, 2005; Nezhat, 1992; Prieto-Diaz-Chavez, 2006; Zakherah, 2010) |
|
Redelijk GRADE |
Er is waarschijnlijk minder extraperitoneale insufflatie bij de directe trocar insertie ten opzichte van Veressnaald insertie.
Bronnen: (Agresta, 2004; Angioli (3), 2013; Borgatta, 1990; Byron, 1993; Gunenc, 2005; Imran, 2014; Karaca, 2014; Nezhat, 1992; Prieto-Diaz-Chavez, 2006; Zakherah, 2010) |
Samenvatting literatuur
Beschrijving studies
Er zijn in totaal 19 artikelen, met 21 vergelijkingen geïncludeerd in de analyses (Agresta, 2004; Akbar, 2008; Angioli 1, 2013; Angioli 2, 2013; Angioli 3, 2013; Borgatta, 1990; Byron, 1993; Channa, 2009; Cogliandolo, 1998; Ertugrul, 2015; Gunenc, 2005; Imran, 2014; Jamil, 2018; Kaistha, 2019; Karaca, 2014; Nezhat, 1991; Peitgen, 1997; Prieto-Diaz-Chavez, 2006; Zakherah, 2010a; Zaman, 2015) (1 studie met 3 armen en 3 vergelijkingen (Angioli, 2013b), deze worden in de analyse besproken als losse studies (Angioli 1, 2013; Angioli 2, 2013; Angioli 3, 2013). De patiëntengroep bestond globaal uit patiënten boven de 18 jaar, die een indicatie hadden voor laparoscopie. Bij sommige studies werden obese patiënten (BMI>30) expliciet geëxcludeerd (Agresta, 2004; Angioli, 2013a; Jamil, 2018). Vaak werden patiënten die eerder een of meerdere operatie hadden gehad geëxcludeerd (Agresta, 2004; Angioli, 2013b; Ertugrul, 2015; Jamil, 2018; Kaistha, 2019; Karaca, 2014; Nezhat, 1991; Peitgen, 1997; Prieto-Diaz-Chavez, 2006; Zaman, 2015).
Voor de artikelen die geïncludeerd zijn in de Cochrane review, werden de resultaten primair uit deze review gehaald. Deze werden aangepast indien er door ons andere of aanvullende resultaten in de originele artikelen werden gevonden. Deze aanpassingen zijn verantwoord in de evidencetabellen.
Het punt van Palmer wordt gedefinieerd als het punt dat zich 3 cm distaal van de onderste rib miclaviculair bevindt.
Binnen de gesloten entreetechniek worden twee technieken onderscheiden: de directe trocarentree en entree via de Veressnaald.
De studies bevatten veel beperkingen. Deze waren vooral op het gebied van imprecisie, gebaseerd op lage incidentie van de uitkomstmaat en suboptimale patiënten aantallen en op het gebied van beperkingen in de studieopzet en uitvoering (risico op bias). De studiemethoden werden slecht beschreven, vaak werd niet beschreven op welke manier patiënten werden gerandomiseerd, of er sprake was van blindering van patiënten en/of zorgverleners en of sprake was van geblindeerde toewijzing van patiënten aan de verschillende onderzoeksgroepen .
Resultaten
Mortaliteit
Er werden geen sterfgevallen gerapporteerd in de geïncludeerde studies tussen de open en de gesloten entreetechniek (0/775 versus 0/940) (Angioli 1, 2013; Angioli 2, 2013; Channa, 2009; Cogliandolo, 1998; Jamil, 2018)). Men rapporteerde ook geen sterfgevallen in de geïncludeerde studies tussen de directe trocar insertie en de Veressnaald (0/692 versus 0/746) (Agresta, 2004; Angioli 3, 2013; Imran, 2014; Karaca, 2014).
Vasculair letsel
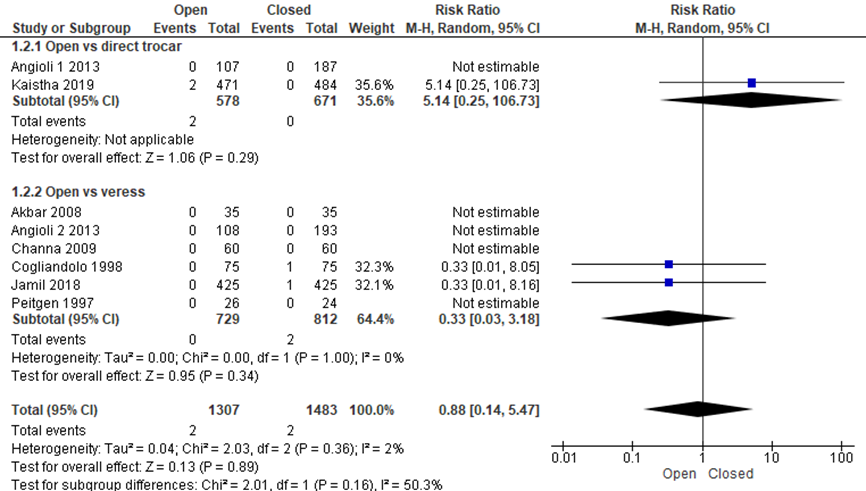
Studies toonden geen statistisch significant verschil in vasculair letsel tussen de open en gesloten entreetechniek (2/1307 versus 2/1483, RR 0.88 (0.14;5.47), I2 (heterogeniteit)= 2%) (Akbar, 2008; Angioli 1, 2013; Angioli 2, 2013; Channa, 2009; Cogliandolo, 1998; Jamil, 2018; Kaistha, 2019; Peitgen, 1997).
Gemiddeld zouden 5.506 patiënten een open entreetechniek moeten krijgen (in plaats van de gesloten entreetechniek) om bij één extra patiënt vasculair letsel te voorkomen, deze grens loopt van “333 patiënten behandelen met de open techniek”, terwijl de andere grens betekent “378 patiënten behandelen met de gesloten techniek” om bij één patiënt vasculair letsel te voorkomen (NNT=5.506, betrouwbaarheidsinterval van 333 patiënten bij de open techniek tot 378 bij de gesloten techniek). De werkgroep beoordeelde deze schatting van het effect als niet klinisch relevant. De grenzen van het betrouwbaarheidsinterval omsluiten zowel een klinisch relevant voordeel als nadeel van de open techniek.
Als naar de subgroepen gekeken werd, waren de uitkomsten verschillend voor de vergelijking open entreetechniek versus directe trocar insertie en voor de vergelijking open entreetechniek versus Veressnaald. Wanneer deze vergelijkingen apart bekeken werden, werd voor beide geen significant verschil gezien (2/578 versus 0/671, RR 5.14 (0.25;106.73) en 0/729 versus 2/812, RR 0.33 (0.03, 3.18), respectievelijk).
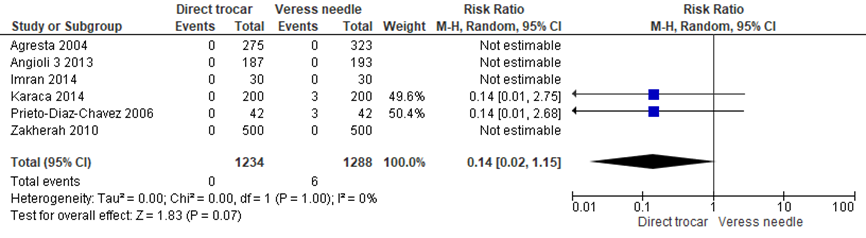
Binnen de gesloten entreetechniek lijken er klinische relevant minder vasculaire letsels op te treden bij de directe trocar insertie, maar bij deze patiënten aantallen bereikte het verschil niet het niveau van statistische significantie (0/1234 versus 6/1288, RR 0.14 (0.02;1.15), I2 = 0%) (Agresta, 2004; Angioli 3, 2013; Imran, 2014; Karac,a 2014; Prieto-Diaz-Chavez, 2006; Zakherah, 2010a). Gemiddeld zouden 214 patiënten een directe trocar insertie moeten krijgen om bij één extra patiënt vasculair letsel te voorkomen, deze grens loopt van 119 tot 1064 patiënten (NNT=214, het betrouwbaarheidsinterval loopt van 119 tot 1064 patiënten). De werkgroep beoordeelde de schatting van het effect inclusief de bovengrens van het betrouwbaarheidsinterval als klinisch relevant.
Figuur 1 Forest plot voor de vergelijkingen open versus gesloten entreetechniek. Uitkomstmaat: vasculair letsel
Figuur 2 Forest plot voor de vergelijking directe trocar insertie versus Veressnaald. Uitkomstmaat: vasculair letsel
Visceraal letsel
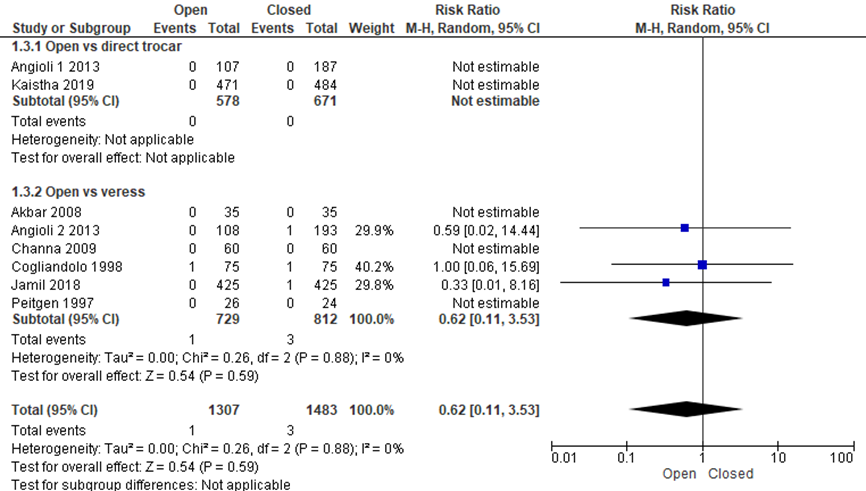
Er werd geen statistisch significant verschil gezien in visceraal letsel tussen de open en gesloten entreetechniek (1/1307 versus 3/1483, RR 0.62 (0.11;3.53), I2 = 0%) (Angioli 1, 2013; Angioli 2, 2013; Channa, 2009; Cogliandolo, 1998; Jamil, 2018; Kaistha, 2019; Peitgen, 1997). Gemiddeld zouden 795 patiënten een open entreetechniek moeten krijgen om bij één extra patiënt visceraal letsel te voorkomen, deze grens loopt van “250 patiënten behandelen met de open techniek”, terwijl de andere grens betekent “677 patiënten behandelen met de gesloten techniek” om bij 1 patiënt met visceraal letsel te voorkomen (NNT 795, betrouwbaarheidsinterval van 250 patiënten bij de open techniek en 677 bij de gesloten techniek). De werkgroep beoordeelde deze schatting van het effect als niet klinisch relevant. De grenzen van het betrouwbaarheidsinterval omsluiten zowel een klinisch relevant voordeel als nadeel van de open techniek.
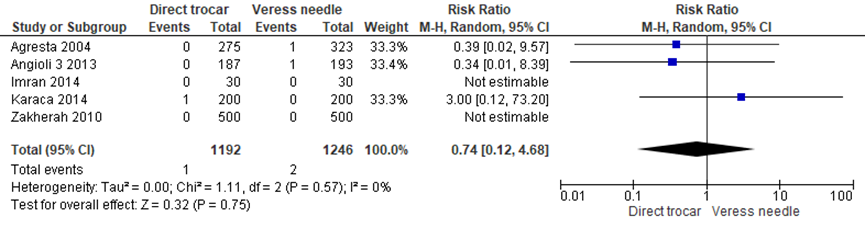
Ook binnen de gesloten entreetechniek was er geen statistisch significant verschil voor visceraal letsel tussen directe trocar insertie en Veressnaald (1/1192 versus 2/1246, RR 0.74 (0.12;4.68), heterogeneity: I2 = 0%) (Agresta, 2004; Angioli 3, 2013; Imran, 2014; Karaca, 2014; Zakherah, 2010a). NNT=1.305, betrouwbaarheidsinterval van 283 patiënten bij de directe trocar insertie en 500 bij de Veressnaald. De werkgroep beoordeelde deze schatting van het effect als niet klinisch relevant. De grenzen van het betrouwbaarheidsinterval omsluiten zowel een klinisch relevant voordeel als nadeel van de directe trocar insertie.
Figuur 3 Forest plot voor de vergelijkingen open versus gesloten entreetechnieken (directe trocar insertie en Veressnaald). Uitkomstmaat: visceraal letsel
Figuur 4 Forest plot voor de vergelijking directe trocar insertie versus Veressnaald. Uitkomstmaat: visceraal letsel
Gasembolie
Deze uitkomstmaat werd niet beschreven voor de vergelijking tussen de open en gesloten entreetechniek. Binnen de gesloten entreetechniek beschreven twee studies deze uitkomstmaat, maar werden er geen gevallen gerapporteerd (0/377 versus 0/433) (Agresta, 2004; Borgatta, 1990).
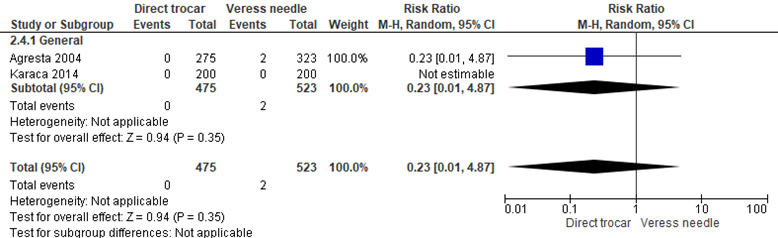
Solide orgaanschade
In één studie werd gekeken naar solide orgaan schade binnen de open en gesloten techniek, maar er werden geen events gerapporteerd (0/471 versus 0/484) (Kaistha, 2019). Binnen de gesloten entreetechniek werd geen statistisch significant verschil gezien voor solide orgaanschade tussen de directe trocar insertie en de Veressnaald (0/475 versus 2/523, RR 0.23 (0.01;4.87), I2 = not applicable). NNT: 261 patiënten behandelen met de directe trocar insertie om bij één patiënt solide orgaanschade te voorkomen, deze grens loopt van 109 patiënten met de directe trocar insertie, tot 682 patiënten met de Veressnaald” om bij één patiënt vasculair letsel te voorkomen. De werkgroep beoordeelde deze schatting van het effect als niet klinisch relevant. De grenzen van het betrouwbaarheidsinterval omsluiten zowel een klinisch relevant voordeel als nadeel van de open techniek (Agresta, 2004; Karaca, 2014).
Figuur 5 Forest plot voor de vergelijking directe trocar insertie versus Veressnaald. Uitkomstmaat: solide orgaanschade
Falen van toegang
Deze uitkomstmaat werd verschillend gedefinieerd per studie. Zo werd falen van toegang beschreven als meer dan twee pogingen om het pneumoperitoneum te bereiken (Zakherah, 2010a), meer dan drie pogingen (Angioli, 2013b; Prieto-Diaz-Chavez, 2006), of werd de techniek verandert naar een andere entreetechniek na twee pogingen(Nezhat, 1991) of na drie pogingen (Akbar, 2008; Jamil, 2018). Eén studie gaf aan dat er bij sommige patiënten geconverteerd was in verband met extraperitoneale insufflatie, maar het was onduidelijk na hoeveel pogingen dit gebeurde en of de originele entreetechniek opnieuw geprobeerd is (Agresta, 2004). Falen van toegang werd in sommige studies niet verder gespecificeerd (Gunenc, 2005; Zaman, 2015), of dit was dit niet te achterhalen voor de werkgroep (Borgatta, 1990; Byron, 1993). Dit maakt de meta-analyse van deze uitkomstmaat minder betrouwbaar.
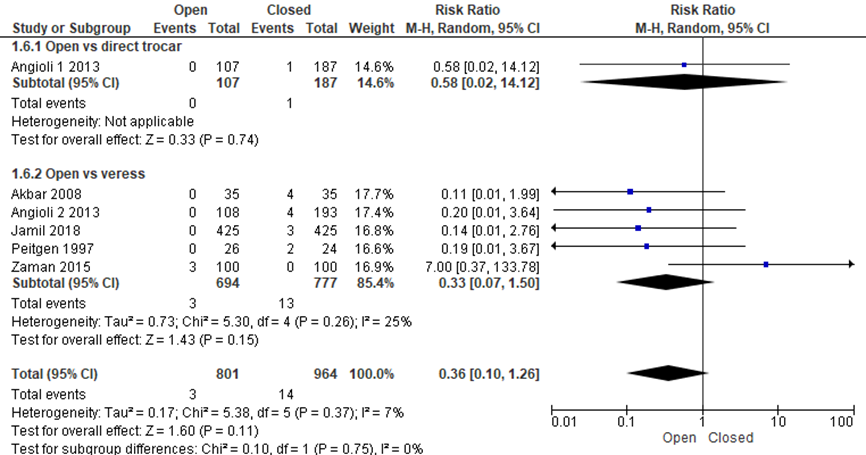
Er lijkt een klinisch relevant voordeel voor de open entreetechniek wat betreft het falen van toegang, maar bij deze patiënten aantallen bereikte het verschil niet het niveau van statistische significantie (3/801 versus 14/964, RR 0.36 (0.10;1.26), I2 = 25%) (Akbar, 2008; Angioli 1, 2013; Angioli 2, 2013; Jamil, 2018; Peitgen, 1997; Zaman, 2015). Gemiddeld zouden 92 patiënten een open entreetechniek moeten krijgen om bij één extra patiënt het falen van toegang te voorkomen, deze grens loopt van 51 tot 471 patiënten (NNT=92 betrouwbaarheidsinterval van 515 tot 471). De werkgroep beoordeelde de schatting van het effect als klinisch relevant. De grenzen van het betrouwbaarheidsinterval omsluiten geen klinisch relevant voordeel voor de gesloten techniek.
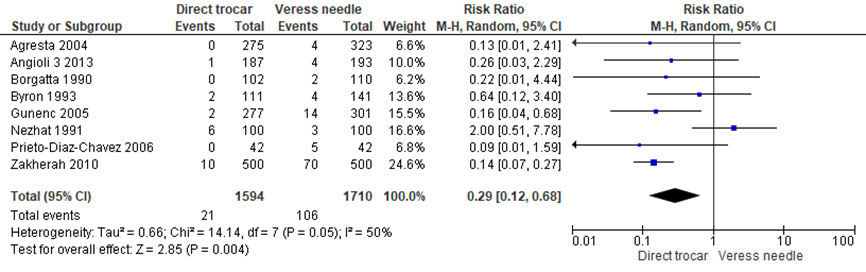
Binnen de gesloten entreetechnieken faalde de toegang bij het gebruik van de directe trocar insertie minder vaak ten opzichte van de Veressnaald (21/1594 versus 106/1710, RR 0.29 (0.12;0.68), I2 = 50%) (Agresta, 2004; Angioli 3, 2013; Borgatta, 1990; Byron, 1993; Gunenc, 2005; Nezhat, 1991; Prieto-Diaz-Chavez, 2006; Zakherah, 2010b). Gemiddeld zouden 20 patiënten een directe trocar insertie moeten krijgen om bij één extra patiënt de toegang niet te laten falen, deze grens loopt van 16 tot 28 patiënten. De werkgroep beoordeelde de schatting van het effect als klinisch relevant. Het betrouwbaarheidsinterval omsluit geen klinisch relevant voordeel voor de Veressnaald.
Figuur 6 Forest plot voor de vergelijkingen open versus gesloten entreetechnieken (directe trocar inserstie en Veressnaald). Uitkomstmaat: falen van toegang
Figuur 7 Forest plot voor de vergelijking directe trocar insertie versus Veressnaald. Uitkomstmaat: falen van toegang
Littekenbreuk
Deze uitkomstmaat werd door vijf studies gerapporteerd. Kaistha (2019) sloot de fascie van de 10 mm poort niet (Kaistha, 2019), terwijl Jamil (2018) standaard de fascie van de 10 mm umbilicale poort sloten (Jamil, 2018). De overige drie studies beschreven niet of de fascie gesloten werd (Channa, 2009; Peitgen, 1997; Zaman, 2015). Ook was bij twee studies geen informatie bekend over de lengte van de follow-up (Jamil, 2018; Peitgen, 1997; Zaman, 2015).
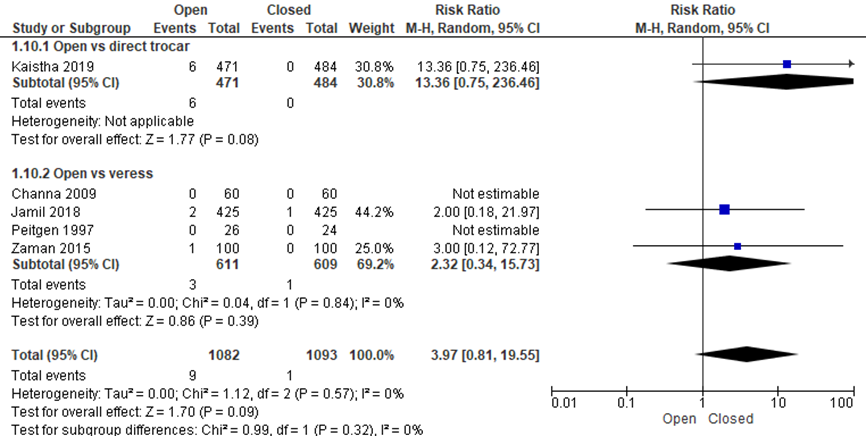
Er lijken klinisch relevant minder littekenbreuken op te treden bij de gesloten entreetechniek, maar bij deze patiënten aantallen bereikte het verschil niet het niveau van statistische significantie (9/1082 versus 1/1093, RR 3.97 (0.81;19.55), I2 = 0%) (Channa, 2009; Jamil, 2018; Kaistha, 2019; Peitgen, 1997; Zaman, 2015). NNT: Gemiddeld moeten 135 patiënten (betrouwbaarheidsinterval loopt van 76 tot 587 patiënten) met de gesloten techniek behandeld worden om één littekenbreuk te voorkomen. De werkgroep beoordeelde de schatting van het effect als klinisch relevant. Het betrouwbaarheidsinterval omsluit geen klinisch relevant voordeel voor de open techniek.
Deze uitkomstmaat werd niet beschreven voor de vergelijking binnen de gesloten entreetechniek.
Figuur 8 Forest plot voor de vergelijkingen open versus gesloten entreetechnieken (directe trocar inserstie en Veressnaald). Uitkomstmaat: littekenbreuk
Extraperitoneale insufflatie
Er was geen statistisch significant verschil in extraperitoneale insufflatie tussen de open en gesloten entreetechniek (14/1307 versus 16/1483, RR 0.90 (0.29;2.82), I2 = 37%) (Akbar, 2008; Angioli 1, 2013; Angioli 2, 2013; Channa, 2009; Cogliandolo, 1998; Jamil, 2018; Kaistha, 2019; Peitgen, 1997). NNT: gemiddeld moeten 12.921 patiënten met de open techniek behandeld worden om extraperitoneale insufflatie bij één patiënt te voorkomen (betrouwbaarheidsinterval loopt van 129 patiënten behandelen met de open techniek tot 131 patiënten behandelen met de gesloten techniek). De werkgroep beoordeelde de schatting van het effect als niet klinisch relevant. Het betrouwbaarheidsinterval omsluit zowel een voordeel als een nadeel van de open entreetechniek.
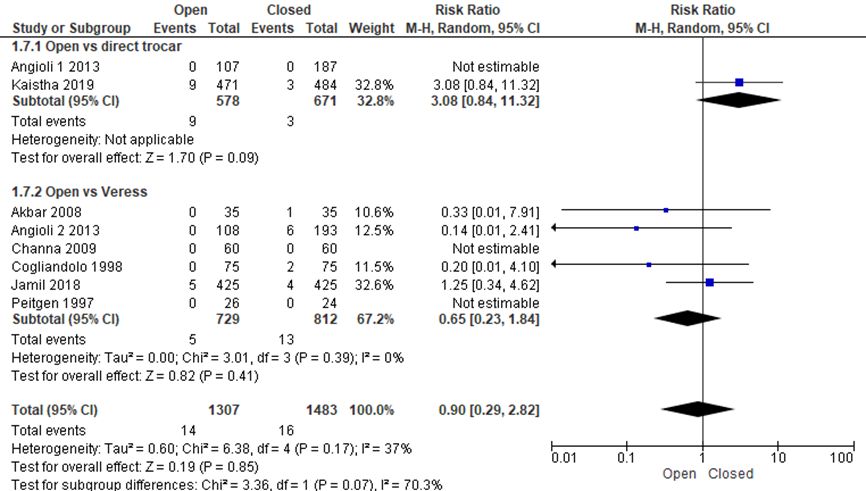
Als naar de subgroepen gekeken werd, waren de uitkomsten verschillend voor de vergelijking open entreetechniek versus directe trocar insertie en voor de vergelijking open versus Veressnaald. Wanneer deze vergelijkingen apart bekeken werden, werd voor de vergelijking open entreetechniek versus Veressnaald geen significant verschil gezien (5/729 versus 13/812, RR 0.65 (0.23;1.84)). Voor de vergelijking open entreetechniek versus directe trocar insertie werd geen significant verschil gezien, maar lijkt er een voordeel voor de directe trocar insertie (9/578 versus 3/671, RR 3.08 (0.84;11.32)).
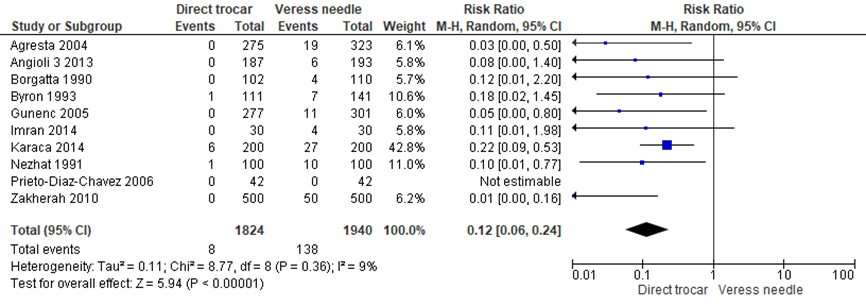
Binnen de gesloten entreetechniek werd een voordeel gezien van de directe trocar insertie ten opzichte van de Veressnaald voor extraperitoneale insufflatie (8/1824 versus 138/1940, RR 0.12 (0.06;0.24), I2 = 9%) (Agresta, 2004; Angioli 3, 2013; Borgatta, 1990; Byron, 1993; Gunenc, 2005; Imran, 2014; Karaca, 2014; Nezhat, 1991; Prieto-Diaz-Chavez, 2006; Zaman, 2015). NNT: gemiddeld moeten 15 patiënten (het betrouwbaarheidsinterval loopt van 13 tot 19) behandeld worden met de directe trocar insertie om extraperitoneale insufflatie te voorkomen bij één patiënt. De werkgroep beoordeelde de schatting van het effect als klinisch relevant.
Figuur 9 Forest plot voor de vergelijkingen open versus gesloten entreetechnieken (directe trocar inserstie en Veressnaald). Uitkomstmaat: extraperitoneale insufflatie
Figuur 10 Forest plot voor de vergelijking directe trocar insertie versus Veressnaald. Uitkomstmaat: extraperitoneale insufflatie
Bloeding van de insteekopening
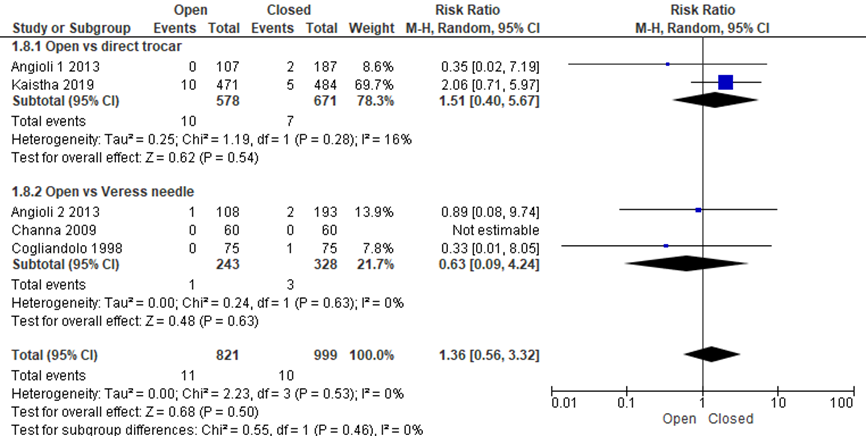
Er was geen statistisch significant verschil voor bloeding van de insteekopening tussen de open en gesloten entreetechniek (11/821 versus 10/999, RR 1.36 (0.56;4.24), I2 = 0%) (Angioli 1, 2013; Angioli 2, 2013; Channa, 2009; Cogliandolo, 1998; Kaistha, 2019). NNT: 295 patiënten moeten behandeld worden met de gesloten techniek om één bloeding te voorkomen, het betrouwbaarheidsinterval loopt van 75 voor de gesloten techniek tot 151 voor de open techniek. De werkgroep beoordeelde deze schatting van het effect als niet klinisch relevant. De grenzen van het betrouwbaarheidsinterval omsluiten zowel een klinisch relevant voordeel als nadeel van de gesloten techniek.
Als naar de subgroepen gekeken werd, waren de uitkomsten verschillend voor de vergelijking open entreetechniek versus directe trocar insertie en voor de vergelijking open versus Veressnaald. Wanneer deze vergelijkingen apart bekeken werden, werd voor beide geen significant verschil gezien (10/578 versus 7/671, RR 1.51 (0.40;5.67) en 1/243 versus 3/328, RR 0.63 (0.09, 4.24), respectievelijk).
Deze uitkomstmaat werd niet beschreven voor de vergelijking binnen de gesloten entreetechniek.
Figuur 11 Forest plot voor de vergelijkingen open versus gesloten entreetechnieken (directe trocar inserstie en Veressnaald). Uitkomstmaat: bloeding van de insteekopening
Relevante informatie uit vergelijkende studies die nieuwe varianten van de huidige technieken beschrijven
Twee studies uit de literatuurzoekactie werden geëxcludeerd omdat ze niet voldeden aan de PICO. Deze studies beschreven twee alternatieven van de huidige technieken betreft (Evsen, 2018; Mikhail, 2019). Deze studies bevatten echter wel relevante informatie en worden daarom hier besproken.
Mikhail (2019) beschreef in een RCT van 46 patiënten dat gelijktijdige CO2 insufflatie met het inbrengen van de Veressnaald voor een hoger slagingspercentage van de 1e toegangspoging zorgt. Er werd echter geen verschil gezien in falen van toegang en preperitoneale insufflatie (Mikhail, 2019). Evsen (2018) beschreef in een RCT van 30 patiënten minder toegangspogingen en minder insufflatiepogingen bij het inbrengen van de Veressnaald met begeleiding van de wijsvinger ten opzichte van de conventionele manier van inbrengen (Evsen, 2018).
Bewijskracht van de literatuur
Wat is het effect van een open entreetechniek versus een gesloten entreetechniek op (ernstige) ongewenste voorvallen en complicaties?
De bewijskracht voor de uitkomstmaat mortaliteit is met één niveau verlaagd gezien de relatief kleine patiëntenpopulatie (imprecisie).
De bewijskracht voor de uitkomstmaat vasculaire schade is met drie niveaus verlaagd gezien het risico op bias, tegenstrijdige resultaten (inconsistentie) en het beiderzijds overlappen van de grens van klinische besluitvorming (imprecisie).
De bewijskracht voor de uitkomstmaat visceraal letsel schade is met drie niveaus verlaagd gezien risico op bias en het beiderzijds overlappen van de grens van klinische besluitvorming (imprecisie, twee niveaus).
De bewijskracht voor de uitkomstmaat solide orgaanschade is met drie niveaus verlaagd gezien het risico op bias en het beiderzijds overlappen van de grens van klinische besluitvorming (imprecisie, twee niveaus).
De bewijskracht voor de uitkomstmaat falen van toegang is met drie niveaus verlaagd gezien het risico op bias, verschillende definitie van de uitkomstmaat (indirect bewijs) en het overlappen van de grens van klinische besluitvorming (imprecisie).
De bewijskracht voor de uitkomstmaat littekenhernia is met drie niveaus verlaagd gezien het risico op bias, verschillende omgaan met het sluiten van de fascie (inconsistentie) en het overlappen van de grens van klinische besluitvorming (imprecisie).
De bewijskracht voor de uitkomstmaat extraperitoneale insufflatie is met drie niveaus verlaagd gezien het risico op bias, tegenstrijdige resultaten en het beiderzijds overlappen van de grens van klinische besluitvorming (imprecisie, twee niveaus).
De bewijskracht voor de uitkomstmaat bloeding van de insteekopening is met drie niveaus verlaagd gezien het risico op bias, tegenstrijdige resultaten (inconsistentie) en het overlappen van de grens van klinische besluitvorming (imprecisie)
Wat is het effect van verschillende gesloten entreetechnieken (directe trocar insertie versus Veressnaald) op (ernstige) ongewenste voorvallen en complicaties?
De bewijskracht voor de uitkomstmaat mortaliteit is met één niveau verlaagd gezien de relatief kleine patiëntenpopulatie (imprecisie).
De bewijskracht voor de uitkomstmaat vasculaire schade is met twee niveaus verlaagd gezien het risico op bias en het overlappen van de grens van klinische besluitvorming (imprecisie).
De bewijskracht voor de uitkomstmaat visceraal letsel is met drie niveaus verlaagd gezien het risico op bias, tegenstrijdige resultaten (inconsistentie) en het beiderzijds overlappen van de grens van klinische besluitvorming (imprecisie).
De bewijskracht voor de uitkomstmaat gasembolie is met twee niveaus verlaagd gezien het risico op bias en de relatief kleine patiëntenpopulatie (imprecisie).
De bewijskracht voor de uitkomstmaat solide orgaan letsel is met drie niveaus verlaagd gezien het risico op bias, tegenstrijdige resultaten (inconsistentie) en het beiderzijds overlappen van de grens van klinische besluitvorming (imprecisie).
De bewijskracht voor de uitkomstmaat falen van toegang is met twee niveaus verlaagd gezien het risico op bias, verschillende definitie van de uitkomstmaat (indirect bewijs).
De bewijskracht voor de uitkomstmaat extraperitoneale insufflatie is met één niveau verlaagd gezien het risico op bias.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
“Wat is het effect van een open entreetechniek versus een gesloten entreetechniek op (ernstige) ongewenste voorvallen en complicaties?” en bijbehorende PICO:
P: volwassenen met een indicatie voor laparoscopie;
I: open entreetechniek;
C: gesloten entreetechniek (directe trocar insertie, tweede generatie endotip, Veress-naald);
O: mortaliteit, vasculair letsel, visceraal letsel (blaas- of darmletsel, solide organen), extraperitoneale insufflatie, CO2-lekkage, falen van toegang, lange termijn letsel/complicaties (zoals littekenbreuk, nerve entrapment syndrome, i.e. ACNES).
Daarnaast beantwoorde de werkgroep de vraag:
“Wat is het effect van verschillende gesloten entreetechnieken (directe trocar insertie versus Veressnaald) op (ernstige) ongewenste voorvallen en complicaties?”
Relevante uitkomstmaten
De werkgroep achtte mortaliteit, visceraal letsel, vasculair letsel, gasembolie en bloeding van de insteekopening voor de besluitvorming cruciale uitkomstmaten. Falen van toegang, littekenbreuk en extraperitoneale insufflatie (insufflatie van CO2 buiten de peritoneaalholte, subcutaan emfyseem is hierin meegenomen, conform de Cochrane Review van Ahmad uit 2019) en solide orgaanschade (schade aan lever, milt) zijn voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De werkgroep definieerde a priori geen klinisch (patiënt) relevante verschillen, maar gebruikte het “Number Needed to Treat” (NNT) of “Number Needed to Harm” (NNH) om de impact voor patiënten te beoordelen en te wegen.
Zoeken en selecteren (Methode)
In de databases Medline, Embase, Emcare, Web of Science en de Cochrane Library is op 19 april 2019 met relevante zoektermen gezocht naar complicaties bij gesloten en open entreetechnieken. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 1157 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: de studie betreft een randomized controlled trial (RCT), systematic review (SR), of een prospectieve cohort studie, de studiepopulatie bestaat uit volwassenen met een indicatie voor laparoscopie, de studie vergelijkt de open entreetechniek met de gesloten entreetechniek en de studie beschrijft één of meer van de, voor deze richtlijn, relevante uitkomsten.
Op basis van titel en abstract werd in eerste instantie een Cochrane review uit 2019 geselecteerd (Ahmad, 2019). Deze Cochrane review beantwoordde exact de PICO. De zoekopbrengst werd daarom doorgenomen op relevante studies gepubliceerd na de zoekdatum van de Cochrane review (195 treffers). Op basis van titel en abstract werden in eerste instantie 15 artikelen voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 10 artikelen geëxcludeerd (zie exclusietabel) en 5 artikelen definitief geselecteerd.
Buiten de zoekopdracht werd nog één artikel geïncludeerd, omdat deze studie wel mee werd genomen in een recente review (Nishimura, 2019), maar niet in de Cochrane review (Ahmad 2019). De artikelen gebruikt in de Cochrane review (Ahmad, 2019), relevant voor deze uitgangsvraag, worden als individuele artikelen meegenomen. Eén artikel uit de Cochrane review is geëxcludeerd, omdat deze specifiek obese patiënten includeerde (Ertugrul, 2015), twee andere artikelen zijn geëxcludeerd (9,26), omdat deze geen uitkomstmaten relevant voor deze uitgangsvraag bevatten. In totaal zijn 19 artikelen geïncludeerd.
Resultaten
In totaal zijn 19 artikelen over 19 afzonderlijke RCT’s opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen. Indien de artikelen reeds door de Cochrane review (Ahmad, 2019) beoordeeld waren op risk-of-bias, is deze beoordeling overgenomen in de risk of bias tabellen.
Referenties
- Agresta, F., De Simone, P., Ciardo, L. F., & Bedin, N. (2004). Direct trocar insertion versus Veress needle in nonobese patients undergoing laparoscopic procedures: a randomized prospective single-center study. Surg Endosc, 18(12), 1778-1781. doi:10.1007/s00464-004-9010-y.
- Ahmad, G., Baker, J., Finnerty, J., Phillips, K., & Watson, A. (2019). Laparoscopic entry techniques. Cochrane Database Syst Rev, 1, CD006583. doi:10.1002/14651858.CD006583.pub5 (doi).
- Akbar, M., Khan, I. A., Naveed, D., Khattak, I., Zafar, A., Wazir, M. S., . . . Zia ur, R. (2008). Comparison of closed and open methods of pneumoperitonium in laparoscopic cholecystectomy. J Ayub Med Coll Abbottabad, 20(2), 85-89.
- Angioli 1, R., Terranova, C., De Cicco, N. C., Cafa, E. V., Damiani, P., Portuesi, R., . . . Panici, P. B. (2013). A comparison of three different entry techniques in gynecological laparoscopic surgery: a randomized prospective trial. Eur J Obstet Gynecol Reprod Biol, 171(2), 339-342. doi:S0301-2115(13)00462-4 (pii);10.1016/j.ejogrb.2013.09.012 (doi).
- Angioli 2, R., Terranova, C., De Cicco, N. C., Cafa, E. V., Damiani, P., Portuesi, R., . . . Panici, P. B. (2013). A comparison of three different entry techniques in gynecological laparoscopic surgery: a randomized prospective trial. Eur J Obstet Gynecol Reprod Biol, 171(2), 339-342. doi:S0301-2115(13)00462-4 (pii);10.1016/j.ejogrb.2013.09.012 (doi).
- Angioli 3, R., Terranova, C., De Cicco, N. C., Cafa, E. V., Damiani, P., Portuesi, R., . . . Panici, P. B. (2013). A comparison of three different entry techniques in gynecological laparoscopic surgery: a randomized prospective trial. Eur J Obstet Gynecol Reprod Biol, 171(2), 339-342. doi:S0301-2115(13)00462-4 (pii);10.1016/j.ejogrb.2013.09.012 (doi).
- Angioli, R., Terranova, C., De Cicco Nardone, C., Cafa, E. V., Damiani, P., Portuesi, R., . . . Panici, P. B. (2013a). A comparison of three different entry techniques in gynecological laparoscopic surgery: a randomized prospective trial. Eur J Obstet Gynecol Reprod Biol, 171(2), 339-342. doi:10.1016/j.ejogrb.2013.09.012.
- Angioli, R., Terranova, C., De Cicco, N. C., Cafa, E. V., Damiani, P., Portuesi, R., . . . Panici, P. B. (2013b). A comparison of three different entry techniques in gynecological laparoscopic surgery: a randomized prospective trial. Eur J Obstet Gynecol Reprod Biol, 171(2), 339-342. doi:S0301-2115(13)00462-4 (pii);10.1016/j.ejogrb.2013.09.012 (doi).
- Borgatta, L., Gruss, L., Barad, D., & Kaali, S. G. (1990). Direct trocar insertion versus. Verres needle use for laparoscopic sterilization. J Reprod Med, 35(9), 891-894.
- Byron, J. W., Markenson, G., & Miyazawa, K. (1993). A randomized comparison of Verres needle and direct trocar insertion for laparoscopy. Surg Gynecol Obstet, 177(3), 259-262.
- Channa, G. A., Siddiqui, A. J., & Zafar, S. N. (2009). Open versus closed method of establishing pneumoperitoneum for laparoscopic cholecystectomy. J Coll Physicians Surg Pak, 19(9), 557-560. doi:09.2009/jcpsp.557560.
- Cogliandolo, A., Manganaro, T., Saitta, F. P., & Micali, B. (1998). Blind versus open approach to laparoscopic cholecystectomy: a randomized study. Surg Laparosc Endosc, 8(5), 353-355.
- Ertugrul, I., Kayaalp, C., Yagci, M. A., Sumer, F., Karagul, S., & Tolan, K. (2015). Comparison of Direct Trocar Entry and Veress Needle Entry in Laparoscopic Bariatric Surgery: Randomized Controlled Trial. J Laparoendosc Adv Surg Tech A, 25(11), 875-879. doi:10.1089/lap.2015.0317 (doi).
- Evsen, M. S., Icen, M. S., Findik, F. M., Tunc, S. Y., Agacayak, E., & Gul, T. (2018). A new technique in laparoscopic abdominal access (Evsen Method, Modified Veress Technique). Ginekol Pol, 89(9), 481-484. doi:VM/OJS/J/58680 (pii);10.5603/GP.a2018.0082 (doi).
- Gunenc, M. Z., Yesildaglar, N., Bingol, B., Onalan, G., Tabak, S., & Gokmen, B. (2005). The safety and efficacy of direct trocar insertion with elevation of the rectus sheath instead of the skin for pneumoperitoneum. Surg Laparosc Endosc Percutan Tech, 15(2), 80-81.
- Imran, M., Chohan, M. Z., Mehmood, Z., Mehmood, K., & Asif, K. (2014). Comparison of Veress needle and direct trocar insertion in establishing pneumoperitoneum for laparoscopic cholecystectomy. Pakistan Journal of Medical and Health Sciences, 8(3), 652-654.
- Jamil, M., Niaz, K., & Tahir, F. (2018). Closed versus. open method of pneumoperitonium at infra-umbilical site in laparoscopic surgery - A comparative study. J Pak Med Assoc, 68(10), 1478-1482. doi:8888 (pii).
- Kaistha, S., Kumar, A., Gangavatiker, R., Br, S., & Sisodiya, N. (2019). Laparoscopic Access: Direct Trocar Insertion Versus Open Technique. J Laparoendosc Adv Surg Tech A, 29(4), 489-494. doi:10.1089/lap.2018.0408 (doi).
- Karaca, A. S., Capar, M., & Ali, R. (2014). The first trocar entry in the laparoscopic cholecystectomy, which technique? Journal of Clinical and Analytical Medicine, 5(1), 1-3.
- Mikhail, E., Tamhane, N., Sarkar, P., Sappenfield, E., Tanner, J. P., & Imudia, A. N. (2019). Laparoscopic Entry Technique Using a Veress Needle Insertion with and without Concomitant CO2 Insufflation: A Randomized Controlled Trial. J Minim Invasive Gynecol. doi:S1553-4650(19)30099-8 (pii);10.1016/j.jmig.2019.02.011 (doi).
- Nezhat, F. R., Silfen, S. L., Evans, D., & Nezhat, C. (1991). Comparison of direct insertion of disposable and standard reusable laparoscopic trocars and previous pneumoperitoneum with Veress needle. Obstet Gynecol, 78(1), 148-150.
- Nishimura, M., Matsumoto, S., Ohara, Y., Minowa, K., Tsunematsu, R., Takimoto, K., . . . Ito, Y. M. (2019). Complications Related to the Initial Trocar Insertion of 3 Different Techniques: A Systematic Review and Meta-analysis. J Minim Invasive Gynecol, 26(1), 63-70. doi:S1553-4650(18)31316-5 (pii);10.1016/j.jmig.2018.06.023 (doi).
- Peitgen, K., Nimtz, K., Hellinger, A., & Walz, M. K. (1997). (Open approach or Veress needle in laparoscopic interventions? Results of a prospective randomized controlled study). Chirurg, 68(9), 910-913. doi:10.1007/s001040050294.
- Prieto-Diaz-Chavez, E., Medina-Chavez, J. L., Gonzalez-Ojeda, A., Anaya-Prado, R., Trujillo-Hernandez, B., & Vasquez, C. (2006). Direct trocar insertion without pneumoperitoneum and the Veress needle in laparoscopic cholecystectomy : a comparative study. Acta Chir Belg, 106(5), 541-544. doi:10.1080/00015458.2006.11679948.
- Zakherah, M. S. (2010a). Direct trocar versus veress needle entry for laparoscopy: a randomized clinical trial. Gynecol Obstet Invest, 69(4), 260-263. doi:000276571 (pii);10.1159/000276571 (doi).
- Zakherah, M. S. (2010b). Direct trocar versus veress needle entry for laparoscopy: a randomized clinical trial. Gynecologic & Obstetric Investigation, 69(4), 260-263. doi:https://dx.doi.org/10.1159/000276571.
- Zaman, M., Singal, S., Singal, R., Shah, A., Sandhu, K., Singh, B., . . . Bassi, S. (2015). Comparison of open and closed entry techniques for creation of pneumoperitoneum in laparoscopic surgery in terms of time consumption, entry-related complications and failure of technique. World Journal of Laparoscopic Surgery, 8(3), 69-71.
Evidence tabellen
Evidence table for systematic reviews (SRs)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Ahmad 2019 (Cochrane Review)
Open versus closed entry technique
(direct trocar + veress needle) |
SR and meta-analysis of RCTs
Literature search up to January 2018 A: Akbar 2008 B1: Angioli 1 2013 B2: Angioli 2 D: Channa 2009 E: Congliandolo 1998 F: Peitgen 1997 G: Zaman 2015
Study design: RCT
Setting and Country: NVT
Source of funding and conflicts of interest: No
|
Inclusion criteria SR: RCT, that compared one entry technique with another. Men, women, children who were undergoing diagnostic, operative, or mixed laparoscopy, performed by gynaecologists or general surgeons. Type of intervention: open entry technique (direct trocar or veress needle), or closed entry technique
Exclusion criteria SR:
7 studies included
Important patient characteristics at baseline: 1225 total
N, mean age A: 70 patients, 42 yr B: 599 D: 120 E: 150 F:50 G:200
Groups comparable at baseline? RCT |
Describe intervention:
A: closed method B1: direct B2: veress D: hasson E: veress F: veress G: veress
|
Describe control:
A: open method B1: open B2: open D: veress E: hasson F: open G: open
|
End-point of follow-up:
A: one month B: surgery D: unknown E: unknown F: unknown G: unknown
For how many participants were no complete outcome data available? (intervention/control) A: 0/0 (but some excluded because conversion, no numbers) B1: 0/3 (malignancy) B2: 0/1 (malignancy) D: 0/0 E: 3 conversion F: 0/0 G: 0/0
|
Primary outcomes
Outcome measure-1 Mortality
Effect measure: RR, RD, mean difference (95% CI): A: NA B1: 0/107 versus 0/187, RR NE B2: 0/108 versus 0/193, RR NE D: 0/60 versus 0/60, RR NE E: 0/75 versus 0/75, RR NE (not mentioned in Cochrane, quote from original article “no mortality was recorded in the patients studied”) F: NA G: NA
Outcome measure-2 Vascular Injury
Effect measure: RR, RD, mean difference (95% CI): A: 0/35 versus 0/35, RR NE (not mentioned in Cochrane, quote from original article “no major vascular or visceral injury occurred in any patient”) B1: 0/107 versus 0/187, RR NE B2: 0/108 versus 0/193, RR NE D: NA E: 0/75 versus 1/75 0.33 (0.01;3.18) F: 0/26 versus 0/24, RR NE G: NA
Outcome measure-3 Visceral Injury
Effect measure: RR, RD, mean difference (95% CI): A: 0/35 versus 0/35 (not mentioned in Cochrane, quote from original article “no major vascular or visceral injury occurred in any patient”) B1: 0/107 versus 0/187, RR NE B2: 0/108 versus 1/193, RR 0.59 D: 0/60 versus 0/60, RR NE (0.02;14.44) E: 1/75 versus 1/75, RR 1.00 (0.06;16.69) F: 0/26 versus 0/24, RR NE G: NA
Outcome measure-4 Failed entry
Effect measure: RR, RD, mean difference (95% CI): A: 0/35 versus 4/35, RR 0.11 (0.01;1.99) B1: 0/107 versus 1/187 RR 0.58 (0.02;14.12) B2: 0/108 versus 4/193, RR 0.20 (0.01;3.64) D: NA E: NA F: 0/26 versus 2/24, RR 0.19 (0.01; 3.67) (not mentioned in Cochrane, quote from original article “Bei 2 Patienten aus der Veress-Nadel -Gruppe wurde nach 3maliger unsicherer Punktion zum offenen Vorgehen gewechselt”) G: 3/100 versus 0/100. RR 7.00 (0.37;1.50)
Secondary outcomes Outcome measure-5 Extraperitoneal insufflation (combined with subcutaneous emphysema)
Effect measure: RR, RD, mean difference (95% CI): A: 0/35 versus 1/35, RR 0.33 (0.01;7.91) (Cochrane stated 1/35 versus 1/35, but the original article stated “No patient in group B (open entry) suffered injury during creation of pneumoperitonium while in group A two patients sustained injuries, one had extra peritoneal insufflation, and other had injury to small bowel mesentery.”) Definition: extraperitoneal insufflation B1: 0/107 versus 0/187, RR NE Definition: extraperitoneal insufflation B2: 0/108 versus 6/193, RR 0.14 (0.01;2.41) Definition: extraperitoneal insufflation D: 0/60 versus 0/60, RR NE Definition: extraperitoneal insufflation E: 0/75 versus 2/75 0.20 (0.01;4.10) Definition: Subcutaneous emphysema F: 0/26 versus 0/24, RR NE Definition: “Subcutaan oder eipfasciaal” G: NA
Outcome measure-6 Trocar site bleeding
Effect measure: RR, RD, mean difference (95% CI): A: NA B1: 0/107 versus 2/187, RR 0.35 (0.02;7.19) B2: 1/108 versus 2/193, RR 0.89 (0.08;9.74) D: 0/60 versus 0/60, RR NE (Cochrane stated 1/60 versus 0/60, but the original article describes this event as “port site hematoma”, therefore this event was excluded from analysis) E: 0/75 versus 1/75, RR 0.33 (0.01;8.05) F: NA G: NA
Outcome measure-7 Incisional hernia
Effect measure: RR, RD, mean difference (95% CI): A: NA B1: NA B2: NA D: 0/60 versus 0/60, RR NE E: NA F: 0/26 versus 0/24, RR NE (not mentioned in Cochrane, quote from original article “Postoperativ wurden in beiden Gruppen keine Wundprobleme im Ersteinstichsbereich, wie z.B. Incisionshernien”) G: 1/100 versus 0/100, RR 2.32 (0.34;15.73)
Pooled effect ( fixed effects model): 7.39 (95% CI 0.15to 372.38) favoring none Heterogeneity (I2): 0%, very low . 2RCT, n=320 All veress needle |
Bemelman 2000 did not report any relevant outcomes, and is therefore excluded from the evidence table
Differences in event rates between Cochrane review and original articles are mentioned with the relevant outcome measure.
Risk Ratio (RR) originates from our own analysis using RevMan. Mantel-Haenszel, with random effect was used, while Cochrane used Peto Odds Ratio. Pooled effect is therefore different and will not be stated in this evidence table |
|
Ahmad 2019 (Cochrane)
Direct trocar entry versus veress needle |
SR and meta-analysis of RCTs
Literature search up to January 2018 A: Agresta 2004 B: Angioli 3 2013 D: Borgatta 1990 E: Byron 1993 G: Gunenc 2005 H: Imran 2014 I: Karaca 2014 J: Prieto-Diaz-Chavez 2006 L: Zakerah 2010
Study design: RCT
Setting and Country: NVT
Source of funding and conflicts of interest: No
|
Inclusion criteria SR: RCT, that compared one entry technique with another. Men, women, children who were undergoing diagnostic, operative, or mixed laparoscopy, performed by gynaecologists or general surgeons. Type of intervention: Direct entry versus veress needle
Exclusion criteria SR:
Important patient characteristics at baseline: 4704 total
N, mean age A: 598 B: 599 C: 60 D: 212 E: 152 F: 81 G: 576 H: 60 I: 400 J: 84 K: 100 L: 1000
Groups comparable at baseline? RCT |
Describe intervention:
A: veress B: veress D: veress E: direct G: direct H: direct I: veress J: direct L: direct trocar
|
Describe control:
A: direct trocar B: direct trocar D: direct trocar E: veress G: veress H: veress I: direct trocar J: veress L: veress
|
End-point of follow-up:
A: surgery B: surgery D: unknown E: unknown G: unknown H: 2 months I: unknown J: unknown L: unknown
For how many participants were no complete outcome data available? (intervention/control) A: 0/0 B: 1/0 (malignancy) D: no data issues E: no incomplete data issues G: 0/0 H: 0/0 I:0/0 J:0/0 K: 0/0 L: 0/0
|
Primary outcomes
Outcome measure-1 Mortality
Effect measure: RR, RD, mean difference (95% CI): A: 0/275 versus 0/323, RR NE B: 0/187 versus 0/193, RR NE D: NA E: NA G: NA H: 0/30 versus 0/30, RR NE I: 0/200 versus 0/200, RR NE J: NA L: NA
Outcome measure-2 Vascular Injury
Effect measure: RR, RD, mean difference (95% CI): A: 0/275 versus 0/323, RR NE B: 0/187 versus 0/193, RR NE D: NA E: NA G: NA H: 0/30 versus 0/30, RR NE I: 0/200 versus 3/200, RR 0.14 (0.01;2.75) J: 0/42 versus 3/42, RR 0.14 (0.01;2.68) L: 0/500 versus 0/500, RR NE (not mentioned in Cochrane, quote from original article “There were no major complications in both groups” Major complications defined as vascular or visceral injury)
Outcome measure-3 Visceral Injury
Effect measure: RR, RD, mean difference (95% CI): A: 0/275 versus 1/323, RR 0.39 (0.02;9.57) (Cochrane stated 0/275 versus 0/323, but the original article describes 1 ileal performation in the veress needle group) B: 0/187 versus 1/193, RR 0.34 (0.01;8.39) D: NA E: NA G: NA H: 0/30 versus 0/30, RR NE I: 1/200 versus 0/200, RR 3.00 (0.12;4.68) J: NA L: 0/500 versus 0/500, RR NE (not mentioned in Cochrane, quote from original article “There were no major complications in both groups” Major complications defined as vascular or visceral injury)
Outcome measure-4 Gas embolism
A: 0/275 versus 0/323, RR NE B: NA D: 0/102 versus 0/110, RR NE E: NA G: NA H: NA I: NA J: NA L: NA
Outcome measure 5- Solid organ injury Effect measure: RR, RD, mean difference (95% CI): A: 0/275 versus 2/323, RR 0.23 (0.01;4.87) B: NA D: NA E: NA G: NA H: NA I: 0/200 versus 0/200, RR NE J: NA L: NA
Outcome measure-4 Failed entry
Effect measure: RR, RD, mean difference (95% CI): A: 0/275 versus 4/323, RR 0.13 (0.01;2.41) B: 1/187 VERSUS 4/193, RR 0.26 (0.03;2.29) D: 0/102 versus 2/110, RR 0.22 (0.01;4.44) E: 2/111 versus 4/141, RR 0.64 (0.12;3.40) G 2/277 versus 14/301, RR 0.16 (0.04;0.68) (Cochrane stated 2/301 versus 13/277, but the original article states different groups (301 patients in direct trocar group and 277 in veress needle group. Also percentages and numbers differ in abstract and results. Percentages from the results section are used to calculate event rates: 2/277 (0.7%) versus 14/301 (4.6%)) H: NA I: NA J: 0/42 versus 5/42, RR 0.09 (0.01;1.59) L: 10/500 versus 70/500, RR 0.14 (0.07;0.27)
Secondary outcomes Outcome measure-7 Extraperitoneal insufflation (combined with subcutaneous emphysema)
Effect measure: RR, RD, mean difference (95% CI): A: 0/275 versus 19/323, RR 0.03 (0.00;0.50) Definition: extraperitoneal insufflation and subcutaneous emphysema) B: 0/187 versus 6/193, RR 0.08 (0.00;1.40) Definition: Extraperitoneal insufflation D: 0/102 versus 4/110, RR 0.12 (0.01;2.20) Definition: unknown E: 1/111 versus 7/141, RR 0.18 (0.02;1.45) Definition unknown G: 0/277 versus 11/301, RR 0.05 (0.00;0.80) (Cochrane stated 0/301 versus 10/277, but the original article states different groups (301 patients in direct trocar group and 277 in veress needle group. Also percentages and numbers differ in abstract and results. Percentages from the results section are used to calculate event rates: 0/277 (0%) versus 11/301 (3.6%)) Definition: subcutaneous emphysema H: 0/30 versus 4/30, RR 0.11 (0.01;1.98) Definition: subcutaneous emphysema I: 6/200 versus 27/200 0.22 (0.09;0.53) (Cochrane stated 5/200 versus 19/200, but the original article states 8 events in the veress needle group and 1 event in the direct trocar group of subcutaneous emphysema. Also 19 events events in the veress needle group and 5 events in the direct trocar group of extraperitoneal insufflation) Definition: Subcutaneous emphysema and extraperitoneal insufflation J: 0/42 versus 0/42, RR NE Definition: preperitoneal insufflation L: 0/500 versus 50/500, RR 0.01 (0.00;0.16) (Cochrane stated 10/500 versus 70/500, but the original article states that extraperitoneal insufflation are 0 events in the direct trocar group and 50 events in the veress needle group. Other events are 2 versus 20 of omental emphysema, which is excluded from this outcome measurement. Definition: Extraperitoneal insufflation |
Bemelman 2000 and Tansitit did not report any relevant outcomes, and are therefore excluded from the evidence table
Ertugrul 2015 included only obese patients and was therefore excluded from the evidence table
Risk Ratio (RR) originates from our own analysis using RevMan. Mantel-Haenszel, with random effect was used, while Cochrane used Peto Odds Ratio. Pooled effect is therefore different and will not be stated in this evidence table |
Evidence table for intervention studies (RCTs)
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Jamil, 2018 |
Type of study: quasi-experimental
Setting and country: 1 hospital, Pakistan
Funding and conflicts of interest: None
|
Inclusion criteria: -30-50 year -symptomatic gall stones - normal common bile duct confirmed by ultrasound - scheduled laparoscopic surgery (cholecystectomy)
Exclusion criteria: -para-umbilical hernia -upper abdominal surgery -co-morbidity (diabetes, hypertension, renal failure, chronic liver disease) -obesity (BMI>30)
N total at baseline: Intervention: 425 Control: 425
Important prognostic factors2: For example age ± SD: not mentioned per group
Groups comparable at baseline? Randomized
Randomization procedure. Non-probability consecutive sampling. Block-randomised in blocks of 2,4,6 at each week of admission. Randomisation was done at time of admission into two equal groups. |
Describe intervention (treatment/procedure/test):
Closed technique (Group A). Blind insertion of Veress Needle and trocar (technique well described, reusable blunt trocars) 3 failed attempts à conversion to open method
|
Describe control (treatment/procedure/test):
Open technique (Group B) Open insertion of trocar (technique well described, reusable blunt trocars)
|
Length of follow-up: Unknown (just surgery complications)
Loss-to-follow-up: Intervention: N 0 (%)
Control: N 0 (%)
Incomplete outcome data: Intervention: N 0 (%)
Control: N 0 (%)
|
Outcome measures and effect size (include 95%CI and p-value if available):
- Complications Failure to pneumoperitoneum (3 versus 0, p= NS)
Abdominal wall related complications (13 versus 24, p= NS) Port site hernia (1 versus 2 NS)
Intra abdominal complications (5 versus 1 NS) Bowel tear (2 versus 1 NS) (no relevant outcome measure, conform Cochrane Review) Bowel perforation (1 versus.0 NS) Mesenteric vascular injury (1 versus. 0 NS) Mortality (0 versus 0 NS)
|
Concluding open is safer, but complications the same. Only few failed entry
|
|
Kaistha 2019 |
Type of study: Prospective Randomized controlled trial
Setting and country: Department of surgical gastroenterology of tertiary center India
Funding and conflicts of interest: No |
Inclusion criteria: Not stated
Exclusion criteria: <10 years Pregnant females Emergency surgeries Previous midline abdominal surgery Respiratory compromise Uncorrected coagulopathy peritonitis N total at baseline: Intervention: 484 Control:471
Important prognostic factors2:
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
Closed entry Sharp trocar Direct trocar insertion (no veress needle) Technique well described Fascia not closed |
Describe control (treatment/procedure/test):
Open entry Variation Hasson technique
Fascia not closed |
Length of follow-up: First postoperative day, 3 months, 6 months, 1 year
Loss-to-follow-up: Intervention: N 2.6 (%) Reasons (describe) Only for 1 year follow up, port site hernia
Control: N 1.9 (%) Reasons (describe) Only for 1 year follow up, port site hernia
Incomplete outcome data: Intervention: N 2.6% (%) Reasons (describe) Port site hernia
Control: N 1.9(%) Reasons (describe) Port site hernia |
Outcome measures and effect size (include 95%CI and p-value if available): All outcomes measured at first postoperative day, 3 months, 6 months, 1 year
(numbers) Major injuries Bowel injuries (0 versus 2 NS) Vascular injury (0 versus 0 NS) Solid organ injury (0 versus 0 NS)
Minor complications Subcutaneous emphysema (3 versus 9 NS) Umbilical portsite infection (5 versus 22 p=0.01) Umbilical portsite bleed (5 versus 10 NS)
Other variables Umbilical port-site pain (6 versus 29 p=0.01) Entry reattempted (9 versus 6 NS) Gas leakage (4 versus 39, p=0.01) Mean access time (seconds) (80.2 versus 180.9, p=0.01) Umbilical port-site hernia (0 versus 6, p=0.01) |
Intention to treat analysis |
|
Nezhat 1991 |
Type of study: RCT
Setting and country: unknown (author in Atlanta)
Funding and conflicts of interest: unknown |
Inclusion criteria: Patients requiring diagnostic and operative laparoscopy
Exclusion criteria: History of laparotomy
N total at baseline: Intervention: 100 Control: 100
Important prognostic factors2:
BMI: I: 20.3 C: 22.5
|
Describe intervention (treatment/procedure/test):
Veress needle
|
Describe control (treatment/procedure/test):
Direct trocar. (first 50 using conventional reusable trocar, sharpened monthly. Last 50 disposable shielded trocars) |
Length of follow-up: Surgery
Loss-to-follow-up: Intervention: 0 N (%) Reasons (describe) 3 patients changed to other procedure
Control: 0 N (%) Reasons (describe) 6 patients changed to other procedure
|
Outcome measures and effect size (include 95%CI and p-value if available):
Veress versus direct trocar Complications: 22 versus 3 (p<0.05). no major. Group 1: 10 subcutaneous emphysema, 12 omental emphysema. Group 2: 2 omental perforation, 1 subcutaneous emphysema. Requiring 2 insertions: 20 versus 20 (NS) Failed insertion (3 versus 6, p>0.05)
Direct trocar: conventional versus disposable Complications: 3 versus 0 (p<0.05) Requiring 2 insertions 10 versus 10 (NS) Failed insertions (4 versus 2 (p>0.05) |
Article not included in Cochrane Review. Included in Nishimura 2019 (Review excluded, due to the same articles compared to Cochrane Review) |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Risk of bias tabel
GRADEpro tabellen
Vraagstelling: Directe trocar insertie versus Veress naald voor Laparoscopie
|
Certainty assessment |
Aantal patiënten |
Effect |
Certainty |
Importantie |
||||||||
|
Aantal studies |
Studieopzet |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Andere factoren |
Directe trocar insertie |
Veress naald |
Relatief |
Absoluut |
||
|
Mortaliteit |
||||||||||||
|
4 |
gerandomiseerde trials |
niet ernstig a |
niet ernstig |
niet ernstig |
ernstig b |
niet gevonden |
0/692 (0.0%) |
0/746 (0.0%) |
Niet te berekenen |
⨁⨁⨁◯ |
CRUCIAAL |
|
|
Vasculair letsel |
||||||||||||
|
6 |
gerandomiseerde trials |
ernstig c |
niet ernstig |
niet ernstig |
ernstig d |
niet gevonden |
0/1234 (0.0%) |
6/1288 (0.5%) |
RR 0.14 |
4 minder per 1,000 |
⨁⨁◯◯ |
CRUCIAAL |
|
Visceraal letsel |
||||||||||||
|
5 |
gerandomiseerde trials |
ernstig c |
ernstig e |
niet ernstig |
zeer ernstig f |
niet gevonden |
1/1192 (0.1%) |
2/1246 (0.2%) |
RR 0.74 |
0 minder per 1,000 |
⨁◯◯◯ |
CRUCIAAL |
|
Gas embolie |
||||||||||||
|
2 |
gerandomiseerde trials |
ernstig c |
niet ernstig |
niet ernstig |
ernstig b |
niet gevonden |
0/377 (0.0%) |
0/433 (0.0%) |
Niet te berekenen |
⨁⨁◯◯ |
CRUCIAAL |
|
|
Solide orgaanletsel |
||||||||||||
|
2 |
gerandomiseerde trials |
ernstig c |
niet ernstig |
niet ernstig |
zeer ernstig f |
niet gevonden |
0/475 (0.0%) |
2/523 (0.4%) |
RR 0.23 |
3 minder per 1,000 |
⨁◯◯◯ |
BELANGRIJK |
|
Falen van toegang |
||||||||||||
|
8 |
gerandomiseerde trials |
ernstig c |
niet ernstig |
ernstig g |
niet ernstig h |
niet gevonden |
21/1594 (1.3%) |
106/1710 (6.2%) |
RR 0.29 |
44 minder per 1,000 |
⨁⨁◯◯ |
BELANGRIJK |
|
Extraperitoneale insufflatie |
||||||||||||
|
10 |
gerandomiseerde trials |
ernstig c |
niet ernstig |
niet ernstig |
niet ernstig h |
niet gevonden |
8/1824 (0.4%) |
138/1940 (7.1%) |
RR 0.12 |
63 minder per 1,000 |
⨁⨁⨁◯ |
BELANGRIJK |
CI: Confidence interval; RR: Risk ratio
Explanations
a. Er wordt niet verwacht dat het risk of bias effect heeft op deze zeer objectieve uitkomstmaat
b. Kleine patientenpopulatie
c. Serious risk of bias due to randomization, blinding and allocation concealment
d. Het betrouwbaarheidsinterval doorkruist de lijn van klinische relevantie eenmaal
e. Tegenstrijdige resultaten tussen de studies
f. Betrouwbaarheidsinterval doorkruist de lijn van klinische relevantie tweemaal
g. De uitkomstmaat wordt verschillend gedefinieerd per studie
h. Het betrouwbaarheidsinterval doorkruist de lijn van klinische relevantie niet
Vraagstelling: Open entreetechniek versus Gesloten entreetechniek voor Laparoscopie
|
Certainty assessment |
Aantal patiënten |
Effect |
Certainty |
Importantie |
||||||||
|
Aantal studies |
Studieopzet |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Andere factoren |
Open entreetechniek |
Gesloten entreetechniek |
Relatief |
Absoluut |
||
|
Mortaliteit |
||||||||||||
|
5 |
gerandomiseerde trials |
niet ernstig a |
niet ernstig |
niet ernstig |
ernstig b |
niet gevonden |
0/775 (0.0%) |
0/940 (0.0%) |
Niet te berekenen |
⨁⨁⨁◯ |
CRUCIAAL |
|
|
Vasculair letsel |
||||||||||||
|
8 |
gerandomiseerde trials |
ernstig c |
ernstig d |
niet ernstig |
zeer ernstig e |
niet gevonden |
2/1307 (0.2%) |
2/1483 (0.1%) |
RR 0.88 |
0 minder per 1,000 |
⨁◯◯◯ |
CRUCIAAL |
|
Visceraal letsel |
||||||||||||
|
8 |
gerandomiseerde trials |
ernstig c |
niet ernstig |
niet ernstig |
zeer ernstig e |
niet gevonden |
1/1307 (0.1%) |
3/1483 (0.2%) |
RR 0.62 |
1 minder per 1,000 |
⨁◯◯◯ |
CRUCIAAL |
|
Solide orgaanletsel |
||||||||||||
|
1 |
gerandomiseerde trials |
ernstig c |
niet ernstig |
niet ernstig |
zeer ernstig b,f |
niet gevonden |
0/471 (0.0%) |
0/484 (0.0%) |
Niet te berekenen |
⨁◯◯◯ |
BELANGRIJK |
|
|
Falen van toegang |
||||||||||||
|
6 |
gerandomiseerde trials |
ernstig c |
niet ernstig |
ernstig g |
ernstig h |
niet gevonden |
3/801 (0.4%) |
14/964 (1.5%) |
RR 0.36 |
9 minder per 1,000 |
⨁◯◯◯ |
BELANGRIJK |
|
Extraperitoneale insufflatie |
||||||||||||
|
8 |
gerandomiseerde trials |
ernstig c |
ernstig d |
niet ernstig |
zeer ernstig e |
niet gevonden |
14/1307 (1.1%) |
16/1483 (1.1%) |
RR 0.90 |
1 minder per 1,000 |
⨁◯◯◯ |
BELANGRIJK |
|
Bloeding van de insteekopening |
||||||||||||
|
5 |
gerandomiseerde trials |
ernstig c |
ernstig i |
niet ernstig |
ernstig h |
niet gevonden |
11/821 (1.3%) |
10/999 (1.0%) |
RR 1.36 |
4 meer per 1,000 |
⨁◯◯◯ |
BELANGRIJK |
|
Littekenbreuk |
||||||||||||
|
5 |
gerandomiseerde trials |
ernstig c |
ernstig j |
niet ernstig |
ernstig h |
niet gevonden |
9/1082 (0.8%) |
1/1093 (0.1%) |
RR 3.97 |
3 meer per 1,000 |
⨁◯◯◯ |
BELANGRIJK |
CI: Confidence interval; RR: Risk ratio
Explanations
a. Er wordt niet verwacht dat het risk of bias effect heeft op deze zeer objectieve uitkomstmaat
b. Kleine patientenpopulatie
c. Serious risk of bias due to randomization, blinding and allocation concealment
d. Tegenstrijdige resultaten tussen de veressnaald en directe trocar insertie
e. Betrouwbaarheidsinterval doorkruist de lijn van klinische relevantie tweemaal
f. Eén studie
g. De uitkomstmaat wordt verschillend gedefinieerd per studie
h. Betrouwbaarheidsinterval doorkruist de lijn van klinische relevantie eenmaal
i. verschillende studies hebben voorkeur voor andere techniek
j. Het verschilt per studie of de fascie gesloten wordt of niet, of dit is onduidelijk. Ook is de follow up niet bekend bij elke studie.
Reden voor exclusie na het lezen van het volledige artikel.
|
Auteur en jaartal |
Redenen van exclusie |
|
Arif 2018 |
Geen vergelijkende studie, alleen de gesloten entreetechniek |
|
Asfour 2018 |
Narrative review |
|
Bemelman 2000 |
Geen relevante uitkomstmaten |
|
Bove 2018 |
Survey over voorkeuren, niet over complicaties |
|
Ertugrul 2015 |
Specifieke inclusie obese patiënten, deze patiëntengroep in een andere uitgangsvraag besproken |
|
Mohammadi 2018 |
Gebruik van optical trocar, wordt in een andere uitgangsvraag besproken |
|
Jung 2018 |
Geen vergelijkende studie, alleen de gesloten entreetechniek |
|
Nishimura 2019 |
Systematic review 2019, alle artikelen uit de Cochrane review worden hierin gebruikt. Eén artikel wat niet in Cochrane zit, deze wordt apart geïncludeerd. Gekozen om Cochrane Review te includeren |
|
Tanaka 2018 |
Gebruik van optical trocar, wordt in een andere uitgangsvraag besproken |
|
Tansatit 2006 |
Geen relevante uitkomstmaten |
|
Ellatif 2018 |
Locatie van inbrengen Veressnaald, wordt bij andere uitgangsvraag besproken |
|
Senturk 2018 |
Geen relevante uitkomstmaten |
|
Vilos 2018 |
Video artikel |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 16-08-2021
Beoordeeld op geldigheid : 16-08-2021
Frequentie van beoordeling op actualiteit: Eens per 5 jaar
Relevante factoren voor wijziging in aanbeveling: Geen factoren bekend
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Patiënten participatie bij deze richtlijn werd medegefinancierd uit de Stichting Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten die een laparoscopie ondergaan.
Werkgroep
- Prof. dr. F.W. (Frank Willem) Jansen, gynaecoloog, Leids Universitair Medisch Centrum, Leiden, NVOG (voorzitter)
- Drs. F.H.M.P. (Fokkedien) Tummers, arts-onderzoeker gynaecologie, Leids Universitair Medisch Centrum, Leiden, NVOG
- Drs. T.A. (Tammo) Brouwer, anesthesioloog, Zorggroep Noorderbreedte, Leeuwarden, NVA
- Dr. S.F.P.J. (Sjors) Coppus, gynaecoloog, Máxima MC, Eindhoven, NVOG
- Dr. A. (Ahmet) Demirkiran, gastro-intestinaal & bariatrisch chirurg, Rode Kruis Ziekenhuis, Beverwijk, NVVH
- Dr. W.A. (Werner) Draaisma, chirurg, Jeroen Bosch Ziekenhuis, ’s-Hertogenbosch, NVEC
- Dr. B.W. (Brunolf) Lagerveld, uroloog, OLVG, Amsterdam, NVU
- Ir. E.S. (Esther) van Schrojenstein Lantman, klinisch fysicus, Albert Schweitzer ziekenhuis, Dordrecht, NVKF
- Drs. K. (Klaartje) Spijkers, senior adviseur patiëntenbelang, Patiëntenfederatie Nederland, Utrecht
Met ondersteuning van
- Dr. M. (Marleen) van Son, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf september 2020)
- Dr. L. (Laura) Viester, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf september 2020)
- Dr. J. (Julitta) Boschman, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf juli 2019 tot september 2020)
- Dr. R. (Roy) Elbers, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot juni 2019)
- Dr. E. (Elvira) den Breejen, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot juni 2019)
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Brouwer |
Anesthesioloog - werkzaam te Medisch Centrum Leeuwarden (MC) (#werkgever) |
- |
Geen |
Geen |
|
Coppus |
Gynaecoloog Maxima Medisch Centrum Eindhoven/Veldhoven |
Bestuurslid Werkgroep Gynaecologische Endoscopie (onbetaald) |
Geen |
Geen |
|
Demirkiran |
Gastro-intestinaal en bariatrisch chirurg. |
Geen |
Geen |
Geen |
|
Draaisma |
Chirurg Jeroen Bosch Ziekenhuis |
Geen |
Geen |
Geen |
|
Jansen |
Gynaecoloog LUMC Professor in Gynaecology and Minimally Invasive Surgery Leiden University |
Professor in Gynaecology and Minimally Invasive Surgery TU Delft |
Geen |
Geen |
|
Lagerveld |
Uroloog OLVG Amsterdam |
Geen |
Geen |
Geen |
|
Schrojenstein - Lantman |
Klinisch Fysicus in het Albert Schweitzer Ziekenhuis (ASZ) (0,9 fte) |
Geen |
Geen |
Geen |
|
Spijkers |
Senior adviseur patiëntenbelang |
Voorzitter Stichting Samen voor Duchenne |
Geen |
Geen |
|
Tummers |
ANIOS Gynaecologie & Verloskunde, Groene Hart Ziekenhuis Gouda |
Onderzoeker LUMC, afdeling Gynaecologie, betaald |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door participatie van een afgevaardigde van Patiëntenfederatie Nederland in de werkgroep. Deze afgevaardigde heeft de werkgroep van input voorzien bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep schriftelijk de knelpunten in de zorg voor patiënten met een indicatie voor een laparoscopie. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijn Minimaal Invasieve Chirurgie (NVOG, 2011) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door onder andere de Inspectie voor Gezondheidszorg en Jeugd, Lareb, het Nederlands Huisartsen Genootschap, de Nederlandse Vereniging voor Heelkunde, de Nederlandse Vereniging voor Klinische Fysica en de Nederlandse Vereniging voor Obstetrie en Gynaecologie. De ingebrachte knelpunten inclusief reactie van de werkgroep is opgenomen in de bijlagen.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij hanteerde de werkgroep een maximum van acht uitkomstmaten. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J (corrected to Schünemann, Holger J). PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
19-4-2019: 1.157 referenties, afkomstig uit:
- PubMed: 614 (RefID/Label 1-616).
- MEDLINE (OVID): 684, waarvan 300 uniek (RefID/Label 617-948)**
- Embase: 744, waarvan 135 uniek (RefID/Label 949-1119).
- Emcare: 280, waarvan 3 uniek (RefID/Label 1120-1125).
- Web of Science: 421, waarvan 97 uniek (RefID/Label 1126-1232).
- COCHRANE Library: 41, waarvan 8 uniek (RefID/Label 1233-1276).
- *ontbrekende RefID/Labels betreffen met de hand verwijderde dubbele referenties.
- ** OVID geeft veel extra referenties omdat de frase-indexering anders is (met "open laparoscop*" krijgen we onbedoeld ook bijvoorbeeld "41 open, 63 laparoscopic" en "open, laparoscopic, or robotic" mee, items die in principe niet de vraag dekken).
PubMed - http://www.ncbi.nlm.nih.gov/pubmed?otool=leiden
(("Laparoscopy"(mesh:noexp) OR "Cholecystectomy, Laparoscopic"(mesh) OR "Hand-Assisted Laparoscopy"(mesh) OR "Minimally Invasive Surgical Procedures"(Mesh:noexp) OR laparoscop*(tw) OR "minimal invasive"(tw) OR "minimally invasive"(tw)) AND ("open entry"(tw) OR open laparoscop*(tw) OR "hasson"(tw) OR "hassen"(tw) OR "balloon trocar"(tw) OR "balloon trocars"(tw) OR "closed entry"(tw) OR closed laparoscop*(tw) OR "direct trocar insertion"(tw) OR "direct trocar"(tw) OR "direct trocars"(tw) OR "veress needle"(tw) OR "veress needles"(tw) OR "veress"(tw) OR "radially expanding"(tw) OR "radially expanding trocars"(tw) OR "step trocar"(tw) OR "step trocars"(tw) OR "direct entry"(tw) OR ("direct"(tw) AND ("entry"(tw) OR insert*(tw))) OR access technique*(tw) OR access technique*(tw) OR entry technique*(tw) OR entry technique*(tw) OR "blunt tip"(tw) OR "endotip"(tw) OR endotip*(tw) OR "optiview"(tw) OR optiview*(tw) OR "visiport"(tw) OR visiport*(tw) OR "needle scope"(tw) OR "troc-doc"(tw) OR "trocdoc"(tw) OR "optical trocar"(tw) OR "alternative entry"(tw) OR "visual access"(tw) OR visual access*(tw) OR "optical access"(tw) OR optical access*(tw) OR ((alternativ*(ti) OR visual*(ti)) AND ("entry"(ti) OR "access"(ti))) OR (("visual"(tw) OR "alternative"(tw)) AND entry system*(tw)) OR microlaparoscop*(tw) OR micro-laparoscop*(tw)) AND ("2010/01/01"(PDAT) : "3000/12/31"(PDAT)) NOT (("Child"(mesh) OR "Infant"(mesh) OR "Adolescent"(mesh) OR "Child"(ti) OR "children"(ti) OR "Infant"(ti) OR "Infants"(ti) OR Adolescen*(ti) OR pedatric*(ti) OR paediatric*(ti)) NOT ("Adult"(mesh) OR "adult"(tw) OR "adults"(tw))) AND english(la) NOT ("Animals"(mesh) NOT "Humans"(mesh)))
MEDLINE (OVID) - http://gateway.ovid.com/ovidweb.cgi?T=JS&MODE=ovid&NEWS=n&PAGE=main&D=prmz
(("Laparoscopy"/ OR exp "Cholecystectomy, Laparoscopic"/ OR exp "Hand-Assisted Laparoscopy"/ OR "Minimally Invasive Surgical Procedures"/ OR laparoscop*.ti,ab,kf OR "minimal invasive".ti,ab,kf OR "minimally invasive".ti,ab,kf) AND ("open entry".ti,ab,kf OR "open laparoscop*".ti,ab,kf OR "hasson".ti,ab,kf OR "hassen".ti,ab,kf OR "balloon trocar".ti,ab,kf OR "balloon trocars".ti,ab,kf OR "closed entry".ti,ab,kf OR "closed laparoscopy".ti,ab,kf OR "direct trocar insertion".ti,ab,kf OR "direct trocar".ti,ab,kf OR "direct trocars".ti,ab,kf OR "veress needle".ti,ab,kf OR "veress needles".ti,ab,kf OR "veress".ti,ab,kf OR "radially expanding".ti,ab,kf OR "radially expanding trocars".ti,ab,kf OR "step trocar".ti,ab,kf OR "step trocars".ti,ab,kf OR "direct entry".ti,ab,kf OR ("direct".ti,ab,kf ADJ4 ("entry".ti,ab,kf OR insert*.ti,ab,kf)) OR "access technique*".ti,ab,kf OR "access technique*".ti,ab,kf OR "entry technique*".ti,ab,kf OR "entry technique*".ti,ab,kf OR "blunt tip".ti,ab,kf OR "endotip".ti,ab,kf OR endotip*.ti,ab,kf OR "optiview".ti,ab,kf OR optiview*.ti,ab,kf OR "visiport".ti,ab,kf OR visiport*.ti,ab,kf OR "needle scope".ti,ab,kf OR "troc-doc".ti,ab,kf OR "trocdoc".ti,ab,kf OR "optical trocar".ti,ab,kf OR "alternative entry".ti,ab,kf OR "visual access".ti,ab,kf OR "visual access*".ti,ab,kf OR "optical access".ti,ab,kf OR "optical access*".ti,ab,kf OR ((alternativ*.ti OR visual*.ti) ADJ4 ("entry".ti OR "access".ti)) OR (("visual".ti,ab,kf OR "alternative".ti,ab,kf) ADJ4 "entry system*".ti,ab,kf) OR microlaparoscop*.ti,ab,kf OR micro-laparoscop*.ti,ab,kf) AND (2010.yr OR 2011.yr OR 2012.yr OR 2013.yr OR 2014.yr OR 2015.yr OR 2016.yr OR 2017.yr OR 2018.yr OR 2019.yr) NOT ((exp "Child"/ OR exp "Infant"/ OR exp "Adolescent"/ OR "Child".ti OR "children".ti OR "Infant".ti OR "Infants".ti OR Adolescen*.ti OR pedatric*.ti OR paediatric*.ti) NOT (exp "Adult"/ OR "adult".ti,ab,kf OR "adults".ti,ab,kf)) AND english.la NOT (exp "Animals"/ NOT exp "Humans"/))
Embase (OVID) - http://ovidsp.ovid.com/ovidweb.cgi?T=JS&PAGE=main&MODE=ovid&D=oemezd
((*"Laparoscopy"/ OR *"Laparoscopic Cholecystectomy"/ OR *"Hand Assisted Laparoscopy"/ OR *"Minimally Invasive Surgery"/ OR laparoscop*.ti,ab OR "minimal invasive".ti,ab OR "minimally invasive".ti,ab) AND ("open entry".ti,ab OR "open laparoscop*".ti,ab OR "hasson".ti,ab OR "hassen".ti,ab OR "balloon trocar".ti,ab OR "balloon trocars".ti,ab OR "closed entry".ti,ab OR "closed laparoscop*".ti,ab OR "direct trocar insertion".ti,ab OR "direct trocar".ti,ab OR "direct trocars".ti,ab OR "veress needle".ti,ab OR "veress needles".ti,ab OR "veress".ti,ab OR "radially expanding".ti,ab OR "radially expanding trocars".ti,ab OR "step trocar".ti,ab OR "step trocars".ti,ab OR "direct entry".ti,ab OR ("direct".ti,ab ADJ4 ("entry".ti,ab OR insert*.ti,ab)) OR "access technique*".ti,ab OR "access technique*".ti,ab OR "entry technique*".ti,ab OR "entry technique*".ti,ab OR "blunt tip".ti,ab OR "endotip".ti,ab OR endotip*.ti,ab OR "optiview".ti,ab OR optiview*.ti,ab OR "visiport".ti,ab OR visiport*.ti,ab OR "needle scope".ti,ab OR "troc-doc".ti,ab OR "trocdoc".ti,ab OR "optical trocar".ti,ab OR "alternative entry".ti,ab OR "visual access".ti,ab OR "visual access*".ti,ab OR "optical access".ti,ab OR "optical access*".ti,ab OR ((alternativ*.ti OR visual*.ti) ADJ4 ("entry".ti OR "access".ti)) OR (("visual".ti,ab OR "alternative".ti,ab) ADJ4 "entry system*".ti,ab) OR microlaparoscop*.ti,ab OR "micro-laparoscop*".ti,ab) AND (2010.yr OR 2011.yr OR 2012.yr OR 2013.yr OR 2014.yr OR 2015.yr OR 2016.yr OR 2017.yr OR 2018.yr OR 2019.yr) NOT ((exp "Child"/ OR exp "Infant"/ OR exp "Adolescent"/ OR "Child".ti OR "children".ti OR "Infant".ti OR "Infants".ti OR Adolescen*.ti OR pedatric*.ti OR paediatric*.ti) NOT (exp "Adult"/ OR "adult".ti,ab OR "adults".ti,ab)) AND english.la NOT (exp "Animals"/ NOT exp "Humans"/) NOT (conference review or conference abstract).pt)
Emcare - http://ovidsp.ovid.com/ovidweb.cgi?T=JS&NEWS=n&CSC=Y&PAGE=main&D=emcr
((*"Laparoscopy"/ OR *"Laparoscopic Cholecystectomy"/ OR *"Hand Assisted Laparoscopy"/ OR *"Minimally Invasive Surgery"/ OR laparoscop*.ti,ab OR "minimal invasive".ti,ab OR "minimally invasive".ti,ab) AND ("open entry".ti,ab OR "open laparoscop*".ti,ab OR "hasson".ti,ab OR "hassen".ti,ab OR "balloon trocar".ti,ab OR "balloon trocars".ti,ab OR "closed entry".ti,ab OR closed laparoscop*.ti,ab OR "direct trocar insertion".ti,ab OR "direct trocar".ti,ab OR "direct trocars".ti,ab OR "veress needle".ti,ab OR "veress needles".ti,ab OR "veress".ti,ab OR "radially expanding".ti,ab OR "radially expanding trocars".ti,ab OR "step trocar".ti,ab OR "step trocars".ti,ab OR "direct entry".ti,ab OR ("direct".ti,ab ADJ4 ("entry".ti,ab OR insert*.ti,ab)) OR "access technique*".ti,ab OR "access technique*".ti,ab OR "entry technique*".ti,ab OR "entry technique*".ti,ab OR "blunt tip".ti,ab OR "endotip".ti,ab OR endotip*.ti,ab OR "optiview".ti,ab OR optiview*.ti,ab OR "visiport".ti,ab OR visiport*.ti,ab OR "needle scope".ti,ab OR "troc-doc".ti,ab OR "trocdoc".ti,ab OR "optical trocar".ti,ab OR "alternative entry".ti,ab OR "visual access".ti,ab OR "visual access*".ti,ab OR "optical access".ti,ab OR "optical access*".ti,ab OR ((alternativ*.ti OR visual*.ti) ADJ4 ("entry".ti OR "access".ti)) OR (("visual".ti,ab OR "alternative".ti,ab) ADJ4 "entry system*".ti,ab) OR microlaparoscop*.ti,ab OR "micro-laparoscop*".ti,ab) AND (2010.yr OR 2011.yr OR 2012.yr OR 2013.yr OR 2014.yr OR 2015.yr OR 2016.yr OR 2017.yr OR 2018.yr OR 2019.yr) NOT ((exp "Child"/ OR exp "Infant"/ OR exp "Adolescent"/ OR "Child".ti OR "children".ti OR "Infant".ti OR "Infants".ti OR Adolescen*.ti OR pedatric*.ti OR paediatric*.ti) NOT (exp "Adult"/ OR "adult".ti,ab OR "adults".ti,ab)) AND english.la NOT (exp "Animals"/ NOT exp "Humans"/) NOT (conference review or conference abstract).pt)
Web of Science - http://isiknowledge.com/wos
(ti=("Laparoscopy" OR "Laparoscopic Cholecystectomy" OR "Hand Assisted Laparoscopy" OR "Minimally Invasive Surgery" OR laparoscop* OR "minimal invasive" OR "minimally invasive") AND ts=("open entry" OR "open laparoscop*" OR "hasson" OR "hassen" OR "balloon trocar" OR "balloon trocars" OR "closed entry" OR "closed laparoscop*" OR "direct trocar insertion" OR "direct trocar" OR "direct trocars" OR "veress needle" OR "veress needles" OR "veress" OR "radially expanding" OR "radially expanding trocars" OR "step trocar" OR "step trocars" OR "direct entry" OR ("direct" NEAR/4 ("entry" OR insert*)) OR "access technique" OR "access technique" OR "entry technique" OR "entry technique" OR "blunt tip" OR "endotip" OR endotip* OR "optiview" OR optiview* OR "visiport" OR visiport* OR "needle scope" OR "troc-doc" OR "trocdoc" OR "optical trocar" OR "alternative entry" OR "visual access" OR "visual access" OR "optical access" OR "optical access" OR ((alternativ* OR visual*) NEAR/4 ("entry" OR "access")) OR (("visual" OR "alternative") NEAR/4 "entry system*") OR microlaparoscop* OR "micro-laparoscop") AND py=(2010 OR 2011 OR 2012 OR 2013 OR 2014 OR 2015 OR 2016 OR 2017 OR 2018 OR 2019) NOT ti=(("child"OR "children" OR "Infant" OR "Infants" OR Adolescen* OR pedatric* OR paediatric*) NOT ("adult" OR "adults")) AND la=english NOT ti=("veterinary" OR "rabbit" OR "rabbits" OR "animal" OR "animals" OR "mouse" OR "mice" OR "rodent" OR "rodents" OR "rat" OR "rats" OR "pig" OR "pigs" OR "porcine" OR "horse" OR "horses" OR "equine" OR "cow" OR "cows" OR "bovine" OR "goat" OR "goats" OR "sheep" OR "ovine" OR "canine" OR "dog" OR "dogs" OR "feline" OR "cat" OR "cats"))
NOT conference abstract
Cochrane - http://www.cochranelibrary.com/
(("Laparoscopy" OR "Laparoscopic Cholecystectomy" OR "Hand Assisted Laparoscopy" OR "Minimally Invasive Surgery" OR laparoscop* OR "minimal invasive" OR "minimally invasive") AND ("open entry" OR "open laparoscop*" OR "hasson" OR "hassen" OR "balloon trocar" OR "balloon trocars" OR "closed entry" OR "closed laparoscop*" OR "direct trocar insertion" OR "direct trocar" OR "direct trocars" OR "veress needle" OR "veress needles" OR "veress" OR "radially expanding" OR "radially expanding trocars" OR "step trocar" OR "step trocars" OR "direct entry" OR ("direct" NEAR/4 ("entry" OR insert*)) OR "access technique" OR "access technique" OR "entry technique" OR "entry technique" OR "blunt tip" OR "endotip" OR endotip* OR "optiview" OR optiview* OR "visiport" OR visiport* OR "needle scope" OR "troc-doc" OR "trocdoc" OR "optical trocar" OR "alternative entry" OR "visual access" OR "visual access" OR "optical access" OR "optical access" OR ((alternativ* OR visual*) NEAR/4 ("entry" OR "access")) OR (("visual" OR "alternative") NEAR/4 "entry system*") OR microlaparoscop* OR "micro-laparoscop")):ti,ab,kw NOT (("child"OR "children" OR "Infant" OR "Infants" OR Adolescen* OR pedatric* OR paediatric*) NOT ("adult" OR "adults")):ti
py=(2010 OR 2011 OR 2012 OR 2013 OR 2014 OR 2015 OR 2016 OR 2017 OR 2018 OR 2019)
AND la=english
NOT conference abstract
