Biomarkers bij MCI
Uitgangsvraag
Wat is de waarde van de toepassing van biomarkers (MRI, PET en CSF) bij het voorspellen van progressie van MCI naar dementie?
Aanbeveling
Verricht niet standaard biomarker-onderzoek (MRI, CSF of PET) bij MCI-patiënten met het doel om te voorspellen welke patiënten progressie naar dementie zullen vertonen, gezien de beperkte voorspellende waarde van de op zichzelf staande testen, het gebrek aan kosteneffectiviteitsanalyses en het ontbreken van invloed op therapeutisch management.
Overwegingen
Uit de diverse meta-analyses en reviews lijkt het bepalen van biomarkers een wisselende diagnostische waarde te hebben in het voorspellen van de progressie van MCI naar Alzheimer dementie. Een kanttekening is dat de methodologische kwaliteit van de geïncludeerde studies vaak onvoldoende is, de studies uitgevoerd zijn bij een beperkt aantal MCI-patiënten, afkappunten vaak pas achteraf zijn bepaald en de follow-up van de studies vaak te kort is. Ook is er grote heterogeniteit tussen de studies, wat de pooling van de data belemmert.
Er zijn geen studies geïncludeerd naar visuele beoordeling van hippocampusatrofie (medial temporal atrophy, MTA), aangezien studies naar deze biomarker overwegend voor de zoekdatum van de literatuursearch gepubliceerd zijn, er geen recente systematische reviews verricht zijn naar MTA en de term MTA ook niet apart opgenomen was in de zoekstrategie. Een recent gepubliceerde niet-systematische review suggereert dat de MTA-score als op zichzelf staande test onvoldoende predictieve waarde heeft om progressie naar Alzheimer dementie te voorspellen in MCI patiënten (Ten Kate, 2017). Echter, vanuit praktisch oogpunt en beschikbaarheid is de MTA score te verkiezen boven volumetrische maten. Om toch een handvat te bieden is de studie van Ferreira (2015) van belang. Deze studie had tot doel de diagnostische en predictieve waarde van MTA te onderzoeken en de beste cut-off score te berekenen voor elke leeftijdscategorie. In de populatie zaten 480 MCI-patiënten waarvan 385 stabiel waren na 1 jaar en 95 progressie vertoonden naar dementie. Een gemiddelde MTA score van 1.5 of hoger had een LR+ van 1,4 en een LR- van 0,54. Een gemiddelde MTA score van 2 of hoger had een LR+ van 1 en LR – van 0,88. Al met al lijkt dus ook MTA als geïsoleerde test niet goed in staat om progressie te voorspellen.
De werkgroep is zich ervan bewust dat er inmiddels veel richtlijnen in het internationale veld verschenen zijn die het gebruik van biomarkers propageren; dit betreft echter gebruik in een wetenschappelijke setting (Albert, 2011; Dubois 2010 en 2014, Jack 2018). Voor de toekomst zal blijken of dit implementatie vindt in een klinische setting.
Aanbevolen wordt om bij herziening van de richtlijn de visuele beoordeling van MTA op te nemen in de zoekstrategie, en dan vooral ook de predictieve waarde van de combinatie van deze maat met andere biomarkers te onderzoeken.
Veiligheid
CSF betreft een matig invasief onderzoek, PET gaat gepaard met zeer beperkte straling. In beide gevallen zijn de risico’s klein. De balans tussen voor- en nadelen zou in kosteneffectiveitsstudies verder onderzocht moeten worden.
Beschikbaarheid
De genoemde technieken zijn niet in alle centra voorhanden; dit geldt vooral voor amyloid PIB-PET dat in Nederland alleen in het VUmc en UMCG beschikbaar is. Inmiddels zijn er nieuwe 18F tracers voor amyloid PET onderzoek beschikbaar, welke de beschikbaarheid in centra aanmerkelijk vergroten, maar hier zijn nog geen studies of meta-analyses naar gedaan.
Aanbevelingen op dit vlak zouden dus in de meerderheid van de Nederlandse centra opgevolgd kunnen worden en voor een verschuiving in het zorgaanbod kunnen zorgen. Dit geldt ook voor CSF analyse. Elke neuroloog doet een lumbale punctie en het materiaal kan eenvoudig verscheept worden naar een lab dat de analyse doet; er zijn twee labs in Nederland (Radboudumc en VUmc) gespecialiseerd in deze analyses.
Een andere overweging is dat standard operating procedures voor zowel CSF analyse (cut-off values voor positiviteit) als voor de bepaling van structurele MRI maten (software die gebruikt wordt, referentiewaarden, cut-off values) niet beschikbaar zijn, en er dus waarschijnlijk grote variabiliteit is tussen centra in wat als normaal of abnormaal beschouwd wordt. Ook zullen lang niet alle centra beschikking hebben over analysemogelijkheden voor volumetrische MRI.
Toegevoegde waarde en kosteneffectiviteit
Vrijwel geen van de geïncludeerde studies heeft de prognostische waarde van de gemeten biomarker afgezet tegen de classificatie op basis van eenvoudiger te bepalen markers, zoals leeftijd of neuropsychologisch onderzoek. Biomarkers zijn daarnaast ook nauwelijks met elkaar vergeleken in multivariate studies. Over het gebruik van combinaties van biomarkers is weinig bekend, hoewel dit veelbelovend lijkt. Uit studies blijkt het combineren van verschillende methodes de sensitiviteit en specificiteit voor het voorspellen van progressie naar Alzheimer dementie te verhogen (Korolev, 2016; Moradi, 2015; Willette, 2014; Prestia 2013; Prestia, 2015). Er is echter geen systematische search verricht naar de combinatie van methoden. Daarnaast rijst de vraag hoe omgegaan moet worden met conflicterende informatie van biomarkers (bijvoorbeeld als biomarker resultaten elkaar tegenspreken). Aanbevolen wordt om dit onderdeel verder uit te zoeken bij herziening van deze richtlijn.
Daadwerkelijke predictiestudies op individueel niveau ontbreken vrijwel. Vrijwel alle studies betreffen retrospectieve analyses van stabiele versus converterende MCI-patiënten. Studies definiëren over het algemeen niet eerst een specifieke cutoff waarde die vervolgens in een predictiemodel getest wordt. Dit belemmert de toepassing in andere settings.
Voor zover bekend zijn er geen kosteneffectiviteitsstudies gedaan naar biomarkers (MRI, CSF, PET) voor het voorspellen van de progressie van MCI naar dementie. De kosten van biomarkers zijn erg verschillend, variërend van €200 tot €300 voor CSF onderzoek of MRI tot €1500 tot €2000 voor amyloid PET. Gezien de beperkte invloed van het toepassen van biomarkers op klinisch handelen, zal een kosteneffectiviteit studie waarschijnlijk negatief uitvallen voor alle drie de onderzoeken. Mogelijk zou dit in de toekomst kunnen veranderen wanneer betere behandelopties en preventieve maatregelen beschikbaar komen.
Follow-up duur
De geïncludeerde studies variëren sterk in follow-up duur, en de onderzochte biomarkers hebben waarschijnlijk wisselende predictieve waarde op kortere of langere termijn. De beschikbare evidence is echter te beperkt om hier een onderscheid in te maken. Een follow-up duur van minimaal 2 jaar wordt nodig geacht om iets te kunnen zeggen over predictieve waarde van biomarkers; veel gepubliceerde studies kennen een kortere follow-up duur.
Leeftijd
Bij een hogere leeftijd wordt de specificiteit kleiner, omdat leeftijdgerelateerde veranderingen in de hersenen en in de CSF toenemen met veroudering, hetgeen het contrast tussen ‘normaal’ en Alzheimer dementie verkleint (Mattsson, 2012). Daarom verdient het aanbeveling extra terughoudend te zijn met het uitvoeren van biomarker-onderzoek op hoge leeftijd.
Onderbouwing
Achtergrond
Het gebruik van biomarkers in de diagnostiek van MCI is groeiende en de wetenschappelijke literatuur op dit vlak kent een explosieve toename. Hierbij zijn met name cerebrospinal fluid (CSF) biomarkers (amyloid beta42 en tau eiwitten), kwantitatieve magnetic resonance imaging (MRI) markers (onder andere volumetrie van grijze en witte stof en van specifieke hersenstructuren) en nucleaire technieken zoals positron emission tomography (PET) amyloid, tau en glucose imaging veelbelovend. De huidige richtlijn kent op dit vlak dus een evident tijdelijk karakter en juist op dit onderwerp zijn toekomstige revisies te verwachten. Beeldvorming met computed tomography (CT) wordt in deze richtlijn buiten beschouwing gelaten omdat in de wetenschappelijke literatuur van de afgelopen 5 jaar structurele beeldvorming met MRI de standaard is.
Biomarkers kunnen potentieel een belangrijke rol spelen in MCI bij het voorspellen van de ziekteprogressie (prognose), en dan met name het risico op progressie van MCI naar dementie op basis van de ziekte van Alzheimer.
Conclusies / Summary of Findings
|
Laag GRADE |
Volumetrische structurele MRI-maten, waaronder kwantitatieve bepaling van hippocampusatrofie, zijn als op zichzelf staande test onvoldoende betrouwbaar om de progressie naar Alzheimer dementie te voorspellen bij MCI-patiënten (op basis van LR- en LR+ miniem tot klein effect op posttest probability). Studies rapporteren echter sterk wisselende structurele maten en ook diverse combinaties van structurele maten, waardoor translatie naar de praktijk bemoeilijkt wordt.
Bronnen (Yuan, 2009; Korolev, 2016; Moradi, 2015; Wilette, 2014; Yu, 2012; Spulber, 2013) |
|
GRADE |
CSF biomarkers (amyloid beta42, totaal tau of gefosforyleerd tau eiwit) zijn als op zichzelf staande test niet voldoende betrouwbaar voor de identificatie van MCI-patiënten met hoog risico op progressie naar Alzheimer dementie.
Bronnen (Ritchie, 2014) |
|
Laag GRADE |
De combinatie van CSF t-tau/ amyloid beta42 eiwit kan mogelijk een rol spelen bij het identificeren van progressie van MCI naar Alzheimer dementie (op basis van LR+ matig tot groot effect op posttest probability). Het aantal studies hiernaar is echter nog zeer beperkt.
Bronnen (Ritchie, 2017) |
|
Laag GRADE |
FDG-PET analyse middels de visueel geïnterpreteerde FDG-PET is als op zichzelf staande test onvoldoende betrouwbaar om de progressie naar Alzheimer dementie te voorpellen bij MCI-patiënten (op basis van de LR- een matig tot klein effect en LR+ een klein effect op posttest probability). Er is grote heterogeniteit tussen studies naar FDG-PET, waarbij de diagnostische waarde erg varieert.
Bronnen (Zhang, 2012; Yuan, 2009; Smailagic, 2015) |
|
Laag GRADE |
Gezien de lage LR- (matig tot groot effect op posttest probability) kan PIB-PET mogelijk een rol spelen bij het uitsluiten van progressie van MCI naar Alzheimer dementie.
Bronnen (Ma, 2015) |
Samenvatting literatuur
Er werden twee systematische reviews geïncludeerd die de waarde van (structurele) MRI onderzocht voor het voorspellen van progressie naar Alzheimer dementie bij MCI-patiënten (Ferreira, 2011; Yuan, 2009). Daarnaast werden er nog zes studies naar MRI geïncludeerd die na de zoekdatum van Ferreira (september 2009) werden gepubliceerd (Xu, 2016; Korolev, 2016; Moradi, 2015; Willette, 2014; Spulber, 2013; Yu, 2012).
Er werd één systematische review geïncludeerd in de literatuuranalyse die de waarde van CSF onderzocht in het voorspellen van de progressie van MCI naar Alzheimer dementie (Ritchie, 2014). Na de zoekdatum van de literatuursearch werd een nieuwe systematische review van Ritchie gepubliceerd naar de voorspellende waarde van CSF t-tau, p-tau en p-tau/amyloid beta ratio (Ritchie, 2017). In deze systematische review werd gebruik gemaakt van de search van de review van Ritchie uit 2014, aangevuld met een ‘top-up’ search. Besloten werd om deze review te gebruiken voor de literatuuranalyse.
Vier systematische reviews onderzochten de waarde van Positron Emission Tomography (PET) in het voorspellen van de progressie van MCI naar Alzheimer dementie, waarvan één review naar C-Pittsburgh compound B (C-PIB-PET) (Ma, 2015), twee reviews naar fluoro-2-deoxyglycose (FDG-PET) (Smailagic, 2015; Yuan, 2009) en één review naar beiden (Zhang, 2012).
Beschrijving studies
1) MRI
Ferreira et al. (2011) voerden een systematische review uit met meta-analyse van voxel-based morphometry (VBM) studies over structurele imaging markers (grijze stof atrofie) als voorspeller van progressie naar Alzheimer dementie. De meta-analyse werd uitgevoerd op zes studies met in totaal 429 amnestische MCI-patiënten. De meta-analyse was gebaseerd op de activation likelihood estimation (ALE) methode, dat gebruikt wordt voor op coördinaten gebaseerde meta-analyses om anatomische convergentie te onderscheiden in de resultaten van verschillende studies. De gemiddelde follow-up duur varieerde tussen 12 en 36 maanden. De methodologische kwaliteit van de geïncludeerde studies werd niet beoordeeld.
Yuan (2009) publiceerden een meta-analyse naar de waarde van structurele MRI, FDG-PET en single-photon emission tomography (SPECT) in het voorspellen van progressie naar de ziekte van Alzheimer bij patiënten met MCI. In totaal werden 24 studies geïncludeerd, waarvan tien naar structurele MRI biomarkers (medial temporal lobe (n=5), hippocampus (n=3), entorhinal cortex (n=2), neocortical association areas (n=1), superior temporal sulcus (n=1) en anterior cingulate (n=1), met in totaal 479 MCI-patiënten in de MRI analyse. De gemiddelde follow-up duur varieerde voor de MRI studies tussen de 15 en 60 maanden. De afkapwaarden voor de index-testen en de uitkomstmaat werden niet beschreven. Er werden alleen gepoolde resultaten weergegeven. De methodologische kwaliteit van de geïncludeerde studies werd niet beoordeeld.
Alle geïncludeerde studies van na de zoekdatum van Ferreira, maakten gebruik van data uit de Alzheimer’s Disease Neuroimaging Initiative (ADNI) database. Het hoofddoel van de ADNI studie was om te testen in hoeverre MRI, PET en andere biomarkers, cognitieve en neuropsychologische testen gecombineerd kunnen worden om de progressie van MCI naar Alzheimer dementie te voorspellen. De studie van Spulber (2013) maakte gebruik van de ADNI database, aangevuld met data van de AddNeuroMed. Het AddNeuroMed project is onderdeel van het InnoMed European Union FP6 programma, opgezet om surrogaatmarkers te ontwikkelen en valideren voor Alzheimer dementie.
In deze studies werd steeds een combinatiemaat voor volumetrische MRI geanalyseerd (waarbij bijvoorbeeld hippocampus, amygdala, midden temporale en inferieure temporale regio’s, insula, en parahippocampale regio’s werden meegenomen), waardoor de verschillende MRI maten er niet uit te destilleren zijn. De studie van Xu (2016) analyseerde MRI en PET data (FDG-PET en florbetapir PET), de studie van Yu (2012) MRI, PET (FDG-PET) en CSF data. De studie van Spulber (2013) analyseerde alleen MRI data. In de studies van Korolev (2016), Moradi (2015) en Willette (2014) werden zowel volumetrische MRI maten afzonderlijk als ook gecombineerd met cognitieve of functionele markers geanalyseerd. In totaal werden 400 MCI patiënten in de ADNI studie gerekruteerd, die voor 2 tot 3 jaar werden gevolgd met elke zes tot 12 maanden een meting. Het aantal MCI-patiënten dat geïncludeerd werd in de analyses van de verschillende studies varieerde tussen 63 (Yu, 2012) en 264 (Moradi, 2015), en was 434 voor het ADNI en AddNeuroMed cohort samen in de studie van Spulber.
2) CSF
Ritchie (2014) voerden een systematische review uit naar de waarde van amyloid beta42 eiwit om MCI-patiënten te identificeren met hoog risico op ontwikkelen van Alzheimer dementie of andere vormen van dementie. Er werden 14 studies geïncludeerd waarin de toepassing van amyloid beta42 eiwit werd geëvalueerd, met in totaal 1349 MCI-patiënten (variërend tussen 37 en 625 patiënten). De gemiddelde follow-up duur varieerde tussen de zes maanden en zes jaar. De index test was CSF amyloid beta42 eiwit op baseline (positief/negatief), waarbij de studies verschillende afkappunten toepasten. De methodologische kwaliteit van de geïncludeerde studies was laag, veel studies hadden een hoog risico op bias voor de index test en flow en timing en een onduidelijk risico op bias voor de referentiestandaard. De afkappunten en follow-up duur liepen erg uiteen.
In 2017 werd een nieuwe systematische review van Ritchie gepubliceerd, waarin de resultaten van de search van de review uit 2014 werden gebruik, aangevuld met een ‘top-up’ search (in december 2015). De voorspellende waarde van CSF t- of p-tau en t- of p-tau/ amyloid beta42 ratio op progressie naar Alzheimer dementie in MCI-patiënten werd onderzocht. Er werden 15 studies geïncludeerd waarin de nauwkeurigheid van CSF werd geëvalueerd: in zeven studies totaal tau (t-tau), zes studies gefosforyleerd tau (p-tau) en zes studies p-tau/amyloid beta42 ratio. In totaal werden 1282 patiënten in de 15 studies geïncludeerd (variërend tussen 37 en 626 patiënten). De follow-up varieerde tussen minder dan een jaar tot meer dan vier jaar, maar lag meestal tussen de één en drie jaar. De index test was p- of t-tau en p- of t-tau/amyloid beta42 ratio op baseline (positief/negatief), waarbij de studies verschillende afkappunten toepasten. De methodologische kwaliteit van de geïncludeerde studies was laag, een significant aantal studies had een onduidelijk risico op bias voor de referentiestandaard, participanten selectie en flow en timing domeinen. Voor het vaststellen van het index domein waren 8 van de 15 studies van slechte kwaliteit.
3) PET
Ma (2015) voerden een systematische review uit naar de prognostische waarde van amyloid PET imaging met PIB-PET om de progressie naar Alzheimer dementie te voorspellen bij MCI-patiënten. Daarbij keken ze naar het effect van verschillende lengte van follow-up (korte en lange termijn) op de prognostische waarde. Er werden 11 studies in de systematische review geïncludeerd (2009 tot 2014), met in totaal 352 MCI-patiënten (per studie variërend tussen de 10 en 68 patiënten). De gemiddelde follow-up duur varieerde tussen de 19 en 62 maanden. De index test was PIB-PET op baseline, ingedeeld in positief of negatief (afkappunten verschillen tussen studies). De methodologische kwaliteit van de geïncludeerde studies liep uiteen. Veel studies hadden een onduidelijk (unclear) risico op bias voor patiëntenselectie en referentiestandaard.
Smailagic (2015) voerden een meta-analyse uit naar de diagnostische waarde van FDG-PET in het voorspellen van Alzheimer dementie in MCI-patiënten. In totaal werden 14 studies opgenomen in een meta-analyse, met in totaal 466 MCI-patiënten. De gemiddelde follow-up duur varieerde tussen de 12 en 37 maanden. De meeste geïncludeerde rapporteerden geen afkappunt voor FDG-PET of specificeerde deze niet voorafgaand aan de dataverzameling. Er was grote variatie in methodologische kwaliteit tussen de studies (risk of bias door selectie van patiënten, index test).
Zhang (2012) voerden een meta-analyse uit naar de waarde van PET imaging in het voorspellen van Alzheimer dementie in MCI patiënten. Ze includeerden studies die keken naar de prognostische waarde van FDG-PET en PIB-PET. Alleen de resultaten van FDG-PET werden opgenomen in de huidige beoordeling, omdat de studies geïncludeerd voor PIB-PET exact dezelfde waren als in de latere (bovengenoemde) review van Ma (2015). In totaal werden zeven studies geïncludeerd naar FDG-PET, met in totaal 270 MCI-patiënten. De gemiddelde follow-up duur varieerde tussen de 12 en 37 maanden. De afkapwaarden voor de index-test en de uitkomstmaat werden niet voor de geïncludeerde studies afzonderlijk beschreven. Er was grote variatie in methodologische kwaliteit tussen de studies (replication bias, assessment bias).
In de bij MRI beschreven meta-analyse van Yuan (2009), werden zes studies geïncludeerd naar FDG-PET, met in totaal 280 MCI-patiënten. De gemiddelde follow-up duur van de FDG-PET studies varieerde tussen de 12 en 37 maanden. De afkapwaarden voor de index-testen en de uitkomstmaat werden niet beschreven. Er werden alleen gepoolde resultaten weergegeven. De methodologische kwaliteit van de geïncludeerde studies werd niet beoordeeld.
Resultaten
Progressie van MCI naar Alzheimer dementie
1) MRI (structurele MRI)
In de meta-analyse van Ferreira (2011) werd één significant cluster van voxels geïdentificeerd waarvoor het volume lager was onder MCI-patiënten die Alzheimer dementie ontwikkelden vergeleken met de patiënten die stabiel bleven. Dit cluster lag in de anterieure hippocampus en parahippocampale gyrus aan de linkerzijde. Geconcludeerd werd dat atrofie in de linker mediale temporale kwab de meest consistente neurostructurele biomarker is om progressie naar Alzheimer dementie te voorspellen. Er werden geen kwantitatieve data gerapporteerd.
In de systematische review van Yuan (2009) was de gepoolde specificiteit en sensitiviteit van structurele MRI (medial temporal lobe, hippocampus, entorhinal cortex, neocortical association areas, superior temporal sulcus en anterior cingulate) voor het correct identificeren van patiënten die van MCI naar dementie converteerden respectievelijk 81,0% (95% BI 76,3 tot 85,1) en 72,8% (95% BI 65,1 tot 79,6). De LR- was 0,37 (95% BI 0,29 tot 0,48) en de LR+ was 3,47 (95% BI 2,62 tot 4,60). De heterogeniteit (I2) was <0,1% voor sensitiviteit en 39,8% voor specificiteit.
In de studies gebaseerd op de ADNI-database was de specificiteit voor structurele MRI (1.5T) voor het correct classificeren van MCI-patiënten die geen Alzheimer zullen ontwikkelen 69,6% (Korolev, 2016), 62,6% (Xu, 2016), 51,6% (Moradi, 2015), 79.3% (Willette, 2014) en 79% (Yu, 2012). De sensitiviteit was in deze studies 68.5% (Korolev, 2016), 65,9% (Xu, 2016), 88,9% (Moradi, 2015), 68,8% (Wilette, 2014) en 76% (Yu, 2012). Dit staat gelijk aan een LR- van 0,45 (Korolev, 2016), 0,54 (Xu, 2016), 0,22 (Moradi, 2015), 0,39 (Willette, 2014) en 0,30 (Yu, 2012) en een LR+ van 2,76 (Korolev, 2016), 1,76 (Xu, 2016), 1,84 (Moradi, 2015),3,32 (Willette, 2014) en 3,62 (Yu, 2012).
Het verschil in sensitiviteit en specificiteit kan mogelijk verklaard worden door de verschillende follow-up duur gebruikt in de studies. Bij een langere follow-up duur wordt de sensitiviteit hoger, maar de specificiteit lager. In de studie over het combinatie cohort van ADNI en AddNeuroMed (Spulber, 2013) was de specificiteit 79% (95% BI 61,1 tot 72,0) en de sensitiviteit 69.9% (95% BI 61,8 tot 76,4). Dit staat gelijk aan een LR- van 0,38 en een LR+ van 3,33.
Geconcludeerd kan worden dat volumetrische structurele MRI maten als enkele test geen betrouwbare test is om MCI-patiënten te identificeren die mogelijk Alzheimer dementie gaan ontwikkelen.
2) CSF
a. Amyloïd Beta42 eiwit
Vanwege de variatie in afkappunten voor CSF amyloid beta42 in de geïncludeerde studies in de systematische review van Ritchie (2014) werd geen gepoolde sensitiviteit en specificiteit gegeven (Figuur 1). In plaats daarvan werden schattingen gegeven van de sensitiviteit op gefixeerde waarden van de specificiteit van het model dat gefit werd om de gepoolde ROC-curve te maken. Op de mediane specificiteit van 64%, was de geschatte sensitiviteit voor het correct identificeren van patiënten die van MCI naar Alzheimer dementie converteren 81% (95% BI 72 tot 87). Dit staat gelijk aan een LR- van 0,31 (95% BI 0,21 tot 0,48) en een LR+ van 2,22 (95% BI 2,00 tot 2,47). Geconcludeerd werd dat het meten van het amyloid beta42 eiwit in cerebrospinale vloeistof als enkele test, geen betrouwbare test is om MCI-patiënten te identificeren die mogelijk Alzheimer dementie gaan ontwikkelen.
Figuur 1
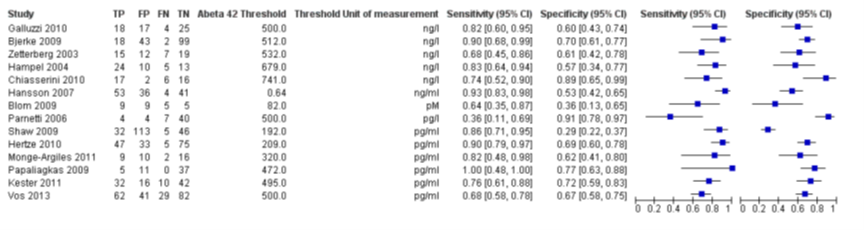
Forest plot van studieresultaten CSF amyloid beta42 voor voorspellen Alzheimer dementie (Ritchie, 2014)
b. Totaal tau (t-tau)
In de systematische review van Ritchie (2017) werden zeven studies geïncludeerd die de voorspellende waarde van t-tau op progressie naar Alzheimer dementie onderzochten (Figuur 2). De sensitiviteit van t-tau afzonderlijk varieerde tussen 51% en 90% en de specificiteit tussen 48% en 88%. Vanwege de variatie in afkappunten voor CSF t-tau in de geïncludeerde studies werd geen gepoolde sensitiviteit en specificiteit gegeven. In plaats daarvan werden schattingen gegeven van de sensitiviteit op gefixeerde waarden van de specificiteit van het model dat gefit werd om de gepoolde ROC-curve te maken. Op de mediane specificiteit van 72%, was de geschatte sensitiviteit voor het correct identificeren van patiënten die van MCI naar dementie converteren 77% (95% BI 67 tot 85). Dit staat gelijk aan een LR+ van 2,72 (95% BI 2,43 tot 3,04) en een LR- van 0,32 (95% BI 0,22 tot 0,47). Op basis van deze resultaten kan geconcludeerd worden dat het meten van het t-tau eiwit in cerebrospinale vloeistof als enkele test, geen betrouwbare test is om MCI-patiënten te identificeren die mogelijk Alzheimer dementie gaan ontwikkelen.
Figuur 2
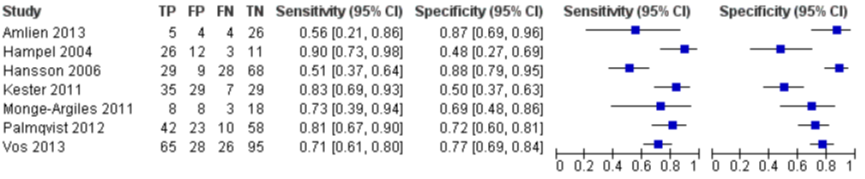
Forest plot van studieresultaten t-tau voor voorspellen Alzheimer dementie (Ritchie, 2014)
c. Gefosforyleerd tau (p-tau)
In de systematische review van Ritchie (2017) werden zes studies geïncludeerd die de voorspellende waarde van p-tau op progressie naar Alzheimer dementie onderzochten (Figuur 3). De specificiteit van p-tau afzonderlijk varieerde tussen 22% en 86% en de sensitiviteit tussen 40% en 100%. Vanwege de variatie in afkappunten voor CSF p-tau in de geïncludeerde studies werd geen gepoolde sensitiviteit en specificiteit gegeven. In plaats daarvan werden schattingen gegeven van de sensitiviteit op gefixeerde waarden van de specificiteit van het model dat gefit werd om de gepoolde ROC-curve te maken. Op de mediane specificiteit van 48%, was de geschatte sensitiviteit voor het correct identificeren van patiënten die van MCI naar dementie converteren 81% (95% BI 64 tot 91). Dit staat gelijk aan een LR+ van 1,55 (95% BI 1,31 tot 1,84) en een LR- van 0,39 (95% BI 0,19 tot 0,82). Op basis van deze resultaten kan geconcludeerd worden dat het meten van het p-tau eiwit in cerebrospinale vloeistof als enkele test, geen betrouwbare test is om MCI-patiënten te identificeren die mogelijk Alzheimer dementie gaan ontwikkelen.
Figuur 3
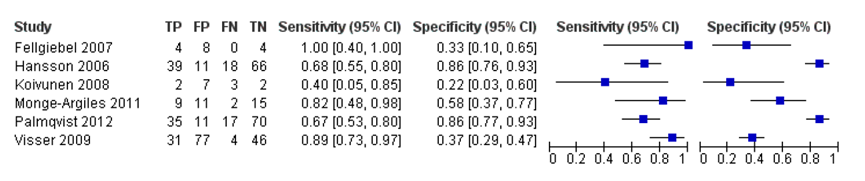
Forest plot van studieresultaten p-tau voor voorspellen Alzheimer dementie (Ritchie, 2014)
d. Combinaties van CSF biomarkers
In de systematische review van Ritchie (2017) werden vijf studies geïncludeerd die de voorspellende waarde van de p-tau/amyloid beta42 ratio op progressie naar Alzheimer dementie onderzochten. De specificiteit van p-tau/amyloid beta42 ratio in de studies afzonderlijk varieerde tussen 33% en 95% en de sensitiviteit tussen 80% en 90%. Er werd geen meta-analyse uitgevoerd, omdat er te weinig studies waren en de studies te klein.
Figuur 4
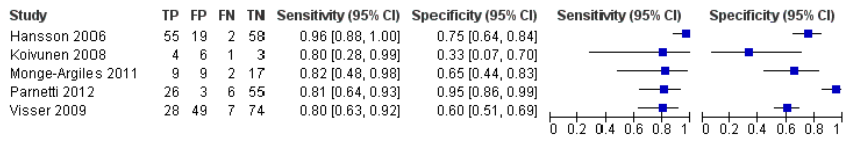
Forest plot van studieresultaten p-tau/amyloid beta voor voorspellen Alzheimer dementie (Ritchie, 2014)
Er waren maar twee studies die de voorspellende waarde van t-tau/amyloid beta42 ratio onderzochten op progressie naar Alzheimer dementie, met een specificiteit van 91% en 96% en een sensitiviteit van 50% en 51% (LR+ 5,65/ 12,75 en LR- 0,55/ 0,51) (Monge-Argiles, 2011; Vos, 2013).
Op basis van de hoge LR+ kan geconcludeerd worden dat, in geval van een positief testresultaat na het meten van de t-tau/amyloid beta42 ratio eiwit in cerebrospinale vloeistof, de waarschijnlijkheid dat een patiënt met MCI Alzheimer dementie zal ontwikkelen sterk vergroot is ten opzichte van een negatief testresultaat.
3) PET
a. Fluorodeoxyglucose–positron-emission tomography (FDG-PET)
In de systematische review van Smailagic (2015) varieerde de specificiteit en sensitiviteit van FDG-PET in de geïncludeerde studies om progressie naar AD te voorspellen respectievelijk tussen 29% en 100% en tussen 25% en 100%. Vanwege de variatie in afkappunten en metingen van FDG opname in de hersenregio’s werd geen gepoolde sensitiviteit en specificiteit berekend. In plaats daarvan werden schattingen gegeven van de sensitiviteit op gefixeerde waarden van de specificiteit van het model dat gefit werd om de gepoolde ROC-curve te maken. Op de mediane specificiteit van 82%, was de geschatte sensitiviteit voor het correct identificeren van patiënten die van MCI naar dementie converteren 76% (95% BI 53,8 tot 89,7). Dit staat gelijk aan een LR+ van 4,22 en een LR- van 0,29.
Figuur 5
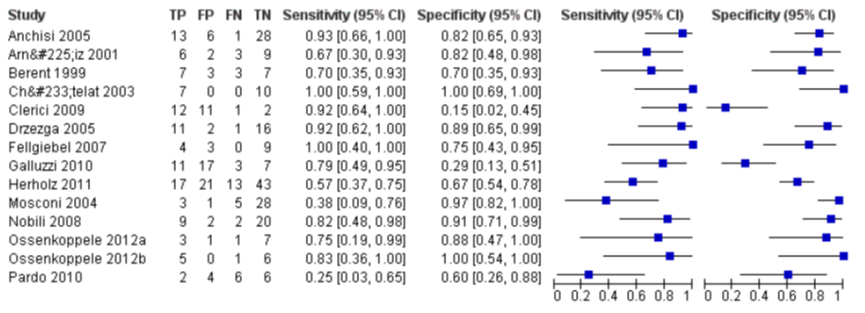
Forest plot van studieresultaten F-FDG-PET voor voorspellen Alzheimer dementie (Smailagic, 2015)
In de systematische review van Zhang (2012) varieerde de specificiteit en sensitiviteit van FDG-PET in de geïncludeerde studies om progressie naar AD te voorspellen respectievelijk tussen 47,4% en 100% en tussen 37,5% en 100%. De gepoolde specificiteit en sensitiviteit van FDG-PET om progressie naar Alzheimer dementie te voorspellen was respectievelijk 74% (95% BI 67 tot 80) en 77% (95% BI 66 tot 85). Dit staat gelijk aan een LR- van 0,31 en een LR+ van 2,96. Er was sprake van een hoge heterogeniteit tussen de studies voor sensitiviteit (I2=57,9%) en specificiteit (I2=84,7%). In de systematische review van Yuan (2009) waren de gepoolde specificiteit en sensitiviteit van FDG-PET respectievelijk 84,9% (95% BI 78,1 tot 90,3) en 88,8% (95% BI 82,2 tot 93,6). De LR- was 0,15 (95% BI 0,05 tot 0,48) en de LR+ was 4,61 (95% BI 3,18 tot 6,69). De heterogeniteit (I2) was 66,1% voor sensitiviteit en 57,4% voor specificiteit. In deze review bleek FDG-PET iets beter de progressie naar Alzheimer dementie te voorspellen dan SPECT en MRI.
Op basis van deze resultaten kan geconcludeerd worden dat FDG-PET als enkele test geen betrouwbare test is om MCI-patiënten te identificeren die mogelijk Alzheimer dementie gaan ontwikkelen.
b. PIB-PET
In de systematische review van Ma (2015) was de gepoolde specificiteit en sensitiviteit van PIB-PET om progressie naar Alzheimer dementie te voorspellen respectievelijk 57,2% (95% BI 50,1 tot 64,2) en 94,7% (95% BI 89,8 tot 97,7). Dit staat gelijk aan een LR- van 0,09 en een LR+ van 2,21. Matige heterogeniteit tussen de geïncludeerde studies werd gevonden voor specificiteit (I2=42,1%) door verschillende gebruikte afkappunten en verschillende follow-up duur (gemiddeld 19 tot 62 maanden). In een subgroep met een lange follow-upduur (>2 jaar) werd een gepoolde specificiteit van 72,4% (95% BI 59,1 tot 83,3) en een gepoolde sensitiviteit van 95,5% (95% BI 84,5 tot 99,4) gevonden. Dit staat gelijk aan een LR- van 0,06 en een LR+ van 3,43. In een subgroep met een korte follow-upduur (1 tot 2 jaar) werd een gepoolde specificiteit van 51,0% (95% BI 42,6 tot 59,5) en een gepoolde sensitiviteit van 94,4% (95% BI 88,2 tot 97,9) gevonden. Dit staat gelijk aan een LR- van 0,12 en een LR+ van 1,92. In de meta-analyse heeft PIB-PET een hele hoge sensitiviteit en een relatief lage specificiteit voor de vroege diagnose van AD bij patiënten met MCI. Geconcludeerd werd dat een langere follow-up duur de voorspellende waarde voor Alzheimer dementie kan versterken.
Figuur 6
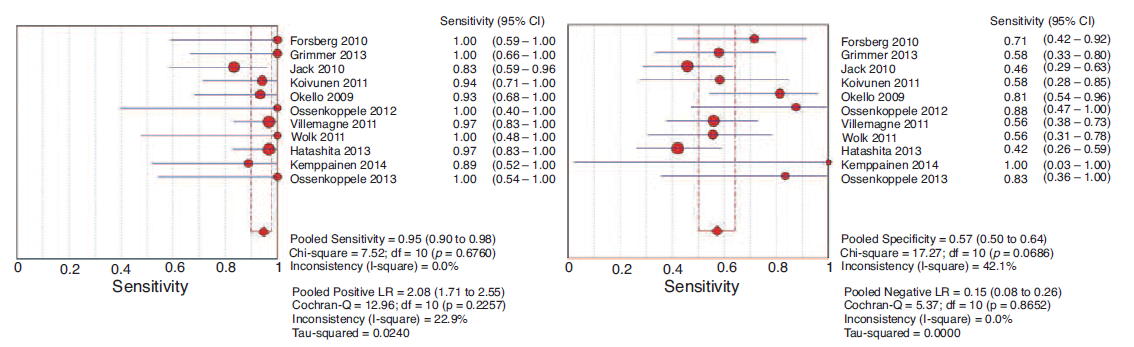
Forest plot van studieresultaten F-FDG PET voor voorspellen Alzheimer dementia en andere vormen van dementie bij patiënten met MCI (Ma, 2015)
Op basis van de lage LR- kan geconcludeerd worden dat, in geval van een negatief testresultaat na het meten van de PIB-PET, de waarschijnlijkheid dat een MCI-patiënt geen Alzheimer dementie gaat ontwikkelen sterk vergroot is ten opzichte van een positief testresultaat.
In de literatuursearch werden geen relevante studies over PIB-PET gevonden na de searchdatum van Ma (februari 2014).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat structurele MRI is met 2 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risico op bias bij patiëntenselectie en index test) en inconsistentie tussen studies (hoge mate van heterogeniteit door verschillen in follow-up en criteria voor MCI en AD).
De bewijskracht voor de uitkomstmaat CSF is met 2 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risico op bias door grote heterogeniteit tussen studies en verschillende afkappunten) en onnauwkeurigheid van de uitkomsten (imprecisie door grote verschillen in betrouwbaarheidsintervallen van sensitiviteit en specificiteit, die overlappen niet).
De bewijskracht voor de uitkomstmaat FDG-PET is met 2 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risico op bias bij patiëntenselectie en referentiestandaard) en inconsistentie tussen studies (hoge mate van heterogeniteit door verschillen in follow-up en criteria voor MCI en AD).
De bewijskracht voor de uitkomstmaat PIB-PET is met 2 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risico op bias bij patiëntenselectie en referentiestandaard) en inconsistentie tussen studies (hoge mate van heterogeniteit door verschillen in follow-up en criteria voor MCI en AD).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is de waarde van de toepassing van MRI, PET en CSF bij het voorspellen van progressie van MCI naar Alzheimer dementie?
P: patiënten met MCI;
I: aanwezigheid van biomarker;
- Magnetic Resonance Imaging (MRI) biomarkers.
- Cerebrospinal fluid (CSF) biomarkers (amyloid beta42 en tau eiwitten).
- Positron Emitted Tomography (PET) biomarkers (amyloid en glucose imaging).
C: afwezigheid van deze biomarker;
O: diagnostische waarde voor progressie naar Alzheimer dementie (sensitiviteit, specificiteit, LR+ en LR-).
Relevante uitkomstmaten
De werkgroep achtte de specificiteit en de negatieve likelihood ratio (LR-) voor progressie naar Alzheimer dementie een voor de besluitvorming kritieke uitkomstmaat, met het oog op het correct identificeren van patiënten die geen progressie zullen vertonen; en sensitiviteit en LR+ een voor de besluitvorming belangrijke uitkomstmaat, met het oog op het correct identificeren van patiënten die wèl progressie zullen vertonen.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 20-12-2016 met relevante zoektermen gezocht naar de waarde van biomarkers (MRI, CSF, PET) in het voorspellen van progressie naar dementie bij patiënten met MCI, en in de diagnose van de onderliggende oorzaak van MCI. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 659 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische review (gezocht in ten minste twee databases met een objectieve en transparante zoekstrategie, data extractie en methodologische beoordeling) of cohortstudies naar de voorspellende waarde van biomarkers (Magnetic Resonance Imaging (MRI), Cerebrospinal fluid (CSF) en Positron Emission Tomography (PET)) voor de progressie naar Alzheimer dementie. Op basis van titel en abstract werden in eerste instantie 216 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 202 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 14 studies definitief geselecteerd. Na de zoekdatum van de literatuursearch werd nog een nieuwe systematische review over CSF gepubliceerd, welke ook werd geïncludeerd in de literatuuranalyse. Bovendien werd een meer recente gemiste systematische review naar FDG-PET aanvullend geïncludeerd.
Uiteindelijk zijn 14 artikelen opgenomen in de literatuuranalyse, waarvan acht systematische reviews en zes individuele studies. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Albert MS, DeKosky ST, Dickson D, et al. The diagnosis of mild cognitive impairment due to Alzheimer's disease: recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimer's & dementia: the journal of the Alzheimer's Association. 2011;7(3):270-9.
- Dubois B, Feldman HH, Jacova C, et al. Revising the definition of Alzheimer's disease: a new lexicon. Lancet Neurol. 2010;9(11):1118-27. doi: 10.1016/S1474-4422(10)70223-4.
- Dubois B, Feldman HH, Jacova C, et al. Advancing research diagnostic criteria for Alzheimer's disease: the IWG-2 criteria. Lancet Neurol. 2014;13(6): 614-29. doi: 10.1016/S1474-4422(14)70090-0.
- Ferreira D, Perestelo-Perez L, Westman E, et al. Meta-Review of CSF Core Biomarkers in Alzheimer's Disease: The State-of-the-Art after the New Revised Diagnostic Criteria. Frontiers in aging neuroscience. 2014;6:47.
- Ritchie C, Smailagic N, Noel-Storr AH, et al. Plasma and cerebrospinal fluid amyloid beta for the diagnosis of Alzheimers disease dementia and other dementias in people withmild cognitive impairment (MCI) (Review). Cochrane Database of Systematic Reviews 2014, Issue 6.
- Clifford R. Jack Jr., David A, et al. NIA-AA Research Framework: Toward a biological definition of Alzheimer's disease. Alzheimers&Dementia. 2018;14(4):535562
- Korolev IO, Symonds LL, Bozoki AC, Alzheimer's Disease Neuroimaging I. Predicting Progression from Mild Cognitive Impairment to Alzheimer's Dementia Using Clinical, MRI, and Plasma Biomarkers via Probabilistic Pattern Classification. PLoS ONE (Electronic Resource). 2016;11(2):e0138866.
- Ma Y, Zhang S, Li J, et al. Predictive accuracy of amyloid imaging for progression from mild cognitive impairment to Alzheimer disease with different lengths of follow-up: a meta-analysis. Medicine. 2014;93(27):e150.
- Mattsson N, Rosen E, Hansson O, et al. Age and diagnostic performance of Alzheimer disease CSF biomarkers. Neurology. 2012;78(7):468-76.
- Moradi E, Pepe A, Gaser C, et al. Alzheimer's Disease Neuroimaging I. Machine learning framework for early MRI-based Alzheimer's conversion prediction in MCI subjects. Neuroimage. 2015;104:398-412.
- Prestia A, Caroli A, van der Flier WM, et al. Prediction of dementia in MCI patients based on core diagnostic markers for Alzheimer disease. Neurology. 2013;12;80(11):1048-56. doi: 10.1212/WNL.0b013e3182872830.
- Prestia A, Caroli A, Wade SK, et al. Prediction of AD dementia by biomarkers following the NIA-AA and IWG diagnostic criteria in MCI patients from three European memory clinics. Alzheimers & Dementia. 11(10):1191-201. doi: 10.1016/j.jalz.2014.12.001.
- Ritchie C, Smailagic N, Noel-Storr AH, et al. Plasma and cerebrospinal fluid amyloid beta for the diagnosis of Alzheimer's disease dementia and other dementias in people with mild cognitive impairment (MCI). Cochrane Database Syst Rev. 2014;6:CD008782.
- Ritchie C, Smailagic N, Noel-Storr AH, et al. CSF tau and the CSF tau/ABeta ratio for the diagnosis of Alzheimer's disease dementia and other dementias in people with mild cognitive impairment (MCI). Send to Cochrane Database Syst Rev. 2017;3:CD010803.
- Smailagic N, Vacante M, Hyde C, et al. ¹8F-FDG PET for the early diagnosis of Alzheimer's disease dementia and other dementias in people with mild cognitive impairment (MCI). Cochrane Database Syst Rev. 2015;28;1:CD010632.doi: 10.1002/14651858.CD010632.pub2. Review. PubMed PMID: 25629415.
- Spulber G, Simmons A, Muehlboeck JS, et al. An MRI-based index to measure the severity of Alzheimer's disease-like structural pattern in subjects with mild cognitive impairment. Journal of Internal Medicine. 2013;273(4):396-409.
- Ten Kate M, Barkhof F, Boccardi M, et al. Geneva Task Force for the Roadmap of Alzheimer's Biomarkers. Clinical validity of medial temporal atrophy as a biomarker for Alzheimers disease in the context of a structured 5-phase development framework Neurobiol Aging. 2017;52:167-182.
- Willette AA, Calhoun VD, Egan JM, et al. Alzheimer's Disease Neuroimaging I. Prognostic classification of mild cognitive impairment and Alzheimer's disease: MRI independent component analysis. Psychiatry Research. 2014;224(2):81-8.
- Xu L, Wu X, Li R, et al. Prediction of Progressive Mild Cognitive Impairment by Multi-Modal Neuroimaging Biomarkers. Journal of Alzheimer's Disease. 2016;51(4):1045-56.
- Yu P, Dean RA, Hall SD, et al. Enriching amnestic mild cognitive impairment populations for clinical trials: optimal combination of biomarkers to predict conversion to dementia. Journal of Alzheimer's Disease. 2012;32(2):373-85.
- Yuan Y, Gu ZX, Wei WS. Fluorodeoxyglucose-positron-emission tomography, single-photon emission tomography, and structural MR imaging for prediction of rapid conversion to Alzheimer disease in patients with mild cognitive impairment: a meta-analysis. Ajnr: American Journal of Neuroradiology. 2009;30(2):404-10.
- Zhang S, Han D, Tan X, et al. Diagnostic accuracy of 18F-FDG and 11C-PIB-PET for prediction of short-term conversion to Alzheimer's disease in subjects with mild cognitive impairment. International Journal of Clinical Practice. 2012;66(2):185-98.
Evidence tabellen
Evidence table for systematic reviews of diagnostic test accuracy studies
|
Study reference |
Study characteristics |
Patient characteristics
|
Index test (test of interest) |
Reference test
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Ma, 2015
|
SR and meta-analysis
Literature search up to February 2014
A: Jack, 2010 B: Wolk, 2009 C: Villemange, 2011 D: Koivunen, 2011 E: Ossenkoppele, 2013 F: Hatashita, 2013 G: Okello, 2009 H: Forsberg, 2010 I: Ossenkoppele, 2012 J: Grimmer, 2013 K: Kemppainen, 2014
Study design: longitudinal cohort studies
Setting (and Country): A: Mixed (USA) B: tertiary (USA) C: outpatients (Australia) D: outpatients (Finland) E: outpatients (NL) F: outpatients (Japan) G: inpatients (UK/Finland) H: outpatients (Sweden) I: NA (NL) J: outpatients (Germany) K: secondary care (Finland)
Source of funding and conflicts of interest: Not reported |
Inclusion criteria SR:
11 studies included
Important patient characteristics: Number of patients; characteristics important to the research question; for example, age, sex, bmi, ... A: 53 patients, 75 yr B: 26 patients, 70.2±8.8 yr C: 67 patients, 73.4±8.5 yr D: 29 patients, 26.9±1.6 yr E: 30 patients, 64±9 yr F: 68 patients, 50-90 yr G: 31 patients, 69.4±7.9 yr H: 21 patients, 12.7±3.1 yr I: 15 patients, 67±7 yr J: 28 patients, 67.9±7.4 yr K: 10 patients, 70.4±5.7 yr |
C-PIB-PET positive or negative at baseline
Cut-off point(s): A: Mean neocortical (ROI)DVR >1.5 B: DVR,SUVR or ROI> upper-inner fence of the control C: Neocortical SUVR>1.5 D: Not specified analytical approach of ROI to-cerebellar ratio > 1.5 E: not reported (visual interpretation) F: Mean neocortical (ROI)DVR>1.49(visual interpretation) G: RATIO≥2 SD greater than the control mean in all 6 ROI (visual interpretation) H: Not specified analytical approach of ROI to-cerebellar ratio >1.6 I: not reported (visual interpretation) J: Not specified analytical approach of ROI to-cerebellar vermis ratio of 1.4 K: Not specified analytical approach of ROI to-cerebellar ratio and SUVR of 1.5 |
Conversion to Alzheimer disease A, B, C, F, G, H, I, J, K: NINCDS-ADRDA D: DSMIV criteria E: Not described
Prevalence (%) A: 34.0 B: 21.7 C: 47.7 D: 58.6 E: 50.0 F: 44.1 G: 48.4 H: 33.3 I: 33.3 J: 32.2 K: 90.0
No complete outcome data: N (%) A: 0 B: 3 (12) C: 2 (3) D: 0 E: 18 (60) F: 0 G: 0 H: 0 I: 3 (20%) J: 0 K: 0
Reasons for incomplete outcome data not described |
Duration of follow-up, mean (months): A: 20.4 (median) B: 21.2±16.0 C: 20.0±3.0 D, E: NA F: 19.2±7.1 G: 27.5±1.5 H: 33.3±19.3 I: 30.0±6.0 J: 31.2±7.8 K: 62.4±4.0 |
Alzheimer disease sensitivity / specificity (%) A: 0.83/0.46 B: 1.00/0.56 C: 0.94/0.58 D: 0.94/0.58 E: 1.00/0.83 F: 0.97/0.42 G: 0.93/0.88 H: 1.00/0.71 I: 1.00/0.88 J: 1.00/0.58 K: 0.89/1.00
C-PIB-PET (positive/negative) Pooled results total group Sensitivity: 94.7% (95% CI 89.8 to 97.7) Specificity: 57.2% (95% CI 50.1 to 64.2) LR+: 2.08 (95% CI 1.71-2.55) LR-: 0.15 (95% CI 0.08-0.26) Diagnostic accuracy: 73.3% AUC: 0.88 ± SE 0.03 Heterogeneity specificity (I2): 42.1%
Pooled results short-term follow-up subgroup Sensitivity: 94.4% (95% CI 88.2 to 97.9) Specificity: 51.0% (95% CI 42.6 to 59.5) LR+: 1.83 (95% CI 1.54-2.18) LR-: 0.16 (95% CI 0.08-0.34) Diagnostic accuracy: 69.6% AUC: 0.88 ± SE 0.03
Pooled results long-term follow-up subgroup Sensitivity: 95.5% (95% CI 84.5 to 99.4) Specificity: 72.4% (95% CI 59.1 to 83.3) LR+: 2.90 (95% CI 1.97-4.27) LR-: 0.12 (95% CI 0.05-0.32) Diagnostic accuracy: 82.4% AUC: 0.93 ± SE 0.03 |
C-PIB-PET = C-Pittsburgh compound B positron emission tomography DVR = distribution volume ratio ROI = regions of interests SUVR = standardised uptake value ratio
In the total group meta-regression to explore potential sources of heterogeneity was not performed because the available data for most covariates were insufficient for conducting this analysis.
The data in the follow-up subgroups had almost no heterogeneity. Duration of follow-up probably major cause of presence of heterogeneity.
All the included studies were also included in the SR’s of Zhang (2012 and 2014)
Author’s conclusion Prolongation of the follow-up duration tended to yield greater accuracy of 11C-PIB-PET for predicting the progression from MCI to AD. |
|
Smailagic, 2015 |
SR
Literature search up to January 2013
A: Anchisi, 2005 B: Arnaiz, 2001 C: Berent, 1999 D: Chételat, 2003 E: Clerici, 2009 F: Drzezga, 2005 G: Fellgiebel, 2007 H: Galuzzi, 2010 I: Herholz, 2011 J: Mosconi, 2004 K: Nobili, 2008 L: Ossenkoppele 2012a M: Ossenkoppele 2012b N: Pardo, 2010
Study design: cohort (prospective / retrospective)
Setting and Country: A: outpatients, Germany B: geriatric hospital, Sweden C: cognitive disorder clinic, USA D: memory clinic, Sweden E: department of neurology, Italy F: research unit, Germany G: outpatients, Sweden H: memory clinic, Italy I: medical centres, USA and Canada J: not reported K: outpatients, country not reported L: not reported M: outpatients memory clinic, Netherlands N: memory loss clinic, USA
Source of funding and conflicts of interest: Not reported |
Inclusion criteria SR:
Exclusion criteria SR: Involve people with MCI possibly caused by current use or history of alcohol/drug abuse; Central Nervous System trauma, tumour or infection other neurological conditions
14 studies included in meta-analysis
N, mean age, sex A: 67 patients, 67.7±8.3 yr, 37% male B: 20 patients, 64.9±8.3 yr (converters), 60.1±8.4 yr (stable), 55% male C: 20 patients, 70.2±5.5 yr, 35% male D: 17 patients, 69.9±6.7 yr, 47% male E: 30 patients, 74.9±7.6 yr, 67% male F: 30 patients, 70±8 yr, 47% male G: 16 patients, 68.6±7.9 yr, 56% male H: 38 patients I: 94 patients, 75±7.6 yr, 70% male J: 37 patients, 69±4 yr, 46% male K: 36 patients, 77.3±4.8 yr, 36% male L: 12 patients, 67±7 yr, 60% male M: 30 patients, 64±9 yr, 77% male N: 19 patients, 80 yr |
FDG-PET Cut-off values A: Optimised threshold identified by ROC (1.138) B: not prespecified C: not prespecified D: not prespecified E: <100 voxel F: >1.64 G: decrease of cerebral glucose metabolism in ≥1 brain regions H: t sum > 11.090 I: t sum > 11.090 J: not reported L: not reported M: not reported N: not prespecified |
Conversion to Alzheimer disease dementia A: NINCDS-ADRDA B: NINCDS-ADRDA C: NINCDS-ADRDA; ICD-10 D: NINCDS-ADRDA E: NINCDS-ADRDA + DSM-IV F: NINCDS-ADRDA G: CDR=1 H: NINCDS-ADRDA I: clinical dementia rating (not specified) and ADAS-cog J: NINCDS-ADRDA K: NINCDS-ADRDA + DSM-IV L: NINCDS-ADRDA M: NINCDS-ADRDA N: not reported |
Endpoint of follow-up: A: 12 months B: 36.5 months C: 3 yr D: 18 months E: 37 months F: 15 months G: 19.6±9 months H: 26.5±16 months I: 24 months J: 12.1±0.6 months K: 21.1±10.9 months L: range 2-4 yr M: 2 yr N: 3 yr |
Alzheimer disease sensitivity / specificity (%) A: 0.93/0.82 B: 0.67/0.82 C: 0.70/0.70 D: 1.00/1.00 E: 0.92/0.15 F: 0.92/0.89 G: 1.00/0.75 H: 0.79/0.29 I: 0.57/0.67 J: 0.38/0.97 K: 0.82/0.91 L: 0.75/0.88 M: 0.83/1.00 N: 0.25/0.60
T-tau Sensitivity / specificity (%) A: 0.56/0.87 F: 0.90/0.48 G: 0.51/0.88 I: 0.83/0.50 K: 0.73/0.69 L: 0.81/0.72 N: 0.71/0.77
P-tau/amyloid beta Sensitivity / specificity (%) G: 0.96/0.75 J: 0.80/0.33 K: 0.82/0.65 M: 0.81/0.95 N: 0.80/0.60
Median specificity: 72% Estimated sensitivity 77% (95% CI 67 to 85) LR+ 2.72 (95% CIU 2.43 to 3.04) LR- 0.32 (95% CI 0.22 to 0.47) |
Due to variation in thresholds, summary sensitivity and specificity were not estimated. Estimates of sensitivity at fixed values of specificity were derived.
Author’s conclusion Given the considerable variability of specificity values and lack of defined thresholds for determination of test positivity in the included studies, the current evidence does not support the routine use of F-FDG-PETscans in clinical practice in people with MCI. |
|
Ritchie, 2017 |
SR
Literature search up to January 2013
A: Amlien, 2013 B: Buchhave, 2012 C: Eckerstrom, 2010 D: Fellgiebel, 2007 E: Galluzzi, 2010 F: Hampel, 2004 G: Hansson, 2006 H: Herukka, 2007 I: Kester, 2011 J: Koivunen, 2008 K: dubois-Argiles, 2011 L: Palmqvist, 2012 M: Parnetti, 2012 N: Visser, 2009 O: Vos, 2013
Study design: cohort (prospective / retrospective)
Setting and Country: A: memory clinic, Norway B: outpatients, Sweden C: University, Sweden D: memory clinic, Sweden E: outpatients, Italy F: outpatients, Sweden G: outpatients, Sweden H: inpatients, Finland I: outpatients, NL J: Finland K: outpatients, Spain L: outpatients, Greece M: memory clinic, Italy N: European multicentre memory clinic O: European multicentre memory clinic
Source of funding and conflicts of interest: Not reported |
Inclusion criteria SR:
Exclusion criteria SR:
14 studies included
N, mean age, sex A: 39 patients, 45-77 yr, 51% male B: 134 patients, 61.9 (stable), 73.9 (converters) yr, 45% male C: 42 patients, 67.9 (stable), 69.3 (converters) yr, 43% male D: 16 patients, 68.6 yr, 56% male E: 90 patients, 72.1 yr, 51% male F: 52 patients, 68 yr, 45% male G: 137 patients, 65 yr, 42% male H: 79 patients, 70.6 yr, 42% male I: 153 patients, 67±9 yr, 39% male J: 15 patients, 71.1±7.2 yr, 60% male K: 37 patients, 73.4±6.6 yr, 35% male L: 133 patients, N: 168 patients, 52% male M: 90 patients, 73% male O: 625 patients, 70.7±7.6 yr, 43% male |
CSF amyloid beta42 Threshold p-tau D: 50 pg/mL, not prespecified F: <6.5 pg/mL G: >60 pg/mL H: >70 pg.L J: <70 pg/mL L: >39 pg.mL N: >51 pg/mL
Threshold t-tau A: 300 ng/L (age <50 yr); 450 ng/L (age 50-69 yr); 500 ng/L (age >70 yr) C: 500 ng/L, not prespecified E: >450 ng/L (age 51-70 yr); >500 ng/L (age 71-93 yr) F: >350 pg/mL G: >350 pg/mL H: >400 pg/mL I: >356 pg/mL J: >400 pg/mL L: >87 pg/mL
Threshold p-tau/amyloid beta B: not pre-specified F >60 pg/mL G: <6.5 pg/mL J: <6.5 pg/mL M: 1074 N: 9.92 |
Conversion to Alzheimer disease dementia A: ? B: NINCDS-ADRDA + DSM-III-R C: NINCDS-ADRDA criteria; Lund andManchester criteria; Erkinjunitti criteria D: CDR E: NINCDS-ADRDA F: NINCDS-ADRDA + DSM-IV G: NINCDS-ADRDA + DSM-III-R H: NINCDS-ADRDA + DSM-IV-R I: NINCDS-ADRDA J: NINCDS-ADRDA + DSM-IV M: NINCDS-ADRDA K: NINCDS-ADRDA L: NINCDS-ADRDA M: NINCDS-ADRDA N: NINCDS-ADRDA + DSM-IV O: NINCDS-ADRDA + DSM-IV
Prevalence (%) B: 54% C: 50% D: 25% E: 43.% F: 56% G: 43% G: 50% H: 20% J: 33% K: 30% L: 9% M: 39% N: O: 43% |
Endpoint of follow-up: A: 2.6.0±0.54 yr B: 9.2 yr C: 2 yr D: 19.6±9.0 months E: 24.0.0±9.7 months F: 8.4±95.1 months G: 5.2 yr H: 4.56±3.09 yr (stable); 3.52±1.95 yr (converters) I: median 18 months J: 2 yr K: 6 months L: 5.9 yr M: 12 months N: 1-3 yr O: 2.5 yr |
Alzheimer disease dementia P-tau Sensitivity / specificity (%) D: 1.00/0.33 G: 0.68/0.86 J: 0.40/0.22 K: 0.82/0.58 L: 0.67/0.86 N: 0.88/0.37
T-tau Sensitivity / specificity (%) A: 0.56/0.87 F: 0.90/0.48 G: 0.51/0.88 I: 0.83/0.50 K: 0.73/0.69 L: 0.81/0.72 N: 0.71/0.77
P-tau/amyloid beta Sensitivity / specificity (%) G: 0.96/0.75 J: 0.80/0.33 K: 0.82/0.65 M: 0.81/0.95 N: 0.80/0.60
Median specificity: 72% Estimated sensitivity 77% (95% CI 67 to 85) LR+ 2.72 (95% CIU 2.43 to 3.04) LR- 0.32 (95% CI 0.22 to 0.47) |
Due to variation in thresholds, summary sensitivity and specificity were not estimated. Estimates of sensitivity at fixed values of specificity were derived.
Author’s conclusion CSF tests appear to have better sensitivity than specificity and therefore might have greater utility in ruling out Alzheimer’s disease as the aetiology to the individual’s evident cognitive impairment, as opposed to ruling it in. |
|
Ritchie, 2014 |
SR
Literature search up to December 2012
A: Galluzzi, 2010 B: Bjerke, 2009 C: Zetterberg, 2003 D: Hampel, 2004 E: Chiasserini, 2010 F: Hansson, 2007 G: Blom, 2009 H: Parnetti, 2006 I: Shaw, 2009 J: Hertze, 2010 K: Monge-Argiles, 2011 L: Papaliagkas, 2009 M: Kester, 2011 N: Vos, 2013
Study design: cohort, case-control (prospective / retrospective)
Setting and Country: A: outpatients, Italy B: outpatients, Sweden C: outpatients, Sweden D: inpatients, Sweden E: outpatients, Italy F: outpatients, Sweden G: outpatients, Sweden H: memory clinic, Italy I: mixed setting, USA J: outpatients, Sweden K: outpatients, Spain L: outpatients, Greece M: outpatients, NL N: European multicentre memory clinic
Source of funding and conflicts of interest: Not reported |
Inclusion criteria SR:
Exclusion criteria SR:
14 studies included
N, mean age, sex A: 90 patients, 72.1 yr, 41% male B: 174 patients, 66.8 yr, 39% male C: 53 patients, 50-83 yr, sex not reported D: 52 patients, 72.6 yr, 46% male E: 41 patients, 65.4 yr, 49% male F: 137 patients, 65 yr, 42% male G: 58 patients, 62.9 yr, 48% male H: 55 patients, age/sex not reported I: 200 patients, 75 yr, 66\5 male J: 166 patients, 72 yr, 39% male K: 37 patients, 73.4±6.6 yr, 35% male L: 53 patients, 67.2 yr, 42% male M: 153 patients, 67±9 yr, 39% male N: 625 patients, 70.7±7.6 yr, 43% male |
CSF amyloid beta42 Thresholds CSF Aß42 A: <500 pg/ml B: 512 ng/l C: <532 ng/L D: <679 ng/l E: 741 pg/ml F: 0.64 ng/ml G: 82 pM H: 500 pg/l I: 192 pg/ml J: 209 pg/ml K: 320 pg/ml L: 472 pg/ml M: <495 pg/ml N: <500 pg/ml |
Conversion to Alzheimer disease dementia A: NINCDS-ADRDA B: NINCDS-ADRDA + ICD-10 C: DSM-IV D: NINCDS-ADRDA + DSM-IV E: NINCDS-ADRDA F: NINCDS-ADRDA + DSM-IV G: NINCDS-ADRDA H: NINCDS-ADRDA I: NINCDS-ADRDA J: NINCDS-ADRDA + DSM-III-R K: NINCDS-ADRDA L: not defined M: NINCDS-ADRDA N: NINCDS-ADRDA + DSM-IV
Prevalence (%) A: 43% B: 25% C: 42% D: 56% E: 56% F: 43% G: 50% H: 20% I: 19% J: 33% K: 30% L: 9% M: 39% N: 43%
No complete outcome data available, N (%) A: 26 (29) B: 12 (7) C, D, E, H, K, L: 0 F: 3 (2) G: 30 (52) I: 4 (2) J: 7 (4) M: 53 (35) N: 17 (8)
Reasons for incomplete data not described for G, I, M |
Endpoint of follow-up: A: 24.0±9.7 months B: 4 yr C: 20±10 months D: 8.4±5.1 months E: 4 yr F: 5.2 yr G: 5.6±2.7 yr H: 12 months I: 12 months J: 4.7 yr K: 6 months L: 11 months M: median 18 months N: 2.5 yr |
Alzheimer disease dementia Sensitivity / specificity (%) A: 0.82/0.60 B: 0.90/0.70 C: 0.68/0.61 D: 0.83/0.57 E: 0.74/0.89 F: 0.93/0.53 G: 0.64/0.36 H: 0.36/0.91 I: 0.86/0.29 J: 0.90/0.69 K: 0.82/0.62 L: 1.00/0.77 M: 0.76/0.72 N: 0.68/0.67
Median specificity: 64% Estimated sensitivity 81% (95% CI 72 to 87) LR+ 2.22 (95% CIU 2.00 to 2.47) LR- 0.31 (95% CI 0.21 to 0.48) |
Due to variation in thresholds, summary sensitivity and specificity were not estimated. Estimates of sensitivity at fixed values of specificity were derived.
Author’s conclusion measure of abnormally low CSF Aß levels has very little diagnostic benefit with likelihood ratios suggesting only marginal clinical utility. |
|
Zhang, 2012
|
SR and meta-analysis
Literature search up to January 2011
A: Landau, 2010 B: Nobili, 2008 C: Anchisi, 2005 D: Arnáiz, 2001 E: Mosconi, 2004 F: Chételat, 2003 G: Drzega, 2005
Study design, setting and country: not reported
Source of funding and conflicts of interest: Not reported |
Inclusion criteria SR:
7 studies included for FDG-PET
N, mean age, sex A: 85 patients, 78.1±7.4 yr, 66% male B: 33 patients, 75.5±5.3 yr, 39% male C: 48 patients, 66.8±8.3 yr, 52% male D: 20 patients, 62.3±8.5 yr, 60% male E: 37 patients, 67.1±7.7 yr, 46% male F: 17 patients, 69.9±6.7 yr, 47% male G: 30 patients, 70.4±7.8 yr, 47% male |
FDG-PET Cut-off values A: Optimised threshold identified by ROC analyses on target VOIs B: NA C: rCGM-r of temporoparietal and posterior cingulate < 1.3–8 D: Optimised threshold identified by logistic regression on ROIs E: Logistic regression analyses on ROI F: rCGM-r <80% of whole brain mean of control subjects G: Hypometabolism in at least unilateral temporoparietal areas compared with control |
Conversion to Alzheimer disease Diagnosis according to NINCDS-ARDRA and DSM -IV criteria (not specified per study)
Prevalence AD (%) A: 60% B: 33% C: 29% D: 45% E: 22% F: 41% G: 40%
Numbers of patients with incomplete data and reasons were not reported
|
Endpoint of follow-up: A: 1.9±0.4 yr B: 21.1±10.9 months C: 12 months (range 12-27) D: 36.8 months (range 10-75) E: 12.1±0.6 months F: 18 months G: 16±2 months
|
Alzheimer disease Sensitivity (95% CI) A: 0.75% (0.55 to 0.89) B: 0.82% (0.48 to 0.98) C: 0.93% (0.66 to 1.00) D: 0.67% (0.30 to 0.93) E: 0.38% (0.09 to 0.76) F: not reported G: 0.92% (0.62 to 1.00)
Specificity (95% CI) A: 0.47% (0.55 to 0.89) B: 0.73% (0.48 to 0.98) C: 0.82% (0.66 to 1.00) D: 0.82% (0.30 to 0.93) E: 0.97% (0.09 to 0.76) F: 1.00 (0.69 to 1.00) G: 0.89% (0.62 to 1.00)
Pooled estimates (95% CI) Sensitivity: 77% (66 to 85) Specificity: 74% (67 to 80) LR+: 4.16 (1.93 to 8.97) LR-: 0.32 (0.16-0.61) Heterogeneity I2 sensitivity-specificity: 53.4% and 84.7% |
C-PIB-PET also in meta-analysis, but exactly the same studies were included as in SR of Ma et al (2015)
Author’s conclusion Studies had high heterogeneity and funnel plot suggested a publication bias. The diagnostic accuracy for FDG-PET suggests that it is a potentially valuable technique for prediction of progression in patients with MCI.
|
|
Ferreira, 2011 |
SR and meta- analysis
Literature search up to September 2009
A: Bozzali, 2006 B: Chetelat, 2005 C: Karas, 2008 D: Risacher, 2009 E: Waragi, 2009 F: Whitwell, 2008
Study design: not reported
Setting and Country: Not reported
Source of funding and conflicts of interest: Not reported |
Inclusion criteria SR:
6 studies included in the meta-analysis
N, mean age, sex: A: 22 patients, converters 71.8 yr, nonconverters 71.4 yr, 45% male B: 18 patients, converters 71.8 yr, nonconverters 71.4 yr 39% male C: 24 patients, converters 72.2 yr, nonconverters 72.4 yr, 25% male D: 339 patients, converters 74.3 yr, nonconverters 75.1 yr, 463% male E: 13 patients, converters 80.2 yr, nonconverters 77.6 yr 454% male F: 63 patients, converters 79.2 yr, nonconverters 80.0 yr 43% male |
Structural brain MRI Thresholds not reported
|
Conversion to Alzheimer disease dementia Criteria not reported
Prevalence (%) Not reported
Incomplete outcome data not reported. |
Endpoint of follow-up: A: 24 months B: 18 months C: 36 months D: 12 months E: 27 months F: 18/36 months
|
No diagnostic accuracy data |
No quality assessment of included studies
Using the method of Activation Likelihood Estimation, coordinates from the six longitudinal VBM studies that enrolled subjects with amnestic MCI (aMCI) at baseline were analysed. No diagnostic accuracy data reported.
Author conclusion: left medial temporal lobe atrophy is the most consistent neurostructural biomarker to predict conversion from aMCI to AD |
|
Yuan, 2009 |
SR and meta-regression analysis
Literature search up to April 2008
A: Chételat, 2003 B: Anchisi, 2005 C: Arnaiz, 2001 D: Mosconi, 2004 E: Drzezga, 2005 F: Silverman, 2003 G: Galton, 2005 H: Convit, 2000 I: Devanand, 2007 J: Geroldi, 2006 K: Visser, 1999 L: Korf, 2004 M: Visser, 2002 N: Dickerson, 2001 O: Teipel, 2007 P: Killiany, 2000
Study design: Retrospective cohort studies
Setting and Country: Not reported
Source of funding and conflicts of interest: Not reported
|
Inclusion criteria SR:
Exclusion criteria SR:
24 studies included (6 FDG-PET, 10 MRI, 8 SPECT)
N, mean age, sex: A: 17 patients, 69.9 yr, 47% male B: 48 patients, 67.7 yr, 51% male C: 20 patients, 62.7 yr, 60% male D: 37 patients, 67.1 yr, 46% male E: 30 patients, 70.4 yr, 47% male F: 128 patients, 66 yr, 49% male G: 29 patients, 63.7 yr, 48% male H: 46 patients, 74.0 yr, 48% male I: 114 patients, 66.8 yr, 44% male J: 52 patients, 70 yr, 44% male K: 13 patients, 78.8 yr, 30% male L: 75 patients, 62.9 yr, 40% male M: 26 patients, 64.9 yr, 58% male N: 23 patients, 68.6 yr, 68% male O: 22 patients, 69.7 yr, 46% male P: 79 patients, 72 yr, 40% male |
Structural MRI Thresholds magnetic strength G, J, P: NA H, I, K, L, M, N, O: 1.5
|
Conversion to Alzheimer disease dementia Study criteria for AD not reported F: change in MMSE score J, L: AD and other types of dementia
Prevalence (%) A: 41% B: 29% C: 55% D: 22% E: 40% F: 64% G: 38% H: 30% I: 27% J: 21% K: 27% L: 49% M: 27% N: 52% O: 32% P: 24%
Incomplete outcome data not reported. |
Endpoint of follow-up: A: 18 months B: 12 months C: 36.8 months D: 12.0 months E: 15 months F: 34.8 months G: 24.2 months H: 38.4 months I: 60 months J: 15.4 months K: 36 months L: 34 months M: 22.8 months N: 15 months O: 27 months P: 36 months |
FDG-PET (positive/negative) Pooled estimates (95% CI) Sensitivity: 88.8% (82.2-93.6) Specificity: 84.9% (78.1-90.3) LR+: 4.61 (3.18-6.69) LR-: 0.15 (0.05-0.48) OR: 40.15 (18.53-6.97) Heterogeneity I2 sensitivity-specificity: 66.1% and 57.4%
MRI (positive/negative) Pooled estimates (95% CI) Sensitivity: 72.8% (65.1-79.6) Specificity: 81.0% (76.3-85.1) LR+: 3.47 (2.62-4.60) LR-: 0.37 (0.29-0.48) OR: 10.58 (6.58-17.02) Heterogeneity I2 sensitivity-specificity: <0.1% and 39.8% |
Patients diagnosed with synonyms of MCI were included as having MCI. Criteria for MCI and AD not reported.
Separate analyses diagnostic value not reported
Subgroup analyses performed for diagnosis at baseline (MCI-synonyms MCI) and end point (AD-dementia including AD) analyses
Author conclusion: FDG-PET performs slightly better than SPECT and structural MR imaging in the prediction of conversion to AD in patients with MCI |
Evidence table for diagnostic test accuracy studies
|
Study reference |
Study characteristics |
Patient characteristics
|
Index test (test of interest) |
Reference test
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Mazzeo, 2016 |
Type of study: Patient cohort study
Setting: hospital
Country: Italy
Conflicts of interest: not reported
|
Inclusion criteria: CDR=0.5, MCI according to IWG diagnostic criteria, attainment of clinical endpoint
Exclusion criteria: presence of either past or concurrent illnesses which could account for patients cognitive deficits, complete data loss, follow-up <12 months
N=96
Prevalence AD: 38%
Sex, mean age ± SD: Converters: 46% male, 72.9 yr, Nonconverters: 51% male, 70.3 yr |
CSF
|
Conversion to AD NINCDS-ARDRA criteria |
Follow-up, mean months (±SD) Converters: 21.58 (9.95) Nonconverters: 36.73 (16.78) |
Aß42 (±CI) Sensitivity: 81.08 (12.2) Specificity: 67.3 (11.98) PPV: 60.62 (13.62) NPV: 84.90 (10.24)
T-tau (±CI) Sensitivity: 62.16 (15.63) Specificity: 75.86 (10.92) PPV: 61.76 (15.61) NPV: 76.17 (10.89)
P-tau (±CI) Sensitivity: 83.78 (11.88) Specificity: 62.07 (12.38) PPV: 58.07 (13.24) NPV: 85.92 (10.44)
T-tau/Aß (±CI) Sensitivity: 86.49 (11.01) Specificity: 70.69 (11.61) PPV: 64.92 (13.32) NPV: 89.30 (8.87)
P-tau/Aß42 (±CI) Sensitivity: 78.37 (13.27) Specificity: 79.32 (10.33) PPV: 70.38 (13.94) NPV: 85.40 (9.35) |
|
|
Korolev, 2016 |
Type of study: patient cohort study
Setting: ADNI cohort
Country: USA
Conflicts of interest: none |
Inclusion criteria: published on www.adni-info.org
N=259
Prevalence AD: 54%
Sex, mean age ± SD: Converters: 62% male, 74.8 yr, Nonconverters: 72% male, 74.8 yr |
Structural MRI 452 region of interest (ROI)-based morphometric measures (1.5 T) |
Conversion to AD NINCDS-ARDRA criteria |
Follow-up 36 months
|
MRI (±SD) Sensitivity: 68.5 (11.8) Specificity: 69.6 (12.4) |
ADNI = Alzheimer’s Disease Neuroimaging Initiative |
|
Xu, 2016 |
Type of study: patient cohort study
Setting: ADNI cohort
Country: USA and Canada
Conflicts of interest: not reported
|
Inclusion criteria: published on www.adni-info.org
N=110
Prevalence AD: 25%
Sex, mean age ± SD: Converters: 52% male, 74.0 ± 7.6 yr, Nonconverters: 754% male, 75.7 ± 7.9 yr |
MRI SPM8 package and VBM8 toolbox (T1-weighted at 1.5T) |
Conversion to AD NINCDS-ARDRA criteria |
Follow-up 36 months
|
MRI (±SD) Sensitivity: 65.9% Specificity: 62.6% |
ADNI = Alzheimer’s Disease Neuroimaging Initiative |
|
Tondelli, 2015 |
Type of study: Patient cohort study
Setting: memory clinic
Country: Italy
Conflicts of interest: none
|
Inclusion criteria: clinical diagnosis of aMCI (single or multiple domain)
Exclusion criteria: not reported
N=71
Prevalence AD: 44% Prevalence other dementias: 24%
Mean age ± SD, sex: MCI-AD: 66.2 ± 9.4 yr, 45% male MCI-NAD: 66.4 ± 7.6, 47% male Stable MCI: 68.1 ± 8.3, 43% male |
CSF Aß42: cutoff <500 pg/ml |
Conversion to AD Not specified Conversion to other dementias Not specified |
Follow-up, mean months (±SD) MCI-AD: 28.2 (4.5) MCI-NAD: 25.5 (1.6) Stable MCI: 27.3 (2.4) |
MCI-AD vs sMCI Aß42 (±CI) Sensitivity: 95.2% Specificity: 80% PPV: 95.2% NPV: 80% |
|
|
Moradi, 2015 |
Type of study: patient cohort study
Setting: ADNI cohort
Country: 6 countries in Europe, USA, Canada
Conflicts of interest: not reported |
Inclusion criteria: published on www.adni-info.org
N=264
Prevalence AD: 62%
Sex, mean age ± SD: Converters: 59% male, 55-89 yr, Nonconverters: 66% male, 57-89 yr |
MRI SPM8 package and VBM8 toolbox (T1-weighted at 1.5T) |
Conversion to AD NINCDS-ARDRA criteria |
Follow-up 36 months
|
MRI Sensitivity: 88.9% Specificity: 51.6% |
ADNI = Alzheimer’s Disease Neuroimaging Initiative |
|
Willette, 2014 |
Type of study: patient cohort study
Setting: ADNI cohort
Country: 6 countries in Europe, USA, Canada
Conflicts of interest: none Type of study:
Setting:
Country:
Conflicts of interest:
|
Inclusion criteria: published on www.adni-info.org
N=162
Prevalence AD: 47%
Sex, mean age ± SD: 34% male, 74.2 ± 7.43 yr,
|
MRI SPM8 package and VBM8 toolbox (T1-weighted at 1.5T) |
Conversion to AD NINCDS-ARDRA criteria |
Follow-up 24 months |
MRI + covariates (age, sex and education) Sensitivity: 68.8% Specificity: 79.3% |
Only adjusted model reported (adjusted for age, sex and education)
ADNI = Alzheimer’s Disease Neuroimaging Initiative |
|
Spulber, 2013 |
Type of study: patient cohort study
Setting: ADNI and ADDNeuroMed cohort
Country: 6 countries in Europe, USA, Canada
Conflicts of interest: none
|
Inclusion criteria: MMSE 24-30, GDS score,<5, ≥65 yr, stable medication and good general health
Exclusion criteria: DSM-IV criteria for dementia, significant neurological or psychiatric illness other than AD, significant unstable systematic illness or organ failure
N=434
Prevalence AD: 40%
Sex, mean age ± SD: Converters: 59% male, 74.3 yr, Nonconverters: 58% male, 74.8 yr |
Structured MRI Cortical thickness and volumetric measures: oa hippocampus, entorhinal cortex, middle temporal gyrus and superior temporal gyrus) (T1-weighted) Method of orthogonal projection to latent structures (OPLS) |
Conversion to AD NINCDS-ARDRA criteria |
Follow-up 36 months
|
OPLS modelling (95% CI) Sensitivity: 69.6% (61.8 to 76.4) Specificity: 66.8% (61.1 to 72.0) |
ADNI = Alzheimer’s Disease Neuroimaging Initiative |
|
Yu, 2012 |
Type of study: patient cohort study
Setting: ADNI cohort
Country: 6 countries in Europe, USA, Canada
Conflicts of interest: not reported |
Inclusion criteria: a MCI (MMSE 24-30, memory complaint, objective memory loss, CDR=0.5), www.adni-info.org
N=63
Prevalence AD: 40%
Sex, mean age ± SD: Converters: 64% male, 74 ± 5.57 yr, Nonconverters: 45% male, 74.8 ± 7.2 yr |
Structural MRI Volumetric SPM8 package and VBM8 toolbox (T1-weighted at 1.5T) |
Conversion to AD NINCDS-ARDRA criteria |
Follow-up 24 months
|
MRI Sensitivity: 76% Specificity: 79%
|
ADNI = Alzheimer’s Disease Neuroimaging Initiative
Biomarkers included in model in addition to ApoE genotype, ADAS-COG and MMSE |
Risk of bias assessment diagnostic accuracy studies (QUADAS II, 2011)
|
Study reference |
Patient selection
|
Index test |
Reference standard |
Flow and timing |
Comments with respect to applicability |
|
Mazzeo, 2016 |
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Yes |
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? No |
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: LOW
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
|
Korolev, 2016 |
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes |
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? No
|
Is the reference standard likely to correctly classify the target condition? No
Were the reference standard results interpreted without knowledge of the results of the index test? Yes |
Was there an appropriate interval between index test(s) and reference standard? No
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Ye
|
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
Xu, 2016 |
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes |
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? No |
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes |
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
Tondelli, 2015 |
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Unclear |
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Yes |
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear |
Was there an appropriate interval between index test(s) and reference standard? No
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: LOW |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
Ito, 2015 |
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? No |
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear |
Was there an appropriate interval between index test(s) and reference standard? No
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? No |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
Moradi, 2015 |
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes |
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? No |
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes |
Was there an appropriate interval between index test(s) and reference standard? No
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
Willette, 2014 |
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes |
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? No
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes |
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
Spulber, 2013 |
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes |
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? No |
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Ye |
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
Yu, 2012 |
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes |
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? No |
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes |
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
Judgments on risk of bias are dependent on the research question: some items are more likely to introduce bias than others, and may be given more weight in the final conclusion on the overall risk of bias per domain:
Patient selection:
- Consecutive or random sample has a low risk to introduce bias.
- A case control design is very likely to overestimate accuracy and thus introduce bias.
- Inappropriate exclusion is likely to introduce bias.
Index test:
- This item is similar to “blinding” in intervention studies. The potential for bias is related to the subjectivity of index test interpretation and the order of testing.
- Selecting the test threshold to optimise sensitivity and/or specificity may lead to overoptimistic estimates of test performance and introduce bias.
Reference standard:
- When the reference standard is not 100% sensitive and 100% specific, disagreements between the index test and reference standard may be incorrect, which increases the risk of bias.
- This item is similar to “blinding” in intervention studies. The potential for bias is related to the subjectivity of index test interpretation and the order of testing.
Flow and timing:
- If there is a delay or if treatment is started between index test and reference standard, misclassification may occur due to recovery or deterioration of the condition, which increases the risk of bias.
- If the results of the index test influence the decision on whether to perform the reference standard or which reference standard is used, estimated diagnostic accuracy may be biased.
- All patients who were recruited into the study should be included in the analysis, if not, the risk of bias is increased.
Judgement on applicability:
Patient selection: there may be concerns regarding applicability if patients included in the study differ from those targeted by the review question, in terms of severity of the target condition, demographic features, presence of differential diagnosis or co-morbidity, setting of the study and previous testing protocols.
Index test: if index tests methods differ from those specified in the review question there may be concerns regarding applicability.
Reference standard: the reference standard may be free of bias but the target condition that it defines may differ from the target condition specified in the review question.
Table of quality assessment for systematic reviews of diagnostic studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Assessment of scientific quality of included studies?5
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?6
Yes/no/unclear |
Potential risk of publication bias taken into account?7
Yes/no/unclear |
Potential conflicts of interest reported?8
Yes/no/unclear |
|
Ritchie, 2017 |
Yes |
Yes |
Yes |
Yes |
Yes |
No |
Yes |
No |
|
Ma, 2015 |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes
|
No (not for included studies) |
|
Smailagic, 2015 |
Yes |
Yes |
Yes |
Yes |
Yes |
No |
No |
No (not for included studies) |
|
Ritchie, 2014 |
Yes |
Yes |
Yes |
Yes |
Yes |
No |
Unclear |
No |
|
Ferreira, 2014 |
Yes |
Yes |
No |
No |
No (only for SR’s) |
Unclear |
No (only for SR’s) |
No (only for SR’s) |
|
Zhang, 2012 |
Yes |
No (not in Medline) |
No |
No |
No (only summarized) |
No |
Yes |
No |
|
Ferreira, 2011 |
Yes |
Yes |
No |
No |
No |
Unclear |
No |
No |
|
Yuan, 2009 |
Yes |
Yes |
Yes |
No |
No |
Unclear |
Yes |
No |
- Research question (PICO) and inclusion criteria should be appropriate (in relation to the research question to be answered in the clinical guideline) and predefined.
- Search period and strategy should be described; at least Medline searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to the research question (PICO) should be reported.
- Quality of individual studies should be assessed using a quality scoring tool or checklist (preferably QUADAS-2; COSMIN checklist for measuring instruments) and taken into account in the evidence synthesis.
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, diagnostic tests (strategy) to allow pooling? For pooled data: at least 5 studies available for pooling; assessment of statistical heterogeneity and, more importantly (see Note), assessment of the reasons for heterogeneity (if present)? Note: sensitivity and specificity depend on the situation in which the test is being used and the thresholds that have been set, and sensitivity and specificity are correlated; therefore, the use of heterogeneity statistics (p-values; I2) is problematic, and rather than testing whether heterogeneity is present, heterogeneity should be assessed by eye-balling (degree of overlap of confidence intervals in Forest plot), and the reasons for heterogeneity should be examined.
- There is no clear evidence for publication bias in diagnostic studies, and an ongoing discussion on which statistical method should be used. Tests to identify publication bias are likely to give false-positive results, among available tests, Deeks’ test is most valid. Irrespective of the use of statistical methods, you may score “Yes” if the authors discuss the potential risk of publication bias.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 04-09-2018
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2023 bepaalt het bestuur van de Nederlandse Vereniging voor Neurologie of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Neurologie is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel was om de bestaande richtlijn dementie aan te vullen met een aantal modules over MCI. In de multidisciplinaire richtlijn dementie is ervoor gekozen om MCI buiten beschouwing te laten. Voor de clinicus practicus die werkt op een geheugenpoli betreft dit echter een grote groep patiënten. Ook in de Standaard Dementie van het Nederlands Huisartsen Genootschap is aandacht voor MCI zeer beperkt. De modules over MCI zullen ontwikkeld worden onder verantwoordelijkheid van de in stand gehouden kerngroep van de richtlijn dementie.
Doelgroep
De modules zijn bedoeld voor alle betrokkenen bij de diagnostiek, behandeling en begeleiding van patiënten met MCI.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2016 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor, of te maken hebben met patiënten met MCI.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Prof. dr. Ph. (Philip) Scheltens, neuroloog, werkzaam in het VU medisch centrum te Amsterdam, voorzitter (NVN)
- Drs. B.A. (Bregje) Appels, klinisch neuropsycholoog, werkzaam in MC Slotervaart te Amsterdam (NIP)
- Prof. dr. B.N.M. (Bart) van Berckel, nucleair geneeskundige, werkzaam in het VU medisch centrum te Amsterdam (NVNG)
- Dr. J.A.H.R. (Jurgen) Claassen, klinisch geriater, werkzaam in het Radboud Universitair Medisch Centrum te Nijmegen (NVKG)
- Dr. H.L. (Dineke) Koek, klinisch geriater, werkzaam in het UMC Utrecht te Utrecht (NVKG)
- Dr. M. (Marieke) Perry, huisarts en senior onderzoeker, werkzaam in het Radboud Universitair Medisch Centrum te Nijmegen (NHG)
- Dr. ir. M.M. (Marcel) Verbeek, neurochemicus, werkzaam in het Radboud Universitair Medisch Centrum te Nijmegen (NVKC)
- Prof. F.R.J. (Frans) Verhey, neuroloog en psychiater, werkzaam in het Maastrichts Universitair Medisch Centrum te Maastricht (NVvP)
- Prof. dr. M.W. (Meike) Vernooij, neuroradioloog, werkzaam in het Erasmus MC te Rotterdam (NVvR)
- Dr. J.M. (Jorien) Willems, internist-ouderengeneeskunde, werkzaam in het Elisabeth-TweeSteden Ziekenhuis te Tilburg (NIV)
Meelezers:
- Dr. C.M.A.A. (Gerwin) Roks, neuroloog, werkzaam in het St. Elisabeth ziekenhuis (NVN)
- Alzheimer Nederland
Met ondersteuning van:
- Dr. J. (Janneke) Hoogervorst-Schilp, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- P.H. (Pieter) Broos MSc, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- D.H.H. (Dunja) Dreesens MSc, MA, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Berckel, Van |
|
Docent voor PIRAMAL en GE, echter geen persoonlijke betaling maar aan Industry Alliance Office van het Vumc. |
PIRAMAL, GE en AVID financieren diverse projecten in het Vumc |
Geen actie |
|
Vernooij |
- Neuroradioloog |
Geen |
Geen |
Geen actie |
|
Willems |
Internist-ouderengeneeskunde |
Geen |
Geen |
Geen actie |
|
Appels |
Klinisch neuropsycholoog in Medisch Centrum Slotervaart |
Geen |
Geen |
Geen actie |
|
Scheltens |
Neuroloog en directeur Alzheimercentrum Vumc Amsterdam |
- Bestuurslid KNAW (0,2 fte betaald aan Vumc) |
- Directeur Alzheimercentrum Amsterdam - Vice-voorzitter Deltaplan Dementie - Lid RVC en Brain Research Center - Dutch Flutemetamol Onderzoek (GE Healthcare en Alzheimer Nederland - Via het Industry Alliance Office van Vumc verricht ik consultancy activiteiten voor: EIP Pharma, Novartis Cardio, Probiodrug AG, Roche en Biogen. Tevens Co-PI van de EU-IMI projecten EPAD, AMYPAD en EMIF-AD. |
Geen actie |
|
Verhey |
Psychiater |
Geen |
Geen |
Geen actie |
|
Claassen |
Klinisch geriater, onderzoeker |
Geen |
Onderzoek gefinancierd door Alzheimer Nederland (onderzoek naar de relatie tussen slaap(stoornis) en Alzheimer) |
Geen actie |
|
Koek |
Lid werkgroep namens de NVKG |
Geen |
- Onderzoek gefinancierd door Alzheimer Nederland (Pl) |
Geen actie |
|
Verbeek |
UHD - Radboudumc, Nijmegen |
Geen |
|
Geen actie |
|
Perry |
- Huisarts in Zevenaar |
- Expertfunctie website dementie.nl van Alzheimer Nederland (vrijwillig) |
- Expertisefunctie website dementie.nl voor Alzheimer Nederland - Gieskes Strijbis fonds - DementieNet (ik ben niet de projectleider) - ZonMw project ism met het MUMC+ over gezamenlijke besluitvorming tav diagnostiek bij geheugenklachten in de eerstelijn (geen projectleider). |
Geen actie |
|
Roks |
Neuroloog |
Lid METC Brabant |
Deelname Lipididiet studie. Onderzoek naar effect van souvenaid op MCI met tekenen van M. Alzheimer. Hier 2 perioden in gemandateerd. Kwestie is reeds beëindigd |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het meelezen van teksten door Alzheimer Nederland. Het conceptaddendum is tevens voor commentaar voorgelegd aan Alzheimer Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens is er een knelpuntenanalyse gehouden om te inventariseren welke knelpunten er in de praktijk bestaan rondom de zorg voor patiënten met MCI. De knelpuntenanalyse vond tijdens een Invitational conference plaats. Hiervoor werden alle belanghebbende partijen (stakeholders) uitgenodigd. Knelpunten konden zowel medisch inhoudelijk zijn, als betrekking hebben op andere aspecten zoals organisatie van zorg, informatieoverdracht of implementatie.
De volgende partijen waren aanwezig en hebben knelpunten aangedragen: Zorginstituut Nederland, Zorgverzekeraars Nederland, ActiZ, Alzheimer Nederland, Nederlands Instituut van Psychologen, Verpleegkundigen & Verzorgenden Nederland, Nederlandse Vereniging voor Neurologie, Nederlandse Vereniging voor Klinische Geriatrie, Nederlandse Vereniging voor Nucleaire Geneeskunde, Nederlandse Vereniging voor Psychiatrie en Nederlandse Vereniging voor Radiologie. Een verslag van de Invitational conference is opgenomen in de aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. De werkgroep besloot voor welke uitgangsvragen een systematische zoekactie werd opgezet en welke uitgangsvragen zonder systematische zoekactie werden beantwoord. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen en naar systematische reviews in Medline (OVID) en Cochrane. Vervolgens werd voor een aantal afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie is opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische testen, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in één of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is voor een aantal uitgangsvragen systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Practice Guideline Update Summary: Mild Cognitive Impairment. American Academy of Neurology. https://www.aan.com/Guidelines/Home/GetGuidelineContent/887. 2018.
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwaliteit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html. 2012.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2013.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID) – december 2016
|
1 exp *Mild Cognitive Impairment/ or 'mild cognitive impairment'.ab,ti. or mci.ti. or 'preclinical dementia'.ab,ti. (13984) 2 exp *Biomarkers/ or exp *Magnetic Resonance Imaging/ or exp *Cerebrospinal Fluid/ or exp *Positron-Emission Tomography/ or exp *Amyloid beta-Peptides/ or exp *Tomography, Emission-Computed, Single-Photon/ or biomarker*.ti. or biological marker*.ti. or diagnostic marker*.ti. or imaging marker*.ti. or magnetic resonance imaging.ti. or mri.ti. or amyloid beta protein.ti. or beta amyloid.ti. or tau protein.ti. or phosphorylated tau.ti. or hippocampal atrophy.ti. or hippocampal volume.ti. or medial temporal atrophy.ti. or brain atrophy.ti. or 'cerebrospinal fluid'.ti. or csf.ti. or 'positron emission tomography'.ti. or amyloid imaging.ti. or spect.ti. (642550) 3 1 and 2 (2672) 4 limit 3 to english language (2613) 5 4 not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (2534) 6 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) 7 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1761272)
= 535 (383 uniek) |
659 |
|
Embase (Elsevier) |
('mild cognitive impairment'/exp/mj OR 'mild cognitive impairment':ab,ti OR mci:ti OR 'preclinical dementia':ab,ti) AND ('biological marker'/exp/mj OR biomarker*:ab,ti OR 'biological marker*':ab,ti OR 'diagnostic marker*':ab,ti OR 'imaging marker*':ab,ti OR 'nuclear magnetic resonance imaging'/exp/mj OR 'magnetic resonance imaging':ti OR mri:ti OR (hippocampal NEAR/2 (atrophy OR volume)):ti OR 'medial temporal atrophy':ti OR 'brain atrophy'/exp/mj OR 'brain atrophy':ti OR 'cerebrospinal fluid'/exp/mj OR 'cerebrospinal fluid':ti OR csf:ti OR 'amyloid beta protein(1-42)'/exp/mj OR 'amyloid beta protein(1-40)'/exp/mj OR 'amyloid beta protein'/exp/mj OR 'amyloid beta protein':ti OR 'beta amyloid':ti OR 'tau protein'/exp/mj OR 'tau protein':ti OR 'phosphorylated tau':ti OR 'positron emission tomography'/exp/mj OR 'positron emission tomography':ti OR pet:ti OR 'amyloid imaging':ti OR 'spect scanner'/exp/mj OR spect:ti) AND (english)/lim NOT ‘conference abstract’:it
Gebruikte filters: Systematische reviews: 'meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp)
RCTs: 'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti NOT 'conference abstract':it
= 434 (424 uniek) |
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Mogelijke systematische reviews |
|
|
Wang, 2016 |
P: AD patients |
|
Ruan, 2016a |
P: screening of cognitive frailty |
|
Ruan, 2016b |
No systematic review |
|
Olsson, 2016 |
P: Alzheimer disease. MCI as subgroup |
|
Martínez, 2016 |
Study protocol |
|
Zhou, 2015 |
No SR or meta-analysis. I: resting state functional MRI |
|
Wu, 2015 |
MicroRNA as biomarker |
|
Tam, 2015 |
No SR or meta-analysis. I: Resting-state functional connectivity |
|
Tabatabaei-Jafari, 2015 |
MCI-related brain changes/atrophy |
|
Petrou, 2015 |
Prevalence of AD in patients with Parkinson and MCI (subgroup) |
|
Mo, 2015 |
P: AD patients |
|
Li, 2015 |
Brain network dysfunction: no diagnostics |
|
Kishi, 2015 |
RCT’s van effect van anti-dementie medicatie |
|
Jansen, 2015 |
Prevalence of amyloid pathology among MCI patients (subgroup) |
|
He, 2015 |
comparison AD and MCI, not etiology or prediciton or conversion |
|
Donagy, 2015 |
Prodromal dementia with Lewy bodies |
|
Colijn, 2015 |
P: CSI patients |
|
Cha, 2015 |
comparison AD MCI and control, not etiology or prediction or conversion |
|
Zhu, 2014 |
connectomes-scale assessment. MCI vs control |
|
Zhang, 2014 |
Same studies included as Ma, 2015 |
|
Tang, 2014a |
difference in p-tau levels in AD vs MCI |
|
Tang, 2014b |
difference in CSF AF42 concentrations in AD vs MCI |
|
Seiler, 2014 |
P: no MCI. I: Magnetization transfer imaging (MTI) |
|
Perani, 2014 |
P: no MCI patients. Diagnosis of AD |
|
Ferreira, 2014a |
Meta-review |
|
Ferreira, 2014b |
R of SR's CSF (Ab42, T-tau,and/orP-tau). SR van Ritchie 2017 is recenter |
|
Davison, 2014 |
Only diagnostics |
|
Chen, 2014 |
I: PET (pittsburgh compound B retention). |
|
Nho, 2013 |
I: apolipoprotein E |
|
Browndyke, 2013 |
BOLD MRI |
|
Wolz, 2012 |
Framework for extraction of biomarkers |
|
Ikram, 2012 |
I: retinal pathology |
|
Filippi, 2012 |
P: AD patients |
|
Clerx, 2012 |
I: diffusion tensor imaging. Comparison MCI and controls |
|
Caroli, 2012 |
PET data analysis techniques |
|
Sexton, 2011 |
Diffusion tension imaging |
|
Quigley, 2011 |
amyloid deposition in AD, DLB and MCI (not etiology or progression) |
|
Bloudek, 2011 |
P: MCI not analyzed separately |
|
Van Rossum, 2010 |
No diagnostic accuracy data. Selection of studies not described |
|
Schmand, 2010 |
P: not demented at baseline, some declined to MCI during follow-up |
|
Shi, 2009 |
Normal controls |
|
Schroeter, 2009 |
I: quantitative automated whole brain analysis |
|
Mitchel, 2009 |
Subgroup MCI progress to dementia |
|
Diniz, 2008 |
Old SR |
|
Modrego, 2006 |
I: not specific biomarkers. No SR |
|
Mosconi, 2004 |
Expert review |
|
Wolf, 2003 |
No SR, >10 yr |
|
Mogelijke RCT’s |
|
|
Zwan, 2016 |
Determine cutpoints for CSF markers |
|
Yamane, 2016 |
Interrater variability |
|
Tuokkola, 2016 |
I: MRI. MCI vs healthy control |
|
Tong, 2016 |
Only AUC reported, no Sens/Spec |
|
Spampinato, 2016 |
No diagnostic accuracy data |
|
Song, 2016 |
P: subjective memory impairment |
|
Sierra-Rio, 2016 |
subjective cognitive decline OR MCI |
|
Pietrzak, 2016 |
P: healthy elderly |
|
Petersen, 2016a |
P: healthy elderly |
|
Petersen, 2016b |
No primary study |
|
Mattson, 2016 |
No progression. Plasma tau in AD patients |
|
Landau, 2016 |
No progression |
|
Kim, 2016 |
No prediction of AD |
|
Hua, 2016 |
Treatment effect in AD patients |
|
Gupta, 2016 |
MCI vs control |
|
Ferreira, 2016 |
Focus on EEG |
|
DeMarshall, 2016 |
No progression to AD |
|
Degerman, 2016 |
Conversion to moderate dementia |
|
Chen, 2016 |
Study protocol |
|
Burnham, 2016 |
O: cognitive decline |
|
Alexopoulos, 2016 |
CSF. No diagnostic accuracy data |
|
Ziegler, 2015 |
No progression to AD |
|
Xekardaki, 2015 |
I: arterial spin labeling |
|
Wolfsgruber, 2015 |
O: abormal CSF biomarkers |
|
Weise, 2015 |
P: AD patients |
|
Varon, 2015 |
No diagnostic accuracy data |
|
Struyfs, 2015 |
No conversion to AD |
|
Schreiber, 2015 |
Comparison 2 PET techniques |
|
Salvatore, 2015 |
MRI; machine learning algorithm |
|
Pietrzak, 2015 |
P: healthy elderly |
|
Palmqvist, 2015 |
C: healthy elderly |
|
Ong, 2015 |
FBB-PET. Only PPV and NPV reported |
|
Olazarán, 2015 |
I: blood based |
|
Namiki, 2015 |
No conversion to AD |
|
Morenas, 2015 |
No conversion to AD |
|
Michaud, 2015 |
6-year follow up analyzed |
|
Maestu, 2015 |
I: Magnetoencephalography |
|
Lorenzi, 2015 |
AD stages |
|
Lehallier, 2015 |
I: MRI, CSF. No diagnostic accuracy data |
|
Kloppel, 2015 |
computer tool |
|
Ithapu, 2015 |
learning algorithm |
|
Gorji, 2015 |
diagnosis of MCI |
|
Ewers, 2015 |
differentiatie AD from other forms of dementia (incl MCI) |
|
Egli, 2015 |
Combined: cognitive, imaging and CSF |
|
Edwards, 2015 |
No conversion to AD |
|
Cherbuin, 2015 |
subjective memory decline prediction of hippocampal atrophy |
|
Caroli, 2015 |
No conversion to AD |
|
Bron, 2015 |
No conversion to AD |
|
Brocchetta, 2015 |
availability and frequency of use of markers |
|
Blennow, 2015 |
No primary study |
|
Bertens, 2015 |
biomarkers and cognitive markers as outcome |
|
Yu, 2014 |
No conversion to AD |
|
Yamane, 2014 |
inter-rater variability in the interpretation of (18)F-FDG-PET images |
|
Tosun, 2014 |
Predict amyloid status |
|
Thurfjell, 2014 |
No progression to AD |
|
Sun, 2014 |
TACE activity. No progression to AD |
|
Palmqvist, 2014 |
O: brain amyloid detection |
|
Liang, 2014 |
Brain changes in early and late MCI |
|
Hye, 2014 |
Plasma proteins |
|
Ellis, 2014 |
cognitive profiles |
|
Doraiswamy, 2014 |
O; change in cognition (not AD) |
|
Dodge, 2014 |
P: no MCI patients. O: cognitive decline |
|
Balasa, 2014 |
SR Ritchie 2017 used for CSF |
|
Wiest, 2013 |
only 18 MCI patients. MCI vs AD |
|
Wang, 2013 |
normal elderly as control |
|
Villemagne, 2013 |
No conversion to AD |
|
Tripathi, 2013 |
No conversion to AD |
|
Tosun, 2013 |
No conversion to AD |
|
Shokouhi, 2013 |
No conversion to AD |
|
Rowe, 2013a |
No conversion to AD |
|
Rowe, 2013b |
SR Ritchie 2017 used for CSF |
|
Rosenberg, 2013 |
P: no MCI patients |
|
Richard, 2013 |
Difference in MRI after memory test, |
|
Prestia, 2013 |
P: biomarker positivity |
|
Ossenkoppele, 2013 |
No conversion to AD |
|
Nordberg, 2013 |
No conversion to AD |
|
Moretti, 2013 |
EEG |
|
Mathis, 2013 |
P: nondemented elderly |
|
Landau, 2013 |
No conversion to AD |
|
Duara, 2013a |
Age cut-offs for visual rating of medical temporal atrophy |
|
Duara, 2013b |
No diagnostic accuracy data |
|
Amlien, 2013 |
O: white matter integrity |
|
Albin, 2013 |
<2014 PET study (SR Ma, 2016) |
|
Aquilar, 2013 |
|
|
Palmqvist, 2012 |
Focus cognitive tests |
|
Ossenkoppele, 2012 |
P: only 12 MCI patients |
|
Mattsson, 2012a |
Age effect. SR Ritchie 2017 used for CSF |
|
Mattsson, 2012b |
P: 30 MCI patients |
|
Gray, 2012 |
Check full tekst: n patients? Prediction AD? |
|
Doraiswamy, 2012 |
<2014 PET study (SR Ma, 2016) |
|
Carter, 2012 |
Cross-sectional study |
|
Westman, 2011 |
<2009 MRI study (SR Yuan, 2009) |
|
Toledo, 2011 |
I: Abeta plasma measurement. Correlated with PET, MRI and CSF |
|
Spampinato, 2011 |
No diagnostic accuracy data |
|
Sabuncu, 2011 |
P: AD patients |
|
Perrin, 2011 |
P: mild AD patients |
|
Okonkwo, 2011 |
SR Ritchie 2017 used for CSF |
|
McEvoy, 2011 |
Risk score of conversion to AD. No prospective value calculated |
|
Jahn, 2011 |
Testing new method |
|
Jack, 2011 |
AD patients |
|
Herzholz, 2011 |
<2014 PET study (SR Ma, 2016) |
|
Habert, 2011 |
I: SPECT |
|
Vermuri, 2010 |
No prediction of dementia (change measured within MCI group) |
|
Tosun, 2010 |
No prediction of progression to dementia |
|
Samaranch, 2010 |
APOE and MAPT |
|
Risacher, 2010 |
No diagnostic accuracy data |
|
Papaliagkas, 2010 |
SR Ritchie 2017 used for CSF |
|
Okonkwo, 2010a |
O: Functional decline (association MRI with functional decline) |
|
Okonkwo, 2010b |
O: Functional decline (association CSF with functional decline) |
|
Nettiksimmons, 2010 |
No diagnostic accuracy data |
|
Liu, 2010 |
<2011 MRI study (SR Ferreira, 2011) |
|
Leung, 2010 |
<2009 MRI study (SR Ferreira, 2011) |
|
Haller, 2010 |
O: cognitive decline |
|
Devanand, 2010 |
I: SPECT |
|
Desikan, 2010 |
No diagnostic accuracy data. I: MRI (medialtemporal, fronto-parietoccipital and lateral temporal factor), CSF and PET |
|
Apostolova, 2010 |
No diagnostic accracy data. I: MRI (hippocampal atrophy). O: conversion to AD |
|
Visser, 2009 |
SR Ritchie 2017 used for CSF |
|
Vemuri, 2009 |
Comparison MRI and CSF, cox proportional hazard-models |
|
Shaw, 2009 |
SR Ritchie 2017 used for CSF |
|
Risacher, 2009 |
In SR Ruan, 2016 |
|
Querbes, 2009 |
No diagnostic accuracy data |
|
Morra, 2009 |
subgroup analysis MCI |
|
Mattsson, 2009 |
SR Ritchie 2017 used for CSF |
|
Ferrarini, 2009 |
<2009 MRI study (SR Yuan, 2009) |
|
Davatzikos, 2009 |
I: MRI. Check outcome (discriminating normal from MCI, cognitive decline) |
|
Bakkour, 2009 |
P: questionable AD dementia. I: MRI |
|
Abdullah, 2009 |
Check subgroup analysis MCI (normal patients conversion to MCI/AD) |
|
Miller, 2008 |
P: 25 MCI patient. I: fMRI |
|
Lewczuk, 2008 |
SR Ritchie 2017 used for CSF |
|
Fleisher, 2008 |
<2009 MRI study (SR Yuan, 2009) |
|
Van de Pol, 2007a |
O: hippocampal atrophy |
|
Van de Pol, 2007b |
O: cognition |
|
Ewers, 2007 |
SR Ritchie 2017 used for CSF |
|
DeCarli, 2007 |
<2009 MRI study (SR Yuan, 2009) |
|
Geroldi, 2006 |
In SR Yuan, 2009 |
|
Fellgiebel, 2006 |
<2009 MRI study (SR Yuan, 2009) |
|
Borroni, 2006 |
combination SPECT and memory scores |
|
Apostolova, 2006 |
P: only 20 MCI patients |
|
Chételat, 2005 |
P: only 18 MCI patients |
|
Mosconi, 2004 |
>10 y |
|
Maruyama, 2004 |
>10 y |
|
Huang, 2003 |
>10 y |
|
Encinas, 2003 |
>10 y |
|
Andreasen, 2003 |
>10 y |
|
Riemenschneider, 2002 |
>10 y |
|
Grundman, 2002 |
>10 y |
|
Visser, 1999 |
>10 y |
