Methode bemonstering GI endoscoop
Uitgangsvraag
Op welke wijze worden flexibele thermolabiele hoog-risico gastro-intestinale endoscopen bemonsterd?
Aanbeveling
Minimale criteria voor afnemen van kweken van flexibele endoscopen zijn:
Afname gebeurt conform het SFERD-handboek.
De wijze van afname en transport valt onder de verantwoordelijkheid van de deskundige scopen reiniging en desinfectie (DSRD).
Minimale criteria voor de ruimte waar kweek wordt afgenomen zijn:
Bemonster in een aparte schone ruimte.
Minimale criteria voor bemonstering endoscopen
Zie SFERD handboek (bijlage 8).
Moment van bemonstering
Bepaal per instelling de kweekmomenten in verhouding endoscopen uit de droogkast versus kweken endoscopen direct uit de desinfector, zoals deze in de dagelijkse praktijk bij de patiënt worden gebruikt.
Wijze van bemonstering endoscopen
Leg de procedure van bemonstering, conform deze richtlijn, vast in een protocol.
Bemonster alle open kanalen van de endoscoop apart door deze te spoelen, met een potje per kanaal.
Volume vloeistof: 20 mL per kanaal.
Gebruik een steriele vloeistof zoals fysiologisch zout, fosfaatgebufferde zoutoplossing (PBS) of water om een endoscoop te bemonsteren.
Bemonster de tip van de endoscoop met een swab.
Transport
Breng de bemonsteringsvloeistof en swab’s meteen naar het laboratorium conform afspraken transport afname patiëntmateriaal in het ziekenhuis.
Overwegingen
Kwaliteit van bewijs
De kwaliteit van het bewijs is zeer laag, deels vanwege beperkingen in opzet en uitvoering van de studies, deels omdat door de relatief kleine studieomvang alle geschatte effecten zeer onnauwkeurig (wijd betrouwbaarheidsinterval) zijn.
Waarden en voorkeuren
Niet van toepassing, omdat de aanbevelingen niet op het niveau van de individuele patiënt zijn maar op het niveau van het laboratorium.
Professioneel perspectief
Minimale criteria ten aanzien van afnemen van kweken voor medewerkers voor reiniging
en desinfectie van flexibele endoscopen
Een medewerker die de kweken afneemt moet kennis hebben van de endoscopen in het eigen ziekenhuis. Daarom is het belangrijk dat werken met deze endoscopen tot de reguliere werkzaamheden van desbetreffende medewerkers behoort. De afname dient met 2 personen te worden uitgevoerd, zodat de (microbiologische) kwaliteit van de bemonstering is geborgd.
Minimale criteria voor de ruimte waar kweek wordt afgenomen zijn
De ruimte waarin de kweken worden afgenomen moet vrij zijn van mogelijke bronnen van contaminatie van de bemonsteringsvloeistof. Dat wil dus zeggen dat de ruimte 1) huishoudelijk schoon is; 2) niet door anderen wordt gebruikt op het moment van bemonstering en 3) geen grote lucht- of waterstromingen heeft (bijvoorbeeld: niet onder een ventilatiekanaal of naast een stromende kraan bemonsteren).
Minimale criteria voor aseptische bemonstering endoscopen
De kweken dienen zodanig te worden afgenomen dat het kweekmateriaal niet met micro-organismen uit de omgeving of van de medewerker kan worden besmet. Daarom is het belangrijk dat ten aanzien van persoonlijke beschermingsmiddelen, werkveld en materialen gewerkt wordt conform SFERD-handboek en WIP Richtlijn Handhygiëne medewerkers, WIP Richtlijn Persoonlijke hygiëne medewerkers en WIP Richtlijn Persoonlijke beschermingsmiddelen.
Moment van bemonstering
Bij afname van de kweek dient te worden aangegeven of de endoscoop wel of niet de hele droogcyclus in de droogkast heeft doorgemaakt, ofwel zoals deze vlak voor gebruik bij de patiënt wordt aangeboden. Streef hierbij de kweekmomenten na in verhouding endoscopen uit droogkast versus kweken endoscopen uit desinfector zoals gebruikt in de dagelijkse praktijk.
Wijze van bemonstering endoscopen
Fysiologisch zout, PBS, water: het is de verwachting dat met fysiologisch zout en in PBS bacteriën beter overleven en dat meer substantie uit de kanalen losgeweekt kan worden dan met water. In internationale richtlijnen worden zowel fysiologisch zout, steriel water en PBS met 0.02% Tween gebruikt als bemonsteringsvloeistof.
Tween 80 in zout opgelost: de resultaten uit het onderzoek (Aumeran et al., 2012) zijn veelbelovend, omdat de kweekopbrengst hoger lijkt te zijn. Daarom is het belangrijk dat er meer onderzoek komt om de studieresultaten te bevestigen of te ontkrachten.
Voor de juiste wijze van bemonstering wordt verwezen naar het SFERD handboek (bijlage 8).
Ragen
Ragen van het biopsie/zuigkanaal: meerdere richtlijnen en surveillance studies bemonsteren het biopsie/zuigkanaal naast het doorspoelen van het kanaal ook met behulp van een rager geschikt voor eenmalig gebruik (Advisory Board Cleaning and Disinfection Flexible Endoscopes (SFERD), 2016; Brandabur et al., 2016; Chapman et al., 2017; Gastroenterological Society of Australia / Gastroenterological Nurses College of Australia, 2010). Het is mogelijk dat deze manier van bemonsteren zorgt voor een hogere kans om contaminatie van het biopsie/zuigkanaal te vinden. De werkgroep is van mening dat het spoelen van het biopsie/zuigkanaal afdoende is. Afzonderlijke centra kunnen overwegen om de biopsie/zuigkanaal rager toe te voegen aan de wijze van bemonstering.
Transport
Volgens de in de instelling geldende voorschriften voor het transport van patiënten monstermateriaal.
Kosten en middelen
Indien een ziekenhuis het kweken van endoscopen niet reeds procedureel heeft ingevoerd zal, door de implementatie van deze richtlijn, rekening gehouden moeten worden met extra kosten (door bijvoorbeeld tijd en mankracht tijdens de afname, extra kweekmaterialen en de verwerking van de kweek op het laboratorium).
Aanvaardbaarheid van de conceptaanbeveling(-en) voor de belanghebbenden
Door het uitvoeren van deze landelijk geaccepteerde methode kunnen eenduidige acties genomen worden bij afwijkende kweekwaarden, en kan de microbiologische veiligheid geborgd worden voor een scopie. Hierdoor is de patiëntveiligheid beheersbaar en heeft men inzicht in het ontstaan en voorkomen en voorkomen van ziekenhuisinfecties.
Haalbaarheid van de te implementeren conceptaanbeveling(-en)
Voor de afname van de kweken zijn alle benodigde materialen reeds voorhanden. Indien het personeel getraind is en de kweekafname routinematig en conform protocol uitgevoerd wordt kan men met minimale middelen en inspanning de kweken doen.
Rationale van de aanbeveling(en)
Ten aanzien van type vloeistof:
Bij het opstellen van de aanbevelingen is veel gewicht toegekend aan de geringe huidige bewijslast van de literatuur om tot spoelvloeistoffen met detergens over te gaan. De richtlijncommissie vindt het wel belangrijk dat Tween 80 in studieverband nader onderzocht wordt.
Ten aanzien van DSRD, ruimte, (moment en wijze van) bemonstering en transport:
Deze zijn in lijn met de gebruikelijke werkwijze in Nederlandse ziekenhuizen.
Onderbouwing
Achtergrond
Er is geen gestandaardiseerde methode voor het afnemen van kweken. Hierdoor zijn de kweekresultaten tussen ziekenhuizen niet vergelijkbaar en is er geen gestandaardiseerde uitkomstparameter om de kwaliteit van het R&D proces te toetsen
Definities
- Bemonstering: het op gestandaardiseerde wijze afnemen van kweken van daarvoor aangewezen afnamepunten van een gereinigde en gedesinfecteerde endoscoop.
- Deskundige Scopen Reiniging en Desinfectie (DSRD): de DSRD is aangesteld als onafhankelijke functionaris en heeft een toezichthoudende beleidsadviserende en controlerende taak, op het gebied van reiniging en desinfectie van flexibele scopen. Functionaris is medeverantwoordelijk voor de verwerving, beheer en borging van alle apparatuur en hulpmiddelen behorend bij flexibele scopen.
Conclusies / Summary of Findings
1) Fysiologisch zout + detergens versus fysiologisch zout alleen
|
Zeer laag GRADE |
Voor endoscopen die het hele reinigings- en desinfectieproces hebben doorlopen Gecontamineerde endoscopen, totaal aantal bacteriën Bemonstering met een 0.5% Tween 80 oplossing ten opzichte van een zoutoplossing lijkt te resulteren in een hoger percentage positieve endoscopen en in een hoger aantal KVE per positieve endoscoop. Bron Aumeran et al, 2012 |
2) steriel water + detergens versus steriel water
|
- |
Er werden geen studies gevonden waarin bemonstering met steriel water met detergens vergeleken is met steriel water zonder detergens. |
3) fosfaatgebufferde zoutoplossing (PBS) + detergens versus fosfaatgebufferde zoutoplossing
|
- |
Er werden geen studies gevonden waarin bemonstering met fosfaatgebufferde zoutoplossing met detergens vergeleken is met een fosfaatgebufferde zoutoplossing zonder detergens. |
Samenvatting literatuur
1) Fysiologisch zout + detergens versus fysiologisch zout alleen
Een RCT vergeleek bij 50 endoscopen die het hele reinigings- en desinfectieproces hebben doorlopen, bemonstering met een Tween 80 oplossing (0.5%) en NaCl (0.5%) met die van een fysiologisch zoutoplossing (0,9%). Van de 50 endoscopen waren 24 gastro-intestinale endoscopen en 22 bronchoscopen (zie tabel 2 hieronder). Bij 41/50 endoscopen werd desinfectie uitgevoerd in een machinale endoscopendesinfector. 47 van de 50 endoscopen werden bemonsterd 12 uur na scopenopslag (zie tabel 2 hieronder).
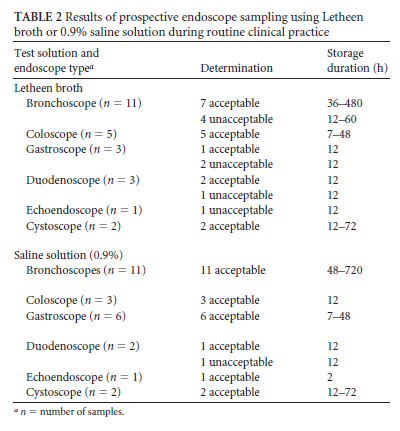
Gecontamineerde endoscopen
Een endoscoop werd als gecontamineerd beschouwd bij meer dan 5 KVE/100 mL of bij aanwezigheid van pathogenen: enterobacteriaceae, Pseudomonas aeruginosa, Staphylococcus aureus, Aspergillus spp. en gisten. In de studie is het aantal gecontamineerde endoscopen 8 maal hoger wanneer een endoscoop bemonsterd wordt met een Tween-oplossing ten opzichte van een zoutoplossing (zie figuur 1).
Figuur 1 Gecontamineerde scopen

Totaal aantal bacteriën
In de groep bemonstering met Tween-oplossing werden bij de 25 endoscopen 281 CFU/100mL gekweekt, in de groep bemonstering met zoutoplossing waren dat 19 CFU/100mL, statistisch significant (p=0.001).
Indirect bewijs:
Sequentiële experimentele studie: Aumeran (2012) onderzocht de recuperatie van een Pseudomonas biofilm aan de binnenzijde van een flexibele teflonbuis voor verschillende bemonsteringsvloeistoffen: een Tween 80 oplossing (0.5%), een zoutoplossing en steriel water (3 proefnemingen). Bij iedere proefneming diende het aantal Pseudomonas KVE dat oorspronkelijk in de biofilm aanwezig was, als controle. Dit aantal KVE werd bepaald door het gemiddelde aantal Pseudomonas KVE te bereken dat verkregen werd op 3 verschillende plaatsen van de teflonbuis: twee aan de uiteindes en één in het midden. De onderzoeksresultaten lieten zien dat de bacterieopbrengst significant hoger was bij bemonstering met een Tween 80 oplossing (zie tabel 1 hieronder). Deze bevindingen liggen in lijn met de resultaten van het RCT.
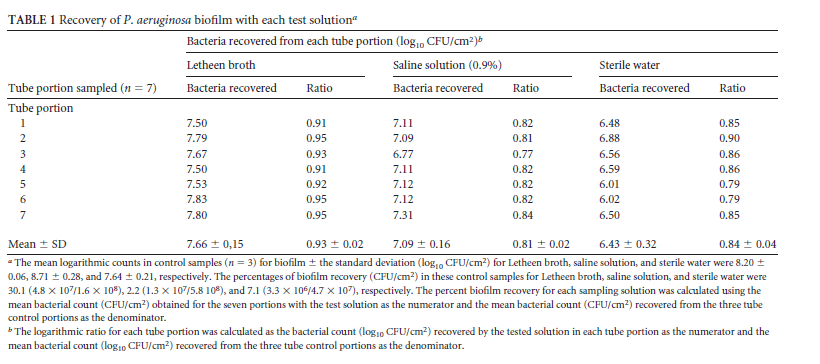
Bewijskracht van de literatuur
Gecontamineerde endoscopen, totaal aantal bacteriën
De bewijskracht voor de uitkomstmaten ‘gecontamineerde endoscopen’ en ‘totaal aantal bacteriën’
verandert van hoog naar zeer laag, omdat het onduidelijk is of de randomisatie geblindeerd was (beperkingen in onderzoeksopzet). De werkgroep vindt blindering van de randomisatie belangrijk, omdat het een onderzoek betreft van een commercieel verkrijgbare oplossing. Ook is het onduidelijk of de onderzoeksgroepen vergelijkbaar waren qua contaminatiegraad, omdat niet eenzelfde desinfectieprocedure werd gehandhaafd en het tijdstip van bemonstering na scopenopslag niet hetzelfde was. Tevens is het aantal onderzochte endoscopen klein en het 95% BI breed (imprecisie). De werkgroep is van mening dat de onderzoeksresultaten niet zonder meer extrapoleerbaar zijn naar de Nederlandse situatie, omdat in de studie andere criteria voor een gecontamineerde endoscoop werden gebruikt (> 5 KVE per 100 mL) dan de criteria waarvoor de werkgroep heeft gekozen (≥ 20 KVE/20mL).
2) steriel water + detergens versus steriel water
Er werden geen studies gevonden die voldeden aan de inclusiecriteria.
3) fosfaatgebufferde zoutoplossing (PBS) + detergens versus fosfaatgebufferde zoutoplossing
Er werden geen studies gevonden die voldeden aan de inclusiecriteria.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden heeft de werkgroep drie systematische literatuuranalyses gepland met de volgende PICO-vraagstellingen:
- Wat is het effect van bemonstering van flexibele gastro-intestinale scopen* met steriel water en een detergens, zoals Tween 80 of Triton X100, in vergelijking met alleen steriel water op de microbiologische controle van het hele decontaminatieproces (zie tabel hieronder)?
- Wat is het effect van bemonstering van flexibele gastro-intestinale scopen* met fysiologisch zout en een detergens, zoals Tween 80 of Triton X100, in vergelijking met alleen fysiologisch zout op de microbiologische controle van het hele decontaminatieproces (zie tabel hieronder)?
- Wat is het effect van bemonstering van flexibele gastro-intestinale scopen* met fosfaatgebufferde zoutoplossing (PBS) en een detergens, zoals Tween 80 of Triton X100, in vergelijking met alleen PBS op de microbiologische controle van het hele decontaminatieproces (zie tabel hieronder)?
*scopen die het reinigings- en desinfectieproces hebben doorlopen.
Selectiecriteria:
|
Type studies |
|
|
Onderzoeksobject |
|
|
Interventie/control |
|
|
Type uitkomstmaten |
|
|
Type setting |
|
|
Exclusiecriteria |
|
In de databases Medline (OVID) en Embase is vanaf 1946/1980 gezocht naar het type spoelvloeistoffen bij bemonstering van flexibele endoscopen. De literatuurzoekactie leverde 158 treffers op. Drie studies werden geselecteerd op basis van titel en abstract (Rutala et al, 2004; Alfa et al, 2014; Aumeran et al, 2012). Na het lezen van de volledige artikelen voldeed alleen de studie van Aumeran (2012) aan de selectiecriteria en is dus opgenomen in de literatuuranalyse van de werkgroep. Ter informatie: de studie van Aumeran (2012) omvat 2 studies: een experimentele studie en een RCT. De experimentele studie is alleen als indirect bewijs meegenomen.
De redenen voor exclusie kunt u vinden in de zoekverantwoording van deze module.
Referenties
- Advisory Board Cleaning and Disinfection Flexible Endoscopes (SFERD). (2016, 01-09-2016). Professional standard handbook. Flexible endoscopes - Cleaning and disinfection. 4.0. Retrieved from https://www.infectiepreventieopleidingen.nl/kennisbank/kennisbank/sferd-handboek-4-0
- Alfa MJ, Alfa MJ. Comparison of clinically relevant benchmarks and channel sampling methods used to assess manual cleaning compliance for flexible gastrointestinal endoscopes. American Journal of Infection Control. 2014; 42[1], e1-e5.
- Aumeran C, Aumeran C. Assessment on experimental bacterial biofilms and in clinical practice of the efficacy of sampling solutions for microbiological testing of endoscopes. Journal of Clinical Microbiology. 2012; 50[3], 938-942.
- Brandabur, J. J., Leggett, J. E., Wang, L., Bartles, R. L., Baxter, L., Diaz, G. A., . . . Oethinger, M. (2016). Surveillance of guideline practices for duodenoscope and linear echoendoscope reprocessing in a large health system. Gastrointestinal endoscopy. doi:http://dx.doi.org/10.1016/j.gie.2016.03.1480
- Chapman, C. G., Siddiqui, U. D., Manzano, M., Konda, V. J., Murillo, C., Landon, E. M., & Waxman, I. (2017). Risk of infection transmission in curvilinear array echoendoscopes: results of a prospective reprocessing and culture registry. Gastrointestinal endoscopy, 85(2), 390-397.e391. doi:http://dx.doi.org/10.1016/j.gie.2016.07.049
- Gastroenterological Society of Australia / Gastroenterological Nurses College of Australia. (2010). Infection Control in Endoscopy. Retrieved from http://www.gesa.org.au/files/editor_upload/File/DocumentLibrary/Professional/Infection_Control_in_Endoscopy_Guidelines_2014.pdf
- Rutala WA, Rutala WA. Reprocessing endoscopes: United States perspective. Journal of Hospital Infection.2004; 56 Suppl 2, S27-S39
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 12-09-2018
Beoordeeld op geldigheid : 16-08-2018
Uiterlijk in 2020 bepaalt het bestuur van de Nederlandse Vereniging voor Medische Microbiologie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Medische Microbiologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke- en beroepsverenigingen verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door B. Niël-Weise, zelfstandig richtlijnmethodoloog en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van het project is het ontwikkelen van een multidisciplinaire richtlijn voor de microbiële controle van thermolabiele flexibele hoog-risico gastro-intestinale endoscopen met een of meerdere kanalen in de intra- en extramurale setting.
Doelgroep
De richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de microbiële controle van thermolabiele flexibele hoog-risico gastro-intestinale endoscopen: artsen-microbiologen, maag-darm-leverartsen, deskundigen infectiepreventie, deskundigen steriele medische hulpmiddelen (DSMH), deskundigen scopen reiniging en desinfectie (DSRD) en iedereen die zich beroepsmatig bezig houdt met gastro-intestinale endoscopieën.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2015 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de microbiële controle van thermolabiele flexibele gastro-intestinale endoscopen (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 18 maanden aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep:
- Dr. M. van Rijn (voorzitter), arts-microbioloog, Ikazia Ziekenhuis, Rotterdam
- Prof. Dr. M.C. Vos, arts-microbioloog, Erasmus MC Universitair Medisch Centrum, Rotterdam
- Dr. E.M. Mascini, arts-microbioloog, Rijnstate, Velp
- Prof. Dr. H.L. Zaaijer, arts-microbioloog, Academisch Medisch Centrum, Amsterdam/Sanquin Bloedvoorziening, Amsterdam
- Prof. Dr. J.J.G.H.M. Bergman, MDL-arts, Academisch Medisch Centrum, Amsterdam
- K. Ballemans, deskundige infectiepreventie, Unic Medical Services BV, Nieuwegein
- M.L. van Leest, deskundige infectiepreventie, Bravis Ziekenhuis, Bergen op Zoom/Roosendaal
- C. te Beest, DSMH, Maasstad Ziekenhuis, Rotterdam
- Drs. A. W. Rauwers, arts-onderzoeker, Erasmus MC Universitair Medisch Centrum, Rotterdam
Meelezers:
- Prof. Dr. A. Voss, arts-microbioloog, Radboud Universitair Medisch Centrum en Canisius Wilhelmina Ziekenhuis, Nijmegen
- Drs. E. P.M. van Elzakker, arts-microbioloog, HagaZiekenhuis, den Haag
- Dr. M.W.H. Wulf, arts-microbioloog, VieCuri Ziekenhuis, Venlo
Met ondersteuning van:
- Drs. B.S. Niël-Weise, arts-microbioloog (n.p.), zelfstandig richtlijnmethodoloog, Deventer
- Drs. H.W.J. Deurenberg, SIROSS, informatiespecialist, Oss
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancierd onderzoek en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij de Nederlandse Vereniging voor Medische Microbiologie, een overzicht vindt u hieronder:
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatie-management |
Extern gefinancierd onderzoek |
Kennis Valorisatie |
Overige belangen |
|
Ballemans K. |
Deskundige infectiepreventie |
SFERD (onbezoldigd); lid expertgroep WIP-richtlijn Flexibele Endoscopen |
Geen |
Geen |
Voorzitter SFERD |
Geen |
Geen |
Geen |
|
Bergman J. |
MDL-arts; hoofd afdeling endoscopie AMC Amsterdam |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Mascini E. |
Arts-microbioloog, Ziekenhuis Rijnstate, Arnhem/Velp. |
Adviseren ten aanzien van preventie, diagnostiek en therapie van infectieziekten in eerste en tweede lijn (betaald) |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Rauwers A.W. |
Arts-onderzoeker, Erasmus MC: aandachtsgebied: Contaminatie van complexe flexibele gastro-intestinale endoscopen |
Geen |
Geen |
Geen |
Geen |
Door VWS gesubsidieerd diepgaander onderzoek naar prevalentie contaminatie duodenoscopen (2016); unrestricted grant 3M: onderzoek naar rol en effect gebruik ATP meting tijdens reiniging en desinfectie van flexibele complexe endoscopen. |
Geen |
Geen |
|
te Beest C. |
Deskundige Steriele Medische hulpmiddelen |
Stuurgroep en medeauteur SFERD (onbetaald); voorzitter NEN normcommissie Steriliseren Steriliteit (onbetaald). |
Geen |
Geen |
Stuurgroep en medeauteur SFERD à vertegenwoordiger VDSMH; voorzitter NEN normcommissie Steriliseren Steriliteit à vertegenwoordiger VDSMH. |
Geen |
Geen |
Geen |
|
van Leest M.L. |
Deskundige infectiepreventie |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Van Rijn M. |
Arts-microbioloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Vos M.C.. |
Arts-microbioloog |
Voorzitter European Study Groep on Nosocomial Infections (ESGNI) (onbetaald); voorzitter Expertgroep WIP MRSA (onbetaald); lid expertgroep Reiniging en Desinfectie WIP (onbetaald) |
Geen |
Geen |
Geen |
Investor-initiated studie naar contaminatie duodenoscopen in NL (2015), waarop volgend door VWS gesubsidieerd diepgaander onderzoek naar prevalentie contaminatie duodenoscopen (2016; unrestricted grant 3M: onderzoek naar rol en effect gebruik ATP meting tijdens reiniging en desinfectie van flexibele complexe endoscopen. |
Geen |
Geen |
|
Zaaijer H.L. |
Arts-microbioloog |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiënten perspectief door in de voorbereidende fase de Patiëntenfederatie Nederland te vragen om schriftelijke input omtrent knelpunten en aandachtspunten. Deze heeft het verzoek om input doorgestuurd naar de Crohn en Colitis Ulcerosa Vereniging Nederland (CCUVN), Nederlandse Federatie van Kankerpatiënten organisaties (NFK) en de Coeliakie Vereniging. Geen van deze verenigingen heeft knelpunten aangeleverd. De werkgroep heeft de conceptrichtlijn ook tijdens de commentaarfase voorgelegd aan de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Zie ook het implementatieplan bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (www.agreecollaboration.org), dat een internationaal breed geaccepteerd instrument is en op ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de extern methodoloog de knelpunten. Deze werden met de werkgroep besproken en vervolgens per mail aan de volgende organisaties voorgelegd met de vraag om input: het Zorginstituut Nederland; de Inspectie voor de Gezondheidszorg; het Ministerie van Volksgezondheid, Welzijn en Sport; Patiëntenfederatie Nederland; Zorgverzekeraars Nederland; Nederlandse Federatie van Universitair Medische Centra; Nederlandse Vereniging van Ziekenhuizen; Sterilisatie Vereniging Nederland; Vereniging van Deskundigen Steriele Medische Hulpmiddelen; NEN normcommissie Steriliseren & steriliteit en Platform Deskundigen Endoscopie.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de extern methodoloog concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
Er werd oriënterend gezocht naar bestaande buitenlandse richtlijnen en naar systematische reviews. De zoekactie of gebruikte trefwoorden van de zoekactie zijn te vinden in de zoekverantwoording.
Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kwaliteit van bewijs (‘quality of evidence’) werd beoordeeld met behulp van GRADE (Guyatt et al., 2008). GRADE is een methode die per uitkomstmaat van een interventie, of voor een risico- of prognostische factor, een gradering aan de kwaliteit van bewijs toekent op basis van de mate van vertrouwen in de schatting van de effectgrootte (tabel 1 en 2).
Tabel 1 Indeling van de kwaliteit van bewijs volgens GRADE
|
Hoog |
Er is veel vertrouwen dat het werkelijke effect dicht in de buurt ligt van het geschatte effect. |
|
|
|
|
Matig |
Er is matig vertrouwen in het geschatte effect: het werkelijk effect ligt waarschijnlijk dicht bij het geschatte effect, maar er is een mogelijkheid dat het hiervan substantieel afwijkt. |
|
|
|
|
Laag |
Er is beperkt vertrouwen in het geschatte effect: het werkelijke effect kan substantieel verschillen van het geschatte effect. |
|
|
|
|
Zeer laag |
Er is weinig vertrouwen in het geschatte effect: het werkelijke effect wijkt waarschijnlijk substantieel af van het geschatte effect. |
Tabel 2 De kwaliteit van bewijs wordt bepaald op basis van de volgende criteria
|
Type bewijs |
Voor studies over interventies: RCT start in de categorie ‘hoog’. Observationele studie start in de categorie ‘laag’. Alle overige studietypen starten in de categorie ‘zeer laag’.
Voor studies over een risico- of prognostische factor: Prospectieve of retrospectieve cohortstudie start in de categorie ‘hoog’. Voor andere studieontwerpen wordt afgewaardeerd via ‘risk of bias’. |
|
|
|
|
|
|
Afwaarderen |
‘Risk of bias’ |
- 1 Serieus - 2 Zeer serieus |
|
|
|
|
|
|
Inconsistentie |
- 1 Serieus - 2 Zeer serieus |
|
|
|
|
|
|
Indirect bewijs |
- 1 Serieus - 2 Zeer serieus |
|
|
|
|
|
|
Onnauwkeurigheid |
- 1 Serieus - 2 Zeer serieus |
|
|
|
|
|
|
Publicatiebias |
- 1 Waarschijnlijk - 2 Zeer waarschijnlijk |
|
|
|
|
|
|
|
|
|
Opwaarderen |
Groot effect |
+ 1 Groot + 2 Zeer groot |
|
|
|
|
|
|
Dosis-respons relatie |
+ 1 Bewijs voor gradiënt |
|
|
|
|
|
|
Alle plausibele ‘confounding’ |
+ 1 zou een effect kunnen reduceren + 1 zou een tegengesteld effect kunnen suggereren terwijl de resultaten geen effect laten zien. |
Formuleren van de conclusies
Een conclusie verwijst niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence).
Overwegingen
Voor het komen tot een aanbeveling zijn naast de kwaliteit van het wetenschappelijk bewijs over de gewenste en ongewenste effecten van een interventie, of over de effectgrootte van een risico- of prognostische factor, vaak ook nog andere aspecten van belang.
Genoemd kunnen worden:
- kosten,
- waarden, voorkeuren en ervaringen van patiënten en behandelaars met betrekking tot interventies en uitkomsten van zorg,
- aanvaardbaarheid van interventies,
- haalbaarheid van een aanbeveling.
Bij voorkeur wordt ook voor deze aspecten naar wetenschappelijk bewijs gezocht. De werkgroep die deze richtlijn heeft opgesteld, heeft hiervan afgezien omdat de hiervoor benodigde tijd in geen enkele verhouding zou staan tot de verwachte opbrengst. De werkgroep heeft, daar waar dit noodzakelijk werd geacht, op basis van eigen ervaring en expertise de hiervoor genoemde aspecten geïnventariseerd.
Deze aspecten worden besproken na de ‘conclusie’ onder het kopje ‘overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in module 9.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Hiervoor werd gebruik gemaakt van de methodiek zoals beschreven in Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de Kennislacunes.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken wetenschappelijke verenigingen voorgelegd voor commentaar. Tevens werd de richtlijn voorgelegd aan de volgende organisaties ter becommentariëring: het Zorginstituut Nederland; de Inspectie voor de Gezondheidszorg; het Ministerie van Volksgezondheid, Welzijn en Sport; Nederlandse Vereniging voor Klinische Fysica; Patiëntenfederatie Nederland; Zorgverzekeraars Nederland; Nederlandse Federatie van Universitair Medische Centra; Nederlandse Vereniging van Ziekenhuizen; Sterilisatie Vereniging Nederland; Vereniging van Deskundigen Steriele Medische Hulpmiddelen; NEN normcommissie steriliseren steriliteit; SFERD-commissie; en Platform Deskundigen Endoscopie. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Literatuurlijst
Guyatt et al., 2008Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, Schünemann HJ; GRADE Working Group (2008). GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 336: 924-6.
Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
