Radiotherapie bij symptoomreductie bij mesothelioom
Uitgangsvraag
Wat is de plaats van radiotherapie bij symptoomreductie van patiënten met mesothelioom?
- Wat is de plaats van radiotherapie ten aanzien van pijnreductie?
- Wat is de plaats van radiotherapie ten aanzien van de preventie van entmetastasen?
- Wat is de plaats van radiotherapie ten aanzien van slik- en passageklachten?
Aanbeveling
Overweeg radiotherapie bij patiënten met gelokaliseerde pijn en een levensverwachting van meer dan vier weken:
- als de pijn onvoldoende afneemt met pijnmedicatie; of
- waarbij pijnmedicatie te veel bijwerkingen veroorzaakt.
Behandel deze patiënten bij voorkeur met een dosis van 20 Gy in 5 fracties.
Geef geen bestraling (met preventie van entmetastasen als doel) op insteekplaatsen van interventies in de thorax.
Overweeg palliatieve bestraling bij een patiënt met dysfagie, als de dysfagie niet op een andere manier te behandelen is en de levensverwachting van de patiënt meer dan vier weken is.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Deelvraag 1 (pijnverlichting):
Er werd geen studie gevonden die voldeed aan de inclusiecriteria en het effect van radiotherapie op pijnverlichting onderzocht in patiënten met mesothelioom. Daarom konden er geen conclusies worden getrokken en bestaat hier duidelijk een kennislacune.
Radiotherapie wordt echter al tientallen jaren op grote schaal gebruikt om pijn te behandelen bij patiënten met pleuraal mesothelioom.
Er werd één prospectieve, niet-gerandomiseerd fase II studie (SYmptom Study of radioThErapy in MeSothelioma (SYSTEMS)) verricht naar de rol van antalgische radiotherapie bij mesothelioompatiënten (Macleod, 2015). In totaal werden 40 patiënten uit drie Britse centra geïncludeerd. De pijnstillers werden geoptimaliseerd vooraleer patiënten in de trial werden opgenomen. Een standaard palliatieve dosis van 20 Gy in 5 fracties werd op de pijnlijke metastasen toegediend. Van de 30 patiënten die 5 weken na de radiotherapie evalueerbaar waren, hadden er 47% een klinisch significante pijnrespons met minimale toxiciteit. Radiotherapie had geen ander palliatief voordeel dan pijnreductie.
In de richtlijn van de American Society of Clinical Oncology (ASCO) wordt radiotherapie daarom aanbevolen bij pijn door het MPM (Kindler, 2018).
Op basis van expert opinie/literatuur welke niet voldeed aan de inclusiecriteria is de werkgroep van mening dat radiotherapie dient te worden aanbevolen bij gelokaliseerde pijn. Een dosis van 20 Gy in 5 fracties wordt aanbevolen.
Deelvraag 2 (entmetastasen):
Er lijkt geen effect te zijn van de toepassing van radiotherapie ter preventie van entmetastasen op de ervaren pijn en kwaliteit van leven van patiënten met mesothelioom in de 12 maanden na behandeling. De bewijskracht van de conclusies ten aanzien van deze cruciale uitkomstmaten is laag. Dit wordt met name veroorzaakt doordat blindering in deze studies vaak niet kan worden toegepast, maar ook vanwege het kleine aantal studies met bovendien kleine patiëntaantallen. Hier ligt dan ook een kennislacune.
De belangrijke uitkomstmaten overall survival, toxiciteit en proportie van entmetastasen kunnen vanwege de zeer lage bewijskracht geen aanvullende richting geven aan de klinische besluitvorming. Het bewijs voor een hoger aantal complicaties na de toepassing van radiotherapie is onzeker.
Naar aanleiding van de literatuursamenvatting is de werkgroep van mening dat preventieve bestraling van insteekplaatsen van de thorax ter preventie van entmetastasen niet geïndiceerd is.
Deelvraag 3 (slikproblemen):
Ten aanzien van de effectiviteit van radiotherapie bij slikproblemen is geen literatuuranalyse uitgevoerd.
Dysfagie treedt op bij 1.4 % van patiënten met MPM als gevolg van compressie of directe infiltratie van de slokdarm (Lockwood, 1989). De prognose van deze patiënten is zeer slecht.
In één retrospectieve reeks werd een gunstig effect van palliatieve radiotherapie op dysfagie beschreven (Gordon, 1982). Radiotherapie wordt echter vaak toegepast naar analogie bij andere longtumoren waarbij een gunstig palliatief effect wordt gezien met beperkte bijwerkingen bij 50 % tot 70 % van de patiënten (Fairchild, 2008).
Op basis van expert opinie is de werkgroep van mening dat palliatieve radiotherapie kan worden aangeboden aan mesothelioompatiënten met dysfagie, naar analogie van longkankerpatiënten.
Uit onderzoek met andere longtumoren weten we dat radiotherapie adequate palliatie van diverse klachten zoals dysfagie kan geven bij 50 tot 75 % van de patiënten (Plataniotis, 2002). Het palliatief effect treedt na 2 tot 4 weken op en houdt gemiddeld circa 3 maanden aan. Bij een levensverwachting korter dan 4 weken is palliatieve radiotherapie dan niet aan te raden. Herbestraling in geval van recidief van klachten is mogelijk. Deze palliatieve radiotherapie kan gecombineerd worden met meerdere systemische behandelingen. Radiotherapie voor dysfagie gegeven in een korte reeks, zoals het veel gebruikte en bestudeerde 20 Gy in 5 fracties gegeven in 1 week, wordt goed verdragen.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Patiënten met een mesothelioom hebben vaak zeer moeilijk en soms onbehandelbare pijn (MacLeod, 2016). Bij patiënten die onvoldoende reageren op pijnstilling of die pijnstillers slecht verdragen is palliatieve radiotherapie te overwegen. Radiotherapie veroorzaakt pijnstilling bij de meeste patiënten en dit met weinig bijwerkingen (Macleod, 2015). Ook bij dysfagie kan een gunstig palliatief resultaat bereikt worden (Gordon, 1982; Expert opinie). Een korte bestralingsreeks volstaat hiervoor. Ook voor palliatieve radiotherapie geldt dat de voor- en nadelen tegen elkaar afgewogen dienen te worden voor elke patiënt. Voordelen van palliatieve radiotherapie zijn dat een patiënt bij positief effect van de behandeling een betere kwaliteit van leven kan ervaren, en/of meer kan doen in het dagelijks leven. Denk aan arbeidsparticipatie, zelfverzorging, en verzorging van bijvoorbeeld huis en familie. Het niet - of minder hoeven gebruiken van pijnstillers kan ook als voordeel worden ervaren. Een potentieel nadeel van radiotherapie is dat de patiënt -vaak begeleid door een verzorger- meerdere malen het ziekenhuis moet bezoeken. Door een kort bestralingsschema toe te passen kan het aantal ziekenhuisbezoeken zoveel mogelijk worden beperkt.
Toxiciteit van de behandeling (voornamelijk radiatiedermatitis) is een ander potentieel nadeel voor de patiënt maar is meestal mild.
Kosten (middelenbeslag)
Palliatieve radiotherapie heeft een lage kostprijs met weinig bijwerkingen en wordt in enkele fracties gegeven. Het gevolg hiervan is dat het middelenbeslag voor palliatieve radiotherapie erg beperkt is. Palliatieve radiotherapie kan in alle radiotherapie-centra in Nederland gegeven worden en is dus ruim beschikbaar.
Aanvaardbaarheid, haalbaarheid en implementatie
De werkgroep verwacht geen problemen ten aanzien van de aanvaardbaarheid, haalbaarheid en implementatie van radiotherapie.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
De wetenschappelijke onderbouwing voor radiotherapie als pijnbehandeling bij pleuraal mesothelioom is zeer laag. Op basis van beperkte literatuur en expert opinion is de werkgroep van mening dat de voordelen voor een patiënt bij positief effect -te weten pijnreductie en daardoor een betere kwaliteit van leven- opwegen tegen de nadelen van meerdere ziekenhuisbezoeken en potentiële toxiciteit.
Onderbouwing
Achtergrond
Bij diagnose vertonen patiënten met een pleuraal mesothelioom vaak dyspneu, pijn en cachexie (British Thoracic Society Standards of Care Committee, 2020). Pijn en dyspneu zijn de belangrijkste symptomen die de kwaliteit van leven negatief beïnvloeden (Macleod, 2016). Pijnbestrijding is notoir moeilijk bij mesothelioompatiënten, omdat de ziekte vaak grote delen van de thoraxwand, de ribben en wervels, de spieren en de intercostale zenuwen en de plexus brachialis kan infiltreren. Dit leidt tot een combinatie van nociceptieve pijn, botpijn en neuropathische pijn, die verergert wanneer patiënten een krimpende hemithorax ontwikkelen. Zelfs met een combinatie van opioïden, ontstekingsremmende geneesmiddelen, anti-epileptica en tricyclische antidepressiva als pijnstillers, lopen patiënten met mesothelioom het risico op hardnekkige pijn (Macleod, 2016; Jackson, 1999). Entmetastasen treden bij 5 tot 40% van de patiënten op, waarvan sommige pijnlijk kunnen worden. Het voorkomen van entmetastasen lijkt daarom logisch bij het voorkomen van pijn. Ten slotte kan mesothelioom metastaseren in de mediastinale lymfeklieren, wat kan leiden tot dysfagie en bronchiale obstructie.
Conclusies / Summary of Findings
Question 1 (pain relief):
|
- GRADE |
No conclusions could be drawn as no studies meeting the inclusion criteria were found investigating the effectivity of radiation therapy regarding pain relief in patients with mesothelioma. |
Question 2 (tract metastasis)
|
Low GRADE |
Radiotherapy, performed to prevent tract metastasis in patients with mesothelioma undergoing an invasive intervention, may not result in a clinically relevant difference in pain in the 12 months after intervention.
Sources: (Clive, 2016) |
|
Low GRADE |
Radiotherapy, performed to prevent tract metastasis in patients with mesothelioma undergoing an invasive intervention, may not result in a clinically relevant effect on the quality of life in those patients in the 12 months after intervention.
Sources: (Clive, 2016) |
|
Very low GRADE |
The evidence is very uncertain about the effect of radiotherapy, performed to prevent tract metastasis, on survival of patients with mesothelioma undergoing an invasive intervention.
Sources: (Boutin, 1995; Clive, 2016) |
|
Very low GRADE |
The evidence is very uncertain about the effect of radiotherapy, performed to prevent tract metastasis, on toxicity in patients with mesothelioma undergoing an invasive intervention.
Sources: (Bayman, 2019) |
|
Very low GRADE |
The evidence is very uncertain about the effect of radiotherapy, performed to prevent tract metastasis, on risk of developing procedure tract metastasis in patients with mesothelioma undergoing an invasive intervention.
Sources: (Bayman, 2019; Boutin, 1996; Bydder, 2004; Clive, 2016; O’Rourke 2017) |
Samenvatting literatuur
Question 1 (pain relief):
Description of studies
No studies meeting the inclusion criteria were found investigating the effectivity of radiation therapy regarding pain relief in patients with mesothelioma.
Results
No results could be analysed as no studies meeting the inclusion criteria were found investigating the effectivity of radiation therapy regarding pain relief in patients with mesothelioma.
Level of evidence of the literature
No level of evidence could be determined as no studies meeting the inclusion criteria were found investigating the effectivity of radiation therapy regarding pain relief in patients with mesothelioma.
Question 2 (tract metastasis)
Description of studies
Bayman (2019) investigated the efficacy of prophylactic irradiation to the chest wall to prevent chest wall metastasis after diagnostic or therapeutic procedures in patients with pleural mesothelioma in a randomized controlled trial. The experimental group (n= 186; age 72.9 years; range 52.3 to 89.8; male 89.8%) received prophylactic radiotherapy (21Gy in three fractions, once per day over three working days, using a single electron field) within 42 days of the most recent chest wall procedure. The control group (n= 189; age 74.6 years; range 49.2 to 90.4; male 88.4%) did not receive radiotherapy.
Boutin (1995) investigated the efficacy of local radiotherapy in preventing malignant seedings along invasive diagnostic procedures in patients with pleural mesothelioma in a randomized controlled trial. The experimental group (n= 20; age 65 years; SD 5; male 75%) received local radiotherapy (21Gy over three days) 10-15 days after thoracoscopy. The control group (n= 20; age 66.5 years; SD 2; male= 90%) did not receive radiotherapy.
Bydder (204) investigated the efficacy of single dose radiotherapy to prevent procedures tract metastasis in patients with pleural mesothelioma in a randomized controlled trial. The experimental group (n= 28; age 70 years; range 53.7 to 85.1; male 93%) received prophylactic radiotherapy (10Gy in a single fraction) within 15 days after the thoracic procedure. The control group (n= 30; age 70 years; range 51.0 to 86.3; male 97.8%) did not receive radiotherapy.
Clive (2016) investigated the efficacy of prophylactic radiotherapy to prevent procedure tract metastasis in patients with pleural mesothelioma in a randomized controlled trial. The experimental group (n= 102; age 70 years; range 66 to 79; male= 89%) received local radiotherapy (21Gy in three fractions, once per day over three working days) 10 to 15 days after thoracoscopy. The control group (n= 101; age 70 years; range 66-77; male: 89%) did not receive radiotherapy until a procedure tract metastasis was identified.
O’Rourke (2007) investigated the efficacy of radiotherapy in preventing tumour seeding after chest drain or biopsy in patients with pleural mesothelioma in a randomized controlled trial. The experimental group (n= 31)) received radiotherapy (21Gy in three fractions) within 21 days after the invasive procedure. The control group (n= 30) did not receive radiotherapy. Participants were 70 (range 47-84) years old and 92% was male.
Results
Pain
Clive (2016) analyzed chest pain with a visual analogue scale summary-score until 12 months after randomization in a per protocol analysis. Clinically relevant differences in pain were reported (experimental group VAS median 12.0; range 3.3 to 23.3; control group VAS median 9.0; range 2.9 to 27.0; MD 3.0; 95%CI not reported), in favor of the control group. The adjusted difference (corrected for baseline values, mesothelioma subtype, type of pleural procedure and nature of procedure) in mean summary scores between groups was 0.6 (range -3.3 to 4.6); p= 0.75 and was not clinically relevant.
Quality of life
Clive (2016) analyzed quality of life with the European Organization for Research and Treatment of Cancer Quality-of-Life Questionnaire - Core 30(QLQ-C30) and EuroQoL-5D (EQ-5D). Maximum scores of these questionnaires were not reported, but assumed to be respectively 100 for QLQ-C-30 and 1 for EQ-5D. Results are shown in table 1. Differences in scores were not clinically relevant.
Table 1 Quality of Life results
|
|
Intervention group summary score from randomization to 12 months median (range) |
Control group summary score from randomization to 12 months median (range) |
Adjusted difference (corrected for baseline values) in mean summary scores median (range) |
Mean difference (95CI) |
p |
|
QLQ-C30: global health status |
59.6 (45.8 to 70.8) |
61.6 (43.1 to 74.9) |
–1.2 (–5.2 to 2.8) |
-2 (NR) |
0.55 |
|
QLQ-C30: physical functioning |
71.0 (54.8 to 83.7) |
70.3 (49.5 to 84.4) |
–0.1 (–3.1 to 2.9) |
0.7 (NR) |
0.94 |
|
QLQ-C30: pain |
22.8 (8.7 to 35.1) |
16.7 (6.7 to 35.9) |
1.3 (–3.1 to 5.6) |
6.1 (NR) |
0.57 |
|
EQ-5D |
0.72 (0.56 to 0.83) |
0.72 (0.58 to 0.82) |
–0.02 (–0.06 to 0.02 |
0 (NR) |
0.38 |
Overall survival
Boutin (1995) reported that the experimental group had a median overall survival of 14 months and the control group had a median overall survival of 8 months (mean difference 6 months). This difference was clinically relevant.
Clive (2016) reported a median overall survival of 357 days in the experimental group and a median overall survival of 365 days in the control group (mean difference: 8 days in favor of control group; HR 1.00; 95%CI 0.68 to 1.46; p= 0.98). The reported differences between groups were not clinically relevant.
Toxicity
Baymann (2019) compared toxicity after radiation between the experimental and control group. It was not reported which events occurred after three months or were still persistent at that time point. In this review, we describe five events occurring most frequently in Baymann (2019) in table 2. Dermatologic radiation recall reaction toxicity showed a clinically relevant difference in favor of the control group.
Table 2 Toxicity
|
|
Intervention group |
Control group |
Risk difference (95%CI) |
Number needed to treat |
|
Radiation dermatitis |
116/186 |
1/189 |
0.62 (0.55 to 0.69) |
2 (1.61) |
|
Skin athrophy |
6/186 |
1/189 |
0.03 (-0.00 to 0.05) |
34 (33.33) |
|
Skin induration |
14/186 |
8/189 |
0.03 (-0.01 to 0.08) |
34 (33.33) |
|
Chest wall pain |
59/186 |
46/189 |
0.07 (-0.02 to 0.16) |
15 (14.3) |
|
Dermatologic radiation recall reaction |
13/186 |
0/189 |
0.07 (0.03 to 0.11) |
15 (14.3) |
Proportion of symptomatic tract metastasis
Five studies (Bayman, 2019; Boutin, 1996; Bydder, 2004; Clive, 2016; O’Rourke, 2017) reported the proportion of symptomatic tract metastasis for all procedures combined. All studies had a follow-up of at least 12 months. Results are shown in the meta-analysis of figure 1. The risk difference between patients who received radiotherapy and those who did not to develop procedure tract metastasis, was 0.06 (-0.16, 0.04). This difference was not considered to be clinically relevant.
Figure 1 Meta-analysis proportion of symptomatic tract metasasis, combined procedures
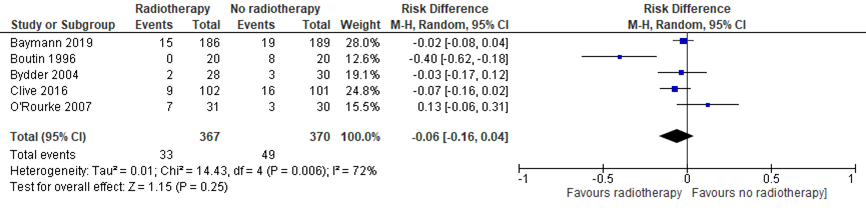
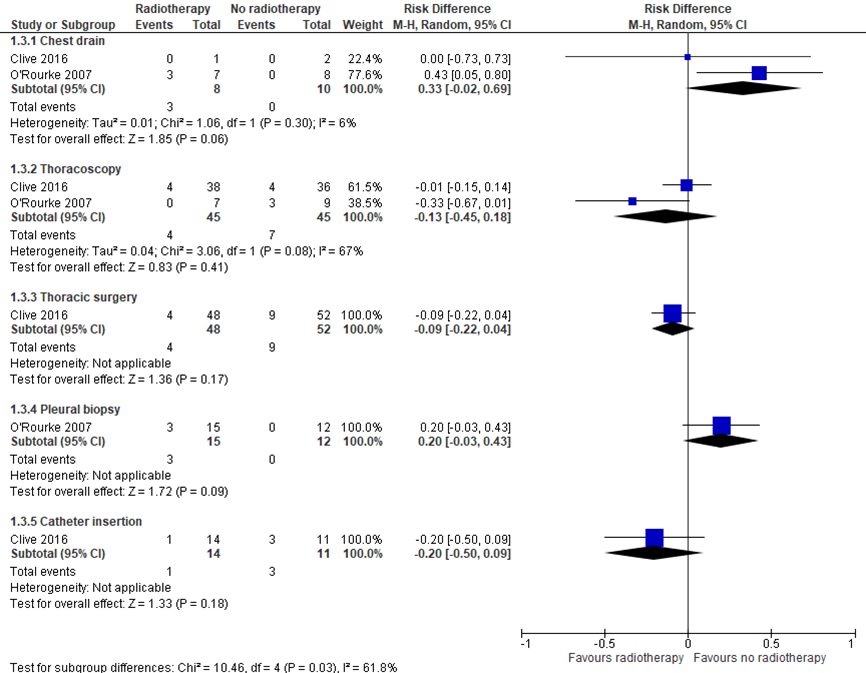
In addition, Clive (2016) and O’Rourke (2007) reported the proportion of symptomatic tract metastasis for each procedure separately. Results are shown in the meta-analysis of figure 2. For the chest drain procedure, results suggest no clinically relevant effect of radiotherapy (RD 0.33; 95%CI -0.02, 0.69). For the thoracoscopy procedure, results suggest no statistically significant or clinically relevant effect of radiotherapy (RD -0.13; 95%CI -0.45, 0.18). For thoracic surgery, results suggest no clinically relevant effect of radiotherapy (RD -0.09; 95%CI -0.22, 0.04). For pleural biopsy, results suggest no clinically relevant effect of radiotherapy (RD 0.20; 95%CI -0.03, 0.43). For catheter insertion, results suggest no clinically relevant effect of radiotherapy on the development of procedure tract metastasis (RD 0.20; 95%CI -0.50, 0.09).
Figure 2 Meta-analysis proportion of symptomatic tract metasasis, subgroups
Level of evidence of the literature
Pain
The level of evidence regarding the outcome measure started at high level and was downgraded to low level by the following reasons: Lack of blinding that may influence the experience of pain (risk of bias, one level, see evidence tables); The small number of studies with a small number of participants (imprecision, one level).
Quality of life
The level of evidence regarding the outcome measure started at high level and was downgraded to low level by the following reasons: Lack of blinding that may influence the experience of quality of life (risk of bias, one level, see evidence tables); The small number of studies with a small number of participants (imprecision, one level).
Overall survival
The level of evidence regarding the outcome measure started at high level and was downgraded to very low level by the following reasons: Limitations in study design (risk of bias, one level, see evidence tables); Differences in study conclusions (inconsistency, one level); The small number of studies with a (very) small number of participants (imprecision, one level).
Toxicity
The level of evidence regarding the outcome measure started at high level and was downgraded to very low level by the following reasons: Limitations in study design (risk of bias, one level, see evidence tables); The unclear timing of measurement (indirectness, one level); Only one study with small numbers of events (imprecision, one level).
Proportion of symptomatic tract metastasis, combined for all procedures
The level of evidence regarding the outcome measure started at high level and was downgraded to very low level by the following reasons: Limitations in study design (risk of bias, one level, see evidence tables); Differences in study results (inconsistency, one level); The small number of included participants (imprecision, one level).
Proportion of symptomatic tract metastasis, subgroups
The level of evidence regarding the outcome measure started at high level and was downgraded to very low level by the following reasons: Limitations in study design (risk of bias, one level, see evidence tables); The low number of studies with very small number of included participants and very wide confidence intervals (imprecision, two levels).
Zoeken en selecteren
For research question one and two, the working group decided to use the literature search of the ERS guideline for their analysis. For research question three, the working group did not expect to find relevant literature and decided to answer this question based on expert opinion only.
PICO Question 1 (pain relief)
What is the effectivity of radiotherapy regarding pain relief in patients with pleural mesothelioma?
P: patients with mesothelioma with persistent pain (regardless of adequate management of pain with analgesia);
I: radiotherapy of the painful area;
C: no radiotherapy (best supportive care, placebo, sham);
O: pain (after at least three months), quality of life (after at least six months), overall survival (after six months), toxicity (after 90 days).
Relevant outcome measures
The guideline development group considered pain and quality of life as critical outcome measures for decision making; and overall survival and toxicity as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined the following differences as a minimal clinically important difference:
- Pain: 2 points reduction on VAS-scale (0 to10).
- Quality of life: 20% (of the maximum score) difference on a validated quality of life questionnaire.
- Overall survival: no decrease in overall survival (HR> 1.3, mean difference (MD)< 12 weeks).
- Toxicity: low number of side effects:
- Grade < 5 (0.8<risk difference (RD)< 1.25).
- Grade 5 (0.95 <RD> 1.05).
PICO Question 2 (tract metastasis):
What is the effectivity of radiotherapy regarding the prevention of tract metastasis in patients with pleural mesothelioma?
P: patients with mesothelioma after intervention (surgery, drain, catheter, thoracoscopy);
I: radiotherapy;
C: no adjuvant radiotherapy (best supportive care, placebo, sham);
O: pain (after at least three months), quality of life (after at least six months), overall survival (after six months), toxicity (after 90 days), proportion of symptomatic tract metastasis (after 6 months).
Relevant outcome measures
The guideline development group considered pain and quality of life as critical outcome measures for decision making; and overall survival, toxicity and proportion of symptomatic tract metastasis as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined the following differences as a minimal clinically important difference:
- Pain: 2 points reduction on a continuous scale from 0 to 10 (for example VAS).
- Quality of life: MD: 20% of the maximum score of a validated quality of life questionnaire.
- Overall survival: no decrease in overall survival (HR> 1.3, MD< 12 weeks).
- Toxicity: low number of side effects:
- Grade < 5 (0.8<risk difference (RD)< 1.25).
- Grade 5 (0.95 <RD> 1.05).
Proportion of symptomatic tract metastasis: a significant difference in diagnosed symptomatic tract metastasis.
Search and select (Methods)
Recently, an European guideline for the management of malignant pleural mesothelioma (Scherpereel, 2019) was published, providing literature reviews regarding both defined PICO’s on pleural mesothelioma, but reporting limited individual study characteristics and results. Because of limited resources and because we did not expect to find additional relevant literature regarding pleural or other types of mesothelioma, the working group decided to select relevant randomized controlled trials meeting the described PICO’s from the European guideline (Scherpereel, 2019) and described the included studies separately.
Question 1 (pain relief)
In the European guideline (Scherpereel, 2019), literature was searched with relevant search terms until January 2019 and included zero randomized trials. Therefore, no studies were included in this literature review.
Question 2 (tract metastasis)
In the European guideline (Scherpereel, 2019), literature was searched with relevant search terms until January 2019 and included five randomized controlled trials. The working group reviewed this selection based on the following criteria:
- Studies were systematic reviews or randomized controlled trials.
- Patients with mesothelioma having an intervention were included.
- Radiotherapy to prevent for tract metastasis was compared with best supportive care, placebo or sham therapy.
- At least one of the following outcome measures was investigated: pain (after at least three months); quality of life (after at least six months); overall survival (after six months); toxicity (after 90 days); proportion of symptomatic tract metastasis (after 6 months).
After reading the full text, no studies were excluded and five studies were included.
Results
No studies were included in the analysis of the literature regarding the first research question (pain relief). Five studies were included in the analysis of the literature regarding the second research question (tract metastasis). Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- British Thoracic Society Standards of Care Committee. BTS statement on malignant mesothelioma in the UK, 2007. Thorax. 2007 Nov;62 Suppl 2(Suppl 2):ii1-ii19. doi: 10.1136/thx.2007.087619. PMID: 17965072; PMCID: PMC2094726.
- Fairchild A, Harris K, Barnes E, Wong R, Lutz S, Bezjak A, Cheung P, Chow E. Palliative thoracic radiotherapy for lung cancer: a systematic review. J Clin Oncol. 2008 Aug 20;26(24):4001-11.
- Gordon W Jr, Antman KH, Greenberger JS, Weichselbaum RR, Chaffey JT. Radiation therapy in the management of patients with mesothelioma. Int J Radiat Oncol Biol Phys. 1982 Jan;8(1):19-25.
- Jackson MB, Pounder D, Price C, Matthews AW, Neville E. Percutaneous cervical cordotomy for the control of pain in patients with pleural mesothelioma. Thorax. 1999;54(3):238–241.
- Kindler HL, Ismaila N, Armato SG, et al. Treatment of malignant pleural mesothelioma: American Society of Clinical Oncology clinical practice guideline. J Clin Oncol. 2018;36(13):1343–1373
- Lockwood CA, Jones HW, Foote CK, Turner MJ. Dysphagia due to meso-thelioma infiltrating the oesophagus: palliative treatment. J R Soc Med 1989;82:168.
- Macleod N, Chalmers A, O’Rourke N, et al. Is radiotherapy useful for treating pain in mesothelioma? A phase II trial. J Thorac Oncol. 2015;10(6):944–950.
- Macleod N, Kelly C, Stobo J, et al. Pain in malignant pleural mesothelioma: a prospective characterization study. Pain Med. 2016;17(11):2119–2126.
- Plataniotis GA, Kouvaris JR, Dardoufas C, Kouloulias V, et al. A short radiotherapy course for locally advanced non-small cell lung cancer (NSCLC). Effective palliation and patients’convenience. Lung Cancer 2002;35;203-7.
- Scherpereel A, Opitz I, Berghmans T, et al. ERS/ESTS/EACTS/ESTRO guidelines for the management of malignant pleural mesothelioma. Eur Respir J 2020; 55: 1900953 (https://doi.org/10.1183/13993003.00953-2019).
Evidence tabellen
Research question: PICO 2
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Bayman 2019 |
Type of study: Phase III randomized controlled trial
Setting and country: Multicentre trial with 54 centres, 375 patients are randomized. UK
Funding and conflicts of interest: Funding: National Institute for Health Research (NIHR) under its Research for Patient Benefit (RfpB) Programme (Grant Reference Number PB-PG-1010-23232). No conflicts of interest reported |
Inclusion criteria: - Aged 18 years or older - Had a diagnosis of MPM confirmed by a thoracic malignancy multidisciplinary team - Had inoperable disease or were medically unsuitable for surgery - Had an Eastern Cooperative Oncology Group performance status score of 0 to 2 - Had undergone a chest wall procedure, including open surgical biopsy, video-assisted thoracoscopic surgery biopsy, local anaesthetic thoracoscopy, or insertion of a chest drain - Had a chest wall procedure scar visible at time of random assignment - Able to start prophylactic radiotherapy within 42-days of the chest wall procedure
Exclusion criteria: Patients who: - Had an open thoracotomy (the resulting large scar or tract would not be adequately covered with the electron field arrangement used) - Had undergone a needle biopsy (the resulting scar would not be visible at the time of random assignment) - Had received previous thoracic radiotherapy to the region of the chest wall procedure site - Were currently receiving chemotherapy - Had an indwelling pleural catheter in situ at the chest wall procedure site
N total at baseline: 375 Intervention: 186 Control: 189
Important prognostic factors: Age ± SD: I: 72.9 (52.3-89.8) C: 74.6 (49.2-90.4)
Sex M (n, %): I: 167 (89.8%) C: 167 (88.4%)
Groups comparable at baseline? Yes
|
Chest wall procedure
Thereafter prophylactic radiotherapy: Start within 42 days of the most recent chest wall procedure. Dose: 21 Gy in three fractions, once per day over three consecutive working days Fraction was delivered using a single electron field. |
Chest wall procedure
Thereafter no prophylactic radiotherapy
|
Length of follow-up: Patients were followed up monthly for 24 months or until the development of CWM or death. Clinic at 1, 3, 6, and 12 months; monthly telephone follow-up
Loss-to-follow-up: Not mentioned
|
Primary end point: Incidence of ipsilateral chest wall metastases, 6 months from randomization (n/N (%) I: 6/186 (3.2%) C: 10/189 (5.3%) OR: 0.60; 95% CI, 0.17 to 1.86; P =.44
Secondary outcomes: Incidence of ipsilateral CWM 12 months form randomization (n/N (%) I: 15/186 (8.1%) C: 19/189 (10.1%) OR, 0.79; 95% CI, 0.36 to 1.69; P =.59
Time from randomization to ipsilateral CWM Cumulative incidence of CWM: No significant difference between groups (subdistribution HR, 0.57; 95% CI, 0.31 to 1.03; P =.06),
Acute and late skin radiotherapy toxicity (n, %)
|
Authors conclusion: “There is no role for the routine use of prophylactic irradiation to chest wall procedure sites in patients with MPM” |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Boutin, 1995 |
Type of study: Randomized trial
Setting and country: 40 patients are randomly assigned to radiotherapy or no radiotherapy after invasive diagnostic procedures. Marseille, France.
Funding and conflicts of interest: Not mentioned |
Inclusion criteria: - Patient with pleural mesothelioma - Life expectancy > 3 months at time of diagnosis - Undergone pleural cytologic study and Abrams needle biopsy < 1 month before thoracoscopy - Puncture sites still visible
Exclusion criteria: Not mentioned
N total at baseline: Intervention: 20 Control: 20
Important prognostic factors: Age ± SD: I: 65 ± 5 C: 66.5 ± 2
Male sex, n/N (%): I: 15/20 (75%) C: 18/20 (90%)
Groups comparable at baseline? Yes |
Diagnostic procedure: cytology, needle biopsy, thoracoscopy, or chest tube placement
Thereafter radiotherapy:
10 to 15 days after thoracoscopy, three daily session of radiotherapy. A dosage of 21 Gy was delivered over 3 days (3x7 Gy) to the thoracic wall, which is equivalent to 45 Gy in 4.5 weeks.
|
Diagnostic procedure: cytology, needle biopsy, thoracoscopy, or chest tube placement
Thereafter no radiotherapy |
Length of follow-up: Not mentioned
Loss-to-follow-up: Unclear, follow up is not described
Incomplete outcome data: Unclear
|
Outcome measures and effect size (include 95%CI and p-value if available):
Median survival: I: 14 months C: 8 months No significant differences in median survival are reported (statistics are not included)
Development of entry tract metastasis: Development of subcutaneous nodules (n/N, %): I: 0/20, 0% C: 8/20, 40% P<0,001 |
- Follow up and outcome measures are not described - Trial states to be randomized, however procedure of randomization is not mentioned. Also, no blinding or allocation concealment is described. - Authors conclusion: authors state that these findings show that early local radiotherapy is effective and safe in preventing tract metastases, after invasive diagnostic procedures. - Due to small number of participants and lack of proper description of blinding and randomization, these results should be interpreted carefully. |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Bydder, 2004 |
Type of study: RCT
Setting and country: 58 sites on 43 patients were randomized between prophylactic treatment and control treatment. Perth, Australia.
Funding and conflicts of interest: Not mentioned |
Inclusion criteria: - Histological confirmation of MPM - Age greater than 18 years - A clearly identifiable procedure site
Exclusion criteria: None
N total at baseline: Intervention: 28 Control: 30
Important prognostic factors: Age years, range: I: 70 (53.7 – 85.1) C: 70 (51.0 – 86.3)
Sex n/N, %: I: 26/28 (93%) C: 29/30 (97%)
Groups comparable at baseline? Yes |
Procedure sites underwent either thoracic drainage, thoracoscopy, Abrams needle or fine needle aspiration (FNA).
Thereafter, prophylactic treatment was given: administered within 15 days after thoracic procedures. A dose of 10 Gy in a single fraction was delivered to the chest wall. |
Procedure sites underwent either thoracic drainage, thoracoscopy, Abrams needle or fine needle aspiration (FNA).
Thereafter, no prophylactic treatment was given. |
Length of follow-up: At 3 and at 6 months after procedure, then 6-monthly until death.
Loss-to-follow-up: Not mentioned
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Procedure tract metastasis (n/N, %): I: 2/28 (7%) C: 3/30 (10%) (P=0.53).
Freedom from tract metastasis survival: Not significantly different between groups (P= 0.82).
|
- N represents the number of procedure sites, not the number of patients - Authors state that no benefit is found from a single dose of prophylactic chest wall irradiation. They recommend prophylactic treatment with delivering 21 Gy in three fractions. |
||||||||||||||||||||||||||||||||||||||||||||||||
|
Clive, 2016
|
Type of study: a multicentre, open-label, phase 3, randomised controlled trial
Setting and country: 22 UK hospitals, Mesothelioma patients who had undergone large-bore pleural interventions in the 35 days prior to recruitment received either radiotherapy, or deferred radiotherapy
Funding and conflicts of interest: Research for Patient Benefit Programme from the UK National Institute for Health Research |
Inclusion criteria: Patients who: - Had a histocytologically proven diagnosis of malignant pleural mesothelioma - Had undergone in the previous 35 days: - an open pleural biopsy - Surgical thoracotomy or video-assisted thoracoscopic surgery -Local anaesthetic thoracoscopy - Large-bore chest tube insertion (≥20 French (Fr) inserted by either a Seldinger technique or blunt dissection) - An indwelling pleural catheter insertion.
Exclusion criteria: Patients who: - Were younger than 18 years - Had an expected survival of less than 4 months - Were pregnant or lactating - Were unable to give informed consent or comply with the protocol - Had had previous radiotherapy resulting in an unacceptable overlap with the proposed treatment field - Had no access to a telephone - Had a clinically palpable nodule of 1 cm or larger in diameter within 7 cm of the margins of the procedure site at the initial trial visit.
N total at baseline: Intervention: 102 Control: 101
Important prognostic factor2: age ± SD: I: 70 (66–76) C: 70 (66–77)
Sex: I: 91 (89%) M C: 90 (89%) M
Groups comparable at baseline? Yes |
Immediate Radiotherapy
Within 42 days of the procedure for which the patient had been randomised, the patient received 21 Gy in three fractions over 3 working days.
|
Deferred radiotherapy
If a PTM (procedure-tract metastases) was identified, within 35 days of PTM diagnosis the patient received 21 Gy of radiotherapy in three fractions over 3 working days.
|
Length of follow-up: All patients were followed up monthly until death or for 12 months. Patients visited the hospital at randomisation and at 1, 3, 6, 9, and 12 months after randomisation
Loss-to-follow-up: Intervention: N (%): 5(5%) Reasons: three (3%) did not attend and two (2%) withdrew
Control: N (%): 7 (75) Reasons: six (6%) did not attend and one (1%) withdrew
Incomplete outcome data: Pain: Intervention/Control: N=9/5 Reasons: not reported
QLQ-C30 global health status and physical function: Intervention/Control: N=11/9 Reasons: not reported
QLQ-C30 pain: Intervention/Control: N=11/8 Reasons: not reported
EQ-5D: Intervention/Control: N=8/6 Reasons: not reported
Per protocol analyses:
Control: N=2
|
The primary endpoint: The incidence of PTM within 12 months from randomisation within the intention-to treat population. No significant difference was found (n/N,%): I: 9/102 (8,8%) C: 16/101 (15,8%) OR 0·51 (95% CI 0·19–1·32); p=0·14
Subgroup: large-bore chest drain insertion (≥20Fr)
Subgroup: Local anaesthetic thoracoscopy
Subgroup: thoracic surgery
Subgroup: indwelling pleural catheter insertion
Secondary outcomes: A per protocol analysis of the primary outcome PTM incidence was significantly lower in I versus C (n/N, %): I: 5/84 (6%) C: 16/99 (16%) OR 0.33 (95% CI 0.09-1.00) p=0.037
Summary chest pain visual analogue scale scores (from randomisation to 12 months after randomisation), per protocol analysis On average how much chest pain have you felt today (median (IQR))? I:12·0 (3·3–23·3) C: 9·0 (2·9–27·0)
Summary quality-of-life score (from randomisation to 12 months after randomisation)
Global health status (QLC-C30): I: 59·6 (45·8 to 70·8) C: 61·6 (43·1 to 74·9) adjusted difference in mean summary scores: –1·2 (–5·2 to 2·8) p=0·55
Physical functioning (QLC-C30): I: 71·0 (54·8 to 83·7) C: 70·3 (49·5 to 84·4) adjusted difference in mean summary scores: –0·1 (–3·1 to 2·9) p=0·94
Pain (QLC-C30): I: 22·8 (8·7 to 35·1) C: 16·7 (6·7 to 35·9) adjusted difference in mean summary scores1·3 (–3·1 to 5·6) p=0·57
EQ-5D summary scores: I: 0·72 (0·56 to 0·83) C: 0·72 (0·58 to 0·82) adjusted difference in mean summary scores–0·02 (–0·06 to 0·02)) p=0·38
Time to development of PTM Time to development of PTM from randomisation (days): (median (IQR)) C: 224 (136–285) P=0,34
Toxicity after 3 months N (%)
For the control group, toxicity was only reported for the subgroup receiving radiotherapy after diagnosis of tract metastasis.
Overall survival in days (from randomisation to death), median I: 357 days C: 365 days HR 1·00 (95% CI 0·68–1·46); p=0·98 |
Authors conclusion: authors state that it is not justified to use prophylactic radiotherapy, in all patients with mesothelioma after large-bore thoracic interventions |
||||||||||||||||||||||||||||||||||||||||||||||||
|
O’Rourke, 2007 |
Type of study: Randomised controlled trial
Setting and country: 61 patients from two centres with a histological diagnosis of pleural mesothelioma and an invasive procedure within the preceding 21 days were treated with either immediate drain site radiotherapy or with best supportive care. Scotland, United Kingdom
Funding and conflicts of interest: None mentioned |
Inclusion criteria: - Patients with malignant pleural Mesothelioma - Patients with an intervention site to the pleura within the preceding 21 days
Exclusion criteria: - Expected survival less than 3 months - Prior systemic chemotherapy or local radiotherapy for their disease.
N total at baseline: Intervention: 31 Control: 30
Important prognostic factors: Median age: 70 (47-84) Male sex (N, %): 56 (92%) Sex and age are not provided separately for the different groups
Groups comparable at baseline? Unknown due to missing information
|
Radiotherapy (XRT): Immediate drain site radiotherapy of 21 Gy in three fractions
|
Best supportive care (BSC) Not explained into further detail |
Length of follow-up: 12 months
Loss-to-follow-up: Only described for all patients: 36 (59%): 28 (46%) died prior to the end of the study 8 (13%) withdrew prior to the end of the study
Incomplete outcome data: Not mentioned
|
Development of tract metastases (n/N) I: 7/31 C: 3/30 No statistics available
Subgroup chest drain:
Subgroup pleural biopsy: I: 3/15 C: 0/12
Subgroup thoracoscopy: I:0/ 7 C: 3/9
Subgroup not known: I: 1/2 C: 0/1
Time from procedure until development of tract metastasis (median) I: 2.4 months C: 6.4 months P = 0.801
Incidence of tract metastases at intervention site No number of events is mentioned p = 0.748 HR: 1.28 (95% CI 0.29– 5.73
Outcomes from questionnaire No number of events are mentioned Depression: Worse depression is described in Control arm p = 0.028 Anxiety: Worse anxiety is described in Intervention arm p = 0.029 |
- Procedure of treatment (best of care) is not described
Authors conclusion: authors state that incidence of tumour seeding by the margin is not reduced by prophylactic drain site radiotherapy |
Risk of bias table
Research question: PICO2
|
Study reference
(first author, publication year) |
Describe method of randomisation |
Bias due to inadequate concealment of allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?
(unlikely/likely/unclear) |
Bias due to loss to follow-up?
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?
(unlikely/likely/unclear) |
|
Bayman 2019 |
“Patients were randomly assigned on 1:1 to receive either prophylactic radiotherapy or observation. A variant of an adaptive, biased-coin randomization method was used to favor balanced allocations in the four strata formed from epithelioid histology (no/yes) and intention to give chemotherapy (no/yes). Allocations were to the lower recruiting arm within a stratum with probability 0.5 if the imbalance was within a predefined limit (3 for no intention and 6 for intention to give chemotherapy) and 0.75 otherwise. Randomization was undertaken centrally using a bespoke randomization computer system.” |
Likely
Article states: “Patients and clinicians were not masked to treatment allocation.” |
Likely
Participants are not blinded |
Likely
Investigators are not blinded |
Likely
Investigators are not blinded |
Unlikely
Predefined outcomes are clearly reported |
Unclear
Numbers of follow up are not mentioned |
Unlikely
Intention to treat is mentioned |
|
Boutin, 1995 |
Not clearly described: “Patients were randomly divided into two groups of 20.” |
Likely
Allocation concealment is not mentioned |
Likely
Blinding not possible as patients are aware whether they are treated with radiotherapy or not |
Likely
Blinding not possible as care providers are aware whether patients are treated with radiotherapy or not |
Unclear
Not described |
Unclear
Outcomes not predefined |
Unclear
Follow up is not described |
Unclear
Intention to treat analysis is not present |
|
Bydder, 2004 |
Exact method not clearly described
“Patients were randomised after stratification by procedure type, to receive either a single dose of electron beam chest wall radiotherapy or no prophylactic therapy.” |
Unclear
No method of allocation concealment is described |
Likely
Blinding not possible as patients are aware whether they are treated with radiotherapy or not |
Likely
Blinding not possible as care providers are aware whether patients are treated with radiotherapy or not |
Unclear
Blinding not mentioned |
Unlikely
Outcomes of interest are mentioned |
Unclear
Method of follow up is described, but not exact follow-up number |
Unclear
Intention to treat not mentioned |
|
Clive 2016 |
“Treatment allocation was done over the telephone by the Oxford Respiratory Trials Unit, operated by staff independent of the study. The randomisation sequence was generated with a validated, online randomisation service (Sealed Envelope, London, UK). Minimisation with a random component was used to reduce the baseline differences between the two groups. The three minimisation factors were histological subtype of mesothelioma (epithelioid only versus other), pleural procedure (indwelling pleural catheter versus other), and nature of procedure (ie, open pleural biopsy, thoracotomy, or video-assisted thoracoscopic surgery versus non-surgical procedure).” |
Likely
“Patients and clinicians were not masked to treatment allocation; therefore, outcome assessments were unblinded. Data analysis was blinded from treatment allocation.” |
Likely
“Patients and clinicians were not masked to treatment allocation; therefore, outcome assessments were unblinded. Data analysis was blinded from treatment allocation.” |
Likely
“Patients and clinicians were not masked to treatment allocation; therefore, outcome assessments were unblinded. Data analysis was blinded from treatment allocation.” |
Unlikely
“Patients and clinicians were not masked to treatment allocation; therefore, outcome assessments were unblinded. Data analysis was blinded from treatment allocation.”
|
Unlikely
Predefined outcome measures are clearly described |
Unlikely
Reasons for loss to follow up are clearly described |
Unlikely
Intention to treat protocol is given |
|
O’Rourke 2007 |
“Patients were allocated to treatment using the minimization technique to ensure the two arms were well balanced.“ |
Unclear
Nothing mentioned |
Likely
Impossible to blind patients due to treatments |
Likely
Impossible to blind patients due to treatments |
Unclear
Nothing mentioned |
Likely
Outcomes are not predefined
|
Unlikely
Reasons for loss of follow up are described
|
Unlikely
Intention to treat is mentioned |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-04-2022
Beoordeeld op geldigheid : 09-03-2022
Algemene gegevens
De Nederlandse Vereniging voor Radiologie heeft een verklaring van geen bezwaar afgegeven.
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met een mesothelioom.
Werkgroep
- Dr. J.M.M.F. Quispel, longarts, NVALT (voorzitter)
- Dr. J.A. Burgers, longarts, NVALT
- Dr. R. Cornelissen, longarts, NVALT
- Drs. B.I. Hiddinga, longarts, NVALT
- Dr. H.M. Klomp, chirurg, NVvH
- Dr. E.V.E. Madsen, oncologisch en gastro-intestinaal chirurg, NVvH
- Prof. dr. D.K.M. de Ruysscher, radiotherapeut-oncoloog, NVRO
- Drs. A.P.W.M. Maat, cardiothoracaal chirurg, NVT
- Dr. J.H. von der Thüsen, patholoog, NVVP
- Dr. M. Nielsen, klinisch geneticus, VKGN
- C.J. van den Boom-Bernaards, patiëntvertegenwoordiger, Asbestslachtoffers Vereniging Nederland (tot en met januari 2021)
- T.J.H. Koopman, patiëntvertegenwoordiger/bestuurslid, Asbestslachtoffers Vereniging Nederland
Meelezers:
- Dr. A. Bartels-Rutten, radioloog, NVvR
Met ondersteuning van
- Dr. J. Boschman, senior adviseur, Kennisinstituut van Medisch Specialisten (tot en met oktober 2020)
- Drs. I. van Dusseldorp, senior informatiespecialist, Kennisinstituut van Medisch Specialisten
- Dr. S.N. Hofstede, senior adviseur, Kennisinstituut van Medisch Specialisten (vanaf november 2020)
- Dr. J.C. Maas, adviseur, Kennisinstituut van Medisch Specialisten
- Drs. M. van der Maten, medisch informatiespecialist, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Quispel-Janssen (voorzitter) |
Longarts Haaglanden Medisch Centrum Antoniushoeve |
* lid Sectie Asbestgerelateerde Aandoeningen, onbetaald |
Subinvestigator bij Investigator Initiated trial NivoMes (nivolumab in mesothelioma) mede gefinancierd met unrestricted grant van BMS. Eerst auteur bij studie, gepubliceerd in 2018; Bijdrage voor het drukken van mijn proefschrift ontvangen waarvoor presentatie gegeven bij BMS over NivoMes studie |
Restrictie, uitsluiten met betrekking tot besluitvorming nivolumab. Vicevoorzitter Hiddinga neemt het hier over. |
|
Madsen |
Oncologisch en gastro-intestinaal chirurg, Erasmus Medisch Centrum Rotterdam |
Geen |
"Extern gefinancierd onderzoek door KWF en stichting Coolsingel: trial naar de feasibility van dendritische cel immunotherapie (DCBI) als adjuvante behandeling na chirurgische behandeling vanwege peritoneaal mesothelioom.
Extern gefinancierd onderzoek door Machiel vd Wouden stipendium (IAS) om het effect van tumor debulking op de effectiviteit van DCBI te beoordelen." |
Restrictie; wordt niet betrokken bij de literatuurselectie en literatuurbeoordeling van modules ten aanzien van immunotherapie na chirurgische behandeling vanwege peritoneaal mesothelioom en modules ten aanzien van immunotherapie en tumor debulking |
|
Nielsen |
Klinisch Geneticus LUMC |
Geen |
"In het LUMC wordt, onder andere door werkgroeplid, onderzoek gedaan naar erfelijke aanleg voor mesothelioom (en oog/huidmelanoom en nierkanker) veroorzaakt door kiembaan mutaties in het BAP1-gen,. Het betreft beschrijvend onderzoek van het phenotype (type tumoren, kanker risico's). Tevens is wordt er een database bijgehouden waarin data worden geregistreerd van patiënten met een BAP1 mutatie wat de uitkomsten zijn van de jaarlijkse controles van de betrokken organen.
Er is een kleine subsidie van het oogfonds (ongeveer 80000 euro) vanuit de oogheelkunde verkregen voor een PhD student die de database en families bijhoudt.
Ik kan op dit moment geen conflict verzinnen / of belang van een bepaalde uitkomst van deze richtlijn direct" |
Geen |
|
Boom, van den |
Geen |
Geen |
Geen |
Geen |
|
Ruysscher, de |
Radiotherapeut-Oncoloog Maastro |
Alle volgende nevenwerkzaamheden worden betaald aan Maastro (dus geen persoonlijke inkomsten): |
Research Funding (nooit persoonlijke ontvangsten): Boehringer Ingelheim, Bristol-Myers Squibb, AstraZeneca, Philips, Olink, KWF, ZonMw, EU |
Geen, nevenwerkzaamheden betreffen niet mesothelioom.
Advies om adviesraden te stoppen tijdens de richtlijnontwikkeling. |
|
Koopman |
* Bestuurslid bij Asbestslachtoffer Vereniging Nederland (AVN). |
Geen |
Ik heb alleen belang bij een duidelijke richtlijn als mede bestuurslid van het AVN |
Geen |
|
Klomp |
Chirurg, NKI - AVL |
Raad van Toezicht IJsselland Ziekenhuis Peer review – onbetaald
Vertrouwenspersoon – onbetaald
Docent AVL academie – onbetaald
Docent CASH – onbetaald
Geen persoonlijke inkomsten, contracten via Technology Transfer NKI-AVL
|
(patent (ongerelateerd aan mesothelioom) WO2010116003), dus: Geen
Educational grants, consultancy, speaker fees via Pfizer, Roche, Medtronic uitsluitend contracten via Technology Transfer NKI-AVL |
Geen, patent wordt niet in de richtlijn aangehaald en/of benoemd |
|
Maat |
Cardiothoracaal chirurg Erasmus MC Rotterdam, full time dienstverband |
Onbetaald: |
“Geen”
Betaald: * voordrachten tijdens diverse ROTS review symposia * organisator landelijke cursussen voor VATS segmentectomie en VATS lobectomie (inkomsten gaan naar onze afdeling) * lessen aan de Amstel Academie voor de landelijke opleiding OK en anesthesie assistenten van de cardio-thoracale chirurgische centra * reviewer voor wetenschappelijke aanvragen van de DLCA-S werkgroep * incidenteel uitvoeren van expertises bij medische aansprakelijkheid zaken" |
Geen |
|
Cornelissen |
Longarts Erasmus MC |
Geen |
"* Speakers fee Roche, Pfizer, BMS * Advisory board Roche, MSD, Boehringer "; subinvestigator: NVALT (NVALT 5 en 19) Boehringer (Lume meso studie) Novocure (stellar studie) Astra (determine studie) Verastem (command studie) Bayer (anetumab ravitansine versus vinorelbine) |
Restrictie: Wordt geen trekker van modules ten aanzien van immunotherapie (nivolumab +ipilimab) |
|
Burgers |
Longarts Antoni van Leeuwenhoek Ziekenhuis |
* Voorzitter SAGA, onbetaald |
Lid van een Independent Data Monitoring Committee bij een studie van Hoffmann-La Roche Ltd. Het AVL krijgt hiervoor een financiële tegemoetkoming. Lidmaatschap van een adviesraad van Astra Zeneca en Boehringer Ingelheim. Beide voor het laatst in 2017. Het AVL kreeg hiervoor een financiële tegemoetkoming. Geen van deze taken betreft/betrof de ziekte mesothelioom; Mijn studie 'Lenvatinib and pembrolizumab in malignant pleural mesothelioma: a singel arm phase II trial'. Wordt gefinancierd door Merck & Co met een unrestricted grant. Mijn studie 'Switch maintenance gemcitabine after first line platinum pemetrexed therapy': a randomised phase II study wordt gefinancierd door het KWF.
Geeft aan dat er ‘actieve’ conflicten zijn met Roche (IDMC) en die met MSD (sponsoring investigator initiated studie) |
Restrictie; uitsluiten bij besluitvorming over lenvatinib and pembrolizumab. |
|
Hiddinga |
Longarts UMCG Groningen |
NVALT, lid sectie asbest gerelateerde aandoeningen, onbetaald; lid sectie Oncologie, onbetaald; lid sectie Endoscopie, onbetaald. |
Geen |
Geen |
|
Von der Tűssen |
Patholoog, Erasmus MC |
Geen |
Geen
Geeft aan bezig te zijn met mesothelioom gerelateerde aanvraag bij BMS, maar is nog niet toegekend. |
Geen |
|
Bartels-Rutten |
Radioloog, Antoni van Leeuwenhoek ziekenhuis |
Geen |
Geen |
Geen |
|
Boschman Tot oktober 2020 |
(senior) adviseur kennisinstituut
Managing Editor/Researcher Cochrane Work, Amsterdam UMC |
Geen |
Financiering Health research (NIHR, UK): Projectleider updaten van Cochrane review over stress-interventies voor werknemers in de gezondheidszorg |
|
|
Hofstede Vanaf oktober 2020 |
(senior) adviseur kennisinstituut |
Geen |
Geen |
Geen |
|
Maas |
Adviseur kennisinstituut |
Onderzoeker in opleiding VU Medisch Centrum 1-4-2009 tot 1-9-2017, vanaf 1-10-2013 onbetaald; Dienstverband National Cardiovascular Data Registry 1 januari 2014 tot en met 31 augustus 2019; Dienstverband Nederlandse Hart Registratie 1 september 2018 tot en met 31 juli 2019 |
Geen, onderzoek inmiddels volledig afgerond, financiering van PhD onderzoek of de sponsors van het proefschrift hebben geen enkele invloed op de huidige werkzaamheden. |
Geen actie nodig. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het opnemen van afgevaardigden namens Asbestslachtoffers Vereniging Nederland (die tevens een enquête onder leden hebben uitgestuurd waarvan een verslag is opgenomen in de bijlagen) in de werkgroep. Daarnaast zijn de Asbestslachtoffers Vereniging Nederland en de Patiëntenfederatie Nederland uitgenodigd voor het deelnemen aan de schriftelijke knelpuntenanalyse. De resultaten hiervan zijn besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Asbestslachtoffers Vereniging Nederland en de Patiëntenfederatie Nederland. De eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz. Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst.
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module [Erfelijkheid] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Diagnostiek - pathologie] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Diagnostiek – beeldvormende technieken] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Systemische behandeling - immuuntherapie] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Systemische behandeling - gemcitabine] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Systemische behandeling - onderhoudsbelandeling] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Systemische behandeling – startpunt van de behandeling] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Chirurgie - peritoneaal] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Chirurgie - pleuraal] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Palliatie - chirurgie] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Palliatie – adjuvante radiotherapie] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Palliatie – radiotherapie symptoomreductie] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Informatieverstrekking aan de patiënt] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Organisatie van zorg] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met een mesothelioom. Tevens zijn er knelpunten aangedragen door verschillende partijen via een vragenlijst. Een verslag hiervan is opgenomen in de bijlagen.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
