Pathologie bij mesothelioom
Uitgangsvraag
Welk pathologisch onderzoek dient verricht te worden om mesothelioom vast te stellen?
Aanbeveling
Overweeg bij mesotheelproliferaties en verdenking op mesothelioom (in histologie of cytologie) zonder morfologisch en/of klinisch eenduidige diagnose, het uitvoeren van BAP1 immuunhistochemie.
Overweeg bij BAP1 proficiënte proliferaties, synchroon of in tweede instantie, CDKN2A/P16 deletie detectie middels P16 FISH of MTAP immuunhistochemie.
Verricht alsnog, of aanvullend, histologisch onderzoek bij cytologische of histologische preparaten die binnen de juiste klinische/radiologische context met deze technieken zijn beoordeeld, maar waarbij de diagnose onduidelijk blijft.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Een literatuuronderzoek werd verricht naar de diagnostische accuratesse van het gecombineerd gebruik van BAP1 IHC en CDKN2A(P16) FISH markers, dan wel gecombineerd gebruik van BAP1 en MTAP IHC markers in vergelijking met het gebruik van één van deze markers om maligne mesothelioom te onderscheiden van een reactieve (benigne) proliferatie in patiënten met atypische mesotheel proliferaties.
Voor de cruciale uitkomstmaten lijkt er geen verschil te zijn in specificiteit en positief voorspellende waarde, en geen verschil in het aantal ‘true negatives’ en ‘false positives’ bij het gecombineerde gebruik van BAP1 IHC en CDKN2A(P16) FISH ten opzichte van deze markers alleen. De bewijskracht hiervoor is laag vanwege beperkingen in de onderzoeksopzet en het lage aantal geïncludeerde cases. Belangrijke uitkomstmaten laten ook een lage bewijskracht zien. Het lijkt dat bij gecombineerd gebruik van BAP1 IHC en CDKN2A(P16) FISH de sensitiviteit hoger is, het aantal ‘true positives’ hoger is en het aantal ‘false negatives’ lager is ten opzichte van gebruik van een enkele marker. Ook lijkt de negatief voorspellende waarde hoger te zijn bij het gecombineerde gebruik van BAP1 IHC en CDKN2A(P16) FISH ten opzichte van deze markers alleen.
Voor het gecombineerde gebruik van BAP1 en MTAP IHC ten opzichte van BAP1 of MTAP IHC alleen, is het effect onzeker. De zeer lage bewijskracht wordt ook hier veroorzaakt door beperkingen in de studieopzet van de enige geïncludeerde studie met daarin een klein aantal geanalyseerde cases.
Verder blijkt uit het literatuuronderzoek dat de specificiteit van het gebruik van BAP1 IHC of CDKN2A/P16 deletie analyse (middels FISH of MTAP immuunhistochemie) als enkelvoudige test, zeer hoog ligt, en daarmee fout positieve uitslagen onwaarschijnlijk zijn. Voorts wordt met name BAP1 IHC als enkelvoudige test gekenmerkt door een acceptabele sensitiviteit / negatieve voorspellende waarde (0.63 to 0.74), zodat een benadering waarbij in ieder geval een BAP1 IHC kleuring onderdeel uitmaakt van het testalgoritme, zou kunnen volstaan. Deze kan aangevuld worden met een CDKN2A/P16 deletie analyse, ofwel synchroon, of in tweede instantie bij het ontbreken van BAP1 verlies. Door het technisch uitdagende karakter van zowel de MTAP IHC kleuringen als de CDKN2A/P16 deletie analyse zou overwogen kunnen worden om deze slechts op indicatie en gecentraliseerd uit te voeren.
Het stellen dan wel uitsluiten van de diagnose maligne mesothelioom in cytologische preparaten kan zeer uitdagend zijn, omdat maligne mesotheliomen soms maar beperkte cytonucleaire atypie vertonen, terwijl vice versa reactieve mesotheelproliferaties vaak juist zeer atypisch kunnen zijn. In dit literatuuronderzoek is geen specifieke aandacht besteed aan de waarde van de onderzochte markers in cytologische preparaten. De predictieve waarde van een BAP1 IHC kleuring of CDKN2A/P16 deletieanalyse die is geoptimaliseerd voor cytologie, is echter, naar verwachting, vergelijkbaar. Het is derhalve aannemelijk dat cytologie van een verdacht maligne mesotheelproliferatie zou kunnen volstaan voor een zekere diagnose van het maligne mesothelioom, mits de uitslagen adequaat interpreteerbaar zijn en de klinische/radiologische context passend is. Hiermee zou meer ingrijpend histologisch onderzoek kunnen worden voorkomen (Andrici, 2015; Cigognetti, 2015; Hatem, 2019; Hiroshima, 2021). Een niet-afwijkende uitslag sluit, evenals bij de histologie, een diagnose maligne mesothelioom echter niet uit, te meer daar pleurale/peritoneale exfoliatieve cytologie als techniek, door wisselende cellulaire opbrengst, ook inherent een beperkte sensitiviteit heeft.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Aanvullende bepalingen zoals bovenstaand besproken (markers in isolatie uitgevoerd dan wel gecombineerd), zullen naar verwachting leiden tot een afname van het aantal benodigde ingrepen voor de te onderzoeken patiëntenpopulatie, omdat met kleinere biopten en cytologische preparaten een zekerdere diagnose kan worden gesteld. Dit leidt tot minder herhalen van cytologie, (her)biopteren middels (CT-geleide) naaldbiopten, en chirurgische (VATS) biopten. Dit zal zich vertalen in verminderde procedure-gerelateerde morbiditeit. Patiënten zullen daarnaast liever kiezen voor een veel minder belastende pleurapunctie waarmee cytologische preparaten kunnen worden verkregen.
Kosten (middelenbeslag)
Aanvullende bepalingen zoals bovenstaand besproken zullen naar verwachting leiden tot een afname van het aantal benodigde ingrepen voor de te onderzoeken patiëntenpopulatie, omdat met kleinere biopten en cytologische preparaten een zekerdere diagnose kan worden gesteld. Dit leidt tot minder herhalen van cytologie, (her)biopteren middels (CT-geleide) naaldbiopten, en chirurgische (VATS) biopten. Dit zal zich vertalen in afname van procedure-gerelateerde kosten. Daartegenover staat een (beperkte) toename van kosten voor aanvullende pathologie bepalingen.
Aanvaardbaarheid, haalbaarheid en implementatie
BAP1 IHC is een standaardprocedure die in principe door alle pathologielaboratoria in Nederland zou moeten kunnen worden opgezet en beoordeeld. MTAP IHC is eveneens een technisch laagdrempelige bepaling, maar optimalisatie en beoordeling vereisen enige ervaring door de sterke aankleuring van niet-neoplastische cellen. Ook de CDKN2A/P16 FISH vereist ervaring met de techniek en beoordeling ervan. Gezien de lage incidentie van het mesothelioom en de hogere complexiteit van de MTAP IHC en de CDKN2A/P16 FISH, is het zinnig om deze aanvullende diagnostiek alleen aan te bieden in grotere regionale centra. De diagnostiek kan dan getrapt uitgevoerd worden, met in eerste instantie een BAP1 kleuring in het lokale laboratorium, en bij ontbreken van lokale beschikbaarheid van technieken voor CDKN2A/P16 deletie analyse, consultatie van een regionaal centrum voor het uitvoeren en verslaan van de aanvullende diagnostiek.
Mutatie analyse voor BAP1 of CDKNA middels DNA sequencing kan in een enkel geval noodzakelijk zijn voor het bevestigen van een afwijkend patroon bij BAP1 of P16 / MTAP analyse, of bij blijvende verdenking op maligniteit bij niet-afwijkende BAP1 IHC of P16 FISH / MTAP IHC. Dit behoort echter niet tot de standaard work-up en dient alleen uitgevoerd te worden in hiertoe uitgeruste laboratoria.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Het literatuuronderzoek laat zien dat BAP1 immuunhistochemie en/of CDKN2A/P16 deletie analyse in staat lijkt te zijn om met zeer hoge specificiteit reactieve mesotheelproliferatie uit te sluiten. De sensitiviteit om mesothelioom aan te tonen lijkt redelijk, waarbij de sensitiviteit van de combinatie iets beter lijkt te zijn dan BAP1 immuunhistochemie alleen. Hoewel de bewijslast laag tot zeer laag is, zijn deze bepalingen relatief eenvoudig te implementeren en de kosten ervan beperkt. De toepassing hiervan bij zowel cytologische als histologische preparaten, kan leiden tot een toename van de diagnostische accuratesse en een reductie van aanvullende (invasieve) ingrepen voor het verkrijgen van additioneel cytologisch of histologisch materiaal.
Onderbouwing
Achtergrond
De diagnose van maligne mesothelioom op basis van cytologie en histologie is in de praktijk vaak lastig. Dit is enerzijds, omdat de differentiaaldiagnose andere maligne tumoren kan omvatten, zoals (adeno)carcinoom, en anderzijds omdat een benigne van een maligne atypische mesotheelproliferatie dient te worden onderscheiden.
Het differentiëren tussen mesothelioom en andere maligne tumoren wordt gedaan op basis van morfologie in combinatie met 2 immunohistochemische (IHC) mesotheelmarkers en 2 IHC carcinoommarkers. Dit wordt uitgebreid behandeld in diverse actuele richtlijnen (zoals van de IMIG (Noor Husain, 2018) en BTS (Woolhouse, 2018)). Bovenstaande werd niet als knelpunt voor de pathologie diagnostiek beschouwd.
Daarom richten wij ons in deze module met name op diagnostische mogelijkheden voor het onderscheid tussen benigne versus maligne atypische mesotheelproliferaties. De diagnosestelling wordt vaak bemoeilijkt door het ontbreken van informatie in het preparaat over eventuele invasieve groei van een aangetroffen atypische mesotheliale celpopulatie, met name in cytologische en kleine histologische preparaten. BAP1-mutaties en CDKN2A-deleties komen, in tegenstelling tot in benigne mesotheelproliferaties, vaak voor in mesotheliomen. Celgebonden markers van deze moleculaire alteraties, zoals IHC voor BAP1 of MTAP (een eiwit waarvan het gen vaak ge-codeleteerd is bij CDKN2A-deletie) en CDKN2A/P16 FISH, kunnen wellicht helpen in dit onderscheid tussen benigne en maligne mesotheelproliferaties.
Conclusies / Summary of Findings
|
Low GRADE |
The use of a combined test (BAP1 IHC & CDKN2A(P16) FISH) may result in an increase in sensitivity, an increase in negative predictive value, an increase in the number of true positive cases and/or a decrease in the number of false negative cases compared to BAP1 IHC or P16 FISH test alone in patients with atypical mesothelial proliferations.
Sources: (Pilippa, 2018; Sheffield, 2015; Walts, 2016; Yoshimura, 2019) |
|
Low GRADE |
The use of a combined test (BAP1 IHC & CDKN2A(P16) FISH) may result in little to no difference in specificity, positive predictive value, the number of false positive cases and/or the number of true negative cases compared to a BAP1 IHC or P16 FISH test alone in patients with atypical mesothelial proliferations.
Sources: (Pilippa, 2018; Sheffield, 2015; Walts, 2016; Yoshimura, 2019) |
|
Very low GRADE |
It is very uncertain whether the use of a combined test (BAP1 & MTAP IHC) results in differences in sensitivity, specificity, positive predictive value, negative predictive value and/or the number of true positive, true negative, false positive and/or false negative cases when compared to BAP1 or MTAP IHC alone in patients with atypical mesothelial proliferations.
Source: (Yoshimura, 2019) |
Samenvatting literatuur
Description of studies
Four studies (Pilippa, 2018; Sheffield, 2015; Walts, 2016; Yoshimura, 2019) investigated the sensitivity and specificity of (the combination) markers in diagnosing malignant mesothelioma in patients with atypical mesothelial proliferations. All studies compared the combination of BAP1 IHC and P16 FISH with BAP1 IHC and P16 FISH alone. Yoshimura (2019) also compared the combination of BAP1 and MTAP with BAP1 and MTAP alone. Relevant study characteristics are shown in table 2. In all studies, there may be risk of bias as case selection may have been selective and blinding during measurements was unclear.
Table 2 Study characteristics
(MM = malignant mesothelioma)
|
|
Cases |
Age |
Gender |
Prevalence |
Reference standard |
|
Pilippa, 2018 |
MM: Epithelioid, biphasic type
Non-MM: atypical mesothelial proliferation |
All cases:
|
All cases: 67.7% male 35.3% female |
44.1% |
Clinically confirmed or pathologically confirmed diagnosis
|
|
Sheffield, 2015 |
MM: epithelioid, sarcomatoid, biphasic type
Non-MM: Benign mesothelioma |
Not reported |
Not reported |
37.3% |
Pathologically confirmed diagnosis |
|
Walts, 2016 |
MM: epithelioid, biphasic, papillary tumor
Non-MM: reactive effusions showing atypical mesothelial cells |
MM: median 69 years (range 37 to 84)
Non-MM: median 69 years (range 18 to 94) |
MM:
Non-MM: 54.3% male 45.7% female |
47.7% |
MM: Biopsy confirmed
Non-MM: Followed for a median of 36 months (range 13-204) |
|
Yoshimura, 2019 |
MM: epithelioid, biphasic, sarcomatoid
Non-MM: reactive mesothelial hyperplasia |
MM: mean 65.3 years (range 33 to 86)
Non-MM: mean 32.5 years (range 18 to 78) |
MM: 81.6% male 18.4% female
Non-MM: 100% male |
56.7% |
MM: histological diagnosis
Non-MM: immunohistochemistry confirmed |
Results
BAP1 IHC and/or CDKN2A(P16) FISH
Sensitivity, FN, TP
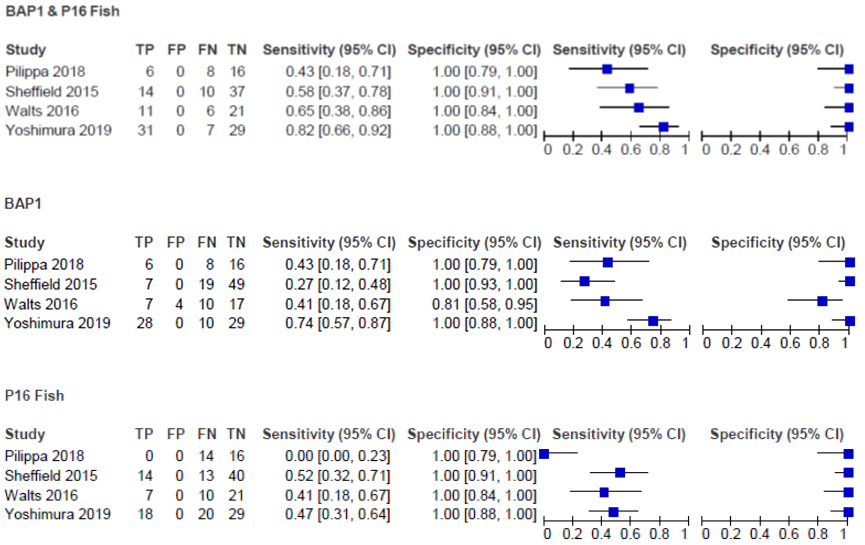
Four studies (Pilippa, 2018; Sheffield, 2015; Walts, 2016; Yoshimura, 2019) investigated the sensitivity of a combination of BAP1 IHC and CDKN2A(P16) FISH tests compared to these markers alone (if at least one of the combined tests showed a positive result, the final test-score was reported as positive). Results are shown in figure 1. The sensitivity for the use of the combination of BAP1 IHC and P16 FISH varied from 0.43 (95%CI 0.18 to 0.71) to 0.82 (95%CI 0.66 to 0.92). In the same study population, sensitivity for the use of BAP1 IHC alone varied from 0.27 (95%CI 0.12 to 0.48) to 0.74 (95%CI 0.57 to 0.87) and for CDKN2A(P16) FISH alone varied from 0.00 (95%CI 0.00 to 0.23) to 0.52 (95%CI 0.32 to 0.71). In most studies, the sensitivity and the number of TP patients was higher and the number of FN patients was smaller when the combination of BAP1 IHC and P16 FISH was used for diagnostic testing compared to the use of BAP1 IHC or P16 FISH alone, which was clinically relevant.
Specificity, FP, TN
Four studies (Pilippa, 2018; Sheffield, 2015; Walts, 2016; Yoshimura, 2019) investigated the specificity of a combination of BAP1 IHC and CDKN2A(P16) FISH tests compared to these markers alone (see figure 1). The specificity for the use of the combination of BAP1 IHC and P16 FISH marker was 1.00 (95%CI 0.84 to 1.00 and 95%CI 0.91 to 1.00, respectively). In the same study population, specificity for the use of BAP1 IHC alone varied from 0.81 (95%CI 0.58 to 0.95) to 1.00 (95%CI 0.93 to 1.00) and for CDKN2A(P16) FISH alone varied from 1.00 (95%CI 0.79 to 1.00) to 1.00 (95%CI 0.91 to 1.00). In most studies, the specificity and the number of FP and TN patients did not differ when the combination of BAP1 IHC and P16 FISH was used for diagnostic testing compared to the use of BAP1 IHC or CDKN2A(P16) FISH alone.
Figure 1 Sensitivity and specificity of studies comparing BAP1 IHC and/or CDKN2A(P16) FISH
PPV and NPV
From data in figure 1, PPV and NPV could be calculated for four studies (Pilippa, 2018; Sheffield, 2015; Walts, 2016; Yoshimura, 2019). Values are reported in table 3. In most studies, the combined markers did not result in higher PPV compared to markers alone. Differences in NPV were mostly clinically relevant in favor of the combined test.
Table 3 Positive and negative predictive values
|
|
Positive predictive value (95%CI) |
Negative predictive value (95%CI) |
|
BAP1 IHC & CDKN2A(P16) FISH |
||
|
Pilippa 2018 |
1.00 |
0.67 (0.56 to 0.76) |
|
Sheffield 2015 |
1.00 |
0.79 (0.70 to 0.86) |
|
Walts 2016 |
1.00 |
0.78 (0.65 to 0.87) |
|
Yoshimura 2019 |
1.00 |
0.81 (0.68 to 0.89) |
|
BAP1 IHC |
||
|
Pilippa 2018 |
1.00 |
0.67 (0.56 to 0.76) |
|
Sheffield 2015 |
1.00 |
0.72 (0.67 to 0.77) |
|
Walts 2016 |
0.64 (0.38 to 0.83) |
0.63 (0.52 to 0.73) |
|
Yoshimura 2019 |
1.00 |
0.74 (0.63 to 0.83) |
|
CDKN2A(P16) FISH |
||
|
Pilippa 2018 |
- |
0.53 (0.53 to 0.53) |
|
Sheffield 2015 |
1.00 |
0.75 (0.68 to 0.82) |
|
Walts 2016 |
1.00 |
0.68 (0.59 to 0.76) |
|
Yoshimura 2019 |
1.00 |
0.59 (0.52 to 0.66) |
BAP1 and/or MTAP IHC
Sensitivity, FN, TP
Yoshimura (2019) reported sensitivity for the use of the combination of BAP1 and MTAP IHC markers and for the markers alone (see table 4). The sensitivity and the number of TP patients was higher and the number of FN patients smaller when the combination of BAP1 and MTAP IHC was used for diagnostic testing compared to the use of MTAP IHC alone. The reported differences were clinically relevant. The sensitivity and the number of FP and TN patients were not different when the combination of BAP1 and MTAP IHC was used for diagnostic testing compared to BAP1 IHC alone.
Specificity, FP, TN
Yoshimura (2019) reported specificity for the use of the combination of BAP1 and MTAP IHC marker and for the markers alone (see table 4). The specificity and the number of FP and TN patients did not differ when the combination of BAP1 and MTAP IHC was used for diagnostic testing compared to the use of BAP1 or MTAP IHC alone.
PPV and NPV
From data reported in Yoshimura (2019), PPV and NPV could be calculated. Values are reported in table 3. The combined markers did not result in higher PPV compared to markers alone. Differences in NPV were clinically relevant in favor of the combined test compared to MTAP IHC alone, but not compared to BAP1 IHC alone.
Table 4 Sensitivity and specificity of studies comparing BAP1 and/or MTAP IHC (Yoshimura, 2019)
|
|
TP |
FP |
FN |
TN |
Sensitivity (95%CI) |
Specificity (95%CI) |
Positive predictive value (95%CI) |
Negative predictive value (95%CI) |
|
BAP1 or MTAP IHC |
28 |
0 |
10 |
29 |
0.74 (0.57 to 0.87) |
1.00 (0.88 to 1.00) |
1.00 |
0.74 (0.63 to 0.83) |
|
BAP1 IHC |
28 |
0 |
10 |
29 |
0.74 (0.57 to 0.87) |
1.00 (0.88 to 1.00) |
1.00 |
0.74 (0.63 to 0.83) |
|
MTAP IHC |
18 |
0 |
20 |
29 |
0.47 (0.31 to 0.64) |
1.00 (0.88 to 1.00) |
1.00 |
0.59 (0.52 to 0.66) |
Level of evidence of the literature
BAP1 IHC & CDKN2A(P16) FISH compared to BAP1 IHC or P16 FISH alone
Sensitivity, FN, TP
The level of evidence regarding the outcome measures was downgraded to low level because of risk of bias (one level, see risk of bias table) and imprecision (one level, wide confidence intervals).
Specificity, FP, TN
The level of evidence regarding the outcome measures was downgraded to low level because of risk of bias (one level, see risk of bias table) and imprecision (one level, wide confidence intervals).
Positive predictive value, Negative predictive value
The level of evidence regarding the outcome measures was downgraded to low level because of risk of bias (one level, see risk of bias table) and imprecision (one level, wide confidence intervals).
BAP1 & MTAP compared to BAP1 or MTAP alone
Sensitivity, FN, TP
The level of evidence regarding the outcome measures was downgraded to very low level because of risk of bias (one level, see risk of bias table) and imprecision (two levels, only one study and low number of cases).
Specificity, FP, TN
The level of evidence regarding the outcome measures was downgraded to very low level because of risk of bias (one level, see risk of bias table) and imprecision (two levels, only one study and low number of cases).
Positive predictive value, Negative predictive value
The level of evidence regarding the outcome measures was downgraded to very low level because of risk of bias (one level, see risk of bias table) and imprecision (two levels, only one study and low number of cases)
Zoeken en selecteren
The working group performed an explorative search to find out whether studies investigating the effect of diagnostic methods for malignant mesothelioma on survival, were available. As these studies were not found, a systematic review of the literature was performed to answer the following question: What is the diagnostic accuracy of BAP1 immunohistochemistry and P16 FISH (9p21) or MTAP immunohistochemistry (IHC) compared to the use of these markers alone to distinguish malignant mesothelioma from benign mesothelioma or reactive mesothelial hyperplasia in patients with atypical mesothelial proliferations?
P: patients with atypical mesothelial proliferations (clinically proven malignant or benign reactive mesothelial hyperplasia);
I: BAP1 IHC and (CDKN2A(P16) FISH or MTAP IHC);
C: BAP1, or CDKN2A(P16) FISH or MTAP IHC, or standard immunohistochemistry alone;
R: definite diagnosis by biopsy/resection, clinical follow-up;
O: sensitivity, specificity, positive predictive value, negative predictive value.
Relevant outcome measures
The guideline development group considered specificity (see table 1) as critical outcome measure for decision making, and sensitivity and positive- and negative predictive values as important outcome measures for decision making.
Table 1 Consequences of diagnostic test characteristics
|
Outcome |
Consequences |
Relevance |
|
True positives (TP), high sensitivity |
Patients are justifiably diagnosed with malignant mesothelioma; giving treatment is justified |
Important
|
|
True negatives (TN), high specificity |
Patients are justifiably not diagnosed with malignant mesothelioma; not giving treatment is justified |
Crucial
|
|
False positives (FP), low specificity |
Patients are unjustifiably diagnosed with malignant mesothelioma; giving treatment is unjustified |
Crucial
|
|
False negatives (FN), low sensitivity |
Patients are unjustifiably not diagnosed with malignant mesothelioma; not giving treatment is unjustified |
Important
|
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined a difference of 5% in sensitivity, specificity, positive predictive value (PPV) and negative predictive value (NPV) and a difference of 50 per 1000 patients in TP, TN, FP and FN as a minimal clinically (patient) important difference.
Search and select (Methods)
The databases Medline (via OVID), Embase (via Embase.com), Trip, Gin and Cochrane were searched with relevant search terms until August 22th, 2020 and the search was updated on February 8th, 2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 924 hits. Studies were selected based on the following criteria:
- Peer reviewed systematic reviews, RCTs or observational studies.
- Studies included patients with atypical mesothelial proliferations (malignant or benign mesothelioma or reactive mesothelial hyperplasia).
- Studies included at least 20 patients (at least 10 patients per subgroup (mesothelioma versus non mesothelioma)).
- Definite diagnosis available (clinical follow-up or diagnosis by biopsy/resection was noted).
- Studies compared a combination of the diagnostic tests BAP1 IHC and P16 FISH, or BAP1 and MTAP IHC with BAP1 IHC, P16 FISH (also defined as CDKN2A / 9p21 FISH), MTAP IHC or standard IHC alone.
- Sensitivity and specificity (by FP, FN, TP, TN) were reported.
Forty studies were initially selected based on title and abstract screening. After reading the full text, 32 studies were excluded (see the table with reasons for exclusion under the tab Methods), and eight studies were included. Five studies used data from the same database (Hida, 2016; Hida, 2017; Kinoshita, 2017; Kinoshita, 2018; Yoshimura, 2019). To prevent for multiple inclusion of the same patients, only the most recent study reporting multiple combinations of markers and including several types of malignant mesothelioma (Yoshimura, 2019), was included in the analysis of the literature, together with the three additional studies (Pilippa, 2018; Sheffield, 2015; Walts, 2016).
Results
Four studies were selected from the search and select process. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Andrici, J., Sheen, A., Sioson, L., Wardell, K., Clarkson, A., Watson, N., …& Gill, A.J. (2015). Loss of expression of BAP1 is a useful adjunct, which strongly supports the diagnosis of mesothelioma in effusion cytology. Modern Pathology, 28, 1360–1368.
- Cigognetti, M., Lonardi, S., Fisogni, S., Balzarini, P., Pellegrini, V., Tironi, A., …& Facchetti, F. (2015).BAP1 (BRCA1-associated protein 1) is a highly specific marker for differentiating mesothelioma from reactive mesothelial proliferations. Modern Pathology, 28, 1043–1057.
- Hatem, L., McIntire, P.J., He, B., Gogineni, S., Ho, M., Mathew, S., …& Rao, R.A. (2019). The role of BRCA1-associated protein 1 in the diagnosis of malignant mesothelioma in effusion and fine-needle aspiration cytology. Diagn Cytopathology, 47(3), 160-165.
- Hida, T., Hamasaki, M., Matsumoto, S., Sato, A., Tsujimura, T., Kawahara, K.,... & Nabeshima, K. (2016). BAP1 immunohistochemistry and p16 FISH results in combination provide higher confidence in malignant pleural mesothelioma diagnosis: ROC analysis of the two tests. Pathology international, 66(10), 563-570.
- Hida, T., Hamasaki, M., Matsumoto, S., Sato, A., Tsujimura, T., Kawahara, K.,... & Nabeshima, K. (2017). Immunohistochemical detection of MTAP and BAP1 protein loss for mesothelioma diagnosis: comparison with 9p21 FISH and BAP1 immunohistochemistry. Lung Cancer, 104, 98-105.
- Hiroshima, K., Wu, D., Hamakawa, S., Tsuruoka, S., Ozaki, D., Orikasa, H., …& Imai, K. (2021). HEG1, BAP1, and MTAP are useful in cytologic diagnosis of malignant mesothelioma with effusion. Diagnostic Cytopathology, 49, 622–632.
- Kinoshita, Y., Hamasaki, M., Yoshimura, M., Matsumoto, S., Sato, A., Tsujimura, T.,... & Nabeshima, K. (2018). A combination of MTAP and BAP1 immunohistochemistry is effective for distinguishing sarcomatoid mesothelioma from fibrous pleuritis. Lung Cancer, 125, 198-204.
- Kinoshita, Y., Hida, T., Hamasaki, M., Matsumoto, S., Sato, A., Tsujimura, T.,... & Nabeshima, K. (2018). A combination of MTAP and BAP1 immunohistochemistry in pleural effusion cytology for the diagnosis of mesothelioma. Cancer cytopathology, 126(1), 54-3.
- Noor Husain, A., Colby, T., Ordonez, N., Allen, T., Attanoos, R., Beasley, M.,... & Wick, M. (2018). Guidelines for Pathologic Diagnosis of Malignant Mesothelioma. 2017 Update of the Consensus Statement From the International Mesothelioma Interest Group Arch Pathol Lab Med.;142:89–108.
- Pillappa, R., Maleszewski, J. J., Sukov, W. R., Bedroske, P. P., Greipp, P. T., Boland, J. M.,... & Roden, A. C. (2018). Loss of BAP1 expression in atypical mesothelial proliferations helps to predict malignant mesothelioma. The American journal of surgical pathology, 42(2), 256-263.
- Sheffield, B. S., Hwang, H. C., Lee, A. F., Thompson, K., Rodriguez, S., Tse, C. H.,... & Churg, A. (2015). BAP1 immunohistochemistry and p16 FISH to separate benign from malignant mesothelial proliferations. The American journal of surgical pathology, 39(7), 977-82.
- Walts, A. E., Hiroshima, K., McGregor, S. M., Wu, D., Husain, A. N., & Marchevsky, A. M. (2016). BAP1 immunostain and CDKN2A (p16) FISH analysis: clinical applicability for the diagnosis of malignant mesothelioma in effusions. Diagnostic cytopathology, 44(7), 599-606.
- Woolhouse, I., Bishop, L., Darlison, L., de Fonseka, D., Edey, A., Edwards, J.,.... & Maskell, N. (2018). BTS guideline for the investigation and management of malignant pleural mesothelioma. BMJ Open Resp Res, 5(1):e000266.
- Yoshimura, M., Kinoshita, Y., Hamasaki, M., Matsumoto, S., Hida, T., Oda, Y.,... & Nabeshima, K. (2019). Highly expressed EZH2 in combination with BAP1 and MTAP loss, as detected by immunohistochemistry, is useful for differentiating malignant pleural mesothelioma from reactive mesothelial hyperplasia. Lung Cancer, 130, 187-93.
Evidence tabellen
Evidence table for diagnostic test accuracy studies
|
Study reference |
Study characteristics |
Patient characteristics
|
Index test (test of interest) |
Reference test
|
Follow-up |
Outcome measures and effect size |
Comments |
|||||||||||||||||||||||||||||||||||||||||||||
|
Hida, 2016 |
Type of study:
Setting and country:
Funding and conflicts of interest: |
Inclusion criteria: - malignant pleural mesothelioma (MPM) or non-mesothelioma with reactive mesothelial hyperplasia (RMH) - obtained from the pleural lesion files of the department of pathology between 2001 and 2015 World Health Organization (WHO) classification issued in 2015 - mesothelial nature of each tumor was confirmed using IHC assay
Exclusion criteria: - Sarcomatoid -type tumors
N= RMH: 20 Prevalence: 40%
Mean age (range): MPM: 63.0 years (range 33 to 81) RMH: 34.5 years (range 18 to 78)
Sex: % M / % F
Other important characteristics: MPM cases: 11/40 biopsy specimens; 29/40 surgical resection) 35/40 epithelioid; 4/40 biphasic |
Describe index test: BAP1 immunohistochemistry (IHC) or Fluorescence In Situ Hybridization (FISH) of P16
Cut-off point(s): BAP1 IHC loss at 19.7% Or P16 HD at 11.0%
Comparator test 1:
Cut-off point(s): BAP1 IHC loss at 19.7%
Comparator test 2:
Cut-off point(s): P16 HD at 11.0%
|
Describe reference test: The mesothelial nature of each tumor was confirmed using IHC assays.
Mesothelioma diagnosis and classification was performed following the World Health Organization (WHO) guideline for 2015
Cut-off point(s): Not applicable
|
Time between the index test and reference test: Not reported
For how many participants were no complete outcome data available? N=0 (0%)
Reasons for incomplete outcome data described? Not applicable |
Outcome measures and effect size (include 95%CI and p-value if available):
BAP1 loss or P16 HD loss:
Sensitivity: 92.5% Specificity: 100% P (versus BAP1): 0.0332 P (versus p16 HD): 0.0005
BAP1 IHC loss:
Sensitivity: 67.5% Specificity: 100% P (versus P16HD): 0.3153
P16 HD FISH loss:
Sensitivity: 67.5% Specificity: 100% P (versus BAP1): 0.3153
|
Author’s conclusions: “BAP1 IHC and p16 FISH had independent diagnostic value for differentiation of MPM from RMH. Combining the results of the two assays increased the sensitivity of, and confidence in, the accuracy of the MPM diagnosis.” |
|||||||||||||||||||||||||||||||||||||||||||||
|
Hida, 2017 |
Type of study: cohort
Setting and country: Fukuoka University Hospital, Japan
Funding and conflicts of interest: Conflicts of interest: non declared |
Inclusion criteria: - malignant pleural mesothelioma (MPM) or non-mesothelioma with reactive mesothelial hyperplasia (RMH) - obtained from the pleural lesion files of the department of pathology between 2001 and 2015 World Health Organization (WHO) classification issued in 2015 - mesothelial nature of each tumor was confirmed using IHC assay
Exclusion criteria: - Sarcomatoid -type tumors
N= MPM: 51 RMH: 25 Prevalence: 67%
Mean age (range): MPM: 63.8 years (range 33 to 81) RMH: 34.4 years (range 18 to 78)
Sex: % M / % F
Other important characteristics: MPM cases: 16/51 biopsy specimens; 35/51 surgical resection) 44/51 epithelioid; 7/40 biphasic |
Describe index test: BAP1 immunohistochemistry (IHC) or 9p21 fluorescence in situ Hybridization (FISH)
Cut-off point(s): BAP1 IHC loss at 19.4% Or 9p21 FISH HD at 11.0%
Index test 2: BAP1 immunohistochemistry (IHC) and MTAP IHC
Cut-off point(s): BAP1 IHC loss at 19.4% Or MTAP IHC loss at 32.2%
Comparator test 1:
Cut-off point(s): BAP1 IHC loss at 19.4%
Comparator test 2:
Cut-off point(s): MTAP IHC loss at 32.2%
Comparator test 3:
Cut-off point(s): 9p21 FISH HD at 11.0%
|
Describe reference test: The mesothelial nature of each tumor was confirmed using IHC assay.
Mesothelioma diagnosis and classification was performed following the World Health Organization (WHO) guideline for 2015
Cut-off point(s): Not applicable
|
Time between the index test and reference test: Not reported
For how many participants were no complete outcome data available? N=0 (0%)
Reasons for incomplete outcome data described? Not applicable |
Outcome measures and effect size (include 95%CI and p-value if available):
BAP1 IHC or 9p21 FISH:
Sensitivity: 84.3% Specificity: 100%
BAP1 IHC or MTAP IHC:
Sensitivity: 76.5% Specificity: 100% P (versus BAP1 IHC): 0.0386 P (versus 9p21 FISH): 0.0229
BAP1 IHC:
Sensitivity: 60.8% Specificity: 100%
MTAP IHC:
Sensitivity: 45.1% Specificity: 100%
9p21 FISH:
Sensitivity: 60.8% Specificity: 100%
|
Author’s conclusions: “A combination of MTAP and/or BAP1 loss detected by IHC can likely detect MPM with good sensitivity that is higher than that of BAP1 IHC alone or 9p21 FISH alone. This combination could therefore serve as a useful ancillary IHC method for the discrimination of MPM from RMH, although a combination of BAP1 IHC and 9p21 FISH remains the most accurate ancillary tool. However, it is important to confirm the mesothelial origin of the tumor before applying combinations of MTAP and BAP1 IHCs or BAP1 IHC and 9p21 FISH for MPM diagnosis.” |
|||||||||||||||||||||||||||||||||||||||||||||
|
Kinoshita, 2017 |
Type of study: cohort
Setting and country: Fukuoka University Hospital, Japan
Funding and conflicts of interest: Japanese Society for the Promotion of Science; Research Center for Advanced Molecular Medicine, Fukuoka University; the Ministry of the Environment; Fukuoka Foundation for Sound Health Cancer Research Fund Conflicts of interest: non declared |
Inclusion criteria: - malignant pleural mesothelioma (MPM) or non-mesothelioma with reactive mesothelial hyperplasia (RMH) - obtained from the pleural lesion files of the department of pathology between 2001 and 2016
Exclusion criteria: None described
N= Initially MPM: 52 RMH: 30 Prevalence: 63%
After exclusion due to insufficient mesothelial cells or inadequate immunostaining of internal control cells or monosomy of chromosome 9 detected. RMH: 21 Prevalence: 63%
Mean age (range): MPM: 69.7 years (range 47 to 94) RMH: 70.5 years (range 44 to 89)
Sex: % M / % F
Other important characteristics: 42/45 epithelioid; 3/45 biphasic RMH cases: 14/21 benign pleural effusions from patients with lung cancer; 3/21 pneumonia; 4/21 cardiovascular disease |
Describe index test: BAP1 immunohistochemistry (IHC) or 9p21 fluorescence in situ Hybridization (FISH)
Cut-off point(s): BAP1 IHC loss at 50% Or 9p21 FISH HD at 10%
Index test 2: BAP1 immunohistochemistry (IHC) or MTAP IHC
Cut-off point(s): BAP1 IHC loss at 50% Or MTAP IHC loss at 50%
Comparator test 1:
Cut-off point(s): BAP1 IHC loss at 50%
Comparator test 2:
Cut-off point(s): MTAP IHC loss at 50%
Comparator test 3:
Cut-off point(s): 9p21 FISH HD at 10%
|
Describe reference test: The mesothelial Origin of the tumor was confirmed using IHC assay.
Mesothelioma diagnosis and histological subtype were performed following the World Health Organization (WHO) classification
Cut-off point(s): Not applicable
|
Time between the index test and reference test: Not reported
For how many participants were no complete outcome data available? N=0 (0%)
Reasons for incomplete outcome data described? Not applicable |
Outcome measures and effect size (include 95%CI and p-value if available):
BAP1 IHC or 9p21 FISH:
Sensitivity: 84.4% Specificity: 100%
BAP1 IHC or MTAP IHC:
Sensitivity: 77.8% Specificity: 100%
BAP1 IHC:
Sensitivity: 60.0% Specificity: 100%
MTAP IHC:
Sensitivity: 42.2% Specificity: 100%
9p21 FISH:
Sensitivity: 62.2% Specificity: 100%
|
Author’s conclusions: “A combination of MTAP and BAP1 IHC in cell blocks from pleural effusions was found to be a reliable and useful method for differentiating MPM cells from reactive mesothelial cells when the results were interpreted properly and accurately” |
|||||||||||||||||||||||||||||||||||||||||||||
|
Kinoshita, 2018 |
Type of study: cohort
Setting and country: Fukuoka University Hospital, Japan
Funding and conflicts of interest: Funding:Grants-in-Aid for Scientific Research from the Japanese Society for the Promotion of Science; Research Center for Advanced Molecular Medicine, Fukuoka UniversityCentral Research Institute of Fukuoka University. Conflicts of interest: non declared |
Inclusion criteria: - malignant pleural mesothelioma (MPM) with a sarcomatoid component (biphasic or sarcomatoid) or fibrous pleuritis - obtained from the pleural lesion files of the department of pathology between 2001 and 2017
Exclusion criteria: - for fibrous pleuritis not able to follow clinical status for a year
N= MPM: 30 Fibrous pleuritis: 17 Prevalence: 63.8%
Mean age (range): MPM: 71.3 years (range 53 to 86) Fibrous pleuritis: 69.2 years (range 49 to 83)
Sex: % M / % F
Other important characteristics: 18/30 sarcomatoid; 12/30 biphasic |
Describe index test: BAP1 immunohistochemistry (IHC) or 9p21 fluorescence in situ Hybridization (FISH)
Cut-off point(s): BAP1 IHC loss at 50% Or 9p21 FISH HD at 10%
Index test 2: BAP1 immunohistochemistry (IHC) or MTAP IHC
Cut-off point(s): BAP1 IHC at 50% Or MTAP IHC loss at 50%
Comparator test 1:
Cut-off point(s): BAP1 IHC loss at 50%
Comparator test 2:
Cut-off point(s): MTAP IHC loss at 50%
Comparator test 3:
Cut-off point(s): 9p21 FISH HD at 10% |
Describe reference test: The mesothelial Origin of the tumor was confirmed using IHC assay.
Mesothelioma diagnosis and histological subtype was performed following the World Health Organization (WHO) classification
Fibrous pleuritis
Cut-off point(s): Not applicable
|
Time between the index test and reference test: Not reported
For how many participants were no complete outcome data available? N=5 (10.6%)
Reasons for incomplete outcome data described? N=2: MTAP IHC was judged as undeterminable N=3: BAP1 IHC was judged as undeterminable |
Outcome measures and effect size (include 95%CI and p-value if available):
BAP1 IHC or 9p21 FISH:
Sensitivity: 100% Specificity: 100%
BAP1 IHC or MTAP IHC:
Sensitivity: 90% Specificity: 100%
BAP1 IHC:
Sensitivity: 36.7% Specificity: 100%
MTAP IHC:
Sensitivity: 80% Specificity: 100%
9p21 FISH:
Sensitivity: 93.3% Specificity: 100%
|
Author’s conclusion: “with an accurate interpretation of results, a combination of MTAP and BAP1 IHC was a reliable and effective method for differentiating sarcomatoid MPM from fibrous pleuritis. When 9p21 FISH is not available for diagnosis, MTAP IHC is a useful alternative detection assay” |
|||||||||||||||||||||||||||||||||||||||||||||
|
Pilippa, 2018 |
Type of study:
Setting and country:
Funding and conflicts of interest: |
Inclusion criteria: - obtained from institutional pathology archives of Mayo Clinic Rochester, MN (1993 to 2016) - available histology slides of the atypical mesothelial proliferation and follow-up, with clinical or pathological confirmed diagnoses
Exclusion criteria: None described
N=37, but three excluded because deeper tissue levels lacked sufficient material for further testing --> N=34
Prevalence: 44.1%
Median age (range): 68.3 years (33.8 to 89)
Sex: 64.7% male; 35.3% female
Other important characteristics: Location: 61.8% pleura; 8.8% pericardium; 29.4% peritoneum Source of tissue: Subtype: 32/34 epithelioid; 2/34 biphasic. Follow-up median 31.7 months (range 0.3 to 202) |
Describe index test: BAP1 immunohistochemistry (IHC) or 9p21 fluorescence in situ Hybridization (FISH)
Cut-off point(s): BAP1 IHC loss: no nuclear staining of mesothelial cells (with positive internal control) was considered lost. Or 9p21 FISH HD at 9.0%
Comparator test 1:
Cut-off point(s): BAP1 IHC loss: no nuclear staining of mesothelial cells (with positive internal control) was considered lost.
Comparator test 2:
Cut-off point(s): 9p21 FISH HD at 9.0%
|
Describe reference test: Clinical or pathological confirmed diagnosis
Cut-off point(s): Not applicable
|
Time between the index test and reference test: Not reported
For how many participants were no complete outcome data available? N=3/34 (8.8%)
Reasons for incomplete outcome data described? No |
Outcome measures and effect size (include 95%CI and p-value if available):
BAP1 IHC or 9p21 FISH:
Sensitivity/specificity: not reported
BAP1 IHC:
Sensitivity: 43.7% Specificity: 100%
9p21 FISH:
Sensitivity/specificity: not reported
|
Author’s conclusion: “loss of BAP1 expression can be useful in making a definitive diagnosis of MM, even in the absence of invasion or tumefactive growth. However, retained expression of BAP1 in atypical mesothelial proliferations cannot be used to predict the absence of MM. Although homozygous CDKN2A deletion has been shown to be specific for MM and has not been described in reactive mesothelial proliferations, in our study, this marker did not prove to be useful in the prediction of MM in cases of atypical mesothelial proliferation.” |
|||||||||||||||||||||||||||||||||||||||||||||
|
Sheffield, 2015 |
Type of study: cohort
Setting and country: Vancouver General Hospital, Canada; PhenoPath Laboratories, Seattle, W.A. USA
Funding and conflicts of interest: none |
Inclusion criteria: - mesotheliomas with typical histologic patterns and characteristic traditional immunohistochemical staining were selected (Lee, 2013) which the clinical features were unequivocally those of a benign process and in which microscopic examination showed nothing to suggest a malignant process were used (Lee, 2013) of the Vancouver General Hospital and from the consultation files of 1 of the authors (A.C.) (Lee, 2013) - having epithelial, spindled, or mixed epithelial and spindled morphology
Exclusion criteria: None described
N= MM: 31 Benign mesoth.: 52 Prevalence: 37.3%
Mean age ± SD: Not reported
Sex: % M / % F
Other important characteristics: 27/31 pleural; 3/31 peritoneal; 1/31 pericardial; Subtype: 15/31 epitheloid; 11/31 sarcomatoid; 5/31 biphasic. BM: site of origin |
Describe index test: BAP1 immunohistochemistry (IHC) or fluorescence in situ Hybridization (FISH) of P16
Cut-off point(s): BAP1 IHC not reported (homogenous loss of nuclear staining in tumor cells) Or P16 FISH HD at 12.0%
Comparator test 1:
Cut-off point(s): BAP1 IHC not reported (homogenous loss of nuclear staining in tumor cells)
Comparator test 2:
Cut-off point(s): P16 HD at 12.0%
|
Describe reference test: original clinical diagnosis
Cut-off point(s): Not applicable
|
Time between the index test and reference test: Not reported
For how many participants were no complete outcome data available? BAP1: N=8 (7%) FISH p16: N=16 (19%)
Reasons for incomplete outcome data described? FISH: technical issues |
Outcome measures and effect size (include 95%CI and p-value if available):
BAP1 loss or FISH P16 loss:
Sensitivity: 58% (95%CI 46 to 71) Specificity: 100% (95%CI 100 to 100)
BAP1 IHC loss:
Sensitivity: 27% (95%CI 17 to 37) Specificity: 100% (95%CI 100 to 100)
P16 FISH loss:
Sensitivity: 52% (95%CI 40 to 64) Specificity: 100% (95%CI 100 to 100)
|
Author’s conclusion: “Tissue invasion is the best marker of malignancy with mesothelial processes, and p16 FISH/BAP1 IHC testing should be reserved for cases in which invasion cannot be demonstrated or is equivocal.” |
|||||||||||||||||||||||||||||||||||||||||||||
|
Walts, 2016 |
Type of study: Cohort
Setting and country:
Funding and conflicts of interest: |
Inclusion criteria: - biopsy confirmed malignant mesothelioma - or reactive effusions showing atypical mesothelial cells - retrieved from the archives of the department of pathology and laboratory medicine at Cedras-Sinai Medical Center Exclusion criteria:
N= MM: 32
Prevalence: 47.7%
(only 38 cases analysed by FISH and bap1: 17 MM and 21 reactive effusion; prevalence 44.7%)
Medan age (range): MM: 69 years (37 to 84) Reactive effusion: 69 years (18 to 94)
Sex: % M / % F Reactive effusion: 54.3%; 45.7% female
Other important characteristics: MM: Subtype: Reactive effusion: |
Describe index test: BAP1 immunohistochemistry (IHC) and/or fluorescence in situ Hybridization (FISH) of P16
Cut-off point(s): BAP1 IHC 50% Or CDKN2A (P16) FISH homozygous deletion pattern 15% or hemizygous deletion patten 41.5%
Comparator test 1:
Cut-off point(s): BAP1 IHC 50%
Comparator test 2:
Cut-off point(s): P16 homozygous deletion pattern 15% or hemizygous deletion patten 41.5%
|
Describe reference test: Mesothelioma biopsy confirmed; patients with reactive effusions were followed for a median of 36 months (range 13-204)
Cut-off point(s): Not applicable
|
Time between the index test and reference test: Not reported
For how many participants were no complete outcome data available? N =0 (0%)
Reasons for incomplete outcome data described? |
Outcome measures and effect size (include 95%CI and p-value if available):
BAP1 loss AND FISH P16 loss:
Sensitivity: 17.6% Specificity: 81.0%
BAP1 loss OR FISH P16 loss:
Sensitivity: 64.7% Specificity: 100%
BAP1 IHC loss:
Sensitivity: 41.2% Specificity: 81%
P16 FISH loss:
Sensitivity: 41.2% Specificity: 100%
|
Author’s conclusion: “support the use of BAP1 IHC and CDKN2A(P16) FISH for the evaluation of atypical mesothelial cells in effusion cytology specimens. Although performance of both tests is preferable, CDKN2A(P16) FISH may not be available in many cytology laboratories and we, like Churg et al.8 find it reasonable to use BAP1 IHC to screen effusions with atypical mesothelial cells followed by CDKN2A(P16) FISH confirmation in selected cases where the clinical and imaging findings are not strongly suggestive of MM” |
|||||||||||||||||||||||||||||||||||||||||||||
|
Yoshimura, 2019 |
Type of study: Cohort
Setting and country: Setting and country:
Funding and conflicts of interest: Funding: Grants-in-Aid for Scientific Research from the Japanese Society of the Promotion of Science; Research Center for Advanced Molecular Medicine, Fukuoka University; Central Research Institute of Fukuoka University |
Inclusion criteria: - malignant pleural mesothelioma and reactive mesothelial hyperplasia case - obtained from the pleural lesion file of the department of pathology, Fukuoka University Hospital, Fukuoka, Japan, between 2001 and 201 - histological mesothelioma diagnosis and classification were performed following the World health Organization guidelines and classification for 2015. - The mesothelial nature of each tumor was confirmed using IHC assays.
Exclusion criteria: None described
N= MPM: 38 RMH:29
Prevalence: 56.7%
Mean age (range): MPM: 65.3 years (33-86)
Sex: % M / % F MPM: 81.6% male; 18.4% female
Other important characteristics: MPM: Histological subtype: 27/28 epithelioid; 6/38 biphasic; 5/38 sarcomatoid RMH: |
Describe index test: BAP1 immunohistochemistry (IHC) or 9p21 fluorescence in situ Hybridization (FISH)
Cut-off point(s): BAP1 IHC loss at 50% Or 9p21 FISH HD at 11%
Index test 2: BAP1 immunohistochemistry (IHC) or MTAP IHC
Cut-off point(s): BAP1 IHC at 50% Or MTAP IHC loss at 50%
Comparator test 1:
Cut-off point(s): BAP1 IHC loss at 50%
Comparator test 2:
Cut-off point(s): MTAP IHC loss at 50%
Comparator test 3:
Cut-off point(s): 9p21 FISH HD at 11% |
Describe reference test:
The mesothelial nature of each tumor was confirmed using IHC assay.
Mesothelioma diagnosis and classification were performed following the World Health Organization (WHO) guideline for 2015
|
Time between the index test and reference test: Not reported
For how many participants were no complete outcome data available? N=0 0(%)
Reasons for incomplete outcome data described? Not applicable |
Outcome measures and effect size (include 95%CI and p-value if available):
BAP1 IHC or 9p21 FISH:
Sensitivity: 81.6% Specificity: 100%
BAP1 IHC or MTAP IHC:
Sensitivity: 73.7% Specificity: 100%
BAP1 IHC:
Sensitivity: 52.6% Specificity: 100%
MTAP IHC:
Sensitivity: 47.9% Specificity: 100%
9p21 FISH:
Sensitivity: 65.8% Specificity: 100%
|
- |
Risk of bias assessment
|
Study reference |
Patient selection
|
Index test |
Reference standard |
Flow and timing |
Comments with respect to applicability |
|
Hida, 2016 |
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? No
Did the study avoid inappropriate exclusions? No
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? No
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Unclear
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: HIGH |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: HIGH (thresholds were defined on study data) |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: UNCLEAR |
|
|
|
Hida, 2017 |
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? No
Did the study avoid inappropriate exclusions? No (only cases with definitive diagnosis included)
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? No
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Unclear
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: HIGH |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: HIGH (thresholds were defined on study data) |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: UNCLEAR |
|
|
Kinoshita, 2017 |
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? No
Did the study avoid inappropriate exclusions? No
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? Yes
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Unclear
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: HIGH |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR (Blinding during measurements not described) |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: UNCLEAR |
|
|
Kinoshita, 2018
|
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? No
Did the study avoid inappropriate exclusions? No
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? Yes
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? No
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: HIGH |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR (Blinding during measurements not described) |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
||
|
Pilippa, 2018
|
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? Yes Did the study avoid inappropriate exclusions? No
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? Yes
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? No
Were all patients included in the analysis? No |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: HIGH |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR (Blinding during measurements not described) |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
||
|
Sheffield, 2015 |
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? No
Did the study avoid inappropriate exclusions? No
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? Yes
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? No
Were all patients included in the analysis? No |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: HIGH |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR (Blinding during measurements not described) |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: HIGH (almost one third of patients had missing data) |
||
|
Walts, 2016 |
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? No
Did the study avoid inappropriate exclusions? No
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? Yes
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? No
Were all patients included in the analysis? No |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: HIGH |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR (Blinding during measurements not described) |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: HIGH (almost half of the included patients were not included in relevant analysis) |
||
|
Yoshimura, 2019 |
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? No
Did the study avoid inappropriate exclusions? No
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? Yes
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Unclear
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: HIGH |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR (Blinding during measurements not described) |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: UNCLEAR |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Althakfi, 2020 |
No comparison of malignant versus non-malignant mesothelioma |
|
Berg, 2018 |
Reference was not described |
|
Berg, 2020 |
No comparison with combined markers (BAP1 & Fish/MTAP) included |
|
Bhardwaj, 2012 |
Paper discussion |
|
Brich, 2020 |
Only malignant mesothelioma cases included |
|
Bruno, 2020 |
Low number of cases |
|
Chevrier, 2020 |
Only malignant mesothelioma cases included |
|
Churg, 2020 |
Narrative review |
|
Eccher, 2021 |
Narrative review |
|
Fels Elliot, 2020 |
Narrative review |
|
Galateay Salle 2018 |
Only malignant mesothelioma cases included |
|
Girolami, 2020 |
Protocol article |
|
Hiroshima, 2017 |
Abstract |
|
Hiroshima, 2020 |
Low number of cases |
|
Hung, 2020 |
Narrative review |
|
Hwang, 2016a |
Compares different types of malignant mesothelioma instead of malignant mesothelioma versus non-malignant mesothelioma |
|
Hwang, 2016b |
Low number of cases |
|
Kinoshita, 2020 |
Other research question |
|
Kinoshita, 2020 |
Abstract |
|
Liu, 2018 |
No comparison with combined markers (BAP1 & Fish/MTAP) included |
|
McGegor, 2017 |
Only malignant mesothelioma cases included |
|
Pillappa, 2019 |
Narrative review |
|
Ren, 2020 |
Reference was not described |
|
Rozitis, 2020 |
Narrative review |
|
Schulte, 2020 |
Narrative review |
|
Shahi, 2018 |
Abstract |
|
Shahi, 2020 |
Abstract |
|
Sheaff, 2020 |
Narrative review |
|
Siddiqui, 2019 |
Proceedings |
|
Singhi, 2016 |
Only malignant mesothelioma cases included |
|
Wu, 2017 |
Only malignant mesothelioma cases included |
|
Zaleski, 2020 |
Only malignant mesothelioma cases included |
|
Hida, 2016 |
Same database as Yoshimura, 2019 |
|
Hida, 2017 |
Same database as Yoshimura, 2019 |
|
Kinoshita, 2017 |
Same database as Yoshimura, 2019 |
|
Kinoshita, 2018 |
Same database as Yoshimura, 2019 |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-04-2022
Beoordeeld op geldigheid : 09-03-2022
Algemene gegevens
De Nederlandse Vereniging voor Radiologie heeft een verklaring van geen bezwaar afgegeven.
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met een mesothelioom.
Werkgroep
- Dr. J.M.M.F. Quispel, longarts, NVALT (voorzitter)
- Dr. J.A. Burgers, longarts, NVALT
- Dr. R. Cornelissen, longarts, NVALT
- Drs. B.I. Hiddinga, longarts, NVALT
- Dr. H.M. Klomp, chirurg, NVvH
- Dr. E.V.E. Madsen, oncologisch en gastro-intestinaal chirurg, NVvH
- Prof. dr. D.K.M. de Ruysscher, radiotherapeut-oncoloog, NVRO
- Drs. A.P.W.M. Maat, cardiothoracaal chirurg, NVT
- Dr. J.H. von der Thüsen, patholoog, NVVP
- Dr. M. Nielsen, klinisch geneticus, VKGN
- C.J. van den Boom-Bernaards, patiëntvertegenwoordiger, Asbestslachtoffers Vereniging Nederland (tot en met januari 2021)
- T.J.H. Koopman, patiëntvertegenwoordiger/bestuurslid, Asbestslachtoffers Vereniging Nederland
Meelezers:
- Dr. A. Bartels-Rutten, radioloog, NVvR
Met ondersteuning van
- Dr. J. Boschman, senior adviseur, Kennisinstituut van Medisch Specialisten (tot en met oktober 2020)
- Drs. I. van Dusseldorp, senior informatiespecialist, Kennisinstituut van Medisch Specialisten
- Dr. S.N. Hofstede, senior adviseur, Kennisinstituut van Medisch Specialisten (vanaf november 2020)
- Dr. J.C. Maas, adviseur, Kennisinstituut van Medisch Specialisten
- Drs. M. van der Maten, medisch informatiespecialist, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Quispel-Janssen (voorzitter) |
Longarts Haaglanden Medisch Centrum Antoniushoeve |
* lid Sectie Asbestgerelateerde Aandoeningen, onbetaald |
Subinvestigator bij Investigator Initiated trial NivoMes (nivolumab in mesothelioma) mede gefinancierd met unrestricted grant van BMS. Eerst auteur bij studie, gepubliceerd in 2018; Bijdrage voor het drukken van mijn proefschrift ontvangen waarvoor presentatie gegeven bij BMS over NivoMes studie |
Restrictie, uitsluiten met betrekking tot besluitvorming nivolumab. Vicevoorzitter Hiddinga neemt het hier over. |
|
Madsen |
Oncologisch en gastro-intestinaal chirurg, Erasmus Medisch Centrum Rotterdam |
Geen |
"Extern gefinancierd onderzoek door KWF en stichting Coolsingel: trial naar de feasibility van dendritische cel immunotherapie (DCBI) als adjuvante behandeling na chirurgische behandeling vanwege peritoneaal mesothelioom.
Extern gefinancierd onderzoek door Machiel vd Wouden stipendium (IAS) om het effect van tumor debulking op de effectiviteit van DCBI te beoordelen." |
Restrictie; wordt niet betrokken bij de literatuurselectie en literatuurbeoordeling van modules ten aanzien van immunotherapie na chirurgische behandeling vanwege peritoneaal mesothelioom en modules ten aanzien van immunotherapie en tumor debulking |
|
Nielsen |
Klinisch Geneticus LUMC |
Geen |
"In het LUMC wordt, onder andere door werkgroeplid, onderzoek gedaan naar erfelijke aanleg voor mesothelioom (en oog/huidmelanoom en nierkanker) veroorzaakt door kiembaan mutaties in het BAP1-gen,. Het betreft beschrijvend onderzoek van het phenotype (type tumoren, kanker risico's). Tevens is wordt er een database bijgehouden waarin data worden geregistreerd van patiënten met een BAP1 mutatie wat de uitkomsten zijn van de jaarlijkse controles van de betrokken organen.
Er is een kleine subsidie van het oogfonds (ongeveer 80000 euro) vanuit de oogheelkunde verkregen voor een PhD student die de database en families bijhoudt.
Ik kan op dit moment geen conflict verzinnen / of belang van een bepaalde uitkomst van deze richtlijn direct" |
Geen |
|
Boom, van den |
Geen |
Geen |
Geen |
Geen |
|
Ruysscher, de |
Radiotherapeut-Oncoloog Maastro |
Alle volgende nevenwerkzaamheden worden betaald aan Maastro (dus geen persoonlijke inkomsten): |
Research Funding (nooit persoonlijke ontvangsten): Boehringer Ingelheim, Bristol-Myers Squibb, AstraZeneca, Philips, Olink, KWF, ZonMw, EU |
Geen, nevenwerkzaamheden betreffen niet mesothelioom.
Advies om adviesraden te stoppen tijdens de richtlijnontwikkeling. |
|
Koopman |
* Bestuurslid bij Asbestslachtoffer Vereniging Nederland (AVN). |
Geen |
Ik heb alleen belang bij een duidelijke richtlijn als mede bestuurslid van het AVN |
Geen |
|
Klomp |
Chirurg, NKI - AVL |
Raad van Toezicht IJsselland Ziekenhuis Peer review – onbetaald
Vertrouwenspersoon – onbetaald
Docent AVL academie – onbetaald
Docent CASH – onbetaald
Geen persoonlijke inkomsten, contracten via Technology Transfer NKI-AVL
|
(patent (ongerelateerd aan mesothelioom) WO2010116003), dus: Geen
Educational grants, consultancy, speaker fees via Pfizer, Roche, Medtronic uitsluitend contracten via Technology Transfer NKI-AVL |
Geen, patent wordt niet in de richtlijn aangehaald en/of benoemd |
|
Maat |
Cardiothoracaal chirurg Erasmus MC Rotterdam, full time dienstverband |
Onbetaald: |
“Geen”
Betaald: * voordrachten tijdens diverse ROTS review symposia * organisator landelijke cursussen voor VATS segmentectomie en VATS lobectomie (inkomsten gaan naar onze afdeling) * lessen aan de Amstel Academie voor de landelijke opleiding OK en anesthesie assistenten van de cardio-thoracale chirurgische centra * reviewer voor wetenschappelijke aanvragen van de DLCA-S werkgroep * incidenteel uitvoeren van expertises bij medische aansprakelijkheid zaken" |
Geen |
|
Cornelissen |
Longarts Erasmus MC |
Geen |
"* Speakers fee Roche, Pfizer, BMS * Advisory board Roche, MSD, Boehringer "; subinvestigator: NVALT (NVALT 5 en 19) Boehringer (Lume meso studie) Novocure (stellar studie) Astra (determine studie) Verastem (command studie) Bayer (anetumab ravitansine versus vinorelbine) |
Restrictie: Wordt geen trekker van modules ten aanzien van immunotherapie (nivolumab +ipilimab) |
|
Burgers |
Longarts Antoni van Leeuwenhoek Ziekenhuis |
* Voorzitter SAGA, onbetaald |
Lid van een Independent Data Monitoring Committee bij een studie van Hoffmann-La Roche Ltd. Het AVL krijgt hiervoor een financiële tegemoetkoming. Lidmaatschap van een adviesraad van Astra Zeneca en Boehringer Ingelheim. Beide voor het laatst in 2017. Het AVL kreeg hiervoor een financiële tegemoetkoming. Geen van deze taken betreft/betrof de ziekte mesothelioom; Mijn studie 'Lenvatinib and pembrolizumab in malignant pleural mesothelioma: a singel arm phase II trial'. Wordt gefinancierd door Merck & Co met een unrestricted grant. Mijn studie 'Switch maintenance gemcitabine after first line platinum pemetrexed therapy': a randomised phase II study wordt gefinancierd door het KWF.
Geeft aan dat er ‘actieve’ conflicten zijn met Roche (IDMC) en die met MSD (sponsoring investigator initiated studie) |
Restrictie; uitsluiten bij besluitvorming over lenvatinib and pembrolizumab. |
|
Hiddinga |
Longarts UMCG Groningen |
NVALT, lid sectie asbest gerelateerde aandoeningen, onbetaald; lid sectie Oncologie, onbetaald; lid sectie Endoscopie, onbetaald. |
Geen |
Geen |
|
Von der Tűssen |
Patholoog, Erasmus MC |
Geen |
Geen
Geeft aan bezig te zijn met mesothelioom gerelateerde aanvraag bij BMS, maar is nog niet toegekend. |
Geen |
|
Bartels-Rutten |
Radioloog, Antoni van Leeuwenhoek ziekenhuis |
Geen |
Geen |
Geen |
|
Boschman Tot oktober 2020 |
(senior) adviseur kennisinstituut
Managing Editor/Researcher Cochrane Work, Amsterdam UMC |
Geen |
Financiering Health research (NIHR, UK): Projectleider updaten van Cochrane review over stress-interventies voor werknemers in de gezondheidszorg |
|
|
Hofstede Vanaf oktober 2020 |
(senior) adviseur kennisinstituut |
Geen |
Geen |
Geen |
|
Maas |
Adviseur kennisinstituut |
Onderzoeker in opleiding VU Medisch Centrum 1-4-2009 tot 1-9-2017, vanaf 1-10-2013 onbetaald; Dienstverband National Cardiovascular Data Registry 1 januari 2014 tot en met 31 augustus 2019; Dienstverband Nederlandse Hart Registratie 1 september 2018 tot en met 31 juli 2019 |
Geen, onderzoek inmiddels volledig afgerond, financiering van PhD onderzoek of de sponsors van het proefschrift hebben geen enkele invloed op de huidige werkzaamheden. |
Geen actie nodig. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het opnemen van afgevaardigden namens Asbestslachtoffers Vereniging Nederland (die tevens een enquête onder leden hebben uitgestuurd waarvan een verslag is opgenomen in de bijlagen) in de werkgroep. Daarnaast zijn de Asbestslachtoffers Vereniging Nederland en de Patiëntenfederatie Nederland uitgenodigd voor het deelnemen aan de schriftelijke knelpuntenanalyse. De resultaten hiervan zijn besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Asbestslachtoffers Vereniging Nederland en de Patiëntenfederatie Nederland. De eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz. Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst.
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module [Erfelijkheid] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Diagnostiek - pathologie] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Diagnostiek – beeldvormende technieken] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Systemische behandeling - immuuntherapie] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Systemische behandeling - gemcitabine] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Systemische behandeling - onderhoudsbelandeling] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Systemische behandeling – startpunt van de behandeling] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Chirurgie - peritoneaal] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Chirurgie - pleuraal] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Palliatie - chirurgie] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Palliatie – adjuvante radiotherapie] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Palliatie – radiotherapie symptoomreductie] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Informatieverstrekking aan de patiënt] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module [Organisatie van zorg] |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met een mesothelioom. Tevens zijn er knelpunten aangedragen door verschillende partijen via een vragenlijst. Een verslag hiervan is opgenomen in de bijlagen.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Algemene informatie
|
Richtlijn: Mesothelioom |
|
|
Orienterende search: Moleculaire diagnostiek |
|
|
Database(s): Embase, Medline, Trip, GIN, Cochrane |
Datum: update op 8-2-2021 (oorspronkelijk 18-8-2020) |
|
Periode: Geen restrictie |
Talen: Engels |
|
Literatuurspecialist: Miriam van der Maten |
|
|
Toelichting en opmerkingen: Er werd een update uitgevoerd op 8 februari 2021 om vanaf 2010 in Embase en Medline, naast SR en RCT, ook naar overige studie designs te zoeken. Dit leverde nog 339 extra hits op.
De opgegeven sleutelartikelen wordt gevonden met de oriënterende search (niet in de categorie SR of RCT). |
|
Zoekopbrengst
Embase en Medline
|
|
Embase |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
22 |
20 |
29 |
|
RCT |
103 |
34 |
122 |
|
Totaal |
1197 |
54 |
- |
|
Update vanaf 2010 Alle studiedesigns |
490 |
461 |
339 (ook ontdubbeld t.o.v. totale set die al op Rayyan stond) |
Trip database
26 systematic reviews
4 key primary research
2 controlled trials
140 primary research
5 Ongoing systematic reviews
5 Ongoing clinical trials
1 eTextbook
GIN database
|
Title |
Organisation |
Type |
Date |
Relevant Countries |
Publication Status |
|
Treatment of Malignant Pleural Mesothelioma: American Society of Clinical Oncology Clinical Practice Guideline |
ASCO (US) - American Society of Clinical Oncology |
Guideline |
Jan 18, 2018 |
United States |
Published |
|
The Use of Chemotherapy in Patients with Advanced Malignant Pleural Mesothelioma |
McMaster University (CA) |
Guideline |
Nov 12, 2012 |
Canada |
Published |
|
Surgical Management of Malignant Pleural Mesothelioma |
McMaster University (CA) |
Guideline |
May 15, 2012 |
Canada |
Publishe |
Cochrane
|
Wat |
Titel |
Auteur |
Jaar |
|
Cochrane reviews |
Radiotherapy for malignant pleural mesothelioma |
Evelina Chapman, Marcelo García Diéguez |
2006 |
|
Radical multimodality therapy for malignant pleural mesothelioma |
Omar Abdel‐Rahman, Zeinab Elsayed, Hadeer Mohamed, Mostafa Eltobgy |
2018 |
|
|
Pemetrexed disodium in combination with cisplatin versus other cytotoxic agents or supportive care for the treatment of malignant pleural mesothelioma |
John A Green, Yenal Dundar, Susanna R Dodd, Rumona C Dickson, Tom Walley |
2007 |
|
|
Cochrane protocols |
Radiation therapy for preventing instrumentation track metastases in malignant pleural mesothelioma |
Jacques G Eastment, Joseph P Burke, Kwun M Fong, Ian A Yang, Rayleen V Bowman |
2017 |
|
Database |
Zoektermen |
||||||||||||||||||||||||||||||
|
Embase
|
|
||||||||||||||||||||||||||||||
|
Medline (OVID)
|
1 exp mesothelioma/ or mesothelioma*.ti,ab,kf. (18817) 2 exp Molecular Diagnostic Techniques/ or ((molecular or gene* or genetic or sequenc*) adj3 (diagnos* or test* or assay* or analys*s)).ti,ab,kf. or exp Sequence Analysis, DNA/ or exp High-Throughput Nucleotide Sequencing/ or (('high throughput' or 'high through put' or 'next generation' or deep or dna) adj3 sequenc*).ti,ab,kf. or ngs.ti,ab,kf. or exp In Situ Hybridization, Fluorescence/ or 'fluorescence in situ hybridi*ation'.ti,ab,kf. or FISH.ti,ab,kf. or exp Polymerase Chain Reaction/ or 'polymerase chain reaction*'.ti,ab,kf. or pcr*.ti,ab,kf. or qpcr*.ti,ab,kf. or 'qRT-pcr*'.ti,ab,kf. or rtpcr*.ti,ab,kf. or 'rt-pcr*'.ti,ab,kf. or RTqpcr*.ti,ab,kf. or 'rt-qpcr*'.ti,ab,kf. or exp Cyclin-Dependent Kinase Inhibitor p16/ or exp Tumor Suppressor Protein p14ARF/ or mtap.ti,ab,kf. or bap1.ti,ab,kf. or (CDKN2A or 'cyclin dependent kinase inhibitor 2A' or 'cyclin dependent kinase inhibitor p16' or INK4* or p16INK4* or 'INK 4*' or p14ARF).ti,ab,kf. (1654523) 3 exp "Sensitivity and Specificity"/ or (Sensitiv* or Specific*).ti,ab. or (predict* or ROC-curve or receiver-operator*).ti,ab. or (likelihood or LR*).ti,ab. or exp Diagnostic Errors/ or (inter-observer or intra-observer or interobserver or intraobserver or validity or kappa or reliability).ti,ab. or reproducibility.ti,ab. or (test adj2 (re-test or retest)).ti,ab. or "Reproducibility of Results"/ or accuracy.ti,ab. or Diagnosis, Differential/ or Validation Studies.pt. (6584427) 4 1 and 2 and 3 (645) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (460819) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicentre study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (2016292) 7 4 and 5 (20) 8 (4 and 6) not 7 (34) 9 7 or 8 (54) |
||||||||||||||||||||||||||||||
|
Tripdatabase |
(title:mesothelioma)(title:diagnosis OR diagnostic)
|
||||||||||||||||||||||||||||||
|
GIN |
International Guideline Library search: mesothelioma |
||||||||||||||||||||||||||||||
|
Cochrane |
Titel/abstract/keyword search: mesothelioma |
