Melanoom - Systemische behandeling
Uitgangsvraag
Wat is de indicatie voor adjuvante systemische therapie behandeling voor patiënten met melanoom in stadium II en III?
Aanbeveling
Er wordt geadviseerd om patiënten met melanoom buiten onderzoeksverband geen systemisch adjuvante behandeling te geven. Dit geldt ook voor adjuvante behandeling met IFN-α.
In verband met de snelle ontwikkelingen op het gebied van systemische therapie heeft de werkgroep besloten de concepttekst "systemische therapie (ipilimumab)" terug te trekken voor publicatie. De binnengekomen commentaren onderstrepen dit gegeven; de huidige concept module is reeds bij publicatie achterhaald.
Tevens is de werkgroep van mening dat de huidige richtlijntekst (versie 2012) niet meer voldoet. Deze representeert niet de huidige klinische praktijk. Het voorstel van de werkgroep is om deze tekst uit te grijzen en bovendien deze module te voorzien van 1) een verwijzing naar de werkafspraken gemaakt door de internist/oncologen uit de melanoomcentra en 2) een op te stellen plan van aanpak voor een update van dit richtlijn onderdeel.
Door de opdrachtgever (NIV) voor deze module wordt in overleg met de eigenaar van de richtlijn (NVDV) en de 'richtlijnwerkgroep met verlengd mandaat i.o.' naar een passende oplossing gezocht voor de lange termijn.
Werkafspraken door internisten/oncologen uit melanoomcentra.
Overwegingen
Nieuwe laboratoriumtechnieken maken een rationele ontwikkeling van anti-melanoomvaccins en antilichamen mogelijk, waarvan de adjuvante waarde thans in klinische onderzoeken wordt bestudeerd. Toepassing van deze vaccins/antilichamen buiten onderzoeksverband is niet aan de orde.
Onderbouwing
Conclusies / Summary of Findings
Samenvatting literatuur
Op grond van diverse prognostische kenmerken, zoals breslowdikte, aanwezigheid van ulceratie, aanwezigheid van regionale lymfekliermetastasering (microscopisch of macroscopisch), kunnen verschillende categorieën patiënten met melanoom worden geïdentificeerd die een verhoogd risico lopen op een lokaal recidief en/of afstandsmetastasen [Balch 2001 (1)]. Allerlei vormen van adjuvante systemische behandeling, zoals chemo-, hormoon- en immunotherapie, zijn bestudeerd bij patiënten met een stadium I-III-melanoom. Verscheidene gerandomiseerde klinische onderzoeken met chemotherapie, hormonale therapie of immunotherapie hebben geen voordeel laten zien voor de progressievrije overleving of de totale overleving ten opzichte van observatie [Veronesi 1982 (2); Meyskens 1994 (3); Barth 1995 (4)].
Nadere beschouwing verdient het geneesmiddel interferon-a (IFN-α). Dit middel is in de adjuvante situatie het meest uitgebreid bestudeerd en de tot nu toe verkregen resultaten zijn niet geheel eenduidig. De gegevens van 24 gerandomiseerde onderzoeken zijn beschikbaar, waarvan een aantal minder goed bruikbaar zijn omdat daarin meerdere behandelingen of verschillende schema's IFN-α met elkaar vergeleken worden. Uiteindelijk blijven er veertien studies (met meer dan 8000 patiënten) over waarin behandeling met IFN-α wordt vergeleken met de standaard benadering van expectatief beleid [Pehamberger 1998 (5); Grob 1998 (6); Cameron 2001 (7); Cascinelli 2001 (8); Hancock 2004 (9); Kirkwood 2000 (10); Creagan 1995 (11); Kirkwood 1996 (12); Kirkwood 2001 (13); Kirkwood2001 (14); Kleeberg 2004 (15); Eggermont 2005 (16); Garbe 2008 (17); Eggermont 2008 (18)]. De samenstelling van de patiëntenpopulaties in deze onderzoeken is heterogeen ten aanzien van stadium (II en/of III) alsook stadiëringmethode (bijvoorbeeld wel of geen sentinel node biopsie). Tevens zijn de gebruikte doseringen, behandelingsschema's en toedieningswijzen in deze onderzoeken sterk wisselend.
Op basis van de gebruikte doseringen kan een onderverdeling worden gemaakt in onderzoeken met lage (1-3 MU), intermediaire (5-10 MU) en hoge (> 10 MU) dosis IFN-α per toediening.
Drie [Pehamberger 1998 (5); Grob 1998 (6); Garbel 2008 (17)]. van de zeven gerandomiseerde onderzoeken met een lage dosering IFN-α tonen een significante winst in de ziektevrije overleving. In twee van de onderzoeken is een winst in de totale overleving waargenomen [Pehamberger 1998 (5); Grob 1998 (6); Cameron 2001 (7); Cascinelli 2001 (8); Hancock 2004 (9); Kirkwood 2000 (10); Kleeberg 2004 (15); Garbe 2008 (17)]. Met een intermediaire dosis IFN-α is één onderzoek door de European Organisation for Research and Treatment of Cancer (EORTC) uitgevoerd. De resultaten lieten een verbetering van de ziektevrije overleving zien zonder significant effect op de totale overleving [Eggermont 2005 (16)].
Behandeling met hoge doses IFN-α is bestudeerd in vijf gerandomiseerde onderzoeken [Kirkwood 2000 (10); Creagan 1995 (11); Kirkwood 1996 (12); Kirkwood 2001 (13); Kirkwood 2001 (14)].Drie hiervan tonen een positief effect op de ziektevrije overleving [Kirkwood 1996; Kirkwood 2001; Kirkwood 2001].Twee van deze onderzoeken toonden ook een winst in totale overleving.
De EORTC heeft tevens een studie uitgevoerd met gepegyleerd IFN-α in een dosis van 6 microgram/kg als inductie gevolgd door 3 microgram/kg als onderhoudsbehandeling gedurende vijf jaar. Ook in deze studie werd een significant effect gezien op de ziektevrije overleving zonder verbetering van de totale overleving [Eggermont 2008 (18)].
Drie meta-analysen hebben geprobeerd een conclusie uit de niet consistente resultaten te trekken. [Pirard 2004 (19); Wheatly 2003 (20) (updated ASCO 2007, abstr 8526); Mocellin2010] Alle drie komen tot conclusie dat IFN adjuvant winst bij ziektevrije overleving bereiken kan. [Pirard 2004 (19); Wheatly 2003 (20)] toonden geen winst bij overleving aan. De meest recente analyse van Mocellin et al. gebruikte originele data van veertien gerandomiseerde studies en gereviseerde versies. Mocellin et al. vonden een significante reductie van het percentage van overlijden in de IFN armen (HR 0,89;95% CI = 0,83-0,96). Subgroep analyses lieten geen overlevingsvoordeel voor IFN in studies waar exclusief stadium III patiënten ingesloten waren noch voor hoge dosis IFN zien.
Samenvattend kan worden gesteld dat de resultaten van de tot nu toe uitgevoerde onderzoeken naar de waarde van adjuvante behandeling met IFN-α niet consistent zijn en dat een duidelijk voordeel van IFN-α-therapie op de overleving van patiënten met melanoom alleen in een van drie meta-analyses aangetoond is [Pirard 2004 (19); Wheatley 2003 (20); Mocellin, 2010 (21)].Voor verscheidene onderzoeken geldt dat deze van onvoldoende omvang zijn om een klein maar klinisch toch mogelijk relevant verschil in overleving aan te tonen. Tevens dient men zich te realiseren dat voor de selectie van patiënten een aantal van de verrichte onderzoeken is uitgevoerd met suboptimale stadiëringtechnieken. Ook moet de toxiciteit die met behandeling met IFN-α gepaard kan gaan (chronische vermoeidheid, algemene malaise en neuropsychiatrische bijwerkingen), niet worden onderschat, met name niet omdat IFN-α relatief lang gegeven moet worden wil het een effect op de overleving kunnen hebben. In diverse retrospectieve subgroep analyses zijn subgroepen geïdentificeerd (onder andere melanoom met ulceratie) die mogelijk meer baat hebben bij behandeling met IFN-α. Dit zal echter bevestigd moeten worden in goed uitgevoerde prospectieve fase III onderzoeken.
Referenties
- 1 - Balch CM, Soong SJ, Gershenwald JE, et al. Prognostic factors analysis of 17.600 melanoma patients: validation of the American Joint Committee on Cancer Melanoma Staging System. J Clin Oncol 2001 ;19:3622-34.
- 2 - Veronesi U, Adamus J, Aubert C, et al. A randomized trial of adjuvant chemotherapy and immunotherapy in cutaneous melanoma. N Engl J Med 1982;307:913-6.
- 3 - Meyskens FL, Liu PY, Tuthill RJ, et al. Randomized trial of vitamin A versus observation as adjuvant therapy in high-risk malignant melanoma: a Southwest Oncology Group study. J Clin Oncol 1994;12:2060-5.
- 4 - Barth A, Morton DL. The role of adjuvant therapy in melanoma management. Cancer 1995;75:726-34.
- 5 - Pehamberger H, Soyer P, Steiner A, et al. Adjuvant interferon _-2a treatment in resected primary stage II cutaneous melanoma. J Clin Oncol 1998;16:1425-9.
- 6 - Grob JJ, Dreno B, Chastang C, et al. Randomised trial of interferon-2a as adjuvant therapy in resected primary melanoma thicker than 1.5 mm without clinically detectable node metastases. Lancet 1998;351:1905-10.
- 7 - Cameron DA, Cornbleet MC, MacKie RM, et al. Adjuvant interferon alpha in high-risk melanoma: The Scottish study. Br J Cancer 2001;84:1146-9.
- 8 - Cascinelli N, Belli F, Mackie RM, et al. Effect of long-term adjuvant therapy with interferon-alpha2a in patients with regional node metastases from cutaneous melanoma: A randomized trial. Lancet 2001;358:866-9.
- 9 - Hancock BW, Wheatley K, Harrison G, et al. Adjuvant interferon in high-risk melanoma: The Aim High Study – United Kingdom Coordinating Committee on Cancer Research randomised study adjuvant low-dose extended-duration interferon alfa-2a in high-risk resected malignant melanoma. J Clin Oncol 2004;22:53-61.
- 10 - Kirkwood JM, Ibrahim JG, Sondak VK, et al. High- and low-dose interferon alfa-2b in high-risk melanoma: First analysis of intergroup trial E1690/S9111/C9190. J Clin Oncol 2000;18;2444-59.
- 11 - Creagan ET, Dalton RJ, Ahmann DL, et al. Randomized surgical adjuvant clinical trial of recombinant interferon-alfa-2a in selected patients with malignant melanoma. J Clin Oncol 1995;13:2776-83.
- 12 - Kirkwood JM, Strawderman MH, Ernstoff MS, et al. Interferon-_2b adjuvant therapy of high-risk resected cutaneous melanoma: The Eastern Cooperative Oncology Group Trial EST 1684. J Clin Oncol 1996;14:7-17.
- 13 - Kirkwood JM, Ibrahim JG, Sosman JA, et al. High-dose interferon alfa-2b significantly prolongs relapse-free and overall survival compared with the GM2-KLH/QS-21 vaccine in patients with resected stage IIB-III melanoma: Results of intergroup trial E1694/S9512/C509801. J Clin Oncol 2001;19:2370-80.
- 14 - Kirkwood JM, Ibrahim J, Lawson DH, et al. High-dose interferon alfa-2b does not diminish antibody response to GM2 vaccination in patients with resected melanoma: Results of the multicenter ECOG phase II trial E 2696. J Clin Oncol 2001;19(5):430-6.
- 15 - Kleeberg UR, Suciu S, Brocker EB, Ruiter DJ, Chartier C, Lienard D, et al. Eortc Melanoma Group in cooperation with the GERMAN CANCER SOCIETY (DKG). Final results of the EORTC 18871/DKG 80-1 randomised phase III trial. rIFN-alpha2b versus rIFN-gamma versus ISCADOR M versus observation after surgery in melanoma patients with either high-risk primary (thickness >3 mm) or regional lymph node metastasis. Eur J Cancer 40 (3): 390-402, 2004.
- 16 - Eggermont AM, Suciu S, MacKie R, Ruka W, Testori A, Kruit W, et al.EORTC Melanoma Group. Post-surgery adjuvant therapy with intermediate doses of interferon alfa 2b versus observation in patients with stage IIb/III melanoma (EORTC 18952): randomised controlled trial.Lancet. 2005 Oct 1;366(9492):1189-96.
- 17 - Garbe C, Radny P, Linse R, Dummer R, Gutzmer R, Ulrich J, et al. Adjuvant low-dose interferon {alpha}2a with or without dacarbazine compared with surgery alone: a prospective-randomized phase III DeCOG trial in melanoma patients with regional lymph node metastasis.Ann Oncol. 2008 Jun;19(6):1195-201. Epub 2008 Feb 14.
- 18 - Eggermont AM, Suciu S, Santinami M, Testori A, Kruit WH, Marsden J, et al EORTC Melanoma Group. Adjuvant therapy with pegylated interferon alfa-2b versus observation alone in resected stage III melanoma: final results of EORTC 18991, a randomised phase III trial. Lancet. 2008 Jul 12;372(9633):117-26.
- 19 - Pirard D, Heenen M, Melot C, Vereecken P.Interferon alpha as adjuvant postsurgical treatment of melanoma: a meta-analysis.Dermatology. 2004;208(1):43-8.
- 20 - Wheatley K, Ives N, Hancock B, Gore M, Eggermont A, Suciu S. Does adjuvant interferon-alpha for high-risk melanoma provide a worthwhile benefit? A meta-analysis of the randomised trials. Cancer Treat Rev. 2003; 29: 241–52.
- 21 - Mocellin S, Pasquali S, Rossi CR, et al. Interferon alpha adjuvant therapy in patients with high-risk melanoma: a systematic review and meta-analysis. J Natl Cancer Inst 2010;102:493-501.
- 22 - Punt CJA, Eggermont AMM. Adjuvant interferon-alpha for melanoma revisited: News from old and new studies. Ann Oncol 2001;12:1663-6
- 23 - Lens MB, Dawes M, Newton-Bishop JA, Goodacre T. Tumour thickness as a predictor of occult lymph node metastases in patients with stage I and II melanoma undergoing sentinel lymph node biopsy.Br J Surg 2002;89:1223-7.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-10-2024
Voorwaarden voor revisie en beoordelingsfrequentie zijn vastgelegd in de richtlijn. De geldigheidstermijn voor de richtlijn (maximaal vijf jaar na vaststelling) wordt vanuit het IKNL bewaakt. Om verscheidene redenen kan actualisatie eerder dan beoogd nodig zijn. Zo nodig zal de richtlijn tussentijds op onderdelen worden bijgesteld.
Algemene gegevens
IKNL (Integraal Kankercentrum Nederland) is het kennis- en kwaliteitsinstituut voor professionals en bestuurders in de oncologische en palliatieve zorg. IKNL draagt bij aan het verbeteren van de zorg rond kanker door het verzamelen van gegevens, het opstellen van richtlijnen, het bewaken van kwaliteit en het faciliteren van samenwerkingsverbanden. Ons doel is de beste zorg voor iedere patiënt.
IKNL werkt aan multidisciplinaire richtlijnontwikkeling voor de oncologische en palliatieve zorg. Naast het reviseren van richtlijnen faciliteert IKNL ook het onderhoud, het beheer, de implementatie en de evaluatie van deze richtlijnen. Een implementatie- en evaluatieplan wordt gepubliceerd indien de richtlijn geautoriseerd beschikbaar is.
De kwaliteit van ontwikkelen, implementeren en evalueren van evidence en consensus based richtlijnen waarborgt IKNL door aan te sluiten bij de criteria opgesteld in de Richtlijn voor Richtlijnen (maart 2012), AGREE II en de Medisch specialistische richtlijnen 2.0.
Financiering
Deze module is gefinancierd door de:
Kwaliteitskoepel Medisch Specialisten (SKMS)
Nederlandse Vereniging voor Nucleaire Geneeskunde (NVNG)
Nederlandse Vereniging voor Pathologie (NVVP)
De inhoud van de modules is niet beïnvloed door de financierende instanties.
Juridische verantwoordelijkheid
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat deze aanbevelingen in een individueel geval niet van toepassing zijn. Er kunnen zich feiten of omstandigheden voordoen waardoor het wenselijk is dat in het belang van de patiënt van de richtlijn wordt afgeweken. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd gedocumenteerd te worden. De toepassing van de richtlijnen in de praktijk is de verantwoordelijkheid van de behandelende arts.
Houderschap richtlijn
De houder van de richtlijn moet kunnen aantonen dat de richtlijn zorgvuldig en met de vereiste deskundigheid tot stand is gekomen. Onder houder wordt verstaan de verenigingen van beroepsbeoefenaren die de richtlijn autoriseren.
Integraal Kankercentrum Nederland draagt zorg voor het beheer en de ontsluiting van de richtlijn.
Doel en doelgroep
Doel
Een richtlijn is een document met aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering. Deze richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het expliciteren van goed medisch handelen. De richtlijn beoogt een leidraad te zijn voor de dagelijkse praktijk van de preventie, diagnostiek, behandeling en follow-up van patiënten met een melanoom van de huid. Melanomen op andere plaatsen in het lichaam zijn in deze richtlijn buiten beschouwing gelaten. De richtlijn omvat alle stadia van de ziekte.
Doelgroep
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, behandeling en begeleiding van patiënten met een melanoom van de huid, zoals dermatologen, pathologen, chirurgen, radiotherapeuten, internist-oncologen, huisartsen, oncologieverpleegkundigen, IKNL-consulenten, maatschappelijk werkers en psychologen.
Samenstelling werkgroep
Leden van de richtlijnwerkgroep 2016
Mw. Dr. A.H. Brouwers, nucleair geneeskundige UMCG (voorzitter)
Dr. A. van Akkooi, oncologisch chirurg NKI, voorzitter TFG Melanoom
Mw. Dr. W.A.M. Blokx, patholoog Radboud UMC
Drs. C.W.J. Ebben, procesbegeleider IKNL
Mw. Dr. A. Fioole-Bruining, radioloog, NKI
Mw. Dr. P.J.T.A. Groenen, Klinisch moleculair bioloog in de pathologie, Radboud UMC
Mw. Dr. N.A. Gruis, ervaringsdeskundige, Stichting Melanoom/Leven met Kanker beweging
Mw. Dr. E.R.M. de Haas, dermatoloog, Erasmus MC
Mw. H.W.G. Hamelers-Paulus, secretaresse IKNL
Mw. dr. O. van der Hel, literatuuronderzoeker IKNL
Prof. dr. H.J. Hoekstra, oncologisch chirurg, UMCG
Prof. dr. O.S. Otto Hoekstra, nucleair geneeskundige VUmc
Dr. W.H.J. Kruit, internist/oncoloog Erasmus MC
Prof. dr. W.J. Mooi, patholoog VUmc
Drs. R. Vernooij, literatuuronderzoeker IKNL
Belangenverklaringen
De werkgroepleden zijn afgevaardigd namens wetenschappelijke en hebben daarmee het mandaat voor hun inbreng.
Om de beïnvloeding van de richtlijnontwikkeling of formulering van de aanbevelingen door conflicterende belangen te minimaliseren zijn de leden van de werkgroep gemandateerd door de wetenschappelijke verenigingen.
Inbreng patiëntenperspectief
Bij de ontwikkeling van de module in 2015-2016 is tijdens alle fasen gebruik gemaakt van de input van patiënten. Door de Leven met Kanker Beweging is stichting Melanoom gevraagd een patiënten vertegenwoordiger voor de richtlijn werkgroep af te vaardigen. Stichting Melanoom heet hierop mw. dr. N.A. Gruis afgevaardigd. Zij heeft gedurende het gehele traject van de revisie 2016 geparticipeerd in de richtijn werkgroep.
De input van patiënt vertegenwoordigers is nodig voor de ontwikkeling van kwalitatief goede richtlijnen. Goede zorg voldoet immers aan de wensen en eisen van zowel zorgverlener als patiënt.
Methode ontwikkeling
Evidence based
Implementatie
Bevorderen van het toepassen van de richtlijn in de praktijk begint met een brede bekendmaking en verspreiding van de richtlijn.
Bij verdere implementatie gaat het om gerichte interventies om te bevorderen dat professionals de nieuwe kennis en kunde opnemen in hun routines van de oncologische en palliatieve zorgpraktijk, inclusief borging daarvan. Als onderdeel van elke richtlijn stelt IKNL een implementatieplan op.
Activiteiten en interventies voor verspreiding en implementatie vinden zowel op landelijk als regionaal niveau plaats. Deze kunnen eventueel ook op maat gemaakt worden per instelling of specialisme.
Werkwijze
Modulaire update 2016
De werkgroep heeft specifiek een aantal modules uit de richtlijn onder de loep genomen en aangepast aan de huidige stand van zaken. Het initiatief voor deze revisie is genomen door de Nederlandse Vereniging voor Nucleair Geneeskundigen (NVNG) en de Nederlandse Vereniging voor Pathologie (NVVP). Voor een drietal uitgansvragen, (1. De rol van de FDG-PET/CT scan in de diagnostiek, 2. De rol van de FDG-PET/CT scan in de follow-up en 3. de schildwachtklierprocedure) zijn systematisch literatuuronderzoeken verricht. Voor uitwerking van de uitgansvraag over de procedure rondom de BRAF-genmutatietest is gekozen voor een consensus based aanpak. Deze module beschrijft met name de organisatie van zorg omtrent deze test. Er zijn ook modules opgesteld voor de onderwerpen “systemische therapie (ipilimumab)” en “kosteneffectiviteit van de FDG-PET/CT scan bij inoperabel stadium 3 en stadium 4 patiënten”, echter door de snelle ontwikkelingen op het gebied van de systemische therapie heeft de werkgroep besloten deze modules (vooralsnog) niet te publiceren. Voor een overzicht van de uitgangsvragen zie bijlage X.
Voor iedere uitgangsvraag werd een subgroep geformeerd met vertegenwoordigers van relevante disciplines. De werkgroepleden schreven tekst, conclusies, overwegingen en aanbevelingen die tijdens plenaire vergaderingen werden besproken en na verwerking van de commentaren werden geaccordeerd.
De concept modules werden naar alle binnen deze werkgroep vertegenwoordigde verenigingen en organisaties gestuurd voor commentaar. Na verwerking van het commentaar zijn de nieuwe modules door de voltallige werkgroep vastgesteld en ter autorisatie naar de relevante beroepsverenigingen voorgelegd. De voorzitter van de werkgroep en de procesbegeleider van het IKNL zorgden voor de coördinatie en onderlinge afstemming van de subgroepen.
De EBRO-methodiek
Opbouw
Elke module van de richtlijn is volgens een vast stramien opgebouwd: de uitgangsvraag en aanbevelingen, de onderbouwing (samenvatting literatuur, referentielijst, conclusies en evidence tabellen), de overwegingen en de verantwoording. Voor het evidence based uitwerken van vragen rondom diagnostische interventie hanteren we de EBRO-methodiek, voor therapeutische interventies de GRADE methodiek. De antwoorden op de uitgangsvragen (derhalve de aanbevelingen in deze richtlijn) zijn voor zover mogelijk gebaseerd op gepubliceerd wetenschappelijk onderzoek.
Selectie Aanbevelingen werden gebaseerd op ‘beste evidence' en daarom werd naast selectie op relevantie tevens geselecteerd op bewijskracht. Hiervoor werd gebruik gemaakt van de volgende hiërarchische indeling van studiedesigns gebaseerd op bewijskracht:
1. Meta-analyses en systematische reviews;
2. Gerandomiseerde gecontroleerde studies (RCT's);
3. Niet gerandomiseerde gecontroleerde studies (CCT's).
Waar deze niet voorhanden waren werd verder gezocht naar vergelijkend cohortonderzoek.
Critical appraisal
De geselecteerde artikelen zijn vervolgens beoordeeld op de kwaliteit van het onderzoek door middel van het invullen van de checklist critical appraisal. Hierbij is het wetenschappelijk bewijs beoordeeld op vertekening (bias) en gegradeerd naar mate van bewijs. In de laatste kolom van de evidence tabellen wordt een samenvatting gegeven van de critical appraisal. De mate van bewijskracht en het niveau van bewijs zijn in de conclusies van de verschillende hoofdstukken of paragrafen weergegeven. De belangrijkste literatuur waarop de conclusies zijn gebaseerd, is daarbij vermeld.
Tabel 1. Diagnostische tests
Indeling van onderzoeksresultaten naar mate van bewijskracht
|
A1 |
Onderzoek naar de effecten van diagnostiek op klinische uitkomsten bij een prospectief gevolgde goed gedefinieerde patiëntengroep met een tevoren gedefinieerd beleid op grond van de te onderzoeken testuitslagen, of besliskundig onderzoek naar de effecten van diagnostiek op klinische uitkomsten, waarbij resultaten van onderzoek van A2-niveau als basis worden gebruikt en voldoende rekening wordt gehouden met onderlinge afhankelijkheid van diagnostische test. |
|
A2 |
Onderzoek ten opzichte van een referentietest, waarbij van tevoren criteria zijn gedefinieerd voor de te onderzoeken test en voor een referentietest, met een goede beschrijving van de test en de onderzochte klinische populatie; het moet een voldoende grote serie van opeenvolgende patiënten betreffen, er moet gebruik gemaakt zijn van tevoren gedefinieerde afkapwaarden en de resultaten van de test, en de ‘gouden standaard' moeten onafhankelijk zijn beoordeeld. Bij situaties waarbij multiple, diagnostische test een rol spelen, is er in principe een onderlinge afhankelijkheid en dient de analyse hierop te zijn aangepast, bijvoorbeeld met logistische regressie. |
|
B |
Vergelijking met een referentietest, beschrijving van de onderzochte test en van de onderzochte populatie, maar niet de kenmerken die verder onder niveau A1 en A2 staan genoemd. |
|
C |
Niet-vergelijkend onderzoek |
|
D |
Mening van deskundigen (bijvoorbeeld werkgroepleden) |
Tabel 2. Niveau van bewijskracht van de conclusie op basis van het aan de conclusie ten grondslag liggend bewijs
|
Niveau van bewijs |
Conclusie gebaseerd op |
Formulering |
|
1 |
Eén systematische review (A1) of ten minste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A1 of A2 |
Het is aangetoond dat... |
|
2 |
Ten minste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
Het is aannemelijk dat... |
|
3 |
Eén onderzoek van niveau A2, B of C |
Er zijn aanwijzingen dat... |
|
4 |
Mening van deskundigen (bijvoorbeeld de werkgroepleden) |
De werkgroep is van mening dat... |
Methode voor het formuleren van ‘Overwegingen'
Naast de evidence uit de literatuur (conclusie) zijn er andere overwegingen die meespelen bij het formuleren van de aanbeveling. Deze aspecten worden beschreven onder het kopje ‘Overwegingen' in de richtlijntekst. Bij de Overwegingen wordt de conclusie (op basis van de literatuur) door de werkgroep leden geplaatst in de context van de dagelijkse praktijk en maken zij een afweging van de voor- en nadelen van de verschillende beleidsopties. Vervolgens stellen werkgroepleden door middel van discussie (consensusmethode) gezamenlijk de aanbevelingen op. De uiteindelijk geformuleerde aanbeveling is het resultaat van de conclusie(s) in combinatie met deze overwegingen.
Voor het gestructureerd en transparant beschrijven van de overwegingen en aanbevelingen is een checklist ‘overwegingen' en een checklist ‘formuleren van aanbevelingen' opgesteld.
Checklist ‘overwegingen'
Eén of meerdere conclusies leidt c.q. leiden tot één aanbeveling. Vul per aanbeveling één checklist ‘overwegingen' in. Maak een link naar de ingevulde checklist in het tabblad ‘overwegingen' van het betreffende onderwerp.
Als een bepaald diagnostisch instrument of bepaalde behandeling niet werkzaam is dient geen gebruik gemaakt te worden van dit diagnostisch instrument of deze behandeling. Overwegingen zijn dan niet bijdragend en worden niet beschreven.
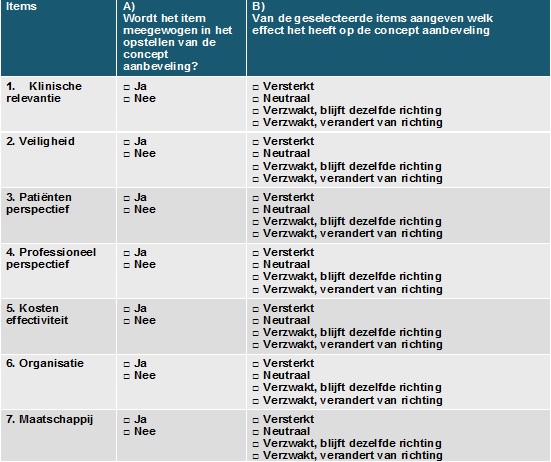

Uitleg items checlist 'overwegingen'
1. Klinische relevantie: bepalen door professionals en evt. literatuuronderzoek
- Sterkte van het effect vergeleken met geen interventie
- Consistentie van het beschikbare bewijs uit de verschillende studies
- Generaliseerbaarheid
- Voorbeeld: een bepaalde behandeling kan een significante verbetering van symptomen geven die patiënten echter niet als zodanig ervaren, dus klinisch niet relevant.
2. Veiligheidsissues: bepalen door professionals en evt. literatuuronderzoek
- Bijwerkingen, risico's of complicaties op korte en lange termijn
- Gebruik bij co-morbiditeit / gelijktijdig gebruik medicatie en/of interventie
- Voorbeeld: fysieke comorbiditeit kan bepaalde behandelingen uitsluiten.
3. Patiënten perspectief: bepalen door professionals, patiënten en eventueel literatuuronderzoek
- Voorkeuren / te verwachten compliance / te verwachten tevredenheid / kwaliteit van leven
- Voorbeeld: diagnostiek of behandeling waarvoor minder ziekenhuisbezoek nodig is; behandeling die makkelijker toe te dienen is; behandeling die sneller effect laat zien.
4. Professioneel perspectief: bepalen door professionals
- Kennis en ervaring met technieken/therapie
- Risico's die professional loopt bij het toepassen van de interventie / tijdbesparing of het verlies aan tijd door het invoeren van de interventie
- Houding, normen en waarden van de professional
- Voorbeeld: een nieuwe techniek die nog niet alle professionals beheersen.
5. Kosteneffectiviteit: bepalen door professionals, indien gewenst en mogelijk kosteneffectiviteitsanalyse door expert
- Kosteneffectiviteit in verhouding tot bestaande ingrepen/behandelingen voor deze ziekte
6. Organisatorische factoren: bepalen door professionals
- De beschikbaarheid/aanwezigheid van faciliteiten & medicijnen
- De wijze waarop de organisatie van de zorg aangeboden dient te worden / grootte van de verandering in het organisatie-zorgproces / infrastructuur voor implementatie
- Voorbeeld: een bepaalde diagnostiek of behandeling kan alleen in bepaalde centra worden uitgevoerd in verband met de aanwezigheid van faciliteiten zoals een PET scan.
7. Maatschappelijke factoren: bepalen door professionals
- Vergoeding door verzekeraars / Industriële belangen / Ethische overwegingen / Juridische overwegingen / Politieke en strategische consequenties
- Voorbeeld: indien twee behandelingen even effectief zijn waarvan één behandeling wordt vergoed, zal deze laatste behandeling worden aanbevolen.
Checklist formuleren van aanbevelingen

Methode voor het formuleren van aanbevelingen
In de praktijk kunnen er per uitgangsvraag meerdere conclusies zijn, met verschillend niveau van bewijs. Indien er meerdere conclusies bij de uitgangsvraag zijn geformuleerd is het van belang de conclusies te prioriteren. Het niveau van bewijs van de conclusie die het meest van belang is voor het formuleren van de aanbeveling wordt meegenomen in de checklist ‘formuleren van aanbevelingen'.
De GRADE-methodiek
Opbouw
Elke module van de richtlijn is volgens een vast stramien opgebouwd: de uitgangsvraag en aanbevelingen, de onderbouwing (samenvatting literatuur, referentielijst, conclusies en evidence tabellen), de overwegingen en de verantwoording. Voor het evidence based uitwerken van vragen rondom therapeutische interventies hanteren we de GRADE methodiek, voor alle overige uitgangsvragen de EBRO methodiek.
De antwoorden op de uitgangsvragen (derhalve de aanbevelingen in deze richtlijn) zijn, voor zover mogelijk, gebaseerd op gepubliceerd wetenschappelijk onderzoek.
Selectie Naast de selectie op relevantie werd tevens geselecteerd op bewijskracht. Hiervoor werd gebruik gemaakt van de volgende hiërarchische indeling van studiedesigns gebaseerd op bewijskracht:
- 1. Gerandomiseerde gecontroleerde studies (RCT's)
- 2. Niet gerandomiseerde gecontroleerde studies (CCT's)
Waar deze niet voorhanden waren werd verder gezocht naar vergelijkend cohortonderzoek.
Critical appraisal
De kwaliteit van bewijs wordt weergegeven in vier categorieën: hoog, matig, laag en zeer laag. RCT's starten hoog en observationele studies starten laag. Vijf factoren verlagen de kwaliteit van de evidentie (beperkingen in onderzoeksopzet, inconsistentie, indirectheid, imprecisie, publicatie bias) en drie factoren kunnen de kwaliteit van de evidentie verhogen (sterke associatie, dosis-respons relatie, plausibele (residuele) confounding) (zie tabel 1).
Tabel 1. GRADE-methodiek voor het graderen van bewijs
|
Quality of evidence |
Study design |
Lower if * |
Higher if * |
|
High (4) |
Randomized trial |
Study limitations -1 Serious -2 Very serious Inconsistency -1 Serious -2 Very serious Indirectness -1 Serious -2 Very serious Imprecision -1 Serious -2 Very serious Publication bias -1 Likely -2 Very likely |
Large effect + 1 Large + 2 Very large Dose response + 1 Evidence of a gradient All plausible confounding + 1 Would reduce a demonstrated effect, or + 1 Would suggest a spurious effect when results show no effect |
|
Moderate (3) |
|
||
|
Low (2)
|
Observational study |
||
|
Very low (1) |
|
Algehele kwaliteit van bewijs
Omdat het beoordelen van de kwaliteit van bewijs in de GRADE-benadering per uitkomstmaat geschiedt, is er behoefte aan het bepalen van de algehele kwaliteit van bewijs. Zowel voor als na het literatuuronderzoek wordt door de richtlijnwerkgroep bepaald welke uitkomstmaten cruciaal, belangrijk en niet belangrijk zijn.
Het niveau van de algehele kwaliteit van bewijs wordt in principe bepaald door de cruciale uitkomstmaat met de laagste kwaliteit van bewijs. Als echter de kwaliteit van het bewijs verschilt tussen de verschillende cruciale uitkomstmaten zijn er twee opties:
a. De uitkomstmaten wijzen in verschillende richtingen (zowel gewenst als ongewenste effecten) of de balans tussen gewenste en ongewenste effecten is onduidelijk, dan bepaalt de laagste kwaliteit van bewijs van de cruciale uitkomstmaten de algehele kwaliteit van bewijs;
b. De uitkomstmaten in dezelfde richting wijzen (richting gewenst of richting ongewenst effecten), dan bepaalt de hoogste kwaliteit van bewijs van de cruciale uitkomstmaat dat op zichzelf voldoende is om de interventie aan te bevelen de algehele kwaliteit van bewijs.
Tabel 2. Formulering conclusies op basis van kwaliteit van bewijs per uitkomstmaat
|
Kwaliteit van bewijs |
Interpretatie |
Formulering conclusie |
|
Hoog |
Er is veel vertrouwen dat het werkelijk effect dicht in de buurt ligt van de schatting van het effect. |
Er is bewijs van hoge kwaliteit dat...
(Referenties) |
|
Matig |
Er is matig vertrouwen in de schatting van het effect: het werkelijk effect ligt waarschijnlijk dicht bij de schatting van het effect, maar er is een mogelijkheid dat het hier substantieel van afwijkt. |
Er is bewijs van matige kwaliteit dat...
(Referenties) |
|
Laag |
Er is beperkt vertrouwen in de schatting van het effect: het werkelijke effect kan substantieel verschillend zijn van de schatting van het effect. |
Er is bewijs van lage kwaliteit dat....
(Referenties) |
|
Zeer laag |
Er is weinig vertrouwen in de schatting van het effect: het werkelijke effect wijkt waarschijnlijk substantieel af van de schatting van het effect. |
Er is bewijs van zeer lage kwaliteit dat....
(Referenties) |
|
Formulering algehele kwaliteit van bewijs: hoog/matig/laag/zeer laag |
||
Methode voor het formuleren van ‘Overwegingen'
Naast de evidence uit de literatuur (conclusies) zijn er andere overwegingen die meespelen bij het formuleren van de aanbeveling. Deze aspecten worden besproken onder het kopje ‘Overwegingen' in de richtlijntekst. Hierin worden de conclusies (op basis van de literatuur) geplaatst in de context van de dagelijkse praktijk en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties. De uiteindelijk geformuleerde aanbeveling is het resultaat van de conclusie(s) in combinatie met deze overwegingen.

Tabel 3. Van bewijs naar aanbeveling
|
Algehele kwaliteit van bewijs hoog / matig / laag / zeer laag |
|
|
Beslissing1 |
Toelichting |
|
1. Kwaliteit van het bewijs Is de algehele kwaliteit van bewijs hoog? |
☐ ja ☐ nee of onduidelijk
|
...
|
|
2. Balans tussen gewenste en ongewenste effecten Overtreffen de gunstige effecten de ongunstige effecten, of de ongunstige effecten de gunstige effecten aanzienlijk en is de werkgroep hier zeker van?
|
☐ ja ☐ nee of onduidelijk
|
...
|
|
3. Patiëntenperspectief Hanteren vrijwel alle patiënten hetzelfde perspectief op de wenselijkheid of de onwenselijkheid van de aan te bieden interventie?
|
☐ ja ☐ nee of onduidelijk
|
...
|
|
4. Professioneel perspectief Hanteren vrijwel alle zorgverleners hetzelfde perspectief op de wenselijkheid of de onwenselijkheid van de aan te bieden interventie?
|
☐ ja ☐ nee of onduidelijk
|
...
|
|
Onderstaande factoren alleen evalueren als een positief geformuleerde aanbeveling wordt overwogen
|
||
|
5. Middelenbeslag Zijn de netto-gunstige effecten de (extra) middelen waard? |
☐ ja ☐ nee of onduidelijk ... |
...
|
|
6. Organisatie van zorg Zijn voldoende condities van zorg-organisatorische aard aanwezig om de interventie toe te passen? |
☐ ja ☐ nee of onduidelijk
|
...
|
|
7. Maatschappelijk perspectief Zijn voldoende condities van maatschappelijke aard aanwezig om de interventie toe te passen? |
☐ ja ☐ nee of onduidelijk
|
...
|
|
1. Indien een of meerdere factoren worden geëvalueerd met ‘ja' neemt de waarschijnlijkheid van een sterke aanbeveling toe. |
||
|
Sterkte van de aanbeveling sterk / zwak (conditioneel) |
Toelichting bij Tabel 3
1. Kwaliteit van het bewijs
Hoe hoger de algehele kwaliteit van het bewijs, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling.
2. Balans van gewenste en ongewenste effecten
Hoe groter het verschil is tussen de gewenste en ongewenste effecten, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. Hoe kleiner dit verschil of hoe meer onzekerheid over de grootte van het verschil, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling. Toelichting:
- Bespreken effectiviteit in relatie tot bijwerkingen en complicaties in het licht van de kwaliteit van bewijs, de precisie van de effectgrootte en minimaal klinisch relevant geacht voordeel.
- Sterkte van het effect vergeleken met geen interventie.
- Aanwezigheid van comorbiditeit.
- Klinisch niet relevantie van het effect.
3. Patiëntenperspectief
Hoe groter de uniformiteit in waarden en voorkeuren van patiënten bij het afwegen van de voor- en nadelen van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling.
4. Professioneel perspectief
Hoe groter de uniformiteit in waarden en voorkeuren van professionals ten aanzien van de toepasbaarheid van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. Toelichting:
- Kennis en ervaring met technieken/therapieën.
- Risico's die professional loopt bij het toepassen van de interventie.
- Verwachte tijdbesparing.
- Verlies aan tijd door het invoeren van de interventie.
N.B.: de hierna volgende factoren (5, 6 en 7) alleen evalueren als een positief geformuleerde aanbeveling wordt overwogen! Een positief geformuleerde aanbeveling is een aanbeveling waarbij een bepaalde interventie wel ‘dient' plaats te vinden (sterk) of wel ‘kan worden overwogen' (zwak/conditioneel). Als dat daarentegen juist niet het geval is, is sprake van een negatief geformuleerde aanbeveling.
5. Middelenbeslag
Hoe minder middelen er worden gebruikt (m.a.w. hoe lager de kosten van een interventie zijn vergeleken met de beschouwde alternatieven en andere kosten gerelateerd aan de interventie), des te waarschijnlijker wordt het formuleren van een sterke aanbeveling. Hoe meer onzekerheid over het middelenbeslag, des te waarschijnlijker wordt een conditionele aanbeveling.
6. Organisatie van zorg
Hoe meer onzekerheid of de geëvalueerde interventie daadwerkelijk op landelijke schaal toepasbaar is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling. Toelichting:
- De beschikbaarheid/aanwezigheid van faciliteiten & medicijnen.
- De wijze waarop de organisatie van de zorg aangeboden dient te worden/grootte van de verandering in de organisatie-zorgproces/infrastructuur voor implementatie.
- Voorbeeld: een bepaalde diagnostiek of behandeling kan alleen in bepaalde centra worden uitgevoerd in verband met de aanwezigheid van faciliteiten zoals een PET scan.
7. Maatschappelijk perspectief (Juridische overwegingen/ethische overwegingen/industriële belangen/vergoeding door verzekeraars/politieke en strategische consequenties) Hoe groter de onzekerheid hierover is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling. Toelichting:
- Indien twee behandelingen even effectief zijn waarvan één behandeling wordt vergoed, zal deze laatste behandeling mogelijk de voorkeur hebben.
Methode voor het formuleren van aanbevelingen
GRADE kent twee soorten aanbevelingen: sterke aanbevelingen of conditionele (zwakke) aanbevelingen. De sterkte van aanbevelingen reflecteert de mate van vertrouwen waarin - voor de groep patiënten waarvoor de aanbevelingen zijn bedoeld - de gewenste effecten opwegen tegen de ongewenste effecten.
Formulering:
- Sterke aanbevelingen: Er dient.... te worden gegeven/gedaan.
- Zwakke/conditionele aanbevelingen: Overweeg..... te geven/te doen.
Zoekverantwoording
Studies: (meta-analyses, systematische reviews, RCT's, observationele studies)meta-analyses, systematische reviews, RCT's, observationele studies (cohort studies)
Databases: Medline, Embase, Cochrane
Taal: Engels, Nederlands, Duits
Periode (vanaf tot): 2009-2014 (muv stadium III en IV: 2011-2014)
Tabel 1: Niveau van bewijskracht van de conclusie op basis van het aan de conclusie ten grondslag liggend bewijs
|
Niveau van bewijs |
Conclusie gebaseerd op |
Formulering |
|
1 |
Eén systematische review (A1) of tenminste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A1 of A2 |
Het is aangetoond dat...; men dient... |
|
2 |
Tenminste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
Het is aannemelijk dat...; men zou...moeten... |
|
3 |
Eén onderzoek van niveau A2, B of C |
Er zijn aanwijzingen dat...; men kan... |
|
4 |
Mening van deskundigen (bijvoorbeeld de werkgroepleden) |
De werkgroep is van mening dat... |
Tabel 2: Indeling van methodologische kwaliteit van individuele studies
|
Voor artikelen betreffende interventie |
|
|
A1 |
Systematische reviews die tenminste enkele onderzoeken van A2-niveau betreffen, waarbij de resultaten van afzonderlijke onderzoeken consistent zijn. |
|
A2 |
Gerandomiseerd vergelijkend klinisch onderzoek van goede kwaliteit en met voldoende omvang en consistentie. |
|
B |
Gerandomiseerde klinische trials van matige kwaliteit of onvoldoende omvang of ander vergelijkend onderzoek (niet-gerandomiseerd: vergelijkend cohortonderzoek, patiënt-controle-onderzoek) |
|
C |
Niet-vergelijkend onderzoek |
|
D |
Mening van deskundigen (bijvoorbeeld de werkgroepleden) |
|
Voor artikelen betreffende diagnostiek |
|
|
A1 |
Onderzoek naar de effecten van diagnostiek op klinische uitkomsten bij een prospectief gevolgde goed gedefinieerde patiëntengroep met een tevoren gedefinieerd beleid op grond van de te onderzoeken testuitslagen, of besliskundig onderzoek naar de effecten van diagnostiek op klinische uitkomsten, waarbij resultaten van onderzoek van A2-niveau als basis worden gebruikt en voldoende rekening wordt gehouden met onderlinge afhankelijkheid van diagnostische tests |
|
A2 |
Onderzoek ten opzichte van een referentietest, waarbij van tevoren criteria zijn gedefinieerd voor de te onderzoeken test en voor een referentietest, met een goede beschrijving van de test en de onderzochte klinische populatie; het moet een voldoende grote serie van opeenvolgende patiënten betreffen, er moet gebruik zijn gemaakt van tevoren gedefinieerde afkapwaarden en de resultaten van de test en de ‘gouden standaard' moeten onafhankelijk zijn beoordeeld. Bij situaties waarbij multipele, diagnostische tests een rol spelen, is er in principe een onderlinge afhankelijkheid en dient de analyse hierop te zijn aangepast, bijvoorbeeld met logistische regressie |
|
B |
Vergelijking met een referentietest, beschrijving van de onderzochte test en populatie, maar niet de kenmerken die verder onder niveau A staan genoemd |
|
C |
Niet-vergelijkend onderzoek |
|
D |
Mening van deskundigen, bijvoorbeeld de werkgroepleden |
