Melanoom - Aanvullend onderzoek/rol PET CT
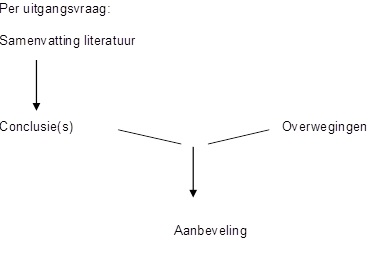
Uitgangsvraag
Disclaimer
De richtlijnwerkgroep heeft geconstateerd dat deze module niet meer actueel is en dat er aanbevelingen in stonden t.a.v. de optimale beeldvorming bij follow-up. Deze zijn nu verwijderd uit deze module en zijn terug te vinden in de module follow-up. Naar verwachting zal medio 2025 een nieuwe (re)stadiëringsmodule worden ontwikkeld voor de verschillende stadia.
Uitgangsvragen 2016
Aanvullend onderzoek
Bij patiënten met melanoom stadium III en IV (primair dan wel recidief) die in aanmerking komen voor in opzet curatieve/lokale behandeling, welke diagnostische test – 18F-FDG PET/ldCT (ld: lowdose), ceCT (ce: contrast enhanced) of WB-MRI (WB: whole body) - resulteert in de meest accurate opsporing van metastasen?
Uitgangsvragen 2012
Wat is het verschil in diagnostische accuratesse en therapeutische impact voor de vaststelling van metastasen tussen PET en CT bij patiënten met een bewezen melanoom van de huid?
Wat is het effect en de accuratesse van beeldvormend onderzoek naar metastasen bij patiënten met nieuw gediagnosticeerd melanoom stadium I-II op de overleving in vergelijking met een ‘wait and see’ aanpak?
Aanbeveling
Aanvullend onderzoek
Er wordt geadviseerd om bij stadium I, II en IIIA geen routinematig aanvullend afbeeldend onderzoek uit te voeren.
Bij pathologisch vergrote lymfeklieren dient bij voorkeur een echografie met (zo nodig) echogeleide punctie uitgevoerd te worden.
Er wordt geadviseerd om bij stadium IIIB, IIIC voor een goede stadiering een volledig afbeeldend onderzoek van borst, buik en bekken (18F-FDG-PET/ldCT gecombineerd met ceCT ) uit te voeren.
Er wordt geadviseerd om bij stadium IV voor een goede stadiering een volledig afbeeldend onderzoek van borst, buik en bekken (18F-FDG-PET/ldCT gecombineerd met ceCT) uit te voeren.
De werkgroep is van mening dat het bij hoger stadium (IIIB-IV) melanoom te vroeg is voor routinematig stadiëringsonderzoek met whole body MRI.
Overwegingen
Aanvullend onderzoek
Klinische relevantie
Hoewel een verandering van klinisch beleid op basis van de verschillende beeldvormingstechnieken geen aparte uitgangsvraag was met dito literatuur onderzoek, zijn er tijdens het huidige literatuur onderzoek twee additionele artikelen gevonden die hierop ingingen [Subesinghe 2013(47), Aukema 2010(24)].
Subesinghe et al. onderzocht retrospectief een cohort van 45 patiënten waarbij 51 (stadium III n=8, stadium IV n=42) 18F-FDG PET scans zijn geherevalueerd [Subesinghe 2013(47)]. Zij maakten een verschil tussen een grotere en geringere verandering in het beleid. Een grote verandering was gedefinieerd als een verandering in het therapeutische beleid of verdere karakterisatie van een eerdere inconclusieve laesie. Onder een geringere verandering werd verstaan de bevestiging van bekende laesies die op een eerdere ceCT gevonden waren. Er was sprake van een grote verandering in beleid in 21 casus (41%) en een geringe verandering in beleid in 23 casus (45%).
Aukema et al. bestudeerden de rol van 18F-FDG PET/ldCT en MRI hersenen pre-operatief in 70 patiënten met palpabele lymfeklieren, zonder aanwijzing voor metastasen op afstand na lichamelijk onderzoek [Aukema 2010(24)]. 18F-FDG positieve laesies werden zo mogelijk middels pathologisch onderzoek of additionele beeldvorming bevestigd. Indien dit niet mogelijk was, diende het klinische beloop van de ziekte als goud standaard. Voor deze in Nederland uitgevoerde studie was voor 18F-FDG PET/ldCT de gerapporteerde sensitiviteit 87% en specificiteit 98% (accuratesse 93% en PPV 96%). De 18F-FDG PET/ldCT leidde tot een verandering van de geplande regionale lymfeklierdissectie bij 26 patiënten (37%; n=23 patiënten wissel naar palliatieve chemotherapie, n=3 patiënten uitbreiding van de locoregionale behandeling). MRI toonde in 5 patiënten (7%) hersenmetastasen. Vier van de vijf patiënten hadden ook extra-craniële afstandsmetastasen bij 18F-FDG PET/ldCT.
Daarnaast is over de verandering van het klinische beleid gerapporteerd in de al eerder beschreven studies van Reinhardt et al. [2006](44), Pfannenberg et al. [2007](42) en Bastiaannet et al. [2009](22).
Bastiaannet et al. rapporteerde een verandering van beleid bij 17% van de 251 patiënten alleen op basis van 18F-FDG PET versus bij 4% alleen op basis van ceCT.
In de eveneens prospectief uitgevoerde studie van Pfannenberg et al. [2007](42) is bij 41 van de 64 patiënten ook gekeken naar de verandering op het klinisch beleid. De grootste impact op het beleid was door de combinatie 18F-FDG PET/ldCT + ceCT (90%), gevolgd door WB-MRI (88%, hersenmetastasen niet meegerekend), alleen 18F-FDG PET/ldCT (76%) en alleen ceCT (73%).
Ook Reinhardt et al. [2006](44) rapporteerden de grootste verandering in klinisch beleid op basis van 18F-FDG PET/CT (met oraal contrast), ten opzichte van alleen 18F-FDG PET of alleen CT. De gerapporteerde verandering in beleid obv 18F-FDG PET/CT in deze studie bedroeg 121/250 patiënten (48%).
Tot slot werden nog de studies van Etchebeere et al. [2010](30) en Bronstein et al. [2012](27) geïdentificeerd over verandering op het voorgenomen klinische beleid.
Etchebeere et al. [2010](30) analyseerde de impact van 18F-FDG PET/ldCT (met oraal contrast) op het klinische beleid bij patiënten (n=78) die al middels conventionele beeldvorming (ceCT thorax/abdomen/bekken en MRI hersenen) geherstadieerd waren op drie niveau’s: voor locaal recidief, locoregionaal recidief en afstandsmetastasen. In de patiëntengroep met locoregionaal recidief was de klinische impact het grootst en vond er bij 5/23 (22%) patiënten up-staging plaats.
De prospectieve studie van Bronstein et al. [2012](27) had een vergelijkbare benadering. Zij bestudeerden bij hoeveel patiënten er middels 18F-FDG PET/ldCT nog onverwachte bevindingen werden gevonden voorafgaande aan chirurgie. Patiënten met klinisch stadium III en stadium IV die op basis van conventionele beeldvorming (ceCT thorax/abdomen/bekken en MRI hersenen) operabel werden geacht, werden geïncludeerd. Bij 4/33 scans (12%) werden onverwachte metastasen aangetoond die op eerdere beeldvorming gemist waren of niet afgebeeld (extremiteiten). Dit resulteerde bij 2 patiënten in afzien van de geplande chirurgische ingreep en bij twee patiënten werd het chirurgische plan aangepast.
Samenvattend geldt ook hier dat de diverse studies onderling verschillen in opzet, definitie van klinische impact, uitvoering van onderzoekstest etc, waardoor pooling niet goed mogelijk is. De trend lijkt hier dat de grootste verandering voor het klinisch beleid gevonden wordt in de groep patiënten die initieel in opzet curatief chirurgisch kunnen worden behandeld, maar waarbij door FDG-PET/ldCT additionele afstandsmetastasen worden opgespoord. Naarmate er voorafgaand aan de FDG-PET/ldCT meer andere beeldvormende diagnostiek (bv volledig stadiëringsonderzoek middels ceCT en MRI hersenen) heeft plaatsgevonden, daalt de klinische impact van de FDG-PET/ldCT.
Hersenmetastasen
Ook niet meegenomen in de onderzoeksvraag is het nut of de opbrengst van MRI hersenen bij stadium III - IV patiënten. In de lagere stadia is de opbrengst verwaarloosbaar laag [Fogarty 2006](11). Zelfs bij stadium III patiënten in de studies van Bastiaannet et al. [2009](22) en Aukema et al. [2010](24) waren er slechts enkele patiënten geïdentificeerd met alleen afstandsmetastasen intra-cranieel. Hierom wordt in de gangbare klinische praktijk bij deze stadia niet standaard een MRI hersenen uitgevoerd. Echter, bij stadium IV patiënten wordt dit onderzoek meer en meer uitgevoerd vanwege ontwikkelingen op het gebied van de verschillende nieuwe systeemtherapieën, waarbij het hebben van hersenmetastasen soms een contra-indicatie voor therapie is. Ook wordt dit onderzoek vaker verricht vanwege nieuwe ontwikkelingen van de behandeling van hersenmetastasen binnen de radiotherapie. Bijvoorbeeld voor de indicatiestelling van stereotactische bestraling, die onder andere afhangt van het aantal en grootte van de gevonden hersenmetastasen. In de praktijk wordt MRI hersenen onderzoek dan ook additioneel aangevraagd wanneer hier behandelconsequenties aan worden verbonden bij (verdenking op) stadium IV patiënten. Immers 18F-FDG PET/ldCT is niet geschikt voor evaluatie van het brein vanwege de intrinsieke hoge achtergrondsopname van 18F-FDG in het cerebrum. Verder beslaat conventioneel diagnostisch ceCT onderzoek alleen de romp. Voor een betrouwbare ceCT evaluatie van de hersenen moet een additioneel CT protocol worden gevolgd ten opzichte van een CT protocol voor ceCT thorax/abdomen/bekken. Zie verder ook de richtlijn ‘Hersenmetastasen’ (http://www.oncoline.nl/hersenmetastasen).
Patientenperspectief
Met de komst van de nieuwere generatie PET/CT camera’s bestaat er de mogelijkheid om twee typen onderzoek, FDG PET/ldCT en diagnostische ceCT, tijdens één sessie te combineren. Voor de patiënt heeft dit het voordeel dat er slechts één ziekenhuisbezoek nodig is ipv twee. Ook kan dit een positief effect hebben in de doorlooptijd tav het diagnostische traject.
Professioneel perspectief
Echografie van de locoregionale klierstations kan behulpzaam zijn bij het identificeren van lymfekliermetastasen. De precieze diagnostische waarde kan nog niet goed worden gedefinieerd door het ontbreken van eenstemmigheid over de sluitende karakteristieken die bepalen welke lymfeklieren pathologisch zijn. Een beperking van de echografie is dat de interpretatie van het onderzoek erg afhankelijk is van de uitvoerder als ook diens ervaring. Na vaststelling van duidelijke criteria zou echografie een rol kunnen gaan spelen bij het selecteren van patiënten voor een schildwachtklierprocedure als de betrouwbaarheid in combinatie met cytologie voldoende blijkt.
Kosteneffectiviteit
Bij de lagere stadia melanomen (stadium I, II en IIIA) is de prevalentie van afstandsmetastasen laag; dit is van belang voor het beoordelen van de noodzaak tot het uitvoeren van afbeeldend onderzoek.
Bij de hogere stadia (IIIb/IIIC en IV) moeten de meerkosten van 18F-FDG PET/ldCT tov ceCT in ogenschouw worden genomen in relatie met de mate van invloed op (verandering van) het beleid voortvloeiend uit de diagnostische accuratesse. Er is een scenarioanalyse uitgevoerd die gebaseerd is op een literatuurstudie en de resultaten van de OMSPECT studie van Bastiaannet et al. (n=252 patiënten) met 5 scenario’s in stadium IIIB/IIIC patienten: (1) alle patiënten een 18F-FDG PET en gelijktijdig een ceCT, (2) eerst een ceCT gevolgd door een 18F-FDG PET/ldCT bij M0, (3) eerst een 18F-FDG PET/ldCT gevolgd door een ceCT in geval van M0, (4) alleen een ceCT en (5) alleen een 18F-FDG PET/ldCT) [Bastiaannet 2009]. Tevens is voor scenario 2, 3 en 5 meegenomen dat patiënten met gemetastaseerde ziekte (M1) een ceCT krijgen als uitgangsituatie voor start systemische therapie; indien als eerste gestart werd met een ceCT die negatief was (met een positieve PET-ldCT), is in de scenario’s niet nogmaals de ceCT herhaald. In de analyses was het percentage juist positieve scans die leidden tot upstaging en een correcte verandering in behandeling 31,0% voor scenario 1 en scenario 3, 30,6% voor scenario 2, 27,0% voor scenario 5 en 24,2% voor scenario 4. Hierbij was de goud standaard voor het aantal patiënten dat terecht werd ge-upstaged gebaseerd op histologie/pathologie, MRI, botscan, of minimaal 6 maanden follow-up.
Het aantal fout-negatieve scans is gelijk in scenario’s 1, 2 en 3 (1 patiënt). Het aantal fout-positieve scans is het laagst bij scenario 1 waar alle patiënten een 18F-FDG PET en gelijktijdig een ceCT ondergaan (1,6%) en scenario 5 (1,6%) waar patiënten een 18F-FDG PET/ldCT ondergaan maar die gevolgd wordt door een ceCT voor patiënten met gemetastaseerde ziekte, gevolgd door scenario 3 (eerst 18F-FDG PET/ldCT: 4,0%) en scenario 2 (eerst ceCT: 4,4%) en scenario 4 (4,4%).
Samenvattend is scenario 1, zowel 18F-FDG PET/ldCT als ceCT, het meest gunstig voor én het aantal patiënten dat terecht is ge-upstaged, en het laagst aantal fout-positieven, én het laagst aantal fout-negatieven.
De kosten voor diagnostiek en behandeling ten opzichte van de uitgangssituatie (geen aanvullende diagnostiek met 18F-FDG PET/ldCT en ceCT bij patiënten met stadium IIIB-C, waarbij alle patiënten een klierdissectie krijgen) stijgen met een aanzienlijk percentage, gerelateerd aan de proportie patiënten dat wordt ge-upstaged naar stadium IV en in het licht van de tegenwoordig veelal kostbare behandelopties. Naar mate de behandelopties duurder worden, zullen de extra kosten van aanvullende beeldvormende diagnostiek relatief minder meetellen in de totale kostenberekening. Ook zullen de kosten van patiënten die onterecht behandeld worden met systemische therapie (op basis van de fout-positieve uitslagen van beeldvorming) ongunstiger uitvallen naarmate deze systeemtherapie duurder is.
Het screenen op hersenmetastasen door middel van een MRI bij stadium I, II en III patiënten is waarschijnlijk niet kosteneffectief omdat de kans op aanwezigheid van intracerebrale metastasen bij patiënten zonder klachten minimaal is. Bij patiënten met een hoger stadium kan dit wel gerechtvaardigd zijn, indien hier behandel consequenties aan zijn verbonden.
Organisatie
Tegenwoordig (anno 2015) is er geen beperking meer in de beschikbaarheid van 18F-FDG PET/CT in Nederland. Wat betreft de whole body diffusie gewogen MRI techniek geldt dat dit slechts in een paar centra in Nederland, voornamelijk in studieverband wordt toegepast. En wordt deze techniek niet als gangbare routine gezien. Ook een gecombineerde PET/MRI systeem is slechts zeer beperkt beschikbaar in Nederland.
Onderbouwing
Achtergrond
Aanvullend onderzoek
Bij veel vormen van kanker vindt, na het stellen van de diagnose, een stadiëring plaats op grond waarvan het therapeutisch beleid wordt vastgesteld. De vraag is of het voor de prognose en therapie van melanomen ook zinvol is om aanvullend afbeeldend onderzoek te doen naar (subklinische) metastasen. Bij beantwoording van deze vraag is het van belang onderscheid te maken tussen stadium I/II en stadium III/IV patiënten. Vormen van afbeeldend onderzoek die momenteel ter beschikking staan zijn echografie, MRI, CT en 18F-FDG PET. Tegenwoordig zijn er geen PET only camera’s meer in gebruik in Nederland. Er wordt bij iedere PET scan tenminste een CT scan gemaakt nodig voor verzwakkingscorrectie van de PET beelen (low dose CT). Daarnaast kunnen er aanvullende diagnostische CT scans gemaakt worden. Onder diagnostische CT scans wordt in het algemeen verstaan: contrast enhanced (ce)CT scans inclusief ademhalingscommando’s en gebruik makend van een hogere stralingsdosis.
Conclusies / Summary of Findings
Aanvullend onderzoek
Conclusies 2012 (onveranderd geldig, niet meegenomen in modulaire revisie 2016)
Het is aangetoond dat 18F-FDG PET of 18F-FDG PET/ldCT een matige tot hoge specificiteit, maar een zeer lage sensitiviteit heeft voor het aantonen van regionale metastasen bij stadium I-II patiënten. Hierdoor is zowel de aantonende als uitsluitende kracht van 18F-FDG PET of 18F-FDG PET/ldCT voor deze indicatie zeer beperkt.
Niveau 1: Krug 2008(39), Cordova 2006(1), Kell 2007(2), Klode 2010(3), Singh 2008(4)
Het is aangetoond dat echografie een hoge specificiteit heeft voor positieve regionale lymfeklieren.
Niveau 1: A2: Xing 2011(10), Van Rijk 2006(8), Voit 2010(9), B; Hocevar 2004(6), Kahle 2003(5), Sanki 2009(7)
Er zijn aanwijzingen dat de sensitiviteit van echografie voor positieve regionale lymfeklieren afhankelijk is van de echografische kenmerken die gehanteerd worden om een abnormale test te definiëren, en dat perifere perfusie en/of verlies van centrale echogeniciteit (oftewel vetcentrum) en/of ballonvorm (ronde vorm itt de normale ovale vorm) de hoogste sensitiviteit heeft.
Niveau 3: A2: Voit 2010(9)
Er zijn aanwijzingen dat de kans dat MRI hersenmetastasen aantoont bij patiënten met stadium I-II klein
Niveau 3: B: Fogarty 2006(9)
Conclusies 2015 (op basis van modulaire revisie 2016)
Het is aannemelijk dat bij (her)stadiëring van stadium IIIb-IV patiënten 18F-FDG PET/ldCT en ceCT elkaar weinig ontlopen in overall sensitiviteit en specificiteit. De hoogste accuratesse (combinatie van sensitiviteit en specificiteit) wordt bereikt met 18F-FDG-PET/ldCT gecombineerd met diagnostische ceCT. Op laesie-niveau presteert 18F-FDG PET/ldCT beter in het opsporen van subcutane en botmetastasen en diagnostische ceCT beter in het opsporen van (kleine) longmetastasen.
Niveau 2: B Xing 2011(10), Bastiaannet 2009(22), Pfluger 2011(43), Jouvet 2013(35)
Momenteel is er nog te weinig literatuur beschikbaar om een goede plaatsbepaling van 18F-FDG-PET/ldCT ten opzichte whole body (diffusie gewogen) MRI te doen bij stadium IIIb-IV melanoom patiënten. De resultaten van drie kleine studies komen niet overeen.
Niveau 3: B Pfannenberg 2007(42), Laurent 2010(41), Jouvet 2013(35)
Samenvatting literatuur
Aanvullend onderzoek
Melanoom stadium I en II
Over de waarde en de diagnostische accuratesse van de 18F-FDG PET of 18F-FDG PET/(ld)CT scan zijn twee systematische reviews verschenen die de gegevens van respectievelijk tien en tweeëntwintig studies samenvatten [Krug 2010(40); Xing 2011(52)]. In het eerste review wordt een gepoolde sensitiviteit gerapporteerd van 60% (95% CI 54-60), gegevens over specificiteit en likelihood ratio’s (LR) worden niet vermeld. Het tweede recentere review berekent respectievelijk een sensitiviteit van 30% (CI 12-55) en een specificiteit van 96% (CI 87-99) voor 18F-FDG PET en een sensitiviteit van 11% (CI 1-50%) en specificiteit van 97% (CI 78-100) voor 18F-FDG PET of 18F-FDG PET/ldCT. Voor de berekening voor 18F-FDG PET of 18F-FDG PET/ldCT is echter maar één studie beschikbaar. Als de analyses beperkt worden tot studies waarbij de sentinelnode biopsie als referentiestandaard wordt gebruikt om regionale lymfogene metastasering op te sporen is de positieve LR 1,33 (CI 0,66-2,68) en de negatieve LR 1,00 (CI 0,83-1,19). De likelihood ratio is een maat voor de informatie, die een test toevoegt aan de al beschikbare informatie over de prevalentie van een ziekte. Hoe dichter de likelihood ratio bij 1,0 ligt, hoe minder de uitslag van de diagnostische test iets zegt over de aanwezigheid van de ziekte. Ook een aantal andere kleine studies die niet in bovengenoemde reviews zijn opgenomen, bevestigen het beeld van de beperkte waarde van 18F-FDG PET of 18F-FDG PET/ldCT bij stadium I en II patiënten. Ze melden een lage sensitiviteit (6-22%), hoge specificiteit (87-100), en niet significante likelihood ratio’s (LR + 1,5-2,7 en LR- 0,87-0,92) [Cordova 2006(1), Kell 2007(2), Klode 2010, Singh 2008(4)].
De rol van de echografie bij de beoordeling van locoregionale lymfeklierstations in stadium I en II patiënten is onderzocht in vijf studies en één review. Eén daarvan [Kahle 2003(5)] rapporteert enkel het aantal klieren dat door echografie geïdentificeerd kan worden in vergelijking met scintigrafie, namelijk 85,4%. De overige artikelen onderzochten de diagnostische nauwkeurigheid van echografie voor het herkennen van positieve lymfklieren in vergelijking met de schildwachtklierprocedure [Hocevar 2004(6), Sanki 2009(7), van Rijk 2006(8), Voit 2010(9), Xing 2011(10)]. De sensitiviteit wisselt sterk (23-71%), de waardes van specificiteit en positieve likelihood ratio zijn meer consistent (80-97% en LR 2,3-8,6). In het systematische review van Xing et al. wordt een gepoolde sensitiviteit van 60% (95% betrouwbaarheidsinterval (95%BI) 33-83) en een gepoolde specificiteit van 97% (BI 88-99) gemeld [Xing 2011(10)]. Wat opvalt, zijn de verschillen in definitie van een abnormale klierstructuur op echo die in de verschillende studies zijn gehanteerd. Dit vormt waarschijnlijk de verklaring voor de grote verschillen in sensitiviteit. Wat betreft de betekenis van andere afbeeldende modaliteiten (MRI, CT scan en SPECT/ldCT) voor stadium I en II patiënten zijn slechts zeer beperkte gegevens voorhanden. Er werd één studie over MRI geïdentificeerd, die de diagnostische waarde voor hersenmetastasen onderzocht [Fogarty 2006(11)]. Van de 100 patiënten die in deze studie werden geïncludeerd, waren er vijftien met stadium I-II. Er werden hersenmetastasen gevonden bij elf patiënten, allen stadium IV. Bij patiënten met stadium I-II werden geen hersenmetastasen gevonden, ook niet bij die patiënten met klachten suggestief voor mogelijke hersenmetastasen. In het review van Xing et al. wordt voor het gebruik van de CT scan bij het opsporen van regionale en afstandsmetastasen een gepoolde sensitiviteit van 9% (95%BI 1-52) respectievelijk 51% (95%BI 24-76) en een gepoolde specificiteit van 92% (95%BI 50-99) respectievelijk 69% (95%BI 30-92) beschreven [Xing 2011(10)].
Melanoom stadium III en IV
Over de waarde en diagnostische accuratesse van FDG PET/low dose (ld)CT, contrast enhanced (ce)CT en whole body (WB)-MRI zijn tussen 2009 en juni 2014 twee overzichtsartikelen verschenen van Xing et al. en Ciliberto et al. [Xing 2011(10), Ciliberto 2013]. Ook zijn er vier additionele artikelen gevonden die voldeden aan de zoekcriteria [Bastiaannet 2009(25), Pfluger 2011(43), Laurent 2010(41), Jouvet 2014(35)].
PET vs CT
Xing et al. [Xing 2011(9)] includeerden in hun review 8 studies die CT vergeleken met 18F-FDG PET en de combinatie 18F-FDG PET/CT [Brady 2006(16), Finkelstein 2004(15), Iagaru 2007(34), Pfannenberg 2007(20), Reinhardt 2006(44), Romer 2006(45), Swetter 2002(14), Veit-Haibach 2009(21)]. Er zijn een aantal beperkingen aan de onderliggende studies. Slechts vier studies binnen deze meta-analyse hebben gebruik gemaakt van de modernere PET/CT systemen (Iagaru 2007(19), Pfannenberg 2007(20), Reinhard 2006(17), Veit-Haibach 2009(21)]. Alleen deze studies zijn daarom aan een nadere analyse onderworpen. Deze studies verschilden onder meer ten aanzien van de gebruikte CT protocollen bij de PET/CT, variërend van non-enhanced CT (neCT) zonder ademinstructies [Iagaru 2007(19), Pfannenberg 2007(20)] naar CT met oraal contrast met alleen ademinstructies rondom het diafragma [Reinhardt 2006(17)] en intraveneus (i.v.) contrast-enhanced (ce) CT zonder ademinstructies [Veit-Haibach 2009(21)]. Verder heeft slechts 1 van deze 4 studies alleen hogere stadia melanoom patienten geïncludeerd: Pfannenberg et al. includeerde in totaal 64 patienten, allen met stadium III/IV [Pfannenberg 2007(20)]. In de studie van Iagaru et al. met 106 patiënten hadden 30 patiënten stadium III/IV en werd het onderzoek gedaan voor restadiëring (zie tabel 1) [Iagaru 2007(19)]. De studie van Veit-Haibach et al. bekeek alleen de situatie bij primaire stadiëring (alle tumorstadia), waarbij er slechts 12 van de 56 patienten waren met stadium III/IV [Veit-Haibach 2009(21)]. En Reinhardt et al. bestudeerde bij alle tumorstadia zowel de waarde van de beeldvorming bij primaire stadiëring als ook bij re-stadiëring, follow-up en therapie controle [Reinhardt 2006(17)]. In de separate studies komen er meestal geen significante verschillen uit, waarschijnliik vanwege kleine patiëntseries en geringe verschillen tussen de beeldvormende technieken. Gezien de heterogeniteit tav de uitvoering onderzoekstest, inclusie van ziekte stadium, etc, is statische pooling niet goed mogelijk. Een overzicht van de beschreven studies staat in tabel 1.
In een prospectieve, in Nederland uitgevoerde studie (n=251) van Bastiaannet et al. werden geen significante verschillen gevonden tussen de sensitiviteit (86% (95%CI 78%-94%) vs. 78% (95%CI 69%-87%)) en specificiteit (beide 94%) van 18F-FDG PET en ceCT bij herstadiëringen van patiënten die zich presenteerden met palpabele lymfklieren (stadium IIIB en IIIC) [Bastiaannet 2009]. Met 18F-FDG PET werden wel meer metastasen op afstand gevonden dan met ceCT (133 vs. 120; p=0,03). Het aantal gedetecteerde botmetastasen en subcutane metastasen lag bij 18F-FDG PET significant hoger dan bij ceCT (27 vs. 10, p< 0,0001; 11 vs. 5, p=0,03, respectievelijk). Er waren geen significante verschillen tussen beide modaliteiten in de detectie van metastasen in lever, abdomen en long, zie ook tabel 1.
De retrospectieve studie van Pfluger et al. vergeleek de diagnostische accuratesse van neCT, ceCT, 18F-FDG PET/neCT en 18F-FDG PET/ceCT in een cohort van 50 patiënten met stadium III melanoom [Pfluger 2011]. De overall op laesie gebaseerde sensitiviteit en specificiteit waren het hoogst voor 18F-FDG PET/ceCT en 18F-FDG PET/neCT. Deze waarden waren het laagst voor ceCT en neCT, zie tabel 1. Betrouwbaarheidsintervallen en significantie niveau’s werden niet gerapporteerd.
PET vs MRI vs CT
Het review van Ciliberto et al. richt zich op de vergelijking tussen 18F-FDG PET-CT en whole-body MRI voor een heel aantal verschillende tumortypen. Zij includeerden onder meer 3 prospectieve studies [Laurent 2010(41), Pfannenberg 2007(20), Dellestable 2011(29)] voor de stadiëring van melanoom (stadium niet vermeld). De studie van Dellestable et al. is Franstalig en voldeed daarom niet aan de inclusie van het huidige literatuur onderzoek. De studies van Laurent et al. en Pfannenberg et al. zijn ook apart met het literatuur onderzoek geïdentificeerd [Laurent 2010(41), Pfannenberg 2007(20)]. Het review van Ciliberto et al. is vooral beschrijvend en vermeldt een vergelijkbare op laesie gebaseerde accuratesse, sensitiviteit en specificiteit voor 18F-FDG PET-CT in vergelijking met WB-MRI, zonder onderscheid tussen klier- of afstandsmetastasen [Ciliberto 2013]. Betrouwbaarheidsintervallen werden niet gerapporteerd.
Laurent et al. vond bij 35 patiënten met een kans op aanwezigheid van metastasen (tumor stadium en verdere indicatie voor deelname aan onderzoek worden niet gegeven) een hogere overall sensitiviteit (83%) en specificiteit (98%) voor whole body MRI (multi contrast protocol inclusief diffusie gewogen opname) dan voor 18F-FDG PET/ldCT (sensitiviteit: 73%; specificiteit: 93%) voor het aantonen van metastasen, het significantieniveau is onbekend. Voor het aantonen van lymfekliermetastasen en metastasen op afstand in bot, lever en long was WB-MRI sensitiever dan 18FDG PET/ldCT, de significantieniveau’s zijn onbekend [Laurent 2010(41)], zie ook tabel 1.
In de prospectieve studie van Jouvet et al. werden de diagnostische accuratesse van de volgende technieken met elkaar vergeleken: 18F-FDG PET/ldCT (met i.v. contrast), ceCT, diffusie gewogen whole body -MRI (DWWB-MRI oftewel: whole body diffusion weighted imaging) en WB-MRI met een VIBE techniek (Volumetric interpolated breath-hold examination) in een cohort van 37 patiënten met een cutaan melanoom, stadium IV [Jouvet 2013(35)]. Er werden geen statistisch significante (p < 0,05) verschillen gevonden tussen 18F-FDG PET/CT en diffusie gewogen WB MRI +/- VIBE voor het opsporen van metastasen in het algemeen of op specifieke plaatsen. WB MRI VIBE presteerde overall wel significant beter dan ceCT, behoudens longmetastasen: hier was ceCT beter. Zie verder ook tabel 1.
Concluderend zijn de gevonden studies lastig direct te vergelijken vanwege diverse verschillen in patiëntinclusie, methodologie en kwaliteit. De meeste studies vergelijken 18F-FDG PET/ldCT en ceCT. Wanneer deze studies bekeken worden is de trend dat de combinatie van 18F-FDG PET en een diagnostische ceCT de beste accuratesse toont. Er zijn slechts enkele vergelijkende MRI studies beschikbaar, met relatief kleine patiënt aantallen, waarvan de resultaten elkaar tegenspreken.
Zie tabel 1: overzicht van de accuratesse-gegevens van de hierboven afzonderlijk beschreven studies.
Referenties
- 1 - Cordova A et al., 18 Fluoro-2-deoxy-D-glucose-positron emission tomography (FDG-PET) imaging versus sentinel lymph node biopsy (SLNB) in the staging of cutaneous melanoma in AJCC stage I and II. Chirurgia. 2006 (of Publication: Jun 2006): p. 19 (3) (pp 189-191).
- 2 - Kell M.R et al. PET CT imaging in patients undergoing sentinel node biopsy for melanoma. European Journal of Surgical Oncology, 2007(of Publication: Sep 2007): p. 33 (7) (pp 911-913), 2007.
- 3 - Klode J et al. Sentinel lymph node excision and PET-CT in the initial stage of malignant melanoma: A retrospective analysis of 61 patients with malignant melanoma in American joint committee on cancer stages i and II. Dermatologic Surgery, 2010(of Publication: April 2010): p. 36 (4) (pp 439-45), 2010.
- 4 - Singh B et al., Preoperative 18F-FDG-PET/CT imaging and sentinel node biopsy in the detection of regional lymph node metastases in malignant melanoma. Melanoma Research, 2008(of Publication: October 2008): p. 18 (5) (pp 346-352), 2008.
- 5 - Kahle B, Hoffend J, Wacker J, Hartschuh W. Preoperative ultrasonographic identification of the sentinel lymph node in patients with malignant melanoma. Cancer. 2003 Apr 15;97(8):1947-54.
- 6 - Hocevar M et al. The role of preoperative ultrasonography in reducing the number of sentinel lymph node procedures in melanoma. Melanoma Research. 2004(of Publication: Dec 2004): p. 14 (6) (pp 533-6), 2004
- 7 - Sanki A et al., Targeted high-resolution ultrasound is not an effective substitute for sentinel lymph node biopsy in patients with primary cutaneous melanoma. J Clin Oncol 2009(Nov) 27(33):5614-9.
- 8 - Van Rijk MC et al., Ultrasonography and fine-needle aspiration cytology in the preoperative evaluation of melanoma patients eligible for sentinel node biopsy. Ann Surg Oncol, 2006 Nov13;(11):1511-6.
- 9 - Voit C et al. Ultrasound morphology criteria predict metastatic disease of the sentinel nodes in patients with melanoma. Journal of clinical oncology. J Clin Oncol. 2010 Feb 10;28(5):847-52. Epub 2010 Jan 11.
- 10 - Xing Y et al. Contemporary diagnostic imaging modalities for the staging and surveillance of melanoma patients: a meta-analysis. J Natnl Canc Inst 2011;103(2):129-42.
- 11 - Fogarty GB, TartagliaC. The Utility of Magnetic Resonance Imaging in the Detection of Brain Metastases in the Staging of Cutaneous Melanoma. Clinical Oncology, 2006(of Publication: May 2006): p. 18 (4) (pp 360-362), 2006.
- 12 - Facey K., Bradbury I, Laking G, Payne E. Overview of het clinical effecttiveness of positron emissoin tomography imaging in selected cancers. Health Technology Assessment. 2007;11(44).
- 13 - Gulec SA, Faries MB, Lee CC, Kirgan D et al. The role of fluorine-18 deoxyglucose positron emission tomography in the management of patients with metastatic melanoma: impact on surgical decision making. Clin Nucl Med. 2003;28(12):961-5.
- 14 - Swetter S, Carroll LA., Johnson DL et al. Positron Emission Tomography is luperior to Computd Tomography for metastatic detection in melanoma patientsl. Annals of Surgical Oncology. 2002;9 (7): 646-53.
- 15 - Finkelstein SE, Carrasquillo JA, Hoffman JM et al. A prospective analysis of positron emission tomography and conventional imaging for detection of stage IV metastatic melanoma in patients undergoing metastasectomy. Ann Surg Oncol. 2004;11(8):731-8.
- 16 - Brady MS, Akhurst T, Spankneber K, et al.Utility of preoperative [18F]Fluorodeoxyglucose Positron Emission Tomography scanning in high-riks melanoma patients. Annals of Surgical Oncology. 2006;13 (4): 525-532.
- 17 - Reinhardt MJ, Joe AY, Jaeger U et al. Diagnostic performance of whole body dual modality 18F-FDG PET/CT imaging for N- and M-staging of malignant melanoma: experience with 250 consectutive patients. Journal of Clinical Onology. 2006; 24 (7): 1178-86.
- 18 - Römer W, Nörmayr A, Fiedler E et al . Retrospective interactive rigid fusion of 18F-FDG PET and CT. Nuklearmedzin. 2006;45: 88-95.
- 19 - Iagaru A, Quon A, Johnson D et al. 2-Deoxy -2-[18F]Fluorodeoxyglucose Positron Emission Tomography / Computd Tomography in the management of melanoma. Molecular Imaging and Biology. 2006;9: 50-7.
- 20 - Pfannenberg C, Aschoff P, Schanz S et al. Prospective comparison of [18F]Fluorode-oxyglucose Positron Emission Tomography. Computed Tomography and whole-body magnetic resonance imaging in staging of advanced malignant melanoma. European Journal of Cancer 2007;43: 557-64.
- 21 - Veit-Haibach P, Vogt FM, Jablonka R et al. Diagnostic accuracy op contraxt-enhanced FDG-ET/CT in primary staging of cutaneous malignant melanoma." Eur J Nucl Med Mol. 2009; Imaging 36: 1910-8.
- 22 - Bastiaannet E, Wobbes, T., Hoekstra, O.S., et al. Prospective Comparison of [18F]Fluorodeoxyglucose Positron Emission Tomography and Computed Tomography in patients with palpable lymph node metastases: Diangnostic accuracy and impact on treatment. Jounal of Clinical Oncology. 2009:27(28): 4774-80.
- 23 - Krug B et al. Role of PET in the initial staging of cutaneous malignant melanoma: systematic review. Radiology, 2008(of Publication: Dec 2008): p. 249 (3) (pp 836-844), 2008.
- 24 - Aukema TS, Valdés Olmos RA, et al. Utility of preoperative 18F-FDG PET/CT and brain MRI in melanoma patients with palpable lymph node metastases. Ann Surg Oncol. 2010: 2773-8.
- 25 - Bastiaannet E, Wobbes, T., Hoekstra, O.S., et al. Prospective Comparison of [18F]Fluorodeoxyglucose Positron Emission Tomography and Computed Tomography in patients with palpable lymph node metastases: Diangnostic accuracy and impact on treatment. JCO. 2009:27: 4774-80.
- 26 - Brady MS, Akhurst T, Spankneber K, et al.Utility of preoperative [18F]Fluorodeoxyglucose Positron Emission Tomography scanning in high-riks melanoma patients. Ann Surg Oncol. 2006;13: 525-532.
- 27 - Bronstein Y, Ng CS, Rohren E, et al. PET/CT in the management of patients with stage IIIC and IV metastatic melanoma considered candidates for surgery: evaluation of the additive value after conventional imaging. AJR Am J Roentgenol. 2012;198:902-8.
- 28 - Cordova A et al., 18 Fluoro-2-deoxy-D-glucose-positron emission tomography (FDG-PET) imaging versus sentinel lymph node biopsy (SLNB) in the staging of cutaneous melanoma in AJCC stage I and II. Chirurgia. 2006 (of Publication: Jun 2006): p.19(189-191).
- 29 - Dellestable P, Granel-Brocard F, Rat AC, et al. [Impact of whole body magnetic resonance imaging (MRI) in the management of melanoma patients, in comparison with positron emission tomography/computed tomography (PET/CT) and CT]. Ann Dermatol Venereol. 2011;138:377-83.
- 30 - Etchebehere EC, Romanato JS, Santos AO, et al. Impact of [F-18] FDG-PET/CT in the restaging and management of patients with malignant melanoma. Nucl Med Commun. 2010;31:925-30.
- 31 - Finkelstein SE, Carrasquillo JA, Hoffman JM et al. A prospective analysis of positron emission tomography and conventional imaging for detection of stage IV metastatic melanoma in patients undergoing metastasectomy. Ann Surg Oncol. 2004;11:731-8.
- 32 - Fogarty GB, Tartaglia C. The Utility of Magnetic Resonance Imaging in the Detection of Brain Metastases in the Staging of Cutaneous Melanoma. Clinical Onc. 2006;18:360-2.
- 33 - Hocevar M, Bracho M, Pogacnik A, et al. The role of preoperative ultrasonography in reducing the number of sentinel lymph node procedures in melanoma. Melanoma Res. 2004;14:533-6.
- 34 - Iagaru A, Quon A, Johnson D, et al. 2-Deoxy-2-[F-18]fluoro-D-glucose positron emission tomography/computed tomography in the management of melanoma. Mol Imaging Biol. 2007;9:50-7.
- 35 - Jouvet JC, Thomas L, Thomson V, et al. Whole-body MRI with diffusion-weighted sequences compared with 18FDG PET-CT, CT and superficial lymph node ultrasonography in the staging of advanced cutaneous melanoma: a prospective study. J Eur Acad Dermatol Venereol. 2014;28:176-85.
- 36 - Kahle B, Hoffend J, Wacker J, et al. Preoperative ultrasonographic identification of the sentinel lymph node in patients with malignant melanoma. Cancer. 2003;97:1947-54.
- 37 - Kell MR, Ridge JA, Joseph N, et al. PET CT imaging in patients undergoing sentinel node biopsy for melanoma. Eur J Surg Oncol. 2007;33:911-3.
- 38 - Klode J, Dissemond J, Grabne S, et al. Sentinel lymph node excision and PET-CT in the initial stage of malignant melanoma: A retrospective analysis of 61 patients with malignant melanoma in American joint committee on cancer stages I and II. Dermatologic Surg. 2010;36:439-45.
- 39 - Krug B, Crott R, Lonneux M, et al. Role of PET in the initial staging of cutaneous malignant melanoma: systematic review. Radiology. 2008:249:836-844.
- 40 - Krug B, Pirson AS, Crott R, et al. The diagnostic accuracy of 18F-FDG PET in cutaneous malignant melanoma. Eur J Nucl Med Mol Imaging. 2010;37:1434-5.
- 41 - Laurent V, Trausch G, Bruot O, et al. Comparative study of two whole-body imaging techniques in the case of melanoma metastases: advantages of multi-contrast MRI examination including a diffusion-weighted sequence in comparison with PET-CT. Eur J Radiol. 2010;75:376-83.
- 42 - Pfannenberg C, Aschoff P, Schanz S, et al. Prospective comparison of [18F]Fluorode-oxyglucose Positron Emission Tomography. Computed Tomography and whole-body magnetic resonance imaging in staging of advanced malignant melanoma. Eur JCancer 2007;43: 557-64.
- 43 - Pfluger T, Melzer HI, Schneider V, et al. PET/CT in malignant melanoma: contrast-enhanced CT versus plain low-dose CT. Eur J Nucl Med Mol Imaging. 2011;38:822-31.
- 44 - Reinhardt MJ, Joe AY, Jaeger U et al. Diagnostic performance of whole body dual modality 18F-FDG PET/CT imaging for N- and M-staging of malignant melanoma: experience with 250 consectutive patients. J Clin Onol. 2006;24:1178-86.
- 45 - Römer W, Nörmayr A, Fiedler E, et al. Retrospective interactive rigid fusion of 18F-FDG PET and CT. Nuklearmedzin. 2006;45:88-95.
- 46 - Sanki A, Uren RF, Moncrieff M, et al., Targeted high-resolution ultrasound is not an effective substitute for sentinel lymph node biopsy in patients with primary cutaneous melanoma. J Clin Oncol. 2009;27:5614-9.
- 47 - Subesinghe M, Marples M, Searsbrook AF, et al. Clinical impact of 18F-FDG PET-CT in recurrent stage III/IV melanoma: a tertiary centre Specialist Skin Cancer Multidisciplinary Team (SSMDT) experience. Insight Imaging. 2013;4:701-709.
- 48 - Swetter S, Carroll LA., Johnson DL, et al. Positron Emission Tomography is luperior to Computd Tomography for metastatic detection in melanoma patientsl. Ann Surg Oncol. 2002;9:646-53.
- 49 - Van Rijk MC, Teertstra HJ, Peterse JL, et al. Ultrasonography and fine-needle aspiration cytology in the preoperative evaluation of melanoma patients eligible for sentinel node biopsy. Ann Surg Oncol. 2006;11:1511-6.
- 50 - Veit-Haibach P, Vogt FM, Jablonka R, et al. Diagnostic accuracy of contraxt-enhanced FDG-PET/CT in primary staging of cutaneous malignant melanoma. Eur J Nucl Med Mol. 2009;36:1910-8.
- 51 - Voit C, van Akkooi AC, Schäfer-Hesterberg G, et al. Ultrasound morphology criteria predict metastatic disease of the sentinel nodes in patients with melanoma. J Clin Oncol. 2010;28:847-52.
- 52 - Xing Y, Bronstein Y, Ross MI, et al. Contemporary diagnostic imaging modalities for the staging and surveillance of melanoma patients: a meta-analysis. J Natl Cancer Inst. 2011;103:129-42.
- 53 - Aukema TS, Valdes Olmos RA, Korse CM, et al. Kroon BB, Wouters MW, Vogel WV, et al. Utility of FDG PET-CT and brain MRI in melanoma patients with increased serum S-100B level during follow-up. Ann Surg Oncol. 2010;17:1657-61.
Evidence tabellen
Aanvullend onderzoek
Bij patiënten met melanoom stadium III en IV (primair dan wel recidief) die in aanmerking komen voor in opzet curatieve/lokale behandeling, welke diagnostische test - FDG PET/CT, contrast CT of whole body MRI - resulteert in de meest accurate opsporing van metastasen?
Primary studies
|
I Study ID |
II Method |
III Patient characteristics |
IV Intervention(s) |
V Results primary outcome |
VI Results secondary and other outcomes |
|
|
|
Eligibility criteria: Stage IV cutaneous melanoma patients Exclusion
Patient characteristics
|
Index test(s)
(diffusion) sequences combined PET-CT, CT and superficial lymph nodes US.
Reference standard
or sequential imaging during clinical follow-up (at least 9 months)
|
Diagnostic accuracy Lesion based Overall PET-CT
CT
MRI
MRI (VIBE)
Overall Lymph node PET-CT
CT
MRI
MRI (VIBE)
No statistically significant difference (P < 0.05) of overall diagnostic performances between wbMRI and PETCT No statistically significant difference was found between wbMRI and PET-CT with two channels for CT with respect to different metastatic sites. Compared with the CT, wbMRI had significantly better overall specificity (P = 0.0011) and PPV (P = 0.02). For lung exploration, sensitivity of wbMRI (51.6%) was inferior to CT (71.4%). To detect superficial metastatic lymph nodes, wbMRI and US both showed high diagnostic accuracy with no statistically significant difference.
|
|
|
|
|
Eligibility criteria: patients with cutaneous melanoma presenting a risk of metastatic spread.
Exclusion: patient with a cardiac pace maker, metal devices in the body, allergy to contrast medium, restricted renal function, pregnancy, claustrophobia
Patient characteristics
|
Index tests
Reference standard
|
Diagnostic accuracy Lesion based Overall PET-CT
MRI
Lung
Bone
Liver
Lymph nodes
|
|
|
Abbreviations: VIBE: Volumetric interpolated breath-hold examination, PET: positron emission tomography, PET-CT: PET/computed tomography, FDG: Fluorine-18-Fluorodeoxyglucose, WB-MRI: whole-body magnetic resonance imaging, NPV: negative predictive value; PPV: positive predictive value
Risk of bias table
| Internal validity | Jouvet et al, 2013 | Laurent, 2010 | Pfluger, 2011 |
| The index test being studied is clearly specified | yes | yes | yes |
| The index test is compared with a reference standard | yes | yes | yes |
| The reference standard is likely to correctly classify the target condition | No, during follow-up non existent lesions can not be distinguished from non detectable lesions | No, during follow-up non existent lesions can not be distinguished from non detectable lesions | No, during follow-up non existent lesions can not be distinguished from non detectable lesions |
| The spectrum of the included patients is representative of the patients who will receive the test in practice | yes | yes | yes |
| Selection criteria are clearly described | yes | yes | yes |
| The time period between reference standard and index test is short enough to be reasonably sure that the target condition did not change between the two tests | unclear | unclear | unclear |
| The whole sample or a random selection of the sample received verification using the reference standard of diagnosis | yes | yes | yes |
| Patients received the same reference standard regardless of the index test result | No: differential verification | No: differential verification | No: differential verification |
| The reference standard is independent of the index test (i.e. the index test did not form part of the reference standard) | unclear | Unclear what technique was used during follow up | no |
| The execution of the index test is described in sufficient detail to permit replication of the test | yes | yes | yes |
| The execution of the reference standard is described in sufficient detail to permit its replication | no | No: Unclear what technique was used during follow up | yes |
| The index test results were interpreted without knowledge of the results of the reference standard | yes | yes | yes |
| The reference standard results were interpreted without knowledge of the results of the index test | unclear | yes | unclear |
| The same clinical data were available when test results were interpreted as would be available when the test is used in practice | yes | yes | yes |
| Uninterpretable/ intermediate test results are reported | no | unclear whether there were uninterpretable/ intermediate test results | unclear whether there were uninterpretable/ intermediate test results |
| Withdrawals from the study are explained | not applicable: no patient was lost in the follow-up | unclear whether there were withdrawals | unclear whether there were withdrawals |
| Overall assessment of the study | |||
| Are the results of the study valid? | High risk on bias | High risk on bias | High risk on bias |
| applicable to the patient group targeted in the search question? | yes | yes | yes |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-10-2024
Voorwaarden voor revisie en beoordelingsfrequentie zijn vastgelegd in de richtlijn. De geldigheidstermijn voor de richtlijn (maximaal vijf jaar na vaststelling) wordt vanuit het IKNL bewaakt. Om verscheidene redenen kan actualisatie eerder dan beoogd nodig zijn. Zo nodig zal de richtlijn tussentijds op onderdelen worden bijgesteld.
Algemene gegevens
IKNL (Integraal Kankercentrum Nederland) is het kennis- en kwaliteitsinstituut voor professionals en bestuurders in de oncologische en palliatieve zorg. IKNL draagt bij aan het verbeteren van de zorg rond kanker door het verzamelen van gegevens, het opstellen van richtlijnen, het bewaken van kwaliteit en het faciliteren van samenwerkingsverbanden. Ons doel is de beste zorg voor iedere patiënt.
IKNL werkt aan multidisciplinaire richtlijnontwikkeling voor de oncologische en palliatieve zorg. Naast het reviseren van richtlijnen faciliteert IKNL ook het onderhoud, het beheer, de implementatie en de evaluatie van deze richtlijnen. Een implementatie- en evaluatieplan wordt gepubliceerd indien de richtlijn geautoriseerd beschikbaar is.
De kwaliteit van ontwikkelen, implementeren en evalueren van evidence en consensus based richtlijnen waarborgt IKNL door aan te sluiten bij de criteria opgesteld in de Richtlijn voor Richtlijnen (maart 2012), AGREE II en de Medisch specialistische richtlijnen 2.0.
Initiatief
Nederlandse Vereniging voor Nucleaire Geneeskunde (NVNG)
Nederlandse Vereniging voor Pathologie (NVVP)
Organisatie
Integraal Kankercentrum Nederland (IKNL)
Betrokken verenigingen
Nederlandse Internisten Vereeniging (NIV)
Nederlandse Melanoom Werkgroep (NMW)
Nederlandse Vereniging voor Dermatologie en Venerologie (NVDV)
Nederlandse Vereniging voor Heelkunde (NVvH)
Nederlandse Vereniging voor Nucleaire Geneeskunde (NVNG)
Nederlandse Vereniging voor Pathologie (NVVP)
Nederlandse Vereniging voor Radiologie (NVvR)
Leven met Kanker beweging - Stichting Melanoom
Financiering
Deze module is gefinancierd door de:
Kwaliteitskoepel Medisch Specialisten (SKMS)
Nederlandse Vereniging voor Nucleaire Geneeskunde (NVNG)
Nederlandse Vereniging voor Pathologie (NVVP)
De inhoud van de modules is niet beïnvloed door de financierende instanties.
Juridische verantwoordelijkheid
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat deze aanbevelingen in een individueel geval niet van toepassing zijn. Er kunnen zich feiten of omstandigheden voordoen waardoor het wenselijk is dat in het belang van de patiënt van de richtlijn wordt afgeweken. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd gedocumenteerd te worden. De toepassing van de richtlijnen in de praktijk is de verantwoordelijkheid van de behandelende arts.
Houderschap richtlijn
De houder van de richtlijn moet kunnen aantonen dat de richtlijn zorgvuldig en met de vereiste deskundigheid tot stand is gekomen. Onder houder wordt verstaan de verenigingen van beroepsbeoefenaren die de richtlijn autoriseren.
Integraal Kankercentrum Nederland draagt zorg voor het beheer en de ontsluiting van de richtlijn.
Doel en doelgroep
Doel
Een richtlijn is een document met aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering. Deze richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het expliciteren van goed medisch handelen. De richtlijn beoogt een leidraad te zijn voor de dagelijkse praktijk van de preventie, diagnostiek, behandeling en follow-up van patiënten met een melanoom van de huid. Melanomen op andere plaatsen in het lichaam zijn in deze richtlijn buiten beschouwing gelaten. De richtlijn omvat alle stadia van de ziekte.
Doelgroep
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, behandeling en begeleiding van patiënten met een melanoom van de huid, zoals dermatologen, pathologen, chirurgen, radiotherapeuten, internist-oncologen, huisartsen, oncologieverpleegkundigen, IKNL-consulenten, maatschappelijk werkers en psychologen.
Samenstelling werkgroep
Leden van de richtlijnwerkgroep 2016
Mw. Dr. A.H. Brouwers, nucleair geneeskundige UMCG (voorzitter)
Dr. A. van Akkooi, oncologisch chirurg NKI, voorzitter TFG Melanoom
Mw. Dr. W.A.M. Blokx, patholoog Radboud UMC
Drs. C.W.J. Ebben, procesbegeleider IKNL
Mw. Dr. A. Fioole-Bruining, radioloog, NKI
Mw. Dr. P.J.T.A. Groenen, Klinisch moleculair bioloog in de pathologie, Radboud UMC
Mw. Dr. N.A. Gruis, ervaringsdeskundige, Stichting Melanoom/Leven met Kanker beweging
Mw. Dr. E.R.M. de Haas, dermatoloog, Erasmus MC
Mw. H.W.G. Hamelers-Paulus, secretaresse IKNL
Mw. dr. O. van der Hel, literatuuronderzoeker IKNL
Prof. dr. H.J. Hoekstra, oncologisch chirurg, UMCG
Prof. dr. O.S. Otto Hoekstra, nucleair geneeskundige VUmc
Dr. W.H.J. Kruit, internist/oncoloog Erasmus MC
Prof. dr. W.J. Mooi, patholoog VUmc
Drs. R. Vernooij, literatuuronderzoeker IKNL
Belangenverklaringen
De werkgroepleden zijn afgevaardigd namens wetenschappelijke en hebben daarmee het mandaat voor hun inbreng.
Om de beïnvloeding van de richtlijnontwikkeling of formulering van de aanbevelingen door conflicterende belangen te minimaliseren zijn de leden van de werkgroep gemandateerd door de wetenschappelijke verenigingen.
Inbreng patiëntenperspectief
Bij de ontwikkeling van de module in 2015-2016 is tijdens alle fasen gebruik gemaakt van de input van patiënten. Door de Leven met Kanker Beweging is stichting Melanoom gevraagd een patiënten vertegenwoordiger voor de richtlijn werkgroep af te vaardigen. Stichting Melanoom heet hierop mw. dr. N.A. Gruis afgevaardigd. Zij heeft gedurende het gehele traject van de revisie 2016 geparticipeerd in de richtijn werkgroep.
De input van patiënt vertegenwoordigers is nodig voor de ontwikkeling van kwalitatief goede richtlijnen. Goede zorg voldoet immers aan de wensen en eisen van zowel zorgverlener als patiënt.
Methode ontwikkeling
Evidence based
Implementatie
Bevorderen van het toepassen van de richtlijn in de praktijk begint met een brede bekendmaking en verspreiding van de richtlijn.
Bij verdere implementatie gaat het om gerichte interventies om te bevorderen dat professionals de nieuwe kennis en kunde opnemen in hun routines van de oncologische en palliatieve zorgpraktijk, inclusief borging daarvan. Als onderdeel van elke richtlijn stelt IKNL een implementatieplan op.
Activiteiten en interventies voor verspreiding en implementatie vinden zowel op landelijk als regionaal niveau plaats. Deze kunnen eventueel ook op maat gemaakt worden per instelling of specialisme.
Werkwijze
Modulaire update 2016
De werkgroep heeft specifiek een aantal modules uit de richtlijn onder de loep genomen en aangepast aan de huidige stand van zaken. Het initiatief voor deze revisie is genomen door de Nederlandse Vereniging voor Nucleair Geneeskundigen (NVNG) en de Nederlandse Vereniging voor Pathologie (NVVP). Voor een drietal uitgansvragen, (1. De rol van de FDG-PET/CT scan in de diagnostiek, 2. De rol van de FDG-PET/CT scan in de follow-up en 3. de schildwachtklierprocedure) zijn systematisch literatuuronderzoeken verricht. Voor uitwerking van de uitgansvraag over de procedure rondom de BRAF-genmutatietest is gekozen voor een consensus based aanpak. Deze module beschrijft met name de organisatie van zorg omtrent deze test. Er zijn ook modules opgesteld voor de onderwerpen “systemische therapie (ipilimumab)” en “kosteneffectiviteit van de FDG-PET/CT scan bij inoperabel stadium 3 en stadium 4 patiënten”, echter door de snelle ontwikkelingen op het gebied van de systemische therapie heeft de werkgroep besloten deze modules (vooralsnog) niet te publiceren. Voor een overzicht van de uitgangsvragen zie bijlage X.
Voor iedere uitgangsvraag werd een subgroep geformeerd met vertegenwoordigers van relevante disciplines. De werkgroepleden schreven tekst, conclusies, overwegingen en aanbevelingen die tijdens plenaire vergaderingen werden besproken en na verwerking van de commentaren werden geaccordeerd.
De concept modules werden naar alle binnen deze werkgroep vertegenwoordigde verenigingen en organisaties gestuurd voor commentaar. Na verwerking van het commentaar zijn de nieuwe modules door de voltallige werkgroep vastgesteld en ter autorisatie naar de relevante beroepsverenigingen voorgelegd. De voorzitter van de werkgroep en de procesbegeleider van het IKNL zorgden voor de coördinatie en onderlinge afstemming van de subgroepen.
De EBRO-methodiek
Opbouw
Elke module van de richtlijn is volgens een vast stramien opgebouwd: de uitgangsvraag en aanbevelingen, de onderbouwing (samenvatting literatuur, referentielijst, conclusies en evidence tabellen), de overwegingen en de verantwoording. Voor het evidence based uitwerken van vragen rondom diagnostische interventie hanteren we de EBRO-methodiek, voor therapeutische interventies de GRADE methodiek. De antwoorden op de uitgangsvragen (derhalve de aanbevelingen in deze richtlijn) zijn voor zover mogelijk gebaseerd op gepubliceerd wetenschappelijk onderzoek.
Selectie Aanbevelingen werden gebaseerd op ‘beste evidence' en daarom werd naast selectie op relevantie tevens geselecteerd op bewijskracht. Hiervoor werd gebruik gemaakt van de volgende hiërarchische indeling van studiedesigns gebaseerd op bewijskracht:
1. Meta-analyses en systematische reviews;
2. Gerandomiseerde gecontroleerde studies (RCT's);
3. Niet gerandomiseerde gecontroleerde studies (CCT's).
Waar deze niet voorhanden waren werd verder gezocht naar vergelijkend cohortonderzoek.
Critical appraisal
De geselecteerde artikelen zijn vervolgens beoordeeld op de kwaliteit van het onderzoek door middel van het invullen van de checklist critical appraisal. Hierbij is het wetenschappelijk bewijs beoordeeld op vertekening (bias) en gegradeerd naar mate van bewijs. In de laatste kolom van de evidence tabellen wordt een samenvatting gegeven van de critical appraisal. De mate van bewijskracht en het niveau van bewijs zijn in de conclusies van de verschillende hoofdstukken of paragrafen weergegeven. De belangrijkste literatuur waarop de conclusies zijn gebaseerd, is daarbij vermeld.
Tabel 1. Diagnostische tests
Indeling van onderzoeksresultaten naar mate van bewijskracht
|
A1 |
Onderzoek naar de effecten van diagnostiek op klinische uitkomsten bij een prospectief gevolgde goed gedefinieerde patiëntengroep met een tevoren gedefinieerd beleid op grond van de te onderzoeken testuitslagen, of besliskundig onderzoek naar de effecten van diagnostiek op klinische uitkomsten, waarbij resultaten van onderzoek van A2-niveau als basis worden gebruikt en voldoende rekening wordt gehouden met onderlinge afhankelijkheid van diagnostische test. |
|
A2 |
Onderzoek ten opzichte van een referentietest, waarbij van tevoren criteria zijn gedefinieerd voor de te onderzoeken test en voor een referentietest, met een goede beschrijving van de test en de onderzochte klinische populatie; het moet een voldoende grote serie van opeenvolgende patiënten betreffen, er moet gebruik gemaakt zijn van tevoren gedefinieerde afkapwaarden en de resultaten van de test, en de ‘gouden standaard' moeten onafhankelijk zijn beoordeeld. Bij situaties waarbij multiple, diagnostische test een rol spelen, is er in principe een onderlinge afhankelijkheid en dient de analyse hierop te zijn aangepast, bijvoorbeeld met logistische regressie. |
|
B |
Vergelijking met een referentietest, beschrijving van de onderzochte test en van de onderzochte populatie, maar niet de kenmerken die verder onder niveau A1 en A2 staan genoemd. |
|
C |
Niet-vergelijkend onderzoek |
|
D |
Mening van deskundigen (bijvoorbeeld werkgroepleden) |
Tabel 2. Niveau van bewijskracht van de conclusie op basis van het aan de conclusie ten grondslag liggend bewijs
|
Niveau van bewijs |
Conclusie gebaseerd op |
Formulering |
|
1 |
Eén systematische review (A1) of ten minste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A1 of A2 |
Het is aangetoond dat... |
|
2 |
Ten minste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
Het is aannemelijk dat... |
|
3 |
Eén onderzoek van niveau A2, B of C |
Er zijn aanwijzingen dat... |
|
4 |
Mening van deskundigen (bijvoorbeeld de werkgroepleden) |
De werkgroep is van mening dat... |
Methode voor het formuleren van ‘Overwegingen'
Naast de evidence uit de literatuur (conclusie) zijn er andere overwegingen die meespelen bij het formuleren van de aanbeveling. Deze aspecten worden beschreven onder het kopje ‘Overwegingen' in de richtlijntekst. Bij de Overwegingen wordt de conclusie (op basis van de literatuur) door de werkgroep leden geplaatst in de context van de dagelijkse praktijk en maken zij een afweging van de voor- en nadelen van de verschillende beleidsopties. Vervolgens stellen werkgroepleden door middel van discussie (consensusmethode) gezamenlijk de aanbevelingen op. De uiteindelijk geformuleerde aanbeveling is het resultaat van de conclusie(s) in combinatie met deze overwegingen.
Voor het gestructureerd en transparant beschrijven van de overwegingen en aanbevelingen is een checklist ‘overwegingen' en een checklist ‘formuleren van aanbevelingen' opgesteld.
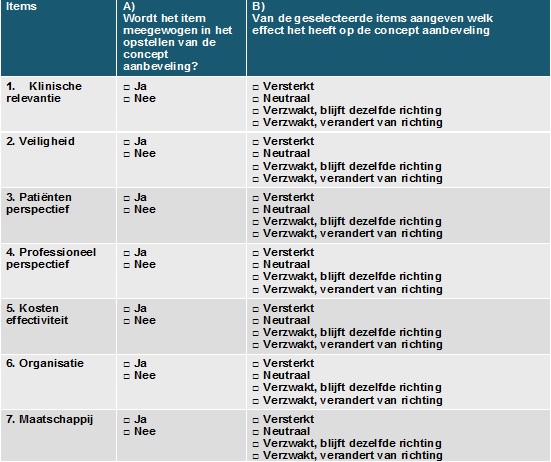
Checklist ‘overwegingen'
Eén of meerdere conclusies leidt c.q. leiden tot één aanbeveling. Vul per aanbeveling één checklist ‘overwegingen' in. Maak een link naar de ingevulde checklist in het tabblad ‘overwegingen' van het betreffende onderwerp.
Als een bepaald diagnostisch instrument of bepaalde behandeling niet werkzaam is dient geen gebruik gemaakt te worden van dit diagnostisch instrument of deze behandeling. Overwegingen zijn dan niet bijdragend en worden niet beschreven.

Uitleg items checlist 'overwegingen'
1. Klinische relevantie: bepalen door professionals en evt. literatuuronderzoek
- Sterkte van het effect vergeleken met geen interventie
- Consistentie van het beschikbare bewijs uit de verschillende studies
- Generaliseerbaarheid
- Voorbeeld: een bepaalde behandeling kan een significante verbetering van symptomen geven die patiënten echter niet als zodanig ervaren, dus klinisch niet relevant.
2. Veiligheidsissues: bepalen door professionals en evt. literatuuronderzoek
- Bijwerkingen, risico's of complicaties op korte en lange termijn
- Gebruik bij co-morbiditeit / gelijktijdig gebruik medicatie en/of interventie
- Voorbeeld: fysieke comorbiditeit kan bepaalde behandelingen uitsluiten.
3. Patiënten perspectief: bepalen door professionals, patiënten en eventueel literatuuronderzoek
- Voorkeuren / te verwachten compliance / te verwachten tevredenheid / kwaliteit van leven
- Voorbeeld: diagnostiek of behandeling waarvoor minder ziekenhuisbezoek nodig is; behandeling die makkelijker toe te dienen is; behandeling die sneller effect laat zien.
4. Professioneel perspectief: bepalen door professionals
- Kennis en ervaring met technieken/therapie
- Risico's die professional loopt bij het toepassen van de interventie / tijdbesparing of het verlies aan tijd door het invoeren van de interventie
- Houding, normen en waarden van de professional
- Voorbeeld: een nieuwe techniek die nog niet alle professionals beheersen.
5. Kosteneffectiviteit: bepalen door professionals, indien gewenst en mogelijk kosteneffectiviteitsanalyse door expert
- Kosteneffectiviteit in verhouding tot bestaande ingrepen/behandelingen voor deze ziekte
6. Organisatorische factoren: bepalen door professionals
- De beschikbaarheid/aanwezigheid van faciliteiten & medicijnen
- De wijze waarop de organisatie van de zorg aangeboden dient te worden / grootte van de verandering in het organisatie-zorgproces / infrastructuur voor implementatie
- Voorbeeld: een bepaalde diagnostiek of behandeling kan alleen in bepaalde centra worden uitgevoerd in verband met de aanwezigheid van faciliteiten zoals een PET scan.
7. Maatschappelijke factoren: bepalen door professionals
- Vergoeding door verzekeraars / Industriële belangen / Ethische overwegingen / Juridische overwegingen / Politieke en strategische consequenties
- Voorbeeld: indien twee behandelingen even effectief zijn waarvan één behandeling wordt vergoed, zal deze laatste behandeling worden aanbevolen.
Checklist formuleren van aanbevelingen

Methode voor het formuleren van aanbevelingen
In de praktijk kunnen er per uitgangsvraag meerdere conclusies zijn, met verschillend niveau van bewijs. Indien er meerdere conclusies bij de uitgangsvraag zijn geformuleerd is het van belang de conclusies te prioriteren. Het niveau van bewijs van de conclusie die het meest van belang is voor het formuleren van de aanbeveling wordt meegenomen in de checklist ‘formuleren van aanbevelingen'.
De GRADE-methodiek
Opbouw
Elke module van de richtlijn is volgens een vast stramien opgebouwd: de uitgangsvraag en aanbevelingen, de onderbouwing (samenvatting literatuur, referentielijst, conclusies en evidence tabellen), de overwegingen en de verantwoording. Voor het evidence based uitwerken van vragen rondom therapeutische interventies hanteren we de GRADE methodiek, voor alle overige uitgangsvragen de EBRO methodiek.
De antwoorden op de uitgangsvragen (derhalve de aanbevelingen in deze richtlijn) zijn, voor zover mogelijk, gebaseerd op gepubliceerd wetenschappelijk onderzoek.
Selectie Naast de selectie op relevantie werd tevens geselecteerd op bewijskracht. Hiervoor werd gebruik gemaakt van de volgende hiërarchische indeling van studiedesigns gebaseerd op bewijskracht:
1. Gerandomiseerde gecontroleerde studies (RCT's)
2. Niet gerandomiseerde gecontroleerde studies (CCT's)
Waar deze niet voorhanden waren werd verder gezocht naar vergelijkend cohortonderzoek.
Critical appraisal
De kwaliteit van bewijs wordt weergegeven in vier categorieën: hoog, matig, laag en zeer laag. RCT's starten hoog en observationele studies starten laag. Vijf factoren verlagen de kwaliteit van de evidentie (beperkingen in onderzoeksopzet, inconsistentie, indirectheid, imprecisie, publicatie bias) en drie factoren kunnen de kwaliteit van de evidentie verhogen (sterke associatie, dosis-respons relatie, plausibele (residuele) confounding) (zie tabel 1).
Tabel 1. GRADE-methodiek voor het graderen van bewijs
|
Quality of evidence |
Study design |
Lower if * |
Higher if * |
|
High (4) |
Randomized trial |
Study limitations -1 Serious -2 Very serious Inconsistency -1 Serious -2 Very serious Indirectness -1 Serious -2 Very serious Imprecision -1 Serious -2 Very serious Publication bias -1 Likely -2 Very likely |
Large effect + 1 Large + 2 Very large Dose response + 1 Evidence of a gradient All plausible confounding + 1 Would reduce a demonstrated effect, or + 1 Would suggest a spurious effect when results show no effect |
|
Moderate (3) |
|
||
|
Low (2)
|
Observational study |
||
|
Very low (1) |
|
Algehele kwaliteit van bewijs
Omdat het beoordelen van de kwaliteit van bewijs in de GRADE-benadering per uitkomstmaat geschiedt, is er behoefte aan het bepalen van de algehele kwaliteit van bewijs. Zowel voor als na het literatuuronderzoek wordt door de richtlijnwerkgroep bepaald welke uitkomstmaten cruciaal, belangrijk en niet belangrijk zijn.
Het niveau van de algehele kwaliteit van bewijs wordt in principe bepaald door de cruciale uitkomstmaat met de laagste kwaliteit van bewijs. Als echter de kwaliteit van het bewijs verschilt tussen de verschillende cruciale uitkomstmaten zijn er twee opties:
a. De uitkomstmaten wijzen in verschillende richtingen (zowel gewenst als ongewenste effecten) of de balans tussen gewenste en ongewenste effecten is onduidelijk, dan bepaalt de laagste kwaliteit van bewijs van de cruciale uitkomstmaten de algehele kwaliteit van bewijs;
b. De uitkomstmaten in dezelfde richting wijzen (richting gewenst of richting ongewenst effecten), dan bepaalt de hoogste kwaliteit van bewijs van de cruciale uitkomstmaat dat op zichzelf voldoende is om de interventie aan te bevelen de algehele kwaliteit van bewijs.
Tabel 2. Formulering conclusies op basis van kwaliteit van bewijs per uitkomstmaat
|
Kwaliteit van bewijs |
Interpretatie |
Formulering conclusie |
|
Hoog |
Er is veel vertrouwen dat het werkelijk effect dicht in de buurt ligt van de schatting van het effect. |
Er is bewijs van hoge kwaliteit dat...
(Referenties) |
|
Matig |
Er is matig vertrouwen in de schatting van het effect: het werkelijk effect ligt waarschijnlijk dicht bij de schatting van het effect, maar er is een mogelijkheid dat het hier substantieel van afwijkt. |
Er is bewijs van matige kwaliteit dat...
(Referenties) |
|
Laag |
Er is beperkt vertrouwen in de schatting van het effect: het werkelijke effect kan substantieel verschillend zijn van de schatting van het effect. |
Er is bewijs van lage kwaliteit dat....
(Referenties) |
|
Zeer laag |
Er is weinig vertrouwen in de schatting van het effect: het werkelijke effect wijkt waarschijnlijk substantieel af van de schatting van het effect. |
Er is bewijs van zeer lage kwaliteit dat....
(Referenties) |
|
Formulering algehele kwaliteit van bewijs: hoog/matig/laag/zeer laag |
||
Methode voor het formuleren van ‘Overwegingen'
Naast de evidence uit de literatuur (conclusies) zijn er andere overwegingen die meespelen bij het formuleren van de aanbeveling. Deze aspecten worden besproken onder het kopje ‘Overwegingen' in de richtlijntekst. Hierin worden de conclusies (op basis van de literatuur) geplaatst in de context van de dagelijkse praktijk en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties. De uiteindelijk geformuleerde aanbeveling is het resultaat van de conclusie(s) in combinatie met deze overwegingen.

Tabel 3. Van bewijs naar aanbeveling
|
Algehele kwaliteit van bewijs hoog / matig / laag / zeer laag |
|
|
Beslissing1 |
Toelichting |
|
1. Kwaliteit van het bewijs Is de algehele kwaliteit van bewijs hoog? |
☐ ja ☐ nee of onduidelijk
|
...
|
|
2. Balans tussen gewenste en ongewenste effecten Overtreffen de gunstige effecten de ongunstige effecten, of de ongunstige effecten de gunstige effecten aanzienlijk en is de werkgroep hier zeker van?
|
☐ ja ☐ nee of onduidelijk
|
...
|
|
3. Patiëntenperspectief Hanteren vrijwel alle patiënten hetzelfde perspectief op de wenselijkheid of de onwenselijkheid van de aan te bieden interventie?
|
☐ ja ☐ nee of onduidelijk
|
...
|
|
4. Professioneel perspectief Hanteren vrijwel alle zorgverleners hetzelfde perspectief op de wenselijkheid of de onwenselijkheid van de aan te bieden interventie?
|
☐ ja ☐ nee of onduidelijk
|
...
|
|
Onderstaande factoren alleen evalueren als een positief geformuleerde aanbeveling wordt overwogen
|
||
|
5. Middelenbeslag Zijn de netto-gunstige effecten de (extra) middelen waard? |
☐ ja ☐ nee of onduidelijk ... |
...
|
|
6. Organisatie van zorg Zijn voldoende condities van zorg-organisatorische aard aanwezig om de interventie toe te passen? |
☐ ja ☐ nee of onduidelijk
|
...
|
|
7. Maatschappelijk perspectief Zijn voldoende condities van maatschappelijke aard aanwezig om de interventie toe te passen? |
☐ ja ☐ nee of onduidelijk
|
...
|
|
1. Indien een of meerdere factoren worden geëvalueerd met ‘ja' neemt de waarschijnlijkheid van een sterke aanbeveling toe. |
||
|
Sterkte van de aanbeveling sterk / zwak (conditioneel) |
Toelichting bij Tabel 3
1. Kwaliteit van het bewijs Hoe hoger de algehele kwaliteit van het bewijs, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling.
2. Balans van gewenste en ongewenste effecten Hoe groter het verschil is tussen de gewenste en ongewenste effecten, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. Hoe kleiner dit verschil of hoe meer onzekerheid over de grootte van het verschil, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling. Toelichting:
- Bespreken effectiviteit in relatie tot bijwerkingen en complicaties in het licht van de kwaliteit van bewijs, de precisie van de effectgrootte en minimaal klinisch relevant geacht voordeel.
- Sterkte van het effect vergeleken met geen interventie.
- Aanwezigheid van comorbiditeit.
- Klinisch niet relevantie van het effect.
3. Patiëntenperspectief Hoe groter de uniformiteit in waarden en voorkeuren van patiënten bij het afwegen van de voor- en nadelen van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling.
4. Professioneel perspectief Hoe groter de uniformiteit in waarden en voorkeuren van professionals ten aanzien van de toepasbaarheid van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. Toelichting:
- Kennis en ervaring met technieken/therapieën.
- Risico's die professional loopt bij het toepassen van de interventie.
- Verwachte tijdbesparing.
- Verlies aan tijd door het invoeren van de interventie.
N.B.: de hierna volgende factoren (5, 6 en 7) alleen evalueren als een positief geformuleerde aanbeveling wordt overwogen! Een positief geformuleerde aanbeveling is een aanbeveling waarbij een bepaalde interventie wel ‘dient' plaats te vinden (sterk) of wel ‘kan worden overwogen' (zwak/conditioneel). Als dat daarentegen juist niet het geval is, is sprake van een negatief geformuleerde aanbeveling.
5. Middelenbeslag Hoe minder middelen er worden gebruikt (m.a.w. hoe lager de kosten van een interventie zijn vergeleken met de beschouwde alternatieven en andere kosten gerelateerd aan de interventie), des te waarschijnlijker wordt het formuleren van een sterke aanbeveling. Hoe meer onzekerheid over het middelenbeslag, des te waarschijnlijker wordt een conditionele aanbeveling.
6. Organisatie van zorg Hoe meer onzekerheid of de geëvalueerde interventie daadwerkelijk op landelijke schaal toepasbaar is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling. Toelichting:
- De beschikbaarheid/aanwezigheid van faciliteiten & medicijnen.
- De wijze waarop de organisatie van de zorg aangeboden dient te worden/grootte van de verandering in de organisatie-zorgproces/infrastructuur voor implementatie.
- Voorbeeld: een bepaalde diagnostiek of behandeling kan alleen in bepaalde centra worden uitgevoerd in verband met de aanwezigheid van faciliteiten zoals een PET scan.
7. Maatschappelijk perspectief (Juridische overwegingen/ethische overwegingen/industriële belangen/vergoeding door verzekeraars/politieke en strategische consequenties) Hoe groter de onzekerheid hierover is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling. Toelichting:
- Indien twee behandelingen even effectief zijn waarvan één behandeling wordt vergoed, zal deze laatste behandeling mogelijk de voorkeur hebben.
Methode voor het formuleren van aanbevelingen
GRADE kent twee soorten aanbevelingen: sterke aanbevelingen of conditionele (zwakke) aanbevelingen. De sterkte van aanbevelingen reflecteert de mate van vertrouwen waarin - voor de groep patiënten waarvoor de aanbevelingen zijn bedoeld - de gewenste effecten opwegen tegen de ongewenste effecten.
Formulering:
- Sterke aanbevelingen: Er dient.... te worden gegeven/gedaan.
- Zwakke/conditionele aanbevelingen: Overweeg..... te geven/te doen.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
