Schildwachtklierprocedure
Uitgangsvraag
Deze module wordt op korte termijn herzien gezien het veranderende landschap.
Wat is het effect van de schildwachtklierprocedure, indien positief gevolgd door een onmiddellijke completerende (aanvullende) lymfeklierdissectie, bij patiënten met nieuw gediagnosticeerd melanoom?
Aanbeveling
1. Re-excisie plus schildwachtklierprocedure versus re-excisie alleen
Verricht een schildwachtklierprocedure bij patiënten met een melanoom van pT1b (TNM 8) en hoger om patiënten optimaal te stadiëren en te informeren over de prognose, alsmede te bepalen of zij in aanmerking komen voor adjuvante therapie.
Verricht geen schildwachtklierprocedure bij patiënten met een pT1a (TNM 8) melanoom.
2. Lymfeklierdissectie versus nodale observatie bij positieve schildwachtklier-procedure
Controleer de aangedane klierstation(s) van patiënten met een positieve schildwachtklier periodiek met echografie volgens onderstaand schema:
- Elke vier maanden in de eerste twee jaar.
- Elke zes maanden in jaar 3 tot 5 jaar.
- Vanaf 5 jaar jaarlijks tot 10 jaar na vaststellen ziekte.
Conform Faries (2017).
Verricht geen onmiddellijke completerende (aanvullende) lymfeklierdissectie bij patiënten met een positieve schildwachtklier.
Verricht een therapeutische klierdissectie bij een radiologisch (echografisch, CT, PET/CT en/of MRI) of palpabel (macroscopisch) recidief.
Overwegingen
Het is aangetoond dat patiënten met metastasen in de schildwachtklier(en) een slechtere prognose hebben dan patiënten bij wie geen metastasen worden aangetroffen. De schildwachtklierprocedure is zeer geschikt voor patiënten die zo goed mogelijk geïnformeerd willen zijn over hun prognose en dit leidt tot een juiste AJCC stadiëring. Het verrichten van een schildwachtklierprocedure is een stadiërende en geen therapeutische ingreep. Het belang van de schildwachtklierprocedure voor stadiëring is groot en in het huidige stadiëringssysteem is hiermee rekening gehouden (zie AJCC referentie)
(https://cancerstaging.org/references-tools/quickreferences/Documents/MelanomaSmall.pdf)
De ziektevrije 5-jaars overleving werd in de MSLT gedefinieerd als overleving zonder recidief, op welke plaats dan ook. Gespecificeerde ziektevrije overleving toonde dat het verschil alleen zichtbaar was in het percentage regionale lymfeklier recidieven (4,9% versus 14,6%), maar dat er geen verschillen waren in lokale / in-transit recidieven (7% versus 6,4%) en afstandsmetastasen (13,9% versus 11,2%) (Morton, 2014; van Akkooi, 2014). De manier van definiëren van ziektevrije overleving is ook uitgebreid bekritiseerd in de literatuur; omdat met de interventie zelf de belangrijkste plaats van recidief verwijderd is en dit mogelijk performance bias introduceert. Een klierrecidief zou geëxcludeerd moeten worden uit de definitie van recidief of de uitkomst zou een recidief op afstand moeten zijn (Thomas, 2009).
In een subgroep analyse werd een betere 5-jaars melanoomspecifieke overleving gevonden voor patiënten met een positieve schildwachtklier, in vergelijking met patiënten die na observatie een lymfeklierrecidief kregen (72.3% (95%BI 67,7 tot 76,9%) versus 52,4% (95%BI 46,5 tot 58,3%)) (Morton, 2006). Idem voor de 10-jaars melanoomspecifieke overleving met 62,1% (+/- 4,8%) versus 41,5% (+/- 5,6%) (Morton, 2014). Dit grote verschil in overleving is onverwacht, aangezien er in de totale studiepopulatie geen verschil in overleving werd gevonden. Er zijn een aantal potentiele oorzaken die dit kunnen verklaren. Bijvoorbeeld dat de fout-negatieve patiënten in de subgroep analyse niet meegerekend zijn. Evenals dat patiënten met benigne nevi in de schildwachtklier foutief als schildwachtklier positief zijn aangemerkt. Of dat er patiënten met sub-micrometastasen (≤ 0.1mm) gevonden zijn, die nooit de potentie hadden om uit te groeien tot klinisch relevante metastasen (van Akkooi, 2014). Deze aspecten kunnen een subgroep analyse beïnvloeden, waardoor er een vertekening in overleving ten gunste van de patiënten met een positieve schildwachtklier kan ontstaan.
Vier andere studies vergeleken patiënten behandeld vóór introductie van de schildwachtklierprocedure, met patiënten die werden behandeld na de introductie van de schildwachtklierprocedure als standaardbehandeling in een bepaald instituut (Starz, 2004; Gutzmer, 2005; Koskivuo, 2007; Leiter, 2010). Eén studie vergeleek een cohort patiënten met schildwachtklierprocedure met een cohort patiënten zonder schildwachtklierprocedure, waarbij de helft van de patiënten deelnam aan de MSLT (van Poll, 2005). In drie studies werd geen verschil gevonden in melanoomspecifieke overleving (Gutzmer, 2005; Koskivuo, 2007; Leiter, 2010). Eén studie vond geen verschil in algemene overleving, wanneer werd gecorrigeerd voor geslacht, leeftijd, plaats van de tumor en dikte van de tumor (Starz, 2004). Wat betreft recidieven was er in geen van de studies een verschil tussen de behandelgroepen wat betreft lokale of in-transit recidieven, maar werden er uiteraard in alle studies vaker lymfekliermetastasen gevonden in de groep die geen schildwachtklierprocedure onderging (Gutzmer, 2005; van Poll, 2005; Koskivuo, 2007; Leiter, 2010). Drie studies vonden geen verschil in metastasen op afstand (Gutzmer, 2005; Koskivuo, 2007; Leiter 2010). Eén studie vond wel een verschil in metastasen op afstand, met minder metastasen in de schildwachtklierprocedure groep, wanneer werd gecorrigeerd voor geslacht, leeftijd, plaats van de tumor en dikte van de tumor (Starz, 2004). In deze studie was er echter een groot verschil in follow-up: een mediane follow-up van 45,5 maanden in de schildwachtklierprocedure groep versus 95 maanden in de standaard behandelde groep. Een verschil in follow-up bevoordeelde steeds de schildwachtklierprocedure groep en zou het verschil in metastasen op afstand, gevonden in deze studie, kunnen verklaren.
In verschillende studies is aangetoond dat patiënten met zeer minimale metastasering of kleine subcapsulair gelokaliseerde kleine metastasen een zeer geringe kans hebben op additionele kliermetastasen in niet-schildwachtklieren. Vooral bij patiënten met dergelijke losse tumorcellen of zeer kleine micrometastasen lijkt een aanvullende klierdissectie geen voordelen op te leveren. De overleving van dergelijke patiënten is gelijk aan patiënten met tumor-vrije schildwachtklieren in vergelijking met historische controlegroepen (van Akkooi, 2006; de Wilt, 2008; van der Ploeg, 2011). In de EORTC-1208 (Minitub) registry worden de uitkomsten van patiënten met dergelijke minimale schildwachtklier uitzaaiingen geregistreerd. Het zal nog een aantal jaren duren voordat duidelijk wordt wat het lokaal recidief percentage is in deze groep patiënten.
De studies van Faries (2017) als Leiter (2016) zijn beiden van hoge kwaliteit en presententeren vergelijkbare resultaten. Hierdoor is het zeer aannemelijk dat de resultaten betrouwbaar zijn. Hoewel er nog geen 5- en 10-jaars resultaten bekend zijn, geven beide studies geen enkel teken van een mogelijk therapeutisch voordeel van onmiddellijke completerende (aanvullende) klierdissecties. Mogelijk is er wel een bias in beide publicaties naar kleinere metastasen in de schildwachtklieren. Echter, uit Faries (2017) lijken juist de patiënten met grotere metastasen in de schildwachtklieren juist geen baat te hebben bij onmiddellijke completerende (aanvullende) lymfeklierdissecties.
Morbiditeit van onmiddellijke completerende (aanvullende) lymfeklierdissecties kan aanzienlijk zijn (Reintgen, 1994; Hughes, 2000; McMasters, 2002; Carlson, 2003; Staritt, 2004; de Vries, 2006; Van Akkooi, 2006; Morton, 2006; Van Akkooi, 2007; Bilimoria, 2008; Torjesen, 2013; Thomas, 2013). Hoewel een onmiddellijke completerende (aanvullende) klierdissectie mogelijk additionele informatie geeft over het ziektestadium, weegt dit niet op tegen de morbiditeit van de procedure. De MSLT-2 studie toont aan dat 24,1% van de patiënten in de klierdissectie groep lymfoedeem had terwijl dit maar 6,3% van de patiënten voorkwam in de nodale observatiegroep (p<0,001) (Faries, 2017). Ook het feit dat een onmiddellijke completerende (aanvullende) klierdissectie minder regionale recidieven geeft, weegt niet op tegen de potentiele morbiditeit.
Periodieke controles van de aangedane klierstation(s) middels echografie zijn wenselijk bij patiënten met een positieve schildwachtklierprocedure. In de studie van Faries (2017) werden patiënten in de nodale observatie groep gemonitord middels het volgende schema: klinisch onderzoek vond elke vier maanden plaats in de eerste twee jaar na het vaststellen van de diagnose, elke zes maanden tussen het derde en het vijfde jaar en daarna jaarlijks.
Ondanks het ontbreken van een therapeutisch effect van de schildwachtklier procedure en/of onmiddellijke completerende (aanvullende) lymfeklierdissectie, is wel gebleken dat het vooralsnog de beste methode is om de prognose van stadium I/II melanoom patiënten te bepalen. Hiermee worden patiënten potentieel als stadium III herkend. De schildwachtklierprocedure is gebruikt voor het selecteren van patiënten voor adjuvante therapie studies. Nu deze adjuvante therapie ook een aangetoond effect op de ziektevrije overleving heeft, is het verrichten van een schildwachtklierprocedure van belang om patiënten optimaal te stadiëren en te informeren of de prognose, alsmede te bepalen of zij in aanmerking komen voor adjuvante therapie. Indien patiënten geen informatie wensen of de prognose of, vanwege bijvoorbeeld comorbiditeit, niet in aanmerking komen voor adjuvante therapie, kan hiervan worden afgezien.
Onderbouwing
Achtergrond
Het concept van de sequentiële progressie van metastasen in het lymfekliersysteem is voor melanoom aangetoond (Reintgen, 1994). Kennis van de tumorstatus van dit systeem wordt bereikt door met een minimaal invasieve chirurgische ingreep de lymfeklier (sentinel node, schildwachtklier, eerste-echelonklier, poortwachterklier, voorstopperklier) te verwijderen. Metastasen kunnen zo worden aangetoond voordat de klier palpabel wordt. Op deze basis kan belangrijke prognostische informatie worden verkregen. Echter, er bestaat ook een concept dat er onafhankelijk hematogene metastasering optreedt, waarbij de schildwachtklier een indicator of biomarker is voor de kans op het ontwikkelen van systemische (non-lymfogene) viscerale micrometastasen (Van Akkooi, 2010; Van Akkooi, 2014). In de praktijk wordt de eerste klier die zichtbaar wordt op het scintigram als schildwachtklier beschouwd, evenals klieren waarnaartoe rechtstreeks een lymfebaan vanuit de injectieplaats zichtbaar is. Er kunnen meerdere schildwachtklieren in verschillende lymfeklierregio's worden gevonden.
Tot recent was het algemeen geaccepteerde beleid om bij patiënten die een schildwachtklierprocedure hebben ondergaan en waarbij de schildwachtklier positief is (bij hematoxyline-eosine kleuring of immuunhistochemie) een onmiddellijke completerende (aanvullende) lymfeklierdissectie uit te voeren. De reden voor deze lymfeklierdissectie was het feit dat bij grofweg 15 tot 20% van de patiënten aanvullende lymfekliermetastasen gevonden werden. Bij 80 tot 85% van de patiënten worden er dus geen aanvullende metastasen gevonden. Deze patiënten ondergaan een chirurgische procedure waarvan zij geen voordeel ondervinden, maar wel de potentiele nadelen. (Reintgen, 1994; Hughes 2000; McMasters, 2002; Carlson, 2003; Staritt, 2004; de Vries, 2006; Van Akkooi, 2006; Morton 2006; Van Akkooi, 2007; Bilimoria, 2008; Torjesen, 2013; Thomas, 2013). Bovengenoemd beleid resulteerde wel in een verlengde ziektevrije overleving, maar er werd geen overlevingswinst aangetoond voor completerende lymfeklierdissecties. (Reintgen, 1994; Hughes 2000; McMasters, 2002; Carlson 2003; Staritt, 2004; de Vries, 2006; Van Akkooi, 2006; Morton 2006; Van Akkooi, 2007; Bilimoria, 2008; Torjesen, 2013; Thomas, 2013) Recentelijk zijn er twee grote gerandomiseerde trials (Faries, 2017 (MSLT-II studie); Leiter, 2016 (DeCOG-SLT studie)) verschenen die de waarde van de aanvullende lymfeklierdissectie onderzoeken. Met de kennis van deze trials is het noodzaak om de richtlijn op dit punt te herzien.
Conclusies / Summary of Findings
1. Re-excisie plus schildwachtklierprocedure versus re-excisie alleen
|
Geen GRADE |
Het is aangetoond dat patiënten met metastasen in de schildwachtklier(en) een slechtere prognose hebben dan patiënten bij wie geen metastasen worden aangetroffen.
Bronnen (Gershenwald, 1999; van Akkooi, 2006; Nowecki, 2006; Cascinelli, 2006; Morton, 2006; van der Ploeg, 2010) |
|
Redelijk GRADE |
Het uitvoeren van re-excisie plus schildwachtklierprocedure leidt tot een vergelijkbare 5-jaars melanoomspecifieke overleving ten opzichte van re-excisie alleen.[1]
Bronnen (Morton, 2006) |
|
Redelijk GRADE |
Het uitvoeren van re-excisie plus schildwachtklierprocedure leidt tot een vergelijkbare 10-jaars melanoomspecifieke overleving ten opzichte van re-excisie alleen.6
Bronnen (Morton, 2014) |
2. Lymfeklierdissectie versus nodale observatie bij positieve schildwachtklier-procedure
|
Hoog GRADE |
Nodale observatie na een positieve schildwachtklierprocedure leidt tot een vergelijkbare 3-jaars melanoom-vrije overleving ten opzichte van onmiddellijke completerende (aanvullende) lymfeklierdissectie.
Bronnen (Faries, 2017; Leiter, 2016) |
|
Redelijk GRADE |
Nodale observatie na een positieve schildwachtklierprocedure leidt tot een vergelijkbare 3-jaars afstandmetastase-vrije overleving ten opzichte van onmiddellijke completerende (aanvullende) lymfeklierdissectie.
Bronnen (Leiter, 2016) |
|
Redelijk GRADE |
Nodale observatie na een positieve schildwachtklierprocedure leidt tot een vergelijkbare 3-jaars ziektevrije overleving ten opzichte van onmiddellijke completerende (aanvullende) lymfeklierdissectie.
Bronnen (Leiter, 2016) |
[1] Conclusie gebaseerd op data verzameld voor de invoering van effectieve systemische therapie.
Samenvatting literatuur
1. Re-excisie plus schildwachtklierprocedure versus re-excisie alleen
De schildwachtklierprocedure vergroot de nauwkeurigheid van stadiëren (Essner, 1999; Dessureault, 2001). Recentere onderzoeken hebben duidelijk gemaakt dat de tumorstatus van de schildwachtklier een belangrijke prognostische factor is bij patiënten met melanoom die zich presenteren zonder klinisch evidente metastasen (Gershenwald, 1999; Morton, 2006; Vuylsteke, 2003; Estourgie, 2003; Nowecki, 2006; Cascinelli, 2006; van Akkooi, 2006; Wagner, 2000; van der Ploeg, 2010; Speijers, 2015). Nederlandse onderzoeken, uitgevoerd voor de invoering van effectieve systemische therapie (adjuvant en palliatief), wezen uit dat de overleving na vijf jaar ongeveer 90% bedraagt indien de schildwachtklier tumorvrij is en ongeveer 65% indien er sprake is van metastasering (Vuylsteke, 2003; Estourgie, 2003; van Akkooi, 2006; van der Ploeg, 2010).
Er wordt aangenomen dat door middel van de schildwachtklierprocedure vroeg behandelde micrometastasen een potentiele overlevingswinst kunnen geven in vergelijking met het verrichten van een lymfeklierdissectie na nodale observatie. In de Multicenter Selective Lymphadenectomy Trial I (MSLT-I) is getracht om hier antwoord op te geven (Morton, 2006). Morton (2006) beschrijft een RCT waarin ruime excisie alleen werd vergeleken met ruime excisie in combinatie met een schildwachtklierprocedure. Deze schildwachtklierprocedure werd direct gevolgd door een lymfeklierdissectie als micrometastasering werd aangetroffen, terwijl in de observatiearm een lymfeklierdissectie werd verricht als zich een regionaal lymfeklierrecidief voordeed. Patiënten met een melanoom dikker dan 1 mm werden geïncludeerd in deze studie. In totaal werden 1269 patiënten beschreven met een primair melanoom van 1,2 tot 3,5 mm. De primaire uitkomstmaten van de MLST-I waren de melanoomspecifieke 5- en 10-jaars overleving. Secundaire uitkomstmaten waren de ziektevrije 5- en 10-jaars overleving; gedefinieerd als overleving zonder recidief (op welke plaats dan ook).
2. Lymfeklierdissectie versus nodale observatie bij positieve schildwachtklier-procedure
De literatuur zoekactie levert twee relevante RCT’s op naar de meerwaarde van lymfeklierdissectie in de behandeling van patiënten met een nieuw gediagnosticeerd melanoom en positieve schilklierwachtprocedure. (Faries, 2017; Leiter, 2016). Het betreffen fase 3 klinische trials met een hoge kwaliteit (laag risico op bias). Beide studies hanteerden stringente inclusiecriteria en includeerden patiënten met een positieve schildwachtklier. Patiënten werden gerandomiseerd verdeeld. Patiënten in de interventiegroep werden behandeld met een completerende lymfeklierdissectie en patiënten in de controlegroep werden geobserveerd met echografie van het lymfeklierstation. Gezien de aard van de interventie (completerende klierdissectie of observatie) is het niet mogelijk om de interventie te blinderen. Omdat de controle interventie verschilt tussen beide studies en verschillende analyses worden uitgevoerd, is het niet mogelijk om de resultaten van beide studies te poolen. De studies worden hieronder afzonderlijk beschreven.
Faries (2017) verrichtte een onderzoek naar de effecten van completerende lymfeklierdissectie bij patiënten na een positieve schildwachtklierprocedure (MSLT-II). Patiënten die in aanmerking kwamen voor deelname hadden een leeftijd van 18 tot 75 jaar, een gelokaliseerd cutaan melanoom, een Eastern Cooperative Oncology Group performance status van 0 of 1 (aangeven op een 5-puntsschaal met 0 als geen disability en 5 als zeer ernstige disability), een non-melanoom levensverwachting van ≥ 10 jaar en een positieve schildwachtklier. Er werd een blokrandomisatie aangehouden met stratificatie voor breslowdikte, ulceratie, methode van metastasedetectie en onderzoekscentrum. Patiënten in de interventiegroep werden behandeld met een completerende lymfeklierdissectie en patiënten in de controlegroep werden geobserveerd met echografie van het lymfeklierstation. Patiënten die waren toegewezen aan de observatiegroep werden gecontroleerd door middel van klinisch onderzoek en echografie van het lymfeklierstation elke 4 maanden tijdens de eerste 2 jaar, elke 6 maanden gedurende de jaren 3 tot en met 5 en daarna jaarlijks. Patiënten in de interventiegroep hadden hetzelfde follow-up schema maar werden niet beoordeeld met echografie. Het onderzoek van Faries (2017) heeft een behoorlijke omvang, met 971 patiënten gerandomiseerd in de experimentele groep (lymfeklierdissectie) en 968 patiënten in de controlegroep (observatie). De studie is van redelijke kwaliteit (zie risk of bias tabel). De primaire uitkomstmaat in de studie van Faries (2017) is melanoomspecifieke overleving. Secundaire uitkomstmaten waren algehele overleving, ziektevrije overleving, overleving zonder terugkeer van regionale kliermetastasen en afstandmetastase-vrije overleving. Aanvangstijd van de studie was het moment van randomisatie. Melanoomspecifieke overleving was gedefinieerd als tijd tot melanoomgerelateerd overlijden. Ziektevrije overleving was de tijd tot het moment van terugkeer van de ziekte. Overleving zonder klierrecidief was de tijd tot recidief binnen het gedraineerde klierstation.
De studie van Leiter (2016) onderzoekt de waarde van completerende klierdissectie in de behandeling van patiënten na een positieve schildwachtklierprocedure (DeCOG-SLT). Leiter (2016) beschrijft een gerandomiseerde fase III klinische trial waarin de overleving wordt onderzocht bij patiënten die wel of geen completerende lymfeklierdissectie hebben gehad na een positieve schildwachtklierprocedure. Patiënten die in aanmerking kwamen voor deelname hadden een leeftijd van 18 tot 75 jaar, een tumordikte van tenminste 1 mm met micrometastasen in de schildwachtklier (tenminste single-cells of grotere micrometastasen). Patiënten met een melanoom in het hoofd-halsgebied, satellietose, in-transit, of afstandmetastasen, of met betrokkenheid van de volledige lymfeklier met capsulaire perforatie (regionale macrometastasen) werden uitgesloten. Het randomisatieschema is opgemaakt door een computer en er werd gestratificeerd voor de dikte van de tumor (≤ 2 mm versus > 2 mm), ulceratie van de primaire tumor en beoogde adjuvante interferontherapie. De studie heeft een behoorlijke omvang, met 242 patiënten in de experimentele (lymfeklierdissectie) en 241 in de controlegroep (observatie). Deze RCT is van overwegend redelijke kwaliteit (zie risk of bias tabel). De primaire uitkomstmaat was afstandmetastase-vrije overleving (gedefinieerd als tijd vanaf het moment van randomisatie tot het moment van diagnose van eerste afstandmetastase). Secundaire uitkomstmaten waren ziektevrije overleving (gedefinieerd als tijd vanaf het moment van randomisatie tot het moment van terugkeer van de ziekte), algehele overleving (gedefinieerd als tijd vanaf het moment van randomisatie tot het moment van overlijden), terugkeer van regionale lymfekliermetastasen, en complicaties door complete lymfeklierdissectie in de experimentele groep.
Resultaten
1. Re-excisie plus schildwachtklierprocedure versus re-excisie alleen
1.1 Melanoomspecifieke overleving (5 jaar)
De melanoomspecifieke overleving was op 5 jaar 87% (SD= 1,3; 95%BI= (85,8 tot 88,4) in de groep re-excisie plus schildwachtklierprocedure en 87% (SD= 1,2; 95%BI= (85,0 tot 88,2) in de groep met alleen re-excisie. Er was geen statistisch significant verschil in 5-jaars melanoomvrije overleving tussen beide groepen (HR= 0,95; 95%BI= (0,67 tot 1,25); p= 0,58) (Morton, 2006).
1.2 Melanoomspecifieke overleving (10 jaar)
De melanoomspecifieke overleving was op 10 jaar 81% (SD= 1,5) in de groep re-excisie plus schildwachtklierprocedure en 78% (SD= 2,0) in de groep met alleen re-excisie. Er was geen statistisch significant verschil in 10-jaars melanoomspecifieke overleving tussen beide groepen (HR= 0,84; 95%BI= (0,64 tot 1,09); p= 0,18) (Morton, 2014).
1.3 Ziektevrije overleving (5 jaar)
De ziektevrije overleving, gedefinieerd als overleving zonder recidief, was op 5 jaar 78% (SD= 1,6; 95%BI= (76,7 tot 79,9) in de groep re-excisie plus schildwachtklier-procedure en 73% (SD= 2,1; 95%BI= (71,0 tot 75,2) in de groep met alleen re-excisie. Er was een statistisch significant voordeel in 5-jaars ziektevrije overleving voor de groep re-excisie plus schildwachtklierprocedure in vergelijking met de controlegroep (HR= 0,74; 95%BI= (0,59 tot 0,93); p= 0,009) (Morton, 2006).
1.4 Ziektevrije overleving (10 jaar)
De ziektevrije overleving, gedefinieerd als overleving zonder recidief, was op 10 jaar 71% (SD= 1,8) in de groep met schildwachtklierprocedure en 65% (SD= 2,3) in de observatiegroep. Er was een statistisch significant voordeel in 10-jaars ziektevrije overleving voor de groep re-excisie plus schildwachtklierprocedure in vergelijking met de controlegroep (HR= 0,76; 95%BI= (0,62 tot 0,94); p= 0,01) (Morton, 2014).
Bewijskracht van de literatuur
De bewijskracht (GRADE-methodiek) is bepaald per uitkomstmaat en in onderstaande tabel schematisch weergegeven.
Tabel 1. Gradering van bewijskracht per uitkomstmaat (GRADE-pro).
Vraagstelling: Schildwachtklierprocedure + re-excisie compared to re-excisie alleen in patienten met een nieuw gediagnosticeerd melanoom
Literatuur: Morton (2006) en Morton (2014)
|
Certainty assessment |
Aantal patiënten |
Effect |
Certainty |
Importantie |
||||||||
|
Aantal studies |
Studieopzet |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Andere factoren |
schildwachtklierprocedure + re-excisie |
re-excisie alleen |
Relatief |
Absoluut |
||
|
Melanoom-specifieke overleving op 5 jaar |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
ernstig a |
niet gevonden |
96/769 (12.5%) |
69/500 (13.8%) |
HR 0.95 |
6 recidieven minder per 1.000 behandelde patiënten |
⨁⨁⨁◯ |
CRUCIAAL |
|
Melanoom-specifieke overleving op 10 jaar |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
ernstig a |
niet gevonden |
125/770 (16.2%) |
97/500 (19.4%) |
HR 0.84 |
28 recidieven minder per 1.000 behandelde patiënten |
⨁⨁⨁◯ |
CRUCIAAL |
|
Ziektevrije overleving op 5 jaar |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
ernstig a |
niet gevonden |
159/769 (20.7%) |
134/500 (26.8%) |
HR 0.74 |
62 recidieven minder per 1.000 behandelde patiënten |
⨁⨁⨁◯ |
CRUCIAAL |
|
Ziektevrije overleving op 10 jaar |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
ernstig a |
niet gevonden |
199/770 (25.8%) |
161/500 (32.2%) |
HR 0.76 |
66 recidieven minder per 1.000 behandelde patienten |
⨁⨁⨁◯ |
CRUCIAAL |
CI: Confidence interval; HR: Hazard Ratio
Explanations a. 95%BI overschrijdt default grens voor klinische relevantie (/ studie voldoet niet aan optimal information size).
2. Lymfeklierdissectie versus nodale observatie bij positieve schildwachtklier-procedure
2.1 Melanoomspecifieke overleving (3 jaar)
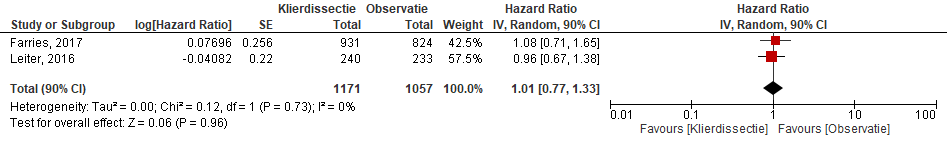
De melanoomspecifieke overleving op 3 jaar was 86% (SD 1,3) in de lymfeklierdissectie groep en 86% (SD 1,2) in de observatie groep. Er is geen statistisch significant verschil in 3-jaars melanoomspecifieke overleving tussen de observatiegroep en de complete lymfeklierdissectie groep (HR= 1,08; 95%BI= (0,88 tot 1,34); p= 0,42) (Farries, 2017). In de studie van Leiter (2016) was de melanoomspecifieke overleving na 3 jaar 81,2% (n= 40 events; 90%BI= (76,1 tot 86,3)) in de lymfeklierdissectie groep en 81,7% (n= 44 events; 90%BI= (76,8 tot 86,6)) in de observatie groep. Ook in deze studie was er geen statistisch significant verschil in melanoomspecifieke overleving na drie jaar tussen de observatie groep en de complete lymfeklierdissectie groep (HR= 0,96; 90%BI= (0,67 tot 1,38); p= 0,87). De gepoolde HR voor totale 3-jaars melanoomspecifieke overleving laat geen statistisch significant verschil zien tussen beide groepen (HR=1,01; 95%BI= (0,77 tot 1,33); p=0,96) (Figuur 1).
Figuur 1. Gepoolde Hazard Ratio (HR) voor melanoomspecifieke overleving na 3-jaar tussen de klierdissectie-groep en observatiegroep.
2.2 Afstandmetastase-vrije overleving (3 jaar)
De intention-to-treat analyse van Leiter (2016) laat zien dat de 3-jaars afstandmetastase-vrije overleving 77,0% (n= 55 events; 90%BI= (71,9 tot 82,1)) is in de patiënten die zijn geobserveerd en 74,9% (n= 54 events; 90%BI= (69,5 tot 80,3)) in de patiënten met een complete lymfeklierdissectie. Er is geen statistisch significant verschil in 3-jaars afstandmetastase-vrije overleving tussen de observatie groep en de complete lymfeklierdissectie groep (HR= 1,03; 90%BI= (0,71 tot 1,50); p= 0,87). De per-protocol analyse liet dezelfde resultaten zien; afstandmetastase-vrije overleving was 78% in de observationele groep (90%BI= (68,8 tot 81,4)) en 75% (90%BI= (68,8 tot 81,1)) in de complete lymfeklierdissectie groep, statistisch geen significant verschil tussen beide groepen (HR= 1,02; 90%BI= (0,72 tot 1,45); p= 0,92).
2.3 Ziektevrije overleving (3 jaar)
De 3-jaar ziektevrije overleving was 67,4% (n= 73 events; 90%BI= (61,6 tot 73,2)) in de observatie groep en 66,8% (n= 67 events; 90%BI= (60,9 tot 72,2)) in de complete lymfeklierdissectie groep. Er is geen statistisch significant verschil in 3-jaars ziektevrije overleving tussen de observatie groep en de complete lymfeklierdissectie groep (HR= 0,95; 90%BI= (0,72 tot 1,25); p= 0,75).
Bewijskracht van de literatuur
De bewijskracht (GRADE-methodiek) is bepaald per uitkomstmaat en in onderstaande tabel schematisch weergegeven.
Tabel 2. Gradering van bewijskracht per uitkomstmaat: complete lymfeklierdissectie versus nodale observatie (GRADE-pro).
Vraagstelling: Complete lymph-node dissection compared to observation in the treatment of patients with sentinel-node positive metastases
Literatuur: Faries (2017); Leiter (2016)
|
Certainty assessment |
Aantal patiënten |
Effect |
Certainty |
Importantie |
||||||||
|
Aantal studies |
Studieopzet |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Andere factoren |
complete lymph-node dissection |
observation |
Relatief |
Absoluut |
||
|
Melanoma-specific free survival (follow up: 3 jaar) |
||||||||||||
|
2 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
niet ernstig a |
niet gevonden |
203/1211 (16.8%) |
209/1201 (17.4%) |
HR 1.01 |
2 recidieven minder per 1.000 behandelde patiënten |
⨁⨁⨁⨁ |
CRUCIAAL |
|
Distant-metastasis free survival (follow up: 3 jaar) |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
ernstig a |
niet gevonden |
54/241 (22.4%) |
55/241 (22.8%) |
HR 1.03 |
6 minder events met afstandsmetastasen per 1.000 behandelde patiënten |
⨁⨁⨁◯ |
BELANGRIJK |
|
Overall survival (follow up: 3 jaar) |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
ernstig a |
niet gevonden |
40/242 (16.5%) |
44/241 (18.3%) |
HR 0.96 |
7 meer overlevenden per 1.000 behandelde patiënten |
⨁⨁⨁◯ |
BELANGRIJK |
|
Recurrence free survival (follow up: 3 jaar) |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
ernstig a |
niet gevonden |
67/242 (27.7%) |
73/241 (30.3%) |
HR 0.95 |
13 recidieven minder per 1.000 behandelde patiënten |
⨁⨁⨁◯ |
BELANGRIJK |
CI: Confidence interval; HR: Hazard Ratio Explanations a. 95%BI overschrijdt default grens voor klinische relevantie (/ studie voldoet niet aan optimal information size).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
- Wat is het effect op de overleving van het wel of niet uitvoeren van de schildwachtklierprocedure bij patiënten met een nieuw gediagnosticeerd melanoom?
- Wat is het effect op de overleving van een onmiddellijke completerende (aanvullende) lymfeklierdissectie in vergelijking met ‘nodale observatie’ bij patiënten met een nieuw gediagnosticeerd melanoom en een positieve schildwachtklierprocedure ?
PICO 1 (klinisch relevante vergelijking)
(P)atiënten: volwassen patiënten (≥18 jaar) met een nieuw gediagnosticeerd melanoom (dun, gemiddeld en/of dik);
(I)nterventie: re-excisie met schildwachtklierprocedure;
(C)omparison: re-excisie zonder schildwachtklierprocedure;
(O)utcome: melanoomspecifieke overleving, ziektevrije overleving, locoregionale overleving, kosten, gezondheid gerelateerde kwaliteit van leven en complicaties.
PICO 2 (klinisch relevante vergelijking)
(P)atiënten: volwassen patiënten (≥18 jaar) met een nieuw gediagnosticeerd melanoom (dun, gemiddeld en/of dik) en een positieve schildwachtklierprocedure;
(I)nterventie: onmiddellijke completerende (aanvullende) lymfeklierdissectie;
(C)omparison: nodale observatie met periodieke echografische controles van het
aangedane lymfklierbassin;
(O)utcome: melanoom specifieke overleving, algehele overleving, ziektevrije overleving, locoregionale overleving, kosten, gezondheid gerelateerde kwaliteit van leven en complicaties.
Relevante uitkomstmaten
De werkgroep achtte algehele en melanoomspecifieke overleving voor de besluitvorming de meest cruciale uitkomstmaten; en ziektevrije overleving, gezondheid gerelateerde kwaliteit van leven en complicaties voor de besluitvorming belangrijke uitkomstmaten. Om de minimale klinisch relevante verschillen te duiden zijn de default grenzen van GRADE gebruikt: voor dichotome uitkomstmaten werd een afkapwaarde van 25% aangehouden (HR= 0,75; HR= 1,25).
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 20 juli 2018 met relevante zoektermen gezocht naar studies over de effecten van lymfeklierdissectie bij patiënten met een positieve schildwachtklierprocedure. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 350 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: gerandomiseerd onderzoek, primair vergelijkend onderzoek, lymfeklierdissectie, en patiënten met een positieve schildwachtklierprocedure. Op basis van titel en abstract werden in eerste instantie twee studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens geen studies geëxcludeerd, en twee studies definitief geselecteerd. Deze studies zijn toegevoegd aan de reeds bestaande literatuursamenvatting welke is gebaseerd op de publicaties van Morton (2006) en Morton (2014).
In totaal zijn vier publicaties opgenomen in de literatuuranalyse (Faries, 2017; Leiter, 2016; Morton, 2006; Morton, 2014). De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- 1 - Faries MB, Thompson JF, Cochran AJ, Andtbacka RH, Mozzillo N, Zager JS, Jahkola T, Bowles TL, Testori A, Beitsch PD, Hoekstra HJ, Moncrieff M, Ingvar C, Wouters MWJM, Sabel MS, Levine EA, Agnese D, Henderson M, Dummer R, Rossi CR, Neves RI, Trocha SD, Wright F, Byrd DR, Matter M, Hsueh E, MacKenzie-Ross A, Johnson DB, Terheyden P, Berger AC, Huston TL, Wayne JD, Smithers BM, Neuman HB, Schneebaum S, Gershenwald JE, Ariyan CE, Desai DC, Jacobs L, McMasters KM, Gesierich A, Hersey P, Bines SD, Kane JM, Barth RJ, McKinnon G, Farma JM, Schultz E, Vidal-Sicart S, Hoefer RA, Lewis JM, Scheri R, Kelley MC, Nieweg OE, Noyes RD, Hoon DSB, Wang HJ, Elashoff DA, Elashoff RM. Completion Dissection or Observation for Sentinel-Node Metastasis in Melanoma. N Engl J Med. 2017 Jun 8;376(23):2211-2222. doi: 10.1056/NEJMoa1613210. PubMed PMID: 28591523; PubMed Central PMCID: PMC5548388.
- 2 - Leiter U, Stadler R, Mauch C, Hohenberger W, Brockmeyer N, Berking C, Sunderkötter C, Kaatz M, Schulte KW, Lehmann P, Vogt T, Ulrich J, Herbst R, Gehring W, Simon JC, Keim U, Martus P, Garbe C; German Dermatologic Cooperative Oncology Group (DeCOG). Complete lymph node dissection versus no dissection in patients with sentinel lymph node biopsy positive melanoma (DeCOG-SLT): a multicentre, randomised, phase 3 trial. Lancet Oncol. 2016 Jun;17(6):757-767. doi: 10.1016/S1470-2045(16)00141-8. Epub 2016 May 5. PubMed PMID: 27161539.
- 3 - Morton DL, Thompson JF, Cochran AJ, Mozzillo N, Elashoff R, Essner R, Nieweg OE, Roses DF, Hoekstra HJ, Karakousis CP, Reintgen DS, Coventry BJ, Glass EC, Wang HJ; MSLT Group. Sentinel-node biopsy or nodal observation in melanoma. N Engl J Med. 2006 Sep 28;355(13):1307-17. Erratum in: N Engl J Med. 2006 Nov 2;355(18):1944. PubMed PMID: 17005948.
- 4 - Morton DL, Thompson JF, Cochran AJ, Mozzillo N, Nieweg OE, Roses DF, Hoekstra HJ, Karakousis CP, Puleo CA, Coventry BJ, Kashani-Sabet M, Smithers BM, Paul E, Kraybill WG, McKinnon JG, Wang HJ, Elashoff R, Faries MB; MSLT Group. Final trial report of sentinel-node biopsy versus nodal observation in melanoma. N Engl J Med. 2014 Feb 13;370(7):599-609. doi: 10.1056/NEJMoa1310460. PubMed PMID: 24521106; PubMed Central PMCID: PMC4058881.
Evidence tabellen
2019
Risk of bias table for intervention studies (randomized controlled trials)
Research question: Schildwachtklierprocedure
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Faries, 2017 |
Randomization was performed in a 1:1 ratio with the use of a permuted-block design, which was stratified according to Breslow thickness, ulceration, method of metastasis detection (standard pathological assessment or RT-PCR assay), and enrollment at an MSLT-I center. |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikey |
Unlikely |
|
Leiter, 2016 |
Randomisation was done centrally by the data management centre of the Central Malignant Melanoma Registry (Tuebingen, Germany) with a randomisation schedule created by the Datinf Biostatistical Company (Tuebingen, Germany), which assigned patients by computer-based randomisation in a 1:1 ratio to either the complete lymph node dissection group or the observation group. |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
|
Geen studies geëxcludeerd naar aanleiding van TiAb-selectie |
2016
Randomized controlled trial
|
I Study ID |
II Method |
III Patient characteristics |
IV Intervention(s) |
V Results |
VII Critical appraisal of study quality |
|
Multicenter Selective Lymphadenectomy Trial (MSLT-1) Morton et al, 2005, 2006, 2014 [1-3]
|
|
|
Wide excision and SNB with immediate lymphadenectomy if nodal micrometastases were detected on biopsy n=533 intermediate; n=186 thick
vs.
wide excision and postoperative observation of regional lymph nodes with lymphadenectomy if nodal relapse occurred n=814 intermediate; n=128 thick
|
Intermediate Thickness 1.20 mm-3.50 mm Overall survival (Melanoma-specific survival) : HR for death from melanoma in biopsy group 0.84 (95% CI 0.64-1.09) p=0.18
5 year overall survival 86.6% ± 1.3% vs. 85.7% ± 1.6%
10 year overall survival 81.4% ± 1.5% vs 78.3% ± 2.0%
Locoregional recurrence free survival Not reported
Thick >3.50 mm Overall survival (Melanoma-specific survival) : HR for death from melanoma in biopsy group 1.12 (95% CI 0.76-1.67) p=0.56
5 year overall survival 67.0% ± 3.7% vs.67.5% ± 4.5%
10 year overall survival 58.9% ± 4.1% vs 64.4% ± 4.6%
Locoregional recurrence free survival Not reported |
Risk of bias
|
Observationele studies
|
I Study ID |
II Method |
III Patient characteristics |
IV Intervention(s) |
V Results |
VII Critical appraisal of study quality |
|
Satzer et al, 2011; Gutzmer et al, 2005 [4,5] |
|
|
Wide excision and SNB with completion lymphadenectomy if nodal micrometastases were detected n=296
vs.
wide excision and postoperative observation of regional lymph nodes with lymphadenectomy if nodal relapse occurred n=377
|
Thickness > 1mm Overall survival: Prolonged survival for SNB group: p=0.049
5 year overall survival control: 84.8% vs SNB: 80.3% (no p values reported)
10 year overall survival Not reported
Locoregional recurrence free survival Locoregional cutaneous metastases p=0.19 |
|
|
Koskivuo et al, 2007 [6] |
|
|
Wide excision and SNB with immediate lymphadenectomy if nodal micrometastases were detected on biopsy n=141(≤1mm);n=159(>1mm))
vs.
wide excision and postoperative observation of regional lymph nodes with lymphadenectomy if nodal relapse occurred n=292(≤1mm); n=324(>1mm) |
thickness ≤1 mm Overall survival (Melanoma-specific survival) : Log rank test p=0.51
5 year overall survival Not reported
10 year overall survival Not reported
Locoregional recurrence free survival Not reported
Thickness >1 mm Overall survival (Melanoma-specific survival) : Log rank test p=0.46
5 year overall survival Not reported
10 year overall survival Not reported
Locoregional recurrence free survival Not reported |
|
|
Leiter et al, 2010 [7] |
|
|
SNB procedure and completion lymph node dissection if SNB was positive (n=439)
vs.
no SNB procedure (n=440) |
Thickness> 1mm
Overall survival (Melanoma-specific survival) : Cox proportional hazard analysis - adjusted for age, gender, body site, tumor thickness, level of invasion, and histological subtype - for risk of overall death from melanoma: 0.74 (95%CI: 0.52–1.05); p=0.09
5 year overall survival SNB: 85.58% (95%CI: 81.8-89.2%) vs. control 81.5% (95%CI: 77.6-85.4%); p=0.28
10 year overall survival Not reported
Locoregional recurrence free survival Satellite/in-transit disease-free survival: SNB: 90.8% (95%CI: 87.9–93.7%) vs. control 89.9% (95%CI: 86.8–93.0%); p=0.66
|
|
|
Starz et al, 2004 [8] |
|
|
SNB procedure and completion lymph node dissection if SNB was positive (n=324)
Vs
no SNB procedure (n=274) |
Thickness> 0.75mm Overall survival (Melanoma-specific survival) (survival until death from melanoma):
Multivariable Cox regression analysis – adjusted for gender, age, tumor site and tumor thickness- RR: 0.65 (95% CI: 0.42-0.998); p=0.049
5 year overall survival Not reported
10 year overall survival Not reported
Locoregional recurrence free survival Not reported
|
|
|
Van Poll et al, 2005 [9] |
|
|
SNB procedure and completion lymph node dissection if SNB was positive (n=754)
vs.
no SNB procedure (n=1035) |
Thickness>1 mm
Overall survival (Melanoma-specific survival) : Not reported
5 year overall survival Not reported
10 year overall survival Not reported
Locoregional recurrence free survival In-transit recurrence: 3.6% vs. 4.9% (non-significant) In-transit recurrence as a first recurrence: 2.4% vs. 2.5% (non-significant)
|
|
|
Calista et al, 2013 [10] |
|
|
SLN biopsy followed by wide surgical excision of the primary CM (SNB group) (n=529)
Vs
Conventional surgery (control group) n=224 |
Thickness>0.75mm Overall survival (Melanoma-specific survival) : HR= 0.93 (95% CI 0.65-1.49) p=0.92
5 year overall survival SNB: 87.9% (95%CI 84.6-90.4) vs control: 88.4% (95% CI 83.2-92.1) not statistically significantly different (p values not mentioned)
10 year overall survival SNB: 84.0% (95% CI 80.0-87.2) vs control: 83.6% (95% CI 77.6-88.2) not statistically significantly different (p values not mentioned)
Locoregional recurrence free survival Local recurrence : 7.5% vs 8,9% (no p- values mentioned) Regional recurrence: 4.7% vs 16.9% (no p values mentioned) |
|
|
Van der Ploeg et al, 2014 [11] |
|
Single primary melanoma 1.0 mm or more in thickness or when ulceration Clark level IV or V invasion or a tumor mitotic rate 1 or more per mm square was recorded
Group comparability
|
vs
|
Thickness >1.00 mm Overall survival (Melanoma-specific survival) : HR=0.82 ; not sign after adj for prognostic factors
5 year overall survival SNB: 83.6% vs control: 82.2%
10 year overall survival Not reported
Locoregional recurrence free survival Not reported
Thickness >1.00-4.00 mm Overall survival (Melanoma-specific survival) : HR=0.79; not sign after adj for prognostic factors
5 year overall survival SNB: 86.8% vs control: 85.3%
10 year overall survival Not reported
Locoregional recurrence free survival Not reported
|
|
|
Starz and Balda, 2007 [12] |
|
|
Wide Local Excision with Sentinel Lymph Node Biopsy n=87
Vs
Wide Local Excision and observation n=61 |
Thickness between 0.76-1 mm Overall survival (Melanoma-specific survival) Overall survival SLNB vs OBS p=0.995 Melanoma specific survival SLNB vs OBS p=0.03
5 year overall survival Not reported
10 year overall survival Not reported
Locoregional recurrence free survival In-transit metastases SNB 0/87 vs control 2/61 p=0.1
|
|
|
McClain et al, 2012 [13] |
|
|
Wide local excision with sentinel Lymph node biopsy (SNB) n=35
Vs
Wide local excision and observation n=31 |
Thickness<1mm Overall survival (Melanoma-specific survival) No significant difference in survival , p values not reported
5 year overall survival SNB group: 93%, SE 6% Control: 89%, SE 7%
10 year overall survival Not reported
Locoregional recurrence free survival Not reported
|
|
CoI= conflict of Interest, CM=cutaneous melanoma, SNB= sentinel node biopsy, SLN= Sentinel Lymph Node, SLNB=sentinel lymph node biopsy, SLND= sentinel lymph node dissection; SE= standard error.
Question: Should Wide excision with sentinel node biopsy vs Wide excision alone be used in newly diagnosed melanoma of the skin?
|
Quality assessment |
No of patients |
Effect |
Quality |
Importance |
||||||||||||
|
No of studies |
Design |
Risk of bias |
Inconsistency |
Indirectness |
Imprecision |
Other considerations |
Wide excision with sentinel node biopsy |
Wide excision alone |
Relative |
Absolute |
|
|||||
|
Overall survival- Thin melanoma-Obs studies |
|
|||||||||||||||
|
3 [6,8,13] |
observational studies |
very serious1,2,3 |
no serious inconsistency |
no serious indirectness |
serious4 |
none |
1:35 2:87 3:141 |
1:31 2: 61 3:292 |
1: p n.r 2: p=0.03 3: p=0.51 - |
- |
ÅOOO |
|
||||
|
- |
|
|||||||||||||||
|
5 year survival-thin melanoma – Obs studies |
|
|||||||||||||||
|
1[13] |
observational studies |
very serious1,2,3 |
no serious inconsistency |
no serious indirectness |
serious4,5 |
none |
31 |
35 |
p n.r. |
ÅOOO |
||||||
|
10 year survival Thin melanoma- Obs studies |
|
|||||||||||||||
|
0 |
No evidence available |
none |
- |
- |
- |
- |
|
|||||||||
|
- |
|
|||||||||||||||
|
Locoregional metastases- Thin melanoma- Obs studies |
|
|||||||||||||||
|
1[12] |
observational studies |
very serious1,2,3 |
no serious inconsistency |
no serious indirectness |
serious4 |
none |
87 |
61 |
P=0.1 |
- - |
ÅOOO |
|||||
|
Overall survival- Intermediate - RCT |
|
|||||||||||||||
|
1[1-3] |
randomised trials |
no serious risk of bias |
no serious inconsistency |
no serious indirectness |
serious4 |
none |
533 |
814 |
HR=0.84 P=0.18 |
- |
ÅÅÅO |
|
||||
|
- |
|
|||||||||||||||
|
5 year survival- Intermediate RCT |
|
|||||||||||||||
|
1[1-3] |
randomised trials |
no serious risk of bias |
no serious inconsistency |
no serious indirectness |
serious4 |
none |
533 |
814 |
- |
SNB=86.6±1.3 OBS=85.7±1.6 |
ÅÅÅO |
|||||
|
10 year survival-Intermediate RCT |
|
|||||||||||||||
|
1[1-3] |
randomised trials |
no serious risk of bias |
no serious inconsistency |
no serious indirectness |
serious6 |
none |
533 |
814 |
- |
SNB=81.4±1.5 OBS=78.3±2.0 |
ÅÅÅO |
|||||
|
Locoregional recurrence free survival- Intermediate RCT |
|
|||||||||||||||
|
0 |
No evidence available |
none |
- |
- |
- |
- |
|
|||||||||
|
0% |
- |
|
||||||||||||||
|
Overall survival -Intermediate Obs studies |
|
|||||||||||||||
|
6[4,6-8,10,11] |
observational studies |
very serious1,2,3 |
no serious inconsistency |
no serious indirectness |
serious4 |
none |
1:296 2:159 3:439 4:324 5:529 6:2909 |
1:377 2:324 3:440 4:274 5:224 6: 2931 |
1: p=0.049 2: p=0.51 3: p=0.09 4: p=0.049 5: p= 0.92 6: HR=0.82 p=n.r. |
- |
ÅOOO |
|
||||
|
- |
|
|||||||||||||||
|
5 year survival Intermediate Obs studies |
|
|||||||||||||||
|
4[4,7,10,11] |
observational studies |
very serious1,3 |
no serious inconsistency |
no serious indirectness |
serious6 |
none |
1:296 2:439 3: 529 4: 2909 |
1:377 2:440 3: 224 4: 2931 |
1:p= n.r. 2: p=0.28 3: p=n.r 4:p=n.r |
1: SNB=84.8% OBS=84.8% 3: SNB=87.9% OBS=88.4% 4: SNB=83.6% OBS=82.2% |
ÅOOO |
|||||
|
10 year survival Intermediate Obs studies |
|
|||||||||||||||
|
1[10] |
observational studies |
very serious1,7 |
no serious inconsistency |
no serious indirectness |
serious4 |
none |
529 |
224 |
P=n.r |
SNB: 84.0% OBS:83.6% |
ÅOOO |
|||||
|
Locoregional recurrence free survival Intermediate Obs studies |
|
|||||||||||||||
|
3[4,7,9] |
observational studies |
very serious1,,7 |
no serious inconsistency |
no serious indirectness |
serious4 |
none |
1: 296 2:439 3: 754 |
1:377 2:440 3:1035
|
1:p=0.19 2:p=0.66 3:p=n.r. |
- |
ÅOOO |
|
||||
|
- |
|
|||||||||||||||
|
Overall survival Thick melanoma RCT |
|
|||||||||||||||
|
1[1-3] |
randomised trials |
no serious risk of bias |
no serious inconsistency |
no serious indirectness |
serious4 |
none |
128 |
186 |
HR=1.12 P=0.56 |
- |
ÅÅÅO |
|
||||
|
- |
|
|||||||||||||||
|
5 year survival Thick RCT |
|
|||||||||||||||
|
1[1-3] |
randomised trials |
no serious risk of bias |
no serious inconsistency |
no serious indirectness |
serious4 |
none |
128 |
186 |
- |
SNB=67.0±3.7 OBS=67.5±4.5 |
ÅÅÅO |
|||||
|
10 year survival Thick RCT |
|
|||||||||||||||
|
1[1-3] |
randomised trials |
no serious risk of bias |
no serious inconsistency |
no serious indirectness |
serious4 |
none |
128 |
186 |
- |
SNB=58.9±4.1OBS=64.4±4.6 |
ÅÅÅO |
|||||
|
Locregional recurrence free survival Thick- RCT |
|
|||||||||||||||
|
0 |
No evidence available |
none |
- |
- |
- |
- |
|
|||||||||
|
- |
|
|||||||||||||||
|
Overall survival Thick Obs studies |
|
|||||||||||||||
|
0 |
No evidence available |
none |
- |
- |
- |
- |
|
|||||||||
|
- |
|
|||||||||||||||
|
5 year survival Thick Obs studies |
|
|||||||||||||||
|
0 |
No evidence available |
none |
- |
- |
- |
- |
|
|||||||||
|
- |
|
|||||||||||||||
|
10 year survival Thick Obs studies |
|
|||||||||||||||
|
0 |
No evidence available |
none |
- |
- |
- |
- |
|
|||||||||
|
|
|
- |
|
|||||||||||||
|
Locoregional recurrence free survival Thick Obs studies |
|
|||||||||||||||
|
0 |
No evidence available |
none |
- |
- |
- |
- |
|
|||||||||
|
- |
|
|||||||||||||||
1 before after design, no concurrent control group; 2 retrospective data collection of the 'before'group; prospective data collection of the 'after'group; 3 differential follow up; 4 the confidence interval crossed the clinical decision threshold between SNB and observation group; 5 low number of patients, low number of events; 7 retrospective data collection, n.r= not reported
Risk of Bias table
| KCE Cohort QA checklist | Calista et al, 2013 | Satzer et al, 2011 | van der Ploeg, 2014 | Starz and Balda 2007 | McClain 2012 | CoCanCPG (2012) | Gutzmer et al , 2005 | Koskivuo et al, 2007 | Leiter et al, 2010 | Starz et al 2004 | van Poll et al, 2005 |
| SELECTION BIAS | |||||||||||
| Can selection bias sufficiently be excluded? | no, different time period of the two groups; more T2 in SLN group | no, treated in a different time period | no, different median thickness in the two groups | no treated in a different time period | no, treated in different time period | the study addresses an appropriate and clearly focused question | yes | yes | yes | yes | yes |
| Are the most important confounding factors identified, are they adequately measured and are they adequately taken into account in the study design and/or analysis? | yes | yes | yes | yes | yes | the cohort being studied is selected from source population that are comparable in all respects other than the factor under investigation | no treated in a different time period | no treated in a different time period | no treated in a different time period. In addition, SNB patients might have been selected; an article from the same institute describes that non-SNB was practiced up to 1999. (Mohre et al, 2004) | no treated in a different time period | In part: 505 of patients participated in the MSLT trial. Some patients (number not specified) differed, i.e. patients treated before Jan 1992 would get an elective lymph node dissection if the tumour had a Breslow thickness of over 2 mm |
| DECTECTION BIAS | the likelihood that some eligible subjects might have the outcome ath the time of enrolment is assessed and thaken into account in the analysis | not applicable | not applicable | not applicable | not applicable | no | |||||
| Is the exposure clearly defined and is the method for assessment of exposure adequate and similar in study groups? | not applicable | not applicable | not applicable | not applicable | not applicable | comparison by exposure status is made between full participants and those lost to follow up | loss to follow up not reported | loss to follow up not reported | loss to follow up not reported on, nor stated how this was handled | loss to follow up was reported as 6% not stated how this was handled | not applicable, loss to follow is not discussed |
| Are the outcomes clearly defined and is the method for assessment of the outcomes adequate and similar in study groups? | yes | yes | yes | yes | yes | the outcomes are clearly defined | yes | yes | yes | yes | yes |
| Is the likelihood that some eligible subjects might have the outcome at the time of enrolment assessed and taken into account in the analysis? | no | no | no | no | no | the assessment of outcome is made blind to exposure status | not reported | not reported, national death records were checked for deaths | no | not stated | not reported |
| Is the assessment of outcome made blind to exposure status? | insufficient information to answer | insufficient information to answer | insufficient information to answer | insufficient information to answer | insufficient information to answer | the measure of assessment of exposure is reliable | not applicable | not applicable | not applicable | not applicable | not applicable |
| Is the follow-up sufficiently long to measure all relevant outcomes? | yes | yes, although 10 year survival not yet | yes | yes | yes, although differential follow up | the main potential confounders are identified and taken into account in the design and analysis | no control for differential follow up. Adjuvant treatment is taken into account but not controlled for. | no control for differential follow up. Adjuvant treatment is taken into account but not controlled for. | Yes- groups were dissimilar with regard to main prognostic factors, for which was adjusted in the analysis. The differential follow-up was not adjusted for, but this difference was small: 3 months across the median times for each group | Yes, A time trend in treatment was not assessed. The differential follow up was not adjusted for. | yes, however, adjusted Cox Proportional survival curves would have been more appropriate |
| ATTRITION BIAS | |||||||||||
| Can selective loss-to-follow-up be sufficiently excluded? | insufficient information to answer | insufficient information to answer | insufficient information to answer | insufficient information to answer | insufficient information to answer | are the results of the study valid? | Difficult to definitely attribute differences in outcome to the intervention. All subjects in the pre-SNB group would be eligible to SNB; there is evidence for a prevailing temporal trend, i.e. more adjuvant treatment with interferon-alpha in the SNB group. I would prefer to see a similar follow-up in both groups and information on loss to follow up. Were additional sources used for deaths (e.g. national death records)? | Difficult to definitely attribute differences in outcome to the intervention. All subjects in the pre-SNB group would be eligible to SNB; there is evidence for a prevailing temporal trend, with wider excision margins in the control group, though this is unlikely to have affected outcomes. I would prefer to see a similar follow-up in both groups and information on loss to follow up. Additional information sources were used to seek for the outcome death | Difficult to definitely attribute differences in outcome to the intervention. Would all subjects in the pre-SNB group be eligible to SNB?; temporal trends were not assessed. I would prefer to see information on loss to follow up. Additional sources were not used to seek for the outcome death | There was a large difference in follow-up, which was not taken into account in the analyses and which could explain the differences found. All subjects in the pre-SNB group would be eligible to SNB; Was there a prevailing temporal trend? | Difficult to definitely attribute differences in outcome to the intervention, however, it seems likely. As (a) 50% of patients came from a RCT; (b) difference in follow-up was minimal, and actually patients in the SNB group had a longer median follow-up. Mean follow-up was similar; and (c) most patients were treated concurrently |
| Applicable to the patient group targeted in the search question? | yes |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-10-2024
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Sentinel Node Procedure |
NVvH |
2019 |
2024 |
5-jaar |
NVvH |
Nieuwe studies |
Bij het opstellen van de module heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodule komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Patiënten participatie bij deze richtlijn werd medegefinancierd uit de Stichting Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Werkgroep:
- Dr. A.C.J. van Akkooi, chirurgisch oncoloog, werkzaam in het Antoni van Leeuwenhoek, NVvH, voorzitter
- Prof. dr. C. Verhoef, chirurgisch oncoloog, werkzaam in het Erasmus Medisch Centrum, NVvH
- Dr. L.B. Been, chirurgisch oncoloog, werkzaam in het Universitair Medisch Centrum Groningen, NVvH
- Prof. dr. A.J.M. van den Eertwegh, internist-oncoloog, werkzaam in het Amsterdam Universitair Medisch Centrum, NIV
- Dr. M.J.B. Aarts, internist-oncoloog, werkzaam in het Maastricht Universitair Medisch Centrum, NIV
- Mr. Dr. E.R.M. de Haas, dermatoloog, werkzaam in het Erasmus Medisch Centrum, NVDV
- Drs. B. van der Hiel, nucleair geneeskundige, werkzaam in het Antoni van Leeuwenhoek, NVNG
- Ir. K.J.A. van Elst, patiëntvertegenwoordiger, Stichting Melanoom
Met ondersteuning van:
- Dr. W.J. Harmsen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. J. Tra, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Van Akkooi |
Oncologisch Chirurg, Nederlands Kanker Instituut - Antoni van Leeuwenhoek |
Voorzitter, Tumor Focus Groep (TFG) Melanomen (Integraal Kankercentrum Nederland) Secretaris EORTC |
Extern gefinancierd onderzoek: Amgen, Novartis |
Geen actie |
|
Verhoef |
chirurgisch oncoloog, Erasmus MC, Rotterdam |
Wetenschappelijke adviesraad KWF, onbezoldigd Wetenschappelijk raad Livermetsurvey, onbezoldigd Voorzitter Nederlandse Vereniging voor Chirurgische Oncologie, onbezoldigd Lid Algemeen Bestuur Nederlandse Vereniging van Heelkunde, onbezoldigd Voorzitter ""Dutch chapter E-AHPBA"", onbezoldigd Nederlands TNM comite, onbezoldigd Adviesraad IKNL, onbezoldigd Nederlandse wetenschappelijke Sarcoom Werkgroep, onbezoldigd Bestuur Dutch Hepatocellular Carcinoma Group, onbezoldigd Bestuur Familiehuis, Daniel den Hoed Kliniek, onbezoldigd" |
Geen |
Geen actie |
|
Been |
chirurgisch oncoloog, Universitair Medisch Centrum Groningen |
Geen |
Geen |
Geen actie |
|
van den Eertwegh, |
internist-oncoloog, Universitair Medisch Centrum |
Bestuurslid WIN-O (onbetaald) Bestuurslid DMTR (onbetaald) Adviesraad (betaald) BMS, Novartis, AMGEN, MSD, Roche, Ipsen, Pfizer, Eisai, Merck, Sanofi |
Extern gefinancierd onderzoek: Roche (REPOSIT), BMS (iplimumab beschikbaar stellen voor zircon-ipi studie, Sanofi (RECAB, CABAZIPET) |
Geen actie |
|
Aarts
|
internist-oncoloog, Maastricht Universitair Medisch Centrum |
Bestuurslid WIN-O (Werkgroep Immunotherapie Nederland voor Oncologie) (onbetaald) Bestuurslid TFG (tumor focus groep)-melanomen (Integraal kankercentrum Nederland) (onbetaald) lid van DUOS (Dutch Uro-Oncolgy Studygroup) (onbetaald) lid van de EORTC GU Group (onbetaald) |
Geen |
Geen actie |
|
de Haas
|
dermatoloog, Erasmus Medisch Centrum |
Voorzitter domeingroep oncologie/NVDV |
Geen |
Geen actie |
|
van der Hiel |
nucleair geneeskundige, Nederlands Kanker Instituut Antoni van Leeuwenhoek |
Geen |
Extern gefinancierd onderzoek: Roche (REPOSIT) |
Geen actie |
|
Van Elst |
voorzitter Stichting Melanoom |
Penningmeester bij de Centrale Oudercommissie SKOALV (Stichting Kinderopvang Arcen, Lomm en Velden), onbetaald. |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiënten perspectief door een afgevaardigde van een patiëntenvereniging, de Stichting Melanoom, in de werkgroep te laten participeren.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze module is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt, wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Uit de inventarisatie van de knelpunten door werkgroep/commissie Melanoom van de NVvH (2017) bleek dat er een noodzaak was voor (revisie) van deze richtlijnmodule.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse is door de werkgroepleden en de adviseur een uitgangsvraag opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad Zoekverantwoording voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB-instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration:
- AMSTAR – voor systematische reviews.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Indien van toepassing: bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor: Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij één van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje ‘Overwegingen’.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en welke worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de module is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die een randvoorwaarde zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Kennislacunes
Tijdens de ontwikkeling van deze module is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze module het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de bijlage Kennislacunes. Deze bijlage is te vinden onder de aanverwante producten.
Commentaar- en autorisatiefase
De conceptmodule werd aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve module werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via: secretariaat@kennisinstituut.nl
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html. 2012.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2013.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Zoekverantwoording
2019
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2012 – juli 2018
|
1 exp MELANOMA/ or (melanoma* or nevocarcinoma* or naevocarcinoma or pigmentary cancer).ti,ab. (120083) 2 exp DISSECTION/ or dissection*.ti,ab. (113835) 3 1 and 2 (2264) 4 limit 3 to (english language and yr="2012 -Current") (515) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (360547) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1770514) 7 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (3001483) 8 4 and 5 (35) 9 4 and 6 (84) 10 9 not 8 (72) 11 4 and 7 (243) 12 11 not 8 not 10 (197) 13 8 or 10 or 12 (304)
= 304 |
350 |
|
Embase (Elsevier) |
((('melanoma'/exp OR melanoma*:ti,ab OR nevocarcinoma*:ti,ab OR naevocarcinoma:ti,ab OR 'pigmentary cancer':ti,ab) AND ('dissection'/exp OR dissection*:ti,ab) AND (english)/lim AND (2012-2018)/py NOT 'conference abstract':it)
= 567
Gebruikte filters: Systematic Reviews (('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp))) = 33 Randomized Controlled Trials (('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it)) = 78 Observationele studies ('clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti))) = 125 = 236 |
2012
Zoekstrategie
Searches were run on January 19, 2011.
OVID Medline, Embase and the COCHRANE DATABASE OF SYSTEMATIC REVIEWS were searched. Detailed search strings are given below.
Zoektermen
medline, MEDLINE in progress (via ovid)
Melanoma/th [Therapy]. (6249)
exp Sentinel Lymph Node Biopsy/(5848)
1 and 2 (89)
limit 3 to (human and (dutch or english) and yr="2002-2010") (59)
melanoma$.ti,ab. (64683)
(sentinel$ or SLN$).ti,ab. (13480)
5 and 6 (2018)
limit 7 to yr="2002-2010" (1468)
4 or 8 (1487 )
Embase (via OVID)
exp Melanoma/ (79668)
melanoma$.mp. (94262)
1 or 2 (94523)
(sentinel$ or SLN$).mp. (18424)
exp Sentinel Lymph Node Biopsy/( 6151)
4 or 5 (18424)
3 and 6 (3235)
limit 7 to (human and (dutch or english) and yr="2002-2010") (2004)
COCHRANE DATABASE OF SYSTEMATIC REVIEWS (via OVID)
melanoma$.ti,ab. (6)
