Follow-up bij locoregionaal gemetastaseerd melanoom (stadium III)
Uitgangsvraag
Wat is de meest optimale follow-up ten aanzien van frequentie, duur en aanvullend onderzoek bij patiënten met een stadium III melanoom?
De uitgangsvraag omvat de volgende deelvragen:
- Wat is de optimale frequentie en duur van follow-up bij patiënten met een stadium III melanoom?
- Wat is de rol van beeldvorming bij de follow-up van patiënten met een stadium III melanoom?
- Wat is de plaats van laboratoriumonderzoek (m.n. S-100B bepalingen) bij de follow-up van patiënten met een stadium III melanoom?
- Hoe wordt voldaan aan de behoefte voor aandacht voor psychosociale problemen, andere nazorg en kwaliteit van leven tijdens de follow-up bij patiënten met een stadium III melanoom?
- Waar vindt de follow-up plaats bij patiënten met een stadium III melanoom?
Aanbeveling
Frequentie en duur follow-up van stadium IIIA melanoom, zonder adjuvante systemische therapie
Controleer patiënten met stadium IIIA melanoom zonder indicatie voor adjuvante systemische therapie (met een metastase in de schildwachtklier ≤1mm) volgens het MELFO- schema:
- Eerste 2 jaar iedere 4 maanden met alleen onderzoek van het litteken, de regionale lymfeklieren en de huid
- Jaar 3 iedere 6 maanden met alleen onderzoek van het litteken, de regionale lymfeklieren en de huid
- Jaar 4 en 5 iedere 12 maanden met alleen onderzoek van het litteken, de regionale lymfeklieren en de huid
- Daarna op indicatie
Frequentie en duur follow-up van stadium IIIB, IIIC en IIID melanoom, zonder adjuvante systemische therapie
Controleer patiënten met stadium IIIB, IIIC en IIID melanoom met contra-indicatie voor immuuntherapie of die kiezen om geen adjuvante systemische therapie te ondergaan:
- Eerste 2 jaar iedere 4 maanden met ceCT thorax-abdomen*
- Jaar 3 iedere 6 maanden zonder beeldvorming
- Jaar 4 en 5 iedere 12 maanden zonder beeldvorming
- Daarna op indicatie
*Verricht aanvullend ceCT-hals bij patiënten met een primair melanoom in het hoofd-hals gebied.
Overweeg PET/CT bij hoog risico op recidief, of vermoeden op recidief in de ledematen.
Frequentie monitoring van stadium III melanoom, tijdens en na adjuvante systemische therapie:
Controleer patiënten met stadium III melanoom tijdens en na systemische adjuvante therapie:
- Eerste 2 jaar iedere 4 maanden met ceCT thorax-abdomen*
- Jaar 3 iedere 6 maanden zonder beeldvorming
- Jaar 4 en 5 iedere 12 maanden zonder beeldvorming
- Daarna op indicatie
*Verricht aanvullend ceCT-hals bij patiënten met een primair melanoom in het hoofd-hals gebied.
Overweeg PET/CT tijdens adjuvante systemische therapie, bij hoog risico op recidief of vermoeden op recidief in de ledematen.
Nut van follow-up bij stadium IIIB, IIIC en IIID melanoom met contra-indicatie voor immuuntherapie
Bespreek het nut van follow-up met patiënten met stadium IIIB, IIIC en IIID melanoom met een contra-indicatie voor immuuntherapie.
S-100B bepalingen bij de follow-up van een stadium III melanoom
Verricht geen laboratorium onderzoek (S-100B) tijdens de follow-up van patiënten met een stadium III (A-D) melanoom
Psychosociale problemen en/of andere nazorg /kwaliteit van leven
Wees bedacht op andere dan lichamelijke klachten en vraag hier actief naar.
Zorg dat de patiënt een duidelijk en vast aanspreekpunt heeft bij vragen. Hier kan een verpleegkundig specialist of physician assistant een rol spelen.
Overweeg het meegeven van schriftelijke informatie (bijvoorbeeld de patiëntfolder vanuit de NVDV). Ook kan naar de patiëntenvereniging (www.stichtingmelanoom.nl) verwezen worden.
Gebruik eventueel de lastmeter om klachten waarvoor ondersteuning gewenst is te signaleren en te monitoren.
Overweeg de verwijsgids kanker te raadplegen voor aanvullende behandelings- en begeleidingsmogelijkheden.
Verantwoordelijke follow-up
Stem de follow-up van patiënten met stadium III (A-D) melanoom af tussen de verschillende betrokken disciplines.
Tijdens de adjuvante systemische therapie vindt de follow-up plaats bij de medisch oncoloog en de dermatoloog.
Na de adjuvante systemische therapie vindt de follow-up plaats bij de verwijzend chirurg (oncologisch chirurg, KNO-arts, MKA-chirurg) en de dermatoloog conform de daarover gemaakte lokale afspraken.
Overwegingen
Frequentie en duur van follow-up
Frequentie follow-up stadium III na resectie zonder adjuvante systemische therapie
Niet alle patiënten met stadium III melanoom komen in aanmerking voor adjuvante systemische therapie vanwege comorbiditeit of wens van de patiënt. Voor deze patiënten geldt dat het a priori risico op recidief hetzelfde is als voor patiënten die wel adjuvante systemische therapie ondergaan. Bij het vinden van een recidief kan de comorbiditeit of de wens van de patiënt anders afgewogen worden. Om die reden is er wel een indicatie voor follow-up inclusief beeldvorming zoals bij de adjuvant systemisch behandelde patiënten.
Frequentie follow-up stadium III tijdens adjuvante behandeling
Er werden geen studies gevonden waarin verschillende follow-up schema’s werden vergeleken tijdens de adjuvante systemische therapie bij patiënten met resectabel stadium III/IV melanoom. Hoewel er op dit moment geen onderzoeken zijn waarin verschillende follow-up schema’s worden vergeleken, zijn er wel follow-up schema’s beschreven in studies waarin de effectiviteit van adjuvante systemische therapie bij resectabel stadium III-IV bij patiënten met melanoom werd onderzocht (Weber, 2017; Long, 2017; Eggermont, 2018; Eggermont, 2015; Eggermont, 2016; Eggermont, 2020). Frequentie van follow-up tijdens adjuvante systemische therapie is voor meeste studies iedere 3 maanden. De enige studie naar follow-up frequentie is de MELFO-studie (Deckers, 2020), echter wel bij patiënten met stadium I/II melanoom. Dit indirecte bewijst vormt op dit moment het meest betrouwbare beschikbare bewijs. Daarom wordt aanbevolen om tijdens adjuvante systemische therapie een follow-up uit te voeren met een frequentie van elke 4 maanden.
Frequentie follow-up stadium III na adjuvante systemische therapie
Er werden geen studies gevonden waarin verschillende follow-up schema’s werden vergeleken na het stoppen van de adjuvante systemische therapie bij patiënten met resectabel stadium III-IV melanoom. De studies die de effectiviteit van de adjuvante systemische therapie hebben onderzocht, laten wel een follow-up schema zien dat doorloopt na het stoppen van de adjuvante systemische therapie waarbij de frequentie van follow-up voor de meeste studies 1x per 6 maanden was (vanaf jaar 2 tot einde studie). Daarom wordt een follow-up frequentie van 1x per 4 maanden, gedurende de eerste 2 jaar na het begin van de adjuvante systemische therapie, en vervolgens 1x per 6 maanden vanaf het tweede jaar na de start van de behandeling aanbevolen. Verondersteld wordt dat patiënten na afronding van de laatste kuur (jaar 2) nog één consult zullen hebben bij de internist, gevolgd door twee consulten elke 4 maanden bij de verwijzend chirurg.
Rol van beeldvorming
De kosten van het beeldvormend onderzoek en de belasting voor de patiënt spelen ook een rol bij de aanbevelingen. Een PET/CT is duurder dan een ceCT en het maken van een PET/CT kost meer tijd dan een ceCT, hetgeen ook voor de patiënt een extra belasting is.
Daarom wordt de voorkeur gegeven aan ceCT als beeldvormend onderzoek. Hoewel bij de keuze tussen ceCT en PET/CT ook rekening gehouden kan worden met voorkeuren van de patiënt en lokale expertise met betrekking tot beide methoden, wordt uniformiteit op nationaal niveau en helderheid voor de patiënt als belangrijk beschouwd.
CeCT en PET/CT laten minimale verschillen zien. In een melanoomcentrum valt het te overwegen om gebruik te maken van hybride beeldvorming. In specifieke situaties kan een PET/CT meerwaarde hebben. Dat geldt met name voor patiënten een hoog risico op recidief of met een primair melanoom op de ledemaat en een hoog risico op recidief (lymfeklieren met extranodale groei, meerdere satelieten).. Alhoewel in transit- of satellietmetastasen meestal het best beoordeeld kunnen worden met lichamelijk onderzoek kan PET/CT een rol in spelen bij recidief in de dieper gelegen weke delen.
In alle gepubliceerde studies naar de waarde van adjuvante systemische therapie van stadium III/IV melanoom (Checkmate-238 (Weber, 2017), COMBI-AD (Long, 2017), EORTC (Eggermont, 2018; Eggermont, 2015; Eggermont, 2016; Eggermont, 2020)) zijn uitsluitend ceCT scans gebruikt. De systematische review die de accuratesse van de verschillende beeldvormingsopties analyseert (Dinnes, 2019) heeft betrekking op publicaties tot 2016. Het is aannemelijk dat er binnenkort nieuwe overzichtsartikelen zullen verschijnen die mogelijk nieuwe inzichten zullen bieden. Om deze reden is op dit moment de voorkeur om ceCT-scans uit te voeren tijdens en na de adjuvante systemische therapie, maar rekening te houden met bovengenoemde overwegingen.
De toegevoegde waarde van S-100B bij stadium III melanoom
Uit de literatuur blijkt dat er een beperkte diagnostische accuratesse te zien is van S-100B serum voor therapiebeoordeling bij patiënten met een melanoom. In 26-64% van de patiënten werden geen verhoogde S-100B levels gevonden terwijl beeldvormend onderzoek wel positieve bevindingen liet zien. Gezien het beperkte wetenschappelijk bewijs, de lastige interpretatie van de S-100B waardes en de beperkte landelijke ervaring is er op dit moment geen rol is voor het gebruik van S-100B bij de follow-up.
Psychosociale problemen en/of andere nazorg /kwaliteit van leven
Het hebben van een melanoom leidt, onafhankelijk van het stadium tot wisselende emoties die soms meer ondersteuning behoeven dan alleen medische. Patiënten worstelen met onzekerheid over de toekomst, ervaren soms gebrek aan informatie en hebben moeite met het weer oppakken van het dagelijks leven. Dit geldt met name voor de patiënten die aanvullende behandelingen nodig hebben. Zij ervaren problemen op het gebied van relaties, sociale contacten, arbeidsparticipatie en financiën. Uniformering van de follow-up biedt in ieder geval duidelijkheid bij de terugverwijzing en zekerheid dat de oncologische follow-up gewaarborgd is.
Betrokken disciplines en verantwoordelijke bij follow-up
Bij patiënten waarbij een schildwachtklier procedure is verricht en bij patiënten met een bewezen lymfekliermetastase is meestal een (oncologisch) chirurg dan wel een KNO-arts of MKA-chirurg betrokken die dan ook de verwijzer is voor de adjuvante systemische therapie.
Tijdens de adjuvante systemische therapie is de medisch oncoloog betrokken bij de oncologische controles en vaak ook bij eventuele bijwerkingen.
Na het afronden van de adjuvante systemische therapie zal de patiënt worden terugverwezen naar de initiële verwijzer voor verdere oncologische follow-up. Daarnaast kan er een indicatie bestaan voor dermatologische follow-up die dan onafhankelijk van de oncologisch follow-up plaats vindt. Veelal zullen daarover lokale afspraken zijn gemaakt door de chirurg en de dermatoloog. De aanbevelingen hieronder gaan uit van de oncologische follow-up van het melanoom.
Voorkeuren en waardes van patiënten
Patiënten met een melanoom vinden voor de follow-up de volgende aspecten van belang:
- Controle op nieuwe ziektemanifestaties
- Goede informatie over nut van controles en zonbescherming
- Mogelijkheid om contact te leggen bij verdachte bevindingen
Kosten
Een minder intensief controle schema heeft economische voordelen (39% minder directe kosten per patiënt (Deckers, 2020)) en legt minder beslag op de toenemend schaarse polikliniektijd. Ook bij de keuze voor ceCT in plaats van PET/CT zijn de kosten in de overwegingen meegenomen.
Haalbaarheid en implementatie
De werkgroep voorziet geen problemen ten aanzien van de haalbaarheid en de implementatie van de aanbevelingen.
Onderbouwing
Achtergrond
Na primaire behandeling van melanoom worden patiënten in de regel gecontroleerd. Deze follow-up, of nacontrole, is vooral gericht op het opsporen van recidieven en het bieden van psychosociale ondersteuning. Patiënten met melanoom met een pT1b of dieper melanoom, met of zonder (microscopische) uitzaaiingen in de schildwachtklier, werden tot recent meestal alleen door de dermatoloog vervolgd. Patiënten met melanoom met macroscopische uitzaaiingen in de lymfeklieren waarvoor een lymfeklierdissectie was verricht werden vanwege hun hoge recidiefkans ook door de chirurg vervolgd. Met de introductie van adjuvante systemische therapie is een nieuwe situatie ontstaan. Adjuvante systemische therapie verbetert de ziektevrije overleving van patiënten na complete resectie van stadium III melanoom en maakt daarom deel uit van de standaardbehandeling in Nederland. De optimale follow-up voor patiënten met adjuvante systemische therapie staat nog niet vast. Daardoor zijn er landelijk grote verschillen in de frequentie van follow-up en de toepassing van aanvullende diagnostiek (laboratoriumonderzoek van biomarker S100-B, beeldvormende diagnostiek) tussen de verschillende specialisten en ziekenhuizen. Deze module beoogt hierin uniformiteit te brengen.
Het begrip follow-up is breder dan alleen nacontrole. Voor in situ en pT1a melanoom is de follow-up een eenmalige uitleg, terwijl tijdens de adjuvante systemische therapie naast de oncologische controle ook bijwerkingen worden opgespoord. In die situatie is monitoring een betere aanduiding. In deze module wordt met follow-up bedoeld alle handelingen die nodig zijn voor de nacontrole en monitoring.
Conclusies / Summary of Findings
|
LAAG GRADE |
De melanoom specifieke mortaliteit na drie jaar follow-up lijkt niet te verschillen tussen het conventionele follow-up schema en het stadium-specifieke, gereduceerde follow-up schema bij patiënten met stadium IB-IIC melanoom.
Bron: Deckers, 2020 |
|
LAAG GRADE |
Het aantal patiënten met een recidief na drie jaar follow-up lijkt niet te verschillen tussen het conventionele follow-up schema en het stadium-specifieke, gereduceerde follow-up schema bij patiënten met stadium IB-IIC melanoom.
Bron: Deckers, 2020 |
|
ZEER LAAG GRADE |
De ziekte gerelateerde stress op patiënten lijkt niet te verschillen tussen het conventionele follow-up schema en het stadium-specifieke, gereduceerde follow-up schema bij patiënten met stadium IB-IIC melanoom. Echter de bewijskracht is zeer laag.
Bron: Deckers, 2020 |
|
ZEER LAAG GRADE |
De impact van het event op patiënten lijkt niet te verschillen tussen het conventionele follow-up schema en het stadium-specifieke, gereduceerde follow-up schema bij patiënten met stadium IB-IIC melanoom. Echter de bewijskracht is zeer laag.
Bron: Deckers, 2020 |
|
ZEER LAAG GRADE |
De kwaliteit van leven (mentale component) van patiënten lijkt niet te verschillen tussen het conventionele follow-up schema en het stadium-specifieke, gereduceerde follow-up schema bij patiënten met stadium IB-IIC melanoom. Echter de bewijskracht is zeer laag.
De kwaliteit van leven (fysieke component) van patiënten lijkt lager te zijn bij het volgen van het conventionele follow-up schema en hoger bij het stadium-specifieke, gereduceerde follow-up schema bij patiënten met stadium IB-IIC melanoom. Echter de bewijskracht is zeer laag.
Bron: Deckers, 2020 |
|
GEEN GRADE |
Er werden geen studies gevonden die effecten van verschillende follow-up schema’s tijdens of na adjuvante systemische therapie vergeleken op de uitkomsten: overleving, recidiefkans, morbiditeit, psychosociale aspecten of kwaliteit van leven.
Bronnen: - |
Samenvatting literatuur
Follow-up schema
Deelvraag 1:Wat is de optimale frequentie en duur van follow-up bij patiënten met een stadium III melanoom?
Beschrijving studies
Follow-up schema’s
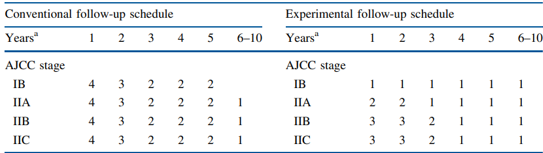
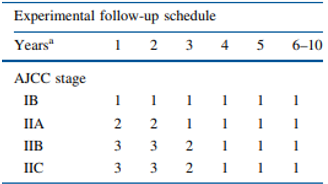
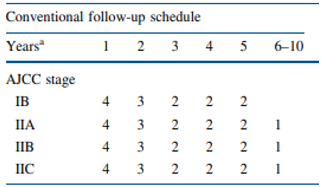
De MELFO-studie onderzocht in een gerandomiseerd onderzoek de effecten van een gereduceerd, stadium specifiek follow-up schema voor patiënten met pathologisch stadium IB-IIC melanoom in Nederland. In totaal werden 180 personen met een pathologisch stadium IB-IIC melanoom (volgens American Joint Committee on Cancer, AJCC) verdeeld over een conventioneel follow-up schema (n=93) en een experimenteel schema (n=87). De conventionele follow-up groep volgde de follow-up zoals beschreven in de Nederlandse richtlijn en de experimentele volgde een gereduceerd schema dat werd afgestemd op het stadium van het melanoom. Een overzicht van de beide follow-up schema’s is weergegeven in figuur 1. Patiënten met een leeftijd <18 of >85 jaar kwamen niet in aanmerking voor participatie. Ook patiënten die de Nederlandse taal niet vaardig waren of een andere maligniteit hadden werden geëxcludeerd van de studie. De volgende voor de werkgroep relevante uitkomstmaten werden meegenomen in de studie: mortaliteit, recidief en psychosociale aspecten (stress volgens de State-Trait Anxiety Inventory–State version, STAI-S; impact van het event met de IES-schaal) en kwaliteit van leven volgens de RAND-36 vragenlijst.
Recent is er een aanvullend artikel verschenen van de MELFO-studie waar er gekeken wordt naar de 5-jaars uitkomsten (Moncrieff, 2022) van zowel Nederlandse patiënten als Engelse patiënten. Deze uitkomsten laten zien dat ook na 5-jaar de uitkomstmaten niet verschillend zijn tussen de schema’s en er in beide schema’s een hoge mate van tevredenheid is (>97%).
Figuur 1. Jaarlijkse follow-up frequentie zoals onderzocht in de MELFO-studie.
NOTE: aAantal jaar na de primaire operatie; AJCC, American Joint Committee on Cancer;
Resultaten
Melanoom specifieke mortaliteit op drie jaar follow-up
Het aantal patiënten dat kwam te overlijden als gevolg van het melanoom was 6,5% in de groep patiënten die het conventionele follow-up schema volgende (6/93) en 8% in de groep patiënten die het experimentele follow-up schema volgde (7/87). Het verschil in melanoom specifieke mortaliteit op drie jaar follow-up was statistisch niet verschillend tussen beide groepen (p=0,777).
Recidief op drie jaar follow-up
Het aantal patiënten met een recidief was 16,1% in de groep patiënten die het conventionele follow-up schema volgende (15/93) en 11,5% in de groep patiënten die het experimentele follow-up schema volgde (10/87). Het verschil in het aantal patiënten met een recidief op drie jaar follow-up was statistisch niet verschillend tussen beide groepen (p=0,397).
Ziekte gerelateerde stress
De ziekte gerelateerde stress werd gemeten met de STAI-S, een 20-item vragenlijst die de emotionele staat van de patiënt evalueert. Items kunnen worden gescoord op een 4-puntsschaal variërend van 1 tot 4 (range 20-80). Hoe hoger de STAI-S score hoe hoger de ervaren stress. Het verschil in STAI-S score tussen beide groepen werd onderzocht middels een ANOVA-test. Repeated measures ANOVA laat geen statistisch significant verschil in STAI-S score zien tussen beide groepen (F=0,2; p=0,66).
Impact van het event
De impact van het melanoom op het dagelijks leven werd onderzocht met de Impact of Event Scale (IES). Deze schaal kent 15 items waarop de impact van het melanoom op het dagelijks leven werd geëvalueerd (range 0-75), met hogere scores die corresponderen met hogere stress response symptomen. Het verschil in IES score tussen beide groepen werd onderzocht middels een ANOVA-test. Repeated measures ANOVA laat geen statistisch significant verschil in IES score zien tussen de groepen (F=0,3; p=0,59).
Kwaliteit van leven
De kwaliteit van leven werd onderzocht met de RAND-36. De RAND-36 kent een fysiek component en een mentaal component. Het verschil in de RAND-36 score tussen beide groepen werd onderzocht middels een ANOVA-test. Repeated measures ANOVA laat geen statistisch significant verschil in RAND-36 (mentaal) score zien tussen de groepen (F=0,004; p=0,95), maar wel een significant verschil voor de RAND-36 (fysiek) score (F=5,4; p=0,002).
Bewijskracht van de literatuur
De bewijskracht van de literatuur werd per uitkomstmaat gegradeerd:
De bewijskracht van de literatuur voor de uitkomstmaat melanoom specifieke mortaliteit op drie jaar follow-up start op hoog vanwege het gerandomiseerde onderzoek en werd met twee niveaus verlaagd vanwege het geringe aantal patiënten en slechts één publicatie (ernstige imprecisie). De bewijskracht van de literatuur is LAAG.
De bewijskracht van de literatuur voor de uitkomstmaat recidief op drie jaar follow-up start op hoog vanwege het gerandomiseerde onderzoek en werd met twee niveaus verlaagd vanwege het geringe aantal patiënten en slechts één publicatie (ernstige imprecisie). De bewijskracht van de literatuur is LAAG.
De bewijskracht van de literatuur voor de uitkomstmaat ziekte gerelateerde stress start op hoog vanwege het gerandomiseerde onderzoek en werd met drie niveaus verlaagd vanwege het geringe aantal patiënten en slechts één publicatie (ernstige imprecisie) en risico op bias (subjectieve karakter van de uitkomstmaat en blindering was niet mogelijk). De bewijskracht van de literatuur is ZEER LAAG.
De bewijskracht van de literatuur voor de uitkomstmaat impact van het event start op hoog vanwege het gerandomiseerde onderzoek en werd met drie niveaus verlaagd vanwege het geringe aantal patiënten en slechts één publicatie (ernstige imprecisie) en risico op bias (subjectieve karakter van de uitkomstmaat en blindering was niet mogelijk). De bewijskracht van de literatuur is ZEER LAAG.
De bewijskracht van de literatuur voor de uitkomstmaat kwaliteit van leven start op hoog vanwege het gerandomiseerde onderzoek en werd met drie niveaus verlaagd vanwege het geringe aantal patiënten en slechts één publicatie (ernstige imprecisie) en risico op bias (subjectieve karakter van de uitkomstmaat en blindering was niet mogelijk). De bewijskracht van de literatuur is ZEER LAAG.
Conclusies
|
LAAG GRADE |
De melanoom specifieke mortaliteit na drie jaar follow-up lijkt niet te verschillen tussen het conventionele follow-up schema en het stadium-specifieke, gereduceerde follow-up schema bij patiënten met stadium IB-IIC melanoom.
Bron: Deckers, 2020 |
|
LAAG GRADE |
Het aantal patiënten met een recidief na drie jaar follow-up lijkt niet te verschillen tussen het conventionele follow-up schema en het stadium-specifieke, gereduceerde follow-up schema bij patiënten met stadium IB-IIC melanoom.
Bron: Deckers, 2020 |
|
ZEER LAAG GRADE |
De ziekte gerelateerde stress op patiënten lijkt niet te verschillen tussen het conventionele follow-up schema en het stadium-specifieke, gereduceerde follow-up schema bij patiënten met stadium IB-IIC melanoom. Echter de bewijskracht is zeer laag.
Bron: Deckers, 2020 |
|
ZEER LAAG GRADE |
De impact van het event op patiënten lijkt niet te verschillen tussen het conventionele follow-up schema en het stadium-specifieke, gereduceerde follow-up schema bij patiënten met stadium IB-IIC melanoom. Echter de bewijskracht is zeer laag.
Bron: Deckers, 2020 |
|
ZEER LAAG GRADE |
De kwaliteit van leven (mentale component) van patiënten lijkt niet te verschillen tussen het conventionele follow-up schema en het stadium-specifieke, gereduceerde follow-up schema bij patiënten met stadium IB-IIC melanoom. Echter de bewijskracht is zeer laag.
De kwaliteit van leven (fysieke component) van patiënten lijkt lager te zijn bij het volgen van het conventionele follow-up schema en hoger bij het stadium-specifieke, gereduceerde follow-up schema bij patiënten met stadium IB-IIC melanoom. Echter de bewijskracht is zeer laag.
Bron: Deckers, 2020 |
|
GEEN GRADE |
Er werden geen studies gevonden die effecten van verschillende follow-up schema’s tijdens of na adjuvante systemische therapie vergeleken op de uitkomsten: overleving, recidiefkans, morbiditeit, psychosociale aspecten of kwaliteit van leven.
Bronnen: - |
Beeldvorming
Deelvraag 2: Wat is de toegevoegde waarde van beeldvorming bij patiënten met een stadium III melanoom?
Beschrijving studies
Beeldvorming tijdens adjuvante systemische therapie
Echografie
Er zijn geen onderzoeken naar de waarde van echografie tijdens adjuvante systemische therapie, tijdens surveillance na resectie of in de follow-up na adjuvante systemische therapie van stadium III melanoom. Daarom wordt de beschikbare literatuur voor de echografie in (re)stadiering van stadium III melanoom meegewogen. Echografie is een eenvoudig, goedkoop en veilig onderzoek dat bij melanoom vooral gebruikt wordt als aanvulling op het lichamelijk onderzoek. Hoewel de sensitiviteit voor detectie van lymfekliermetastasen bij een primair melanoom gering is (20%), is het wel behulpzaam bij beoordelen van palpabele klieren (in combinatie met cytologische punctie) of bij het beoordelen van dieper gelegen klieren (Dinnes, 2019).
PET/CT vs ceCT
Er zijn slechts 2 studies die de waarde van PET/CT tijdens adjuvante systemische therapie hebben onderzocht (Jaeger, 2022; Stahlie, 2020). In deze studies heeft PET/CT meerwaarde in het detecteren van recidief voorafgaand aan start adjuvante systemische therapie en binnen 6 maanden na starten van adjuvante systemische therapie. Het betreft echter relatief kleine patiënten aantallen, 1 studie is retrospectief en is er niet vergeleken met ceCT.
Alhoewel op basis van de huidige literatuur gesuggereerd wordt dat PET/CT een hoge sensitiviteit heeft voor het detecteren van recidief tijdens surveillance na resectie, voorafgaand aan adjuvante systemische therapie en vroegtijdig tijdens adjuvante systemische therapie, is de bewijsvoering beperkt en in deze setting niet vergeleken met ceCT. Daarom wordt ook beschikbare literatuur voor de restadiering van stadium IIIB en IIIC melanoom meegewogen. Hieruit komt voort dat PET/CT met diagnostische CT thorax een vergelijkbare of mogelijk betere sensitiviteit lijkt te hebben dan ceCT hals-thorax-abdomen. Op basis van deze literatuur is echter geen eenduidig advies te geven over de meest geschikte beeldvorming.
Beeldvorming tijdens follow-up na adjuvante systemische therapie
Er is 1 (niet systematisch) review gevonden over beeldvorming bij surveillance voor detectie van metastasen bij high-risk melanoom (Freeman, 2019). Dit review bespreekt tevens de noodzaak van vroege recidiefdetectie en implicaties voor op waarde gebaseerde klinische besluitvorming, nabestaandenzorg en multidisciplinair patiëntmanagement.
In dit review van Freeman (2019) worden vier studies aangehaald, waarin PET/CT onderzocht is als surveillance bij patiënten na resectie van high-risk melanoom (Lim, 2018; Lewin, 2018; Leon-Ferre, 2017; Madu, 2017). Daarnaast werden 4 aanvullende studies gevonden over de diagnostische accuratesse en klinische impact van PET/CT voor het diagnosticeren van recidief in stadium III na complete resectie (surveillance) en tijdens adjuvante behandeling (Jaeger, 2022; Stahlie, 2020; Andersen, 2022; Koskivuo, 2016). Er zijn geen studies gevonden over de waarde van PET/CT of ceCT bij follow-up na adjuvante systemische therapie.
Lim (2018) includeerde 173 high-risk stadium II/III patiënten met melanoom in hun retrospectieve multicenter analyse, echter hiervan werd in de meeste patiënten (89%) ceCT gebruikt als surveillance en in 11% PET/CT. De studie van Jaeger (2022) onderzocht ook in stadium IIB (n=56), IIC (n=54) en IIIA (n=48) retrospectief de waarde van surveillance PET/CT en concludeerden dat in deze patiëntenpopulatie de PPV overall laag is (32%, 95%CI 11%-53%) met een hoog aantal fout positieven (Jaeger, 2022)
Lewin (2018) onderzocht radiologische surveillance met PET/CT in 170 patiënten (Stadium IIIA:34, IIIB:93, IIIC:43). PET/CT detecteerde recidief in 65 (38%) patiënten, waarvan 45 (69%) asymptomatisch. Sensitiviteit, specificiteit, positief voorspellende waarde (PPV) en negatief voorspellende waarde (NPV) was hoger voor stadium IIIB/C patiënten dan voor stadium IIIA patiënten (Stadium IIIA: 45%, 81%, 55%, 74%, Stadium IIIB: 73%, 89%, 83%, 82%, Stadium IIIC: 79%, 89%, 88%, 80%). Een negatieve PET na 18 maanden had NPV's van 80%-84% voor echte niet-recidief op enig moment in de 47 maanden durende (mediane) follow-up periode. Van de patiënten met recidief ondergingen 33 (52%) potentieel curatieve resectie en 10 (16%) bleven ziektevrij na 24 maanden (mediaan). Lewin (2018) concludeert dat substadium specifieke PET/CT bij stadium III melanoom de meeste asymptomatische recidieven detecteert en wordt geassocieerd met een hoge mate van detectie van reseceerbare en mogelijk geneesbare ziekte bij recidief.
Leon-Ferre (2017) evalueerde surveillance PET/CT bij patiënten met gereseceerd stadium III-IV melanoom voor de detectie van klinisch occulte recidieven die in aanmerking komen voor in opzet curatieve behandeling. Er werden retrospectief 299 compleet gereseceerde stadium III/IV patiënten met melanoom geïncludeerd, die ten minste 1 PET/CT hebben ondergaan binnen een jaar na operatie. In 162 (54%) patiënten werd recidief vastgesteld (locoregionaal: 77 (48%), afstandsmetastasen: 85 (52%)), waarvan in 98 (60%) patiënten asymptomatisch. Hiervan konden 65 (66%) patiënten behandeld worden met in opzet curatieve therapie. 90% van alle recidieven werd ontdekt binnen 2.8 jaar. PET/CT had een hoge sensitiviteit (88%, 95% CI = 79.94–93.31%), specificiteit (90%, 95% CI = 88.56–91.56%), en NPV (99%, 95% CI = 98.46–99.52%). Echter, de PPV was slechts 37% (95% CI = 31.32–43.68%), waardoor histologische bevestiging van PET-positieve bevindingen belangrijk blijft.
Koskivuo (2016) includeerden retrospectief 110 asymptomatische patiënten met klinisch lokaal American Joint Committee on Cancer (AJCC) stadium IIB-IIIB melanoom en die surveillance PET/CT hadden ondergaan na een gemiddeld interval van zeven maanden na de eerste operatie. Bij 45 patiënten (41%) werd recidief gevonden met PET/CT. Bij 11 asymptomatische patiënten (10%) werd occulte ziekte gedetecteerd met een enkele PET/CT. In zeven (64%) van hen was een positieve PET/CT van grote invloed op behandelstrategie. Bij 34 (31%) patiënten werd een recidief gedetecteerd mediaan 19 maanden na negatieve PET/CT-scan. Bij 50 patiënten (45%) was de PET/CT-bevinding echt negatief. Bij 15 patiënten (14%) was de scan fout-positief, wat leidde tot aanvullende behandeling of herhaalde beeldvorming. PET/CT kon 24% van alle recidieven bij asymptomatische patiënten met melanoom in een vroeg stadium van de follow-up detecteren, maar een vroege detectie van occulte metastasen verbeterde de overleving niet.
Stahlie (2022) onderzocht prospectief in twee verschillende cohorten de waarde PET/CT in het detecteren van recidief na complete resectie van high-risk melanoom. Cohort 1 was een uitgebreid cohort van de studie van Madu (2017) en includeerde 35 stadium IIIB- of IIIC-patiënten met melanoom, die een surveillanceprotocol met PET/CT volgden na volledige chirurgische resectie. Cohort 2 omvatte 42 stadium IIIB, IIIC of IIID (8e AJCC) patiënten met melanoom, die adjuvante systemische therapie kregen na volledige chirurgische resectie. Een screening PET/CT werd uitgevoerd binnen 12 weken na volledige chirurgische resectie en vóór aanvang van adjuvante systemische therapie, gevolgd door daaropvolgende ceCT of PET/CT tijdens adjuvante systemische therapie. In cohort 1 (mediane follow-up: 33 maanden) ontwikkelden 12 patiënten (34,3%) een recidief gedetecteerd door middel van PET/CT, waarvan 7 (20%) werden gedetecteerd met de eerste scan na 6 maanden. De sensitiviteit en specificiteit waren respectievelijk 92,3% en 100%. In cohort 2 werd recidief vermoed op negen screening PET/CT scans (21,4%), waarvan vier (9,5%) terecht positief. Een negatieve screening PET/CT bleek niet voorspellend voor het niet ontwikkelen van recidief tijdens adjuvante systemische therapie (8 patiënten, 21.1%). Zes (75%) van deze recidieven zich ontwikkelde binnen 6 maanden na het starten van adjuvante systemische therapie. Stahlie (2022) concludeerde dat PET/CT waardevol kan zijn om recidief in stadium III melanoom op te sporen, zelfs kort na de operatie en dat een surveillance PET/CT-protocol na de operatie of een screening PET/CT vóór adjuvante systemische therapie kan worden overwogen.
Laboratorium onderzoek S-100B
Deelvraag 3: Wat is de plaats van S-100B bepalingen bij de follow-up/monitoring van een stadium III melanoom?
Beschrijving studies
S-100B
Er werden zes studies gevonden waarin de diagnostische waarde van S-100B werd onderzocht (Deckers, 2019; Deckers, 2020; Ertekin, 2020; Kruijff, 2009; Strobel, 2007).
De studie van Deckers (2019) includeerde 100 stadium III patiënten met melanoom in follow-up na curatieve lymfeklierdissectie. Vervolgbezoeken omvatten lichamelijk onderzoek en S‐100B laboratoriumonderzoek. Een PET/CT-scan werd uitgevoerd bij verdenking van klinische symptomen en/of bij verhoogde S-100B. In de follow-up hadden 13/100 patiënten een verhoogde S-100B zonder klinische symptomen, van wie 7 patiënten (54%) daadwerkelijk ziektebewijs vertoonden na evaluatie middels een PET/CT-scan. Zesentwintig patiënten (26%) hadden klinische symptomen maar een normale S-100B; waarbij bij 20 patiënten (77%) metastasen werden aangetoond met een PET/CT-scan. In totaal hadden 3 patiënten zowel klinische symptomen als een verhoogde S-100B; bij al deze patiënten bevestigede PET/CT metastasen (100%). In totaal bevestigde een PET/CT-scan uitzaaiingen bij 30 van de 42 patiënten (71%). In zeven recidieven werd een verhoogd S-100B gevonden; 10% van alle patiënten zonder klinische symptomen in de follow-up; 23% van alle patiënten met een recidief. De belangrijkste conclusie t.a.v. de follow-up van stadium III patiënten met melanoom is dat S-100B niet in staat is om een recidief melanoom te detecteren in de follow-up.
Deckers (2020) onderzocht de associatie tussen biomarker S-100B en de PET-afgeleide beoordelingen in stadium IV melanoom. De belangrijkste bevinding was dat van de 52 patiënten met nieuw gediagnosticeerd stadium IV melanoom de biomarker S-100B was verhoogd bij 37 (71%) patiënten ten tijde van de eerste diagnose van stadium IV-ziekte.
Ertekin (2020) beschrijft een retrospectief cohortonderzoek waarin 289 patiënten met stadium IIB, IIC en III melanoom werden gevolgd volgens een intensief protocol waarbij elke 3-6 maanden serum S-100B spiegels werden onderzocht en vergeleken met de referentiestandaard (metastasen bevestigd met beeldvorming of histologie). In totaal werden 289 van de patiënten gedurende 44 maanden gevolgd waarvan 45% metastasen ontwikkelde. Tijdens de onderzoeksperiode hadden 129 patiënten een recidief, waarvan 46 (36%) verhoogde waarden van S-100B vertoonden op het moment van terugval. Ertekin (2020) concludeert dat tijdens follow-up van hoog-risico patiënten met melanoom stijgende serum-S-100B-waarden een aanwijzing kunnen zijn voor ziekteprogressie.
Kruijff (2009) onderzocht de rol van S-100B bij stadium III patiënten met melanoom, bevestigd met PET/CT, met palpabele lymfekliermetastasen waarvoor lymfeklierdissectie. In totaal werden 56 patiënten geïncludeerd. Preoperatieve verhoging van S-100B werd gevonden bij 27 patiënten (48%).
De studie van Strobel (2007) onderzocht de waarde van de tumormarker S-100B in vergelijking met PET/CT bij patiënten behandeld voor melanoommetastasen. Bij 41 patiënten met bewezen melanoommetastasen werden S-100B-analyses en PET/CT scans uitgevoerd. Bij 15/41 patiënten (37%) waren S-100B-waarden normaal voor en na therapie. Bij 26/41 patiënten was S-100B geschikt voor beoordeling van de therapierespons. PET/ CT was geschikt voor responsbeoordeling bij alle patiënten. Een volledige overeenkomst tussen S-100B en PET/CT-beoordeling werd bereikt in 22 van 26 patiënten. Bij een derde van patiënten met metastasen was de S-100B-tumormarker niet geschikt voor therapiebeoordeling en bleven beeldvormende technieken noodzakelijk.
Deelvraag 4 en 5 wordt niet beantwoord met literatuur
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (deelvraag):
Deelvraag 1:
Wat is de optimale frequentie en duur van follow-up bij patiënten met een stadium III melanoom?
PICO-criteria
P: patiënten met melanoom;
I: kort follow-up schema;
C: lang follow-up schema;
O: overleving, recidiefkans, morbiditeit, psychosociale aspecten en kwaliteit van leven.
Deelvraag 2:
Wat is de rol van beeldvorming bij patiënten met een stadium III melanoom?
PICO-criteria
P: patiënten met stadium IIIA, IIIB, IIIC en IV melanoom;
I: diagnostisch instrument contrast-enhanced CT (ceCT), FDG PET/lage dosis non-ceCT (PET/CT), MRI of echografie;
C: andersoortige beeldvormingstechnieken (ceCT, PET/CT, MRI of echografie);
R: actieve surveillance;
O: diagnostische accuratesse: sensitiviteit, specificiteit, negatief voorspellende waarde, positief voorspellende waarde, oppervlakte onder de receiver operating curve (ROC).
Deelvraag 3:
Wat is de plaats van laboratoriumonderzoek (m.n. S-100B bepalingen) bij de follow-up van patiënten met een stadium III melanoom?
Voor deze deelvraag is geen PICO opgesteld
Deelvraag 4:
Hoe wordt voldaan aan de behoefte voor aandacht voor psychosociale problemen, andere nazorg en kwaliteit van leven tijdens de follow-up bij patiënten met een stadium III melanoom?
Voor deze deelvraag is geen systematisch literatuursearch verricht
Deelvraag 5:
Waar vindt de follow-up plaats bij patiënten met een stadium III melanoom?
Voor deze deelvraag is geen systematisch literatuursearch verricht
Indien relevant wordt er een onderscheid gemaakt in de volgende patiëntengroepen:
- Patiënten met een stadium III melanoom, zonder adjuvante systemische therapie:
- Stadium IIIA melanoom zonder indicatie voor adjuvante systemische therapie (met een metastase in de schildwachtklier ≤1mm)
- Stadium IIIB en IIIC melanoom met contra-indicatie voor immuuntherapie
- Stadium III melanoom waarbij patiënt zelf afziet van adjuvante systemische therapie
- Patiënten met een stadium III melanoom tijdens adjuvante systemische therapie
- Patiënten met een stadium III melanoom na adjuvante systemische therapie
Relevante uitkomstmaten
De werkgroep achtte overleving en recidiefkans voor de besluitvorming cruciale uitkomstmaten en morbiditeit, psychosociale aspecten, kwaliteit van leven en kosten voor de besluitvorming belangrijke uitkomstmaten.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 31-08-2020 met relevante zoektermen gezocht naar follow-up schema’s bij patiënten met een melanoom. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 1028 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: patiënten met melanoom, follow-up en primair vergelijkend onderzoek op basis van een RCT. Op basis van titel en abstract werden in eerste instantie 48 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 40 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), er werd één studie definitief geselecteerd voor de uitwerking van de literatuur.
Resultaten
Voor het beantwoorden van deelvraag 1 werd er één studie opgenomen in de literatuuranalyse (Deckers, 2020). Deze studie onderzocht het effect van twee verschillende follow-up schema’s bij patiënten met stadium IB-IIC melanoom. De resultaten van deze studie zijn goed toepasbaar op patiënten met een stadium III melanoom (best available evidence), met name omdat de recidiefkans bij de stadium IIC patiënten vergelijkbaar is aan de recidiefkans bij stadium IIIA en B (Luke, 2022).
Voor het beantwoorden van deelvraag 2 werd er geen vergelijkend onderzoek gevonden. Om deze vraag te kunnen beantwoorden, is gebruik gemaakt van een Cochrane review (Dinnes, 2019). Dit is het enige overzichtsartikel over de diagnostische accuratesse van verschillende beeldvormende technieken voor primaire stadiëring melanoom en bij stadiëring van recidief.
Voor het beantwoorden van deelvraag 3 werden zes studies gevonden waarin de diagnostische waarde van S-100B werd onderzocht (Deckers, 2019; Deckers, 2020; Ertekin, 2020; Kruijff, 2009; Strobel, 2007).
Voor het beantwoorden van deelvraag 4 en 5 is er geen systematisch literatuursearch verricht.
Referenties
- 1 - Andersen JAS, Spatzek AD, Vilstrup MH, Grupe P, Hess S, Holdgaard PC, Bastholt L, Gerke O, Hildebrandt MG. The diagnostic accuracy and clinical impact of FDG-PET/CT follow-up for patients on adjuvant immunotherapy for high-risk malignant melanoma. Eur J Nucl Med Mol Imaging. 2022 Jun;49(7):2342-2351. doi: 10.1007/s00259-022-05704-0. Epub 2022 Feb 7. PMID: 35129651.
- 2 - Deckers EA, Hoekstra-Weebers JEHM, Damude S, Francken AB, Ter Meulen S, Bastiaannet E, Hoekstra HJ. The MELFO Study: A Multicenter, Prospective, Randomized Clinical Trial on the Effects of a Reduced Stage-Adjusted Follow-Up Schedule on Cutaneous Melanoma IB-IIC Patients-Results After 3 Years. Ann Surg Oncol. 2020 May;27(5):1407-1417. doi: 10.1245/s10434-019-07825-7. Epub 2019 Sep 18. PMID: 31535302; PMCID: PMC7138761.
- 3 - Deckers EA, Kruijff S, Brouwers AH, van der Steen K, Hoekstra HJ, Thompson JF, Vállez García D, Wevers KP. The association between active tumor volume, total lesion glycolysis and levels of S-100B and LDH in stage IV melanoma patients. Eur J Surg Oncol. 2020 Nov;46(11):2147-2153. doi: 10.1016/j.ejso.2020.07.011. Epub 2020 Jul 27. PMID: 32819759.
- 4 - Deckers EA, Wevers KP, Muller Kobold AC, Damude S, Vrielink OM, van Ginkel RJ, Been LB, van Leeuwen BL, Hoekstra HJ, Kruijff S. S-100B as an extra selection tool for FDG PET/CT scanning in follow-up of AJCC stage III melanoma patients. J Surg Oncol. 2019 Nov;120(6):1031-1037. doi: 10.1002/jso.25682. Epub 2019 Aug 29. PMID: 31468535; PMCID: PMC6851671.
- 5 - Dinnes J, Ferrante di Ruffano L, Takwoingi Y, Cheung ST, Nathan P, Matin RN, Chuchu N, Chan SA, Durack A, Bayliss SE, Gulati A, Patel L, Davenport C, Godfrey K, Subesinghe M, Traill Z, Deeks JJ, Williams HC; Cochrane Skin Cancer Diagnostic Test Accuracy Group. Ultrasound, CT, MRI, or PET-CT for staging and re-staging of adults with cutaneous melanoma. Cochrane Database Syst Rev. 2019 Jul 1;7(7):CD012806. doi: 10.1002/14651858.CD012806.pub2. PMID: 31260100; PMCID: PMC6601698.
- 6 - Eggermont AM, Chiarion-Sileni V, Grob JJ, Dummer R, Wolchok JD, Schmidt H, Hamid O, Robert C, Ascierto PA, Richards JM, Lebbé C, Ferraresi V, Smylie M, Weber JS, Maio M, Konto C, Hoos A, de Pril V, Gurunath RK, de Schaetzen G, Suciu S, Testori A. Adjuvant ipilimumab versus placebo after complete resection of high-risk stage III melanoma (EORTC 18071): a randomised, double-blind, phase 3 trial. Lancet Oncol. 2015 May;16(5):522-30. doi: 10.1016/S1470-2045(15)70122-1. Epub 2015 Mar 31. Erratum in: Lancet Oncol. 2015 Jun;16(6):e262. Lancet Oncol. 2016 Jun;17 (6):e223. PubMed PMID: 25840693.
- 7 - Eggermont AM, Chiarion-Sileni V, Grob JJ, Dummer R, Wolchok JD, Schmidt H, Hamid O, Robert C, Ascierto PA, Richards JM, Lebbé C, Ferraresi V, Smylie M, Weber JS, Maio M, Bastholt L, Mortier L, Thomas L, Tahir S, Hauschild A, Hassel JC, Hodi FS, Taitt C, de Pril V, de Schaetzen G, Suciu S, Testori A. Prolonged Survival in Stage III Melanoma with Ipilimumab Adjuvant Therapy. N Engl J Med. 2016 Nov 10;375(19):1845-1855. Epub 2016 Oct 7. PubMed PMID: 27717298; PubMed Central PMCID: PMC5648545.
- 8 - Eggermont AMM, Blank CU, Mandala M, Long GV, Atkinson V, Dalle S, Haydon A, Lichinitser M, Khattak A, Carlino MS, Sandhu S, Larkin J, Puig S, Ascierto PA, Rutkowski P, Schadendorf D, Koornstra R, Hernandez-Aya L, Maio M, van den Eertwegh AJM, Grob JJ, Gutzmer R, Jamal R, Lorigan P, Ibrahim N, Marreaud S, van Akkooi ACJ, Suciu S, Robert C. Adjuvant Pembrolizumab versus Placebo in Resected Stage III Melanoma. N Engl J Med. 2018 May 10;378(19):1789-1801. doi: 10.1056/NEJMoa1802357. Epub 2018 Apr 15. PubMed PMID: 29658430.
- 9 - Ertekin SS, Podlipnik S, Ribero S, Molina R, Rios J, Carrera C, Malvehy J, Puig S. Monthly changes in serum levels of S100B protein as a predictor of metastasis development in high-risk melanoma patients. J Eur Acad Dermatol Venereol. 2020 Jul;34(7):1482-1488. doi: 10.1111/jdv.16212. Epub 2020 Feb 21. PMID: 31967695.
- 10 - Freeman M, Laks S. Surveillance imaging for metastasis in high-risk melanoma: importance in individualized patient care and survivorship. Melanoma Manag. 2019 Apr 18;6(1):MMT12. doi: 10.2217/mmt-2019-0003. PMID: 31236204; PMCID: PMC6582455.
- 11 - Jaeger ZJ, Williams GA, Chen L, Mhlanga JC, Cornelius LA, Fields RC. 18 F-FDG positron emission tomography-computed tomography has a low positive predictive value for detecting occult recurrence in asymptomatic patients with high-risk Stages IIB, IIC, and IIIA melanoma. J Surg Oncol. 2022 Mar;125(3):525-534. doi: 10.1002/jso.26737. Epub 2021 Nov 6. PMID: 34741547; PMCID: PMC8799500.
- 12 - Koskivuo I, Kemppainen J, Giordano S, Seppänen M, Veräjänkorva E, Vihinen P, Minn H. Whole body PET/CT in the follow-up of asymptomatic patients with stage IIB-IIIB cutaneous melanoma. Acta Oncol. 2016 Nov;55(11):1355-1359. doi: 10.1080/0284186X.2016.1213879. Epub 2016 Aug 24. PMID: 27553064
- 13 - Kruijff S, Bastiaannet E, Suurmeijer AJ, Hoekstra HJ. Detection of melanoma nodal metastases; differences in detection between elderly and younger patients do not affect survival. Ann Surg Oncol. 2010 Nov;17(11):3008-14. doi: 10.1245/s10434-010-1085-1. Epub 2010 May 5. PMID: 20443146; PMCID: PMC2950925.
- 14 - Leon-Ferre RA, Kottschade LA, Block MS, McWilliams RR, Dronca RS, Creagan ET, Allred JB, Lowe VJ, Markovic SN. Association between the use of surveillance PET/CT and the detection of potentially salvageable occult recurrences among patients with resected high-risk melanoma. Melanoma Res. 2017 Aug;27(4):335-341. doi: 10.1097/CMR.0000000000000344. PMID: 28296712.
- 15 - Lewin J, Sayers L, Kee D, Walpole I, Sanelli A, Te Marvelde L, Herschtal A, Spillane J, Gyorki D, Speakman D, Estall V, Donahoe S, Pohl M, Pope K, Chua M, Sandhu S, McArthur GA, McCormack CJ, Henderson M, Hicks RJ, Shackleton M. Surveillance imaging with FDG-PET/CT in the post-operative follow-up of stage 3 melanoma. Ann Oncol. 2018 Jul 1;29(7):1569-1574. doi: 10.1093/annonc/mdy124. PMID: 29659679.
- 16 - Lim KHJ, Spain L, Barker C, Georgiou A, Walls G, Gore M, Turajlic S, Board R, Larkin JM, Lorigan P. Contemporary outcomes from the use of regular imaging to detect relapse in high-risk cutaneous melanoma. ESMO Open. 2018 Feb 24;3(2):e000317. doi: 10.1136/esmoopen-2017-000317. PMID: 29531842; PMCID: PMC5844377
- 17 - Long GV, Hauschild A, Santinami M, Atkinson V, Mandalà M, Chiarion-Sileni V, Larkin J, Nyakas M, Dutriaux C, Haydon A, Robert C, Mortier L, Schachter J, Schadendorf D, Lesimple T, Plummer R, Ji R, Zhang P, Mookerjee B, Legos J, Kefford R, Dummer R, Kirkwood JM. Adjuvant Dabrafenib plus Trametinib in Stage III BRAF-Mutated Melanoma. N Engl J Med. 2017 Nov 9;377(19):1813-1823. doi: 10.1056/NEJMoa1708539. Epub 2017 Sep 10. PubMed PMID: 28891408.
- 18 - Long GV, Hauschild A, Santinami M, Atkinson V, Mandalà M, Chiarion-Sileni V, Larkin J, Nyakas M, Dutriaux C, Haydon A, Robert C, Mortier L, Schachter J, Schadendorf D, Lesimple T, Plummer R, Ji R, Zhang P, Mookerjee B, Legos J, Kefford R, Dummer R, Kirkwood JM. Adjuvant Dabrafenib plus Trametinib in Stage III BRAF-Mutated Melanoma. N Engl J Med. 2017 Nov 9;377(19):1813-1823. doi: 10.1056/NEJMoa1708539. Epub 2017 Sep 10. PubMed PMID: 28891408.
- 19 - Luke JJ, Rutkowski P, Queirolo P, Del Vecchio M, Mackiewicz J, Chiarion-Sileni V, de la Cruz Merino L, Khattak MA, Schadendorf D, Long GV, Ascierto PA, Mandala M, De Galitiis F, Haydon A, Dummer R, Grob JJ, Robert C, Carlino MS, Mohr P, Poklepovic A, Sondak VK, Scolyer RA, Kirkwood JM, Chen K, Diede SJ, Ahsan S, Ibrahim N, Eggermont AMM; KEYNOTE-716 Investigators. Pembrolizumab versus placebo as adjuvant therapy in completely resected stage IIB or IIC melanoma (KEYNOTE-716): a randomised, double-blind, phase 3 trial. Lancet. 2022 Apr 30;399(10336):1718-1729. doi: 10.1016/S0140-6736(22)00562-1. Epub 2022 Apr 1. PMID: 35367007.
- 20 - Madu MF, Timmerman P, Wouters MWJM, van der Hiel B, van der Hage JA, van Akkooi ACJ. PET/CT surveillance detects asymptomatic recurrences in stage IIIB and IIIC melanoma patients: a prospective cohort study. Melanoma Res. 2017 Jun;27(3):251-257. doi: 10.1097/CMR.0000000000000347. PMID: 28225434.
- 21 - Moncrieff MD, Bastiaannet E, Underwood B, Francken AB, Garioch J, Damude S, Heaton M, Deckers EA, Patel N, Hoekstra-Weebers JE, Hoekstra HJ. Follow-up Schedule for Patients With Sentinel Node-negative Cutaneous Melanoma (The MELFO Study): An International Phase III Randomized Clinical Trial. Ann Surg. 2022 Oct 1;276(4):e208-e216. doi: 10.1097/SLA.0000000000005621. Epub 2022 Jul 22. PMID: 35866644.
- 22 - Stahlie EHA, van der Hiel B, Stokkel MPM, Schrage YM, van Houdt WJ, Wouters MW, van Akkooi ACJ. The use of FDG-PET/CT to detect early recurrence after resection of high-risk stage III melanoma. J Surg Oncol. 2020 Dec;122(7):1328-1336. doi: 10.1002/jso.26155. Epub 2020 Aug 11. PMID: 32783266.
- 23 - Strobel K, Skalsky J, Kalff V, Baumann K, Seifert B, Joller-Jemelka H, Dummer R, Steinert HC. Tumour assessment in advanced melanoma: value of FDG-PET/CT in patients with elevated serum S-100B. Eur J Nucl Med Mol Imaging. 2007 Sep;34(9):1366-75. doi: 10.1007/s00259-007-0403-8. Epub 2007 Mar 28. PMID: 17390135.
- 24 - Weber J, Mandala M, Del Vecchio M, Gogas HJ, Arance AM, Cowey CL, Dalle S, Schenker M, Chiarion-Sileni V, Marquez-Rodas I, Grob JJ, Butler MO, Middleton MR, Maio M, Atkinson V, Queirolo P, Gonzalez R, Kudchadkar RR, Smylie M, Meyer N, Mortier L, Atkins MB, Long GV, Bhatia S, Lebbé C, Rutkowski P, Yokota K, Yamazaki N, Kim TM, de Pril V, Sabater J, Qureshi A, Larkin J, Ascierto PA; CheckMate 238 Collaborators. Adjuvant Nivolumab versus Ipilimumab in Resected Stage III or IV Melanoma. N Engl J Med. 2017 Nov 9;377(19):1824-1835. doi: 10.1056/NEJMoa1709030. Epub 2017 Sep 10. PubMed PMID: 28891423.
- 25 - Weber J, Mandala M, Del Vecchio M, Gogas HJ, Arance AM, Cowey CL, Dalle S, Schenker M, Chiarion-Sileni V, Marquez-Rodas I, Grob JJ, Butler MO, Middleton MR, Maio M, Atkinson V, Queirolo P, Gonzalez R, Kudchadkar RR, Smylie M, Meyer N, Mortier L, Atkins MB, Long GV, Bhatia S, Lebbé C, Rutkowski P, Yokota K, Yamazaki N, Kim TM, de Pril V, Sabater J, Qureshi A, Larkin J, Ascierto PA; CheckMate 238 Collaborators. Adjuvant Nivolumab versus Ipilimumab in Resected Stage III or IV Melanoma. N Engl J Med. 2017 Nov 9;377(19):1824-1835. doi: 10.1056/NEJMoa1709030. Epub 2017 Sep 10. PubMed PMID: 28891423.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) / Control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Deckers, 2020
(MELFO)
NCT0108004 |
Type of study:
Setting and country: The study was conducted at six hospital in the Netherlands. Treated between February 2006 and November 2013
Funding and conflicts of interest: Groningen Melanoma Sarcoma Foundation.
No conflicts of interests |
All patients diagnosed with AJCC stage IB-II cutaneous melanoma, treated with curative intent
Inclusion criteria:
Exclusion criteria:
N total at baseline: N = 180 Intervention: N=87 Control: N=93
Important prognostic factors: Age, mean (±SD): I: 58 (11) C: 55 (14) *based on 110 patients
Sex, n/N (%) male: I: 23/54 (42.6%) C: 31/56 (55.4%)
Groups comparable at baseline? Yes
|
Intervention: Experimental follow-up schedule
Control: Conventional follow-up schedule
|
Length of follow-up: 3 year after diagnosis
Loss-to-follow-up & incomplete outcome data: I: n= 37/93 (39.8%) Reasons: - 15 recurrences - 2 death, non-melanoma related - 20 declined T3 questionnaire completion
I: n=33/87 (37.9%) Reasons: - 23 declined T3 questionnaire completion
|
Deaths (during the 3-year follow-up) I: 7/87 (8%) P=0.777
Recurrences (during the 3-year follow-up) I: 10/87 (11.5%) C: 15/93 (16.1%) P=0.397
Stress (measured with the STAI-S) mean (SD) I: 32.4 (8.1) (T1) I: 30.4 (7.9) (T3) C: 31.2 (8.3) (T1) C: 30.3 (9.4) (T3)
F=0.2; p=0.66 (group) F=0.5; p=0.48 (interaction)
Impact of event (measured with the IES) mean (SD) I: 6.2 (8.5) (T3)
F=11.4; p<0.05 (group) (intervention group)
Quality of life (mental component) I: 48.6 (10.9) (T1) I: 54.3 (5.3 (T3) C: 49.6 (11.3) (T1) C: 53.5 (8.3) (T3)
F=0.004; p=0.95 (group) F=21.2; p<0.05 (group) (intervention group)
Quality of life (physical component) I: 43.3 (11.3) (T1) I: 50.3 (10.6) (T3) (intervention group) F=29.8; p<0.001 (time) (intervention group)
Repeated measures analyses of variance (ANOVAs) showed a significant group effect on the IES (p = 0.001) in favor of the intervention group, and on the RAND-36 PCS (p = 0.02) favoring the control group. Mean IES and CWS scores decreased significantly over time, while those on the RAND-36 MCS and PCS increased. Effect sizes were small.
|
STAI-S State-Trait Anxiety Inventory–State (range 20–80). 4-point scale ranging from ‘not at all’ (1) to ‘very much’ (4) (range from 20-80)
IES Impact of Event Scale (range 15–75). A higher score corresponds to a higher level of stress response symptoms.
MCS mental component summary of the RAND-36 (standardized mean of 50, SD of 10). A high score defines a more favorable health status.
PCS physical component summary of the RAND-36 (standardized mean of 50, SD of 10). A high score defines a more favorable health status
Authors conclusion: “The 3-year results of the MELFO study seem to support the notion that a reduced stage-adjusted follow-up schedule is an appropriate, safe, and cost-effective alternative for pathological, sentinel node staged, AJCC stage IB–IIC melanoma patients, in terms of quality of life, recurrences, deaths, and financial costs, to the follow-up regimen as advised in the current melanoma guideline.” |
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
The MELFO study Deckers (2020)
NCT0108004 |
Definitely yes;
Reason: Randomization was performed into the conventional (CSG) or experimental (ESG) follow-up schedule group, stratified for AJCC stage, in random permuted blocks of four patients, generated by a validated system (Intrialgrator) with the use of a pseudo–random number generator and a supplied seed number. |
Probably no;
Reason: No information
|
Definitely no;
Reason: “Given the nature of the study, it was not possible to blind participants or physicians/nurse practitioners for group assignment.” |
Definitely yes;
Reason: After randomization C: N=93
At T3 I: N=54 C: N=56
|
Probably yes;
Reason: De uitkomsten staan beschreven in het studie protocol. |
Probably no;
DISCLOSURE: None declared.
Power analysis showed that 89 patients per group were needed. We commenced with 93 patients in the CGS group and 87 patients in the ESG group. |
Some concerns
|
Exclusietabel
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Howard, 2020 |
Narrative review |
|
Wernli, 2016 |
Voldoet niet aan PICO: screening |
|
Gamble, 2010 |
Narrative review |
|
Koskivuo, 2016 |
Opgenomen in overwegingen |
|
Kruijff, 2010 |
Opgenomen in overwegingen |
|
Leiter, 2012 |
Geen vergelijkend onderzoek |
|
Lewin, 2018 |
Opgenomen in overwegingen |
|
Livingstone, 2015 |
Voldoet niet aan de PICO |
|
Madu, 2017 |
Geen vergelijkend onderzoek |
|
Matheson, 2017 |
Voldoet niet aan de PICO |
|
Podlipnik, 2016 |
Geen vergelijkend onderzoek |
|
Podlipnik, 2019 |
Geen vergelijkend onderzoek |
|
Testori, 2013 |
Geen vergelijkend onderzoek |
|
Abbot, 2013 |
Geen vergelijkend onderzoek |
|
Baker, 2014 |
Geen vergelijkend onderzoek |
|
Deckers, 2019 |
Opgenomen in overwegingen |
|
Ertekin, 2020 |
Opgenomen in overwegingen |
|
Gebhardt, 2016 |
Geen vergelijkend onderzoek |
|
Holterhues, 2012 |
Richtlijn NL Geen vergelijkend onderzoek |
|
Kruger, 2012 |
Geen vergelijkend onderzoek |
|
Kurtz, 2017 |
Geen vergelijkend onderzoek |
|
Lee, 2017 |
Geen vergelijkend onderzoek |
|
Lee, 2018 |
Geen vergelijkend onderzoek |
|
Leiter, 2010 |
Geen vergelijkend onderzoek |
|
Leon-Ferre, 2017 |
Opgenomen in overwegingen |
|
Lim, 2018 |
Geen vergelijkend onderzoek |
|
Lugowska, 2015 |
Geen vergelijkend onderzoek |
|
Memari, 2015 |
Voldoet aan de PICO |
|
Nijhuis, 2019 |
Geen vergelijkend onderzoek |
|
Osella-Abate, 2015 |
Geen vergelijkend onderzoek |
|
Ribero, 2017 |
Geen vergelijkend onderzoek |
|
Romano, 2010 |
Geen vergelijkend onderzoek |
|
Reuth, 2014 |
Geen vergelijkend onderzoek |
|
Soliman, 2019 |
Geen vergelijkend onderzoek |
|
Stahlie, 2020 |
Opgenomen in overwegingen |
|
Tas, 2019 |
Geen vergelijkend onderzoek |
|
Rodriguez, 2018 |
Geen vergelijkend onderzoek |
|
Beasly, 2017 |
Geen vergelijkend onderzoek |
|
Dellestable, 2015 |
Geen vergelijkend onderzoek |
|
Park, 2016 |
Geen vergelijkend onderzoek |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-10-2024
Bij het opstellen van de module heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodule komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
|
Regiehouder(s)[1] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijnmodule[2] |
Frequentie van beoordeling op actualiteit[3] |
Wie houdt er toezicht op actualiteit[4] |
Relevante factoren voor wijzigingen in aanbeveling[5] |
|
NVvH |
2024 |
2025 |
Jaarlijks |
NIV |
Geen |
[1] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[2] Maximaal na vijf jaar
[3] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[4] regie voerende vereniging, gedeelde regie voerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[5] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Autorisatie
De richtlijnmodules zullen worden geautoriseerd door de: Nederlandse Vereniging voor Heelkunde, Nederlandse Vereniging voor Dermatologie en Venereologie, Nederlandse Internisten Vereniging, Nederlandse Vereniging voor Nucleaire Geneeskunde, Nederlandse Vereniging voor Radiologie, Nederlandse Vereniging voor Pathologie, Verpleegkundigen & Verzorgenden Nederland. Op dit moment is er nog geen consensus bereikt over het patiëntperspectief binnen deze module.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Patiënten participatie bij deze richtlijn werd medegefinancierd uit de Stichting Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
NHG-standaard Verdachte huidafwijkingen
Voor huisartsen is de NHG-Standaard Verdachte huidafwijkingen leidend. Deze sluit aan op de richtlijn Melanoom.
Samenstelling werkgroep
Huidige samenstelling van de werkgroep:
- Dr. A.A.M. (Astrid) van der Veldt, voorzitter, internist-oncoloog, werkzaam in het Erasmus Medisch Centrum, NIV
- Dr. M.J.B. (Maureen) Aarts, internist oncoloog, werkzaam in het Maastricht Universitair Medisch Centrum, NIV
- Prof. dr. A.J.M. van den Eertwegh, internist-oncoloog, werkzaam in het Amsterdam Universitair Medisch Centrum, NIV
- Dr. M. (Hilde) Jalving, internist oncoloog, werkzaam in het Universitair Medisch Centrum Groningen, NIV
- Dr. S. (Sofie) Wilgenhof, werkzaam in het Antoni van Leeuwenhoek, NIV
- Dr. J.J. (Han) Bonenkamp, chirurg oncoloog, werkzaam in het Radboudumc, NVvH
- Dr. D.J. (Dirk) Grünhagen, chirurg oncoloog, werkzaam in het Erasmus Medisch Centrum, NVvH
- Dr. A.B. (Anne Brecht) Francken, chirurgisch oncoloog, werkzaam in het Isala, NVvH
- Dr. E.I. (Elsemieke) Plasmeijer, dermatoloog, werkzaam in het Antoni van Leeuwenhoek, NVDV
- Dr. R. (Remco)van Doorn, dermatoloog, werkzaam in het Leids Universitair Medisch Centrum, NVDV
- Drs. B. (Bernies) van der Hiel, nucleair geneeskundige, werkzaam in het Antoni van Leeuwenhoek, NVNG
- Drs. A. (Annemarie) Bruining, radioloog, werkzaam in het Antoni van Leeuwenhoek, NVvR
- Drs. J.G.M. (Anne) van den Hoek, radiotherapeut, werkzaam in het Universitair Medisch Centrum Groningen, NVRO
- Dr. T.P. (Thomas) Potjer, klinisch geneticus, werkzaam in het Leids Universitair Medisch Centrum, VKGN
- Dr. W.A.M. (Willeke) Blokx, patholoog, werkzaam in het Universitair Medisch Centrum Utrecht, NVVP
- Dr. A.M.L. (Anne) Jansen, klinisch moleculair bioloog in de pathologie, werkzaam in het Universitair Medisch Centrum Utrecht, NVVP
- MSc. L. (Lianne) van der Beek, verpleegkundig specialist, werkzaam in het Erasmus Medisch Centrum, V&VN
- Ir. K. van Elst, patiëntvertegenwoordiger, Stichting Melanoom (tot juni 2024)
Met ondersteuning van:
- Dr. W.J. (Wouter) Harmsen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot februari 2023)
- Dr. D. (Dagmar) Nieboer, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf februari 2023
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Veldt, van der (voorzitter) |
Internist-oncoloog, afdeling Interne Oncologie (0,8 fte) en afdeling Radiologie & Nucleaire Geneeskunde (0,2 fte) Erasmus MC, Rotterdam |
Adviesraden: BMS, MSD, Merck, Novartis, Pfizer, Eisai, Sanofi, Pierre-Fabre en Ipsen. Betaald aan het instituut (Erasmus MC) |
A.A.M. van der Veldt is principal investigator van meerdere studies van firma's (BMS, Exelexis, Novartis, Roche) en investigator-initiated studies (o.a. Safe Stop Trials) die financieel worden ondersteund door onder andere de zorgverzekeraars en non-profit organisaties |
Geen actie |
|
Bonenkamp |
Chirurg Oncoloog, RadboudUMC Nijmegen |
* Lid DB TFG Melanoom (onbetaald) |
Geen |
Geen actie |
|
Aarts |
Internist-oncoloog Maastricht Universitair Medisch Centrum |
* Bestuurslid WIN-O (Werkgroep Immunotherapie Nederland voor Oncologie) melanoom en nierkanker (onbetaald) |
* Pfizer - Tyrosine Inhibitor effect op trombocyten - Co-promotor |
Geen actie |
|
Doorn, van |
Dermatoloog, Leids Universitair Medisch Centrum |
Onbetaald lid van enkele besturen (European Society for Dermatological Research, Nederlandse Vereniging voor Experimentele Dermatologie) |
Stichting KiKA - Therapeutic targeting of congenital melanocytic naevus and childhood melanoma using FOXO4 anti-senescence peptides - Projectleider |
Geen actie |
|
Francken |
Chirurg oncoloog, Isala |
* Voorzitter werkgroep audit NVvH |
Geen |
Geen actie |
|
Jalving |
Internist-oncoloog, UMCG Groningen |
Adviesraden: Bristol-Myers Squibb, AstraZenica,Pierre Fabre (betaald aan instituut (UMCG)
|
* KWF - TAMIC: Dichloroacetate in patients with metastatic melanoma prior to treatment with immune-checkpoint inhibition - Projectleider |
Geen actie |
|
Hiel, van der |
Nucleair geneeskundige, Antoni van Leeuwenhoek |
Geen |
Roche - Reposit - PET imaging for (early) response prediction in unresectable stage III/IV melanoma treated with BRAF/MEKi - Geen projectleider |
Geen actie |
|
Bruining |
Radioloog, Antoni van Leeuwenhoek ziekenhuis in Amsterdam |
* Richtlijncommissie endometriumcarcinoom IKNL |
Geen |
Geen actie |
|
Wilgenhof |
Internist-oncoloog in het Antoni van Leeuwenziekenhuis |
Adviesraden: Eisai, Bristol-Myers Squibb, Pfizer, Novartis en Pierre Fabre (betaald aan instituut (AVL)) |
Oncode - HDAC inhibitor in resistant BRAF V600 mutated advanced melanoma - Projectleider |
Geen actie |
|
Grünhagen |
Chirurg, Erasmus MC |
Lid bestuur WIN-O melanoom, onbetaald |
Geen |
Geen actie |
|
Hoek, van den |
Radiotherapeut-oncoloog, UMCG, 90% |
|
Geen |
Geen actie |
|
Plasmeijer |
Dermatoloog, AVL |
* Bestuurslid Win-O: onbetaald |
Geen |
Geen actie |
|
Eertwegh, van den |
Medisch-oncoloog, afdeling medische oncologie, Cancer Center Amsterdam, Amsterdam UMC, Vrije Universiteit Amsterdam |
Adviesraad (betaald): Board Bristol-Myers Squibb, MSD Oncology, Amgen, Roche, Novartis, Sanofi, Sanofi, Pfizer, Ipsen, Merck, Peirre Fabre |
* Sanofi - Prostaat studies (cabazipet en RECAB) - Projectleider |
Geen actie |
|
Elst, van |
Voorzitter Stichting Melanoom |
Geen |
Geen |
Geen actie |
|
Potjer |
Klinisch Geneticus, LUMC |
Cluster expertisegroep Maligniteiten van de huid |
Geen |
Geen actie |
|
Blockx |
Klinisch patholoog, UMC Utrecht |
Geen |
Geen |
Geen actie |
|
Jansen |
Klinisch Moleculair Bioloog in de Pathologie, UMC Utrecht |
Bestuurslid Stichting PALGA (vacatiegelden) |
Geen |
Geen actie |
|
van der Beek |
Verpleegkundig specialist, Erasmus MC, Rotterdam |
Voorzitter deelnetwerk V&VN VSO melanoom - voorzitter vakgroep VS Erasmus MC - diverse projectgroepen en kwaliteitsverbetering (allen onbetaald) |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiënten perspectief door een afgevaardigde van een patiëntenvereniging, de Stichting Melanoom, in de werkgroep te laten participeren. Er werd aandacht besteed aan het patiënten perspectief door een afgevaardigde van een patiëntenvereniging, de Stichting Melanoom, in de werkgroep te laten participeren. Op dit moment is er nog geen consensus bereikt over het patiëntperspectief binnen deze module.
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren.
Werkwijze
AGREE
Deze module is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt, wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Uit de inventarisatie van de knelpunten door werkgroep/commissie Melanoom van de NVvH (2017) bleek dat er een noodzaak was voor (revisie) van deze richtlijnmodule.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse is door de werkgroepleden en de adviseur een uitgangsvraag opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad Zoekverantwoording voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB-instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration:
• AMSTAR – voor systematische reviews.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Indien van toepassing: bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor: Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in één of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij één van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje ‘Overwegingen’.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en welke worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de module is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die een randvoorwaarde zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Kennislacunes
Tijdens de ontwikkeling van deze module is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze module het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de bijlage Kennislacunes. Deze bijlage is te vinden onder de aanverwante producten.
Commentaar- en autorisatiefase
De conceptmodule werd aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve module werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via: secretariaat@kennisinstituut.nl
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html. 2012.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2013.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.