Verkorting geboorte-interval bij meerlingzwangerschap
Uitgangsvraag
Wat is het optimale geboorte-interval tussen kind 1 en 2 voor de uitkomsten van het tweede kind?
Aanbeveling
Weeg individueel af, indien het geboorte-interval tussen kind 1 en 2 langer dan 30 minuten lijkt te gaan duren, of vermindering van de kans op neonatale acidose bij het tweede kind opweegt tegen de nadelen van een obstetrische interventie.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Op basis van de literatuur kunnen geen conclusies worden getrokken ten aanzien van mogelijke verschillen voor de cruciale en belangrijke uitkomstmaten tussen een kort (≤ 30 minuten) versus lang geboorte-interval (> 30 minuten) bij een ongecompliceerde tweelingzwangerschap. De bewijskracht voor alle uitkomsten was namelijk zeer laag. Dit komt voor een groot deel omdat er alleen observationele studies werden gevonden: en dit type studie heeft al een laag niveau van bewijskracht. Bovendien werden er over het algemeen weinig events gerapporteerd of was er sprake van betrouwbaarheidsintervallen van het gepoolde effect die zowel geen effect als een klinisch relevant effect omvatten (imprecisie). Er waren geen data beschikbaar voor de uitkomstmaten maternale infectie en lange termijn neonatale uitkomsten.
Het is daarom, op basis van de literatuuranalyse, onduidelijk of het geboorte-interval (≤ 30 versus > 30 minuten) tussen eerst- en laatstgeborene van invloed is op de uitkomsten van het 2e kind.
De enige uitkomstmaat waarbij een mogelijke verbetering met een kort interval werd gevonden is het voorkomen van een navelsteng pH < 7,00. Slechts twee studies (Algeri, 2019; Leung, 2002) konden in deze analyse worden meegenomen omdat de meeste studies (Algeri, 2019; Lindroos, 2018; Stein, 2008; Tal, 2018) een ander afkappunt gebruikten voor het definiëren van ernstige acidose, namelijk pH < 7,10. In deze is het dan interessant dat ook hier een gunstig effect werd geobserveerd van een korter geboorte interval op het voorkomen van deze uitkomst (207/5040 (4,1%) versus 76/609 (12,5%); OR 0,32 95% CI 0,22 tot 0,44).
In de overwegingen dient ook nog te worden meegenomen dat voor deze uitgangsvraag er arbitrair gekozen is voor een interval van meer of minder dan 30 minuten. Echter wanneer er als alternatief gekeken zou worden naar het effect van een interval van 10 of 15 minuten bekomt men eveneens geen duidelijke verschillen in cruciale uitkomstmaten (Gupta, 2014; Leung, 2002; Stein, 2008, Benito, 2019; Cukierman, 2018; Swanson, 2017).
Ten slotte is het ook nog op te merken dat er in de geïncludeerde studies geen onderverdeling werd gemaakt op basis van chroniciteit. Het is dus met andere woorden niet duidelijk of er een verschil is in het optimale geboorte-interval voor monochoriale danwel dichoriale tweelingzwangerschappen. Er werd eveneens in het merendeel van de studies niet gecorrigeerd voor de zwangerschapsduur op moment van geboorte, welke voor een uitkomstmaat zoals opname op NICU wel degelijk van belang kan zijn.
Waarden en voorkeuren van patiënten
In geen van de geïncludeerde studies werden de voorkeuren en ervaringen van de patiënten geëvalueerd. Een verlenging van het geboorte interval lijkt in ieder geval niet tot een verhoogde incidentie van post partum bloedingen te leiden. Echter in de groep met een langer geboorte interval (onafhankelijk of dit > 10, > 15 of > 30 min is) worden wel meer kinderen geboren door middel van een instrumentele bevalling of een sectio. Het is onmogelijk uit te sluiten dat dit ten gevolge van een toename in foetale nood is, maar meer waarschijnlijk is dit gewoon een reflectie van het feit dat bij uitblijven van een spontane bevalling een interventie nodig is. De maternale morbiditeit bij zulke interventies is echter niet te onderschatten ondanks dat dit in de geselecteerde studies geen uitkomstwaarde is.
Voor vrouwen kan dit ook aanvoelen als een verlies van controle met name omdat er vaak een zekere mate van urgentie is. Vanuit het perspectief van de patiënt is een spontaan beloop te prefereren en dus is bij definiëren van een optimaal interval belangrijk dit af te wegen ten opzichte van het onzekere effect op neonatale uitkomsten.
Het blijft altijd van belang om patiënte en partner goed te informeren over het verloop van een bevalling bij een tweelingzwangerschap. In deze gesprekken zal vanzelfsprekend ook aandacht moeten zijn voor de persoonlijke waarden en voorkeuren van het koppel.
Kosten (middelenbeslag)
Er zijn betreffende de duur van het geboorte interval bij een tweeling geen kosten-effectiviteitsstudies uitgevoerd. In het algemeen zal er bij een toename van interventies een verhoging van de kosten zijn en dus is ook hiervoor een spontaan beloop gunstiger. Ondanks een vermindering in de incidentie van ernstige neonatale acidose lijkt er op basis van de geselecteerde studies geen verschil in de frequentie van opnames op de neonatale intensive care afdeling. Een mogelijk gunstig effect van een verkort interval op de kosten is dus onzeker en op basis van de beschikbare gegevens niet te bepalen.
Aanvaardbaarheid, haalbaarheid en implementatie
Er is geen onderzoek gedaan met betrekking tot de haalbaarheid en aanvaarbaarheid als een geboorte-interval van < 30 minuten wordt geadviseerd voor alle ongecompliceerde vaginale tweelingbevallingen. Echter, gezien het feit dat de steekproefgrootte van het aantal tweede kinderen met een interval van > 30 minuten maar een kleine minderheid betrof zal dit vermoedelijk voor vele clinici weinig verandering geven in het huidige beleid.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventie
Ondanks dat de bewijskracht laag tot zeer laag is, is mogelijk het risico op neonatale acidose bij het 2e kind kleiner bij een korter geboorte-interval (≤ 30 minuten) vergeleken met een lang geboorte-interval (> 30 minuten) tussen kind 1 en kind 2.
Wanneer het streven is de geboorte van het tweede kind binnen 30 minuten te laten plaatsvinden is het aan te raden na de geboorte van het eerste kind hierop te anticiperen middels het vlot in kaart brengen van conditie, aard en indaling van het voorliggend deel van het tweede kind en weeën activiteit bij de moeder. Indien aan de orde kunnen maatregelen genomen worden om de voorwaarden voor een vlotte geboorte van het tweede kind te optimaliseren (bijvoorbeeld uitwendige versie bij dwarsligging, beginnen met of verhogen van oxytocinetoediening). Neem de ouders mee in de overwegingen om nog af te wachten of een obstetrische interventie te doen bij een langer geboorte-interval.
Onderbouwing
Achtergrond
Het optimale tijdsinterval tussen de geboorte van het eerste en tweede kind bij een vaginale bevalling van een tweeling is momenteel niet duidelijk. Bij een korter interval is er mogelijk een betere neonatale uitkomst en minder kans op perinatale asfyxie. Echter, bij een korter tijdsinterval zal men waarschijnlijk sneller een instrumentele verlossing of een stuitextractie uitvoeren met daarbij de gerelateerde risico’s.
Conclusies / Summary of Findings
Neonatal outcomes 2nd twin
|
Very low GRADE |
The evidence is very uncertain about the effect of the length of the intertwin delivery interval on an Apgar score < 7 at 5 minutes of the second twin.
Bronnen: (Cukierman, 2019; Lindroos, 2018; Stein, 2008; Tal, 2018) |
|
Very low GRADE |
The evidence is very uncertain about the effect of the length of the intertwin delivery interval on umbilical cord pH < 7.00 of the second twin.
Bronnen: (Algeri, 2019; Leung, 2002) |
|
Very low GRADE |
The evidence is very uncertain about the effect of the length of the intertwin delivery interval on NICU admission of the second twin.
Bronnen: (Cukierman, 2019; Lindroos, 2018; Stein, 2008) |
|
Very low GRADE |
The evidence is very uncertain about the effect of the length of the intertwin delivery interval on sepsis/septicemia of the second twin.
Bronnen: (Algeri, 2019; Cukierman, 2019; Lindroos, 2018) |
|
Very low GRADE |
The evidence is very uncertain about the effect of the length of the intertwin delivery interval on perinatal mortality of the second twin.
Bronnen: (Lindroos, 2018; Stein, 2008) |
|
- GRADE |
The effects of the length of the intertwin delivery interval on long-term neonatal outcomes are unclear. None of the included studies reported this outcome. |
Maternal outcomes
|
Very low GRADE |
The evidence is very uncertain about the effect of the length of the intertwin delivery interval on postpartum hemorrhage (undefined).
Bronnen: (Algeri, 2019; Tal, 2018) |
|
Very low GRADE |
The evidence is very uncertain about the effect of the length of the intertwin delivery interval on postpartum hemorrhage > 1500 mL.
Bronnen: (Algeri, 2019) |
|
- GRADE |
The effects of the length of the intertwin delivery interval on maternal infection are unclear. None of the included studies reported this outcome. |
Samenvatting literatuur
Description of studies
The retrospective observational study of Algeri (2019) included 400 diamniotic twin pregnancies. These twins were delivered in one hospital in Italy between January 2000 and July 2017. Inclusion criteria were diamniotic pregnancies with vaginal delivery of the first twin, monoamniotic pregnancies and twins with caesarean delivery of the first twin were excluded. Based on the time elapsed between the delivery of the first and second twin i.e., intertwin delivery interval, twin deliveries were divided into two groups: an intertwin delivery interval ≤ 30 minutes (n=365 twin pregnancies) versus an intertwin delivery interval > 30 minutes (n=35 twin pregnancies). There was not a predefined interval cut-off to expedite delivery if maternal and second twin healthy conditions were maintained. There were 115/400 (28.8%) monochorionic diamniotic twin pregnancies in this study sample: 110/365 (30.1%) monochorionic pregnancies in the group with an intertwin delivery interval of ≤ 30 minutes versus 5/35 (14.3%) monochorionic pregnancies in the > 30 minutes time interval group (p=.051). The mode of delivery of the second twin for the intertwin delivery interval of ≤ 30 minutes was vaginal delivery for 333/365 (91.2%) twins, instrumental delivery for 20/365 (5.5%), and emergency caesarean section for 12/365 (3.3%). In the group with a > 30 minutes time interval, vaginal delivery was found in 18/35 (51.4%) of the second twins, instrumental delivery in 7/35 (20.0%), and emergency caesarean section in 10/35 (28.6%). There was a significant difference between groups on mode of delivery (p<.001).
Cukierman (2019) performed a retrospective cohort study of twin pregnancies (delivered between January 2011 and September 2017) in a tertiary hospital in Melbourne, Australia. A total of 345 twin pregnancies, with a vaginal delivery of the first twin after 24 weeks gestation, were included. Exclusion criteria were an elective caesarean section or caesarean section of the first twin or major congenital abnormalities in either twin. Of the included twin pregnancies, 243 (70.4%) were dichorionic and 102 (29.6%) monochorionic. The twin pregnancies were divided into the following groups with the use of two different cut-offs: an intertwin interval ≤ 10 (n=164 twin pregnancies) versus > 10 minutes (n=181 twin pregnancies) and ≤ 30 (n=317 twin pregnancies) versus > 30 minutes (n=28 twin pregnancies). For the intertwin interval ≤ 30 minutes, spontaneous vertex delivery of the second twin was reported in 95/317 (30.0%), instrumental delivery in 55/317 (17.4%), breech delivery in 163/317 (51.4%), and emergency caesarean section in 4/317(1.2%). Regarding the > 30 minutes interval, spontaneous vertex delivery was found in 9/28 (32.1%), instrumental delivery in 11/28 (39.3%), breech delivery in 5/28 (17.9%), and emergency caesarean section in 3/28 (10.7%). Significant differences were found in the occurrence of instrumental delivery, breech delivery, and emergency caesarean section between the two time intervals (all p<0.01).
Leung (2002) conducted a retrospective study including 118 twin deliveries (with the first twin delivered vaginally) of a university teaching hospital in Hong Kong, China over a period of 5 years and nine months. Exclusion criteria were delivery before 34 weeks of gestation, intrauterine death of either one of the twins before the onset of labour or the first twin being delivered by caesarean section. In addition, pregnancies complicated by pre-eclampsia, discordant growth, intrauterine growth restriction, twin–twin transfusion or fetal malformations were excluded. All uncomplicated twin pregnancies with the first twin in cephalic presentation were allowed a trial of labour, regardless of the presentation of the second twin. Twin deliveries were divided into three groups according to the twin-to-twin delivery interval: 0 to 15 minutes (n=52); 16 to 30 minutes (n=51); > 30 min (n=15). For the 0 to 30 minutes twin-to-twin delivery interval, normal vertex delivery of the second twin was reported in 45/103 (43.7%), vaginal breech delivery in 31/103 (30.1%), instrumental delivery in 17/103 (16.5%) and caesarean section in 10/103 (9.7%). For the > 30 minutes time interval, normal vertex delivery of the second twin was reported in 1/15 (6.7%), vaginal breech delivery in 2/15 (13.3%), instrumental delivery in 2/15 (13.3%), and caesarean section in 10/15 (66.7%).
Lindroos (2018) performed a retrospective study at a university teaching hospital in Western Sweden, including twin deliveries that occurred between January 2008 and December 2014. A total of 527 twin deliveries, with the first twin delivered vaginally, were studied after exclusion of the following deliveries: delivery before 32 weeks of gestation; monoamniotic twin gestations; intrauterine death of one or both twins before onset of labour; the first twin delivered by caesarean section; known fetal malformations or chromosome aberrations in one or both twins. All twin pregnancies with the first twin in cephalic presentation were planned for vaginal delivery. If the second twin was in transverse position an attempt of external version, to either cephalic or breech presentation, was performed. Of the included twin pregnancies, 386/501 (77%) were dichorionic diamniotic twin gestations and 115/501 (23%) monochorionic twin gestations (chorionicity was unknown in 26 deliveries). The mode of delivery of the second twin was spontaneous vertex in 288/527 (54.6%), spontaneous breech in 123/527 (23.3%), breech extraction in 9/527 (1.7%), vacuum extraction in 72/527 (13.7%), and caesarean section in 35/527 (6.6%) of the second twins. Lindroos performed analyses of twin-to-twin time intervals ≤ 30 minutes (n=360) and >30 minutes (n=167).
Stein (2008) used the perinatal birth register of patients discharged from maternity hospitals in Hesse, Germany (i.e., population-based cohort). The study population consisted of twin deliveries of ≥ 34+0 weeks gestation with a vaginally delivered first twin (n=4110). Exclusion criteria were the first twin delivered by caesarean section, intrauterine death of either one of the twins before the onset of labour and/or pregnancies complicated by twin-twin transfusion or fetal malformations. In order to examine trends over time, Stein stratified the intertwin birth intervals into periods of 15 minutes: 1 to 15 minutes (n=3115, 75.8%); 16 to 30 minutes (n= 674, 16.4%); 31-45 minutes (n=178, 4.3%); 46-60 minutes (n=71, 1.7%); > 60 minutes (n=72, 1.8%). Based on the 1 to 30 minutes time interval, spontaneous vertex delivery was reported in 3110/3770 (82.5%), vaginal assisted delivery in 305/3770 (8.1%), caesarean section in 101/3770 (2.7%), and manual extraction in 254/3770 (6.7%). For the ≥ 31 minutes intertwin birth interval, spontaneous vertex delivery was found in 203/319 (63.6%), vaginal assisted delivery in 35/319 (11.0%), caesarean section in 71/319 (22.3%), and manual extraction in 10/319 (3.1%).
Tal (2018) conducted a retrospective study at a single teaching hospital in Israel, including twin deliveries (between 1995 and 2015) with the first twin delivered vaginally at a gestational age of 24 weeks or more (n=713). Exclusion criteria were monoamniotic twins, women who had a planned caesarean delivery or any indicated caesarean delivery without a trial of labor, and twins with major malformations or complicated with antepartum fetal death of one or both twins. After delivery of the first twin, expectant management was employed during the study period regardless of second twin presentation. The preferred method for delivering the breech second twin was assisted breech delivery. Of the included cases there were 562/686 (81.9%) dichorionic twins, 107/686 (15.6%) monochorionic twins and 44/686 (6.4%) of unknown chorionicity. Twin deliveries were divided into two groups: an intertwin delivery interval < 30 minutes (n=596) versus intertwin delivery interval ≥ 30 minutes (n=117). The mode of delivery of second twins with a < 30 minutes interval was spontaneous vaginal delivery for 552/596 (92.6%), instrumental delivery for 25/596 (4.25%), and caesarean section for 19/596 (3.2%). For the longer interval of ≥ 30 minutes, the birth of second twin was spontaneous vaginal delivery for 88/117 (75.2%), instrumental delivery for 7/117 (6.0%), and caesarean section for 22/117 (18.8%) (spontaneous vaginal reference group; instrumental RR=1.70 (95% CI 0.76 to 3.82; caesarean RR=6.01 (95% CI 3.37 to 10.72).
Results
1. Neonatal outcomes 2nd twin
1.1 Apgar score < 7 at 5 minutes
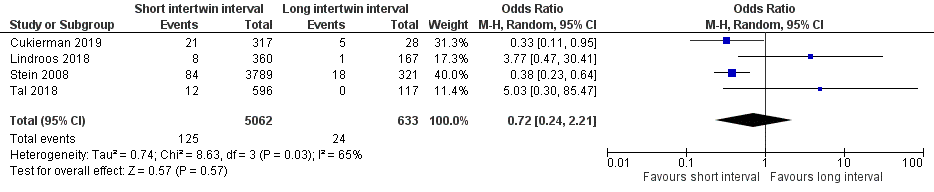
Four studies reported on the Apgar score < 7 at 5 minutes (Cukierman, 2019; Lindroos, 2018; Stein, 2008; Tal, 2018), comparing a short intertwin delivery interval of 30 minutes or less versus a long intertwin delivery interval of more than 30 minutes. An Apgar score < 7 at 5 minutes was reported for 125 of 5062 (2.5%) second twins of mothers with an intertwin delivery interval of ≤ 30 minutes versus 24 of 633 (3.8%) second twins of mothers with an intertwin interval > 30 minutes (OR 0.72 (95% CI 0.24 to 2.21)) (Figure 1).
Figure 1 Apgar score < 7 at 5 minutes, comparison short intertwin delivery interval (≤ 30 minutes) versus long intertwin delivery interval (> 30 minutes)
1.2 Umbilical cord pH < 7.00
Algeri (2019) and Leung (2002) reported on umbilical cord pH with the cut-off < 7.00, comparing a short intertwin delivery interval of 30 minutes or less versus a long intertwin delivery interval of more than 30 minutes. Leung (2002) defined pH further as umbilical cord arterial pH, Algeri (2019) did not describe if arterial or venous umbilical cord pH was reported. A pH < 7 was found in 8 of 468 (1.7%) second twins of mothers with an intertwin delivery interval of ≤ 30 minutes, compared to 6 of 50 (12%) second twins of mothers with an intertwin interval > 30 minutes (OR 0.14 (95% CI 0.04 to 0.43)) (Figure 2).
Figure 2 Umbilical cord pH < 7.00, comparison short intertwin delivery interval (≤ 30 minutes) versus long intertwin delivery interval (> 30 minutes)

1.3 NICU admission
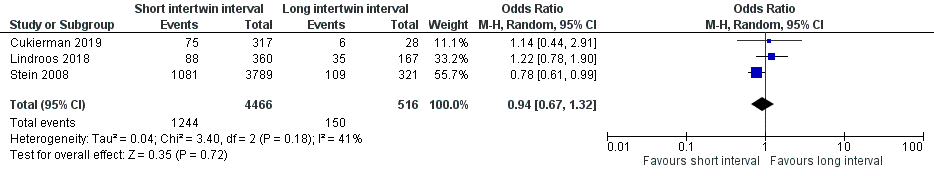
Three studies reported on the outcome measure NICU admission, comparing a short intertwin delivery interval of 30 minutes or less versus a long intertwin delivery interval of more than 30 minutes (Cukierman, 2019; Lindroos, 2018; Stein, 2008). NICU admission was reported for 1244 of 4466 (27.9%) second twins of mothers with an intertwin delivery interval of ≤ 30 minutes, compared to 150 of 516 (29.1%) second twins of mothers with an intertwin interval > 30 minutes (OR 0.94 (95% CI 0.67 to 1.32)) (Figure 3).
Figure 3 NICU admission, comparison short intertwin delivery interval (≤ 30 minutes) versus long intertwin delivery interval (> 30 minutes)
Lindroos (2018) reported besides merely on admission to NICU, also on admittance to NICU for more than 7 days. NICU admission > 7 days was reported for 54 of 88 (61.4%) of the admitted second twins of mothers with an intertwin delivery interval of ≤ 30 minutes, compared to 22 of 35 (62.9%) of the admitted second twins of mothers with an intertwin interval > 30 minutes (p=1.0).
1.4 Neonatal infection: sepsis/septicemia
Three studies reported on the outcome measure sepsis/septicemia, comparing a short intertwin delivery interval of 30 minutes or less versus a long intertwin delivery interval of more than 30 minutes (Algeri, 2019; Cukierman, 2018; Lindroos, 2018). Lindroos (2018) defined septicemia as a positive blood culture within 28 days after birth, Algeri (2019) diagnosed sepsis using ICD-9 codes. Cukierman (2018) did not further define sepsis.
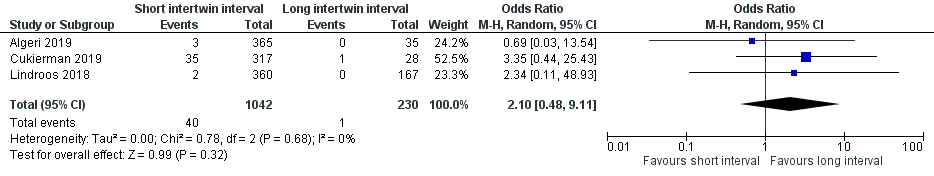
Sepsis/septicemia was found in 40 of 1042 (3.8%) of the second twins of mothers with an intertwin delivery interval of ≤ 30 minutes, compared to 1 of 230 (0.4%) second twins of mothers with an intertwin interval > 30 minutes (OR 2.10 (95% CI 0.48 to 9.11)) (Figure 4).
Figure 4 Sepsis/septicemia, comparison short intertwin delivery interval (≤ 30 minutes) versus long intertwin delivery interval (> 30 minutes)
1.5 Perinatal mortality
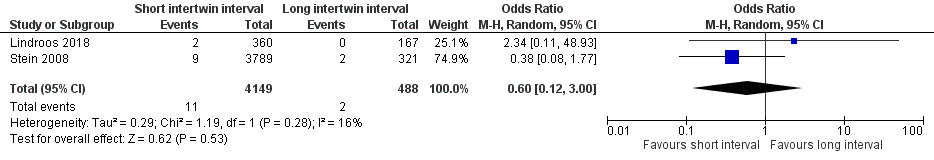
Perinatal mortality was included as outcome measure by two studies, comparing a short intertwin delivery interval of 30 minutes or less versus a long intertwin delivery interval of more than 30 minutes (Lindroos, 2018; Stein, 2008). Perinatal mortality was defined as death after onset of labour and within 7 days after birth. Perinatal mortality occurred in 11 of 4149 (0.3%) second twins of mothers with an intertwin delivery interval of ≤ 30 minutes, compared to 2 of 488 (0.4%) second twins of mothers with an intertwin interval > 30 minutes (OR 0.60 (95% CI 0.12 to 3.00)) (Figure 5).
Figure 5 Perinatal mortality, comparison short intertwin delivery interval (≤ 30 minutes) versus long intertwin delivery interval (> 30 minutes)
1.6 Long-term neonatal outcomes
Only short-term neonatal outcomes were reported. None of the six studies reported long-term neonatal outcomes (Algeri, 2019; Cukierman, 2019; Leung, 2002; Lindroos, 2018; Stein, 2008; Tal, 2018).
2. Maternal outcomes
2.1 Postpartum hemorrhage
Only two studies comparing a short intertwin delivery interval of 30 minutes or less versus a long intertwin delivery interval of more than 30 minutes, included postpartum hemorrhage as one of their outcome measures (Algeri, 2019; Tal, 2018). Tal (2018) reported on any postpartum hemorrhage, Algeri (2019) made a distinction between two types of postpartum hemorrhage: (1) postpartum hemorrhage defined as an amount of bleeding that exceeds 500 mL following vaginal delivery or 1000 mL following caesarean delivery; (2) postpartum hemorrhage > 1500 mL.
The results of Algeri (2019) and Tal (2018) regarding postpartum hemorrhage were pooled (Algeri; their first definition of postpartum hemorrhage). Postpartum hemorrhage occurred in 123 of 961 (12.8%) women with an intertwin interval ≤ 30 minutes compared to 17 of 152 (32.7%) women with an intertwin delivery interval >30 minutes (OR 0.92 (95% CI 0.31 to 2.70)) (Figure 6).
Figure 6 Postpartum hemorrhage, comparison short intertwin delivery interval (≤ 30 minutes) versus long intertwin delivery interval (> 30 minutes)

Postpartum hemorrhage > 1500 mL was found in 9 of 365 (2.5%) women with an intertwin interval ≤ 30 minutes versus in 1 of 35 (2.9%) women with an intertwin delivery interval > 30 minutes (p=1.0) (Algeri, 2019).
2.2 Maternal infection
None of the six studies reported on the outcome measure maternal infection (Algeri, 2019; Cukierman, 2019; Leung, 2002; Lindroos, 2018; Stein, 2008; Tal, 2018).
Level of evidence of the literature
The level of evidence of all defined outcomes measures started low because the evidence was based on observational cohort studies. The following two outcome measures were not reported in the included studies: 1) long-term neonatal outcomes and 2) maternal infection.
The level of evidence regarding the outcome measure Apgar score < 7 at 5 minutes was downgraded by 1 level because of inconsistency (conflicting results: two studies favour the ≤30-minute interval, two studies favour the > 30-minute interval) to ‘very low’.
The level of evidence regarding the outcome measure umbilical cord pH < 7.00 was downgraded by 1 level because of imprecision (small sample size and number of events was low: 8/468 in the ≤ 30-minute interval-group and 6/50 in the > 30-minute interval-group) to ‘very low’.
The level of evidence regarding the outcome measure NICU admission was downgraded by 2 levels because of imprecision (the 95% confidence interval of the pooled effect includes no effect as well as a clinically relevant effect in favour for the ≤ 30-minute interval-group and an clinically relevant effect in favour for the > 30-minute interval-group) to ‘very low’.
The level of evidence regarding the outcome measure neonatal infection (sepsis/septicemia) was downgraded by 2 levels because of imprecision (the 95% confidence interval of the pooled effect includes no effect as well as a clinically relevant effect in favour for the ≤ 30-minute interval-group and an clinically relevant effect in favour for the > 30-minute interval-group) to ‘very low’.
The level of evidence regarding the outcome measure perinatal mortality was downgraded by 2 levels because of imprecision (number of events was low: 11/4149 in the ≤ 30-minute interval-group and 2/488 in the > 30-minute interval group. In addition, the 95% confidence interval of the pooled effect includes no effect as well as a clinically relevant effect in favour for the ≤ 30 minute interval-group and a clinically relevant effect in favour for the > 30 minute interval-group) to ‘very low’.
The level of evidence regarding the outcome measure postpartum hemorrhage was downgraded by 1 level because of imprecision (the 95% confidence interval of the pooled effect includes no effect as well as a clinically relevant effect in favour for the ≤ 30 minute interval-group and an clinically relevant effect in favour for the > 30 minute interval-group) to ‘very low’.
The level of evidence regarding the outcome measure postpartum hemorrhage > 1500 mL was downgraded by 1 level because of imprecision (only one study was included for this outcome measure. In addition, the number of events and sample size was low: 9/365 in the ≤ 30-minute interval-group and 1/35 in the > 30-minute interval group) to ‘very low’.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (un)favourable effects of shortening the intertwin delivery interval (≤ 30 minutes) compared to a long intertwin delivery interval (> 30 minutes) on neonatal and maternal outcomes?
P: uncomplicated twin pregnancies (dichorionic twins and monochorionic twins) with the first child in a cephalic position.
I: short intertwin delivery interval (≤ 30 minutes).
C: long intertwin delivery interval (> 30 minutes).
O: neonatal outcomes 2nd twin: perinatal mortality, neonatal infection, Apgar score < 7 at 5 minutes, umbilical cord pH < 7.00, NICU admission, long-term neonatal outcomes.
Maternal outcomes: postpartum hemorrhage, maternal infection.
Relevant outcome measures
The guideline development group considered umbilical cord pH < 7.00, Apgar score < 7 at 5 minutes, NICU admission, and postpartum hemorrhage as critical outcome measures for decision making; and perinatal mortality, neonatal infection, maternal infection, and long-term neonatal outcomes as important outcome measures for decision making.
A priori, the working group did not define the outcome measures NICU admission, postpartum hemorrhage, perinatal mortality, neonatal infection, maternal infection, and long-term neonatal outcomes but used the definitions used in the studies.
The working group defined a relative risk ≤ 0.8 or ≥ 1.25 as a minimal clinically (patient) important difference for all the outcome measures.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until January 2020. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 273 hits. Studies were selected based on the following criteria: 1) the study compared a short intertwin delivery interval (≤30 minutes) versus a long intertwin delivery interval (> 30 minutes); 2) at least one of the predefined outcome measures was reported. Twenty-seven studies were initially selected based on title and abstract screening. After reading the full text, 21 studies were excluded (see the table with reasons for exclusion under the tab Methods) and six studies were included.
Results
Six studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Algeri, P., Callegari, C., Mastrolia, S. A., Brienza, L., Vaglio Tessitore, I., Paterlini, G.,... & Vergani, P. (2019). What is the effect of intertwin delivery interval on the outcome of the second twin delivered vaginally?. The Journal of Maternal-Fetal & Neonatal Medicine, 32(20), 3480-3486.
- Benito, M., De Bonrostro, C., Agustín, A., Roca, M., Campillos, J. M., & Castán, S. (2019). Impact of intertwin interval on short‐term neonatal outcomes of the second twin in dichorionic pregnancies with vaginal delivery. International Journal of Gynecology & Obstetrics, 145(2), 193-198.
- Cukierman, R., Heland, S., Palmer, K., Neil, P., da Silva Costa, F., & Rolnik, D. L. (2019). Inter‐twin delivery interval, short‐term perinatal outcomes and risk of caesarean for the second twin. Australian and New Zealand Journal of Obstetrics and Gynaecology, 59(3), 375-379.
- Gupta, P., Faridi, M. M. A., Goel, N., & Zaidi, Z. (2014). Reappraisal of twinning: epidemiology and outcome in the early neonatal period. Singapore medical journal, 55(6), 310.
- Leung, T. Y., Tam, W. H., Leung, T. N., Lok, I. H., & Lau, T. K. (2002). Effect of twin-to-twin delivery interval on umbilical cord blood gas in the second twins. BJOG: an international journal of obstetrics and gynaecology, 109(1), 63-67.
- Lindroos, L., Elfvin, A., Ladfors, L., & Wennerholm, U. B. (2018). The effect of twin-to-twin delivery time intervals on neonatal outcome for second twins. BMC pregnancy and childbirth, 18(1), 36.
- Stein, W., Misselwitz, B., & Schmidt, S. (2008). Twin‐to‐twin delivery time interval: influencing factors and effect on short‐term outcome of the second twin. Acta obstetricia et gynecologica Scandinavica, 87(3), 346-353.
- Swanson, K., Grobman, W. A., & Miller, E. S. (2017). The association between the intertwin interval and adverse neonatal outcomes. American journal of perinatology, 34(01), 70-73.
- Tal, A., Peretz, H., Garmi, G., Zafran, N., Romano, S., & Salim, R. (2018). Effect of inter‐twin delivery interval on umbilical artery pH and Apgar score in the second twin. Birth, 45(1), 37-42.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy - otherwise the evidence table for studies of diagnostic test accuracy should be used.
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Algeri 2019 |
Unlikely
|
Unlikely Outcomes of interest available for all included second twins. |
Unlikely
|
Unlikely Monochorionicity was more frequent in case of shorter intertwin delivery interval (30.1 versus 14.3%, p=.05). Multivariate regression analysis was performed. |
|
Cukierman 2019 |
Unlikely
|
Unlikely Outcomes of interest available for all included second twins. |
Unlikely The outcome measure sepsis was not further defined. |
Unlikely Maternal characteristics were similar between the two interval groups. Monochorionicity was associated with a shorter delivery interval (p=0.01; 0.02). Multivariate regression analysis was performed. |
|
Leung 2002 |
Unlikely
|
Unlikely Outcomes of interest available for all included second twins. |
Unlikely
|
Unlikely Only uncorrected, descriptive data were given. Not reported if groups were comparable at baseline. |
|
Lindroos 2018 |
Unlikely
|
Unclear There were missing umbilical arterial blood gas pH values in 101/527 (19.2%) second twins. Reasons not given. |
Unlikely
|
Unclear Baseline characteristics are not depicted for the intervention group (time interval ≤30 min) and control group (time interval >30 min) separately (i.e, only showed for total group). Only uncorrected, descriptive data were given. |
|
Stein 2008 |
Unlikely
|
Unlikely Outcomes of interest available for all included second twins. |
Unlikely
|
Unlikely Only uncorrected, descriptive data were given. Maternal parameters and gestational age were not associated with the time interval. |
|
Tal 2018 |
Unlikely
|
Unlikely Outcomes of interest available for all included second twins. |
Unclear The outcome measure ‘any postpartum haemorrhage’ was ill-defined. Neonatal death was not further defined. |
Unlikely Only uncorrected, descriptive data were given. Women who used fertility treatments to become pregnant (p=.001) or had dichorionic twins (p=.02) were at greater risk to have an interval of 30 minutes or more. |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Algeri, 2019b |
Not conform PICO (wrong outcome: neonatal hypoxia) |
|
Armson, 2006 |
Not conform PICO (intertwin differences) |
|
Axelsdóttir, 2019 |
Not conform PICO (wrong comparison: monochorionic twins versus dichorionic twins) |
|
Benito, 2019 |
Not conform PICO (wrong comparison: <10 minutes intertwin interval versus ≥10 minutes interval) |
|
Bhide, 2006 |
Not conform PICO (intertwin differences) |
|
Edris, 2006 |
Not conform PICO (outcomes not dichotomized) |
|
Fill Malfertheiner, 2018 |
Not conform PICO (time interval not dichotomized) |
|
Gupta, 2014 |
Not conform PICO (wrong comparison: ≤15 minutes intertwin interval versus ≥16 minutes interval) |
|
Hartley, 2005 |
Not conform PICO (intertwin differences) |
|
Kwon, 2011 |
Not conform PICO (intertwin differences; caesarean section versus vaginal delivery) |
|
Leung, 2004 |
Not conform PICO (umbilical cord blood gas status with the duration of the corresponding second stage of labour) |
|
McGrail, 2005 |
Not conform PICO (outcomes not dichotomized) |
|
Mekki, 2016 |
Wrong language (French) |
|
Nkwabong, 2009 |
Not conform PICO (outcomes not dichotomized) |
|
Persad, 2001 |
Not conform PICO (outcomes analyzed by four modes of delivery) |
|
Quintana, 2013 |
Not conform PICO (caesarean section versus vaginal delivery) |
|
Roopnarinesingh, 2002 |
Not conform PICO (outcomes not dichotomized) |
|
Rosen, 2016 |
Not conform PICO (OASIS, obstetric anal sphincter injuries, versus no OASIS) |
|
Swanson, 2017 |
Not conform PICO (wrong comparison: <10 minutes intertwin interval versus ≥10 minutes interval) |
|
Verbeek, 2016 |
Not conform PICO (intertwin differences) |
|
Young, 2007 |
Not conform PICO (caesarean section versus vaginal delivery) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 25-07-2022
Beoordeeld op geldigheid : 25-07-2022
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Verkorting geboorte-interval |
NVOG |
2022 |
2027 |
5 jaar |
NVOG |
Nieuwe evidence |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De ontwikkeling van deze richtlijnmodules werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
De richtlijn is ontwikkeld in samenwerking met:
- Nederlandse Vereniging voor Kindergeneeskunde
- Koninklijke Nederlandse Organisatie van Verloskundigen
- Nederlandse Vereniging voor Anesthesiologie
- Patiëntenfederatie Nederland
- Nederlandse Vereniging voor Ouders van Meerlingen
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor vrouwen zwanger van een meerling.
Werkgroep
- Dr. C.J. (Caroline) Bax, gynaecoloog-perinatoloog, werkzaam in het Amsterdam UMC te Amsterdam, NVOG (voorzitter)
- Dr. K.E.A. (Karien) Hack, gynaecoloog, werkzaam in Gelre Ziekenhuizen, locatie Apeldoorn, NVOG
- Dr. J.M. (Annemieke) Middeldorp, gynaecoloog-perinatoloog, werkzaam in het Leids Universitair Medisch Centrum te Leiden, NVOG
- Dr. M. (Marieke) Sueters, gynaecoloog, werkzaam in het Leids Universitair Medisch Centrum te Leiden, NVOG
- Dr. P.L.J. (Philip) DeKoninck, gynaecoloog-perinatoloog, werkzaam in het ErasmusMC Sophia te Rotterdam, NVOG
- Dr. J.B. (Jan) Derks, gynaecoloog-perinatoloog, werkzaam in het UMC Utrecht te Utrecht, NVOG
- Prof. dr. E. (Enrico) Lopriore, kinderarts-neonatoloog, werkzaam in het Leids Universitair Medisch Centrum te Leiden, NVK
- Drs. M.L. (Mark) van Zuylen, anesthesioloog, werkzaam in het Amsterdam UMC te Amsterdam, NVA
- Drs. I.C.M. (Ingrid) Beenakkers, anesthesioloog, werkzaam in het UMC Utrecht te Utrecht, NVA
- H. (Hanna) den Hartog-van Veen, zelfstandig verloskundige te Alphen aan den Rijn, KNOV
- J. (Jolein) Vernooij, klinisch verloskundige, werkzaam in het OLVG te Amsterdam, KNOV
- J.C. (Anne) Mooij, MSc, adviseur, Patientenfederatie Nederland
- Dr. S.V. (Steven) Koenen, gynaecoloog, werkzaam in het ETZ, locatie Elisabeth Ziekenhuis, NVOG, lid stuurgroep
- Dr. J.J. (Hans) Duvekot, gynaecoloog, werkzaam in het Erasmus MC, NVOG, lid stuurgroep
Meelezers
- J. (José) van Bijsterveld, Nederlandse Vereniging voor Ouders van Meerlingen
- J.D.M. (Jacobien) Wagemaker, MSc, Care4Neo
- Leden van de Otterlo-werkgroep (2020)
Met ondersteuning van
- Dr. J. (Janneke) Hoogervorst-Schilp, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. L. (Laura) Viester, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M.A.C. (Marleen) van Son, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. W.J. (Wouter) Harmsen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenwerkzaamheden |
Gemelde belangen |
Actie |
|
Bax* |
Gynaecoloog-perinatoloog Amsterdam UMC |
Gastvrouw Hospice Xenia Leiden (onbetaald) |
Geen |
Geen actie |
|
Beenakkers |
Anesthesioloog UMCU/WKZ |
Geen |
Geen |
Geen actie |
|
DeKoninck |
Gynaecoloog, Erasmus MC |
Geen |
Geen |
Geen actie |
|
Derks |
Gynaecoloog/ perinatoloog |
Geen |
Geen |
Geen actie |
|
Duvekot |
Gynaecoloog, Erasmus MC |
Directeur 'Medisch Advies en Expertise Bureau Duvekot', Ridderkerk, ZZP'er |
Geen |
Geen actie |
|
Hack |
Gynaecoloog, Gelre Ziekenhuizen Apeldoorn |
Bestuurslid Werkgroep Klinische Verloskunde (NVOG) - onbetaald |
|
Geen actie |
|
Koenen |
Gynaecoloog, ETZ Tilburg |
Incidenteel juridische expertise (betaald) |
Geen |
Geen actie |
|
Lopriore |
Hoofd afdeling neonatologie LUMC sinds 2013 hoogleraar neonatologie, in het bijzonder foetale geneeskunde sinds 2016 |
Geen |
Geen |
Geen actie |
|
Middeldorp |
Leids Universitair Medisch Centrum |
Geen |
LUMC is nationaal verwijscentrum voor foetale behandeling, dus ook voor de behandeling van gecompliceerde monochoriale zwangerschappen. |
Geen actie |
|
Mooij |
Adviseur Patientenbelang, Patientenfederatie Nederland |
Geen |
Geen |
Geen actie |
|
Sueters |
Gynaecoloog, LUMC |
Geen |
Geen |
Geen actie |
|
Van Zuylen |
Anesthesioloog i.o. Amsterdam UMC- locatie AMC |
Geen |
Geen |
Geen actie |
|
Van Veen |
1e lijns verloskundige, zzp'er, waarneemster voor Vivre praktijk voor verloskunde en echoscopie in Alphen a/d Rijn |
Sensiplanconsulente: cursussen geven, vrijwilligersvergoeding. Toetsgroepbegeleider: voor 1e lijns verloskundigen, onbetaald |
Geen |
Geen actie |
|
Vernooij |
Klinisch verloskundige (1fte) - Physician Assistant in opleiding - klinisch verloskundige Werkgever: OLVG locatie Oost, Amsterdam |
Geen |
Geen |
Geen actie |
*Voorzitter werkgroep
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door vertegenwoordigers van de Patiëntenfederatie Nederland en de Nederlandse Vereniging voor Ouders van Meerlingen af te vaardigen in de clusterwerkgroep. De conceptrichtlijn werd tevens ter commentaar voorgelegd aan de betrokken patiëntenverenigingen.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodules zijn opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens is er een knelpunteninventarisatie gedaan in november 2018 middels een Invitational conference met onder andere meerlingen als onderwerp.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen.
Commentaar- en autorisatiefase
De conceptrichtlijnmodules worden aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren worden de conceptrichtlijnmodules aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodules worden aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas, T., Merglen, A., Heen, A. F., Kristiansen, A., Neumann, I., Brito, J. P.,... & Guyatt, G. H. (2017). UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ open, 7(11).
Alonso-Coello, P., Schünemann, H. J., Moberg, J., Brignardello-Petersen, R., Akl, E. A., Davoli, M.,... & Morelli, A. (2018). GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. Gaceta sanitaria, 32(2), 166-e1.
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G.,... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Cmaj, 182(18), E839-E842.
Hultcrantz, M., Rind, D., Akl, E. A., Treweek, S., Mustafa, R. A., Iorio, A.,... & Katikireddi, S. V. (2017). The GRADE Working Group clarifies the construct of certainty of evidence. Journal of clinical epidemiology, 87, 4-13.
Richtlijnen, A., & Kwaliteit, R. (2012). Medisch specialistische richtlijnen 2.0. Utrecht: Orde van Medisch Specialisten.
https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Neumann, I., Santesso, N., Akl, E. A., Rind, D. M., Vandvik, P. O., Alonso-Coello, P.,... & Guyatt, G. H. (2016). A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. Journal of clinical epidemiology, 72, 45-55.
Schünemann, H., Brożek, J., Guyatt, G., & Oxman, A. (2013). GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from guidelinedevelopment. org/handbook. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E.,... & Bossuyt, P. (2008). Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. Bmj, 336(7653), 1106-1110.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
|
What is the optimum intertwin delivery interval regarding de outcomes of the second twin? |
|
|
Database(s): Medline, Embase |
Date: 13 januari 2020 |
|
Publication date range: 2000-January 2020 |
Languages: English |
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
|
1 exp Pregnancy, Multiple/ or exp Multiple Birth Offspring/ or twin*.ti,ab,kf. or (multiple adj2 (pregnanc* or gestation*)).ti,ab,kf. (71760) 2 ((intertwin or delivery or birth or labo*r) adj3 (interval or second)).ti,ab,kf. (7242) 3 1 and 2 (562) 4 limit 3 to (english language and yr="2000 -Current") (329) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (427761) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1937369) 7 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (3342891) 8 4 and 5 (21) 9 (4 and 6) not 8 (30) 10 (4 and 7) not (8 or 9) (159) 11 8 or 9 or 10 (210)
21 SRs + 30 RCTs + 159 observationele studies = 210 totaal (32 uniek) |
273 |
|
Embase
|
'multiple pregnancy'/exp OR 'multiple birth offspring'/exp OR 'dichorionic twin pregnancy'/exp OR 'monochorionic twin pregnancy'/exp OR twin*:ti,ab OR ((multiple NEAR/2 (pregnanc* OR gestation*)):ti,ab) AND ((intertwin OR delivery OR birth OR labo*r) NEAR/3 (interval OR second)):ti,ab,kw AND (english)/lim AND (2000-2020)/py NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)
Gebruikte filters: Sytematische reviews ('meta-analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) = 18 RCT’s ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) = 62 Observationeel onderzoek 'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) = 167
= 247 totaal (241 uniek) |
