SC vs. vaginale partus bij tweelingzwangerschap
Uitgangsvraag
Welke modus partus (primaire sectio of vaginale partus) verdient de voorkeur bij ongecompliceerde tweelingzwangerschappen, indien het eerste kind in hoofdligging ligt?
Aanbeveling
Adviseer een vaginale partus bij een ongecompliceerde tweelingzwangerschap van AD 32+0 tot 38+6 weken, indien het eerste kind in hoofdligging ligt.
Maak lokale afspraken over de beschikbaarheid van de gynaecologen, anesthesiologen, het OK-team, de kinderartsen en verpleegkundigen.
Overwegingen
Literatuurstudie, welke voornamelijk is gebaseerd op 1 grote RCT14, toont tot op heden geen significant verschil aan in maternale en neonatale mortaliteit en morbiditeit tussen een primaire sectio caesarea en een vaginale partus voor ongecompliceerde tweelingzwangerschappen, waarbij het eerste kind in hoofdligging ligt.
De Cochrane van Hofmeyr et al. beschrijft een sectiopercentage van 42,9% in de vaginale partus groep en 9,1 % van de vrouwen beviel vaginaal terwijl een sectio caesarea was gepland.
De literatuurstudie laat geen significant voordeel zien van een sectio caesarea ten opzichte van een vaginale partus in maternale en neonatale mortaliteit en morbiditeit, echter de kans op complicaties voor moeder en kind op de lange termijn zoals uterusruptuur en abnormale invasie van de placenta in een volgende graviditeit zijn niet beschreven in deze studies. Uit de data van de NethOSS-registratie blijkt dat de prevalentie van een uterusruptuur bedraagt (2-7/1000) en van een placenta previa/accreta (4-8/1000). Een vaginale partus verdient daarom de voorkeur bij tweeling- zwangerschappen, waarbij het eerste kind in hoofdligging ligt, mits het een ongecompliceerde tweelingzwangerschap betreft. Een ongecompliceerde tweelingzwangerschap wordt gedefinieerd als: beide kinderen in leven, geschat gewicht bij echoscopische onderzoek tussen 1.500 en 4.000 gram bij AD 32+0 tot 38+6 weken. Deze richtlijn geldt niet voor gecompliceerde tweelingzwangerschappen zoals monoamniotische tweelingzwangerschappen, foetale reductie na AD 13 weken, letale congenitale afwijking, intra-uteriene groeirestrictie en contra-indicatie voor vaginale partus.
Bij het interpreteren van deze studie is de aanwezigheid van faciliteiten om een spoedsectio (binnen 30 minuten) te verrichten meegenomen, waarbij de gynaecologen, anesthesiologen, het OK-team, de kinderartsen en verpleegkundigen ten tijde van een vaginale partus bij een tweelingzwangerschap aanwezig waren.
De optimale termijn voor inleiding van een tweelingzwangerschap wordt onderzocht in een andere uitgangsvraag. Er is reeds literatuur waarin inleiding tussen 37+0 – 37+6 weken wordt aanbevolen 28.
Onderbouwing
Achtergrond
Tweelingzwangerschappen zijn geassocieerd met hogere perinatale mortaliteit en morbiditeit1-8. Deze zijn gerelateerd aan prematuriteit, maar ook complicaties tijdens de partus dragen hieraan bij. Het kind dat als tweede geboren wordt, heeft meer kans op een nadelige perinatale uitkomst in vergelijking met de eerstgeborene9-13.
Bij een vaginale partus van een tweelingzwangerschap is er 23-44% kans op een secundaire sectio14-17. Ook wanneer het eerste kind vaginaal ter wereld komt, is er 3 tot 7% kans op een secundaire sectio voor het tweede kind16;17.
Nadelige perinatale uitkomsten worden mogelijk vermeden wanneer men een primaire sectio caesarea verricht bij een tweelingzwangerschap. Echter, een sectio caesarea heeft nadelen voor de moeder en neonaat in de huidige en toekomstige zwangerschap(pen). Respiratoire morbiditeit treedt vaker op bij de neonaat na een sectio caesarea dan na een vaginale partus voor 39 weken18-21.
Bovendien is een sectio caesarea geassocieerd met een langere opnameduur van de moeder in het ziekenhuis en haemorrhagia postpartum.
De LEMMoN-studie liet een verhoogde kans op uterusextirpatie of embolisatie postpartum zien (RR 6,6 (95%-betrouwbaarheidsinterval (BI) 5,0–8,7)22.
Daarnaast neemt de kans op abnormale placenta invasie toe, vooral wanneer de patiënte meerdere sectio’s in de voorgeschiedenis heeft23;24.
In deze module worden aanbevelingen gedaan over de modus partus bij ongecompliceerde tweelingzwangerschappen, waarbij het eerste kind in hoofdligging ligt. Hierbij wordt uitgegaan van het ‘intention-to-treat’-principe waarbij men van een vaginale partus spreekt wanneer er een intentie is tot vaginale partus, ongeacht of de patiënte uiteindelijk vaginaal of per sectio caesarea bevalt.
Conclusies / Summary of Findings
|
Matig GRADE |
Er is geen significant verschil in neonatale en maternale mortaliteit en morbiditeit op de korte termijn (eerste 28 dagen postpartum) tussen een vaginale partus en primaire sectio voor ongecompliceerde tweelingzwangerschappen van AD 32+0 tot 38+6 weken, waarbij het eerste kind in hoofdligging ligt.
Bronnen: Hofmeyr et al. 2015 |
|
Matig GRADE |
Er is geen significant verschil in maternale mortaliteit en morbiditeit op de lange termijn tussen een vaginale partus en een primaire sectio voor ongecompliceerde tweelingzwangerschappen van AD 32+0 tot 38+6 weken, waarbij het eerste kind in hoofdligging ligt.
Bronnen: Hofmeyr et al. 2015 |
|
Matig GRADE |
Er is geen significant verschil in mortaliteit en morbiditeit bij kinderen op de lange termijn (2 jaar) tussen een vaginale partus en een primaire sectio voor ongecompliceerde tweelingzwangerschappen van AD 32+0 tot 38+6 weken, waarbij het eerste kind in hoofdligging ligt.
Bronnen: Asztalos et al. 2016 |
Samenvatting literatuur
Primaire uitkomstmaat
Wat is de neonatale uitkomst bij een primaire sectio caesarea dan wel vaginale partus bij een tweelingzwangerschap, waarbij het eerste kind in hoofdligging ligt, van AD 32+0 tot 38+6 weken op de korte termijn?
In een Cochrane-review (Hofmeyr et al. 2015) werden de neonatale en maternale korte- en lange- termijneffecten van een primaire sectio caesarea bij een tweelingzwangerschap vergeleken met een vaginale partus. Hiervoor werden RCT’s geselecteerd uit de ‘Cochrane Pregnancy and Childbirth Group’s Trials Register (18 november 2015)’. Twee auteurs beoordeelden onafhankelijk van elkaar de geselecteerde studies en bijbehorende referentielijsten, waarbij de kwaliteit van de studies werd geanalyseerd door middel van de GRADE-methode.
Twee studies werden geïncludeerd (Barrett et al. 201314, Rabinovici et al. 198727). De meeste data kwamen van een multicenter studie van Barrett waarin 2.804 vrouwen werden gerandomiseerd in 106 centra in 25 landen. Alle centra beschikten over de faciliteiten om binnen 30 minuten een sectio te verrichten en de gynaecologen, anesthesiologen, het OK-team, de kinderartsen en verpleegkundigen waren beschikbaar op het moment van de vaginale partus.
In de tweede studie (Rabinovici et al.) werden 60 vrouwen gerandomiseerd. Er werden monochoriale en bichoriale tweelingen geïncludeerd. De twee geïncludeerde studies leverden in totaal 2.864 vrouwen.
Het aantal vrouwen dat een sectio onderging werd in beide studies beschreven. In de primaire sectio groep onderging 90,9% van de vrouwen een sectio caesarea. In de vaginale partus groep werd bij 42,9% een sectio caesarea verricht.
Statistische analyse vond plaats op basis van het ‘intention-to-treat’-principe. Er werd geen significant verschil aangetoond tussen de groepen in perinatale mortaliteit en ernstige morbiditeit in de eerste 28 dagen postpartum (RR 1,15; 95% BI 0,80 – 1,67) op basis van de Barrett-studie (5565 neonaten, één studie, moderate quality of evidence).
Wanneer de uitkomstmaten apart van elkaar werden bekeken, bleek er ook geen significant verschil tussen de groepen voor perinatale of neonatale mortaliteit (RR 1,41; 95% BI 0,76 – 2,62; 5685 neonaten, twee studies, moderate quality of evidence), voor ernstige neonatale morbiditeit (RR 1,03; 95% BI 0,65 – 1,64; 5644 neonaten, twee studies, moderate quality of evidence) of één van de andere neonatale uitkomsten.
Wat is de maternale uitkomst bij een primaire sectio caesarea dan wel vaginale partus bij een tweelingzwangerschap, waarbij het eerste kind in hoofdligging ligt, van AD 32+0 tot 38+6 weken op de korte termijn?
De maternale mortaliteit en ernstige morbiditeit bij vrouwen die een sectio caesarea ondergingen ten opzichte van vrouwen die een vaginale partus ondergingen verschilden niet significant van elkaar (RR 0,86; 95% BI 0,67 – 1,11, twee studies, 2.844 vrouwen, moderate quality of evidence).
Deze uitkomstmaat werd beschreven bij beide RCT’s, echter alle bruikbare data waren afkomstig uit de Barrett-studie.
In de studie van Rabinovici waren geen patiënten overleden, in de studie van Barrett in elke groep één. De studies waren niet gepowerd op maternale uitkomsten.
Secundaire uitkomstmaat
Wat is de neonatale uitkomst bij een primaire sectio caesarea dan wel vaginale partus bij een tweelingzwangerschap, waarbij het eerste kind in hoofdligging ligt, van AD 32+0 tot 38+6 weken op de lange termijn?
Lange-termijn-effecten van een primaire sectio dan wel een vaginale partus bij een tweelingzwanger- schap worden beschreven in het artikel van Asztalos et al. (2016). In deze studie wordt de mortaliteit en neurologische ontwikkelingsachterstand op tweejarige leeftijd, een secundaire uitkomstmaat van de Twin Birth Study, geanalyseerd.
4.603 kinderen van het oorspronkelijke cohort van 5.565 kinderen (83%) konden hiervoor worden geïncludeerd. De kinderen werden gescreend door middel van ‘Ages en Stage Questionnaire’, waarna er voor kinderen met een abnormale score een klinische neurologische beoordeling volgde. Het effect van een primaire sectio versus vaginale partus op mortaliteit en neurologische ontwikkelings- achterstand werd gekwantificeerd door middel van een logistisch model.
Baseline-karakteristieken verschilden niet van elkaar. De gemiddelde leeftijd van de kinderen tijdens de beoordeling was 26 maanden. Ongeveer eenderde van de kinderen onderging een klinische neurologische beoordeling. Er werd geen significant verschil gevonden in de samengestelde uitkomstmaat mortaliteit of neurologische ontwikkelingsachterstand op tweejarige leeftijd: 5,99%
(139/2.320) in de primaire sectiogroep versus 5,85% (133/2283) in de vaginale partus groep (OR 1,04; 95%, BI 0,77-1,41, P = 0,79, 2.323 kinderen, één studie, moderate quality of evidence).
Wat is de maternale uitkomst bij een primaire sectio caesarea dan wel vaginale partus bij een tweelingzwangerschap, waarbij het eerste kind in hoofdligging ligt, van AD 32+0 tot 38+6 weken op de lange termijn?
De Cochrane-review van Hofmeyr laat geen klinisch relevante verschillen zien tussen de groepen na drie maanden. Borstvoeding werd gegeven door 84,4% vrouwen na een sectio caesarea en door 86,4% vrouwen na vaginale partus (p=0,13), gebaseerd op de studie van Barrett.
Er was geen significant verschil tussen de groepen in het falen van borstvoeding (RR 1,14; 95% BI 0,95 – 1,38, 2.570 vrouwen, één studie, moderate quality of evidence).
Kwaliteit van leven was in beide groepen nagenoeg gelijk. De gemiddelde lichamelijke en mentale ‘quality of life’-scores op basis van de ‘Short Form (36) health Survey (SF-36)’ waren respectievelijk 51,8 bij de sectiogroep versus 51,6 in vaginale partus groep (p=0,65) en 46,7 versus 46,0 (p=0,09).
De frequentie van waarschijnlijke depressie volgens de ‘Edinburgh Postnatal Depression Scale’ was 14,0% versus 14,8% (p=0,57). Er was geen significant verschil tussen de twee groepen in het aantal vrouwen met een score van meer dan 12 op de ‘Edinburgh Postnatal Depression Scale’ in de studie van Barrett (RR 0,95; 95% BI 0,78 –1,14, 1 studie, 2.570 vrouwen, moderate quality of evidence).
Urine-incontinentie kwam in 5,5% van de vrouwen bij een sectio voor versus 6,4% van de vrouwen bij een vaginale partus (p=0,31). Het gemiddelde incontinentie ‘Impact Questionnaire-7’ score was 20,5 versus 20,4 (p=0,99). Er werd geen significant verschil aangetoond tussen de twee groepen in urine (RR 0,87; 95% BI 0,64 – 1,18), flatus (RR 0,92; 95% BI 0,77 – 1,09) of faecale incontinentie (RR 1,02; 95% 0,69 – 1,51) (2.570 vrouwen, 1 studie (Barrett)).
Bewijskracht van de literatuur
De betrouwbaarheidsintervallen voor mortaliteit en morbiditeit zijn breed en overschrijden de GRADE-grenzen voor klinische relevantie. Op basis van de GRADE-afkapwaarden voor imprecisie is de bewijskracht voor de uitkomstmaten neonatale en maternale mortaliteit en morbiditeit van de Cochrane-studie met 1 niveau verlaagd. Risico op bias werd gegradeerd als ‘low’ voor alle categorieën, behalve ‘performance’ (‘high’) and ‘outcome assessment bias’ (‘unclear’). Aangezien de verwachting is dat deze ‘performance’ en ‘outcome assessment’ bias dusdanig weinig effect hebben op de uitkomst, werd hiervoor de bewijskracht niet verlaagd. De bewijskracht werd gegradeerd als ‘matig’. De bewijskracht van de RCT van Asztalos werd voor de uitkomstmaat neonatale mortaliteit en morbiditeit op de lange termijn gegradeerd als hoog, echter vanwege imprecisie is de bewijskracht met 1 niveau verlaagd.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Leidt een primaire sectio caesarea (I) tot lagere neonatale en maternale mortaliteit en morbiditeit (O) bij ongecompliceerde tweelingzwangerschappen met een zwangerschapsduur van 32+0 tot 38+6 weken, waarbij het eerste kind in hoofdligging ligt (P), in vergelijking tot een vaginale partus (C)?
P = ongecompliceerde tweelingzwangerschappen met een zwangerschapsduur van 32+0 tot 38+6 weken, waarbij het eerste kind in hoofdligging ligt
I = primaire sectio caesarea
C = vaginale partus
O = neonatale en maternale mortaliteit en morbiditeit
Primaire uitkomst
Neonataal: mortaliteit, ernstige morbiditeit (APGAR-score minder dan 4 na 5 min., twee of meer insulten binnen 72 uur, coma, vertraagde reactie op pijn, intubatie indicatie voor minimaal 24 uur, sepsis, necrotiserende enterocolitis, bronchopulmonale dysplasie, intraventriculaire bloeding graad 3 of 4, periventriculaire leucomalacie).
Maternaal: mortaliteit, ernstige morbiditeit (fluxus postpartum, (re-)laparotomie, trauma genitalia interna, veneuze trombo-embolie, levensbedreigende ziekte (zoals paralytische ileus), wondinfectie, heropname, wonddehiscentie).
Secundaire uitkomst
Neonataal/ kinderleeftijd: samengestelde uitkomstmaat mortaliteit en/of neurologische ontwikkelingsachterstand op tweejarige leeftijd.
Maternaal: urine of faecale incontinentie, borstvoeding, kwaliteit van leven, moeheid, depressie.
Relevante uitkomstmaten
De werkgroep achtte neonatale mortaliteit, ernstige neonatale morbiditeit, maternale mortaliteit en ernstige maternale morbiditeit op korte termijn voor de besluitvorming kritieke uitkomstmaten; en neonatale en maternale mortaliteit en morbiditeit op lange termijn voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Per uitkomstmaat:
De werkgroep hanteerde de afkapgrenzen van de GRADE ter bepaling van een klinisch (patiënt)
Relevant verschil, waarbij rekening wordt gehouden met het 95% betrouwbaarheidsinterval. Voor een klinisch relevant verschil wordt de afkapwaarde van 0,70 gehanteerd.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Embase.com), Cinahl (via EBSCO) en de Cochrane Library (via Wiley) is met relevante zoektermen gezocht naar studies die een primaire sectio caesarea vergeleken met vaginale partus bij ongecompliceerde tweelingzwangerschappen, waarbij het eerste kind in hoofdligging ligt.
De zoekverantwoording is weergegeven onder het tabblad Verantwoording.
De literatuurzoekactie leverde 239 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- Systematische reviews, Randomized Controlled Trials (RCT’s) of vergelijkend onderzoek;
- Gericht op de vergelijking van neonatale en maternale uitkomstmaten van een primaire sectio caesarea en een vaginale partus bij ongecompliceerde tweelingzwangerschappen tussen de 32+0 en 38+6 weken waarbij het eerste kind in hoofdligging ligt. In- en exclusiecriteria werden overgenomen uit de Twin Birth Study14. Ongecompliceerde tweelingzwangerschap werd gedefinieerd als: beide kinderen in leven, geschat gewicht bij echoscopisch onderzoek tussen respectievelijk 1500 en 4000 gram bij AD 32+0 tot 38+6 weken. Ook monochoriale biamniotische tweelingen worden hierin meegenomen mits ongecompliceerd (zonder Tweeling Transfusie Syndroom (TTS), Tweeling Anemie Polycythemie Sequentie (TAPS) of Selective Intrauterine Growth Restriction (sIUGR). Exclusiecriteria: monoamniotische tweelingzwangerschap, foetale reductie na AD 13 weken, letale congenitale afwijking, contra-indicatie voor vaginale partus.
Op basis van de titel en het abstract werden in eerste instantie 30 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 28 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en twee studies definitief geselecteerd (figuur 1).
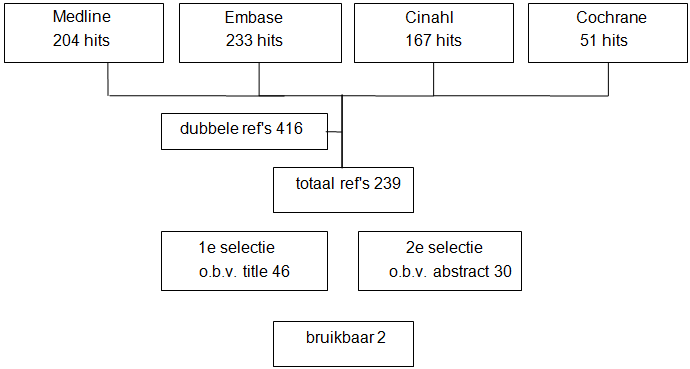
Figuur 1. Weergave selectieproces literatuur
Twee onderzoeken zijn opgenomen in de literatuuranalyse, namelijk: een Cochrane-review uit 2015 (Hofmeyr et al. 201525) en een artikel (Asztalos et al. 201626) dat is verschenen na de Cochrane review. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen.
De beoordeling van de individuele studieopzet (risk-of-bias) is opgenomen in de ‘risk-of-bias’- tabellen.
Referenties
- Barrett JF. Delivery of the term twin. Best Pract Res Clin Obstet Gynaecol 2004 Aug;18(4):625-30.
- Cheung YB, Yip P, Karlberg J. Mortality of twins and singletons by gestational age: a varying-coefficient approach. Am J Epidemiol 2000 Dec 15;152(12):1107-16.
- Fabre E, Gonzalez de AR, de Agustin JL, Perez-Hiraldo MP, Bescos JL. Perinatal mortality in twin pregnancy: an analysis of birth weight-specific mortality rates and adjusted mortality rates for birth weight distributions. J Perinat Med 1988;16(2):85-91.
- Gezer A, Rashidova M, Guralp O, Ocer F. Perinatal mortality and morbidity in twin pregnancies: the relation between chorionicity and gestational age at birth. Arch Gynecol Obstet 2012 Feb;285(2):353-60.
- Ghai V, Vidyasagar D. Morbidity and mortality factors in twins. An epidemiologic approach. Clin Perinatol 1988 Mar;15(1):123-40.
- Hartley RS, Emanuel I, Hitti J. Perinatal mortality and neonatal morbidity rates among twin pairs at different gestational ages: optimal delivery timing at 37 to 38 weeks' gestation. Am J Obstet Gynecol 2001 Feb;184(3):451-8.
- Joseph KS, Marcoux S, Ohlsson A, Liu S, Allen AC, Kramer MS, et al. Changes in stillbirth and infant mortality associated with increases in preterm birth among twins. Pediatrics 2001 Nov;108(5):1055-61.
- Kiely JL. The epidemiology of perinatal mortality in multiple births. Bull N Y Acad Med 1990 Nov;66(6):618-37.
- Arnold C, McLean FH, Kramer MS, Usher RH. Respiratory distress syndrome in second-born versus first-born twins. A matched case-control analysis. N Engl J Med 1987 Oct 29;317(18):1121-5.
- Bricelj K, Tul N, Lasic M, Bregar AT, Verdenik I, Lucovnik M, et al. Respiratory morbidity in twins by birth order, gestational age and mode of delivery. J Perinat Med 2016 Apr 18.
- Smith GC, Shah I, White IR, Pell JP, Dobbie R. Mode of delivery and the risk of delivery-related perinatal death among twins at term: a retrospective cohort study of 8073 births. BJOG 2005 Aug;112(8):1139-44.
- Swanson K, Grobman WA, Miller ES. The Association between the Intertwin Interval and Adverse Neonatal Outcomes. Am J Perinatol 2016 May 30.
- Wen SW, Fung Kee FK, Oppenheimer L, Demissie K, Yang Q, Walker M. Neonatal mortality in second twin according to cause of death, gestational age, and mode of delivery. Am J Obstet Gynecol 2004 Sep;191(3):778-83.
- Barrett JF, Hannah ME, Hutton EK, Willan AR, Allen AC, Armson BA, et al. A randomized trial of planned cesarean or vaginal delivery for twin pregnancy. N Engl J Med 2013 Oct 3;369(14):1295-305.
- Hack KE, Derks JB, Elias SG, van Mameren FA, Koopman-Esseboom C, Mol BW, et al. Perinatal mortality and mode of delivery in monochorionic diamniotic twin pregnancies >/= 32 weeks of gestation: a multicentre retrospective cohort study. BJOG 2011 Aug;118(9):1090-7.
- Persad VL, Baskett TF, O'Connell CM, Scott HM. Combined vaginal-cesarean delivery of twin pregnancies. Obstet Gynecol 2001 Dec;98(6):1032-7.
- Suzuki S. Risk factors for emergency cesarean delivery of the second twin after vaginal delivery of the first twin. J Obstet Gynaecol Res 2009 Jun;35(3):467-71.
- Berthelot-Ricou A, Lacroze V, Courbiere B, Guidicelli B, Gamerre M, Simeoni U. Respiratory distress syndrome after elective caesarean section in near term infants: a 5-year cohort study. J Matern Fetal Neonatal Med 2013 Jan;26(2):176-82.
- Hansen AK, Wisborg K, Uldbjerg N, Henriksen TB. Elective caesarean section and respiratory morbidity in the term and near-term neonate. Acta Obstet Gynecol Scand 2007;86(4):389-94.
- Prefumo F, Ferrazzi E, Di TM, Severi FM, Locatelli A, Chirico G, et al. Neonatal morbidity after cesarean section before labor at 34(+0) to 38(+6) weeks: a cohort study. J Matern Fetal Neonatal Med 2016;29(8):1334-8.
- Tita AT, Landon MB, Spong CY, Lai Y, Leveno KJ, Varner MW, et al. Timing of elective repeat cesarean delivery at term and neonatal outcomes. N Engl J Med 2009 Jan 8;360(2):111-20.
- Zwart JJ, Dijk PD, van RJ. Peripartum hysterectomy and arterial embolization for major obstetric hemorrhage: a 2-year nationwide cohort study in the Netherlands. Am J Obstet Gynecol 2010 Feb;202(2):150-7.
- Usta IM, Hobeika EM, Musa AA, Gabriel GE, Nassar AH. Placenta previa-accreta: risk factors and complications. Am J Obstet Gynecol 2005 Sep;193(3 Pt 2):1045-9.
- Cook JR, Jarvis S, Knight M, Dhanjal MK. Multiple repeat caesarean section in the UK: incidence and consequences to mother and child. A national, prospective, cohort study. BJOG 2013 Jan;120(1):85-91.
- Hofmeyr GJ, Barrett JF, Crowther CA. Planned caesarean section for women with a twin pregnancy. Cochrane Database Syst Rev 2015;12:CD006553.
- Asztalos EV, Hannah ME, Hutton EK, Willan AR, Allen AC, Armson BA, et al. Twin Birth Study: 2-year neurodevelopmental follow-up of the randomized trial of planned caesarean or planned vaginal delivery for twin pregnancy. Am J Obstet Gynecol 2016 Mar;214(3):371.
- Rabinovici J, Barkai G, Reichman B, Serr DM, Mashiach S. Randomized management of the second nonvertex twin: vaginal delivery or cesarean section. Am J Obstet Gynecol 1987 Jan;156(1):52-6.
- Cheong-See F, Schuit E, Arroyo-Manzano D, Khalil A, Barrett J, Joseph K S et al. Prospective risk of stillbirth and neonatal complications in twin pregnancies: systematic review and meta-analysis. BMG 2016 Sep; 354 :i4353
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: Does an elective caesarean delivery (I) lead to less neonatal and maternal morbidity and mortality (O) in term uncomplicated twin pregnancies with the first twin in vertex position (P) compared to
a vaginal delivery (C)?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Hofmeyr, 2015
[individual study characteris tics deduced from Hofmeyr, 2015] |
SR and meta- analysis of 2 RCTs
Literature search up to November 18, 2015
A: Rabinovici, 1987 B: Barrett, 2013.
Study design: systematic review
Setting and Country: A: Chaim Sheba Medical Center, Tel-Hashomer, Israel B: 106 centres with facilities to perform an emergence caesarean section and anaesthetic, obstetrical and nursing staff in the hospital at time of planned vaginal delivery in 25 countries. Randomization at |
Inclusion criteria SR: RCTs comparing policy of caesarean section with planned vaginal birth for women with twin pregnancy
Exclusion criteria SR: brief abstract
2 studies included
Important patient characteristics at baseline:
A: 60 patients Baseline imbalance: caesarean section n = 27 versus vaginal n = 33 B: 2804 patients caesarean section n = 1392 versus vaginal n = 1392 Groups comparable at baseline (parity, |
Intervention: A: caesarean section B: caesarean section |
Control: A: vaginal delivery B: vaginal delivery |
End-point of follow-up: A: not reported B: primary outcome: 28 days postpartum secondary outcome: up to 2 years
For how many participants were no complete outcome data available? (intervention/control) A: (intervention 0/control 6 ) B: (intervention 1/control 1) |
Maternal death or serious maternal morbidity, neonatal death or serious neonatal morbidity, perinatal or neonatal death, serious neonatal morbidity, longterm maternal outcomes – failure to breastfeed, longterm maternal outcomes – postnatal depression (> 12 EPDS) Effect measure: RR,(95% CI):
Maternal death or serious maternal morbidity A: not estimable B: RR 0,86 (95% CI 0,67 – 1,11)
Perinatal or neonatal mortality and serious morbidity A: not reported B: RR 1,15 (95% CI 0,80 – 1,67)
Perinatal or neonatal death A: not estimable B: RR 1,41 (95% CI 0,76 – 2,62)
Serious neonatal morbidity A: not estimable B: RR 1,03 (95% CI 0,65 – 1,64)
Longterm maternal outcomes – failure to breastfeed |
Authors conclude that in twin pregnancy between 32 weeks 0 days and 38 weeks 6 days of gestation, with the first twin in cephalic presentation, planned cesarean delivery did not significantly decrease or increase the risk of fetal or neonatal death or serious neonatal morbidity, as compared with planned vaginal delivery.
Data mainly from one large, multicenter study.
Level of evidence: GRADE MODERATE |
|
|
the Centre for Mother, Infant, and Child Research at Sunnybrook Health Sciences Centre in Toronto, Canada.
Source of funding: A: non-commercial B: non-commercial |
gestational age, maternal age, chorionicity, national perinatal mortality in mothers country of residence, estimated fetal weight)
|
|
|
|
A: not reported B: RR 1,14 (95% 0,95 – 1,38)
Longterm maternal outcomes – postnatal depression (EPD >12) A: not reported B: RR 0,95 (95% 0,78 – 1,14)
Longterm maternal outcomes – urinary incontinence A: not reported B: RR 0,87 (95% 0,64 – 1,18)
Meta-analysis
Maternal death or serious maternal morbidity RR 0,86 (95% CI 0,67 – 1,11) Heterogeneity: not applicable
Perinatal or neonatal death or serious neonatal morbidity RR 1,15 (95% CI 0,80 – 1,67) Heterogeneity: not applicable
Perinatal or neonatal death RR 1,41 (95% CI 0,76 – 2,62) Heterogeneity: not applicable
Serious neonatal morbidity RR 1,03 (95% CI 0,65 – 1,64) Heterogeneity: not applicable
Longterm maternal outcomes : failure to breastfeed RR 1,14 (95% 0,95 – 1,38) Heterogeneity: not applicable
Longterm maternal outcomes: postnatal depression (EPDS >12) RR 0,95 (95% 0,78 – 1,14) Heterogeneity: not applicable |
|
|
|
|
|
|
|
|
Longterm maternal outcomes: urinary incontinence RR 0,87 (95% 0,64 – 1,18) Heterogeneity: not applicable |
|
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10;doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken i into account?8
Yes/no/unclear |
Potential conflicts of nterest reported?9
Yes/no/unclear |
|
Hofmeyr, 2015 |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASEsearched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken).Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the
systematic review AND for each of the included studies.
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the
evidence table for studies of diagnostic test accuracy should be used.
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Asztalos, 2016 |
Type of study: RCT
Setting and country: Women with twin pregnancy from 106 centres with facilities to perform an emergence caesarean section and anaesthetic, obstetrical and nursing staff in the hospital at time of planned vaginal delivery in 25 countries, Dec 2003 – April 2011. Randomization at the Centre for Mother, Infant, and Child Research at Sunnybrook Health Sciences Centre in Toronto, Canada. |
Inclusion criteria: - twin pregnancy with first twin in cephalic position and both fetuses alive with EFW 1500 – 4000 g (confirmed by ultrasound < 7 weeks of randomisation)
and 38 weeks 6 days of gestation
Exclusion criteria:
N total at baseline: Intervention: 1172 women, 2320 children Control: 1151 women, 2283 |
Intervention: Planned caesarean section |
Control: Planned vaginal delivery |
Length of follow-up: Planned caesarean: mean 26,1 months (5th, 95th percentile 22-40 months) Planned vaginal: mean 25,8 months (5th, 95th percentile 23-37 months)
Loss-to-follow-up: Intervention: 396 Reasons: not reported
Control: 426 Reasons: not reported
Incomplete outcome data: Intervention: 68 Reason: not reported
Control: 73 Reason: not reported |
Death or neurodevelopomental delay: 139/2320 (5,99%) in the planned cesarean versus 133/2283 (5,83%) in the planned vaginal delivery group (OR, 1,04; 95% CI, 0,77-1,41, p = 0,79) |
There was no increase or decrease in the risk of death or neurodevelopmental delay at 2 years of age. |
|
|
Source of funding: Non- commercial |
children
Important prognostic factors2: Mean age at assessment, requirement of a clinical neurodevelopmental assessment to confirm or dispute the presence of a neurodevelopmental delay or cerebral palsy: similar in both groups
Groups were comparable at baseline (no significant between- group differences) |
|
|
|
|
|
|
Notes: |
|
|
1. |
Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case- |
|
|
control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures |
|
2. |
Provide data per treatment group on the most important prognostic factors [(potential) confounders] |
|
3. |
For case-control studies, provide sufficient detail on the procedure used to match cases and controls |
|
4. |
For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders |
Risk of bias table for intervention studies (randomized controlled trials)
Research question:
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Asztalos, 2016 |
Computarized randomization program stratified according to parity and gestational age |
unlikely |
likely |
likely |
unclear |
unlikely |
unlikely |
unlikely |
Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignment influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Exclusietabel
|
Auteur |
Jaartal |
Reden van exclusie |
|
Fumagalli |
2016 |
Retrospectieve studie |
|
Hutton |
2016 |
Antwoord op commentaar |
|
Hutton |
2015 |
Gepubliceerd voor Cochrane |
|
Dekeunink |
2015 |
Gepubliceerd voor Cochrane |
|
Seelbach |
2014 |
Gepubliceerd voor Cochrane |
|
Ganchimeg |
2014 |
Gepubliceerd voor Cochrane |
|
Wenckus |
2014 |
Gepubliceerd voor Cochrane |
|
Barrett |
2014 |
Gepubliceerd voor Cochrane |
|
Barrett |
2014 |
Gepubliceerd voor Cochrane |
|
Barrett |
2013 |
Gepubliceerd voor Cochrane |
|
Steins Bisschop |
2012 |
Gepubliceerd voor Cochrane |
|
Hofmeyr |
2011 |
Gepubliceerd voor Cochrane |
|
Rossi |
2011 |
Gepubliceerd voor Cochrane |
|
Pope |
2010 |
Gepubliceerd voor Cochrane |
|
Vendittelli |
2009 |
Gepubliceerd voor Cochrane |
|
Schmitz |
2009 |
Gepubliceerd voor Cochrane |
|
Herbst |
2008 |
Gepubliceerd voor Cochrane |
|
Bjelic |
2007 |
Gepubliceerd voor Cochrane |
|
Juhasz |
2004 |
Gepubliceerd voor Cochrane |
|
Barrett |
2004 |
Gepubliceerd voor Cochrane |
|
Hogle |
2003 |
Gepubliceerd voor Cochrane |
|
Colla |
2001 |
Gepubliceerd voor Cochrane |
|
Crowther |
2000 |
Gepubliceerd voor Cochrane |
|
Rydhstrom |
1991 |
Gepubliceerd voor Cochrane |
|
Rabinovici |
1988 |
Gepubliceerd voor Cochrane |
|
Rabinovici |
1987 |
Gepubliceerd voor Cochrane |
|
Heluin |
1981 |
Gepubliceerd voor Cochrane |
|
Heluin |
1979 |
Gepubliceerd voor Cochrane |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 12-11-2015
Beoordeeld op geldigheid : 12-11-2015
Voor het beoordelen van de actualiteit van deze richtlijnmodule is de Otterlo werkgroep (B.M.E. Adriaanse (AIOS), M.G. van Pampus/OLVG en C.J. Bax/Amsterdam UMC) verantwoordelijk, die in stand zal blijven. Uiterlijk in 2022 bepaalt de Otterlo werkgroep van de NVOG of deze module nog actueel is. De geldigheid van deze module komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn.
Algemene gegevens
De Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV) en Nederlandse Vereniging voor Kindergeneeskunde (NVK) hebben concepttekst ter beoordeling ontvangen.
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Dr. C.J. Bax, gynaecoloog, Amsterdam UMC, Nederlandse Vereniging voor Obstetrie & Gynaecologie
Dr. M.G. van Pampus, OLVG Amsterdam, Nederlandse Vereniging voor Obstetrie & Gynaecologie
Dr. B.M.E. Adriaanse (AIOS), Nederlandse Vereniging voor Obstetrie & Gynaecologie
Meelezers:
Leden van de Otterlo werkgroep (2016-2018)
Met ondersteuning van:
Dr. E.M.E. den Breejen, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van de NVOG.
Inbreng patiëntenperspectief
Met de Patiëntenfederatie Nederland heeft gedurende het ontwikkelproces contact plaatsgevonden over het patiëntenperspectief. De conceptrichtlijn is voor commentaar voorgelegd. De Patientenfederatie is geconsulteerd en onderschrijft deze module.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze module is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
De Otterlo werkgroep inventariseerde de knelpunten, stelde een long list met knelpunten op en prioriteerde de knelpunten.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse is door de werkgroepleden en de adviseur een uitgangsvraag opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad ‘Zoekverantwoording’ voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB)-tabellen. Het gebruikte RoB-instrument (AMSTAR – voor systematische reviews) is een gevalideerd instrument dat wordt aanbevolen door de Cochrane Collaboration.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Indien van toepassing: bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt)relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in één of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij één van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en deze worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, de kosten, de beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de module is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Pubmed (OVID) |
("Pregnancy, Twin"[Mesh] OR "Twins"[Mesh] OR twin*[tiab] OR multiple gestation[tiab]) AND ((Mode of delivery[tiab] OR delivery mode[tiab] OR ("Cesarean Section"[Mesh] OR cesarean[tiab] OR caesarean[tiab] OR c- section*[tiab] OR abdominal delivery[tiab]) AND ("Delivery, Obstetric"[Mesh:NoExp] OR "Labor, Induced"[Mesh] OR delivery[tiab] OR vaginal[tiab] OR labor[tiab] OR labour[tiab]))) AND ((("clinical trial"[pt] OR "randomized controlled trial"[pt] OR "clinical trials as topic"[mesh] OR "Randomized controlled trials as topic"[Mesh:NoExp] OR "Random Allocation"[Mesh] OR "Double-Blind Method"[Mesh] OR "Single-Blind Method"[Mesh] OR clinical trial, phase i[pt] OR clinical trial, phase ii[pt] OR clinical trial, phase iii[pt] OR clinical trial, phase iv[pt] OR controlled clinical trial[pt] OR randomized controlled trial[pt] OR multicenter study[pt] OR clinical trial[pt] OR random*[tiab] OR clinical trial*[tw] OR single blind*[tw] OR double blind*[tw] OR treble blind*[tw] OR triple blind[tw] OR single mask*[tw] OR double mask*[tw] OR treble mask*[tw] OR triple mask*[tw] OR "Placebos"[Mesh] OR placebo*[tw]) NOT ("animals"[Mesh] NOT "humans"[Mesh])) OR (("Meta- analysis"[pt] OR "Meta-analysis as topic"[Mesh] OR meta analy*[tw] OR systematic review*[tw] OR literature review*[tw] OR "review of the literature"[tw] OR systematic overview*[tw] OR "Review Literature as Topic"[Mesh] OR cochrane[tiab] OR "Cochrane Database syst rev"[Jour] OR "Evid Based child health"[Jour] OR "Cochrane libr"[Jour] OR embase[tiab] OR medline[tiab] OR psychlit[tiab] OR psyclit[tiab] OR cinahl[tiab] OR cinhal[tiab] OR cancerlit[tiab] OR ((selection criteria[tiab] OR data extraction[tiab]) AND "review"[pt])) NOT (Comment[pt] OR Editorial[pt] OR Letter[pt] OR ("animals"[mesh] NOT "humans"[mesh])))) |
204 |
|
Cinahl (via Ebscohost) |
(MH "Pregnancy, Twin" OR MH "Twins" OR TI (twin* OR ‘multiple gestation’) OR AB (twin* OR ‘multiple gestation’)) AND ( (TI (‘mode of delivery’ OR ‘delivery mode’) OR AB (‘mode of delivery’ OR ‘delivery mode’)) OR ( (MH "Cesarean Section+" OR TI (cesarean OR caesarean OR c-section OR ‘abdominal delivery’) OR AB (cesarean OR caesarean OR c- section OR ‘abdominal delivery’)) AND (MH "Delivery, Obstetric" OR TI (vaginal OR labor OR labour) OR AB (vaginal OR labor OR labour)))) |
167 |
|
Embase |
('twin pregnancy'/exp OR 'twins'/exp OR twin*:ab,ti OR ‘multiple gestation’:ab,ti) AND ((‘Mode of delivery’:ab,ti OR ‘delivery mode’:ab,ti OR ('cesarean section'/exp OR cesarean:ab,ti OR caesarean:ab,ti OR (c NEXT/1 section*):ab,ti OR ‘abdominal delivery’:ab,ti) AND (('delivery'/exp NOT 'cesarean section'/exp) OR delivery:ab,ti OR vaginal:ab,ti OR labor:ab,ti OR labour:ab,ti))) AND ((‘meta analysis'/exp OR 'meta analysis' OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/exp OR 'systematic review') OR ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single |
233 |
|
|
blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti)) NOT 'conference abstract':it NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
|
|
Cochrane |
(Twin*:ti or 'multiple gestation':ti) and (deliver*:ti or cesarean:ti or caesarean:ti or c-section:ti or vaginal:ti or labor:ti or labour:ti) |
51 |
