Screening op slaapproblemen en OSA bij kinderen met downsyndroom
Uitgangsvraag
Is screening middels polysomnografie geïndiceerd bij kinderen met downsyndroom?
Aanbeveling
Aanbeveling-1
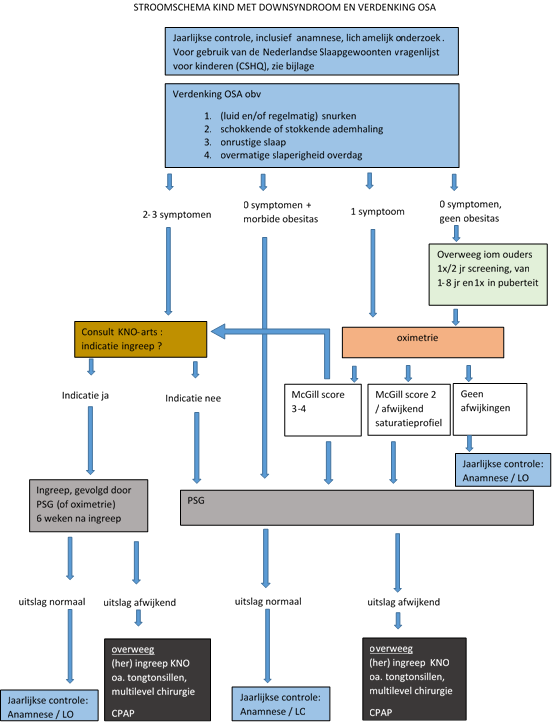
- Maak gebruik van een combinatie van onderzoeken om kinderen met downsyndroom te screenen op mogelijk onderliggend obstructief slaap apneusyndroom (OSA). Doe dit aan de hand van onderstaand screeningsvoorstel:
- vraag bij ieder regulier follow up consult naar symptomen suggestief voor OSA, in ieder geval;
- (luid en/of regelmatig) snurken;
- schokkende of stokkende ademhaling;
- onrustige slaap;
- overmatige slaperigheid overdag.
- Verwijs bij een positieve respons en sterke verdenking op OSA direct naar de KNO-arts, ter overweging van adenotomie en/of tonsillectomie en/of aanvullende behandeling. Verricht een polysomnografie (PSG) indien bij suggestieve symptomen niet wordt overgegaan tot een ingreep.
- Verricht bij milde verdenking (bijvoorbeeld bij slechts 1 van bovengenoemde symptomen) laagdrempelig een nachtelijk saturatieprofiel.
- Overweeg in overleg met de ouders een standaard screening op OSA door middel van een nachtelijk saturatieprofiel, tenminste 1x/per 2 jaar. Doe dit vanaf een leeftijd van 1 jaar tot 8 jaar en daarna nog ten minste een keer na inzetten van de puberteit. Doe de meting zo mogelijk buiten een periode met tekenen van een virale infectie.
- Overweeg bij een saturatieprofiel sterk verdacht voor ernstige OSA (McGill score 3 tot 4, zie Tabel 2) rechtstreeks naar de KNO-arts te verwijzen of verricht aanvullend een PSG. Indien adenotonsillectomie al plaatsgevonden heeft, verwijzen naar gespecialiseerd centrum.
- Bij anderszins afwijkend saturatieprofiel overweeg verwijzing voor PSG:
- McGill score 2 (zie tabel 2);
- >4 desaturaties per uur van tenminste 4% (ODI4% >4);
- langdurige (> 2 minuten) desaturaties <90%;
- anderszins visueel afwijkend saturatieprofiel.
Tabel 2 McGill score beoordeling nachtelijk saturatieprofiel
|
Oximetry Score |
Comment |
Criteria |
|||
|
No. of drops* in SaO2 <90% |
No. of drops* in SaO2 <85% |
No. of drops* in SaO2 <80% |
Other |
||
|
1 |
Normal study/ inconclusive for OSA |
<3 |
0 |
0 |
Baseline: stable (<3 clusters of desa-turation) and >95% |
|
2 |
OSA, mild |
≥3 |
≤3 |
0 |
Three or more clusters of desaturation events |
|
3 |
OSA, moderate |
≥3 |
>3 |
≤3 |
Three or more clusters of desaturation events |
|
4 |
OSA, severe |
≥3 |
>3 |
>3 |
Three or more clusters of desaturation events |
Uit: Nixon (2004). Het aantal "drops" betreft het aantal clusters van saturatiedalingen per nacht.
(voor visuele voorbeelden: zie bijlage ‘Mc Gill 1 tot en met 4’)
Aanbeveling-2
Verricht een polysomnografie (PSG) in de volgende additionele situaties:
- na verrichten van ATE in verband met matig/ernstig OSA (ten minste 6 weken na ingreep);
- bij het bestaan en/of ernstige toename van (morbide) obesitas;
- na opstarten van CPAP-ondersteuning ter controle van het effect.
Eventueel kan voor punt 1 t/m 3 volstaan worden met een oximetriemeting.
Heb bij de jaarlijkse anamnese aandacht voor problemen van insomnie, gefragmenteerde slaap en matige slaapefficiëntie, waarbij gebruik gemaakt kan worden van de voor kinderen gevalideerde slaapgewoonten vragenlijst (CSHQ), eventueel tezamen met actigrafie. Start zonodig gedragsgerichte en/of pedagogische interventies.
Stroomschema kind met downsyndroom en verdenking OSA
Overwegingen
Hoewel de exacte prevalentie van obstructieve OSA (AHI> 1) bij kinderen met downsyndroom onbekend is, wordt deze geschat op meer dan 50% (Lee, 2018). Een verstoorde slaap door OSA is geassocieerd met verminderde cognitie, verstoorde spraaktaalontwikkeling, en toegenomen gedragsproblematiek. Er bestaat consensus onder internationale experts dat bij een AHI van > 5/uur behandeling geïndiceerd is, en er zijn goede behandelmogelijkheden bij kinderen met downsyndroom. Derhalve adviseren meerdere internationale richtlijnen (Bull, 2011; Royal College of Paediatric and Child Health, 2009) actieve opsporing van OSA middels screening bij kinderen met downsyndroom. De vraag blijft echter wat de meest optimale methode van screening is.
De meest eenvoudige en goedkope manier van screening zou zijn op basis van anamnese en lichamelijk onderzoek. Dit zou bovendien het grote voordeel hebben dat uitsluitend kinderen met aantoonbare klinische klachten van hun OSA gedetecteerd zouden worden. Helaas concludeert onder andere de Nederlandse OSAS richtlijn in 2013 (CBO, 2013) op basis van literatuuronderzoek dat “anamnese en lichamelijk onderzoek onbetrouwbaar zijn voor het stellen van de diagnose OSAS bij kinderen”. Een review van Brietzke (2004) rapporteerde dat gemiddelde sensitiviteit en specificiteit van de 4 meest voorkomende symptomen van OSA niet hoger bleek dan 65%, en dat de gemiddelde positief voorspellende waarde van anamnese en lichamelijk onderzoek 56% was bij kinderen zonder downsyndroom. De in de literatuursamenvatting beschreven studie van Shott (2006) toont dat ook binnen de groep van kinderen met downsyndroom symptomen die suggestief zouden zijn voor OSA slechts een lage sensitiviteit en specificiteit hebben voor de diagnose van OSA, respectievelijk 23% en 61%. Een studie in België in een niet geselecteerde populatie van kinderen met downsyndroom liet zien dat 53% van de kinderen zonder symptomen toch een AHI > 1 scoorden (Maris, 2016).
Screening op OSA is relevant indien de gevonden afwijkingen ook behandelconsequenties hebben, volgens internationale consensus ligt de grens daarvoor bij een obstructieve AHI >5. De in de PICO beschreven studie door Shott (2006) toonde aan dat zelfs in de groep van de kinderen die een obstructieve AHI > 5 bleken te hebben, ouders geen regelmatig snurken rapporteerden in 46% van de gevallen. In dit kader is het van belang te realiseren dat ouders van kinderen met downsyndroom relatief weinig klachten lijken te rapporteren, ten opzichte van ouders van kinderen zonder downsyndroom, bij overigens vergelijkbare ernst van OSA geobjectiveerd met PSG (Lin, 2014). In de afweging of en wanneer screening op OSA moet plaats vinden dient men zich te realiseren dat ook op latere leeftijd OSA kan ontstaan, zelfs als een PSG eerder normaal is geweest. Hoewel in het algemeen behandeling wordt geadviseerd bij AHI > 5, blijken sommige kinderen met OSA gediagnostiseerd in het eerste levensjaar in de navolgende jaren spontaan over die symptomen heen te groeien (Rosen, 2011). Zoals in de module 'Behandeling van OSA' is beschreven hebben kinderen met downsyndroom een verhoogd risico op persisterende OSA na behandeling met ATE, waardoor richtlijnen adviseren om na operatief ingrijpen controle PSG te verrichten (ERS). Men moet er ook op bedacht zijn dat OSA op een later tijdstip kan recidiveren.
Als gevolg van deze complexe relatie tussen symptomen en de diagnose van OSA stellen (inter)nationale richtlijnen dat screening op OSA bij kinderen met downsyndroom middels anamnese en lichamelijk onderzoek alleen niet afdoende is (Bull, 2011; CBO, 2013; Hill, 2018; Kaditis, 2016; Royal College of Paediatric and Child Health, 2009). De meest toonaangevende Amerikaanse richtlijn uit 2011 adviseert dat alle kinderen met downsyndroom tenminste een PSG dienen te ondergaan vóór de leeftijd van 5 jaar, en eerder bij suggestieve symptomen (AAP) (Bull, 2011). Hoewel PSG geaccepteerd is als de enige gouden standaard voor de diagnose van OSA zitten er evidente nadelen aan. PSG wordt vaker slecht verdragen door kinderen met downsyndroom, het is arbeidsintensief en duur. Bovendien vereist het vaak een ziekenhuisopname, met grote kans dat het slaapverloop anders is dan gebruikelijk. De OSAS richtlijn uit 2013 (CBO, 2013) stelt dat polysomnografie voor kinderen niet overal beschikbaar is in Nederland en dat de arts de diagnose OSA dan toch zal moeten overwegen op basis van anamnese en lichamelijk onderzoek.
Goedkopere, minder belastende en beter beschikbare alternatieven voor PSG zijn onderzocht. De in de literatuursamenvatting beschreven studie van Hill (2018) beschrijft oximetrie, in het bijzonder de uitkomstmaten delta12s index en de ODI, als een sensitieve maat om bij kinderen met downsyndroom te screenen op matige tot ernstige OSA. Een dergelijk screeningsbeleid werd reeds in 2009 door de UK consensus groep geadviseerd (Hill, 2018; Royal College of Paediatric and Child Health, 2009). Hoewel de screening met deze parameters tot een acceptabele sensitiviteit leidt (92%), is de consequentie dat bij ongeveer de helft van alle kinderen met downsyndroom alsnog een PSG zal moeten worden verricht om een vals positief resultaat uit te sluiten. Exacte data over de Nederlandse situatie ontbreken, maar een dergelijk beleid zou een forse toename betekenen ten opzichte van het huidige verwijsbeleid voor PSG bij downsyndroom. Een eerder gebruikte methode om nachtelijke oximetrie te analyseren is de McGill score (Nixon, 2004), gebaseerd op het aantal clusters van saturatiedalingen < 90, 85 en 80% gedurende de nacht. Een hoge McGill score (≥ 3) heeft een specificiteit van 98% voor het bestaan van OSA, maar de lage sensitiviteit (geschat 25% op basis van Coverstone (2014)) maakt deze score ongeschikt als screeningtool.
Bij NO kinderen zijn de waarden van biomarkers in urine een maat gebleken voor het bestaan van OSA, maar deze methode is vanwege een ander biomarkerprofiel bij kinderen met downsyndroom (onafhankelijk van het bestaan van OSA) niet bruikbaar (Elsharkawi, 2017; Skotko, 2017). Over dit type onderzoek werden geen vergelijkende studies gevonden.
Brockmann (2016) liet zien dat polysomnografie in de thuissituatie met een draagbare device in 83% van kinderen met downsyndroom na eenmalig onderzoek bruikbare resultaten gaf (n= 37, gemiddelde leeftijd 3 jaar), en dit resultaat werd bevestigd door Ikizoglu (2019). De groep van Hill deed onderzoek naar polygrafie (PG) in de thuissituatie en rapporteerde gemiddeld 1,3 studies nodig te hebben voor een bruikbare registratie, tegenover 1,2 studie per kind in een intramurale setting (Kingshott, 2019).
Andere slaapproblemen
Naast OSA heeft een groot deel van de kinderen met downsyndroom slaapproblemen zoals insomnie, rusteloze slaap, parasomnieën en slaperigheid overdag. Vragenlijsten kunnen gedrag gerelateerde insomnie, parasomnieën en slaperigheid overdag goed detecteren (Bassell, 2015; Esbensen, 2017; Nixon, 2004). De Children’s Sleep Habits Questionnaire(CSHQ) is ook voor Nederland gevalideerd (Waumans, 2010). Het is belangrijk dat zorgverleners hier aandacht aan besteden, omdat er een duidelijke relatie bestaat met gedragsproblemen en neurocognitieve vermogens (zie de module 'Slaappatroon'). Ook voor deze problematiek blijkt dat ouders minder vaak spontaan melding maken van symptomen, dan wanneer er systematisch navraag naar wordt gedaan (Hoffmire, 2014). Actigrafie geeft beter dan vragenlijstresultaten aan wat het rust- en activiteitenpatroon is als een weerspiegeling van het slaap-waak ritme (Ashworth, 2013). Een combinatie van vragenlijsten en actigrafie kan dus inzicht geven in verschillende aspecten van de slaap(problematiek) (Esbensen, 2018), maar is weinig bijdragend in de diagnostiek van OSA.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Screening op en behandeling van slaapproblematiek bij kinderen met downsyndroom verhoogt kosten. Echter, de verwachting is dat bij een aanzienlijk deel van de kinderen sprake is van klinisch relevante slaapproblematiek en dat adequate diagnostiek en behandeling hiervan leidt tot beter gedragsmatig, cognitief en sociaal functioneren in het dagelijks leven. De winst van screening weegt daarmee op tegen de toegenomen kosten. Een nadeel inherent aan screening is dat een deel van de kinderen zonder klinisch relevante pathologie worden blootgesteld aan medische onderzoeken. Naast anamnese wordt nu oximetrie geadviseerd als screenende test; over het algemeen wordt dit onderzoek als weinig belastend ervaren en wordt het goed verdragen door kinderen met downsyndroom.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Het is mogelijk dat bij de introductie van deze screening weerstand ontstaat bij ouders op basis van de angst te veel te medicaliseren. Anderzijds zullen ouders tevreden zijn wanneer gezondheidswinst behaald wordt.
Haalbaarheid en implementatie
Er zal een implementatiefase nodig zijn waarbij er binnen de 2e lijns zorg beschikbaarheid van devices voor thuisoximetrie gaan komen, en de kennis bij kinderartsen ten aanzien van het interpreteren van de uitslagen op peil komt. Ook informatie rond dit onderwerp voor ouders en andere hulpverleners in de zorg voor kinderen met downsyndroom is van groot belang.
Onze verwachting is dat er opschaling zal moeten plaatsvinden van capaciteit voor PSG bij slaappoli’s en expertisecentra en in enige mate ook voor CPAP. Dit is mogelijk via de reguliere financiering verzekerde zorg.
Aanbevelingen ten aanzien van screening op OSA:
De huidige literatuur maakt duidelijk dat een beleid om OSA bij kinderen met downsyndroom actief op te sporen wenselijk is. Verschillende recente buitenlandse richtlijnen adviseren ook in afwezigheid van klachten standaard screening met PSG of oximetrie te verrichten. Hoewel exacte aantallen ontbreken, is het aannemelijk dat er momenteel in Nederland sprake is van onderdiagnostiek ten aanzien van OSA bij kinderen met downsyndroom. Derhalve formuleren wij een nieuw voorstel voor screening bij downsyndroom in Nederland.
Wij baseren dit voorstel (zie aanbevelingen) op de volgende uitgangspunten:
- Prevalentie van matig tot ernstig OSA (obstructieve AHI > 5) lijkt verhoogd bij kinderen met downsyndroom, onder andere 14% in studie van Hill (2014) in ongeselecteerde kinderen met downsyndroom (Hill, 2014) tot mogelijk meer dan 30% (Lee, 2018), zie de module 'Slaappatroon'.
- Symptomen en lichamelijk onderzoek zijn onvoldoende sensitief om matig tot ernstig OSA te diagnosticeren.
- Er bestaat internationale consensus dat bij matig tot ernstig OSA een indicatie bestaat voor behandeling en er zijn goede opties voor behandeling bij kinderen met downsyndroom (zie de module 'Behandeling van OSA').
- OSA kan bij downsyndroom op iedere leeftijd ontstaan en de ernst kan variëren in de tijd.
- Na een aanvankelijke verbetering bijvoorbeeld door ATE kan later opnieuw OSA ontstaan.
- PSG is duur, belastend onderzoek en is beperkt beschikbaar.
- In andere landen is de ervaring met PSG en oximetrie in de groep downsyndroom groter (VS, UK, Australië, België).
Onderbouwing
Achtergrond
In Nederland wordt bij verdenking op slaapproblematiek/ slaapapneu weinig gebruik gemaakt van polysomnografie om het probleem te kwantificeren, vanwege de moeilijke uitvoerbaarheid/grote belasting voor de patiënt. Is er sprake van onderdiagnostiek? De vraag is of er op andere wijze dan met polysomnografie ook een goed beeld te krijgen is over de aard en ernst van de slaapproblemen.
Conclusies / Summary of Findings
|
Low GRADE |
It is not certain whether measurement of delta 12s index, as measured by home pulse oximetry, could be used as a screening tool for OSA in children with Down syndrome, compared to polygraphy.
Sources: (Hill, 2018) |
|
Very low GRADE |
It is unsure whether using a non-validated parental questionnaire, could be used as a screening tool for sleep problems in children with Down syndrome, compared to polysomnography.
Sources: (Shott, 2006) |
Samenvatting literatuur
Description of studies
The study by Hill (2018), investigated whether home pulse oximetry could be a screening tool for discriminating children at moderate to high risk of OSA, who need further diagnostic sleep study. In a cross-sectional prospective study, children with Down syndrome, aged 0.5 to 6 years, were included via paediatricians, advertising to local support groups, the Down Syndrome Association website and word of mouth between parents. All children were analysed by home pulse oximetry and polygraphy. Based on ROC-curves, cut off points for oxygen desaturation measures were defined. Threshold choices prioritised sensitivity over specificity to identify as many true positives as possible. Cut off for OSA diagnosis was ≥ 5 obstructive events/hour. Data were analysed blinded to the child’s clinical status. As a validation sample, the author’s analysed single-centre retrospective clinical data from 57 children with Down syndrome, clinically evaluated for OSA in Southampton.
The second study, by Shott (2006), aimed to determine the incidence of OSA in children with Down syndrome by non-validated parental questionnaire. In a prospective cohort study in a tertiary pediatric referral center, 65 children with Down syndrome, aged 2 years or younger at study entry, were included in the study. Of these, 56 were able to complete a full sleep study. It is unclear what questionnaire was used and when results of this index test were considered positive. Results of the questionnaire were compared to results of PSG. PSG was considered abnormal if: obstructive index > 1, or CO2 level > 45 mm Hg for more than 2/3 of the study, or pCO2 > 50 mm Hg for >10% of the study, or - hypoxemia < 92% during sleep, or repeated intermittent desaturations < 90%, or arousal index > 10 and associated with increased work of breathing.
Results
In the study by Hill (2018), the prevalence of moderate to severe OSA (obstructive AHI > 5) in an unselected population of DS children was 14% (140/1000). The best predictor of OSA by home pulse oximetry (HPO) was “delta 12 s index”, which was defined as the absolute difference between successive 12 s interval recordings, which serves as a measure of baseline SpO2 variability. Sensitivity and specificity for delta 12s index were 92% (95% CI: 74 to 99%) and 65% (95% CI: 57 to 73%), respectively. Predicting OSA status, by delta 12s index, in the validation sample yielded the same sensitivity (92%) and similar specificity (63% versus 65%). When combining these sensitivity and specificity with a prevalence (pre-test probability) of OSA in children with Down syndrome of 14% (Hill, 2016), values in table 1 can be calculated: per 1000 children with Down syndrome, home pulse oximetry identifies 129 children correctly as having OSA, 11 children will be incorrectly identified as healthy. Also, 301 children will be incorrectly classified by HPO as having OSA.
Table 1 Test characteristics when predicting OSA using delta 12s index by home pulse oximetry
|
Uitkomst |
Effect per 1.000 patients tested |
|
Pre-test probability 14% |
|
|
True positive |
129 (104 to 139) |
|
False negative |
11 (1 to 36) |
|
True negative |
559 (490 to 628) |
|
False positieve |
301 (232 to 370) |
Hill (2018) also calculated sensitivity and specificity for 3% oxyhaemoglobin desaturation index (3% ODI). These were comparable to delta 12s index in the original study: 92% (95% CI: 74 to 99%) and 63% (95% CI: 55 to 71%). However, specificity was lower in the validation sample (39% (95% CI: 24 to 57%)). Other measures of HPO showed lower sensitivity in the original study: SpO2 < 90% min/AF hour (60% (39 to 79%)), mean spO2 (72% (51 to 88%)) and minimum SpO2 (84% (64 to 95%)).
When using a parental questionnaire as a screening tool for sleep problems in children with Down syndrome, Shott (2006), found a sensitivity and specificity of 0.23 and 0.61 respectively. These values are of no clinical significance. Confidence intervals were not described.
Level of evidence of the literature
The level of evidence regarding the diagnostic accuracy of home pulse oximetry was downgraded by 2 levels because of study limitations (risk of bias) and number of included patients (imprecision).
The level of evidence regarding the diagnostic accuracy of a non-validated parental questionnaire on sleep problems was downgraded by 3 levels because of study limitations (risk of bias); applicability (bias due to indirectness) and number of included patients (imprecision).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the value of available screening methods for the detection of sleep disorders in children with Down syndrome, compared to the gold standard of poly(somno)graphy?
P: children with Down syndrome;
I: screening tests on sleep disorders (sleep efficiency, sleep apnea, insomnia, sleep disturbance, sleep position, snoring) other than poly(somno)graphy;
C: screening by poly(somno)graphy as (surrogate) gold standard;
O: diagnostic accuracy of index test (sensitivity, specificity, positive and negative predictive values, true positives, true negatives, false positives, and false negatives).
Relevant outcome measures
The guideline development group considered sensitivity and specificity as a critical measure for decision making and tolerance as important outcome measures for decision making.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from January 1st 1999 until September 3rd 2019. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 124 hits. Studies were selected based on the following criteria: systematic review, meta-analysis, randomized controlled trial, or comparative observational study. The patient population consisted of Down syndrome patients, aged 0 to 18 years, and compared the index test to polygraphy or polysomnography. Thirty-three studies were initially selected based on title and abstract screening. After reading the full text, 31 studies were excluded (see the table with reasons for exclusion under the tab Methods) and 2 studies were included.
Results
Two studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Ashworth, A., Hill, C. M., Karmiloff-Smith, A., & Dimitriou, D. (2013). Cross syndrome comparison of sleep problems in children with Down syndrome and Williams syndrome. Research in developmental disabilities, 34(5), 1572–1580.
- Bassell, J. L., Phan, H., Leu, R., Kronk, R., & Visootsak, J. (2015). Sleep profiles in children with Down syndrome. American Journal of Medical Genetics Part A, 167(8), 1830–1835.
- Brietzke, S. E., Katz, E. S., & Roberson, D. W. (2004). Can history and physical examination reliably diagnose pediatric obstructive sleep apnea/hypopnea syndrome? A systematic review of the literature. Otolaryngology—Head and Neck Surgery, 131(6), 827–832.
- Brockmann, P. E., Damiani, F., Nunez, F., Moya, A., Pincheira, E., Paul, M. A., & Lizama, M. (2016). Sleep-disordered breathing in children with Down syndrome: Usefulness of home polysomnography. International Journal of Pediatric Otorhinolaryngology, 83, 47–50.
- Bull, M. J., & Committee on Genetics. (2011). Health supervision for children with Down syndrome. Pediatrics, 128(2), 393–406. https://doi.org/10.1542/peds.2011-1605.
- CBO. (2013). Richtlijn non-invasieve beademing tijdens acute respiratoire insufficiëntie bij COPD.
- Coverstone, A. M., Bird, M., Sicard, M., Tao, Y., Grange, D. K., Cleveland, C., Molter, D., & Kemp, J. S. (2014). Overnight pulse oximetry for evaluation of sleep apnea among children with trisomy 21. Journal of Clinical Sleep Medicine, 10(12), 1309–1315.
- Elsharkawi, I., Gozal, D., Macklin, E. A., Voelz, L., Weintraub, G., & Skotko, B. G. (2017). Urinary biomarkers and obstructive sleep apnea in patients with Down syndrome. Sleep medicine, 34, 84–89.
- Esbensen, A. J., & Hoffman, E. K. (2017). Reliability of parent report measures of sleep in children with Down syndrome. Journal of Intellectual Disability Research, 61(3), 210–220.
- Esbensen, A. J., & Hoffman, E. K. (2018). Impact of sleep on executive functioning in school-age children with Down syndrome. Journal of Intellectual Disability Research, 62(6), 569–580.
- Hill, C. M., Elphick, H. E., Farquhar, M., Gringras, P., Pickering, R. M., Kingshott, R. N., Martin, J., Reynolds, J., Joyce, A., Gavlak, J. C., & Evans, H. J. (2018). Home oximetry to screen for obstructive sleep apnoea in Down syndrome. Archives of Disease in Childhood, 103(10), 962–967. https://doi.org/10.1136/archdischild-2017-314409
- Hill, C. M., Evans, H. J., Elphick, H., Farquhar, M., Pickering, R. M., Kingshott, R., Martin, J., Reynolds, J., Joyce, A., & Rush, C. (2016). Prevalence and predictors of obstructive sleep apnoea in young children with Down syndrome. Sleep medicine, 27, 99–106.
- Hoffmire, C. A., Magyar, C. I., Connolly, H. V., Fernandez, I. D., & van Wijngaarden, E. (2014). High prevalence of sleep disorders and associated comorbidities in a community sample of children with Down syndrome. Journal of Clinical Sleep Medicine, 10(4), 411–419.
- Ikizoglu, N. B., Kiyan, E., Polat, B., Ay, P., Karadag, B., & Ersu, R. (2019). Are home sleep studies useful in diagnosing obstructive sleep apnea in children with down syndrome? Pediatric pulmonology, 54(10), 1541–1546.
- Kaditis, A. G., Alvarez, M. L. A., Boudewyns, A., Alexopoulos, E. I., Ersu, R., Joosten, K., Larramona, H., Miano, S., Narang, I., & Trang, H. (2016). Obstructive sleep disordered breathing in 2-to 18-year-old children: Diagnosis and management. European Respiratory Journal, 47(1), 69–94.
- Kingshott, R. N., Gahleitner, F., Elphick, H. E., Gringras, P., Farquhar, M., Pickering, R. M., Martin, J., Reynolds, J., Joyce, A., & Gavlak, J. C. (2019). Cardiorespiratory sleep studies at home: Experience in research and clinical cohorts. Archives of disease in childhood, 104(5), 476–481.
- Lee, C.-F., Lee, C.-H., Hsueh, W.-Y., Lin, M.-T., & Kang, K.-T. (2018). Prevalence of obstructive sleep apnea in children with Down syndrome: A meta-analysis. Journal of Clinical Sleep Medicine, 14(5), 867–875.
- Lin, S. C., Davey, M. J., Horne, R. S., & Nixon, G. M. (2014). Screening for obstructive sleep apnea in children with Down syndrome. The Journal of pediatrics, 165(1), 117–122.
- Maris, M., Verhulst, S., Wojciechowski, M., Van de Heyning, P., & Boudewyns, A. (2016). Prevalence of obstructive sleep apnea in children with Down syndrome. Sleep, 39(3), 699–704.
- Nixon, G. M., Kermack, A. S., Davis, G. M., Manoukian, J. J., Brown, K. A., & Brouillette, R. T. (2004). Planning adenotonsillectomy in children with obstructive sleep apnea: The role of overnight oximetry. Pediatrics, 113(1), e19–e25.
- Rosen, D. (2011). Management of obstructive sleep apnea associated with Down syndrome and other craniofacial dysmorphologies. Current opinion in pulmonary medicine, 17(6), 431–436.
- Royal College of Paediatric and Child Health. (2009). Working Party on Sleep Physiology and Respiratory Control Disorders in Childhood. Standards for Services for Children with Disorders of Sleep Physiology. Royal College of Paediatrics and Child Health London.
- Shott, S. R., Amin, R., Chini, B., Heubi, C., Hotze, S., & Akers, R. (2006). Obstructive sleep apnea: Should all children with Down syndrome be tested? Archives of Otolaryngology--Head & Neck Surgery, 132(4), 432–436. https://doi.org/10.1001/archotol.132.4.432
- Skotko, B. G., Macklin, E. A., Muselli, M., Voelz, L., McDonough, M. E., Davidson, E., Allareddy, V., Jayaratne, Y. S., Bruun, R., & Ching, N. (2017). A predictive model for obstructive sleep apnea and Down syndrome. American journal of medical genetics Part A, 173(4), 889–896.
- Waumans, R. C., Terwee, C. B., Van den Berg, G., Knol, D. L., Van Litsenburg, R. R., & Gemke, R. J. (2010). Sleep and sleep disturbance in children: Reliability and validity of the Dutch version of the Child Sleep Habits Questionnaire. Sleep, 33(6), 841–845.
Evidence tabellen
DS = Down Syndrome; NIV = non-invasive ventilation; HPO: Home pulse oximetry; PG = polygraphy; AF-date = artefact-free data; ODI = oxyhaemoglobin desaturation index; CSHQ = Children’s Sleep Habits Questionnaire; PSG = polysomnography; AASM: American Academy of Sleep Medicine
Risk of bias assessment diagnostic accuracy studies
|
Study reference |
Patient selection
|
Index test |
Reference standard |
Flow and timing |
Comments with respect to applicability |
|
Hill, 2018 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? No
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear
|
Was there an appropriate interval between index test(s) and reference standard? No
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: HIGH |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
|
Shott, 2006 |
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Unclear
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? No
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear
|
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? No |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? Unclear
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: HIGH |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: UNCLEAR |
CONCLUSION Could the patient flow have introduced bias?
RISK: HIGH |
|
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
|
Austeng |
2014 |
does not fit PICO |
|
Bassell |
2015 |
does not fit PICO |
|
Chamseddin |
2019 |
case series,does not fit PICO |
|
Coverstone |
2014 |
does not fit PICO |
|
De Miguel-Díez |
2003 |
case series, does not fit PICO |
|
Dyken |
2003 |
case series |
|
Esbensen |
2016 |
does not fit PICO |
|
Esbensen |
2018 |
does not fit PICO |
|
Fan |
2017 |
case series |
|
Friedman |
2018 |
does not fit PICO |
|
Fung |
2012 |
does not fit PICO |
|
Gimenez |
2018 |
does not fit PICO |
|
Goffinski |
2015 |
case series |
|
Jheeta |
2013 |
postscript |
|
Knollman |
2019 |
does not fit PICO |
|
Konstantinopoulou |
2016 |
does not fit PICO |
|
Lee |
2018 |
does not fit PICO |
|
Levanon |
1999 |
does not fit PICO |
|
Lin |
2014 |
does not fit PICO |
|
Maris |
2016 |
does not fit PICO |
|
Maris |
2016 |
does not fit PICO |
|
Maris |
2016 |
does not fit PICO |
|
Miano |
2008 |
does not fit PICO |
|
Nehme |
2017 |
does not fit PICO |
|
Ng |
2006 |
does not fit PICO |
|
Nisbet |
2015 |
does not fit PICO |
|
Rosen |
2011 |
does not fit PICO |
|
Senthilvel |
2011 |
does not fit PICO |
|
Shires |
2010 |
does not fit PICO |
|
Skotko |
2017 |
does not fit PICO |
|
Wong |
2017 |
does not fit PICO |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 10-11-2021
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
De richtlijn is ontwikkeld in samenwerking met:
- Nederlands Oogheelkundig Gezelschap
- Nederlandse Orthopaedische Vereniging
- Nederlandse Vereniging voor Dermatologie en Venereologie
- Nederlandse Vereniging voor Neurologie
- Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Nederlandse Vereniging voor Psychiatrie
- Nederlandse Vereniging voor Logopedie en Foniatrie
- Verpleegkundigen & Verzorgenden Nederland
- AJN Jeugdartsen Nederland
- Nederlands Instituut van Psychologen
- Nederlandse Vereniging van Diëtisten
- Ergotherapie Nederland
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een werkgroep ingesteld, bestaande uit vertegenwoordigers van kinderartsen, de Stichting Downsyndroom en een arts voor Verstandelijk Gehandicapten. Omdat de richtlijn een breed scala van onderwerpen betreft, is bij de ontwikkeling van de richtlijnmodules samengewerkt met een meeleesgroep en zijn conceptteksten voorgelegd aan een klankbordgroep, voorafgaand aan de reguliere commentaarfase.
Werkgroep
- Dr. M.E. Weijerman, kinderarts, NVK
- Drs. H. van Wieringen, kinderarts-EAA, NVK
- Dr. H.B.M. van Gameren - Oosterom, kinderarts, NVK
- Drs. A.M. van Wermeskerken, kinderarts, NVK
- Dr. A.M.W. Coppus, arts voor verstandelijk gehandicapten, NVAVG
- Drs. R.D. Lamberts, directeur Stichting Downsyndroom
Samenstelling klankbordgroep
- Dr. P.B.J. Vermeltfoort, oogarts, NOG
- Drs. K.C. Noz, dermatoloog, NVDV
- M. de Ruiter, stafverpleegkundige jeugdgezondheidszorg, V&VN
- F. Visscher, (kinder)neuroloog, NVN
- Dr. I.H. Linskens, gynaecoloog, NVOG
- Drs. J.H.J.M. Bessems, kinderorthopeed, (NOV)
- K. Vermeulen, kinder- en jeugdpsychiater, NVvP
- N. Schulpen, psycholoog, NIP
- T.M.C. Harperink-Oude Nijhuis, diëtist, NVD
- L. Isbouts, kinderarts, NVK
- C.M. Holweg-Brummelhuis, ergotherapeut, Ergotherapie Nederland
- Dr. R.H. Free, KNO-arts, NVKNO
Met medewerking van
Schrijversgroep (naast werkgroep)
- Drs. J.H.J.M. Bessems, kinderorthopeed
- Dr. J.E.H. Bunt, kinderarts-neonatoloog
- Dr. D. Caudri, kinderlongarts
- Dr. B.F. Goemans, kinderoncoloog
- Drs. C.M. Salvatore, kindergynaecoloog
- Dr. D.A.C.M. Snepvangers, kinderarts
Meeleesgroep
- Dr. L.A. Bok, kinderarts-EAA
- Dr. R. Cuperus, kinderarts
- Drs. F.P.J. Dikken, kinderarts
- Dr. J. de Goede, kinderarts
- I. de Haan, ergotherapeut
- Drs. G. Janssen, kinderarts
- Dr. M. Klaassens, kinderarts-EAA
- Dr. A.M.H. Korver, kinderneuroloog
- Dr. S.A. de Man, kinderarts
- Dr. A. Meißner, uroloog
- Drs. K.C. Noz, dermatoloog
- Dr. R.N. van der Plas, kinderarts
- Drs. J. Potjewijd, kinderarts
- Drs. S.L. Quaak, Jeugdarts
- Drs. V. Roelfsema, kinderarts-kinderneuroloog
- Drs. M. Ruige, kinderarts
- J.A.J. Spies, logopedist
- Drs. M. Spijkers, jeugdarts
- Dr. A.S.P. Trotsenburg, kinderarts
- Prof. dr. E. de Vries, kinderarts-immunoloog
- C. de Weger-Zijlstra, orthoptist
Met ondersteuning van
- Drs. E. van Dorp, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. Kortlever-van der Spek, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M. Moret-Hartman, senior-adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot 1-6-2021)
- Drs. N. Verheijen, senior-adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Coppus |
Arts voor Verstandelijk Gehandicapten (AVG); werkzaam bij Dichterbij. Omvang functie 100%, waarvan 30% gedetacheerd als onderzoeker bij Radboud UMC, afdeling Eerstelijns geneeskunde, Geneeskunde voor mensen met een verstandelijke beperking |
"AVG werkzaam vanuit Stichting ORO (organisatie van polikliniek voor volwassenen met downsyndroom), Elkerliek ziekenhuis, 10% dienstverband AVG werkzaam voor het CCE (Centrum voor consultatie en Expertise), als ZZP 'er wisselend aantal uren" |
Geen |
Geen |
|
Gameren van-Oosterom |
Kinderarts, Groene Hart Ziekenhuis, Gouda |
Geen |
Geen |
Geen |
|
Lamberts |
Directeur stichting Downsyndroom |
Geen |
Geen |
Geen |
|
Weijerman |
Kinderarts en RVE voorzitter Kindergeneeskunde Alrijne ziekenhuis Leiderdorp. Kinderarts voor kinderen met downsyndroom, in het Down Centrum (West-) Nederland (DCN) een samenwerking van het Alrijne ziekenhuis Leiderdorp en het Amsterdam UMC, locatie VUmc. Het DCN is een door NVU gecertificeerd expertisecentrum voor kinderen met downsyndroom. " |
Geen |
Coördinator en deskundige van de multidisciplinaire Down poli Alrijne ziekenhuis, ook in samenwerking met DCN. Schrijver van medische artikelen over downsyndroom (zie PubMed). Co-promotor dissertatie Amsterdam UMC over downsyndroom. Spreker op verschillende symposia over downsyndroom in verband met expertise. |
Geen |
|
Wermeskerken van |
Algemeen kinderarts in Flevoziekenhuis/De kinderkliniek, Almere Coördinator Downteam Almere |
Secretaris commissie richtlijnen en indicatoren NVK: onbetaald |
Tot sep 2018 lokale hoofdonderzoeker STRAP studie (sponsor is onafhankelijk instituut), Erasmus in deze studie werd het effect van een algoritme op vermindering antibiotica voorschriften onderzocht. Betaald per inclusie. Beraming is gebruikt voor betaling arts-assistenten geen persoonlijke betaling |
Geen |
|
Wieringen van |
Kinderarts erfelijke en aangeboren aandoeningen, 0,75 fte Medisch manager 0, 1 fte Werkgever: St. Antonius Ziekenhuis Utrecht/Nieuwgein |
0- aanstelling bij Medische Genetica, UMC Utrecht (Multidisciplinair patiëntenoverleg, regionaal zorgpad, ontwikkeling samenwerkingsverbanden). |
Geen |
Geen |
Inbreng patiëntenperspectief
Een afgevaardigde van de Stichting Downsyndroom was lid van de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Stichting Downsyndroom.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de WKKGZ
|
Module |
Uitkomst raming |
Toelichting |
|
Module 1 Algemene ontwikkeling
|
Geen substantiële financiële gevolgen |
De richtlijnmodule is getoetst op financiële gevolgen. Hieruit volgt dat de aanbeveling(en) niet breed toepasbaar zijn en daarom geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 2 Spraaktaalmethodes/ ondersteunende communicatie
|
Geen substantiële financiële gevolgen |
De richtlijnmodule is getoetst op financiële gevolgen. Hieruit volgt dat de aanbeveling(en) niet breed toepasbaar zijn en daarom geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 3 Slaappatroon
|
Geen substantiële financiële gevolgen |
De richtlijnmodule is getoetst op financiële gevolgen. Hieruit volgt dat de aanbeveling(en) niet breed toepasbaar zijn en daarom geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 4 Behandeling van slaapstoornissen
|
Geen substantiële financiële gevolgen |
De richtlijnmodule is getoetst op financiële gevolgen. Hieruit volgt dat de aanbeveling(en) niet breed toepasbaar zijn en daarom geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 5 Diagnostiek van slaapstoornissen
|
Geen substantiële financiële gevolgen |
De richtlijnmodule is getoetst op financiële gevolgen. Hieruit volgt dat de aanbeveling(en) niet breed toepasbaar zijn en daarom geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 6 RSV-profylaxe
|
Geen substantiële financiële gevolgen |
De richtlijnmodule is getoetst op financiële gevolgen. Hieruit volgt dat de aanbeveling(en) niet breed toepasbaar zijn en daarom geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 7 Antibioticaprofylaxe voor recidiverende luchtweginfecties
|
Geen substantiële financiële gevolgen |
De richtlijnmodule is getoetst op financiële gevolgen. Hieruit volgt dat de aanbeveling(en) niet breed toepasbaar zijn en daarom geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 8 Screenen op TMD en leukemie
|
Geen substantiële financiële gevolgen |
De richtlijnmodule is getoetst op financiële gevolgen. Hieruit volgt dat de aanbeveling(en) niet breed toepasbaar zijn en daarom geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 9 Voorspellende waarde anti-TPO
|
Geen substantiële financiële gevolgen |
De richtlijnmodule is getoetst op financiële gevolgen. Hieruit volgt dat de aanbeveling(en) niet breed toepasbaar zijn en daarom geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 10 Beleid bij geïsoleerde TSH-verhoging
|
Geen substantiële financiële gevolgen |
De richtlijnmodule is getoetst op financiële gevolgen. Hieruit volgt dat de aanbeveling(en) niet breed toepasbaar zijn en daarom geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 11 Energiebehoefte
|
Geen substantiële financiële gevolgen |
De richtlijnmodule is getoetst op financiële gevolgen. Hieruit volgt dat de aanbeveling(en) niet breed toepasbaar zijn en daarom geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 12 Vruchtbaarheid
|
Geen substantiële financiële gevolgen |
De richtlijnmodule is getoetst op financiële gevolgen. Hieruit volgt dat de aanbeveling(en) niet breed toepasbaar zijn en daarom geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 13 Anticonceptie
|
Geen substantiële financiële gevolgen |
De richtlijnmodule is getoetst op financiële gevolgen. Hieruit volgt dat de aanbeveling(en) niet breed toepasbaar zijn en daarom geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 14 Screenen op orthopedische afwijkingen
|
Geen substantiële financiële gevolgen |
De richtlijnmodule is getoetst op financiële gevolgen. Hieruit volgt dat de aanbeveling(en) niet breed toepasbaar zijn en daarom geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 15 Behandeling van orthopedische afwijkingen
|
Geen substantiële financiële gevolgen |
De richtlijnmodule is getoetst op financiële gevolgen. Hieruit volgt dat de aanbeveling(en) niet breed toepasbaar zijn en daarom geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 16 Screenen op testiskanker
|
Geen substantiële financiële gevolgen |
De richtlijnmodule is getoetst op financiële gevolgen. Hieruit volgt dat de aanbeveling(en) niet breed toepasbaar zijn en daarom geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 17 Urologische en nefrologische afwijkingen
|
Geen substantiële financiële gevolgen |
De richtlijnmodule is getoetst op financiële gevolgen. Hieruit volgt dat de aanbeveling(en) niet breed toepasbaar zijn en daarom geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor kinderen met downsyndroom. Tevens zijn er knelpunten aangedragen door kinderartsen, een jeugdarts, dermatoloog, orthoptist, oogarts en een verpleegkundig specialist tijdens een Invitational conference. Een verslag hiervan is opgenomen in de bijlagen.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule zijn voorafgaand aan de commentaarfase voorgelegd aan de klankbordgroep. De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en de patiëntorganisatie voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en patiëntorganisatie voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas, T., Merglen, A., Heen, A. F., Kristiansen, A., Neumann, I., Brito, J. P., Brignardello-Petersen, R., Alexander, P. E., Rind, D. M., Vandvik, P. O., & Guyatt, G. H. (2017). UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ open, 7(11), e018593. https://doi.org/10.1136/bmjopen-2017-018593.
Alonso-Coello, P., Schünemann, H. J., Moberg, J., Brignardello-Petersen, R., Akl, E. A., Davoli, M., Treweek, S., Mustafa, R. A., Rada, G., Rosenbaum, S., Morelli, A., Guyatt, G. H., Oxman, A. D., & GRADE Working Group (2016a). GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ (Clinical research ed.), 353, i2016. https://doi.org/10.1136/bmj.i2016.
Alonso-Coello, P., Oxman, A. D., Moberg, J., Brignardello-Petersen, R., Akl, E. A., Davoli, M., Treweek, S., Mustafa, R. A., Vandvik, P. O., Meerpohl, J., Guyatt, G. H., Schünemann, H. J., & GRADE Working Group (2016b). GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ (Clinical research ed.), 353, i2089. https://doi.org/10.1136/bmj.i2089.
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., Fervers, B., Graham, I. D., Grimshaw, J., Hanna, S. E., Littlejohns, P., Makarski, J., Zitzelsberger, L., & AGREE Next Steps Consortium (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ: Canadian Medical Association journal = journal de l'Association medicale canadienne, 182(18), E839–E842. https://doi.org/10.1503/cmaj.090449.
Hultcrantz, M., Rind, D., Akl, E. A., Treweek, S., Mustafa, R. A., Iorio, A., Alper, B. S., Meerpohl, J. J., Murad, M. H., Ansari, M. T., Katikireddi, S. V., Östlund, P., Tranæus, S., Christensen, R., Gartlehner, G., Brozek, J., Izcovich, A., Schünemann, H., & Guyatt, G. (2017). The GRADE Working Group clarifies the construct of certainty of evidence. Journal of clinical epidemiology, 87, 4–13. https://doi.org/10.1016/j.jclinepi.2017.05.006.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Neumann, I., Santesso, N., Akl, E. A., Rind, D. M., Vandvik, P. O., Alonso-Coello, P., Agoritsas, T., Mustafa, R. A., Alexander, P. E., Schünemann, H., & Guyatt, G. H. (2016). A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. Journal of clinical epidemiology, 72, 45–55. https://doi.org/10.1016/j.jclinepi.2015.11.017.
Schünemann, H., Brożek, J., Guyatt, G., et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
