Startpagina - Systemische lupus erythematodes
Systemische lupus erythematodes (SLE) is een auto-immuunziekte met zeer wisselende manifestaties, van relatief mild tot levensbedreigend. De prevalentie van SLE is 1-3 op 10.000 mensen, 80-90% hiervan is vrouw. De prognose van patiënten met SLE is de afgelopen decennia sterk verbeterd door verbeterde zorg en meer inzicht in juist gebruik van medicatie.
Aanleiding voor de richtlijn
Tot op heden was er voor de medicamenteuze behandeling van SLE geen richtlijn beschikbaar gericht op de Nederlandse situatie. Omdat hier bij de leden wel behoefte aan is, heeft de Nederlandse Vereniging voor Reumatologie (NVR) het initiatief genomen voor een landelijke richtlijn. Met ondersteuning van de Federatie Medisch Specialisten (FMS) is hiervoor een multidisciplinaire werkgroep samengesteld.
Indeling en gebruik van de richtlijn
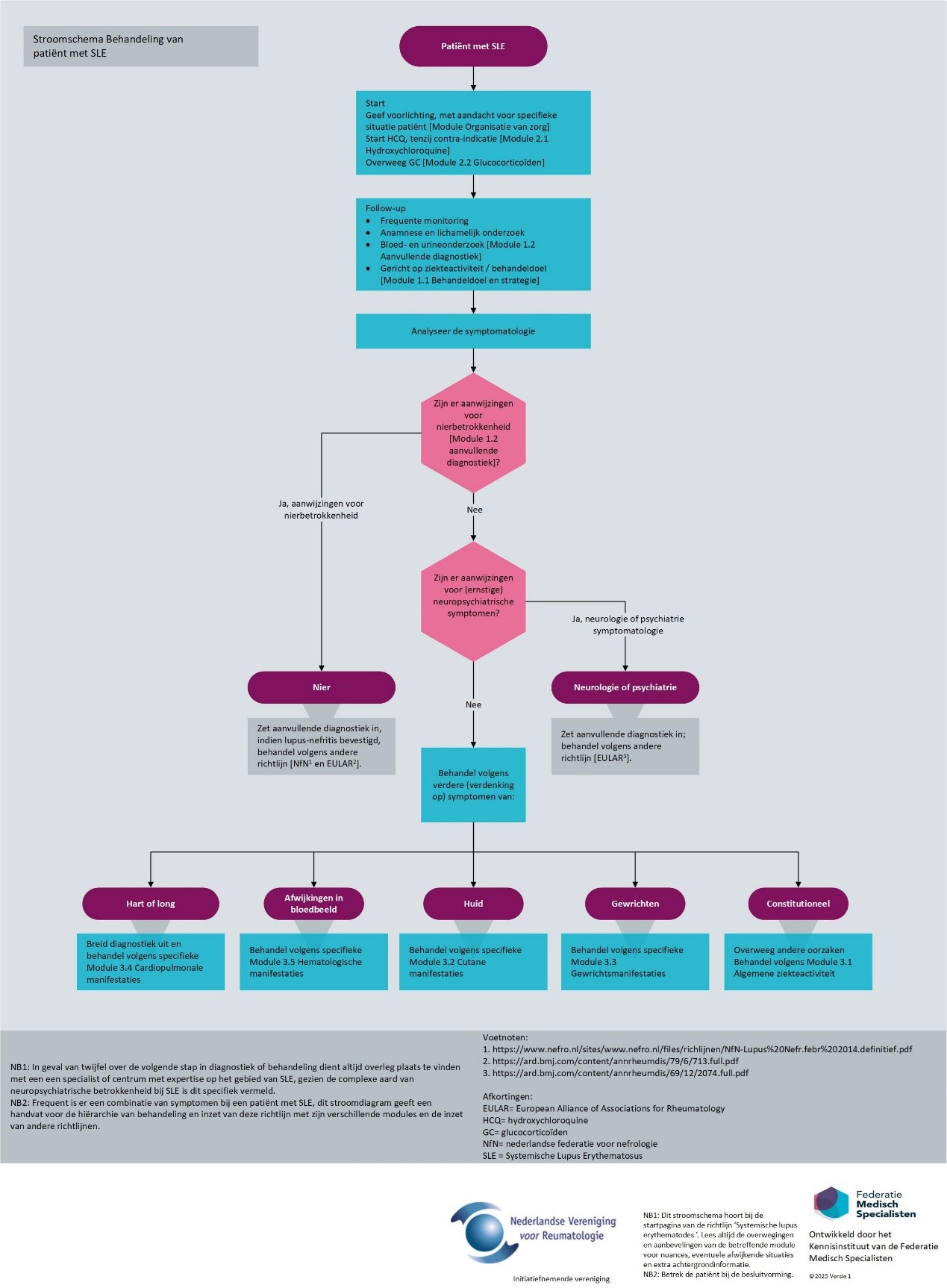
Deze richtlijn beschrijft o.a. de medicamenteuze behandeling van SLE en inzet van disease modifying antirheumatic drugs (DMARDs). Binnen deze groep medicijnen wordt onderscheid gemaakt tussen conventional synthetic disease modifying antirheumatic drugs (csDMARDs) en biological disease modifying antirheumatic drugs (bDMARDs). Onder csDMARDs vallen de immunosuppressieve geneesmiddelen zoals methotrexaat en leflunomide. Onder bDMARDs vallen selectieve immunosuppressieve geneesmiddelen zoals belimumab en andere biologicals zoals rituximab. Een gedetailleerd overzicht is weergegeven in de terminologielijst. Meerdere medicamenten die in de richtlijn worden beschreven, zijn niet geregistreerd met een indicatie voor gebruik bij SLE. Desalniettemin is het wel gebruikelijk om deze medicatie in te zetten bij de behandeling van SLE, deze richtlijn is een weerslag van de praktijk. Behandeling van manifestaties van SLE met betrekking tot de nieren (nefritis) en het centraal en perifeer zenuwstelsel (neuropsychiatrische SLE) vallen buiten de scope van de huidige richtlijn, zie Figuur 1.
Om een zo goed mogelijk handvat voor de dagelijkse praktijk te geven, dient de richtlijn per patiënt te worden ingezet volgens Figuur 1. Hierin staat de plaatsbepaling van de verschillende modules weergegeven.
De richtlijn bestaat uit de volgende modules:
- Behandeldoel (meten ziekteactiviteit)
- Ziekte-monitoring (aanvullende diagnostiek)
- Gebruik van glucocorticoïden
- Gebruik van hydroxychloroquine
- Gebruik van csDMARDs en bDMARDs bij algemene ziekteactiviteit
- Gebruik van csDMARDs en bDMARDs bij cutane manifestaties
- Gebruik van csDMARDs en bDMARDs bij gewrichtsmanifestaties
- Gebruik van csDMARDs en bDMARDs bij cardiopulmonale manifestaties
- Gebruik van csDMARDs en bDMARDs bij hematologische manifestaties
- Organisatie van Zorg
Beoogde gebruikers van de richtlijn
Deze richtlijn is bedoeld voor behandelaars van volwassen patiënten met SLE, specifiek betreft dit medisch specialisten, physician assistants/verpleegkundig specialisten, verpleegkundigen en ziekenhuisapothekers. Kinderen dienen te worden verwezen naar een kinderarts-immunoloog/reumatoloog.
Voor patiënten
SLE is een ziekte waarbij ontstekingen ontstaan, omdat het afweersysteem ontregeld is. De ontstekingen kunnen op meerdere plaatsen in het lichaam voorkomen. Zo komt het vaak voor dat de gewrichten gezwollen raken en er huiduitslag ontstaat. Ook kunnen er ontstekingen ontstaan in de nieren, longen en het hart.
Meer informatie over SLE staat op de website van de patiëntenvereniging: NVLE
Op Thuisarts.nl staat informatie in begrijpelijke taal over SLE. De teksten zijn gemaakt met de informatie uit deze richtlijn:
Hoe is de richtlijn tot stand gekomen?
Het initiatief voor deze richtlijn is afkomstig van de Nederlandse Vereniging voor Reumatologie (NVR).
De richtlijn is opgesteld door een multidisciplinaire commissie met vertegenwoordigers vanuit de internisten, longartsen, cardiologen, ziekenhuisapothekers, verpleegkundig specialisten en verpleegkundigen, patiëntvertegenwoordigers en reumatologen.
Figuur 1. Stroomdiagram
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 15-02-2023
Beoordeeld op geldigheid : 15-02-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met systemische lupus erythematosus.
Werkgroep
- Dr. E. Zirkzee, reumatoloog, werkzaam in Maasstad ziekenhuis Rotterdam, NVR, voorzitter van de werkgroep.
- Dr. M. van Onna, reumatoloog, werkzaam in Amsterdam UMC, NVR.
- Dr. C. Magro Checa, reumatoloog, werkzaam in Zuyderland Medisch Centrum, NVR.
- Dr. R. Luijten, reumatoloog, werkzaam in ETZ Tilburg, NVR (t/m 10-2021).
- Drs. R.J. Goekoop, internist-reumatoloog, werkzaam in Hagaziekenhuis, NVR.
- Dr. R. Klaasen, reumatoloog, werkzaam in Meander MC, NVR (vanaf 10-2021).
- Dr. K. de Leeuw, internist-klinisch immunoloog, werkzaam in UMC Groningen, NIV.
- Dr. M. Limper, internist-klinisch immunoloog, werkzaam in UMC Utrecht, NIV.
- Mw. L. Beaart-van de Voorde, MSc, verpleegkundig specialist AGZ, expertisegebied reumatologie, werkzaam in Leids Universitair Medisch Centrum, V&VN.
- Dr. J.R. Miedema, longarts, werkzaam in Erasmus MC, NVALT.
- Drs. M.J.R. Quanjel, longarts, werkzaam in St. Antonius ziekenhuis Nieuwegein, NVALT.
- Prof Dr. B.J.F van den Bemt, apotheker/klinisch farmacoloog, werkzaam in St. Maartenskliniek/RadboudUMC, NVZA.
- Dr. A. Berden, reumatoloog, werkzaam in Maasstad Ziekenhuis Rotterdam, NVR.
- Mw. W. Zacouris-Verweij, patiëntvertegenwoordiger, NVLE.
- Mw. G. Brandts, patiëntvertegenwoordiger, NVLE.
Klankbordgroep
- Dr. H.B. Thio, dermatoloog, werkzaam in Erasmus MC, NVDV.
- Dr. N. Ajmone Marsan, cardioloog, werkzaam in Leiden UMC, NVvC.
Met ondersteuning van
- Drs. I. van Dusseldorp, Literatuurspecialist, Van Dusseldorp, Delvaux & Ket.
- Dr. A. Claassen, senior beleidsmedewerker, NVR.
- Dr. M. van Vilsteren, senior beleidsmedewerker, NVR.
- Dr. M.M.A. Verhoeven, adviseur, Kennisinstituut van de Federatie Medisch Specialisten.
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
E.J.M. Zirkzee |
Reumatoloog Maasstad ziekenhuis Rotterdam |
2018 Adviesraad SLE GSK (betaald, eenmalig) |
|
Geen |
|
M. van Onna |
Reumatoloog Amsterdam UMC, locatie AMC |
n.v.t. |
|
Geen |
|
C. Magro Checa |
Reumatoloog Zuyderland Medisch Centrum, Heerlen en Sittard-Geleen |
n.v.t. |
Deelname SLE-BRAVE I en II studies (Lilly) |
Geen |
|
R. Luijten |
Reumatoloog ETZ Tilburg |
Medical Information Officer binnen het ETZ (onbetaald) |
|
Geen |
|
R.J. Goekoop |
Internist-Reumatoloog CMIO Haga ziekenhuis 1,0fte |
Voorzitter SANL (onbetaald) / advies raad FMS t.a.v. kwaliteits aanleveringen |
Deelname Bliss-Beieve Studie (GSK), res centrum |
Geen |
|
K. de Leeuw |
Internist-Klinisch immunoloog bij de afdeling Reumatoloog & Klinische Immunologie van het Universitair Medisch Centrum Groningen (UMCG) |
n.v.t. |
Adviesraad GSK, Adviesraad Otsuka, deelname BLISS BELIEVE-studie (GSK), deelname Topaz studie (Biogen) |
Geen |
|
M. Limper |
internist - klinisch immunoloog UMC Utrecht |
lid wetenschappelijke adviesraad Farmacotherapeutisch Kompas; onkostenvergoeding |
Consultancy GSK, Roche, Novartis; Unrestricted grant van Thermo Fisher, unrestricted grant van GSK; deelname BLISS BELIEVE-studie (GSK) en deelname JAK/TK-studie (AbbVie); Lid van de medische adviesraad verbonden aan de NVLE. |
Geen |
|
L. Beaart-van de Voorde |
Verpleegkundig specialist, LUMC - afdeling Reumatologie / Docent Master Advanced Nursing Practice, Hogeschool Leiden |
Voorzitter V&VN-VS Netwerk Reumatologie (onbetaald) / Redactielid Nurse Academy Ouderen & Thuiszorg (vergoeding) |
|
Geen |
|
W. Zacouris-Verweij |
Financieel Adviseur Emuraal Advies B.V. te Rotterdam |
Voorzitter NVLE onbetaald ARCH werkgroep SLE, onbetaald |
Patient Advocate bij UCB voor interne opleiding |
Geen |
|
J.R. Miedema |
Longarts Erasmus MC |
Longarts is regulier betaald |
Adviesraad Beuringer Ingelheim nationaal/internationaal t.a.v. nintedanib voor systemische sclerose en progressieve fibrose. / patent JAK remmer voor pulmonale sarcoidose (eigendom van Erasmus MC, niet individueel); deelname onderzoek / pirfenidon bij asbestose (Roche - NVALT). Rest onderzoek n.v.t. voor SLE richtlijn |
Niet meeschrijven aan aanbevelingen Nintedanib |
|
M. Quanjel |
Longarts Antonius ziekenhuis Nieuwegein |
Longarts vast in dienst |
Adviesraad Beuringer Ingelheim nationaal/internationaal t.a.v. nintedanib voor systemische sclerose en progressieve fibrose |
Geen |
|
B. van den Bemt |
apotheker/klinisch farmacoloog, werkzaam in St. Maartenskliniek/RadboudUMC |
Incidentele nascholingen gedaan voor Pfizer, Novartis, Sandoz en Bayer |
Adviesraad UCB tav farmaceutische zorg; Onderzoek naar therapietrouw gesponsored door Abbvie |
Geen |
|
A. Berden |
Reumatoloog (sinds eind 2020; voorheen AIOS Leiden UMC) Reumatologie Maasstad Ziekenhuis Rotterdam |
n.v.t. |
|
Geen |
|
R. Klaasen |
Reumatoloog, werkzaam in Meander MC |
Arch werkgroep SLE (niet betaald) Penningmeester Nederlandse vereniging voor reumatologie (betaald) Geneesmiddelen commissie Meander Medisch Centrum (niet betaald) |
Vakgroep reumatologie in Meander Medisch centrum heeft meegedaan (afgerond 2021) aan Bliss-Believe studie (GSK): Wereldwijd opgezet onderzoek naar de combinatie behandeling van Rituximab + Belimumab vergeleken met Placeob + Belimumab en alleen Belimumab in SLE patiënten. (doelgroep: SLE ). |
Geen |
|
G. Brandts |
Patiëntvertegenwoordiger |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door patiëntenverenigingen uit te nodigen voor de schriftelijke knelpuntenanalyse en meerdere leden van de patiëntenvereniging af te vaardigen in de werkgroep. Het verslag hiervan is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan meerdere patiëntenverenigingen en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module monitoring |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module medicamenteuze behandeling - basis |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module medicamenteuze behandeling - DMARD |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met de schriftelijk knelpuntenanalyse. Tevens zijn er knelpunten aangedragen door Inspectie voor de Gezondheidszorg en Jeugd, Zorginstituut Nederland, NVZ, ZKN, VIG, NVR, V&VN, KNMP, NVZA, NVN, ReumaNederland, Nationale Vereniging ReumaZorg Nederland, Nationale Vereniging voor Lupus, APS, Sclerodemie, MCTD (NVLE) via de schriftelijke knelpuntenanalyse. Een verslag hiervan is opgenomen onder aanverwante producten (Bijlage I).
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, veiligheid aspecten, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.

