Behandelingen bij overgangsklachten
Uitgangsvraag
Wat is de veiligheid van progesteron met estradiol in vergelijking met een ander (synthetisch) progestageen met estradiol als behandeling bij patiënten met overgangsklachten?
Aanbeveling
Informeer vrouwen dat verschillende typen progestagenen bij gecombineerd HST (hormoonsuppletietherapie) een verschillend risico geven op mammacarcinoom.
Informeer vrouwen met een indicatie voor HST dat er bij de combinatie estradiol met natuurlijk progesteron er geen aanwijzingen zijn op een verhoogd risico op mammacarcinoom.
Informeer vrouwen met een indicatie voor HST dat de combinatie estradiol met dydrogesteron pas na vijf jaar gebruik mogelijk een gering verhoogd risico geeft op mammacarcinoom.
Informeer vrouwen met een indicatie voor HST dat de combinatie estradiol met andere synthetische progestagenen (met uitzondering van dydrogesteron) reeds binnen vijf jaar een gering verhoogd risico geven op mammacarcinoom.
Informeer vrouwen met een indicatie voor HST dat de combinatie estradiol met natuurlijk progesteron bij gebruik langer dan vijf jaar mogelijk een gering verhoogd risico op endometriumcarcinoom geeft.
Informeer vrouwen dat verschillende typen progestagenen bij gecombineerd HST geen verschillend risico geven op VTE (Veneuze trombo-embolie) en cardiovasculaire aandoeningen.
Overwegingen
Er is veel literatuur over de risico’s van progestageengebruik, echter er zijn geen vergelijkende studies met natuurlijk progesteron en de verschillende progestagenen. Medroxyprogesteronacetaat (MPA) als pregnaanderivaat en norethisteronacetaat (NETA) als nortestosteronderivaat zijn het meest bestudeerd in de postmenopauze en de risico’s van deze progestagenen zijn bekend. MPA is niet meer beschikbaar als HST en wordt derhalve hier niet verder besproken. In de geselecteerde Franse studies is progesteron ten opzichte van verschillende progestagenen beoordeeld, maar werden NETA en MPA weinig gebruikt in verhouding tot andere progestagenen. De veiligheid van drospirenon en LNG IUS (spiraal) ten opzichte van progesteron bij peri-/postmenopauzale vrouwen is niet bekend, want die zijn nog onvoldoende goed onderzocht.
In het E3N-cohort was de incidentie voor mammacarcinoom bij vrouwen zonder HST 34/1000 in 10 jaar, voor endometriumcarcinoom 4/1000 in 10 jaar en voor VTE 6/1000 in 10 jaar. De werkgroep heeft derhalve gesteld dat een nadelig effect van HST op mammacarcinoomrisico zwaarder weegt dan het risico op endometriumcarcinoom. Progesteron heeft een lagere potentie ten opzichte van andere progestagenen waardoor het mammacarcinoomrisico in dit cohort niet verhoogd is, terwijl het endometriumcarcinoom risico wel toeneemt. Voor dydrogesteron neemt het mammacarcinoom- en endometriumcarcinoom risico alleen toe bij >5 jaar gebruik (Fournier, 2008; Fournier, 2014). Het risico op mammacarcinoom neemt langzaam af na het staken van HST (NICE guideline 2015).
Er bestaat geen combinatie preparaat van oestradiol met progesteron. Er wordt thans wel onderzoek gedaan naar de dosis-effect-relatie van diverse combinaties van oestradiol en progesteron in een fase 3-studie (REPLENISH).
Oraal progesteron heeft als neveneffect slaperigheid (SmPC-tekst Utrogestan). De werkgroep adviseert daarom om de capsules ’s avonds in te nemen. Indien doorbraakbloedingen optreden kunnen deze progesteron capsules vaginaal worden gebruikt (Ruan 2014).
Het gebruik van progesterongel (via internet te verkrijgen) wordt afgeraden in combinatie met oestrogeensuppletie omdat de veiligheid van progesterongel op het endometrium niet is aangetoond.
Het risico op endometriumcarcinoom bij HST wordt bepaald door de oestrogene component. De oestrogeendoseringen zijn niet beschreven in de onderzoeken (Allen, 2010; Fournier, 2014; Dossus, 2014). Het risico op endometriumcarcinoom met oestrogeen met progesteron/ progestagenen is lager dan met oestrogeen alleen (Fournier, 2014).
De werkgroep is van mening dat de laagst mogelijke effectieve, in Nederland verkrijgbare HST de voorkeur verdient, zolang nog niet alle bijwerkingen op de lange termijn bekend zijn. Er is geen consensus over de optimale schema’s bij lage doseringen (UptoDate 2017).
Onderbouwing
Achtergrond
Bij vrouwen zonder uterus is er geen indicatie voor toevoeging van progesteron of progestagenen aan estradiol. Bij vrouwen met een uterus dienen gedurende ten minste tien dagen per cyclus van 28 dagen progestageen aan oestrogeen te worden toegevoegd om het risico op endometriumhyperplasie en -carcinoom te verkleinen. In Nederland worden progesteron en synthetische progestagenen gebruikt om dit risico te verlagen. De veiligheid met betrekking tot hart- en vaatziekten, veneuze trombo-embolische processen, endometriumcarcinoom en mammacarcinoom zou kunnen verschillen tussen natuurlijk progesteron en synthetische progestagenen.
Conclusies / Summary of Findings
|
Laag GRADE |
Het verhoogde risico van HST op mammacarcinoom wordt bepaald door het type progestageen. Er zijn aanwijzingen dat de combinatie estradiol met progesteron geen verhoogd risico op mammacarcinoom geeft. Estradiol met dydrogesteron lijkt veiliger dan andere oestrogeen-progestageen combinaties bij postmenopauzale vrouwen.
(Asi, 2016; Cordina-Duverger, 2013; Fournier, Fabre, 2008). |
|
Zeer laag GRADE |
Er zijn aanwijzingen dat progesteron, dydrogesteron en norethisteron in combinatie met estradiol geen hoger risico geven op een herseninfarct in de postmenopauze vergeleken met geen HST-gebruik (OR 0,78; 95% BI 0,49 – 1,26; OR 1,00; 95% BI 0,60 – 1,66 en OR 1,26; 95% BI 0,62 – 2,58, respectievelijk).
(Canonico, 2016). |
|
Geen GRADE |
Vanwege het ontbreken van studies kan er geen conclusie worden gegeven over cardiovasculaire relatie tot progesteron en progestagenen. |
|
Zeer laag GRADE |
Er zijn aanwijzingen dat progesteron, dydrogesteron en norethisteron in combinatie met estradiol geen hoger risico geven op veneuze trombo-embolische processen in de postmenopauze vergeleken met geen HST-gebruik.
(Canonico, 2010; Canonico, 2007). |
|
Zeer laag GRADE |
Er zijn aanwijzingen dat het risico op endometriumcarcinoom toeneemt bij >5 jaar gebruik van oestrogenen in combinatie met natuurlijk progesteron (HR 2,66 95% BI 1,87 – 3,77) ten opzichte van geen HST-gebruik.
(Fournier, 2014). |
Samenvatting literatuur
Hieronder zal een samenvatting van de literatuur worden weergegeven per uitkomstmaat.
Mammacarcinoom
De systematische review van Asi, 2016 beschrijft het risico op mammacarcinoom voor progesteron ten opzichte van verschillende synthetische progestagenen, welke beide gecombineerd werden met estradiol. In deze review zijn twee cohortstudies (Fournier, Fabre 2008; Espie 2007) en een case-control-studie (Cordina Duverger 2013) geïncludeerd. Er is een meta-analyse verricht van de twee cohortstudies. Een vervolgcohortstudie onderzocht de invloed van het stoppen met HST en het risico op mammacarcinoom (Fournier, 2014).
In een groot Frans prospectief cohortonderzoek (E3N cohort) werden 80.377 vrouwen van 1990 tot 2002 gevraagd verschillende vragenlijsten in te vullen. Gedurende de follow-up (gemiddeld 8,1 postmenopauzale jaren) waren er 2.354 gevallen van invasieve mammacarcinoom. Er werd een Cox proportional hazards-model voor ieder type HST berekend, gedefinieerd op basis van het type oestrogeen en het type progestageen (Fournier, Berrino, & Clavel-Chapelon, 2008). In een vervolgonderzoek werd onderzocht wat het effect van het stoppen van HST op het mammacarcinoom risico was. Door middel van vragenlijsten werd de blootstelling aan HST uitgevraagd en geclassificeerd naar het type progestageen (progesteron, dydrogesteron, andere progestagenen), duur (kortdurend ≤5 jaar; langdurig >5 jaar) en tijd sinds het laatste gebruik (huidig, 3 maanden – 5 jaar, 5 – 10 jaar, >10 jaar) (Fournier, 2014).
Een Franse prospectieve cohortstudie (MISSION study) onderzocht de incidentie van mammacarcinoom bij postmenopauzale vrouwen met en zonder HST-gebruik. In totaal namen 800 gynaecologen de door de studie opgestelde vragenlijsten af bij hun patiënten. De data- verzameling startte in januari 2004 en eindigde in juni 2006. In totaal werden er 6.755 patiënten geïncludeerd en data waren beschikbaar voor 4.949 patiënten: 2.693 vrouwen die HST gebruikten en 2.256 die geen HST gebruikten. Patiënten die als progestageen progesteron, pregnaanderivaten of norpregnaanderivaten gebruikten werden geïncludeerd en patiënten die medroxyprogesteronacetaat of nortestosteronderivaten gebruikten werden geëxcludeerd. Vrouwen in de HST-groep waren jonger, hadden minder overgewicht en minder 1e graads familieleden met mammacarcinoom dan vrouwen in de niet blootgestelde groep. Gemiddelde behandelduur van HST was 8,3 jaar (Espie, 2007).
Een Franse case-control studie (CECILE-study) werd uitgevoerd bij 1.555 postmenopauzale vrouwen. De cases (n = 739) bestonden uit vrouwen met in situ of invasieve mammacarcinoom gediagnosticeerd tussen april 2005 en maart 2007. De controlegroep bestond uit vrouwen zonder mammacarcinoom in de voorgeschiedenis uit de algemene populatie, gematcht voor leeftijd en geografisch gebied (816 controles). Gedetailleerde informatie werd verkregen via persoonlijke interviews. HST werd in drie categorieën ingedeeld: oestrogeen, oestrogeen + progestageen (E + P) en tibolon. E + P behandeling werd onderverdeeld in drie subgroepen volgens het type progestageen: natuurlijk progesteron, progesteronderivaten en testosteronderivaten (Cordina-Duverger, 2013).
Hart- en vaatziekten
Er zijn geen studies over cardiovasculaire morbiditeit en mortaliteit gevonden waarin progesteron in combinatie met estradiol vergeleken is met progestagenen in combinatie met estradiol.
Er is een case-control-studie geïncludeerd die het risico op een herseninfarct beschrijft voor progesteron ten opzichte van verschillende synthetische progestagenen in combinatie met estradiol (Canonico, 2016)
Canonico, 2016, voerde een nested-case-control-studie uit onder alle Franse vrouwen met een leeftijd van 51 tot 62 jaar tussen 2009 en 2011. Vrouwen werden geëxcludeerd bij een voorgeschiedenis van cardiovasculaire ziekten, een contra-indicatie voor HST en bij antistolling- gebruik. Deelnemers werden geïdentificeerd met behulp van de Franse nationale zorgverzekeringdatabase en Franse nationale ziekenhuisdata. Er werden 3.144 patiënten met een herseninfarct geïdentificeerd, welke gematcht werden voor leeftijd en postcode met 12.158 controles. HST werd onderverdeeld naar de toedieningsweg van het oestrogeen (oraal of transdermaal) en type progestageen (progesteron, pregnaanderivaten, norpregnaanderivaten, en nortestosteronderivaten). De aanwezigheid van co-morbiditeit en risicofactoren werd duidelijk beschreven in het artikel, maar onvolledig (rookgedrag en BMI werden niet beschreven) (Canonico, 2016).
Veneuze trombo-embolische processen
Er zijn twee studies geïncludeerd die het risico op veneuze trombo-embolische processen (VTE) beschreven voor progesteron ten opzichte van verschillende progestagenen in combinatie met estradiol, een cohortstudie en een case-control-studie (Canonico, 2010; Canonico, 2007).
In de Franse ESTHER-studie, een case-control-onderzoek bij postmenopauzale vrouwen van 45-70 jaar, werd het risico op VTE bepaald bij verschillende soorten progestagenen (progesteron, pregnaanderivaten, norpregnaanderivaten, en nortestosteronderivaten). Er werden 271 vrouwen met een VTE en 610 vrouwen in de controlegroep geïncludeerd (Canonico, 2007).
In een groot Frans prospectief cohortonderzoek (E3N cohort) werden 80.308 vrouwen van 1990 tot 2002 gevraagd verschillende vragenlijsten in te vullen. Gedurende de follow-up (gemiddeld 10,1 postmenopauzale jaren) waren er 549 gevallen van VTE. Er werd een Cox proportional hazards-model voor ieder type HST berekend, gedefinieerd door het type oestrogeen, de toedieningsweg en door het type progestageen dat werd toegediend (Canonico, 2010).
Endometriumcarcinoom/hyperplasie
Er is één systematische review geïncludeerd waarin het risico op endometriumcarcinoom beschreven werd voor verschillende progestagenen gecombineerd met estradiol (Sjogren, 2016). Hierin werden twee cohortstudies geïncludeerd die progesteron ten opzichte van progestagenen beide gecombineerd met estradiol beoordeeld hebben (Allen, 2010; Fournier, 2014 ).
De E3N-studie, een Franse cohort van 98.995 postmenopauzale vrouwen met een leeftijd van 40–65 jaar onderzocht het effect van HST op het risico van endometriumcarcinoom door middel van vragenlijsten. Vrouwen werden geëxcludeerd indien er sprake was van lost-to-follow-up, overige maligniteiten of gebrek aan data. Er werden totaal 65.630 postmenopauzale geïncludeerd tussen 1992 en 2008. De gemiddelde follow-up was 10,8 jaar (Fournier, 2014).
De cohortstudie “The European Prospective Investigation into Cancer and Nutrition” onderzocht 370.000 Europese postmenopauzale vrouwen tussen 1992 – 2000 door middel van vragenlijsten. Het risico op endometriumcarcinoom werd onderzocht door gebruik te maken van de kankerregistraties. De gemiddelde follow-up was 9,0 jaar. Er werden 601 gevallen van endometriumcarcinoom geïdentificeerd (Allen, 2010).
Resultaten
Mammacarcinoom
De meta-analyse van de twee geïncludeerde cohortstudies liet een lager mammacarcinoom risico zien voor progesteron vergeleken met synthetische progestagenen, welke beiden gecombineerd werden met oestrogeen (RR 0,67, 95% BI 0,55 – 0,81, I² = 42%) (Asi, 2016).
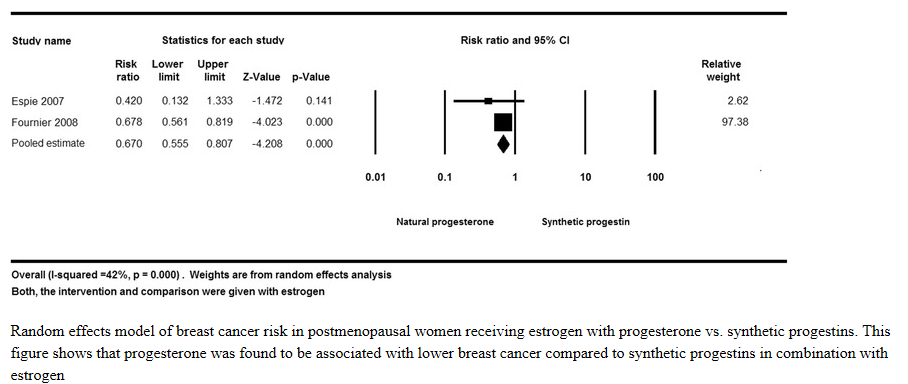
In het E3N cohort varieerde het risico voor mammacarcinoom significant voor het type progestageen: het RR was 1,00 (95% BI 0,83 – 1,22) voor oestrogeen - progesteron, 1,16 (95% BI 0,94 – 1,43) voor oestrogeen – dydrogesteron en 1,69 (95% BI 1,50 – 1,91) voor oestrogeen gecombineerd met andere progestagenen (androgene, niet-androgene, anti-androgene) vergeleken met geen HST-gebruik (Fournier, 2008). Het verhoogde mammacarcinoomrisico bleef ook na stoppen met HST aanwezig indien vrouwen langdurig >5 jaar oestrogeen - progestageen (anders dan progesteron of dydrogesteron) hadden gebruikt. Bovendien bleek dat HST bij vrouwen met BMI <25 kg/m² een hoger mammacarcinoomrisico gaf dan bij vrouwen met een BMI ≥25 kg/m² (Fournier, 2014).
In de MISSION-studie werd er geen verschil in aantal vrouwen met mammacarcinoom gerapporteerd tussen vrouwen die HST hadden gebruikt en geen HST hadden gebruikt (RR 0,91, 95% BI 0,45–1,86). Wanneer de incidentie van mammacarcinoom werd vergeleken tussen de verschillende groepen HST, was de incidentie 0,28% voor estradiol, 0,40% voor estradiol + progesteron, en 0,94% voor estradiol + synthetisch progestagenen (pregnaanderivaat (exclusief medroxyprogesteron acetaat) of norpregnaanderivaten); dit verschil was niet statistisch significant (Espie, 2007).
In de CECILE-studie (case-control-studie) verschilde het mammacarcinoomrisico per toegediend progestageen. In vergelijking met de controlegroep werd er geen verschil gerapporteerd bij het gebruik van natuurlijk progesteron in het mammacarcinoomrisico OR 0,80 (95% BI 0,44 – 1,43). Echter, er werd wel een verhoogd risico op mammacarcinoom gerapporteerd bij het gebruik van synthetische progestagenen, OR 1,57 (95% BI 0,99 – 2,49) bij progesteron-derivaten en OR 3,35 (95% BI 1,07 – 10,4) bij testosteron-derivaten. Vrouwen die continu gecombineerd progestagenen gebruikten, hadden een hoger risico dan bij sequentieel-gebruik, OR 2,52 (95 % BI 0,77 - 8,32) en 1,75 (95 % BI 1,09 - 2,79) respectievelijk (Cordina-Duverger, 2013).
Hart- en vaatziekten
In de studie van Canonico, 2016, werd een verschil gerapporteerd in het risico op een herseninfarct tussen de verschillende progestagenen. Progesteron, pregnaanderivaten, en nortestosteronderivaten hadden geen associatie met het optreden van een herseninfarct (OR 0,78; BI 95% 0,49 – 1,26; OR 1,00; 95% 0,60 – 1,66 en OR 1,26; 95% BI 0,62 – 2,58, respectievelijk), gebruiksters van norpregnaanderivaten hadden een hoger risico op een herseninfarct (OR 2,25; BI 1,05 – 4,81). In deze groep gebruikte 85% van de patiënten nomegestrolacetaat (Canonico, 2016).
Veneuze trombo-embolische processen
In de ESTHER-studie werd geen significant verschil in het risico op een VTE gerapporteerd tussen progesteron en synthetische progestagenen (OR 0,7; 95% BI 0,3 – 1,9 en OR 0,9; 95% BI 0,4 – 2,3, respectievelijk). Bij de norpregnaanderivaten werd echter wel een verhoogd risico op VTE gerapporteerd (OR 3,9; 95% BI 1,5 – 10,0) (Canonico, 2007).
In de E3N-studie werd geen significant verschil in het risico op een VTE gerapporteerd tussen progesteron, pregnaanderivaten en nortestosteronderivaten (HR 0,9; 95% BI 0,6 – 1,5, HR 1,3; 95% BI 0,9 – 2,0 en HR 1,4; 95% BI 0,7 – 2,4 respectievelijk). Echter, er werd bij de norpregnaanderivaten wel een verhoogd risico op VTE gerapporteerd (HR 1,8; 95% BI 1,2 tot 2,7) (Canonico, 2010).
Endometriumcarcinoom
Er werd een verhoogd risico op endometriumcarcinoom bij het huidig gebruik van progesteron in combinatie met estradiol gerapporteerd in de systematische review van het EPIC-cohort (HR 2,42; 95% BI 1,53–3,83) en in het E3N-cohort (HR 1,96; 95% BI 1,41 – 2,73) (Allen, 2010; Fournier, 2014; Sjogren, 2016).
In het E3N-cohort werd een verhoogd risico gerapporteerd bij langer dan vijf jaar gebruik van progesteron in vergelijking tot korter dan vijf jaar gebruik (HR 2,66; 95% BI 1,87 – 3,77 en HR 1,39; 95% BI -,99 – 1,97, respectievelijk P for trend <0.001) en voor dydrogesteron (HR 1.69 1.06 – 2.70 en HR 0.87 0.57 – 1.32, respectievelijk P for trend <0.006). Dit geldt niet voor andere vormen van progestagenen waaronder nortestosteronderivaten (HR 1.30 (95% BI: 0.85 - 1.99) (Fournier, Dossus, 2014).
In het EPIC-cohort was sequentieel-gebruik van progestagenen geassocieerd met een verhoogd risico op endometriumcarcinoom. Een verlaagd risico bij huidig gebruik van continu gecombineerd oestrogeen + progestageen was gebaseerd op een zeer klein aantal gevallen (n=3). Er werd een hoger risico op endometriumcarcinoom gevonden bij oudere vrouwen, bij een lager BMI en bij vrouwen die ooit gerookt hadden (Allen, 2010).
In deze onderzoeken was het risico op endometriumcarcinoom hoger naarmate de gebruiksduur langer was. Het risico op endometriumcarcinoom blijft na het stoppen van HST nog jarenlang verhoogd (Sjogren, 2016).
Bewijskracht van literatuur
Wat betreft de bewijskracht voor de uitkomstmaat mammacarcinoom is de betrouwbaarheid van deze uitkomstmaat gegradeerd als laag, omdat de studie van Asi, 2016 een systematische review is van observationele studies, waarbij met twee van de drie geïncludeerde studies een meta-analyse is uitgevoerd. Het systematische review is goed uitgevoerd (Asi, 2016).
Wat betreft de bewijskracht voor de uitkomstmaat hart- en vaatziekten is de betrouwbaarheid van deze uitkomstmaat gegradeerd als zeer laag. De studie van Canonico, 2016, is een observationele studie (Canonico, 2016). De data voor risicofactoren en co-morbiditeit waren incompleet.
Wat betreft de bewijskracht voor de uitkomstmaat veneuze trombo-embolische processen is de betrouwbaarheid van deze uitkomstmaat gegradeerd als zeer laag. In de ESTHER-studie waren er kleine aantallen in de subgroepen, waardoor vergelijkingen voorzichtig moeten worden geïnterpreteerd (Canonico, 2007). In het E3N-cohort werden voornamelijk leerkrachten onderzocht. Dit reflecteert een gezondheidsbewuste populatie waardoor de studiepopulatie minder representatief is. Daarnaast werd het gebruik van HST zelf gerapporteerd, waardoor er misclassificaties zou kunnen zijn ontstaan (Canonico, 2010).
Wat betreft de bewijskracht voor de uitkomstmaat endometriumcarcinoom is de betrouwbaarheid gegradeerd als laag, omdat de studie van Sjogren (Sjogren, 2016) een systematische review is van observationele studies, waarbij geen meta-analyse is uitgevoerd. Vervolgens is de bewijskracht met één niveau verlaagd naar zeer laag, omdat vergelijking progesteron versus synthetische progestagenen een deelvraag betrof in de systematische review.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is de veiligheid van progesteron met estradiol in vergelijking met een ander (synthetisch) progestageen met estradiol als behandeling bij patiënten met overgangsklachten?
P Patiënten met overgangsklachten en wens/indicatie HST
I Behandeling met progesteron in combinatie met estradiol
C Behandeling met een ander progestageen in combinatie met estradiol
O Morbiditeit (mammacarcinoom, hart- en vaatziekten, veneuze trombo-embolische processen en endometrium hyperplasie/carcinoom)
Voor de beantwoording van de uitgangsvraag zijn alleen progestagenen die in Nederland gebruikt worden meegenomen, zoals norethisteron, dydrogesteron, drospirenon, en levonorgestrel (incl. LNG IUS).
Relevante uitkomstmaten
De werkgroep achtte mammacarcinoom, hart- en vaatziekten en veneuze trombo-embolische processen de voor de besluitvorming kritieke uitkomstmaten; en endometriumhyperplasie/ carcinoom voor de besluitvorming een belangrijke uitkomstmaat.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en de Cochrane Library (via Wiley) is met relevante zoektermen gezocht naar wetenschappelijke literatuur naar de veiligheid van progesteron in combinatie met estradiol in vergelijking tot andere progestagenen in combinatie met estradiol als behandeling bij patiënten met overgangsklachten. Er werd gezocht op systematische reviews, randomized controlled trials en observationele studies. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 696 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: postmenopauzale vrouwen, progesteron, progestagenen die in Nederland gebruikt worden (norethisteron, dydrogesteron, drospirenon, LNG IUS) en beschrijving van ten minste één van de geselecteerde uitkomstmaten.
Op basis van titel en abstract werden in eerste instantie 97 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 89 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en acht studies definitief geselecteerd.
Acht onderzoeken zijn opgenomen in de literatuuranalyse.
De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias-tabellen.
Referenties
- Allen, N. E., Tsilidis, K. K., Key, T. J., Dossus, L., Kaaks, R., Lund, E.,... Riboli, E. (2010). Menopausal hormone therapy and risk of endometrial carcinoma among postmenopausal women in the European Prospective Investigation Into Cancer and Nutrition. Am J Epidemiol, 172(12), 1394-1403. doi: 10.1093/aje/kwq300
- Asi, N., Mohammed, K., Haydour, Q., Gionfriddo, M. R., Vargas, O. L., Prokop, L. J.,... Murad, M. H. (2016). Progesterone vs. synthetic progestins and the risk of breast cancer: a systematic review and meta-analysis. Syst Rev, 5(1), 121. doi: 10.1186/s13643-016-0294-5
- Canonico, M., Carcaillon, L., Plu-Bureau, G., Oger, E., Singh-Manoux, A., Tubert-Bitter, P.,... Scarabin, P. Y. (2016). Postmenopausal Hormone Therapy and Risk of Stroke: Impact of the Route of Estrogen Administration and Type of Progestogen. Stroke. doi: 10.1161/strokeaha.116.013052
- Canonico, M., Fournier, A., Carcaillon, L., Olie, V., Plu-Bureau, G., Oger, E.,... Scarabin, P. Y. (2010). Postmenopausal hormone therapy and risk of idiopathic venous thromboembolism: results from the E3N cohort study. Arterioscler Thromb Vasc Biol, 30(2), 340-345. doi: 10.1161/atvbaha.109.196022
- Canonico, M., Oger, E., Plu-Bureau, G., Conard, J., Meyer, G., Levesque, H.,... Scarabin, P. Y. (2007). Hormone therapy and venous thromboembolism among postmenopausal women: impact of the route of estrogen administration and progestogens: the ESTHER study. Circulation, 115(7), 840-845. doi: 10.1161/circulationaha.106.642280
- College ter beoordeling geneesmiddelen. SmPC tekst Utrogestan. https://db.cbg-meb.nl/IB-teksten/h11473.pdf
- Cordina-Duverger, E., Truong, T., Anger, A., Sanchez, M., Arveux, P., Kerbrat, P., & Guenel, P. (2013). Risk of breast cancer by type of menopausal hormone therapy: a case-control study among post-menopausal women in France. PLoS One, 8(11), e78016. doi: 10.1371/journal.pone.0078016
- Espie, M., Daures, J. P., Chevallier, T., Mares, P., Micheletti, M. C., & De Reilhac, P. (2007). Breast cancer incidence and hormone replacement therapy: results from the MISSION study, prospective phase. Gynecol Endocrinol, 23(7), 391-397. doi: 10.1080/09513590701382104
- Fournier, A., Berrino, F., & Clavel-Chapelon, F. (2008). Unequal risks for breast cancer associated with different hormone replacement therapies: results from the E3N cohort study. Breast Cancer Res Treat, 107(1), 103-111. doi: 10.1007/s10549-007-9523-x
- Fournier, A., Dossus, L., Mesrine, S., Vilier, A., Boutron-Ruault, M. C., Clavel-Chapelon, F., & Chabbert-Buffet, N. (2014). Risks of endometrial cancer associated with different hormone replacement therapies in the E3N cohort, 1992-2008. Am J Epidemiol, 180(5), 508-517. doi: 10.1093/aje/kwu146
- Fournier, A., Fabre, A., Mesrine, S., Boutron-Ruault, M. C., Berrino, F., & Clavel-Chapelon, F. (2008). Use of different postmenopausal hormone therapies and risk of histology- and hormone receptor-defined invasive breast cancer. J Clin Oncol, 26(8), 1260-1268. doi: 10.1200/jco.2007.13.4338
- Fournier, A., Mesrine, S., Dossus, L., Boutron-Ruault, M. C., Clavel-Chapelon, F., & Chabbert-Buffet, N. (2014). Risk of breast cancer after stopping menopausal hormone therapy in the E3N cohort. Breast Cancer Res Treat, 145(2), 535-543. doi: 10.1007/s10549-014-2934-6
- Lyytinen HK, Dyba T, Ylikorkala O, Pukkala El. A case-control study on hormone therapy as a risk factor for breast cancer in Finland: Intrauterine system carries a risk as well. Int J Cancer 2010;126(2):483-9
- Morch, L. S., Kjaer, S. K., Keiding, N., Lokkegaard, E., & Lidegaard, O. (2016). The influence of hormone therapies on type I and II endometrial cancer: A nationwide cohort study. Int J Cancer, 138(6), 1506-1515. doi: 10.1002/ijc.29878
- NICE guideline menopause: diagnosis and management (NG23) (2017)
- Ruan X, Mueck AO. Systemic progesterone therapy--oral, vaginal, injections and even transdermal? Maturitas 2014;79(3):248-55
- Sjogren, L. L., Morch, L. S., & Lokkegaard, E. (2016). Hormone replacement therapy and the risk of endometrial cancer: A systematic review. Maturitas, 91, 25-35. doi: 10.1016/j.maturitas.2016.05.013
Evidence tabellen
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?
Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported?
Yes/no/unclear |
|
Asi et al. 2016 ("ACOG Committee Opinion No. 420, November 2008: hormone therapy and heart disease," 2008) |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
|
Sjogren et al. 2016 (Sjogren et al., 2016) |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Risk of bias-tabel voor mammacarcinoom
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?
(unlikely/likely/unclear)
|
Bias due to ill-defined or inadequately measured outcome ?
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?
(unlikely/likely/unclear) |
|
Fournier 2008 (Fournier, Fabre, et al., 2008) |
Unlikely (The exposed cohort was somehow representative, the non-exposed cohort was drawn from the same community) |
Unlikely (adequacy of follow-up cohort) |
Unlikely (self-report questionnaires of files of health insurance plan, pathology reports were obtained in 96% of cases) |
Unclear |
|
Espie 2007 (Espie et al., 2007) |
Unlikely (The exposed cohort was somehow representative, the non-exposed cohort was drawn from the same community) |
Unlikely (adequacy of follow-up cohort) |
Likely (no co description of assessment of outcome) |
Unclear |
|
Cordina – Duverger 2013 (Cordina-Duverger et al., 2013) |
Unlikely (The exposed cohort was somehow representative, the non-exposed cohort was drawn from the general population within predefined quotas by age and socio-economic status (SES).) |
Unclear |
Likely (The statistical analysis was based on small sample sizes. The primary endpoint important for power calculation was not given) |
Likely (Dosage and route of administration of progesterone were not assessed). |
Evidence table systematic review breast cancer
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Asi 2016 (Asi et al., 2016)
|
SR and meta-analysis of cohort and case-control studies
Literature search up to May 2016
A: Espie 2007 B: Fournier 2008 C: Cordina-Duverger 2013
Study design: A: Cohort B: Cohort C: Case-control
Setting and Country: A: France B: France C: France
Source of funding: Non-commercial
|
Inclusion criteria SR: women aged 45 – 59 years within 1- years of menopause, using MHT (comparing estrogen + progesterone with estrogen +synthetic progestins), >6 months follow-up period
Exclusion criteria SR: not described
3 studies included
N A 4949 women B: 80.377 women C: 1555 women
|
A: Estradiol + natural progesterone B: Estrogen + progesterone C: Estrogen + progesterone
|
A: Estradiol + synthetic progestins (excluding medroxyprogesterone acetate and 19-nortestosterone derivatives) B: Estrogen + synthetic progestins (alsmost exclusively estradiol compounds) C: Estrogen + synthetic progestins
|
End-point of follow-up: A: 2.4 years B: 8.1 years C: 4 years
|
Outcome measure-1 Defined as breast cancer
A: Breast cancer incidence Estradiol + progesterone 0.40% (4/999) Estradiol + synthetic progestin 0.94% (12/1272) RR 0.42 (95% CI 0.13 – 1.31) B: Breast cancer incidence Estradiol + progesterone 0.40% (4/999) Estradiol + synthetic progestin 0.94% (12/1272) Breast cancer risk (RR) RR 0.67 (95% CI 0.76 – 0.81) C: Breast cancer risk Estrogen + progesterone OR 0.80 [95% CI 0.44-1.43] Estradiol + synthetic progestin OR 1.72 [95% CI 1.11-2.65]
|
Conclusion: Observation studies suggest that estrogen and progesterone use may be associated with lower breast cancer risk compared to synthetic progestin.
Only low-risk women are included in these studies, since common practice in France is to avoid prescribing MHT to high-risk women. |
MHT = menopausal hormone therapy
Evidencetabel mammacarcinoom
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Fournier 2008 (Fournier, Berrino, et al., 2008)
|
Type of study Prospective cohort study
Setting Women, living in metropolitan France and insured by the Mutuelle Générale de l’ Education Nationale
Country
Source of funding Financial support of the “Mutuelle Générale de l’Education Nationale” (MGEN); European Community; French League against Cancer (LNCC); Gustave Roussy Institute (IGR); French Institute of Health and Medical Research (Inserm); 3M Company. |
Inclusion criteria: Postmenopausal women
Exclusion criteria: A cancer other than a basal cell carcinoma, no age at first HRT use available
N total at baseline: Cases: 2,265 Control: 78,112
Important prognostic factors: Age (mean) + SD 55.0 ±4.8 for MHT never-users, 52.3 ± 4.1 for MHT ever-users
|
Estrogen + progesterone (almost exclusively estradiol compounds) |
Estrogen + synthetic progestins (almost exclusively estradiol compounds) |
Length of follow-up: Mean duration 8.1 postmenopausal years
Loss to follow-up The last follow-up questionnaire was completed by 88.7% of the 80,377 women;
Reasons of incomplete data of the 9,095 non-respondents, 892 had been diagnosed with a cancer, 866 had died, and 7,337 were lost to follow-up (of them, 3,979 had replied to the previous questionnaire).
|
Outcome measures and effect size (include 95%CI and p-value if available):
The association of estrogen-progestagen combinations with breast cancer risk varied significantly according to the type of progestagen: the relative risk was 1.00 (0.83-1.22) for estrogen-progesterone, 1.16 (0.94-1.43) for estrogen-dydrogesterone, and 1.69 (1.50-1.91) for estrogen combined with other progestagens. This latter category involves progestins with different physiologic activities (androgenic, nonandrogenic, antiandrogenic), but their associations with breast cancer risk did not differ significantly from one another. |
|
|
Espié 2007 (Espie et al., 2007) |
Type of study Prospective observational study
The MISSION Study (Menopause: Risk of Breast Cancer, Morbidity and Prevalence)
Setting Multiple centre study
Country France
Source of fundingResearch support from THERAMEX Laboratories, a subsidiary of theMerck Serono group.
|
Inclusion criteria: Women on HRT Natural progesterone, a progesterone-like compound, a pregnane derivative or a norpregnane derivative
Exclusion criteria: 19-nortestosterone derivatives, formulations containing medroxyprogesterone acetate
N total at baseline: Cases: 2693 women Control: 2256 women
Important prognostic factors: Female age I: 60.6 ± 6.3 years C: 64.2 ± 8.3 years
|
Women on HRT regimens commonly prescribed in France or who had stopped < or =5 years previously. |
Women who had never received HRT or stopped >5 years previously |
Length of follow-up: Mean duration 2,5 postmenopausal years
Loss to follow-up: 1806 (26.7%) of patients, no case report form was obtained.
Reasons of incomplete data Of these patients, eight died, 195 officially withdrew, 1603 had not returned to gynecologist or were lost to follow-up |
The breast cancer incidence was 0.28% for estradiol alone, 0.40% for estradiol + natural progesterone, and 0.94% for estradiol+ synthetic progestin; there was no statistically significant difference between the groups.
|
|
|
Cordina-Duverger 2013 (Cordina-Duverger et al., 2013) |
Type of study Case–control study
Setting Population-based case-control study in two French administrative areas (départements) located in Eastern and Western part of France, respectively.
Country France
Source of funding Grants from the French National Institute of Cancer (INCa), Fondation de France, the French Agency for Environmental and Occupational Health Safety (ANSES – ex-AFSSET), the French National Research Agency (ANR), the League against Cancer (Grand Ouest). |
Inclusion criteria: Menopausal women (no menstruation for twelve months or more (natural menopause, bilateral oophorectomy, or if they used MHT before natural cessation of menstruation
Exclusion criteria: Women with unknown menopausal status below 50 years old were excluded from the analysis.
N total at baseline: Cases: 739women Control: 816 women
Important prognostic factors: Female age Range (25 – 75 years)
|
The case group included incident cases of in situ or invasive breast cancer, women aged 25-75. |
The control group included women from the general population within predefined quotas by age and socio-economic status (SES). |
Length of follow-up: Mean duration 4 years
Loss to follow-up: Unclear? |
Compared to never MHT use, current use of EPT containing a synthetic progestogen for 4 or more years was associated with a significantly increased BC risk (adjusted OR 2.07; 95 % CI 1.26–3.39), but EPT containing micronized progesterone was not (adjusted OR 0.79; 95 % CI 0.37–1.71). |
The statistical analysis was based on small sample sizes. The primary endpoint important for power calculation was not given. Dosage and route of administration of progesterone were not assessed.
|
MHT menopausal hormone therapy
Risk of bias-tabel voor hart- en vaatziekten
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?
(unlikely/likely/unclear)
|
Bias due to ill-defined or inadequately measured outcome ?
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?
(unlikely/likely/unclear) |
|
Canonico 2016 (Canonico et al., 2016) |
Unlikely (The exposed cohort was somehow representative, the non-exposed cohort was drawn from the same community) |
Unclear |
Unlikely (Clear description outcome measure, series of sensitivity analysis to assess the robustness the findings were performed). |
Likely (Incomplete data on risk factors and comorbidities) |
Evidencetabel cardiovasculaire mortaliteit/morbiditeit
|
Study reference |
Study characteristics |
Patient characteristics2 |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Canonico 2016 (Canonico et al., 2016) |
Type of study Nested case-control study
Setting Participants were identified using the French National Health Insurance database and French National hospital data
Country France
Source of funding The study was supported by National Institute of Health and Medical Research (INSERM) and Institute of Research in Public Health (IReSP) in France |
Inclusion criteria: French women first hospitalization for a stroke aged 51 to 62 years
Exclusion criteria: Excluded cases identified in aftercare and rehabilitation units or home hospitalization, contraindication to HT use, personal history of cardiovascular disease or gynecological cancers (breast, uterine, ovary), cases using antithrombotic
N total at baseline: Cases: 3144 Controls: 12 158
Important prognostic factors: Female age I: 56.7 ± 2.8 years C: 56.6 ± 2.7years |
HT users were classified according to route of estrogen administration (oral or transdermal) and type of concomitant progestogen (progesterone, pregnane derivatives, norpregnane derivatives, and nortestosterone derivatives). |
Controls were randomly selected among healthy women who had never been hospitalized during the follow-up and who had no contraindication to HT use |
Follow-up Covers 3 consecutive years |
Conditional logistic regression was used to estimate odds ratios (OR) and 95% confidence intervals (95% CI)
There was no association of IS with use of progesterone (OR, 0.78; 95% CI, 0.49-1.26), pregnanes (OR, 1.00; 95% CI, 0.60-1.67) and nortestosterones (OR, 1.26; 95% CI, 0.62-2.58), whereas norpregnanes increased IS risk (OR, 2.25; 95% CI, 1.05-4.81). |
Incomplete data on risk factors and comorbidities |
Risk of bias-tabel voor veneuze trombo-embolische processen
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear)
|
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Canonico 2007 (Canonico et al., 2007) |
Unlikely (The exposed cohort was somehow representative, the non-exposed cohort matched for center, 2-year age band, admission date, and area of residence, matched with 1 to 3 controls) |
Unclear |
Unlikely (Clear description outcome measure). |
Unlikely (adjustment for age, obesity status, familial history of VTE, and varicose veins, education, age at menopause, hysterectomy, and cigarette smoking) |
|
Canonico 2010 (Canonico et al., 2010) |
Likely (Women recruited in the E3N study were mostly teachers and could represent a health-conscious population). |
Unlikely (adequacy of follow-up cohort) |
Likely (HT use was self-reported and nondifferential misclassifications regarding exposure might have occurred during follow-up) |
Unlikely (adjustment for for age, body-mass index, parity, education level, and time-period). |
Evidencetabel veneuze trombo-embolische processen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Canonico 2007(Canonico et al., 2007)
|
Type of study Case-control study
Setting: Multicenter study, 8 hospitals and in the general population
Country: France
Source of funding: Multiple foundations in France and by grants from Aventis, Besins International, Sanofi, and Servier Institute |
Inclusion criteria: All women aged 51 to 62 years with a first hospitalization for a stroke
Exclusion criteria: A history of VTE, contraindication for hormone therapy (breast cancer, endometrial cancer, and cardiovascular disease), predisposing factor for VTE
N total at baseline: Cases: 271 Control: 610
Important prognostic factors: Female age I: 61.6 ± 6.7 years C:61.5 ± 6.6 years
|
Women were classified as users of micronized progesterone or pregnane derivatives, norpregnane derivatives, or nortestosterone derivatives. Pregnane derivatives included dydrogesterone or medrogestone, chlormadinone acetate, cyproterone acetate, or medroxyprogesterone acetate. Norpregnane derivatives included either nomegestrol acetate or promegestone |
Controls had to have been admitted to the hospital with an a priori diagnosis unrelated to estrogen use (diseases of eye, ear, skin, respiratory and alimentary tracts, bones and joints, and kidneys; infectious diseases; and diabetes). Cases and controls were matched for center, 2-year age band, admission date, and area of residence. Each case was matched with 1 to 3 controls. |
Study period from 1999 - 2006
|
There was no significant association of VTE with micronized progesterone and pregnane derivatives (OR, 0.7; 95% CI, 0.3 to 1.9 and OR, 0.9; 95% CI, 0.4 to 2.3, respectively). In contrast, norpregnane derivatives were associated with a 4-fold-increased VTE risk (OR, 3.9; 95% CI, 1.5 to 10.0).
|
Small number of subjects within progestogen subgroups, especially among users of oral estrogen |
|
Canonico 2010 (Canonico et al., 2010) |
Prospective cohort study
Setting: E3N is a prospective cohort initiated in 1990, the aim of which is to investigate risk factors for cancer in women.
Country French
Source of funding: Financial support of the MGEN, European Community; French League against Cancer, Gustave Roussy Institute, French Institute of Health and Medical Research, 3M Company. |
Inclusion criteria: Postmenopausal women
Exclusion criteria: Personal history of thrombotic events or cancer before the start of follow-up N total at baseline: Cases: 549 Control: 80 308
Important prognostic factors: At the beginning of follow-up female age 54.0 years, mean body-mass index 22.6 kg/m2.
|
Progestogens were categorized according to the progestogen North American Menopause Society (NAMS) classification. Women were classified as users of either micronised progesterone, pregnane derivatives, norpregnane derivatives, or nortestosterone derivatives. Pregnane derivatives included dydrogesterone, medrogestone, chlormadinone acetate, cyproterone acetate, and medroxyprogesterone acetate. Norpregnane derivatives included nomegestrol acetate and promegestone. Nortestosterone derivatives were norethisterone acetate |
Non-users |
Average follow-up: 10.1 years
In the principal analysis, 65 of the validated cases were excluded because no information on predisposing factors was available. |
The main clinical outcome was a first documented incident episode of pulmonary embolism or lower-extremity deep vein thrombosis having occurred without any of the following predisposing factors (ie, cancer, surgery, immobilization, or trauma).
Hazard ratios (HR) and 95% confidence intervals (CI) were estimated using Cox proportional models. The thrombotic risk significantly differed by concomitant progestogens type (homogeneity: P<0.01): there was no significant association with progesterone, pregnanes, and nortestosterones (HR=0.9; 95% CI: 0.6 to 1.5, HR=1.3; 95% CI: 0.9 to 2.0 and HR=1.4; 95% CI: 0.7 to 2.4). However, norpregnanes were associated with increased thrombotic risk (HR=1.8; 95% CI: 1.2 to 2.7). |
Women recruited in the E3N study were mostly teachers and could represent a health-conscious population
Another limitation is that HT use was self-reported and nondifferential misclassifications regarding exposure might have occurred during follow-up |
Evidencetabel endometrial cancer
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Sjögren et al. 2016 (Sjogren et al., 2016)
|
SR of cohort studies
Literature search up to March 2016
A: Fournier 2014 B: Allen 2010
Study design: cohort [prospective and retrospective]
Setting and Country: A: France B: Denmark, France, Germany, Netherlands, Italy, Norway, Spain, United Kingdom
Source of funding: Non-commercial |
Inclusion criteria: Women with an intact uterus being treated with systemic hormone therapy for menopausal symptoms.
Exclusion criteria: Carrier of BRCA1 and 2 genes or if history of current or prior gynecological cancers, breast cancer, hysterectomy or hormonal therapy within one month prior to the beginning of the study.
2 studies included
Important patient characteristics at baseline: A: 65.630 women B: 370.000 women Mean age A: 64.3 years B: 57 years, at diagnosis 65 years |
Studies on any combination of unopposed estrogen, continuous and sequential combined estrogen plus progestin compared with placebo or never-users were included. SERM and antiestrogens were not considered. Only oral regimens and treatment lasting at least a year were considered.
A: Hormone therapy B: Hormone therapy
|
A: Never users of MHT B: Never users of MHT
|
End-point of follow-up: A: 10.8 years B: 9.0 years
No complete outcome available: A: For 9,541 no follow-up was available. B: Of the 370,000 women incomplete follow-up data (n = 2,296), or no return of the baseline lifestyle questionnaire (n = 509).
|
Outcome measure Risk of endometrial cancer A: Risk of endometrial cancer identified by self-reports. B: Risk of endometrial cancer assessed by cancer registries, herof 81% verified by histology reports.
Effect measure: Cox proportional hazard ratio [95% CI]
A: Estradiol + progesterone HR 1.96 (95% CI 1.41 – 2.73); Estradiol + dydrogesterone HR 0.67 (95% CI 0.36 - 1.25); Estradiol + other progesterone derivative HR 0.65 (95% CI 0.41 - 1.02) B: Estradiol + progesterone HR 2.42 (95% CI 1.53 - 3.83); Estradiol + Progesterone derivative HR 1.23 (95% CI 0.84 - 1.79); Estradiol + Testosterone derivative HR 1.09 (95% CI 0.74 - 1.61)
|
Facultative:
For formulations with micronized progesterone, an increased risk with a HR of 1.96 (95% CI 1.41 – 2.73) and 2.42 (95% CI 1.53 – 3.83) was found.
A: Risk of bias: some risk of detection and performance bias, as outcome could not be excluded prior to baseline. GRADING of evidence: Reliable estimate, high external and internal validation high quality of evidence. B: Risk of bias: Low risk of selection bias. Some risk of detection bias. GRADING of evidence: high internal validity moderate quality of evidence.
|
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 19-01-2026
Beoordeeld op geldigheid : 15-06-2018
Samenstelling werkgroep
- C.A.H. Janssen, gynaecoloog Groene Hart Ziekenhuis, Gouda (voorzitter)
- D.K.E. van Dijken, gynaecoloog OLVG West, Amsterdam
- M.M.A. Brood-Van Zanten, arts endocrinologische gynaecologie VUmc/AMC,
Antoni van Leeuwenhoek ziekenhuis, Amsterdam - M. Hemelaar, gynaecoloog Westfriesgasthuis, Hoorn
- L. Jaspers, seksuoloog, Erasmus MC, Rotterdam
- M.A.A. van Trotsenburg, gynaecoloog VUmc, Amsterdam
- E. van den Boogaard, AIOS AMC, Amsterdam
- N.M.P. Daan, AIOS St. Antonius Ziekenhuis, Nieuwegein
- M.M. van Dijk, AIOS LUMC, Leiden
- A. Rozeboom, junior adviseur Kennisinstituut van Medisch Specialisten
- E.M.E. den Breejen, senior adviseur, teamleider Kennisinstituut van Medisch Specialisten
Belangenverklaringen
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
C.A.H. Janssen |
gynaecoloog |
Geen |
geen |
geen |
|
D.K.E. van Dijken |
gynaecoloog |
Voorzitter DMS (onbetaald) |
geen |
geen |
|
M.M.A. Brood-van Zanten |
Arts, endocrinologische gynaecologie menopauze |
Geen |
geen |
geen |
|
M. Hemelaar |
gynaecoloog |
Geen |
geen |
geen |
|
L. Jaspers |
Seksuoloog |
Coördinator kamer wetenschap NVvS (onbetaald) |
geen |
geen |
|
M.A.A. van Trotsenburg |
gynaecoloog |
Bestuurslid DMS (onbetaald) |
geen |
geen |
|
N.M.P. Daan |
AIOS gynaecologie/ verloskunde |
Geen |
geen |
geen |
|
M.M. van Dijk |
AIOS gynaecologie/ verloskunde |
Arts-onderzoeker T4-life studie |
geen |
geen |
|
E. van den Boogaard |
AIOS gynaecologie/ verloskunde |
Geen |
geen |
geen |
Methode ontwikkeling
Evidence based
Zoekverantwoording
Gebruikte queries in Medline-database (Pubmed)
|
Search |
Query |
Items found |
|
#1 |
((((((((((("Postmenopause"[Mesh] OR "Perimenopause"[Mesh] OR postmenopaus* [tiab] OR post menopaus* [tiab] OR perimenopaus* [tiab] OR menopaus* [tiab]) AND ("Hormone Replacement Therapy"[Majr] OR "Estrogen Replacement Therapy"[Majr] OR hormone replacement therap* [title] OR hormonal replacement therap* [title] OR hormone therap* [title] OR estrogen replacement therap* [title])) AND (("Progestins"[Majr] OR "Progesterone"[Majr] OR progestin* [tiab] OR progestogen* [tiab] OR progesterone [tiab] OR levonorgestrel [tiab]) AND ("Estradiol"[Majr] OR "Estrogens"[Majr] OR estradiol [tiab] OR estrogen* [tiab] OR activelle [tiab] OR kliogest [tiab] OR angeliq [tiab] OR femoston [tiab])))))) AND (("dutch"[Language] OR "english"[Language]))) AND ("2000"[Date - Publication] : "3000"[Date - Publication]) AND ("Mortality"[Mesh] OR mortality [tiab] OR "Morbidity"[Mesh] OR morbidity [tiab] OR "Breast Neoplasms"[Majr] OR breast cancer* [ti] OR breast neoplasm* [ti] OR breast tumor* [ti] OR mamma carcinoma* [ti] OR "Cardiovascular Diseases"[Majr] OR heart disease* [ti] OR cardiovascular [ti] OR coronary heart [ti] OR myocardial infarct* [ti] OR stroke [ti] OR "Vascular Diseases"[Majr] OR "Thromboembolism"[Majr] OR thromboemboli* [ti] OR vascular disease* [ti] OR "Endometrial Neoplasms"[Majr] OR "Endometrial Hyperplasia"[Majr] OR endometrial carcinoma* [ti] OR endometrial cancer* [ti] OR endometrial hyperplasia [ti] OR endometrial neoplasm* [ti] OR endometrial histology [ti]))))) NOT (Comment[pt] OR Editorial[pt] OR Letter[pt] OR (“animals”[mesh] NOT “humans”[mesh])) |
696 |
Exclusietabel
|
Author and year |
Excluded on |
|
Aiello 2009 |
Wrong outcomes |
|
Al-Azzawi 2006 |
Wrong outcomes |
|
Alexandersen 2006 |
Wrong intervention |
|
Allen 2010 |
Wrong comparison |
|
Antoine 2016 |
Wrong outcomes |
|
Archer 2001 |
Wrong intervention |
|
Bakken 2011 |
Wrong intervention |
|
Benagiano 2004 |
Wrong study design |
|
Benkhadra 2015 |
Wrong intervention |
|
Bergendal 2016 |
Wrong comparison |
|
Billeci 2008 |
Wrong intervention |
|
Brinton 2014 |
Wrong study design |
|
Burbos 2012 |
Wrong outcomes |
|
Calle 2009 |
Wrong intervention |
|
Canchola 2010 |
Wrong intervention |
|
Canonico 2015 |
Wrong study design |
|
Canonico 2006 |
Wrong study design |
|
Collins 2005 |
Wrong setting |
|
Daling 2002 |
Wrong study design |
|
de Lignières 2002 |
Wrong intervention |
|
deVries 2006 |
Wrong comparison |
|
Depypere 2015 |
Wrong study design |
|
Doherty 2007 |
Wrong study design |
|
Douketis 2005 |
Wrong setting |
|
Flesch-Janys 2008 |
Wrong comparison |
|
Fournier 2005 |
Wrong study design |
|
Fournier 2008 |
Wrong study design |
|
Fournier 2009 |
Wrong study design |
|
Fournier 2014 |
Wrong study design |
|
Furness 2012 |
Wrong study design |
|
Furness 2009 |
Wrong study design |
|
Gadducci 2009 |
Wrong setting |
|
Garwood 2008 |
Wrong study design |
|
Graff-Iversen 2004 |
Wrong study design |
|
Greiser 2005 |
Wrong setting |
|
Harman 2005 |
Wrong setting |
|
Jaakkola 2011 |
Wrong intervention |
|
Jick 2009 |
Wrong intervention |
|
Jondet 2002 |
Wrong intervention |
|
Kirsh 2002 |
Wrong setting |
|
Lacey 2002 |
Wrong setting |
|
Lacey 2007 |
Wrong setting |
|
Lambrinoudaki 2014 |
Wrong study design |
|
Lethaby 2004 |
Wrong study design |
|
Løkkegaard 2013 |
Wrong study design |
|
Lyytinen 2009 |
Wrong study design |
|
Lyytinen 2010 |
Wrong study design |
|
Marjoribanks 2012 |
Wrong intervention |
|
Marshall 2010 |
Wrong setting |
|
Motival 2007 |
Wrong setting |
|
Mueck 2012 |
Wrong study design |
|
Ni 2012 |
Wrong study design |
|
Norman 2010 |
Wrong setting |
|
North American Menopause Society 2003 |
Wrong study design |
|
Olié 2011 |
Wrong study design |
|
Olsson 2003 |
Wrong setting |
|
Opatrny 2008 |
Wrong study design |
|
Panjari 2010 |
Wrong setting |
|
Pérez-López 2010 |
Wrong study design |
|
Phipps 2011 |
Wrong setting |
|
Prentice 2014 |
Wrong study design |
|
Renoux 2010 |
Wrong study design |
|
Razavi 2010 |
Wrong setting |
|
Renoux 2011 |
Wrong study design |
|
Roach 2013 |
Wrong comparison |
|
Román 2016 |
Wrong comparison |
|
Rosano 2001 |
Wrong study design |
|
Rosenberg 2006 |
Wrong setting |
|
Ruan 2012 |
Wrong study design |
|
Samsioe 2006 |
Wrong intervention |
|
Santen 2010 |
Wrong setting |
|
Sare 2008 |
Wrong setting |
|
Saxena 2010 |
Wrong setting |
|
Scarabin 2014 |
Wrong study design |
|
Schenck-Gustafsson 2011 |
Wrong study design |
|
Schneider 2009 |
Wrong study design |
|
Schneider 2009 |
Wrong study design |
|
Seeger 2008 |
Wrong study design |
|
Shah 2005 |
Wrong setting |
|
Shulman 2002 |
Wrong intervention |
|
Stahlberg 2004 |
Wrong study design |
|
Sturdee 2006 |
Wrong study design |
|
Stute 2014 |
Wrong study design |
|
Suhrke 2015 |
Wrong study design |
|
Sweetland 2012 |
Wrong study design |
|
Tjønneland 2004 |
Wrong setting |
|
Trabert 2013 |
Wrong setting |
|
Wells 2002 |
Wrong study design |
|
Wu 2005 |
Wrong setting |
