Drainbeleid
Uitgangsvraag
Wat is de meerwaarde van het gebruik van drains bij mammareductie?
Aanbeveling
Gebruik standaard geen drains bij een mammareductie.
Overweeg het gebruik van een drain bij mammareductie patiënten met een verhoogd bloedingsrisico of bij veel bloedverlies peroperatief.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is een systematische literatuuranalyse uitgevoerd waarbij het verwijderen van drains is vergeleken met het laten zitten van drains na een mammareductie. Daarbij is één Cochrane review geïncludeerd, die drie gerandomiseerde studies omvat.
De studies hadden beperkingen in het studie design, omdat blindering niet mogelijk was bij patiënten en chirurgen. Samen met het feit dat de studies klein waren, kwam met bewijskracht uit op laag tot zeer laag.
Voor de uitkomstmaten hematoom, oedeem, vetnecrose, wondproblemen, re-operatie en opnameduur in het ziekenhuis was veel onzekerheid en konden geen eenduidige conclusies worden getrokken op basis van de beschikbare literatuur.
Voor de incidentie van een seroom, het (gedeeltelijk) verlies van de tepel en pijn wordt geconcludeerd dat het laten zitten van de drain niet tot nauwelijks effect heeft t.o.v. het verwijderen van de drain.
Er werden geen studies gevonden die hersteltijd rapporteerden.
De overall bewijskracht voor het wel of niet verwijderen van drains is zeer laag.
Als we de bovengenoemde uitkomstmaten niet meenemen in de analyse naar draingebruik, komen er wel andere factoren naar voren die wellicht de keuze voor het al dan niet plaatsen van een drain kunnen ondersteunen. In de literatuur wordt beschreven dat patiënten met een drain gemiddeld langer in het ziekenhuis verblijven dan patiënten zonder drain. Daarnaast brengen patiënten met een drain vaak een extra bezoek aan het ziekenhuis voor het verwijderen van de drain.
Waarden en voorkeuren van patiënten
Er worden in de literatuur geen klinisch relevante verschillen beschreven, maar er wordt wel beschreven dat de aanwezigheid van drains bij patiënten kan leiden tot pijnklachten, dan wel discomfort. Bovendien geeft een drain meer kans op een litteken.
Kosten (middelenbeslag)
Het plaatsen van een drain/drains brengt extra kosten met zich mee ten opzichte van geen drain. Niet alleen de drain zelf, maar ook de eventuele hechting en/of pleister om de drain te fixeren en het werk voor de verpleegkundigen. Daarnaast krijgen patiënten bij ontslag vaak een drainpakket (of thuiszorg) mee naar huis wat tevens extra kosten met zich meebrengt. Een extra polibezoek vanwege de drain zorgt ook voor extra kosten.
Aanvaardbaarheid, haalbaarheid en implementatie
De verwachting is dat de aanvaardbaarheid en haalbaarheid om geen drains te gebruiken acceptabel is. Drains hebben geen duidelijke voordelen en zijn meer werk voor de verpleegkundigen.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Op basis van bovengenoemde punten en het feit dat er geen bewijs in de literatuur wordt gevonden dat een meerwaarde laat zien van het gebruik van drains bij mammareducties kan er geconcludeerd worden dat het gebruik van drains bij mammareducties niet nuttig, dan wel zinvol is.
Er kunnen bepaalde risicogroepen zijn waarbij een drain wel overwogen kan worden, bij patiënten met een verhoogd bloedingsrisico of bij veel bloedverlies peroperatief.
Onderbouwing
Achtergrond
Het wel of niet gebruiken van drains is in de literatuur al vele jaren controversieel. Het niet achterlaten van een drain wordt het best ondersteund door de literatuur. Echter in een groot Amerikaans onderzoek gaf 58% van de responderende 2665 plastisch chirurgen aan wel routinematig een drain achter te laten. Ook in Nederland laat 63% standaard, en nog eens 25% op indicatie drains achter (Van Huizum, 2009).
De reden voor het achterlaten van een drain na een borstverkleinende operatie is om eventueel bloed en vocht op te vangen in de eerste dagen na de operatie. De vraag is echter of dit wel nuttig dan wel noodzakelijk is om te doen. Het plaatsen van een drain brengt extra kosten met zich mee. Deze kosten bestaan niet alleen uit de drain zelf, maar ook uit een eventuele extra hechting en/of pleister die wordt geplaatst. Daarnaast laat de literatuur zien dat patiënten met een drain gemiddeld langer in het ziekenhuis verblijven dan patiënten zonder drain. En tenslotte brengen patiënten met een drain vaak een extra bezoek aan het ziekenhuis voor het laten verwijderen van de drain. Ook ervaren veel patiënten het hebben van een drain als pijnlijk dan wel onplezierig.
Conclusies / Summary of Findings
|
Very low GRADE |
The evidence is very uncertain about the effect of leaving drains on the incidence of hematoma, oedema, fat necrosis and wound problems when compared to removing drains in mamma reduction patients.
Source: Collis, 2005; Corion, 2009; Wrye, 2003. |
|
Low GRADE |
Leaving drains may result in little to no difference in the incidence of seroma, (partial) nipple loss and pain when compared to removing drains in mamma reduction patients.
Source: Collis, 2005; Corion, 2009; Wrye, 2003. |
|
Very low GRADE |
The evidence is very uncertain about the effect of leaving drains on reoperation and the length of hospital stay when compared to removing drains in mamma reduction patients.
Source: Corion, 2009. |
|
No GRADE |
No evidence was found regarding the effect of leaving drains on recovery time when compared with removing drains in mamma reduction patients.
Source: - |
Samenvatting literatuur
Description of study
A Cochrane review of Khan et al. (2015) was included. They included three RCTs that studied the efficacy and safety of the use of wound drains. The participants were female patients of all ages, who underwent elective plastic or reconstructive surgery of the breast. In table 1, an overview of the study characteristics for the three included RCTs is presented.
Table 1. Characteristics of the included studies.
|
Author, year |
Intervention |
Control |
N |
|
Collis, 2005 |
unilateral Bellovac closed suction drain in one breast |
no drain in the other breast (on the same patient) |
I: 150 C: 150 |
|
Corion, 2009 |
patients with drains in both breasts |
patients with no drains in either of their breasts |
I: 55 C: 52 |
|
Wrye, 2003 |
drain (no. 10 flat Blake or Jackson-Pratt) in one breast |
no drain in the other breast (on the same patient) |
I: 49 C: 49 |
Results
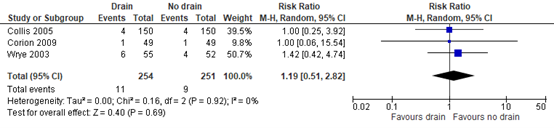
1. Hematoma
All three studies reported the incidence of hematoma. A risk ratio (RR) of 1.19 (95% confidence interval (CI) 0.51, 2.82) was found in favor of no drains (figure 1). This difference was clinically relevant.
Figure 1: Effect of drain use on the incidence of hematoma, drain versus no drain.
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistic heterogeneity; CI: Confidence Interval
2. Seroma
The occurrence of seroma was reported in two studies (Collis, 2005; Wrye, 2003).
Collis (2005) reported seroma in 1 out of 150 in the drain group and 1 out of 150 in the no drain group.
Wrye (2003) reported seroma in 0 out of 49 in the drain group and 0 out of 49 in the no drain group.
No differences were observed between drains or no drains.
3. Oedema
The occurrence of oedema was reported by Corion (2009).
In the drain group, 1 out of 55 reported oedema and in the no drain group 2 out of 52 (RR 0.47; 95% CI 0.04, 5.06). This difference was clinically relevant in favor of using drains.
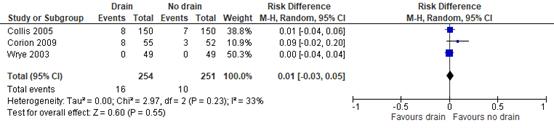
4. Infection
All three studies reported infections. A risk difference (RD) of 0.01 (95% CI -0.03, 0.05) was found in favor of no drain (figure 2). This difference was not clinically relevant.
Figure 2: Effect of drain use on the incidence of infections, drain versus no drain.
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistic heterogeneity; CI: Confidence Interval
5. Fat necrosis
The occurrence of fat necrosis was reported in two studies (Collis, 2005; Wrye, 2003).
Collis (2005) reported fat necrosis in 3 out of 150 (2%) in the drained group and 1 out of 150 (0.7%) in the no drain group (RR 3; 95% CI 0.32, 28.52).
Wrye (2003) reported fat necrosis in 2 out of 49 (4.1%) in the drained group and 1 out of 49 (2.0%) in the no drain group (RR 2; 95% CI 0.19, 21.34).
Both differences are clinically relevant in favor of no drains.
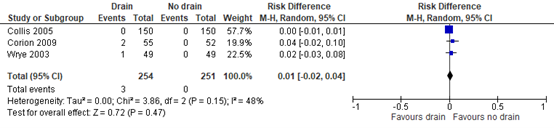
6. (Partial) nipple loss
All three studies reported the incidence of (partial) nipple loss. A RD of 0.01 (95% CI -0.02, 0.04) was found in favor of no drains (figure 3). This difference was not clinically relevant.
Figure 3: Effect of drain use on the incidence of (partial) nipple loss, drain versus no drain.
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistic heterogeneity; CI: Confidence Interval
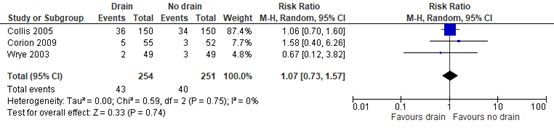
7. Wound problems
All three studies reported the incidence of wound problems (hypertrophic scarring, skin loss, wound dehiscence). A RR of 1.07 (95% CI 0.73, 1.57) was found in favor of no drains (figure 4). This difference was not clinically relevant.
Figure 4: Effect of drain use on the incidence of wound problems, drain versus no drain.
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistic heterogeneity; CI: Confidence Interval
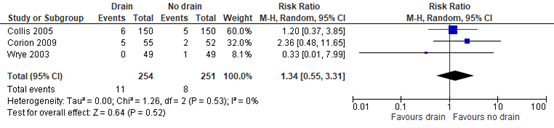
8. Reoperation
All three studies reported the proportion of patients requiring reoperation due to major complications. The reoperation was required to evacuate abscess and hematoma fluids. A RR of 1.34 (95% CI 0.55, 3.31) was found in favor of no drains (figure 5). This difference was clinically relevant.
Figure 5: Effect of drain use on reoperation, drain versus no drain.
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistic heterogeneity; CI: Confidence Interval
9. Pain
Pain was reported by Corion (2009).
On a visual analogue scale of 0 to 10, the drain group reported a mean pain score of 3.4 (SD 1.9) and the no drain group 3 (SD 1.8). The mean difference was 0.4 (95% CI -0.29, 1.09) in favor of no drains. This difference was not clinically relevant.
In addition, Wrye (2003) reported patients’ discomfort.
Immediately after discharge, 17 out of 19 (89%) patients experienced more comfort in the nondrained breast compared to the drained breast. A few reported the drained breast to be more painful or other problems were experienced. Little to no difference in comfort was reported by 2 out of 19 (11%) patients.
10. Recovery time
None of the included studies reported the patients’ recovery time.
11. Hospital length of stay
Corion (2009) reported hospital length of stay. The mean stay for the drained group was 2.62 days (SD 0.89), and 1.85 days (SD 1.04) for the non-drained group (MD 0.77; 95% CI 0.40, 1.14). This difference was not clinically relevant.
Level of evidence of the literature
The level of evidence started as high, since the included studies were RCTs.
The level of evidence regarding the outcome measure hematoma was downgraded by 3 levels because of study limitations (risk of bias, lack of blinding -1); number of included patients and the pooled confidence interval crossing the boundaries of clinical relevance (imprecision, -2). The level of evidence is very low.
The level of evidence regarding the outcome measure seroma was downgraded by 2 levels because of study limitations (risk of bias, lack of blinding -1); number of included patients (imprecision, -1). The level of evidence is low.
The level of evidence regarding the outcome measure oedema was downgraded by 3 levels because of study limitations (risk of bias, lack of blinding -1); number of included patients and wide confidence interval (imprecision, -2). The level of evidence is very low.
The level of evidence regarding the outcome measure infection was downgraded by 2 levels because of study limitations (risk of bias, lack of blinding -1); number of included patients (imprecision, -1). The level of evidence is low.
The level of evidence regarding the outcome measure fat necrosis was downgraded by 3 levels because of study limitations (risk of bias, lack of blinding -1); number of included patients and wide confidence intervals (imprecision, -2). The level of evidence is very low.
The level of evidence regarding the outcome measure (partial) nipple loss was downgraded by 2 levels because of study limitations (risk of bias, lack of blinding -1); number of included patients (imprecision, -1). The level of evidence is low.
The level of evidence regarding the outcome measure wound problems was downgraded by 3 levels because of study limitations (risk of bias, lack of blinding; -1); conflicting results (inconsistency, -1); number of included patients and the pooled confidence interval crossing the boundaries of clinical relevance (imprecision, -2). The level of evidence is very low.
The level of evidence regarding the outcome measure reoperation was downgraded by 3 levels because of study limitations (risk of bias, lack of blinding; -1); number of included patients and the pooled confidence interval crossing the boundaries of clinical relevance (imprecision, -2). The level of evidence is very low.
The level of evidence regarding the outcome measure pain was downgraded by 2 levels because of study limitations (risk of bias, lack of blinding -1); number of included patients (imprecision, -1). The level of evidence is low.
No studies were included reporting recovery time.
The level of evidence regarding the outcome measure hospital length of stay was downgraded by 3 levels because of study limitations (risk of bias; -1); number of included patients (imprecision, -2). The level of evidence is very low.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the favorable and unfavorable effects of leaving drains compared with removing drains in patients after mamma reduction surgery?
P: patients Mamma reduction patients
I: intervention Drains
C: control No drains
O: outcome measure (Postoperative) seroma, (postoperative) oedema, recovery time, hematoma, wound breakdown, fat necrosis, (partial) nipple loss, infection, reoperation, discomfort/pain, hospital length of stay
Relevant outcome measures
The guideline development group considered reoperation as a critical outcome measure for decision making; hematoma, seroma, oedema, wound breakdown, fat necrosis, (partial) nipple loss, infection, discomfort/pain, hospital length of stay as an important outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
For dichotomous outcome measures, the working group defined a difference of 10% was considered clinically relevant (relative risk: 0.91≤RR≥1.10 or -0.10≤RD≥0.10).
For the continuous outcome measures, the working group defined mean difference of 1 point for pain scores and 1 day for hospital length of stay as a minimal clinically (patient) important difference.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 16-05-2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 135 hits. Studies were selected based on the following criteria:
- Randomized controlled trial or systematic review of randomized controlled trials
- Published ≥ 2000
- Patients ≥ 18 years
- Conform PICO
Twelve studies were initially selected based on title and abstract screening. After reading the full text, eleven studies were excluded (see the table with reasons for exclusion under the tab Methods), and one study was included.
Results
One systematic review was included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Collis N, McGuiness CM, Batchelor AG. Drainage in breast reduction surgery: a prospective randomised intra-patient trail. Br J Plast Surg. 2005 Apr;58(3):286-9. doi: 10.1016/j.bjps.2004.11.018. PMID: 15780221.
- Corion LU, Smeulders MJ, van Zuijlen PP, van der Horst CM. Draining after breast reduction: a randomised controlled inter-patient study. J Plast Reconstr Aesthet Surg. 2009 Jul;62(7):865-8. doi: 10.1016/j.bjps.2008.01.009. Epub 2008 Jun 18. PMID: 18562265.
- Khan SM, Smeulders MJ, Van der Horst CM. Wound drainage after plastic and reconstructive surgery of the breast. Cochrane Database Syst Rev. 2015 Oct 21;2015(10):CD007258. doi: 10.1002/14651858.CD007258.pub3. PMID: 26487173; PMCID: PMC8627700.
- Wrye SW, Banducci DR, Mackay D, Graham WP, Hall WW. Routine drainage is not required in reduction mammaplasty. Plast Reconstr Surg. 2003 Jan;111(1):113-7. doi: 10.1097/01.PRS.0000037867.10862.80. PMID: 12496571.
Evidence tabellen
Evidence tables
Research question: What are the favorable and unfavorable effects of leaving drains compared with removing drains in patients after mamma reduction surgery?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Khan, 2015 |
SR and meta-analysis of RCTs
Literature search up to March 2015
A: Collis, 2005 B: Corion, 2009 C: Wrye, 2003
Study design: A: RCT B: RCT C: RCT
Setting and Country: A: United Kingdom B: The Netherlands C: the United States
Source of funding and conflicts of interest: None
|
Inclusion criteria SR: RCTs comparing the use of wound drain with no wound drain after plastic and reconstructive surgery of the breast in female patients
Exclusion criteria SR: -
3 studies included
Important patient characteristics at baseline:
N, mean age A: 150 patients, 37 yrs B: 107 patients, 35 yrs C: 49 patients, 33 years
mean BMI A: 29 B: 26 C: NR
Groups comparable at baseline? Not reported |
Describe intervention:
A: unilateral Bellovac closed suction drain in one breast. B: patients with drains in both breasts C: drain (no. 10 flat Blake or Jackson-Pratt) in one breast
|
Describe control:
A: no drain in the other breast (on the same patient). B: patients with no drains in either of their breasts C: no drain in the other breast (on the same patient)
|
End-point of follow-up:
A: 3 months B: until discharge C: 5-17 months (mean 9 months)
For how many participants were no complete outcome data available? (intervention/control) A: 0.67%/0.67% B: 0% C: 40% (for secondary outcome measure; patient satisfaction and review of complications)
|
Hematoma Defined as “a breast more swollen and firm than the contralateral breast”
Effect measure: RR [95% CI]: A: 1 [0.25,3.92] B: 1.42 [0.42,4.74] C: 1 [0.06,15.54]
Pooled effect (fixed effects model): RR 1.19 [95% CI 0.50 to 2.80] favoring no drain Heterogeneity (I2): I: 11/254; C: 9/251 (I2 = 0%)
Infection
A: 1.14 [0.43,3.07] B: 2.52 [0.71,8.99] C: not estimable
Pooled effect (fixed effects model): RR 1.56 [0.73,3.37] favoring no drain I: 16/254; C: 10/251 (I2 = 0%)
Oedema: Effect measure: RR [95% CI]: B: I: 1/55; C: 2/52; RR 0.47 [0.04,5.06]
Seroma: Effect measure: RR [95% CI]: A: I: 1/150; C: 1/150; RR 1 [0.06,15.84] C: I: 0/49; C: 0/49; not estimable
Fat necrosis: Effect measure: RR [95% CI]: A: I: 3/150; C: 1/150; RR 3 [0.32, 28.52] C: I: 2/49; C: 1/49; RR 2 [0.19, 21.34]
(Partial) nipple loss Effect measure: RR [95% CI]: A: Not estimable B: 3 [0.13,71.89] C: 4.73[0.23,96.3]
Pooled effect (fixed effects model): RR 3.88 [95% CI 0.44 to 34.24] favoring no drain I: 3/254; C: 0/251 (I2 = 0%)
Pain Effect measure: MD [95% CI]: B: 0.4 [-0.29,1.09] favoring no drain
Hospital length of stay Effect measure: MD [95% CI]: B: 0.77 [0.4,1.14] favoring no drain
Major complications (i.e. reoperation) Pooled effect (fixed effects model): RR 1.33; 95% CI 0.56 to 3.17, favoring no drain (I: 11/254, C: 8/251)
|
The limited evidence available shows no significant benefit of using post-operative wound drains in reduction mammoplasty, though hospital stay may be shorter when drains are not used.
Sensitivity analyses were performed for low vs. high methodological quality
There was no indication for heterogeneity |
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
Research question: What are the favorable and unfavorable effects of leaving drains compared with removing drains in patients after mamma reduction surgery?
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Collis, 2005 |
Probably no;
Reason: Patients were ‘prospectively randomised intra-operatively’ , randomisation procedure was not discussed. |
Probably no;
Reason: Not reported |
Definitely no;
Reason: Blinding could not be achieved in patients, personnel and outcome assessors. |
Probably yes;
Reason: ‘One patient was excluded after the drain was accidentally avulsed in the early post-operative period’ . Reason for exclusion is not reported |
Probably yes;
Reason: Study protocol not available, however all relevant outcomes were reported. |
Definitely yes;
Reason: No other problems noted |
HIGH
Reason: lack of blinding, lack of randomization and concealment (all outcomes) |
|
Corion, 2009 |
Probably no;
Reason: Patients were ‘prospectively randomised during surgery’, randomisation procedure was not discussed. |
Probably yes;
Reason: Assignment by an independent investigator. |
Probably no;
Reason: ‘Patients were not assigned to the experimental groups until the subcutaneous sutures were placed’. The surgeon was unaware if the patient would receive a drain till the end of the surgery. Blinding of the outcome assessors could not be carried out, due to scarring. |
Definitely yes;
Reason: : ‘Intention to treat analysis was not performed, because all the patients received the treatment they were selected for’ No patient data were lost. |
Probably yes;
Reason: Study protocol not available, however all relevant outcomes were reported. |
Definitely yes;
Reason: No other problems noted |
Some concerns
Reason: lack of blinding, lack of randomization (all outcomes) |
|
Wrye, 2003 |
Probably no;
Reason: each patient was randomised to receiving a drain in either the right or left breast. They acted as their own control. The randomisation method was not discussed. |
Probably no;
Reason: Not reported |
Definitely no;
Reason: Patients could not be blinded. It is not reported when the surgeon was made aware which breast would receive a drain. Blinding of outcome assessors could not be performed. |
Probably no;
‘Data was available at the final outcome assessment for wound complications (primary outcome). However participants were followed up for a review of complications and patient satisfaction and this data were incomplete (40% of total participants). |
Probably yes;
Reason: Study protocol not available, however all relevant outcomes were reported. |
Definitely yes;
Reason: No other problems noted |
HIGH
Reason: lack of blinding, lack of randomization and concealment (all outcomes) |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Collis N, McGuiness CM, Batchelor AG. Drainage in breast reduction surgery: a prospective randomised intra-patient trail. Br J Plast Surg. 2005 Apr;58(3):286-9. |
Included in Khan et al. |
|
Corion LU, Smeulders MJ, van Zuijlen PP, van der Horst CM. Draining after breast reduction: a randomised controlled inter-patient study. J Plast Reconstr Aesthet Surg. 2009 Jul;62(7):865-8. |
Included in Khan et al. |
|
Daar DA, Bekisz JM, Chiodo MV, DeMitchell-Rodriguez EM, Saadeh PB. Hematoma After Non-Oncologic Breast Procedures: A Comprehensive Review of the Evidence. Aesthetic Plast Surg. 2021 Dec;45(6):2602-2617. |
Not conform PICO: drain use not studies |
|
Kosins AM, Scholz T, Cetinkaya M, Evans GRD. Evidence-based value of subcutaneous surgical wound drainage: the largest systematic review and meta-analysis. Plast Reconstr Surg. 2013 Aug;132(2):443-450. |
Outdated publication with broad patient population |
|
Ngan PG, Iqbal HJ, Jayagopal S, Sillitoe AT, Dhital SK, Juma A. When to use drains in breast reduction surgery? Ann Plast Surg. 2009 Aug;63(2):135-7. |
Wrong study design |
|
Scott GR, Carson CL, Borah GL. Maximizing outcomes in breast reduction surgery: a review of 518 consecutive patients. Plast Reconstr Surg. 2005 Nov;116(6):1633-9; discussion 1640-1. |
Wrong study design |
|
Stojkovic CA, Smeulders MJ, Van der Horst CM, Khan SM. Wound drainage after plastic and reconstructive surgery of the breast. Cochrane Database Syst Rev. 2013 Mar 28;(3):CD007258. Update in: Cochrane Database Syst Rev. 2015;(10):CD007258. PMID: 23543550. |
Outdated publication (Updated version included - Khan et al.) |
|
Vandeweyer E. Breast reduction mammaplasty. Shall we drain? Acta Chir Belg. 2003 Nov-Dec;103(6):596-8. |
Wrong study design |
|
Vidali N, Chevet-Noel A, Ringenbach P, Andreoletti JB. Faut-il encore drainer les réductions mammaires ? [Should surgeons keep performing drainage after breast reduction?]. Ann Chir Plast Esthet. 2019 Feb;64(1):54-60. French. |
French language |
|
Weissler JM, Kuruoglu D, Antezana L, Curiel D, Kerivan L, Alsayed A, Banuelos J, Harless CA, Sharaf BA, Vijayasekaran A, Martinez-Jorge J, Tran NV, Nguyen MT. Efficacy of Tranexamic Acid in Reducing Seroma and Hematoma Formation Following Reduction Mammaplasty. Aesthet Surg J. 2022 May 18;42(6):616-625. |
Not conform PICO: wrong intervention; Wrong study design |
|
Wrye SW, Banducci DR, Mackay D, Graham WP, Hall WW. Routine drainage is not required in reduction mammaplasty. Plast Reconstr Surg. 2003 Jan;111(1):113-7. |
Included in Khan et al. |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 09-10-2023
Beoordeeld op geldigheid : 01-10-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten die een mammareductie ondergaan.
Werkgroep
Drs. E.M.J. (Esther) Mesters, (voorzitter), plastisch chirurg, NVPC
Drs. M.F. (Mirjam) Hoefkens, plastisch chirurg, NVPC
Dr. C. (Corinne) Schouten, plastisch chirurg, NVPC
Dr. C.P.H. (Celien) Vreuls, patholoog, NVVP
Drs. K.M. (Katya) Duvivier, radioloog, NVvR
Drs. L.J. (Laura) Schijf, radioloog, NVvR
Drs. K. (Klaartje) Spijkers, senior adviseur patiëntbelang, Patiëntenfederatie Nederland
Met ondersteuning van
Dr. F. Willeboordse, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
I. van Dijk, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
* Voorzitter |
Plastisch Chirurg
Mesters kliniek te Oisterwijk 01-12-2022 en Eyevolve-clinic te Schilde 01-12-2022 |
Geen |
Geen |
Geen actie |
|
Hoefkens |
Plastisch Chirurg - Alexander Monro Ziekenhuis (0,74 fte) |
Geen |
Geen |
Geen actie |
|
Schouten |
Plastisch chirurg in het Rijnstate Ziekenhuis in Arnhem. |
Geen |
Geen |
Geen actie |
|
Duvivier |
Radioloog AmsterdamUMC 0,8FTE |
Geen |
Geen |
Geen actie |
|
Schijf |
Radioloog AmsterdamUMC 0,7 FTE |
Geen |
Geen |
Geen actie |
|
Vreuls |
Patholoog (UMCU 0,8 FTE) |
voorzitter expert commissie mamma van de NVVP (onbetaald) |
Geen |
Geen actie |
|
Spijkers |
Senior adviseur bij MSZ Patiëntfederatie Nederland |
Geen |
Geen |
Geen actie |
|
Willeboordse |
Senior adviseur, Kennisinstituut Federatie Medisch specialisten |
Geen |
Geen |
Geen actie |
|
Van Dijk |
Junior adviseur, Kennisinstituut Federatie Medisch specialisten |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Patiëntenfederatie Nederland voor de schriftelijke knelpunteninventarisatie en afvaardiging in de werkgroep. Het verslag van de knelpunteninventarisatie (zie aanverwante producten) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module Preoperatieve beeldvorming |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Tepelsteeltechniek |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Drainbeleid |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Tranexaminezuur |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Postoperatief pathologisch onderzoek |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Organisatie van zorg |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten die een mammareductie ondergaan. Tevens zijn er knelpunten aangedragen door relevante partijen via een schriftelijke knelpunteninventarisatie. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
|
Database |
Zoektermen |
||||||||||||||||||||||||||||||||||||
|
Embase
|
|
||||||||||||||||||||||||||||||||||||
|
Medline (OVID)
|
1 (((mammoplast* or mammaplast*or mastoplast*) adj3 (reduction or reductive)) or ((breast or mamma) adj1 reduction*)).ti,ab,kf. or 'breast hypertroph*'.ti,ab,kf. or (macromast* or gigantomast*).ti,ab,kf. (3010) 2 exp Drainage/ or drain*.ti,ab,kf. (178113) 3 1 and 2 (83) 4 limit 3 to yr="2000-Current" (73) 5 4 not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) (69) 6 (meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) (564755) 7 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (2257611) 8 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (4017326) 9 5 and 6 (4) – SRs 10 (5 and 7) not 9 (13) - RCTs 11 (5 and 8) not (9 or 10) (31) - observationeel 12 9 or 10 or 11 (48) 13 5 not 12 (21) – overige studiedesigns |