Confirmatie; bepalen van de Plasmodium soort en parasitemie
Uitgangsvraag
Is species determinatie en bepaling van parasitemie altijd noodzakelijk voor het bepalen van de ernst van de malaria in het acute stadium?
Deze uitgangsvraag bevat de volgende deelvraag:
- Kan de ernst van de infectie ook betrouwbaar bepaald worden met andere parameters dan conventionele microscopie?
Aanbeveling
Bepaal bij het aantonen van een Plasmodium infectie zo snel mogelijk, maar bij voorkeur binnen 4 uur na de eerste bloedafname:
- species determinatie (onderscheid maken tussen P. falciparum- en non-falciparum malaria);
- parasitemie (bij P. falciparum- en verdenking op P. knowlesi malaria);
- aanwezigheid van delingsvormen.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar de waarde van behandeling op basis van parasitemie ten opzichte van behandeling op basis van enkel klinische parameters en laboratorium parameters voor het bepalen van de ernst van de malaria. Er is geen literatuur gevonden die aan de onderzoeksvraag voldoet. Hier ligt een kennislacune. De aanbevelingen zullen daarom gebaseerd worden op aanvullende argumenten waaronder expert opinion, waar mogelijk onderbouwd met (indirecte) literatuur.
Recent is een beschrijving verschenen van het klinisch beloop van alle patiënten gediagnosticeerd met malaria in Zweden tussen 1995 en 2015 (Wångdahl, 2019). Dit geeft inzichten die het belang van adequate en tijdige diagnostiek benadrukken. Een belangrijke prognostische factor in deze studie was de duur tot adequate malariadiagnostiek. Vertraging in deze diagnostiek was geassocieerd met een verhoogd risico op een slechter klinisch beloop (dokters delay 1 tot 6 dagen (aOR 3,3 tot 3,8) ten opzichte van geen delay). Ook stelde men vast dat als de diagnostiek plaatsvond buiten de grote academische centra, er een twee keer verhoogd risico bestond op een ernstiger beloop (laboratorium buiten Stockholm/Gotenburg (aOR 2,0) ten opzichte van laboratorium in Stockholm/Gotenburg). Dit suggereert dat in Zweden de ervaring en competentie van het diagnostisch laboratorium een prognostische factor is voor het beloop van een infectie met P. falciparum. De situatie in Zweden kan echter niet zomaar geëxtrapoleerd worden naar Nederland omdat de diagnostiek daar sterk gecentraliseerd is. De ‘diagnostic delay’ van 1-6 dagen, die daar gezien wordt, zal in Nederland niet snel het geval zijn. Bij ons gaat het om een vertraging in de orde van uren tot 2 dagen, het weekend meegerekend. Toch onderstreept deze studie het belang van tijdige diagnostiek. Het uitstellen van een adequate klinische beoordeling met juiste laboratoriumdiagnostiek verslechtert de prognose van een malaria infectie, ook in Nederland.
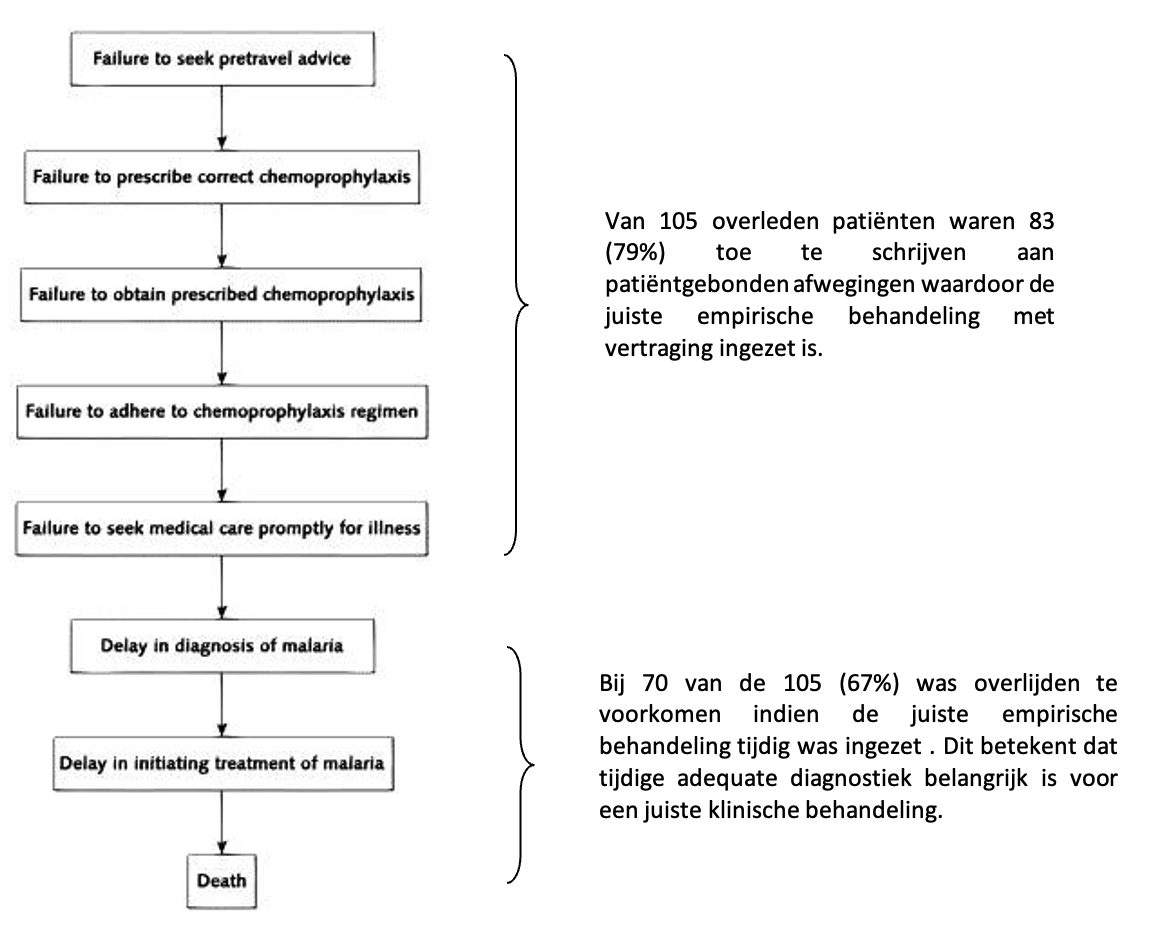
Een studie uit 2004 beschrijft de redenen voor het overlijden van patiënten met een malaria infectie in de Verenigde Staten (Newman, 2004). De auteurs schatten in dat 85% van de overlijdens (n=185) mogelijk te voorkomen was geweest als er een adequater beleid was gevoerd. N=24 van deze patiënten ontvingen geen empirische behandeling of ontvingen te laat de juiste behandeling.
Een literatuur review van 51 artikelen tot en met 2013 benadrukt het belang van tijdige diagnostiek en start van de juiste behandeling. Uitgestelde en inadequate diagnostiek lag ten grondslag aan 68 % van de gevallen van fatale P. falciparum malaria (Lüthi, 2015).
Figuur 1 Overlijden van patiënten met een malaria infectie. Gebaseerd op Newman (2004)
De behandeling van malaria wordt bepaald door de species en de ernst van de ziekte. Een belangrijke prognostische factor voor het bepalen van de ernst van ziekte bij P. falciparum malaria is de parasitemie bij presentatie. Dit bepaalt mede de keuze van initiële antiparasitaire behandeling en de plaats van behandeling (thuis, verpleegafdeling, bewaakte afdeling). Ernstige malaria heeft een hoge mortaliteit en dient zo spoedig behandeld te worden met artesunaat intraveneus (i.v.). (Therapierichtlijn Parasitaire Infecties, 2020; Nederlandse Vereniging voor Parasitologie; WHO malaria treatment guidelines). Tot de criteria voor ernstige P. falciparum malaria behoren een asexuele P. falciparum parasietenindex ≥ 5% of asexuele P. falciparum parasietenindex < 5% met delingsvormen dan wel met klinische complicaties. Ongecompliceerde hyperparasitemia (parasietenindex ≥ 2%) bij niet immune personen gaat gepaard met een verhoogd risico op een ernstig beloop. Patiënten kunnen in korte tijd verslechteren en dienen nauwlettend gemonitord te worden en zo spoedig mogelijk behandeld te worden met artesunaat i.v. (Therapierichtlijn Parasitaire Infecties, 2020; Nederlandse Vereniging voor Parasitologie; UK malaria treatment guidelines 2016 (Lalloo, 2016); WHO malaria treatment guidelines). Aanwezigheid van (ongecompliceerde) hyperparasitemie kan niet worden uitgesloten door middel van klinisch onderzoek en/of de resultaten van moleculaire, hematologische of biochemische bloedbepalingen.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Malaria is een potentieel dodelijke aandoening en vertraging in diagnose en behandeling kan leiden tot levensbedreigende complicaties. Zoals uit de bovenstaande literatuur blijkt is het tijdig diagnosticeren van malaria dan ook van groot belang voor patiënten. Anderzijds zal een negatief testresultaat op malaria aanleiding kunnen geven tot aanvullend onderzoek en behandeling van andere infecties dan malaria. Potentiële nadelen van het niet direct bepalen van de species determinatie, parasietenindex en aanwezigheid van delingsvormen voor de patiënt, is mogelijk onnodige ziekenhuisopname en behandeling met artesunaat i.v.
Kosten (middelenbeslag)
Microscopie voor het bepalen van species determinatie, parasietenindex en aanwezigheid van delingsvormen vergt beschikbaarheid van getraind personeel, ook buiten kantooruren. Training en beschikbaarheid van bekwaam personeel binnen- en buiten kantooruren brengt kosten met zich mee. Daarentegen is malaria een levensbedreigende aandoening en kan het niet tijdig verrichten van de juiste diagnostiek leiden tot ernstige complicaties, hetgeen ook hoge kosten met zich meebrengt. Het maken van (inter-)regionale afspraken over diagnostiek binnen en buiten kantoortijden kan kosten beperken.
Aanvaardbaarheid, haalbaarheid en implementatie
Malaria is een zeldzame importziekte in Nederland. Onbehandelde malaria kan snel leiden tot ernstige complicaties en overlijden. Malaria dient daarom altijd overwogen te worden bij mensen met koorts die recent zijn teruggekeerd uit gebieden waar malaria voorkomt. Bij hen dient diagnostiek naar malaria zonder vertraging plaats te vinden.
Patiënten met malaria, en vooral P. falciparum, kunnen in korte tijd verslechteren. De parasitemie en de aan- of afwezigheid van delingsvormen helpen bij het inschatten van de ernst van de infectie en de kans op complicaties, en bepalen mede de keuze voor antiparasitaire beleid.
Aanwezigheid van (ongecompliceerde) hyperparasitemie kan niet worden uitgesloten door middel van klinisch onderzoek en/of de resultaten van routine moleculaire, hematologische of biochemische bloedbepalingen. De concentratie van P. falciparum histidine-rich protein 2 (PfHRP2) correleert met de totale parasieten biomassa en is geassocieerd met ernst van de ziekte (Kwak, 2021). Ook markers van endotheel- en immuunactivatie, zoals angiopoietine-2 of soluble triggering receptor expressed on myeloid cells-1 (sTREM-1), zijn geassocieerd met ernst van ziekte en klinische uitkomst bij patiënten met P. falciparum malaria in endemische gebieden (McDonald, 2018; Yeo, 2008). Bepalingen van PfHRP2 en markers van endotheel- en immuunactivatie zijn echter niet gevalideerd en niet routinematig beschikbaar.
De werkgroep is daarom van mening dat bij een positieve screeningstest voor malaria, aanvullende microscopie voor het bepalen van P. falciparum vs. non-falciparum, de parasitemie en de aanwezigheid van delingsvormen zo spoedig mogelijk (uiterlijk binnen 2,5 uur na uitslag van de screeningstest) dient afgerond te zijn.
Microscopische beoordeling van een bloeduitstrijk bij malaria vergt specifieke training en ervaring. De zeldzaamheid van malaria en de beschikbaarheid van gekwalificeerd personeel buiten kantooruren vormt hierbij een mogelijke barrière.
De werkgroep is van mening dat er bij patiënten met malaria door P. falciparum, die in een centrum zijn beoordeeld door een internist-infectioloog met ervaring met malaria infecties, ’buiten kantooruren afgezien kan worden van direct microscopisch onderzoek. Dit betreft bijvoorbeeld een patiënt waar reeds gekozen is voor behandeling met artesunaat i.v. in combinatie met nauwlettende klinisch observatie voor het optreden van complicaties. In dergelijke situaties dient geborgd te zijn dat de behandelend arts op indicatie alsnog de complete uitslag van microscopie te allen tijde kan aanvragen. Ook moet geborgd zijn dat de complete microscopie alsnog de volgende ochtend beschikbaar dient te zijn.
De diagnose P.knowlesi infectie zal waarschijnlijk slechts overwogen worden gezien het beperkt voorkomen van deze infectie. Toch is deze diagnose belangrijk en moet hierbij stilgestaan worden. Als de parasitemie van een malaria-infectie onder de 2% is bij een verdenking op een P. knowlesi infectie, is er microscopisch geen handvat om de diagnose P. knowlesi te stellen: parasieten van P. malariae en P. knowlesi worden morfologische als identiek beschouwd. Bij een lage parasitemie kan met microscopie daarom alleen de verdenking op een P. knowlesi geopperd worden (b.v. bij een patiënt met op P. malariae lijkende parasieten in het bloed na een bezoek aan Maleisië). De uiteindelijke diagnose P. knowlesi kan vervolgens alleen gesteld worden met behulp van moleculaire diagnostiek, een procedure die niet binnen 4 uur afgerond kan zijn.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Er is geen literatuur gevonden om te onderbouwen dat het direct bepalen van parasitemie geassocieerd is met een betere prognose. Anderzijds kunnen patiënten met malaria, en vooral malaria ten gevolge van P. falciparum met een hoge parasitemie, in korte tijd verslechteren en zij moeten daarom bewaakt worden. Als de parasitemie niet bekend is, kan een patiënt niet in de thuissituatie behandeld worden. De parasitemie en de aan- of afwezigheid van delingsvormen helpen bij het inschatten van de ernst van de infectie en de kans op complicaties, en bepalen mede de keuze voor anti-parasitaire behandeling. De werkgroep is daarom van mening dat bij een positieve screeningstest op malaria, aanvullende microscopie voor het differentiëren van P. falciparum met non-falciparum, het bepalen van de parasitemie en het beoordelen van de aanwezigheid van delingsvormen bij voorkeur binnen 2,5 uur na uitslag van de screeningstest geleverd moet worden. De screeningstest heeft zelf een tijd tot uitslag heeft van maximaal 90 minuten, waardoor een parasitologische diagnose bij voorkeur binnen 4 uur na de eerste bloedafname compleet moet zijn. (Boonstra, 2021)
Microscopische beoordeling van een bloeduitstrijk bij malaria vergt specifieke training en ervaring. De zeldzaamheid van malaria en de beschikbaarheid van gekwalificeerd personeel buiten kantooruren vormen hierbij een mogelijke barrière. Het maken van (inter)regionale afspraken over diagnostiek buiten kantoortijden kan een oplossing bieden.
Onderbouwing
Achtergrond
Op dit moment bestaat er een grote verscheidenheid aan algoritmes van malariadiagnostiek, met name buiten kantooruren. (Boonstra, 2021) Er zijn ziekenhuizen waar 24 uur per dag (parasitologie) analisten op afroep beschikbaar zijn voor microscopie. In andere centra wordt gescreend met LAMP waarna wel of niet bevestiging met microscopie binnen 2 uur plaatsvindt. Ook zijn er ziekenhuizen die buiten kantooruren alleen gebruik maken van een antigeentest. Screening op een infectie met malaria is behandeld in module 1. Deze module richt zich op de vervolgdiagnostiek na een positieve screeningstest.
Vervolgdiagnostiek heeft drie doelen: 1) confirmatie van de diagnose die middels screening is verkregen 2) Specificeren van de malaria soort en 3) Bepalen van de ernst van infectie. Betrouwbare malariadiagnostiek zou in alle centra haalbaar en beschikbaar moeten zijn. Vanwege een beperkte beschikbaarheid van adequaat getraind analytisch personeel, met name buiten kantooruren, lijkt vervolgdiagnostiek een belangrijk knelpunt.
De werkgroep is van mening dat species determinatie tot het niveau P. falciparum versus non-falciparum in eerste instantie afdoende is. Deze kennis is voldoende om de juiste behandelkeuze te kunnen maken. Daarbij is van belang dat artemether/lumefantrine ook voor non-falciparum malaria tegenwoordig de eerste keus behandeling is (Therapierichtlijn parasitaire infecties NVP, 2020). P. knowlesii leidt vaker tot hyperparasitemie en een ernstige klinische presentatie en het aantonen van een hoge P. knowlesi parasitemie kan ook reden zijn om intraveneus artesunaat te starten. (Cox-Singh, 2008) P. knowlesi zal volgens deze redenering echter in het acute stadium het algoritme van een non-falciparum malaria volgen. Dit is momenteel acceptabel omdat importinfecties met P. knowlesi zeldzaam zijn. Bij een ernstige klinische presentatie bij een patiënt met non-falciparum malaria die teruggekeerd is uit een endemisch gebied voor P. knowlesi zal echter in het acute moment een parasitemie bepaald moeten worden zolang een infectie met P. knowlesi niet uitgesloten is.
Het tijdig bepalen van de parasitemie van een P. falciparum en P. knowlesi infectie is de belangrijkste parameter voor het bepalen van de ernst van de infectie en het inschatten van de kans op complicaties. Hierbij moet worden aangetekend dat de perifere parasitemie niet altijd goed correleert met het totale aantal parasieten in de circulatie/ totale parasieten biomassa. Dit vanwege sequestratie van geïnfecteerde erythrocyten in de microcirculatie (Uyoga, 2021). Bij het inschatten van de ernst van de infectie wordt naast de perifere parasitemie gevaren op bevindingen bij lichamelijk onderzoek en resultaten van andere bloedbepalingen zoals de aanwezigheid van een diepe anemie, hypoglycemie, metabole acidose en nier- of leverfunctiestoornissen.
Er is onderzoek gedaan naar de voorspellende waarde van hematologische parameters zoals thrombocyten en leukocyten voor de ernst van malaria. Een studie uit Nederland liet zien dat de voorspellende waarde van lymfocytopenie en de ratio tussen neutrofielen en lymfocyten onvoldoende was voor het inschatten van ernstige ziekte bij importmalaria (van Wolfswinkel, 2013; Nishimura, 2021). Andere studies bij zowel reizigers (Bruneel, Medicine 2016) als patiënten in malaria-endemische gebieden (Nishimura 2021; Uyoga 2021) hebben associaties beschreven tussen een breder scala aan biomarkers met parasitemie en de ernst van infectie. Voorbeelden van gastheer- en parasiet-gerelateerde biomarkers zijn C-reactive protein (CRP), procalcitonine, albumine, soluble triggering receptor expressed on myeloid cells (sTREM), en histidine-rich protein 2 (HRP2).
Species determinatie is niet meer belangrijk voor de empirische keuze voor anti-malaria middel. De NVP therapie richtlijn is zo aangepast dat artemeter combinatie preparaten of artesunaat de eerste keus is bij een positieve screeningstest met malaria.
Met diagnostiek verzamel je parameters die helpen bij het instellen van een juiste behandeling om de kans op een goede afloop van de infectie te vergroten. De zoekvragen hieronder zijn geformuleerd om op wetenschappelijke wijze in kaart te kunnen brengen welke invloed het wel of niet direct bepalen van de parasitemie heeft op de klinische uitkomst bij een patiënt bij wie in de screeningstest een P. falciparum malaria is vastgesteld. De zoekvraag is erop gericht te kijken of het bepalen van de parasitemie bijdraagt aan een goede afloop van de malaria infectie. Hiervoor zijn vergelijkende studies nodig. Wij hebben als uitkomstmaat voor de vergelijkende studies “wel of geen gecompliceerde malaria” gekozen.
Conclusies / Summary of Findings
|
- GRADE |
It was not possible to draw conclusions or grade the level of evidence, due to the absence of studies comparing the interventions. |
Samenvatting literatuur
Not applicable
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
P: returned travellers with fever and positive for P. falciparum malaria upon screening;
I: treatment based on clinical and laboratory parameters including quantitative parasitemia;
C: treatment based on clinical and laboratory parameters not including quantitative parasitemia;
O: complicated course of malaria (including IC admission, ARDS, renal insufficiency, cerebral damage, coma, liver failure, mortality, readmission).
Relevant outcomes
The guideline development group considered complicated course of malaria to a critical outcome for decision-making.
The working group did not define the outcomes listed above a priori but used the definitions used in the studies.
The working group defined 5% as a minimal clinically (patient) important difference for mortality (relative risk), and 25% for other dichotomous outcomes.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 1990 until 23 December 2020. The detailed search strategy is outlined under the tab Methods. The systematic literature search resulted in 493 hits. Studies were selected if the population and intervention matched the PICO. Based on title and abstract screening, no studies were selected.
Referenties
- Boonstra MB, Koelewijn R, Brienen EAT, Silvis W, Stelma FF, Mank TG, Mulder B, van Lieshout L, van Hellemond JJ. Malaria diagnosis in a malaria non-endemic high-resource country: high variation of diagnostic strategy in clinical laboratories in the Netherlands. Malar J. 2021 Oct 19;20(1):411. doi: 10.1186/s12936-021-03889-7. PMID: 34666766; PMCID: PMC8524939.
- Bruneel F, Tubach F, Mira JP, Houze S, Gibot S, Huisse MG, Megarbane B, Choquet C, Corne P, Peytel E, Villers D, Camus C, Bouchaud O, Caumes E, Girard PM, Simon F, Kalloumeh A, Roy C, Durand R, Le Bras J, Matheron S, Wolff M; PALUREA Study Group. Imported falciparum malaria in adults: host- and parasite-related factors associated with severity.
- Cox-Singh J, Davis TM, Lee KS, et al. Plasmodium knowlesi malaria in humans is widely distributed and potentially life threatening. Clin Infect Dis. 2008;46(2):165-171. doi:10.1086/524888
- The French prospective multicenter PALUREA cohort study. Intensive Care Med. 2016 Oct;42(10):1588-1596. doi: 10.1007/s00134-016-4356-x. Epub 2016 May 11. Erratum in: Intensive Care Med. 2017 Nov 14;: PMID: 27169586.
- Kwak JD, Young JJ, Stuij AC, Koelewijn R, van Hellemond JJ, van Genderen PJJ. A comparative study of Plasmodium falciparum histidine-rich protein 2 (PfHRP2) blood levels and peripheral blood parasitemia as parameters of disease severity in individuals with imported falciparum malaria. Travel Med Infect Dis. 2021 Jul-Aug;42:102076. doi: 10.1016/j.tmaid.2021.102076. Epub 2021 May 4. PMID: 33962039.
- Lalloo DG, Shingadia D, Bell DJ, Beeching NJ, Whitty CJM, Chiodini PL; PHE Advisory Committee on Malaria Prevention in UK Travellers. UK malaria treatment guidelines 2016. J Infect. 2016 Jun;72(6):635-649. doi: 10.1016/j.jinf.2016.02.001. Epub 2016 Feb 12. PMID: 26880088; PMCID: PMC7132403.
- Lüthi B, Schlagenhauf P. Risk factors associated with malaria deaths in travellers: a literature review. Travel Med Infect Dis. 2015 Jan-Feb;13(1):48-60. doi: 10.1016/j.tmaid.2014.04.014. Epub 2014 Jun 5. PMID: 25022610.
- McDonald CR, Weckman A, Richard-Greenblatt M, Leligdowicz A, Kain KC. Integrated fever management: disease severity markers to triage children with malaria and non-malarial febrile illness. Malar J. 2018 Oct 10;17(1):353. doi: 10.1186/s12936-018-2488-x. PMID: 30305137; PMCID: PMC6180660.
- Newman RD, Parise ME, Barber AM, Steketee RW. Malaria-related deaths among U.S. travelers, 1963-2001. Ann Intern Med. 2004 Oct 5;141(7):547-55. doi: 10.7326/0003-4819-141-7-200410050-00012. PMID: 15466772.
- Nishimura J, Dharap P, Raimbault S. The utility of basic blood counts, WBC histogram and C-reactive protein in detecting malaria. BMC Infect Dis. 2021 Sep 26;21(1):1006. doi: 10.1186/s12879-021-06704-5. PMID: 34565334; PMCID: PMC8474782.
- Therapierichtlijn Parasitaire Infecties 2020, Nederlandse Vereniging voor Parasitologie. https://www.parasitologie.nl/medische-parasitologie/therapie/therapie-protocollen. Geraadpleegd augustus 2021.
- Wångdahl A, Wyss K, Saduddin D, Bottai M, Ydring E, Vikerfors T, Färnert A. Severity of Plasmodium falciparum and Non-falciparum Malaria in Travelers and Migrants: A Nationwide Observational Study Over 2 Decades in Sweden. J Infect Dis. 2019 Sep 13;220(8):1335-1345. doi: 10.1093/infdis/jiz292. PMID: 31175365; PMCID: PMC6743839.
- WHO malaria treatment guidelines. https://www.who.int/publications/i/item/guidelines-for-malaria. Geraadpleegd augustus 2021.
- van Wolfswinkel ME, Vliegenthart-Jongbloed K, de Mendonça Melo M, Wever PC, McCall MB, Koelewijn R, van Hellemond JJ, van Genderen PJ. Predictive value of lymphocytopenia and the neutrophil-lymphocyte count ratio for severe imported malaria. Malar J. 2013 Mar 18;12:101. doi: 10.1186/1475-2875-12-101. PMID: 23506136; PMCID: PMC3608093.
- Uyoga S, Wanjiku P, Rop JC, Makale J, Macharia AW, Nyutu GM, Shebe M, Awuondo KA, Mturi N, Woodrow CJ, Dondorp AM, Maitland K, Williams TN. Plasma Plasmodium falciparum Histidine-rich Protein 2 Concentrations in Children With Malaria Infections of Differing Severity in Kilifi, Kenya. Clin Infect Dis. 2021 Oct 5;73(7):e2415-e2423. doi: 10.1093/cid/ciaa1141. PMID: 32772115; PMCID: PMC8492128.
- Yeo TW, Lampah DA, Gitawati R, Tjitra E, Kenangalem E, Piera K, Price RN, Duffull SB, Celermajer DS, Anstey NM. Angiopoietin-2 is associated with decreased endothelial nitric oxide and poor clinical outcome in severe falciparum malaria. Proc Natl Acad Sci U S A. 2008 Nov 4;105(44):17097-102. doi: 10.1073/pnas.0805782105. Epub 2008 Oct 28. PMID: 18957536; PMCID: PMC2575222.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 17-10-2022
Beoordeeld op geldigheid : 06-10-2022
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS) .
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de diagnostiek en zorg voor patiënten met malaria.
Werkgroep
- Dr. F.F. Stelma, Arts-microbioloog/parasitoloog, werkzaam in het Radboud Universitair Medisch Centrum te Nijmegen (NVMM/NVP), voorzitter
- Dr. G.J.H. Bastiaens, Arts-microbioloog/parasitoloog, werkzaam in Rijnstate en het Slingeland Ziekenhuis te Arnhem/Velp en Doetinchem (NVMM/NVP)
- Dr. J.J. Hofstra, Arts-microbioloog in opleiding, werkzaam in Amsterdam UMC, locatie AMC (NVMM)
- Dr. Q. de Mast, internist-infectioloog, werkzaam in Radboud Universitair Medisch Centrum te Nijmegen (NIV)
- Dr. I.C.A. Munnix, Klinisch chemicus, werkzaam in CWZ te Nijmegen (NVKC)
- Ing. B.G. Peereboom, microbiologisch en parasitologisch analist, werkzaam in Streeklaboratorium te Haarlem (NVML)
- Dr. H. Russcher, Klinisch chemicus-hematoloog, werkzaam in Erasmus Medisch Centrum te Rotterdam (NVKC)
- Prof. dr. M. van Vugt, internist-infectioloog, werkzaam in Amsterdam UMC, locatie AMC (NIV)
- Dr. L.J. Wammes, Arts-microbioloog/parasitoloog, werkzaam in Leids Universitair Medisch Centrum te Leiden (NVMM/NVP)
Met ondersteuning van
- Dr. F. Willeboordse, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M.S. Ruiter, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Met dank aan
- Dr. T.J.W. van de Laar, Medisch Moleculair Microbioloog, werkzaam bij Sanquin en OLVG Lab BV te Amsterdam (NVMM)
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
* Stelma |
arts-microbioloog in het radboudumc te Nijmegen |
Lidmaatschap NV parasitologie. Bestuur Ned. Ver. Parasitologie (penningmeester). Voorzitter SKML sectie parasitologie. |
|
Geen actie |
|
Bastiaens |
Arts-microbioloog van Maatschap Medische Microbiologie en Immunologie Gelderland. Werkzaam in het Rijnstate te Arnhem en in het Slingeland Ziekenhuis te Doetinchem |
Lid van de Werkgroep Internationale Medische Microbiologie van de NVMM (onbetaald). Consultant voor Mott MacDonald op het gebied van laboratoriumopbouw in ontwikkelingslanden (vergoeding |
|
Geen actie |
|
Wammes |
arts-microbioloog bij het Leids Universitair Medisch Centrum (0,8 fte) |
Lid Hoofdredactieraad Tijdschrift voor Infectieziekten (onbetaald, wel vergoeding voor |
|
Geen actie |
|
Munnix |
Laboratoriumspecialist Klinische Chemie-Hematologie Canisius-Wilhelmina Ziekenhuis, Nijmegen |
adviseur Aanmoediging en advies (IFMS) |
|
Geen actie |
|
Russcher |
Laboratoriumspecialist Klinische Chemie Erasmus MC 1fte |
Auditor/Vakdeskundige Raad voor Accreditie (RvA) (betaald) |
Extern gefinancierd onderzoek door Roche diagnostics en Sysmex (niet direct gerelateerd aan malaria)
Tegemoetkoming in de studiekosten van de XN31 door de firma Sysmex. 5000 euro + gratis hardware/software en reagens. Dit is direct gerelateerd aan malaria diagnostiek. |
Geen actie, aangezien de richtlijn geen aanbevelingen zal doen over een specifiek apparaat (Sysmex versus ander merk). |
|
Peereboom-Goudriaan |
Microbiologisch en Parasitologisch analist bij het Streeklaboratorium Haarlem |
geen |
|
Geen actie |
|
Mast de |
Internist-infectioloog, Radboudumc |
Lid Kleine Werkgroep, Landelijk Coordinatiecentrum Reizigersadvisering. Onbetaald Lid van verschillende DSMBs, inclusief malaria onderzoek. Onbetaald" |
Financier: ZonMW. Inhoud onderzoek: The transition from a traditional to a Western lifestyle and its effect on the interrelation between diet, gut microbiome and health. Rol als projectleider;ja.
Fin: ZonMW. Inhoud onderzoek: Treating dengue with an influenza drug. TOTO trial. Rol projectleider ja.
Financier: ViiV. Inhoud onderzoek: 2000HIV+study geen rol als projectleider.
Financier: Sysmex Europe.
Inhoud onderzoek: voor validatie van infection management tool op hematologie analyzer, waaronder malaria diagnostiek. rol als projectleider ja |
Geen actie, aangezien de richtlijn geen aanbevelingen zal doen over een specifiek apparaat (Sysmex versus ander merk). |
|
Vugt |
Internist-infectioloog, Amsterdam UMC, locatie AMC (100%) |
Lid van internationale DSMB’s ten behoeven van malariaonderzoek, onbetaald |
De uitkomsten zijn onder andere bijdragend in de kennis en het advies vanuit de malariawerkgroep LCR- GG&GD, waar ik voorzitter van ben momenteel |
Geen actie |
|
Hofstra |
AIOS Medische Microbiologie AUMC |
Bestuur NVAMM (onbetaald) |
|
Geen actie |
|
Willeboordse |
Adviseur Kennisinstituut Federatie Medisch Specialisten |
geen |
geen |
Geen actie |
|
Ruiter |
Adviseur Kennisinstituut Federatie Medisch Specialisten |
geen |
geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van Patiëntenfederatie Nederland voor de schriftelijke knelpunteninventarisatie. De schriftelijke knelpunteninventarisatie is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de diagnostiek voor patiënten met verdenking op malaria. Tevens zijn er knelpunten aangedragen door NVMM, NVKC, NVTG, Patiëntenfederatie Nederland, IGJ, NVML, NHG via een schriftelijke knelpunteninventarisatie. De terugkoppeling hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Zoekverantwoording
Zoekverantwoording
Embase
|
No. |
Query |
Results |
|
#11 |
#8 OR #9 OR #10 |
279 |
|
#10 |
#4 AND #7 NOT (#8 OR #9) |
132 |
|
#9 |
#4 AND #6 NOT #8 |
122 |
|
#8 |
#4 AND #5 |
25 |
|
#7 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) OR 'evaluation study'/exp |
5637182 |
|
#6 |
'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
3129248 |
|
#5 |
'meta-analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de |
525995 |
|
#4 |
#1 AND #2 AND #3 AND ((english)/lim OR (dutch)/lim) AND (2000-2020)/py NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) |
653 |
|
#3 |
'malaria complications'/exp OR 'shock'/exp OR 'intensive care unit'/exp OR 'adult respiratory distress syndrome'/exp OR 'kidney failure'/exp OR 'brain damage'/exp OR 'coma'/exp OR 'liver failure'/exp OR 'death'/exp OR 'hospital readmission'/exp OR shock:ti,ab,kw OR 'intensive care':ti,ab,kw OR icu:ti,ab,kw OR ards:ti,ab,kw OR 'respiratory distress':ti,ab,kw OR (((kidney OR renal OR liver) NEAR/2 failure):ti,ab,kw) OR 'renal insufficiency':ti,ab,kw OR (((brain OR cerebr*) NEAR/2 damage*):ti,ab,kw) OR coma:ti,ab,kw OR death*:ti,ab,kw OR readmission:ti,ab,kw OR rehospitali*:ti,ab,kw OR 'severe complication*':ti,ab,kw |
2742145 |
|
#2 |
'parasitemia'/exp/mj OR parasitemia*:ti,ab,kw OR parasitaemia*:ti,ab,kw |
13977 |
|
#1 |
'malaria'/exp OR malaria:ti,ab,kw OR 'malaria falciparum'/exp OR falciparum:ti,ab,kw |
130938 |
Ovid/Medline
1 exp malaria/ or exp Malaria, Falciparum/ or malaria.ti,ab,kf. or falciparum.ti,ab,kf. (101586)
2 (parasitemia* or parasitaemia*).ti,ab,kf. (11731)
3 (shock* or 'intensive care' or icu or ards or 'respiratory distress' or 'renal insufficiency' or coma or death* or readmission or rehospitali* or 'severe complication*' or ((kidney or renal or liver) adj2 failure) or ((brain or cerebr*) adj2 damage*)).ti,ab,kf. (1422357)
4 exp Shock/ or exp Critical Care/ or exp Respiratory Distress Syndrome, Adult/ or exp Renal Insufficiency/ or exp Brain Injuries/ or exp Coma/ or exp Liver Failure/ or exp Death/ or exp Patient Readmission/ or Malaria/co (Complications) (590897)
5 1 and 2 and (3 or 4) (1065)
6 limit 5 to (english language and yr="2000 -Current") (695)
7 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (483042)
8 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (2065342)
9 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ or evaluation study/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (3790584)
10 6 and 7 (18)
11 (6 and 8) not 10 (85)
12 (6 and 9) not (10 or 11) (201)
13 10 or 11 or 12 (304)
