Adjuvante chemoradiatie
Uitgangsvraag
Wat is de plaats van adjuvante chemoradiatie bij de curatieve behandeling van maagcarcinoom?
Aanbeveling
Behandel patiënten met een curatief te behandelen maagcarcinoom bij weinig of geen respons op neoadjuvante chemotherapie indien mogelijk met post-operatieve FLOT kuren.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
In de systematische review van Matuschek (2019) worden zeven gerandomiseerde studies besproken die het effect van adjuvante chemoradiatie vergelijken met adjuvante chemotherapie bij patiënten met een resectabel of gereseceerd maagcarcinoom. Voor de cruciale uitkomstmaten totale overleving en ziektevrije overleving werden geen klinisch relevante verschillen gevonden. Voor de cruciale uitkomstmaten progressievrije overleving en toxiciteit was de klinische relevantie niet vast te stellen omdat de uitkomst niet werd gerapporteerd of de uitkomst niet voldoende vergelijkbaar was tussen de studies. De bewijskracht was laag of zeer laag, met name vanwege beperkingen in studieopzet van de systematische review en toepasbaarheid (met betrekking tot de populatie en interventie). De heterogeniteit in de resultaten zou verklaard kunnen worden door positieve nodale status, histologisch subtype en sekse.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Er is geen onderzoek gedaan naar de waarden en voorkeuren van patiënten wat betreft de adjuvante chemo(radiatie) behandeling. Het is goed om te realiseren dat in de studies ook selectie heeft plaatsgevonden, bijvoorbeeld op basis van leeftijd en de aan- of afwezigheid van ernstige comorbiditeit. Met de patiënt moet duidelijk gecommuniceerd worden wat met de huidige behandelopties bereikt kan worden, en tegen welke prijs. Op basis hiervan en de eigen doelen van de patiënt kan een gewogen beslissing worden genomen.
Kosten (middelenbeslag)
De werkgroep heeft geen informatie gevonden over de kosteneffectiviteit van adjuvante chemoradiatie ten opzichte van adjuvante chemotherapie. De werkgroep heeft dit aspect daarom niet meegewogen bij het formuleren van de aanbeveling. De werkgroep verwacht dat de aanbeveling geen relevante impact heeft op de zorgkosten.
Aanvaardbaarheid, haalbaarheid en implementatie
Patiënten bezoeken het ziekenhuis dagelijks voor de radiotherapie, daarom is de belasting van chemoradiatie ten opzichte van chemotherapie wat groter.
In Nederland is de chirurgische behandeling van maagkanker gecentreerd, waardoor een hoge mate van expertise is gewaarborgd. Voor sommige patiënten betekent dit langere reistijden, wat een belasting kan zijn. Er zijn geen aanwijzingen dat dit de therapietrouw ten nadele beïnvloedt. In het algemeen is in de centra sprake van voldoende capaciteit, hoewel er binnen financiële kaders spanningen op kunnen treden. Gezien de zeer goede onderlinge samenwerking binnen een groot team, waarvan de samenstelling en benodigde expertise is vastgesteld in de SONCOS-normen, is de kwaliteit gewaarborgd. Alle patiënten worden besproken binnen het multidisciplinaire overleg (MDO), waarbij ook de behandelaar aanwezig is. Hierna vindt uitgebreid overleg plaats met de patiënt, waarbij op basis van de adviezen uit het MDO en de eigen voorkeur van de patiënt een beleid wordt uitgestippeld.
De werkgroep is van mening dat de aanbeveling aanvaardbaar is voor zowel zorgverleners als patiënten. De werkgroep verwacht dat het uitvoeren van de aanbeveling haalbaar en implementeerbaar is. De aanbeveling sluit aan bij de huidige werkwijze in de praktijk.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Perioperatieve chemotherapie middels FLOT is de standaardbehandeling voor patiënten met een curatief te behandelen maagcarcinoom. Op basis van de huidige literatuur is er geen voorkeur voor chemoradiatie boven chemotherapie in de postoperatieve setting bij weinig of geen respons bij pathologische onderzoek van het resectiepreparaat.
Onderbouwing
Achtergrond
Het standaard beleid bij patiënten met maagkanker bestaat in Nederland uit het geven van perioperatieve chemotherapie middels FLOT. Over het adjuvante deel van deze behandeling bestaat echter discussie. Dit wordt ingegeven door het feit dat een aanzienlijk deel van de patiënten de adjuvante behandeling niet (volledig) krijgt. Met name in situaties waarin er in het resectiepreparaat geen tot weinig respons wordt gezien op de neoadjuvant gegeven chemotherapie of waarin de patiënt veel toxiciteit van de behandeling heeft ondervonden, ontstaan discussies over het vervangen van de adjuvante chemotherapie door chemoradiatie.
Conclusies / Summary of Findings
Overall survival
|
Low GRADE |
The evidence suggests that adjuvant chemoradiotherapy has no effect on overall survival when compared with adjuvant chemotherapy in patients with gastric cancer with poor response to neoadjuvant chemotherapy and/or unfavorable histological characteristics.
Source: Bamias, 2010; Cats, 2018; Kim, 2012; Kwon, 2010; Park, 2015/Lee, 2012; Zhu, 2012; Yu, 2012 |
Progression-free survival
|
No GRADE |
No studies reported the progression-free survival of patients with gastric cancer with poor response to neoadjuvant chemotherapy and/or unfavorable histological characteristics treated with adjuvant chemoradiotherapy compared to progression-free survival of patients treated with adjuvant chemotherapy. |
Disease-free survival
|
Low GRADE |
The evidence suggests that adjuvant chemoradiotherapy has no effect on disease-free survival when compared with adjuvant chemotherapy in patients with gastric cancer with poor response to neoadjuvant chemotherapy and/or unfavorable histological characteristics.
Source: Bamias, 2010; Cats, 2018; Kim, 2012; Kwon, 2010; Park, 2015/Lee, 2012; Zhu, 2012; Yu, 2012 |
Locoregional recurrence
|
Very low GRADE |
The evidence is very uncertain about the effect of adjuvant chemoradiotherapy on locoregional recurrence when compared with adjuvant chemotherapy in patients with gastric cancer with poor response to neoadjuvant chemotherapy and/or unfavorable histological characteristics.
Source: Bamias, 2010; Cats, 2018; Kim, 2012; Kwon, 2010; Park, 2015/Lee, 2012; Zhu, 2012 |
Toxicity
|
Very low GRADE |
The evidence is very uncertain about the effect of adjuvant chemoradiotherapy on toxicity when compared with adjuvant chemotherapy in patients with gastric cancer with poor response to neoadjuvant chemotherapy and/or unfavorable histological characteristics.
Source: Bamias, 2010; Cats, 2018; Kim, 2012; Kwon, 2010; Park, 2015/Lee, 2012; Zhu, 2012; Yu, 2012 |
Compliance
|
Very low GRADE |
The evidence is very uncertain about the effect of adjuvant chemoradiotherapy on compliance when compared with adjuvant chemotherapy in patients with gastric cancer with poor response to neoadjuvant chemotherapy and/or unfavorable histological characteristics.
Source: Bamias, 2010; Cats, 2018; Kim, 2012; Kwon, 2010; Park, 2015/Lee, 2012; Zhu, 2012; Yu, 2012 |
Samenvatting literatuur
Description of studies
Matuschek (2019) conducted a systematic review and meta-analysis to compare the efficacy and adverse events of adjuvant chemotherapy and combined adjuvant chemoradiotherapy in patients with advanced gastric cancer. Multiple databases (MEDLINE, EMBASE and the EMBR database) were searched up to May 2018. Randomized controlled trials comparing chemoradiotherapy to chemotherapy alone in patients with resectable or resected gastric cancer were included. Seven RCTs (Bamias, 2010; Cats, 2018; Kim, 2012; Kwon, 2010; Park, 2015/Lee, 2012; Zhu, 2012; Yu, 2012) with a total of 1807 patients were included. Most participants were male patients with stage III cancer with a median age of 50-65 years. Partial and complete gastrectomies with varying extents of lymph node dissection were performed. Patients were randomly assigned to either adjuvant chemoradiotherapy or adjuvant chemotherapy (multiple cycles of docetaxel, cisplatin, carboplatin, fluoracil, leucovorin, capecitabine, epirubicin and/or oxaliplatin). The radiotherapy was given concurrent or sequential to chemotherapy in the chemoradiotherapy group. One trial was analyzed separately, because patients of both groups were additionally treated with preoperative chemotherapy (Cats, 2018). The systematic review assessed the outcomes overall survival, disease-free survival, and locoregional recurrence.
It should be noted that in some of the included trials, the chemotherapy component in the chemoradiotherapy group was modified to improve tolerability and to account for adding radiotherapy (Cats, 2018; Kwon, 2010; Park, 2015). Moreover, ethnic disparities between the Caucasian and Asian populations of the studies should be considered when interpreting the results.
Kim (2018) conducted a subgroup analysis of the patients with stage IB gastric cancer from the ARTIST trial (Park, 2015), that was included in the systematic review of Matuschek. In this subgroup analysis, 99 of the 458 patients who were enrolled in the ARTIST trial were included. The survival differences between adjuvant chemotherapy and chemoradiotherapy groups were compared. Because the population of this study overlaps with the population of the main publication of the ARTIST trial (Park, 2015), the results of this subgroup analysis are not meta-analyzed, but separately described.
De Steur (2021) conducted a per-protocol analysis of the CRITICS trial (Cats, 2018). This trial was included in the systematic review of Matuschek and was originally analyzed by the intention-to-treat method. The post hoc per-protocol analysis was carried out for the patients who started post-operative treatment, because the difference in treatments between the two groups started in the post-operative phase. In the per-protocol analysis, 478 of the 788 patients who were enrolled in the CRITICS trial were included. Because the population of this study overlaps with the population of the main publication of the CRITICS trial (Cats, 2018), the results of this subgroup analysis are not meta-analyzed, but separately described.
Results
Overall survival (critical)
Seven RCTs reported overall survival (OS) for adjuvant chemoradiotherapy versus adjuvant chemotherapy (figure 1). The pooled hazard ratio (HR) was 0.86 (95% CI: 0.72 to 1.03) in favor of adjuvant chemoradiotherapy. With the addition of preoperative chemotherapy, the pooled HR was 0.93 (95% CI: 0.82 to 1.06). These differences were not considered clinically relevant.
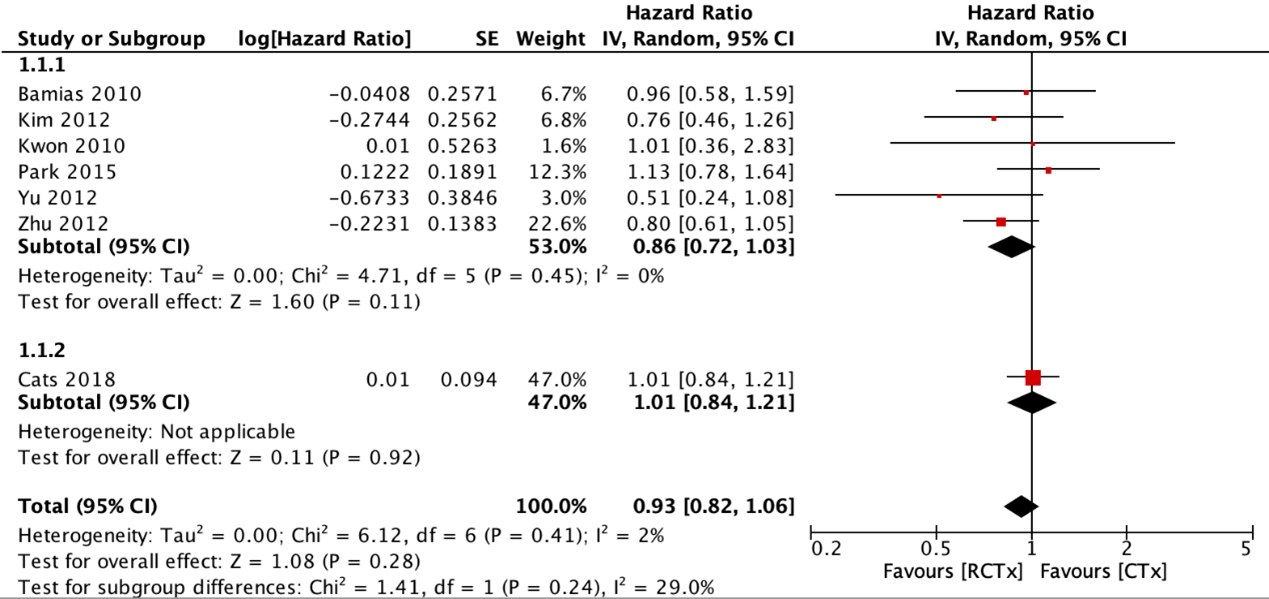
Additionally, Kim (2018) reported the 5-year OS of the stage IB subgroup from the ARTIST trial (Park, 2015). The 5-year OS was 90% for the adjuvant chemoradiotherapy group and 86% for the adjuvant chemotherapy group. This difference was not considered clinically relevant.
De Steur (2021) reported the 5-year OS of the per-protocol analysis of the CRITICS trial (Cats, 2018). The 5-year OS was 45.5% (95% CI: 39.2 to 51.8) for the adjuvant chemoradiotherapy group and 57.9% (95% CI: 51.4% to 64.3%) for the adjuvant chemotherapy group. The adjusted hazard ratio was 1.62 (95% CI: 1.24 to 2.12) in favor of adjuvant chemotherapy.
Progression-free survival (critical)
The systematic review did not report results of studies that assessed progression-free survival (PFS) of patients with gastric cancer treated with adjuvant chemoradiotherapy compared with PFS of patients treated with adjuvant chemotherapy.
Disease-free survival (critical)
Seven RCTs reported disease-free survival (DFS) for adjuvant chemoradiotherapy versus adjuvant chemotherapy (figure 2). The pooled HR was 0.77 (95% CI: 0.64 to 0.91) in favor of adjuvant chemoradiotherapy. With the addition of preoperative chemotherapy, the pooled HR was 0.86 (95% CI: 0.76 to 0.98). These differences were not considered clinically relevant.
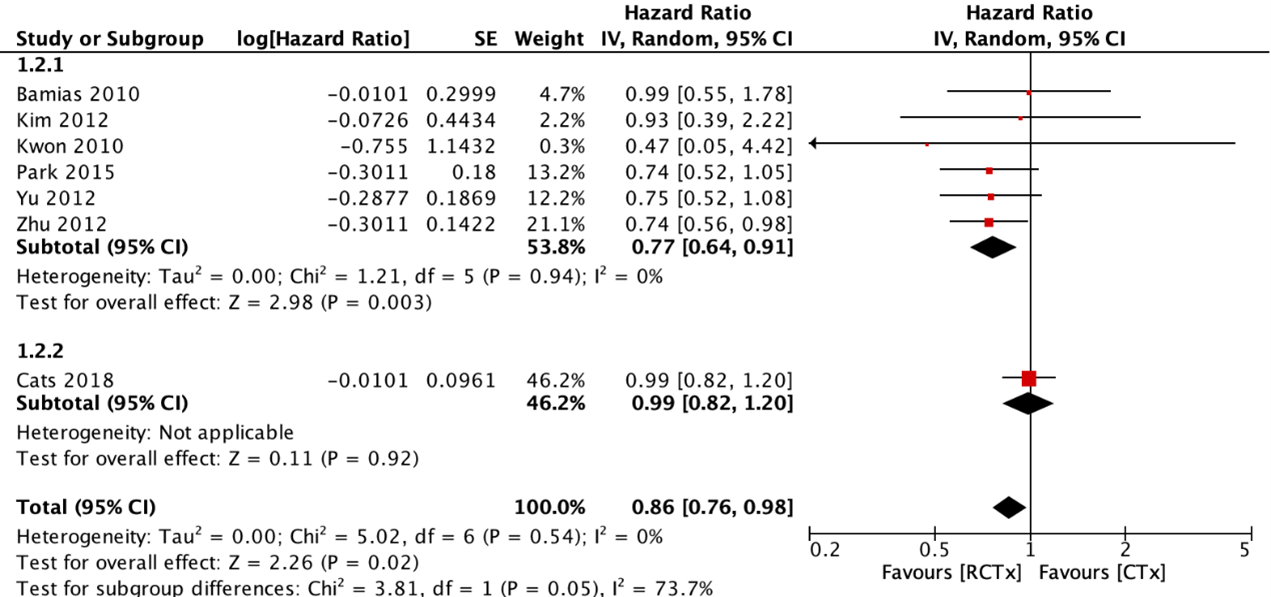
Additionally, Kim (2018) reported the 5-year DFS of the stage IB subgroup from the ARTIST trial (Park, 2015). The 5-year DFS was 84% for the adjuvant chemoradiotherapy group and 88% for the adjuvant chemotherapy group. This difference was not considered clinically relevant.
Locoregional recurrence (important)
Six RCTs reported locoregional recurrence for adjuvant chemoradiotherapy versus adjuvant chemotherapy (figure 3). The pooled odds ratio (OR) was 0.49 (95% CI: 0.34 to 0.70) in favor of adjuvant chemoradiotherapy. With the addition of preoperative chemotherapy, the pooled OR was 0.56 (95% CI: 0.42 to 0.75). These differences were considered clinically relevant.
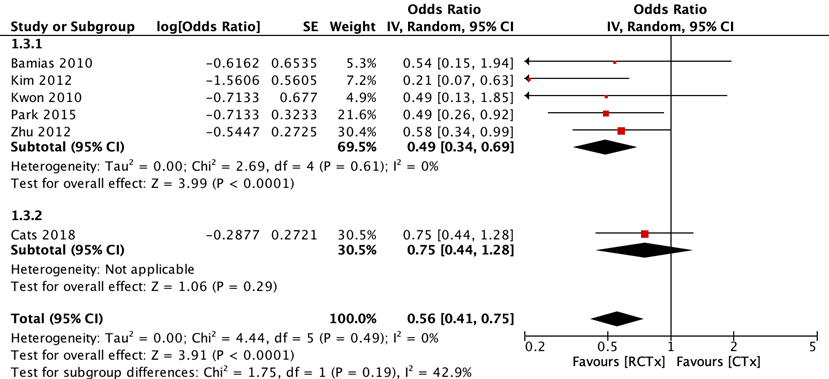
Additionally, De Steur (2021) reported the 2-year and 5-year locoregional recurrence of the per-protocol analysis of the CRITICS trial (Cats, 2018). The 2-year cumulative incidence was 4% for the adjuvant chemoradiotherapy group and 6% for the adjuvant chemotherapy group. The 5-year cumulative incidence was 6% for the adjuvant chemoradiotherapy group and 9% for the adjuvant chemotherapy group.
Toxicity (critical)
Seven RCTs reported toxicity of treatment. Acute hematologic side effects (grade III+IV) and acute gastrointestinal (GI) side effects (grade III+IV) were reported for both groups.
Three studies reported cumulative hematologic side effects (Bamias, 2010; Kim, 2012; Kwon, 2010). These ranged from 19.6% to 61.3% for the adjuvant chemoradiotherapy group and from 22% to 33% for the adjuvant chemotherapy group. Three studies (Cats, 2018; Park, 2015; Yu, 2012) reported neutropenia. This ranged from 4.4% to 48.4% for the adjuvant chemoradiotherapy group and from 17.6% to 40.7% for the adjuvant chemotherapy group. One study (Zhu, 2012) reported leucopenia. This side effect was 7.5% in the adjuvant chemoradiotherapy group and 7.3% in the adjuvant chemotherapy group.
Two studies reported cumulative GI side-effects (Kim, 2012; Kwon, 2010). These ranged from 12.9% to 17.4% for the adjuvant chemoradiotherapy group and from 11.4% to 16.7% for the adjuvant chemotherapy group. Four studies (Bamias, 2010; Cats, 2018; Park, 2015; Zhu, 2012) reported diarrhea. This ranged from 0.9% to 6% in the adjuvant chemoradiotherapy group and from 0% to 7% in the adjuvant chemotherapy group. Two studies (Zhu, 2012; Yu, 2012) reported (anorexia and) nausea and vomiting. Nausea and vomiting (Yu, 2012) was 2.7% in the adjuvant chemoradiotherapy group and 0% in the adjuvant chemotherapy group. Anorexia, nausea and vomiting (Yu, 2012) was 23.5% in the adjuvant chemoradiotherapy group and 14.7% in the adjuvant chemotherapy group.
As no meta-analysis was performed, clinical relevance could not be determined.
Compliance (important)
Seven RCTs reported compliance. The percentage of patients that completed the treatment as intended ranged from 49.9% to 90.7% for the adjuvant chemoradiotherapy group and from 45.8% to 100% for the adjuvant chemotherapy group. As no meta-analysis was performed, clinical relevance could not be determined.
Level of evidence of the literature
The level of evidence of randomized controlled trials is considered high according to the GRADE methodology. Therefore, the level of evidence of these cohort studies starts at high GRADE.
Overall survival
The level of evidence regarding the outcome measure overall survival was downgraded by two levels because of study limitations (-1; risk of bias systematic review); and applicability (-1, bias due to indirectness). Therefore, the evidence was graded as low.
Progression-free survival
The level of evidence regarding the outcome measure progression-free survival could not be graded as no studies reported the progression-free survival of patients with gastric cancer with poor response to neoadjuvant chemotherapy and/or unfavorable histological characteristics treated with adjuvant chemoradiotherapy compared to progression-free survival of patients treated with adjuvant chemotherapy.
Disease-free survival
The level of evidence regarding the outcome measure disease-free survival was downgraded by two levels because of study limitations (-1; risk of bias systematic review); and applicability (-1, bias due to indirectness). Therefore, the evidence was graded as low.
Locoregional recurrence
The level of evidence regarding the outcome measure locoregional recurrence was downgraded by three levels because of study limitations (-1; risk of bias systematic review); applicability (-1, bias due to indirectness); and number of included patients (-1; imprecision because the confidence interval includes the possibility of no effect and a favorable effect). Therefore, the evidence was graded as very low.
Toxicity
The level of evidence regarding the outcome measure toxicity was downgraded by three levels because of study limitations (-1; risk of bias systematic review); conflicting results (inconsistency); and applicability (-1, bias due to indirectness). Therefore, the evidence was graded as very low.
Compliance
The level of evidence regarding the outcome measure compliance was downgraded by three levels because of study limitations (-1; risk of bias systematic review); conflicting results (inconsistency); and applicability (-1, bias due to indirectness). Therefore, the evidence was graded as very low.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (un)favorable effects of adjuvant chemoradiotherapy compared to adjuvant chemotherapy as treatment for patients with gastric cancer with poor response to neoadjuvant chemotherapy and/or unfavorable histologic characteristics?
P: patients with gastric cancer with poor response to neoadjuvant chemotherapy and/or unfavorable histological characteristics (pT3-4, N2-3)
I: adjuvant chemoradiotherapy
C: adjuvant chemotherapy
O: overall survival, progression-free survival, disease-free survival, locoregional recurrence, toxicity, compliance
Relevant outcome measures
The guideline development group considered overall survival, progression-free survival, disease-free survival, and toxicity as critical outcome measures for decision making; and locoregional recurrence and compliance as important outcome measures for decision making.
The guideline development group defined the outcome measures as follows:
- Overall survival: Time to death from any cause.
- Progression-free survival: Time from randomization or initiation of treatment to the occurrence of disease progression or death from any cause.
- Disease-free survival: Time from randomization or initiation of treatment to the recurrence of tumor or death from any cause.
- Locoregional recurrence: Any cancer recurrence in the gastric bed, upper abdominal retroperitoneal lymph nodes or at the local anastomotic sites.
- Toxicity: Adverse events following treatment (grade 3 and higher).
- Compliance: Adherence, treatment completed as intended.
The guideline development group defined the following differences as a minimal clinically (patient) important difference:
- Overall survival: Absolute difference >5% or absolute difference >3% and Hazard Ratio (HR) <0.7
- Progression-free survival: Absolute difference >5% or absolute difference >3% and Hazard Ratio (HR) <0.7
- Disease-free survival: Absolute difference >5% or absolute difference >3% and Hazard Ratio (HR) <0.7
- Locoregional recurrence: Absolute difference >5% or absolute difference >3% and Hazard Ratio (HR) <0.7
- Toxicity: Absolute difference >5% for lethal complications, or >25% for serious complications
- Compliance: Absolute difference >5% or absolute difference >3% and Hazard Ratio (HR) <0.7
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 2015 until 21-07-2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 235 hits. Studies were selected based on the following criteria:
- Systematic reviews or randomized controlled trials;
- full-text English language publication;
- complying with the PICO criteria.
Twenty-seven studies were initially selected based on title and abstract screening. After reading the full text, 24 studies were excluded (see the table with reasons for exclusion under the tab Methods), and three studies were included.
Results
One systematic review and two additional RCTs were included in the analysis of the literature. The additional RCTs are secondary analyses of primary studies included in het systematic review. Their results are therefore presented separately. Important study characteristics and results are summarized in the evidence table. The assessment of the risk of bias is summarized in the risk of bias table.
Referenties
- 1 - Bamias A, Karina M, Papakostas P, Kostopoulos I, Bobos M, Vourli G, Samantas E, Christodoulou Ch, Pentheroudakis G, Pectasides D, Dimopoulos MA, Fountzilas G. A randomized phase III study of adjuvant platinum/docetaxel chemotherapy with or without radiation therapy in patients with gastric cancer. Cancer Chemother Pharmacol. 2010 May;65(6):1009-21. doi: 10.1007/s00280-010-1256-6. Epub 2010 Feb 4. PMID: 20130877.
- 2 - Cats A, Jansen EPM, van Grieken NCT, Sikorska K, Lind P, Nordsmark M, Meershoek-Klein Kranenbarg E, Boot H, Trip AK, Swellengrebel HAM, van Laarhoven HWM, Putter H, van Sandick JW, van Berge Henegouwen MI, Hartgrink HH, van Tinteren H, van de Velde CJH, Verheij M; CRITICS investigators. Chemotherapy versus chemoradiotherapy after surgery and preoperative chemotherapy for resectable gastric cancer (CRITICS): an international, open-label, randomised phase 3 trial. Lancet Oncol. 2018 May;19(5):616-628. doi: 10.1016/S1470-2045(18)30132-3. Epub 2018 Apr 9. PMID: 29650363.
- 3 - Kim TH, Park SR, Ryu KW, Kim YW, Bae JM, Lee JH, Choi IJ, Kim YJ, Kim DY. Phase 3 trial of postoperative chemotherapy alone versus chemoradiation therapy in stage III-IV gastric cancer treated with R0 gastrectomy and D2 lymph node dissection. Int J Radiat Oncol Biol Phys. 2012 Dec 1;84(5):e585-92. doi: 10.1016/j.ijrobp.2012.07.2378. Epub 2012 Sep 11. PMID: 22975616.
- 4 - Kim Y, Kim KM, Choi MG, Lee JH, Sohn TS, Bae JM, Kim S, Lee SJ, Kim ST, Lee J, Park JO, Park YS, Lim HY, Kang WK, Park SH. Adjuvant Chemotherapy with or without Concurrent Radiotherapy for Patients with Stage IB Gastric Cancer: a Subgroup Analysis of the Adjuvant Chemoradiotherapy in Stomach Tumors (ARTIST) Phase III Trial. J Gastric Cancer. 2018 Dec;18(4):348-355. doi: 10.5230/jgc.2018.18.e34. Epub 2018 Nov 16. PMID: 30607298; PMCID: PMC6310765.
- 5 - Kwon HC, Kim MC, Kim KH, Jang JS, Oh SY, Kim SH, Kwon KA, Lee S, Lee HS, Kim HJ. Adjuvant chemoradiation versus chemotherapy in completely resected advanced gastric cancer with D2 nodal dissection. Asia Pac J Clin Oncol. 2010 Dec;6(4):278-85. doi: 10.1111/j.1743-7563.2010.01331.x. Epub 2010 Oct 26. PMID: 21114777.
- 6 - Lee J, Lim DH, Kim S, Park SH, Park JO, Park YS, Lim HY, Choi MG, Sohn TS, Noh JH, Bae JM, Ahn YC, Sohn I, Jung SH, Park CK, Kim KM, Kang WK. Phase III trial comparing capecitabine plus cisplatin versus capecitabine plus cisplatin with concurrent capecitabine radiotherapy in completely resected gastric cancer with D2 lymph node dissection: the ARTIST trial. J Clin Oncol. 2012 Jan 20;30(3):268-73. doi: 10.1200/JCO.2011.39.1953. Epub 2011 Dec 19. PMID: 22184384.
- 7 - Matuschek C, Haussmann J, Bölke E, Tamaskovics B, Djiepmo Njanang FJ, Orth K, Peiper M, Gerber PA, Anooshar B, Kammers K, Budach W. Adjuvant radiochemotherapy vs. chemotherapy alone in gastric cancer: a meta-analysis. Strahlenther Onkol. 2019 Aug;195(8):695-706. English. doi: 10.1007/s00066-019-01431-y. Epub 2019 Feb 22. PMID: 30796495.
- 8 - Park SH, Sohn TS, Lee J, Lim DH, Hong ME, Kim KM, Sohn I, Jung SH, Choi MG, Lee JH, Bae JM, Kim S, Kim ST, Park JO, Park YS, Lim HY, Kang WK. Phase III Trial to Compare Adjuvant Chemotherapy With Capecitabine and Cisplatin Versus Concurrent Chemoradiotherapy in Gastric Cancer: Final Report of the Adjuvant Chemoradiotherapy in Stomach Tumors Trial, Including Survival and Subset Analyses. J Clin Oncol. 2015 Oct 1;33(28):3130-6. doi: 10.1200/JCO.2014.58.3930. Epub 2015 Jan 5. PMID: 25559811.
- 9 - de Steur WO, van Amelsfoort RM, Hartgrink HH, Putter H, Meershoek-Klein Kranenbarg E, van Grieken NCT, van Sandick JW, Claassen YHM, Braak JPBM, Jansen EPM, Sikorska K, van Tinteren H, Walraven I, Lind P, Nordsmark M, van Berge Henegouwen MI, van Laarhoven HWM, Cats A, Verheij M, van de Velde CJH; CRITICS investigators. Adjuvant chemotherapy is superior to chemoradiation after D2 surgery for gastric cancer in the per-protocol analysis of the randomized CRITICS trial. Ann Oncol. 2021 Mar;32(3):360-367. doi: 10.1016/j.annonc.2020.11.004. Epub 2020 Nov 20. PMID: 33227408.
- 10 - Yu C, Yu R, Zhu W, Song Y, Li T. Intensity-modulated radiotherapy combined with chemotherapy for the treatment of gastric cancer patients after standard D1/D2 surgery. J Cancer Res Clin Oncol. 2012 Feb;138(2):255-9. doi: 10.1007/s00432-011-1085-y. Epub 2011 Nov 22. PMID: 22105898.
- 11 - Zhu WG, Xua DF, Pu J, Zong CD, Li T, Tao GZ, Ji FZ, Zhou XL, Han JH, Wang CS, Yu CH, Yi JG, Su XL, Ding JX. A randomized, controlled, multicenter study comparing intensity-modulated radiotherapy plus concurrent chemotherapy with chemotherapy alone in gastric cancer patients with D2 resection. Radiother Oncol. 2012 Sep;104(3):361-6. doi: 10.1016/j.radonc.2012.08.024. Epub 2012 Sep 14. PMID: 22985776.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies
Research question: What are the (un)favourable effects of adjuvant chemoradiotherapy compared to adjuvant chemotherapy as treatment for patients with gastric cancer with poor response to neoadjuvant chemotherapy and/or unfavourable histologic characteristics?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Matuschek et al, 2019
[individual study characteristics deduced from Matuschek, 2019 as well as from the original articles] |
SR and meta-analysis of RCTs
Literature search up to May, 2018
A: Bamias, 2010 B: Kim, 2012 C: Kwon, 2010 D: Yu, 2012 E: Zhu, 2012 F: Park, 2015 G: Cats, 2018
Study design: parallel RCT (all included studies)
Setting and Country: A: Greece B: South Korea C: South Korea D: China E: China F: South Korea G: Netherlands
Source of funding and conflicts of interest: Funding source not reported. Authors declare to have no competing interests.
|
Inclusion criteria SR: randomized controlled trials comparing chemoradiotherapy to chemotherapy alone in resectable or resected gastric cancer.
Exclusion criteria SR: not stated
7 studies included
Important patient characteristics at baseline:
N, median age A: 143 patients, 63 yrs B: 90 patients, median or mean age not reported1 C: 61 patients, 53 yrs D: 68 patients, 57 yrs E: 351 patients, 57 yrs F: 458 patients, 56 yrs G: 636 patients, 63 yrs
Sex: A: 70% male B: 65% male C: 72% male D: 87% male E: 74% male F: 64% male G: 66% male
Percentage of patients that underwent surgery: A: 40% B: 31% C: not stated D: 31% E: not stated F: not stated G: 50%
Cancer stage % ≥ Stage III) A: 72% B: 100% C: 100% D: 100% E: 72% F: 58% G: 38%
Studies are comparable: largely male patients with cancer stage III (except study by Cats, 2018) and patients with median age of 50-65 yrs.
|
Adjuvant radio-chemotherapy (RCTx)
A: 75 mg/m2 of both docatexel and cisplatin (later replaced by carboplatin) every three weeks; six cycles. Radiation therapy (5 Gy) between third and fourth cycle, five times per week for five weeks. B: Fluoracil 425 mg/m2 + leucovorin 20 mg/m2 for five days with a four-week interval; five cycles. Cycle 2 and 3 with 45 Gy radiation. C: 5-fluorouracil 1000 mg/m2 + cisplatin 60 mg/m2 every three weeks; four cycles. After cycle 1, radiation therapy (45 Gy) + capecitabine 1650 mg/m2 for five weeks. D: 5- Fluoracil 400 mg/m2 + tetrahydrofolic acid 20 mg/m2; five cycles. Cycle 2 and 3 with 45 Gy radiation. E: Fluoracil 400 mg/m2 + leucovorin 25 mg/m2; five cycles. Cycle 2 and 3 with 45 Gy radiation in between for 5 weeks. F: Capecitabine 1000 mg/m2 (twice a day)+ cisplatin 60 mg/m2 (first day) for three weeks; five cycles. Cycle 3 with 45 Gy radiation and capecitabine 825 mg/m2. G: Capecitabine 575 mg/m2 (twice daily, for 5 weeks) + cisplatin 20 mg/m2 (every first day of 5 week radiation treatment (45 Gy)) + perioperative CTx
|
Adjuvant chemotherapy (CTx)
A: 45 mg/m2 of both docatexel and cisplatin (later replaced by carboplatin) every three weeks; six cycles B: Fluoracil 425 mg/m2 + leucovorin 20 mg/m2 for five days with a four-week interval; five cycles. C: 5-fluorouracil 1000 mg/m2 + cisplatin 60 mg/m2 every three weeks; six cycles D: 5- Fluoracil 400 mg/m2 + tetrahydrofolic acid 20 mg/m2; five cycles. Cycle 2 and 3 with 45 Gy radiation. E: Fluoracil 400 mg/m2 + leucovorin 20 mg/m2; five cycles. F: Capecitabine 1000 mg/m2 (twice a day)+ cisplatin 60 mg/m2 (first day) for three weeks; six cycles. G: Epirubicin 50 mg/m2 + (cisplatin 60 mg/m2 or oxaliplatin 130 mg/m2) every first day of 21 day cycle + capecitabine 1000 (cis.) or 625 (ox.) mg/m2 twice daily; three cycles + perioperative CTx
|
End-point of follow-up: A: 77.8 months B: 116.5 months C: 92.8 months D: 3 years E: 5 years F: 7 years G: 82.8 months
For how many participants were no complete outcome data available? (resp intervention and control) A: 22 and 9 patients B: 6 and 3 patients C: 8 and 8 patients D: 4 and patients E: 19 and 10 patients F: 42 and 46 patients G: 48 and 53 patients
|
Effect on overall survival in percentage of patients after X yrs (or months (median)), resp intervention and control group A: 44.5 (57% after 3 yrs) vs. 55.3 months (61% after 3 yrs), p = 0.448 B: 65.2% vs. 54.6% after 5 yrs, p = 0.670 C: 70.1% vs 70.0% after 5 yrs, p = 0.814 D: 85.9, 73.4 and 67.7% vs. 68.0, 50.0 and 44.1% (after 1, 2 and 3 yrs resp.), p = 0.037 E: 54 (48.4% after 5 yrs) vs. 38 months (41.8% after 5 yrs), p = 0.122 F: 75% vs. 73% after 5 yrs, p = 0.484 G: 37 (40% after 5 yrs) vs. 43 months (42% fter 5 yrs), p = 0.942
Effect on disease-free survival (in months, resp intervention and control group) A: 33.1 (48% fter 3 yrs) vs. 37 months (51% after 3 yrs), p = 0.879 B: 60.9% vs. 50.0% after 5 yrs, p = 0.246 C: 80.0% vs 75.2% after 5 yrs, p = 0.887 D: 73.5, 64.7 and 55.8% vs. 61.8, 38.2 and 29.4% (after 1, 2 and 3 yrs resp.), p = 0.021 E: 50 (45.2% after 5 yrs) vs. 32 months (35.5% after 5 yrs), p = 0.029 F: Unclearly stated G: 25 (38% after 5 yrs) vs 28 months (39% after 5 yrs), p = 0.920
Effect on toxicity (% of patients with side-effects)
Hematologic side effects (neutropenia, leucopenia. Grade I-IV) Resp. RCTx and CTx A: 30% vs. 22% (Grade III-IV) B: 19.6% vs. 25% (Grade III-IV) C: 61.3% vs. 33% (Grade III-IV) D: 70.6% vs 44.1% (Grade I-II), 26.5% vs. 17.6% (Grade III-IV) E: 24.2% vs. 18.2% (Grade I-II), 7.5% vs. 7.3% (Grade III-IV) F: 42.8% vs. 46.9% (Grade I-II), 48.8% vs. 40.7% (Grade III-IV) G: 9% vs. 28% (Grade I-II), 4.4% vs. 34% (Grade III-IV)
GI side effects (diarrhea, anorexia, nausea, vomiting. Grade I-IV. Percentge of patients) Resp. RCTx and CTx A: 6% vs. 7% (Grade III-IV) B: 17.4% vs. 11.4% (Grade III-IV) C: 32.2% vs 0.0%2 (Grade I-II), 12.9% vs. 16.7% (Grade III-IV) D: 82.4% vs. 73.5% (Grade I-II), 23.5% vs. 14.7% (Grade III-IV) E: 36% vs. 30.3% (Grade I-II), 4.3% vs. 0% (Grade III-IV) F: 44% vs. 43.8% (Grade I-II), 0.9% vs. 2.2% (Grade III-IV) G: 33% vs. 37% (Grade I-II), 3% vs. 6% (Grade III-IV)
Effect on compliance A: 69.4% vs. 87% B: 87% vs. 93.2% C: 74.2% vs. 73.3% D: 88.2% vs. 100% E: 90.7% vs. 94.3% F: 81.7% vs. 75.4% G: 45.8% vs. 49.9%
Meta-analysis Hazard ratio (HR) or Odds ratio (OR) HR/OR < 0 favours RCTx, HR/OR > 0 favours CTx
Overall survival (HR) A: 0.96 (0.58-1.59), p = 0.870 B: 0.76 (0.46-1.26), p = 0.290 C: 1.01 (0.36-2.84), p = 0.980 D: 0.51 (0.24-1.09), p = 0.080 E: 0.80 (0.61-1.05), p = 0.11 F: 1.13 (0.78-1.65), p = 0.530 G: 1.01 (0.84-1.22), p = 0.920 Overall: 0.93 (0.82-1.06), p = 0.280 Heterogeneity: 0% Overall (excl. Cads, 2018): 0.86 (0.72-1.03), p = 0.110 Heterogeneity: 2%
Disease-free survival (HR) A: 0.99 (0.55-1.79) B: 0.93 (0.39-2.18) C: 0.47 (0.05-4.88) D: 0.75 (0.52-1.08) E: 0.74 (0.56-0.97) F: 0.74 (0.52-1.05) G: 0.99 (0.82-1.19) Overall: 0.86 (0.76-0.98), p = 0.023 Heterogeneity: 0% Overall (excl. Cads, 2018): 0.77 (0.64-0.91), p = 0.003 Heterogeneity: 0%
Locoregional recurrence (OR) A: 0.54 (0.15-1.94) B: 0.21 (0.07-0.63) C: 0.49 (0.13-1.85) D: not reported E: 0.58 (0.34-0.99) F: 0.49 (0.26-0.92) G: 0.75 (0.34-0.99) Overall: 0.56 (0.41-0.75), p < 0.01 Heterogeneity: 0% Overall (excl. Cads, 2018): 0.49 (0.34-0.69), p < 0.01 Heterogeneity: 0%
|
Brief description of author’s conclusion: The authors conclude that their results demonstrate a lack of overall survival benefit fot RCTx compared to CTx although there are significant reductions in disease-free survival. The advantages of radiochemo-therapy diminish when both pre- and postoperative chemo-therapy are administered (used in study by Cads, 2018).
Personal remarks: Individual studies are comparable with respect to study population, except for study of Cads, 2018 (separate meta-anaysis excluding this study was carried out). Large varieties in compound and doses for chemotherapy. Survival measures differed between studies (progression-free survival in Bamias, 2010, recurrence-free survival in Zhu, 2012 and event-free survival in Cads, 2018). Large differences between studies in presence of side-effects. |
|
132% of patients from control group < 60 years of age, 20% of patients from intervention group > 60 years of age 2Not reported |
|||||||
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Matuschek, 2019 |
No;
Reason: the research question and inclusion criteria were not predefined as such. It was only stated that radiochemotherapy was compared to chemotherapy alone in resectable or resected gastric cancer. |
No;
Reason: two databases were searched in a defined search period, but the search strategy was not provided. |
No;
Reason: exclusion criteria and excluded studies were not reported. |
Yes;
Reason: relevant baseline characteristics were reported. |
Not applicable;
Reason: the systematic review solely included RCTs. |
No;
Reason: the quality of the included studies was not assessed. |
No;
Reason: Clinical heterogeneity could be questioned because of differences in a.o. surgical resection distribution, completion percentage of the intended study treatment and TNM stage. Statistical heterogeneity was assessed (Chi-square, I2). |
Unclear. |
Unclear;
Reason: source of funding or support was nog indicated for the systematic review. |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 04-10-2023
Beoordeeld op geldigheid : 01-07-2021
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodules is in 2021 een multidisciplinair cluster ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de samenstelling van het cluster) die betrokken zijn bij de zorg voor patiënten met oesofagus- en maagcarcinoom.
Clusterstuurgroep
- Dhr. prof. dr. P.D. (Peter) Siersema (voorzitter), maag-darm-leverarts, Erasmus MC, Rotterdam; NVMDL
- Mevr. dr. A. (Annemarieke) Bartels – Rutten, radioloog, NKI-AVL, Amsterdam; NVvR
- Dhr. prof. dr. M.I. (Mark) van Berge Henegouwen, chirurg, Amsterdam UMC, Amsterdam; NVvH
- Dhr. prof. dr. R. (Richard) van Hillegersberg, chirurg, UMC Utrecht, Utrecht; NVvH
- Dhr. dr. M.C.C.M. (Maarten) Hulshof, Radiotherapeut, Amsterdam UMC, Amsterdam; NVRO
- Mevr. dr. H.W.M. (Hanneke) van Laarhoven, internist, Amsterdam UMC, Amsterdam; NIV
- Mevr. dr. E.M. (Liesbeth) Timmermans, bestuurslid Stichting voor Patiënten met Kanker aan het Spijsverteringskanaal; SPKS (tot 1 december 2022)
- Dhr. dr. E. (Erik) Vegt, nucleair geneeskundige, Erasmus MC, Rotterdam; NVNG
Clusterexpertisegroep
- Dhr. drs. W.W. (Weibel) Braunius, keel-neus-oorarts, UMC Utrecht, Utrecht; NVKNO
- Mevr. dr. M.J. (Marc) van Det, chirurg, Ziekenhuisgroep Twente; NVvH
- Mevr. dr. S.S. (Suzanne) Gisbertz, chirurg, Amsterdam UMC, Amsterdam; NVvH
- Mevr. dr. N.C.T. (Nicole) van Grieken, patholoog, Amsterdam UMC, Amsterdam; NVVP
- Dhr. dr. R. (Ronald) Hoekstra, internist, Ziekenhuisgroep Twente; NIV
- Dhr. R. (Remco) Huiszoon MBA, ervaringsdeskundige Stichting voor Patiënten met kanker aan het Spijsverteringskanaal; SPKS
- Dhr. dr. P.M. (Paul) Jeene, radiotherapeut, Radiotherapiegroep; NVRO
- Dhr. dr. S.M. (Sjoerd) Lagarde, chirurg, Erasmus MC, Rotterdam; NVvH
- Dhr. dr. R.W.F. (Roelof) van Leeuwen, ziekenhuisapotheker, Erasmus MC, Rotterdam; NVZA
- Dhr. dr. S.L. (Sybren) Meijer, patholoog, Amsterdam UMC, Amsterdam; NVVP
- Mevr. dr. B. (Bianca) Mostert, internist, Erasmus MC, Rotterdam; NIV
- Mevr. dr. C.T. (Kristel) Muijs, radiotherapeut, UMCG, Groningen; NVRO
- Mevr. dr. R.E. (Roos) Pouw, maag-darm-leverarts, Amsterdam UMC, Amsterdam; NVMDL
- Mevr. dr. L. (Luidmila) Peppelenbosch – Kodach, patholoog, NKI-AVL, Amsterdam; NVVP
- Mevr. drs. H. (Heidi) Rütten, radiotherapeut, Radboud UMC, Nijmegen; NVRO
- Mevr. dr. M. (Marije) Slingerland, internist, LUMC, Leiden; NIV
- Mevr. prof. dr. V.M.C.W. (Manon) Spaander, maag-darm-leverarts, Erasmus MC, Rotterdam; NVMDL
Met ondersteuning van:
- Mevr. dr. C. (Charlotte) Gaasterland, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Mevr. S.N. (Sarah) van Duijn MSc, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Mevr. M. (Miriam) te Lintel Hekkert MSc, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle clusterleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van de clusterleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Clusterstuurgroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Siersema (Voorzitter) |
MDL-arts Erasmus MC Rotterdam
|
Editor in Chief, Endoscopy |
Research funding/advisory board zonder invloed op deze richtlijn |
Geen restrictie |
|
Timmermans |
- Bestuurslid SPKS (Stichting voor Patiënten met kanker aan het Spijsverteringskanaal) 5 uur per week - Gedragswetenschappelijk docent huisartsenopleiding Eerstelijnsgeneeskunde Radboudumc |
Onbetaald vrijwilligerswerk Bestuurslid SPKS (15 uur per week) |
Geen |
Geen restrictie |
|
Van Laarhoven |
Hoofd afdeling medische oncologie, Amsterdam UMC |
- Wetenschappelijke raad KWF (onbetaald) - Voorzitter ESMO upper GI faculty (onbetaald) - Lid ESMO Leadership Generation programme (onbetaald) - Lid EORTC upper GI strategy commiittee (onbetaald) |
- Research funding/medication: Amgen, AstraZeneca, Bayer, BMS, Celgene, Janssen, Lilly, Merck, MSD, Nordic Pharma, Philips, Roche, Servier |
Geen restrictie |
|
Bartels |
Radioloog, Antoni van Leeuwenhoek |
Geen |
Geen |
Geen restrictie |
|
Van Berge Henegouwen |
Chirurg slokdarm en maagchirurgie Amsterdam UMC Hoogleraar slokdarm en maagchirurgie Universiteit van Amsterdam |
Geen |
- Olympus financiering studie (researcher initiated grant) Stryker financiering studie (researcher initiated grant) uitkomsten richtlijn geen invloed op deze bedrijven of studies - Consultancy voor meerdere bedrijven (uitbetaling aan Amsterdam UMC), niet gerelateerd aan richtlijn. |
Geen restrictie |
|
Hulshof |
Radiotherapeut oncoloog Amsterdam UMC |
Geen |
Geen |
Geen restrictie |
|
Van Hillegersberg |
Chirurg, UMC Utrecht |
Proctor Intuitive Surgical Consultant Medtronic |
- Bestuur DUCA, DICA |
Geen restrictie |
|
Vegt |
Nucleair geneeskundige, Afdeling Radiologie en Nucleaire Geneeskunde, Erasmus MC, Rotterdam |
Geen |
- ZonMW-subsidie voor de PLASTIC-studie, programma doelmatigheid van zorg, naar de kosten-effectiviteit van FDG-PET/CT en laparoscopie bij maagcarcinoom. |
Geen restrictie |
Clusterexpertisegroep
Richtlijn oesofaguscarcinoom: Module 1 ‘Adjuvante immuuntherapie bij oesofaguscarcinoom’
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Mostert |
Internist-oncoloog, Erasmus MC |
Consultancy voor: BMS, Lilly, Servier |
- BMS: fase 2 studie: nivolumab tijdens actieve surveillance slokdarmcarcinoom Sanofi: cabazitaxel bij AR-v7 positieve prostaatcarcinoom patiënten Pfizer: DLA bij mammacarcinoompatiënten behandeld met CDK4/6 |
De NIV is gevraagd extra reviewers af te vaardigen tijdens de commentaarfase met betrekking tot de modules over immunotherapie en chemoradiatie. |
|
Hoekstra |
Internist-oncoloog, Ziekenhuisgroep Twente (ZGT) |
Lid Concillium Medicinae Internae (onbetaald) |
- Als internist-oncoloog betrokken bij inclusie van patiënten in klinische studies bij oesofagus- en maagcarcinoom. Op dit moment Critics-2 studie en Lyrics studie |
Geen restrictie |
|
Meijer |
Patholoog, Amsterdam UMC |
Geen |
Geen |
Geen restrictie |
Richtlijn maagcarcinoom: Module 2 ‘Diagnostiek M-stadium’
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Gisbertz |
Slokdarmkanker en maagkanker chirurg - Amsterdam UMC |
Geen |
Geen |
Geen restrictie |
|
Van Det |
Gastro-intestinaal chirurg Ziekenhuis groep Twente (ZGT) |
- Proctor/Instructor voor Intuitive Surgical betreffende Robot-Assisted operaties in de upper-GI zoals: - Slokdarm resecties - Maagresecties - Hernia diafragmatica. |
Geen |
Geen restrictie |
Richtlijn maagcarcinoom: Module 3 ‘Adjuvante therapie bij maagcarcinoom’
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Rutten |
Radiotherapeut, Radboud UMC |
Geen |
Geen |
Geen restrictie |
|
Slingerland |
Internist-oncoloog LUMC |
Geen |
- Advisory board Lilly en BMS |
De NIV is gevraagd extra reviewers af te vaardigen tijdens de commentaarfase met betrekking tot de modules over immunotherapie en chemoradiatie. |
Richtlijn maagcarcinoom: Module 4 ‘Biomarker diagnostiek: PD-L1 bepaling’
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Slingerland |
Internist-oncoloog LUMC |
Geen |
- Advisory board Lilly en BMS |
Geen restrictie |
|
Van Grieken |
Patholoog, Amsterdam UMC (locatie Vumc), Amsterdam |
Detachering Expertisepanel poliepen BVO-DK, Screeningsorganisatie BVO darmkanker (3 uur/week) |
- KWF - Identificatie van markers voor response op immunotherapie - projectleider - KWF - CRITICS-II klinische trial voor resectabel maagcarcinoom - ZonMW - Effect van chemotherapie bij patienten met microsatelliet instabiel resectabel maagcarcinoom. - projectleider |
Geen restrictie |
|
Kodach |
Patholoog, NKI/AVL |
Geen |
Deelname studie inter-observer variabiliteit voor PD-L1 CPS in maagcarcinomen, gefinancierd door BMS, fee naar de werkgever AVL/NKI |
Geen restrictie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door de afvaardiging van de Stichting voor Patiënten met kanker aan het Spijsverteringskanaal (SPKS). De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptmodule is tevens voor commentaar voorgelegd aan SPKS en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module 1 ‘Adjuvante immuuntherapie’ |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar zijn (<5.000 patiënten) en daarom naar verwachten geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module 2 ‘M-stadiëring’ |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar zijn (<5.000 patiënten) en daarom naar verwachten geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module 3 ‘Adjuvante therapie’ |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar zijn (<5.000 patiënten) en daarom naar verwachten geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module 4 ‘Biomarker diagnostiek: PD-L1 expressie’ |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar zijn (<5.000 patiënten) en daarom naar verwachten geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Need-for-update, prioritering en uitgangsvragen
Tijdens de need-for-update fase inventariseerde het cluster de geldigheid van de modules binnen het cluster. Naast de betrokken wetenschappelijke verenigingen en patiëntenorganisaties zijn hier ook andere stakeholders voor benaderd in juni 2021.
Per module is aangegeven of deze geldig is, kan worden samengevoegd met een andere module, obsoleet is en kan vervallen of niet meer geldig is en moet worden herzien. Ook was er de mogelijkheid om nieuwe onderwerpen voor modules aan te dragen die aansluiten bij één (of meerdere) richtlijn(en) behorend tot het cluster. De modules die door één of meerdere partijen werden aangekaart als ‘niet geldig’ zijn meegegaan in de prioriteringsfase. Deze module is geprioriteerd door het cluster.
Voor de geprioriteerde modules zijn door het cluster concept-uitgangsvragen herzien of opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde het cluster welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. Het cluster waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Het cluster definieerde klinisch (patiënt) relevante verschillen, tenminste voor de cruciale uitkomstmaten.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen.
De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID).
Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en deze worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door het cluster wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. Het cluster heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar.
De commentaren werden verzameld en besproken met het cluster. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door het cluster. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Aggelis V, Cunningham D, Lordick F, Smyth EC. Peri-operative therapy for operable gastroesophageal adenocarcinoma: past, present and future. Ann Oncol. 2018 Jun 1;29(6):1377-1385. doi: 10.1093/annonc/mdy183. PMID: 29771279. |
Wrong publication type (narrative review). |
|
Agolli L, Nicosia L. Between evidence and new perspectives on the current state of the multimodal approach to gastric cancer: Is there still a role for radiation therapy? World J Gastrointest Oncol. 2018 Sep 15;10(9):271-281. doi: 10.4251/wjgo.v10.i9.271. PMID: 30254722; PMCID: PMC6147768. |
Wrong publication type (narrative review). |
|
Ben Kridis W, Rejab H, Mzali R, Daoud J, Khanfir A. Localized stomach cancer: Perioperative or postoperative approach? A meta-analysis of phase III studies. JGH Open. 2022 Mar 18;6(4):236-240. doi: 10.1002/jgh3.12727. PMID: 35475203; PMCID: PMC9021713. |
Systematic review with a broader PICO. |
|
Cai Z, Yin Y, Shen C, Wang J, Yin X, Chen Z, Zhou Y, Zhang B. Comparative effectiveness of preoperative, postoperative and perioperative treatments for resectable gastric cancer: A network meta-analysis of the literature from the past 20 years. Surg Oncol. 2018 Sep;27(3):563-574. doi: 10.1016/j.suronc.2018.07.011. Epub 2018 Jul 18. PMID: 30217320. |
Wrong comparisons. |
|
Cainap C, Vlad C, Seicean A, Balacescu O, Seicean R, Constantin AM, Balacescu L, Crisan O, Marta MM, Cainap S. Gastric cancer: adjuvant chemotherapy versus chemoradiation. A clinical point of view. J BUON. 2019 Nov-Dec;24(6):2209-2219. PMID: 31983085. |
Wrong publication type (narrative review). |
|
Cats A, Jansen EPM, van Grieken NCT, Sikorska K, Lind P, Nordsmark M, Meershoek-Klein Kranenbarg E, Boot H, Trip AK, Swellengrebel HAM, van Laarhoven HWM, Putter H, van Sandick JW, van Berge Henegouwen MI, Hartgrink HH, van Tinteren H, van de Velde CJH, Verheij M; CRITICS investigators. Chemotherapy versus chemoradiotherapy after surgery and preoperative chemotherapy for resectable gastric cancer (CRITICS): an international, open-label, randomised phase 3 trial. Lancet Oncol. 2018 May;19(5):616-628. doi: 10.1016/S1470-2045(18)30132-3. Epub 2018 Apr 9. PMID: 29650363. |
Included in selected systematic review (Matuschek, 2019). |
|
Chen X, Eads JR, Ammori JB, Kumar AM, Biswas T, Dorth JA. Adjuvant and neoadjuvant options in resectable gastric cancer: is there an optimal treatment approach? Curr Oncol Rep. 2015 Apr;17(4):18. doi: 10.1007/s11912-015-0442-4. PMID: 25708803. |
Wrong publication type (narrative review). |
|
Dai Q, Jiang L, Lin RJ, Wei KK, Gan LL, Deng CH, Guan QL. Adjuvant chemoradiotherapy versus chemotherapy for gastric cancer: a meta-analysis of randomized controlled trials. J Surg Oncol. 2015 Mar;111(3):277-84. doi: 10.1002/jso.23795. Epub 2014 Oct 1. PMID: 25273525. |
Overlap with the selected systematic review (Matuschek, 2019). |
|
Fiorica F, Trovò M, Ottaiano A, Nasti G, Carandina I, Marzola M, De Paoli P, Berretta M. Can the addition of radiotherapy postoperatively increase clinical outcome of patients with gastric cancer? A systematic review of the literature and meta-analysis. Oncotarget. 2017 Dec 28;9(12):10734-10744. doi: 10.18632/oncotarget.23754. PMID: 29535839; PMCID: PMC5828196. |
Wrong comparisons. |
|
Fitzgerald TL, Efird JT, Bellamy N, Russo SM, Jindal C, Mosquera C, Holliday EG, Biswas T. Perioperative chemotherapy versus postoperative chemoradiotherapy in patients with resectable gastric/gastroesophageal junction adenocarcinomas: A survival analysis of 5058 patients. Cancer. 2017 Aug 1;123(15):2909-2917. doi: 10.1002/cncr.30692. Epub 2017 Apr 6. PMID: 28386965. |
Wrong publication type (retrospective cohort). |
|
Fuchs CS, Niedzwiecki D, Mamon HJ, Tepper JE, Ye X, Swanson RS, Enzinger PC, Haller DG, Dragovich T, Alberts SR, Bjarnason GA, Willett CG, Gunderson LL, Goldberg RM, Venook AP, Ilson D, O'Reilly E, Ciombor K, Berg DJ, Meyerhardt J, Mayer RJ. Adjuvant Chemoradiotherapy With Epirubicin, Cisplatin, and Fluorouracil Compared With Adjuvant Chemoradiotherapy With Fluorouracil and Leucovorin After Curative Resection of Gastric Cancer: Results From CALGB 80101 (Alliance). J Clin Oncol. 2017 Nov 10;35(32):3671-3677. doi: 10.1200/JCO.2017.74.2130. Epub 2017 Oct 4. PMID: 28976791; PMCID: PMC5678342. |
Wrong intervention. |
|
Jabo B, Selleck MJ, Morgan JW, Lum SS, Bahjri K, Aljehani M, Garberoglio CA, Reeves ME, Namm JP, Solomon NL, Luca F, Yang G, Senthil M. Role of lymph node ratio in selection of adjuvant treatment (chemotherapy vs. chemoradiation) in patients with resected gastric cancer. J Gastrointest Oncol. 2018 Aug;9(4):708-717. doi: 10.21037/jgo.2018.05.12. PMID: 30151267; PMCID: PMC6087859. |
Wrong publication type (retrospective cohort). |
|
Kanda M, Kodera Y, Sakamoto J. Updated evidence on adjuvant treatments for gastric cancer. Expert Rev Gastroenterol Hepatol. 2015;9(12):1549-60. doi: 10.1586/17474124.2015.1094373. Epub 2015 Sep 28. PMID: 26414453. |
Wrong publication type (narrative review). |
|
Lu H, Sun Y, Zhu Z, Yao J, Xu H, Huang R, Huang B. Effect of Chemoradiotherapy on the Survival of Resectable Gastric Cancer Patients: A Systematic Review and Meta-Analysis. Ann Surg Oncol. 2022 Oct;29(11):6962-6975. doi: 10.1245/s10434-022-12005-1. Epub 2022 Jun 20. PMID: 35723792. |
The systematic review did not include RCTs. |
|
Marrelli D, Polom K, de Manzoni G, Morgagni P, Baiocchi GL, Roviello F. Multimodal treatment of gastric cancer in the west: Where are we going? World J Gastroenterol. 2015 Jul 14;21(26):7954-69. doi: 10.3748/wjg.v21.i26.7954. PMID: 26185368; PMCID: PMC4499339. |
Wrong publication type (narrative review). |
|
Park SH, Lim DH, Sohn TS, Lee J, Zang DY, Kim ST, Kang JH, Oh SY, Hwang IG, Ji JH, Shin DB, Yu JI, Kim KM, An JY, Choi MG, Lee JH, Kim S, Hong JY, Park JO, Park YS, Lim HY, Bae JM, Kang WK; ARTIST 2 investigators. A randomized phase III trial comparing adjuvant single-agent S1, S-1 with oxaliplatin, and postoperative chemoradiation with S-1 and oxaliplatin in patients with node-positive gastric cancer after D2 resection: the ARTIST 2 trial☆. Ann Oncol. 2021 Mar;32(3):368-374. doi: 10.1016/j.annonc.2020.11.017. Epub 2020 Dec 3. PMID: 33278599. |
Wrong comparison. |
|
Park SH, Sohn TS, Lee J, Lim DH, Hong ME, Kim KM, Sohn I, Jung SH, Choi MG, Lee JH, Bae JM, Kim S, Kim ST, Park JO, Park YS, Lim HY, Kang WK. Phase III Trial to Compare Adjuvant Chemotherapy With Capecitabine and Cisplatin Versus Concurrent Chemoradiotherapy in Gastric Cancer: Final Report of the Adjuvant Chemoradiotherapy in Stomach Tumors Trial, Including Survival and Subset Analyses. J Clin Oncol. 2015 Oct 1;33(28):3130-6. doi: 10.1200/JCO.2014.58.3930. Epub 2015 Jan 5. PMID: 25559811. |
Included in selected systematic review (Matuschek, 2019). |
|
Rim CH, Shin IS, Lee HY, Yoon WS, Park S. Oncologic Benefit of Adjuvant Chemoradiation after D2 Gastrectomy: A Stepwise Hierarchical Pooled Analysis and Systematic Review. Cancers (Basel). 2020 Jul 31;12(8):2125. doi: 10.3390/cancers12082125. PMID: 32751879; PMCID: PMC7465129. |
The systematic review did not only include RCTs. |
|
Slagter AE, Jansen EPM, van Laarhoven HWM, van Sandick JW, van Grieken NCT, Sikorska K, Cats A, Muller-Timmermans P, Hulshof MCCM, Boot H, Los M, Beerepoot LV, Peters FPJ, Hospers GAP, van Etten B, Hartgrink HH, van Berge Henegouwen MI, Nieuwenhuijzen GAP, van Hillegersberg R, van der Peet DL, Grabsch HI, Verheij M. CRITICS-II: a multicentre randomised phase II trial of neo-adjuvant chemotherapy followed by surgery versus neo-adjuvant chemotherapy and subsequent chemoradiotherapy followed by surgery versus neo-adjuvant chemoradiotherapy followed by surgery in resectable gastric cancer. BMC Cancer. 2018 Sep 10;18(1):877. doi: 10.1186/s12885-018-4770-2. PMID: 30200910; PMCID: PMC6131797. |
Wrong publication type (study protocol). |
|
Sugawara K, Kawaguchi Y, Seto Y, Vauthey JN. Multidisciplinary treatment strategy for locally advanced gastric cancer: A systematic review. Surg Oncol. 2021 Sep;38:101599. doi: 10.1016/j.suronc.2021.101599. Epub 2021 May 11. PMID: 33991939. |
No meta-analysis. |
|
Wang MJ, Li C, Sun Y, Shen FJ, Wang CB. Prognostic effect of adjuvant chemoradiotherapy for patients with gastric cancer: an updated evidence of randomized controlled trials. Oncotarget. 2017 Oct 24;8(61):102880-102887. doi: 10.18632/oncotarget.21983. PMID: 29262530; PMCID: PMC5732696. |
Overlap with the selected systematic review (Matuschek, 2019). |
|
Wong RK, Jang R, Darling G. Postoperative chemoradiotherapy vs. preoperative chemoradiotherapy for locally advanced (operable) gastric cancer: clarifying the role and technique of radiotherapy. J Gastrointest Oncol. 2015 Feb;6(1):89-107. doi: 10.3978/j.issn.2078-6891.2014.089. PMID: 25642342; PMCID: PMC4294828. |
Wrong publication type (narrative review). |
|
Wu DM, Wang S, Wen X, Han XR, Wang YJ, Shen M, Fan SH, Zhang ZF, Zhuang J, Shan Q, Li MQ, Hu B, Sun CH, Lu J, Zheng YL. Survival Benefit of Three Different Therapies in Postoperative Patients With Advanced Gastric Cancer: A Network Meta-Analysis. Front Pharmacol. 2018 Aug 22;9:929. doi: 10.3389/fphar.2018.00929. PMID: 30210338; PMCID: PMC6119769. |
Wrong comparisons. |
|
Zhou ML, Kang M, Li GC, Guo XM, Zhang Z. Postoperative chemoradiotherapy versus chemotherapy for R0 resected gastric cancer with D2 lymph node dissection: an up-to-date meta-analysis. World J Surg Oncol. 2016 Aug 8;14(1):209. doi: 10.1186/s12957-016-0957-7. PMID: 27502921; PMCID: PMC4977857. |
Overlap with the selected systematic review (Matuschek, 2019). |
Literature search strategy
Zoekverantwoording
Aantallen treffers en ontdubbeling
|
SR |
RCT |
Aantal treffers |
Aantal treffers na ontdubbeling |
|
|
Medline |
62 |
86 |
148 |
146 |
|
Embase |
104 |
121 |
225 |
89 |
|
Na ontdubbeling |
110 |
125 |
235 |
|
Ovid MEDLINE(R) ALL <1946 to July 20, 2022>
|
1 |
Stomach Neoplasms/ or linitis-plastica.ti,ab,kf. or ((carcinoma* or neoplas* or adenoma* or adenocarcinoma* or tumor* or tumour* or cancer* or oncolog* or malignan* or carcinogen* or oncogen* or anticarcinogen* or squamous*) adj5 (stomach or gastric* or cardia or gastroesophag* or gastrooesophag* or oesogast* or esogast*)).ti,ab,kf. |
149280 |
|
2 |
exp Radiotherapy, Adjuvant/ or exp Chemoradiotherapy, Adjuvant/ or ((Postoperative Period/ or exp Postoperative Care/ or adjuvant*.ti,ab,kf. or postoperat*.ti,ab,kf. or postsurg*.ti,ab,kf. or post-operat*.ti,ab,kf. or post-surg*.ti,ab,kf. or (after adj3 surg*).ti,ab,kf. or (after adj3 operat*).ti,ab,kf.) and (Chemoradiotherapy/ or Radiotherapy/ or chemoradio*.ti,ab,kf. or radiochemo*.ti,ab,kf. or chemo-radio*.ti,ab,kf. or radio-chemo*.ti,ab,kf. or chemoradiati*.ti,ab,kf. or radiati*.ti,ab,kf. or radiotherap*.ti,ab,kf.)) |
94164 |
|
3 |
1 and 2 |
2218 |
|
4 |
3 not ((Adolescent/ or Child/ or Infant/) not Adult/) |
2209 |
|
5 |
4 not ((exp animals/ or exp models, animal/) not humans/) |
2206 |
|
6 |
5 not (comment/ or editorial/ or letter/ or Case Reports/) |
1858 |
|
7 |
limit 6 to (english language and yr="2015 -Current") |
671 |
|
8 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
577973 |
|
9 |
7 and 8 |
62 |
|
10 |
exp randomized controlled trial/ or random*.ti,ab,kf. or ((pragmatic or practical) adj clinical trial*).ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf. |
1475276 |
|
11 |
7 and 10 |
124 |
|
12 |
11 not 9 |
86 |
Embase.com 21 juli 2022
|
No. |
Query |
Results |
|
#12 |
#11 NOT #9 |
121 |
|
#11 |
#7 AND #10 |
163 |
|
#10 |
'randomized controlled trial'/exp OR random*:ti,ab,kw OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab,kw) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab,kw) |
1931746 |
|
#9 |
#7 AND #8 |
104 |
|
#8 |
('meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT ('conference abstract'/it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) |
644668 |
|
#7 |
#6 AND [english]/lim AND [2015-2022]/py |
917 |
|
#6 |
#5 NOT ('conference abstract'/it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it OR 'case report'/exp) |
2263 |
|
#5 |
#4 NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
3707 |
|
#4 |
#3 NOT (('adolescent'/exp OR 'child'/exp) NOT ('adult'/exp OR 'aged'/exp OR 'middle aged'/exp)) |
3714 |
|
#3 |
#1 AND #2 |
3725 |
|
#2 |
'adjuvant radiotherapy'/exp OR (('postoperative period'/de OR 'postoperative care'/exp OR adjuvant*:ti,ab,kw OR postoperat*:ti,ab,kw OR postsurg*:ti,ab,kw OR 'post operat*':ti,ab,kw OR 'post surg*':ti,ab,kw OR ((after NEAR/3 surg*):ti,ab,kw) OR ((after NEAR/3 operat*):ti,ab,kw)) AND ('chemoradiotherapy'/de OR 'radiotherapy'/de OR chemoradio*:ti,ab,kw OR radiochemo*:ti,ab,kw OR 'chemo radio*':ti,ab,kw OR 'radio chemo*':ti,ab,kw OR chemoradiati*:ti,ab,kw OR radiati*:ti,ab,kw OR radiotherap*:ti,ab,kw)) |
140617 |
|
#1 |
'stomach tumor'/exp OR 'linitis plastica':ti,ab,kw OR (((carcinoma* OR neoplas* OR adenoma* OR adenocarcinoma* OR tumor* OR tumour* OR cancer* OR oncolog* OR malignan* OR carcinogen* OR oncogen* OR anticarcinogen* OR squamous*) NEAR/5 (stomach OR gastric* OR cardia OR gastroesophag* OR gastrooesophag* OR oesogast* OR esogast*)):ti,ab,kw) |
220304 |
