Manuele lymfedrainage (MLD)
Uitgangsvraag
Wat is de indicatie van MLD bij patiënten met lymfoedeem?
Aanbeveling
Overweeg alleen op zorgvuldige gronden alle soorten van MLD bij obstructieve lymfafvloedstoornissen/hoge afterload (zoals bijv. lymfoedeem na oncologische ingrepen) in de midline regio’s, het hoofdhalsgebied en de onderste extremiteiten gedurende de initiële behandelfase als aanvulling op de standaard DLT-modaliteiten.
Wees terughoudend om MLD toe te passen bij de behandeling van borstkanker gerelateerd arm lymfoedeem in de initiële behandelfase als de meerwaarde niet onderbouwd kan worden.
Pas geen MLD toe bij patiënten met oedeem ten gevolge van een hoge preload zoals dynamische lymfinsufficiëntie, oedeem bij overgewicht, dependency oedeem en ulcus cruris.
Pas geen MLD toe ten behoeve van preventie van lymfoedeem voor patiënten met een verhoogd risico op lymfoedeem.
Onderzoek de aard van pijnklachten en andere sensorische klachten. Het gebruik van MLD ter verlichting van neuropatische en nociplastische (pijn) klachten wordt ontraden.
Pas in principe geen MLD toe in de onderhoudsfase.
Overweeg de toepassing van mobiliserende weefseltechnieken bij fibrosering van de huid als aanvulling op standaard DLT-modaliteiten ter verbetering van de mobiliteiten en gliding van het weefsel en daarmee de uitbreiding van de functionaliteit van de patiënt (mits de meerwaarde klinisch onderbouwd kan worden).
Overwegingen
Kwaliteit van het bewijs
Het globale niveau van de aanbevelingen rondom MLD is laag tot zeer laag. Mede doordat er een verscheidenheid aan meetmethoden wordt toegepast en deze ook op verschillende wijze wordt gerapporteerd kan er geen meta-analyse worden uitgevoerd. Daardoor is het niet mogelijk om tot een hoger niveau van bewijskracht te komen. De conclusies uit de studies zijn er eenduidig over dat het effect van MLD niet kan worden vastgesteld of uitgesloten.
Na de zoekdatum van de literatuursearch is de RCT van de Vrieze et al. (2022) gepubliceerd. Gezien het niveau en de opzet van de studie is ervoor gekozen om deze mee te nemen in de overwegingen. De Vrieze et al. (2022) onderzoeken het effect van decongestieve lymfatische therapie (DLT) + FG-MLD (Fluroscopy Guided MLD) (n = 65) vs. DLT + traditionele MLD (n = 64) en vs. DLT + placebo MLD (n = 64) bij unilateraal borstkanker gerelateerd lymfoedeem (n = 65). Er werd geen significant verschil gevonden tussen zowel FG-MLD en traditionele MLD (gemiddeld verschil 0,0%; 95% BI -2,0 tot 2,1) als tussen FG-MLD en placebo MLD (gemiddeld verschil -0,2%; 95% BI -2,1 tot 1,8). Conclusie van de Vrieze et al. (2022) is dat MLD geen klinisch voordeel geeft t.o.v. andere onderdelen van DLT.
Een beperking is dat alle geïncludeerde studies borstkanker gerelateerd (arm) lymfoedeem beschrijven. Er zijn geen studies geïncludeerd die het effect van MLD op de onderste extremiteiten, het hoofd- hals gebied en het midline gebied onderzoeken. Om deze reden baseren de aanbevelingen op de onderste extremiteiten, het hoofd- hals gebied en het midline gebied zich op de mening van de werkgroep.
Balans van gewenste en ongewenste effecten
De afzonderlijke studies naar MLD vonden alle geen significant verschil op het subjectief ervaren van oedeemreductie, zwaar gevoel, spanning van de arm en borst, pijn, angst en sensorische klachten.
Toch is een veel gebruikte onderbouwing voor toepassing van MLD een recidiverende sensatie van ongemak door de patiënt; pijn, branderig gevoel, zeurend gevoel, gevoel van zwelling, etc. Met name de pijn is niet een typisch kenmerk van lymfoedeem. Behandelaren dienen alert te zijn op patiënten met (risico op) centrale sensitisatie en patiënten met neuropatische klachten na een invasief of oncologisch behandeltraject. Het toepassen van MLD draagt waarschijnlijk niet bij aan het verhelpen van neuropatische klachten.
Gradalski et al. (2015) omschrijft een significant verschil in de belemmering bij intieme relaties bij toepassing van MLD in het voordeel van MLD. Er kunnen geen uitspraken gedaan worden of aanraking in het algemeen dit effect veroorzaakt of de typische MLD-handgrepen.
Omdat op basis van de geïncludeerde literatuur geen uitspraken gedaan kunnen worden over de effectiviteit van MLD maar deze ook niet uitgesloten kan worden, vraagt toepassing van MLD een weloverwogen beoordeling van de patiënt en diens voorgeschiedenis. Toepassing van MLD is daarmee een individuele afweging en dient terughoudend of niet toegepast of voortgezet (bv. onderhoudsfase) te worden als de meerwaarde niet onderbouwd kan worden (secundaire preventie, latent oedeem).
Professioneel perspectief
MLD is een tijdsintensieve behandeling die niet altijd van toegevoegde waarde is bij een oedeembehandeling. Zorgprofessionals kijken daarom zorgvuldig en selectief naar de inzet van MLD complementair aan DLT. MLD aan de bovenste/onderste extremiteiten wordt niet meer als de standaardbehandeling beschouwd bij lymfoedeemtherapie en wordt ook niet als zodanig bij de gehele patiëntenpopulatie toegepast.
Bij bepaalde patiëntengroepen en behandelgebieden, waar bijvoorbeeld compressie niet optimaal kan worden ingezet, kan overwogen worden MLD toe te passen, zoals het hoofd-hals gebied. Echter geldt ook hier dat MLD terughoudend of niet toegepast of voortgezet (bv. onderhoudsfase) wordt als de meerwaarde niet onderbouwd kan worden. Bij oedeem-exacerbaties en fluctuerend oedeem verdient het de voorkeur om eerst te kijken naar de overige behandelopties zoals optimaliseren van compressie, gewichtsreductie indien van toepassing, beweegadviezen (oefen- en reactivering-therapie indien van toepassing), zelfmanagement methodes en leefstijl interventie alvorens MLD te overwegen. Te allen tijde moet een medische evaluatie plaatsvinden om een medische oorzaak van de exacerbatie zoals recidief tumor of andere oorzaken van toegenomen lymfbelasting (zowel preload als afterload) te beoordelen.
Het beoogde effect van MLD is het vergroten van de lymfatische flow bij een verminderde werking van het lymfesysteem. Er is geen meerwaarde voor MLD bij oedeem t.g.v. hoge preload/dynamische insufficiëntie, denk hierbij aan oedeem door veneuze insufficiëntie, hart of nierfalen.
Manuele of machinale mobiliserende weefseltechnieken kunnen worden toegepast bij fibrosering van het weefsel ontstaan na bijvoorbeeld operaties, radiotherapie of bij lang bestaand oedeem. Ondanks het benoemen van deze technieken binnen de module MLD, is er een duidelijk onderscheid tussen MLD en deze mobiliserende weefsel technieken.
Deze technieken hebben niet het doel om het vocht te verplaatsen of het lymfesysteem te stimuleren maar kunnen worden toegepast om mobiliteit te verbeteren, weefsel soepeler te maken en de onderlinge verschuifbaarheid te verbeteren. Er is (nog) geen wetenschappelijk bewijs voor de effectiviteit, of het ontbreken daaraan, van deze mobiliserende weefsel technieken als onderdeel van DLT. Bij langdurig bestaand lymfoedeem is er een toename van de vetvorming. Deze kan alleen operatief worden verwijderd. (zie de module reductiechirurgie)
Waarden en voorkeuren van patiënten
Patiënten geven vaak aan baat te hebben bij MLD/mobiliserende en machinale weefseltechnieken, waarbij het niet mogelijk is een uitsplitsing te maken tussen beide behandelingen. Voor patiënten vallen beide behandelingen vaak onder de noemer massage. Zij ervaren verlichting (vooral minder druk en zwelling en meer soepelheid). Het is belangrijk dat MLD en mobiliserende/machinale weefseltechnieken worden toegepast als het zinvol is.. Daarbij dient de behandelaar niet alleen aandacht te hebben voor volumereductie, maar ook voor de kwaliteit van leven voor patiënten. Daarnaast is het belangrijk de contra-indicaties van MLD en mobiliserende/machinale weefseltechnieken te bespreken met de patiënt, zodat hij/zij weet dat de behandelingen veilig zijn. Indien zelfmassage zinvol is, dient de patiënt goed geïnstrueerd te worden bij de behandelaar in de praktijk.
Aanvaardbaarheid en haalbaarheid
Wanneer MLD in de eerste lijn aansluitend aan andere DLT-modaliteiten in één consult wordt toegepast, zal dit met weinig tot geen extra kosten gepaard gaan. Anderzijds is MLD wel een tijdsintensieve methode; deze tijd mag niet ten koste gaan van het toepassen van de andere effectieve modaliteiten van DLT. Compressietherapie, kennisverstrekking, beweegadviezen, zelfmanagement en huidzorg vormen de basis van DLT.
Zowel MLD als mobiliserende weefseltechnieken kunnen desalniettemin bij een deel van de patiënten van meerwaarde zijn. Het informeren van de patiënt over de toepassing en het effect van MLD in de initiële fase en de methode van afbouwen en evalueren zijn belangrijke randvoorwaarden voor het toepassen van MLD. Hier dienen therapeuten van bewust te zijn en voldoende aandacht aan te spenderen. Ook dient de therapeut alert te zijn bij patiënten met een nociplastisch of neuropatisch pijn beeld. Patiënten kunnen tijdelijke verlichting ervaren van MLD, maar MLD is niet geschikt om als monotherapie toe te passen. Doorverwijzing voor medische beoordeling en een passend behandeltraject zijn vereist.
Onderbouwing
Achtergrond
Manuele lymfedrainage (MLD) is een massagetechniek waarbij de oedeemtherapeut probeert, door langzame afferente bewegingen richting oedeemvrij gebied, de vochtopname door de lymfvaten te stimuleren en de lymfe afvloed te stimuleren. Er bestaan verschillende ‘lymfescholen’ die hun eigen techniek hebben ontwikkeld. In Nederland worden de volgende drainage technieken (of een combinatie hiervan) aangeleerd: Vodder, Casley-Smith, Asdonk, Földi en Fill&Flush (FG-MLD). De verschillen van de technieken zitten voornamelijk in verschillende inzichten van de grondlegger van de methode: hoe de handgrepen worden uitgevoerd en combinaties van verschillende (aanvullende) technieken. MLD wordt al jaren wereldwijd toegepast als techniek binnen de oedeemtherapie als onderdeel van DLT (decongestieve lymfatische therapie).
Het beoogde doel van MLD is om de lymfvasomotoriek te stimuleren en om een betere reabsorptie van interstitieel vocht te bewerkstelligen (zonder gelijktijdig een verhoging van de filtratie te veroorzaken). Daarnaast beoogt het de stimulatie van de vorming van collaterale banen, parasympatische stimulatie en het creëren van lymfo-lymfatische anastomose. Manuele lymfedrainage wordt voornamelijk toegepast als het lymfoedeem verplaatsbaar (pitting) is.
Naast MLD zijn er manuele en machinale technieken om weefsels soepeler te maken en de gliding (onderlinge verschuifbaarheid van weefsels) te verbeteren. Voorbeelden hiervan zijn de fascie release technieken, fibrosegrepen, littekenmassage, negatieve druktechnieken en percussietherapie. Deze technieken hebben niet het doel om het vocht te verplaatsen of het lymfesysteem te stimuleren maar kunnen worden toegepast om mobiliteit te verbeteren, weefsel soepeler te maken en de onderlinge verschuifbaarheid te verbeteren. Dit kan bij een deel van de patiënten met lymfoedeem van toegevoegde waarde zijn.
Sinds de introductie van de Richtlijn Lymfoedeem in 2014 zijn een aantal prospectieve onderzoeken verschenen en enkele reviews die de effectiviteit van verschillende lymfoedeem-behandeling met en zonder MLD hebben onderzocht. Deze studies in combinatie met de mening van de werkgroep vormen de basis van de aanbevelingen en overwegingen.
Conclusies / Summary of Findings
|
Laag |
Uitkomstmaat: Ernst van lymfoedeem volgens behandelaars
Het toevoegen van MLD aan een behandeling van oefentherapie en compressietherapie lijkt de ernst van lymfoedeem volgens onderzoekers niet te verminderen.
Andersen (2000), Bergmann (2014), Gradalski (2015), Tambour (2018) |
|
Zeer laag |
Uitkomstmaat: Ernst van lymfoedeem volgens patiënten
Een effect van MLD op de ernst van lymfoedeem volgens patiënten kon niet worden aangetoond of worden uitgesloten.
Bergmann (2014), Tambour (2018) |
|
Laag |
Uitkomstmaat: Kwaliteit van leven
Het is toevoegen van MLD aan een behandeling van oefentherapie en compressietherapie lijkt kwaliteit van leven niet te verbeteren.
Gradalski (2015) |
|
- |
Uitkomstmaten: patiënttevredenheid t.a.v. behandeling, bijwerkingen, kosteneffectiviteit, onafhankelijkheid/zelfmanagement, therapietrouw, beweging/activiteit
Er zijn geen studies gevonden die deze uitkomstmaten beschreven. |
|
Zeer laag |
Uitkomstmaat: Ernst van lymfoedeem volgens behandelaars
Het effect van MLD + zwachtelen t.o.v. alleen zwachtelen op de ernst van lymfoedeem volgens behandelaars kon niet worden aangetoond en niet worden uitgesloten.
Johansson (1999), McNeely (2004) |
|
- |
Uitkomstmaten: ernst van lymfoedeem volgens patiënten, kwaliteit van leven, patiënttevredenheid t.a.v. behandeling, bijwerkingen, kosteneffectiviteit, onafhankelijkheid/zelfmanagement, therapietrouw, beweging/activiteit
Er zijn geen studies gevonden die deze uitkomstmaten beschreven. |
|
Zeer laag |
Uitkomstmaat: Ernst van lymfoedeem volgens behandelaars
Het effect van MLD + compressie t.o.v. pneumatische compressie + compressie op de ernst van lymfoedeem volgens behandelaars kon niet worden aangetoond en niet worden uitgesloten.
Johansson (1998) |
|
- |
Uitkomstmaten: ernst van lymfoedeem volgens patiënten, kwaliteit van leven, patiënttevredenheid t.a.v. behandeling, bijwerkingen, kosteneffectiviteit, onafhankelijkheid/zelfmanagement, therapietrouw, beweging/activiteit
Er zijn geen studies gevonden die deze uitkomstmaten beschreven. |
|
Zeer laag |
Uitkomstmaat: Ernst van lymfoedeem volgens behandelaars
Het effect van MLD + compressie vs. simple lymphatic drainage (SLD) + compressie is op ernst van lymfoedeem volgens behandelaars kon niet worden aangetoond en niet worden uitgesloten.
Sitzia (2002), Williams (2002) |
|
- |
Uitkomstmaten: ernst van lymfoedeem volgens patiënten, kwaliteit van leven, patiënttevredenheid t.a.v. behandeling, bijwerkingen, kosteneffectiviteit, onafhankelijkheid/zelfmanagement, therapietrouw, beweging/activiteit
Er zijn geen studies gevonden die deze uitkomstmaten beschreven. |
|
Vergelijking: MLD + oefentherapie + compressie vs. oefentherapie + compressie Literatuur: Andersen (2000), Bergmann (2014), Gradalski (2015), Tambour (2018) |
||||||||
|
Certainty assessment |
Samenvatting resultaten |
|||||||
|
Aantal deelnemers |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Publicatie bias |
Overall certainty of evidence |
|
|
|
Uitkomstmaat: ernst van lymfoedeem volgens behandelaars |
||||||||
|
221 |
ernstiga |
niet ernstig |
niet ernstig |
ernstigb |
niet gevonden |
⨁⨁◯◯ |
Alle vier studies rapporteerden volume als uitkomstmaat en geen van de studies vond een significant verschil tussen interventiegroep en controlegroep. Een meta-analyse van 3 studies die percentage overmatig volumeafname rapporteerden, vond geen significant verschil aan het einde van de interventie (mean difference 1.50%, 95% BI -1,56 ; 4,56). Drie studies rapporteerden volume na een follow-up van 6-12 maanden na staken van de MLD en vonden geen verschil. Het toevoegen van MLD aan een standaardbehandeling van oefentherapie en compressietherapie lijkt de ernst van lymfoedeem volgens behandelaars niet te verminderen. |
|
|
Uitkomstmaat: ernst van lymfoedeem volgens patiënten |
||||||||
|
130 |
ernstigc |
ernstigd |
niet ernstig |
ernstigb |
niet gevonden |
⨁◯◯◯ |
Beide studies vonden geen significant verschil op meerdere uitkomstmaten die de ernst van lymfoedeem volgens patiënten zou weergeven. Het is onduidelijk wat de invloed van MLD naast oefentherapie en compressie is op de ernst van lymfoedeem volgens patiënten |
|
|
Uitkomstmaat: kwaliteit van leven |
||||||||
|
51 |
ernstigc |
niet ernstig |
niet ernstig |
ernstigb |
niet gevonden |
⨁⨁◯◯ |
De studie vond geen verschil in algehele kwaliteit van leven tussen de interventiegroep en controlegroep. Van de 18 subschalen werd er voor 17 subschalen geen significant verschil gevonden en voor de subschaal 'belemmeringen in intieme relaties' wel een verschil. Het is toevoegen van MLD aan een standaardbehandeling van oefentherapie en compressietherapie lijkt kwaliteit van leven niet te verbeteren. |
|
BI: betrouwbaarheidsinterval
Legenda:
a. Er zijn beperkingen in studieopzet zoals geen blindering van patiënten en zorgverleners, het ontbreken van een studieprotocol en het in één studie niet rapporteren van alle uitkomstmaten.
b. De resultaten van de studies kunnen een effect van de interventie niet aantonen dan wel uitsluiten.
c. Er zijn beperkingen in studieopzet zoals geen blindering van patiënten en zorgverleners en het ontbreken van een studieprotocol.
d. Er zijn verschillende meetmethodes gebruikt om deze uitkomstmaat weer te geven.
|
Vergelijking: MLD + zwachtelen vs. zwachtelen Literatuur: Johansson (1999), McNeely (2004) |
||||||||
|
Certainty assessment |
Samenvatting resultaten |
|||||||
|
Aantal deelnemers |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Publicatie bias |
Overall certainty of evidence |
|
|
|
Uitkomstmaat: ernst van lymfoedeem volgens behandelaren |
||||||||
|
83 |
ernstiga |
ernstigb |
niet ernstig |
ernstigc |
niet gevonden |
⨁◯◯◯ |
Beide studies rapporteerden drie uitkomstmaten die de ernst van lymfoedeem volgens behandelaren zouden weergeven. Op twee van de drie uitkomstmaten werd geen significant verschil tussen de interventiegroep en controlegroep gevonden. Voor één van de drie uitkomstmaten werd een significant effect in de richting van de interventie-groep gevonden. Het is onduidelijk wat het effect van MLD naast een behandeling met zwachtelen is op de ernst van lymfoedeem volgens behandelaren. |
|
Legenda:
a. Er waren ernstige beperkingen in één van de studies, welke ook een groot gewicht had in de meta-analyse. Zo waren er problemen wat betreft randomisatie, allocatie en blindering.
b. Er waren variaties in de duur van de interventie (1 vs 4 weken). Er is heterogeniteit in de uitkomstmaten, waarbij alle gerapporteerde uitkomstmaten iets over volume zouden zeggen maar er verschillende resultaten zijn.
c. De resultaten kunnen een effect van de interventie niet aantonen dan wel uitsluiten.
|
Vergelijking: MLD + compressie vs. IPC + compressie Literatuur: Johansson (1998) |
||||||||
|
Certainty assessment |
Samenvatting resultaten |
|||||||
|
Aantal deelnemers |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Publicatie bias |
Overall certainty of evidence |
|
|
|
Uitkomstmaat: ernst van lymfoedeem volgens behandelaars |
||||||||
|
24 |
ernstiga |
niet ernstig |
niet ernstig |
zeer ernstigb |
niet gevonden |
⨁◯◯◯ |
De studie rapporteerde drie uitkomstmaten die volume zouden weergeven. Voor twee van de drie uitkomstmaten werd geen significant verschil gevonden tussen de interventiegroep en de controlegroep. Voor de uitkomstmaat 'volumeafname' werd een significant verschil ten gunste van de MLD-groep gevonden. Het is onduidelijk wat het effect van MLD + compressietherapie vs. IPC + compressietherapie is op de ernst van lymfoedeem volgens behandelaars. |
|
Legenda:
a. Er waren ernstige beperkingen in de studieopzet, zoals onjuiste randomisatie en allocatie en geen blindering.
b. Er waren zeer weinig inclusies. De gevonden resultaten kunnen een effect van de interventie niet aantonen dan wel uitsluiten.
|
Vergelijking: MLD + compressie vs. SLD + compressie Literatuur: Sitzia (2002), Williams (2002) |
||||||||
|
Certainty assessment |
Samenvatting resultaten |
|||||||
|
Aantal deelnemers |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Publicatie bias |
Overall certainty of evidence |
|
|
|
Uitkomstmaat: ernst van lymfoedeem volgens behandelaars |
||||||||
|
59 |
ernstiga |
ernstigb |
niet ernstig |
ernstigc |
niet gevonden |
⨁◯◯◯ |
Eén studie rapporteerde 3 uitkomstmaten die volume van lymfoedeem zouden weergeven en vond voor twee van de drie uitkomstmaten geen significant verschil tussen de interventiegroep en controlegroep. Voor volumereductie in mL werd een significant effect ten gunste van MLD gevonden. De studie van Sitzia (2002) rapporteerde alleen percentage volumeverlies en vond geen verschil tussen interventiegroep en controlegroep. Het is onduidelijk wat het effect van MLD + compressie vs. SLD + compressie is op ernst van lymfoedeem volgens behandelaars |
|
Legenda:
a. Er waren ernstige beperkingen in studieopzet zoals geen blindering en onduidelijkheid over allocatie.
b. Er was sprake van heterogeniteit tussen de studies: zo werden er verschillende MLD protocollen toegepast, verschilde de duur van de interventies en was er sprake van verschillende controlebehandelingen waarbij in één studie SLD door de patiënt zelf werd toegepast en in de andere studie door de behandelaar.
c. De gevonden resultaten kunnen een effect van de interventie niet aantonen dan wel uitsluiten.
Samenvatting literatuur
Eén systematische review (Ezzo 2015) en zes primaire studies die gepubliceerd werden na de zoekdatum van de review, werden in 2e instantie alsnog geïncludeerd. Voor een volledig overzicht van de karakteristieken van geïncludeerde reviews en studies en de beoordeling van het risico op bias wordt verwezen naar 'Evidence tabellen'.
De literatuuranalyse is als volgt opgebouwd:
- MLD + oefentherapie + compressie vs. oefentherapie + compressie.
- MLD + zwachtelen vs. zwachtelen.
- MLD + compressie vs. pneumatische compressie + compressie.
- MLD + compressie vs. simple lymphatic drainage (SLD) + compressie.
MLD + oefentherapie + compressie vs. oefentherapie + compressie
Beschrijving van de studies
Eén RCT uit een systematic review van Ezzo et al. (2015) en 3 RCT’s gepubliceerd na de zoekdatum van deze
SR, vergeleken MLD, oefentherapie en compressie met alleen oefentherapie en compressie
(Andersen 2000, Bergmann 2014, Gradalski 2015, Tambour 2018). Alle studies onderzochten patiënten met borstkanker-gerelateerd lymfoedeem. De interventie-duur varieerde van twee tot vier weken, waarbij patiënten twee tot vijf MLD-sessies per week ondergingen die 45 minuten tot één uur duurden. Eén studie paste de Foldi methode toe (Tambour 2018), alle overige studies de Vodder methode. De standaardzorg waarmee werd vergeleken was in drie studies combined decongestive therapy (CDT), compressie, oefentherapie, huidzorg en voorlichting (Bergmann 2014, Gradalski 2015, Tambour 2018). In de studie van Andersen et al. (2000) werden naast oefentherapie, huidverzorging en voorlichting, compressiekousen toegepast die werden afgebouwd naarmate het oedeem afnam. Daarmee voldoen zij niet geheel aan de criteria voor CDT, waarbij gezwachteld wordt in de initiële fase. De studies van Gradalski et al. (2015) en Tambour et al. (2018) hadden een follow-up van 6 maanden na het staken van de MLD. Andersen et al. (2000) had een follow-up van 12 maanden. In de studie van Bergmann et al. (2014) werden de laatste metingen gedaan direct na de laatste MLD-sessie en was er geen follow-up.
Beschrijving van de resultaten
1. Ernst van lymfoedeem volgens behandelaars
Alle studies rapporteerden volume als uitkomstmaat, maar deden dit op verschillende manieren, zoals absoluut armvolume en percentage afname van overmatig volume. Waar mogelijk werden de verschillende uitkomsten gepoold in een meta-analyse.
Percentage afname van overmatig volume (direct na laatste MLD behandeling):
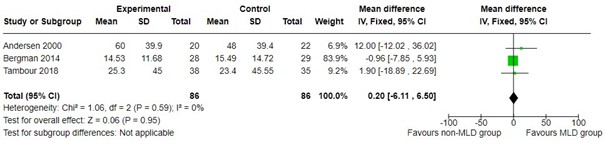
Drie studies rapporteerden deze uitkomstmaat (Andersen 2000, Bergman 2014, Tambour 2018). Een meta-analyse van deze studies liet geen significant verschil tussen de MLD groep en non-MLD-groep zien (gemiddeld verschil 1,50%; 95% BI -1,56 tot 4,56).
Figuur 1: percentage afname van overmatig volume: MLD + oefentherapie + compressie vs. oefentherapie + compressie
Absoluut armvolume:
De studie van Gradalski et al. (2015) mat het absolute armvolume na elke MLD behandeling en na 1, 3 en 6 maanden en vond geen verschil tussen de interventiegroep en controlegroep op alle meetmomenten.
Volumeverschil op lange termijn (6-12 maanden na laatste MLD behandeling):
Drie studies rapporteerden deze uitkomstmaat op verschillende manieren, zoals absoluut armvolume, overmatig volume en percentage overmatig volume. Hierdoor zijn de resultaten niet te combineren in een meta-analyse. Geen van de studies vond een significant verschil in volume op lange termijn tussen groepen die wel of geen MLD hadden ontvangen in de initiële behandelfase.
Andere uitkomstmaten die de ernst van lymfoedeem volgens behandelaars weergeven, werden niet beschreven.
2. Ernst van lymfoedeem volgens patiënten VAS-pijn:
Twee studies rapporteerden deze uitkomstmaat waarbij Bergmann et al. (2014) de afname in VAS-pijn vergeleek tussen de interventiegroep en controlegroep en Tambour et al. (2018) de absolute VAS-pijn. Hierdoor is een meta-analyse niet mogelijk. Beide studies vonden geen significant verschil: Bergmann et al. (2014) vond in de interventiegroep een gemiddeld verschil van -1,54 (SD 3,43) en in de controlegroep -1,17 (SD 3,24). Tambour et al. (2018) vond een gemiddeld absoluut verschil in VAS-pijn (1-5) na afloop van de interventie van 0,1 punten (SE 0,2) en na follow-up van 7 maanden 0,2 punten (SE 0,2).
Overige uitkomstmaten die ernst van lymfoedeem volgens patiënten beschrijven (omdat er geen overlap in uitkomstmaten tussen studies is, worden deze per studie beschreven): Bergmann et al. (2014) vond geen significant verschil in subjectief ervaren oedeemreductie, schouderfunctie en waardering van de behandeling door patiënten. Tambour et al. (2018) vond een significant verschil in spanning in de schouder na 1 maand maar niet na 7 maanden. Zij vonden geen significant verschil in zwaarheid van de arm, spanning in de arm en borst, mobiliteit, zelfzorg, dagelijkse activiteiten, pijn, angst of VAS-gezondheid.
3. Kwaliteit van leven
Kwaliteit van leven werd in één studie gerapporteerd (Gradalski 2015). De studie maakte gebruik van de Lymphedema Questionnaire en vond geen significant verschil tussen de interventiegroep en de controlegroep. De Lymphedema questionnaire scoort een aantal subschalen waarvan een significant verschil werd gevonden op het onderdeel ‘belemmeringen in intieme relaties’. Er werd geen significant verschil gevonden op de subschalen pijn, zwaar gevoel, strakheid van de huid, sensorische klachten, subjectief ervaren grootte van de arm, restricties bij bewegen, zwak gevoel van de arm, huidinfecties, subjectieve ervaring over hoe de arm er uit ziet, belemmeringen in sociaal leven, belemmeringen in subjectief welbevinden, belemmeringen in huishoudelijke taken, belemmeringen in taken op het werk, belemmeringen in activiteiten in de vrije tijd, problemen met het passen van kleding, slaapstoornissen, en afhankelijkheid van anderen.
4. Overige uitkomstmaten
Er waren geen studies die de volgende uitkomstmaten beschreven: patiënttevredenheid t.a.v. behandeling, bijwerkingen, kosteneffectiviteit, onafhankelijkheid/zelfmanagement, therapietrouw en beweging/activiteit.
Risk of Bias
De systematic review van Ezzo et al. (2015) had een laag risico op bias op alle onderdelen. In de primaire studie van Andersen (2000) die in deze review geïncludeerd was, was de randomisatie, allocatie en blindering onduidelijk. Ook werden niet alle uitkomstmaten gerapporteerd, waardoor er een risico is op reporting bias. De studies van Bergmann et al. (2014), Gradalski et al. (2015) en Tambour et al. (2018) hadden geen beperkingen in randomisatie, maar allocatie was onduidelijk en er waren beperkingen t.a.v. niet blinderen van de proefpersonen en onduidelijkheid over het blinderen van de personen die de uitkomstmaten beoordeelden. Bij alle studies ontbrak een verwijzing naar het studieprotocol waardoor niet te beoordelen is of er sprake is van selectief rapporteren.
De Risk of Bias analyse is te vinden in 'Evidence tabellen'.
Kwaliteit van bewijs – GRADE
De GRADE-analyse van deze vergelijking is te vinden in 'Conclusies'.
|
Laag |
Uitkomstmaat: Ernst van lymfoedeem volgens behandelaars
Het toevoegen van MLD aan een behandeling van oefentherapie en compressietherapie lijkt de ernst van lymfoedeem volgens onderzoekers niet te verminderen.
Andersen (2000), Bergmann (2014), Gradalski (2015), Tambour (2018) |
|
Zeer laag |
Uitkomstmaat: Ernst van lymfoedeem volgens patiënten
Een effect van MLD op de ernst van lymfoedeem volgens patiënten kon niet worden aangetoond of worden uitgesloten.
Bergmann (2014), Tambour (2018) |
|
Laag |
Uitkomstmaat: Kwaliteit van leven
Het is toevoegen van MLD aan een behandeling van oefentherapie en compressietherapie lijkt kwaliteit van leven niet te verbeteren.
Gradalski (2015) |
|
- |
Uitkomstmaten: patiënttevredenheid t.a.v. behandeling, bijwerkingen, kosteneffectiviteit, onafhankelijkheid/zelfmanagement, therapietrouw, beweging/activiteit
Er zijn geen studies gevonden die deze uitkomstmaten beschreven. |
MLD + zwachtelen vs. zwachtelen
Beschrijving van de studies
De systematic review van Ezzo et al. (2015) includeerde twee primaire studies die het effect van MLD naast zwachtelen onderzochten bij lymfoedeem van de arm (Johansson 1999, McNeely 2004). In de studie van Johansson et al. (1999) werden patiënten in de interventiegroep in week 1 en 2 gezwachteld en kregen zij in week 3 vijf MLD-sessies van 45 minuten volgens de Vodder techniek. De controlegroep werd gedurende 3 weken gezwachteld. De zwachtels van zowel de interventie- als de controlegroep werden elke twee dagen gewisseld McNeely et al. (2004) paste MLD volgens de Vodder methode toe waarbij patiënten sessies van 45 minuten ondergingen 5 dagen per week gedurende 4 weken. In beide groepen werd er dagelijks gezwachteld. Bij beide studies werden de uitkomstmaten gemeten na de laatste behandeling en was er geen verdere follow-up.
Beschrijving van de resultaten
1. Ernst van lymfoedeem volgens behandelaars
Beide studies rapporteerden meerdere uitkomstmaten die volume weergeven na aflopen van de interventie. De studies werden in de systematic review van Ezzo et al. (2015) gepoold in een meta-analyse.
Lymfoedeem volume (overmatig volume in de ledemaat na behandeling):
Een meta-analyse van beide studies liet geen significant verschil zien tussen de MLD + zwachtelen groep en de groep waar alleen gezwachteld werd (gemiddeld verschil -60,73 ml; 95% BI -194,43 tot 72,96).
Volume reductie in ml:
Een meta-analyse van beide studies liet geen significant verschil zien in volumereductie tussen de MLD + zwachtelen groep en de groep waar alleen gezwachteld werd (gemiddeld verschil 26,21 ml; 95% BI -1,04 tot 53,45).
Percentage volumeverandering:
Een meta-analyse van beide studies liet een significant verschil zien ten gunste van de MLD groep in percentage volumeverandering (gemiddeld verschil 7,11%; 95% BI 1,75 tot 12,47).
Overige uitkomstmaten die ernst van lymfoedeem volgens behandelaren rapporteren: Er waren geen andere uitkomstmaten die de ernst van lymfoedeem volgens behandelaren rapporteren.
2. Overige uitkomstmaten
Er waren geen studies die de volgende uitkomstmaten beschreven: ernst van lymfoedeem volgens patiënten, kwaliteit van leven, patiënttevredenheid t.a.v. behandeling, bijwerkingen, kosteneffectiviteit, onafhankelijkheid/zelfmanagement, therapietrouw en beweging/activiteit.
Risk of Bias
De systematic review van Ezzo et al. (2015) had een laag risico op bias op alle onderdelen. De auteurs van de systematic review deden een risk of bias analyse van de primaire studies uit deze systematic review en vonden in de studie van McNeely et al. (2004) geen beperkingen. In de studie van Johansson et al. (1999) was er geen adequate randomisatie en allocatie en waren proefpersonen en medewerkers niet geblindeerd.
De Risk of Bias analyse is te vinden in 'Evidence tabellen'.
Kwaliteit van bewijs
De GRADE analyse van deze vergelijking is te vinden in 'Conclusies'.
|
Zeer laag |
Uitkomstmaat: Ernst van lymfoedeem volgens behandelaars
Het effect van MLD + zwachtelen t.o.v. alleen zwachtelen op de ernst van lymfoedeem volgens behandelaars kon niet worden aangetoond en niet worden uitgesloten.
Johansson (1999), McNeely (2004) |
|
- |
Uitkomstmaten: ernst van lymfoedeem volgens patiënten, kwaliteit van leven, patiënttevredenheid t.a.v. behandeling, bijwerkingen, kosteneffectiviteit, onafhankelijkheid/zelfmanagement, therapietrouw, beweging/activiteit
Er zijn geen studies gevonden die deze uitkomstmaten beschreven. |
MLD + compressie vs. IPC + compressie
Beschrijving van de studies
De systematic review van Ezzo et al. (2015) includeerde één primaire studies die MLD + compressie vergeleek met pneumatische compressie + compressie (Johansson 1998). Er waren geen studies na de zoekdatum van de systematic review die deze behandelingen met elkaar vergeleken. De studie includeerde patiënten met lymfoedeem van de arm. In deze studie kregen alle patiënten in week 1 en 2 een TEK en kreeg de interventiegroep in week 3 en 4 vijf dagen per week een MLD behandeling van 45 minuten volgens de Vodder methode. De controlegroep onderging in week 3 en 4 een behandeling met een pneumatische pomp van 40-60 mmHg gedurende 2 uur per dag.
Beschrijving van de resultaten
1. Ernst van lymfoedeem volgens behandelaars
Lymfoedeem volume (overmatig volume in de ledemaat na behandeling):
Er werd een onbetrouwbaar verschil in lymfoedeem volume gezien tussen de MLD + compressie groep en de pneumatische compressie + compressie groep aan het einde van de interventie (gemiddeld verschil 122,00 ml; 95% BI -57,59 tot 301,59).
Volume reductie in ml:
Er werd een verschil ten gunste van de MLD groep gezien in volume reductie van de aangedane arm (gemiddeld verschil 47,00 ml; 95% BI 15,25 tot 78,75).
Percentage volumeverandering:
Er was geen verschil in percentage volumeverandering tussen de MLD + compressie groep en de pneumatische compressie + compressie groep (gemiddeld verschil 8,00%; 95% BI -0,75 tot 16,75).
Overige uitkomstmaten die ernst van lymfoedeem volgens behandelaren rapporteren: Er waren geen andere uitkomstmaten die de ernst van lymfoedeem volgens behandelaren rapporteren.
2. Ernst van lymfoedeem volgens patiënten
Er werd geen verschil in subjectieve sensaties (pijn, zwaarheid/spanning) tussen de interventiegroep en controlegroep aan het einde van de interventie waargenomen. Er waren geen gegevens gerapporteerd over de grootte van het effect.
3. Overige uitkomstmaten
Er waren geen studies die de volgende uitkomstmaten beschreven: kwaliteit van leven,
patiënttevredenheid t.a.v. behandeling, bijwerkingen, kosteneffectiviteit, onafhankelijkheid/zelfmanagement, therapietrouw en beweging/activiteit.
Risk of Bias
De systematic review van Ezzo et al. (2015) had een laag risico op bias op alle onderdelen. Een risk of bias analyse uitgevoerd door de auteurs van de review, liet zien dat in de primaire studie van Johansson et al. (1998) beperkingen waren op het gebied van randomisatie, allocatie en blinderen.
De Risk of Bias analyse is te vinden in 'Evidence tabellen'.
Kwaliteit van bewijs
De GRADE analyse van deze vergelijking is te vinden in 'Conclusies'.
|
Zeer laag |
Uitkomstmaat: Ernst van lymfoedeem volgens behandelaars
Het effect van MLD + compressie t.o.v. pneumatische compressie + compressie op de ernst van lymfoedeem volgens behandelaars kon niet worden aangetoond en niet worden uitgesloten.
Johansson (1998) |
|
- |
Uitkomstmaten: ernst van lymfoedeem volgens patiënten, kwaliteit van leven, patiënttevredenheid t.a.v. behandeling, bijwerkingen, kosteneffectiviteit, onafhankelijkheid/zelfmanagement, therapietrouw, beweging/activiteit
Er zijn geen studies gevonden die deze uitkomstmaten beschreven. |
MLD + compressie vs. SLD + compressie
Beschrijving van de studies
De systematic review van Ezzo et al. (2015) includeerde drie primaire studies die MLD + compressie vergeleken met een simpele lymfatische drainage (SLD) + compressie (Sitzia 2002, Williams 2002). Er werden geen studies gevonden die gepubliceerd waren na de zoekdatum van de review. Beide studies onderzochten patiënten met lymfoedeem van de arm.
In de studie van Sitzia et al. (2002) ondergingen patiënten in de interventiegroep dagelijks een 90 minuten durende MLD behandeling volgens de LeDuc methode gedurende 2 weken. In de controlegroep werd dagelijks 30 minuten SLD toegepast door de behandelaar. Beide groepen kregen ook een compressie behandeling. De studie van Williams et al. (2002) behandelde patiënten in de interventiegroep met 5 MLD sessies per week van 45 minuten volgens de Vodder methode gedurende drie weken, terwijl in de controlegroep patiënten zelf SLD toepasten gedurende 20 minuten per dag. Beide groepen droegen een kous. Er was een cross-over design, maar alleen de data na afloop van de eerste interventie werden geïncludeerd in deze analyse. Bij beide studies werden de uitkomstmaten gemeten na de laatste behandeling en was er geen verdere follow-up.
Beschrijving van de resultaten
1. Ernst van lymfoedeem volgens behandelaars
Volume werd door beide studies bepaald en op verschillende manieren gemeten. Vanwege verschillen in de studieopzet en interventie, konden de resultaten niet gepoold worden in een meta-analyse.
Lymfoedeem volume (overmatig volume in de ledemaat na behandeling):
Deze uitkomstmaat werd alleen beschreven door de studie van Williams et al. (2002). Er werd een verschil in lymfoedeem volume gevonden ten gunste van de MLD + compressie groep (gemiddeld verschil -230,00 ml; 95% BI -450,84 tot -9,16).
Volume reductie in ml:
Deze uitkomstmaat werd alleen beschreven door de studie van Williams et al. (2002). Er werd geen verschil tussen de MLD + compressie groep en SLD + compressie groep gevonden (gemiddeld verschil 10,00 ml; 95% BI -90,54 tot 110,54). Deze resultaten zijn echter onzeker gezien het betrouwbaarheidsinterval.
Percentage volumeverandering:
Beide studies rapporteerden deze uitkomstmaat en vonden geen verschil in percentage volumeverandering tussen de interventiegroep en de controlegroep (Sitzia 2002:
gemiddeld verschil 11,80%; 95% BI -2,47 tot 26,07, Williams 2002: gemiddeld verschil 2,40%; 95% BI -14,11 tot 9,31). Deze resultaten zijn echter onzeker gezien het betrouwbaarheidsinterval.
Overige uitkomstmaten die ernst van lymfoedeem volgens behandelaren rapporteren Er waren geen andere uitkomstmaten die de ernst van lymfoedeem volgens behandelaren rapporteren.
2. Overige uitkomstmaten
Er waren geen studies die de volgende uitkomstmaten beschreven: Ernst van lymfoedeem volgens patiënten, kwaliteit van leven, patiënttevredenheid t.a.v. behandeling, bijwerkingen, kosteneffectiviteit, onafhankelijkheid/zelfmanagement, therapietrouw en beweging/activiteit.
Risk of Bias
De systematic review van Ezzo et al. (2015) had een laag risico op bias op alle onderdelen. Een risk of bias analyse uitgevoerd door de auteurs van de review, liet zien dat in de primaire studies beperkingen waren ten aanzien van de blindering van patiënten en uitkomstbeoordelaars. In de studie van Sitzia et al. (2002) was onduidelijkheid over de allocatie.
De Risk of Bias analyse is te vinden in 'Evidence tabellen'.
Kwaliteit van bewijs
De GRADE analyse van deze vergelijking is te vinden in 'Conclusies'.
|
Zeer laag |
Uitkomstmaat: Ernst van lymfoedeem volgens behandelaars
Het effect van MLD + compressie vs. simple lymphatic drainage (SLD) + compressie is op ernst van lymfoedeem volgens behandelaars kon niet worden aangetoond en niet worden uitgesloten.
Sitzia (2002), Williams (2002) |
|
- |
Uitkomstmaten: ernst van lymfoedeem volgens patiënten, kwaliteit van leven, patiënttevredenheid t.a.v. behandeling, bijwerkingen, kosteneffectiviteit, onafhankelijkheid/zelfmanagement, therapietrouw, beweging/activiteit
Er zijn geen studies gevonden die deze uitkomstmaten beschreven. |
Zoeken en selecteren
Om de uitgangsvraag te beantwoorden is een systematische literatuuranalyse uitgevoerd. Voor dit onderzoek is de volgende PICO opgesteld:
|
P: |
Patiënten met lymfoedeem of chronisch oedeem. |
|
I: |
Manuele lymfdrainage. |
|
C: |
Geen behandeling, placebo behandeling, andere behandelingen voor lymfoedeem. |
|
O: |
zie hieronder weergegeven. |
Uitkomstmaten
De werkgroep definieerde de uitkomstmaten als volgt en hanteerde de in de studies gebruikte definities.
Primair (cruciaal):
- Ernst van lymfoedeem volgens behandelaars aan het eind van de studie: objectieve gevalideerde parameters
- Volumetrische veranderingen;
- Duur remissie/duur tot volgende behandeling (bij compressiebehandeling);
- Bewegingsbeperking (met name bij de armen) (goniometrie);
- Kracht (1 Repetitie Maximaal);
- Algehele Conditie (Astrand test, CPET, );
- Bioimpedance of Tissue Dialectric Constant;
- BMI / buikomvang / taille / heup ratio;
- Huid verschuifbaarheid, oppakbaarheid en turgor (littekens);
- Wonden.
- Ernst van lymfoedeem volgens patiënten aan het eind van de studie.
- Pijn (Margolis pijn diagram, pijn algometrie, Central Sensitisation Inventory, Pain Detect, Numeric Rating Scales / Visual Analoge Scale);
- Vermoeidheid (Multi Dimensionelel Vermoeidheid Vragenlijst);
- DASH voor schouderproblematiek;
- Kwaliteit van leven aan het eind van de studie, gevalideerde QoL lijsten;
- Quality of life measure for limb lymphoedema (LYMQOL);
- Quality of life: Rand/SF36, (CES-D), Distress thermometer/lastmeter, 4DKL);
- the Upper Limb Lymphedema 27 (ULL-27);
- Freiburg Life Quality Assessment-Lymphedema (FLQA-L);
- Lymph-ICF armen en benen (LYMPH-ICF-LL/UL);
- EQ-5D-5L.
- Patiënttevredenheid t.a.v. behandeling.
Secundair (belangrijk):
- Proportie patiënten met bijwerking;
- Kosteneffectiviteit;
- Onafhankelijkheid/zelfmanagement.
Zoeken en selecteren
Er werd een systematische zoekstrategie uitgevoerd in de elektronische databases Embase en Medline. De zoekstrategie is toegevoegd in de bijlage ‘zoekstrategieën’. Studies werden geïncludeerd wanneer deze overeenkwamen met de elementen van de PICO en aan de volgende in- en exclusiecriteria voldeden:
Inclusie
- Uitsluitend studies die gevalideerde meetmethodes gebruiken;
- RCT’s, CCT’s of SR’s van RCT’s of CCT’s;
- Uitsluitend Nederlandstalige, Duitstalig en Engelstalige publicaties;
- Geen beperking leeftijd patiënten;
- Interventieduur > 4 weken.
Exclusie
- Studies zonder originele gegevens (wel systematische reviews);
- Case control studies;
- Studies met minder dan 30 deelnemers (10 bij zeldzame vorm van lymfoedeem);
- Studies die middelen beschrijven die in Nederland niet beschikbaar zijn.
Er werden in totaal 24 studies geselecteerd op basis van beoordeling van titel en abstract. Uiteindelijk zijn er na de screening van de volledige tekst 17 studies geëxcludeerd. Specifieke redenen voor exclusie zijn beschreven in de 'Evidence tabellen'.
Referenties
- Bergmann, A., M. G. Da Costa Leite Ferreira, S. S. De Aguiar, R. De Almeida Dias, K. De Souza Abrahão, E. M. Paltrinieri, R. G. Martinez Allende and M. F. C. Andrade (2014). "Physiotherapy in upper limb lymphedema after breast cancer treatment: A randomized study." Lymphology 47(2): 82-91.
- Ezzo, J., E. Manheimer, M. L. McNeely, D. M. Howell, R. Weiss, K. I. Johansson, T. Bao, L. Bily, C. M. Tuppo, A. F. Williams and D. Karadibak (2015). "Manual lymphatic drainage for lymphedema following breast cancer treatment." Cochrane Database of Systematic Reviews 2015(5).
- Gradalski, T., K. Ochalek and J. Kurpiewska (2015). "Complex Decongestive Lymphatic Therapy with or Without Vodder II Manual Lymph Drainage in More Severe Chronic Postmastectomy Upper Limb Lymphedema: A Randomized Noninferiority Prospective Study." Journal of Pain and Symptom Management 50(6): 750-757.
- Tambour, M., M. Holt, A. Speyer, R. Christensen and B. Gram (2018). "Manual lymphatic drainage adds no further volume reduction to Complete Decongestive Therapy on breast cancer-related lymphoedema: a multicentre, randomised, singleblind trial." British Journal of Cancer 119(10): 1215-1222.
- De Vrieze T, Gebruers N, Nevelsteen I, Fieuws S, Thomis S, De Groef A, Tjalma WA, Belgrado JP, Vandermeeren L, Monten C, Hanssens M, Devoogdt N. Manual lymphatic drainage with or without fluoroscopy guidance did not substantially improve the effect of decongestive lymphatic therapy in people with breast cancer-related lymphoedema (EFforT-BCRL trial): a multicentre randomised trial. J Physiother. 2022 Apr;68(2):110-122.
- Provencher AM, Giguère-Lemieux É, Croteau É, Ruchat SM, Corbin-Berrigan LA. The use of manual lymphatic drainage on clinical presentation of musculoskeletal injuries: A systematic review. Complement Ther Clin Pract. 2021 Nov;45:101469.
- Klein I, Tidhar D, Kalichman L. Lymphatic treatments after orthopedic surgery or injury: A systematic review. J Bodyw Mov Ther. 2020 Oct;24(4):109-117.
Evidence tabellen
Tabellen karakteristieken geselecteerde studies
|
Study reference |
Study characteristic |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
|
Ezzo 2015
A. Andersen 2000 B. Johansson 1998 C. Johansson 1999 D. McNeely 2004 E. Sitzia 2002 F. Williams 2002 |
Type of study Systematic review
Country USA
Search date May 2013
Number of included studies 6
Source of funding The Cochrane Complementary Medicine Field
Inclusion criteria - Randomised or quasi-randomised trials of any language. - participants who have been diagnosed with BCRL in any body area (i.e., arm, hand, trunk) (at least 2 cm circumference increase compared to unaffected arm, 200 ml increase in water displacement, 10% excess volume, or criteria for BCRL defined by the authors when bioimpedance or tissue dialectric constant was used. - Studies where MLD was given to one group and not the other. |
N total: 208
|
1. MLD + standard physiotherapy + compression therapy A. Vodder method, 8 1h sessions over 2 weeks.
2. MLD + compression bandaging C. Vodder method, 5 45m sessions in the 3rd week of compression therapy (no MLD in week 1 and 2). D. Vodder method, 5 45 m sessions per week for 4 weeks.
3. MLD + compression therapy B. Vodder method 10 45m sessions over 2 weeks. E. LeDuc method, 10 90m sessions over 2 weeks. F. Vodder method, 5 45 m sessions per week for 3 weeks.
|
1. standard physiotherapy + compression therapy A.
2. Compression bandaging C, D.
3. non-MLD treatment + compression therapy B: IPC E, F: Simple lymphatic drainage, performed by patient in F. and performed by therapist in E.
|
Length of follow up: Follow-up times were presented immediately post-treatment for all trials except study A, which followed up for one year. All trials assessed Phase 1 (decongestion phase), and only study A also assessed Phase 2 (maintenance phase).
Loss to follow up Not reported. |
1. MLD + standard physiotherapy vs standard physiotherapy alone (A) Volumetry: water displacement & circumference, percentage reduction:
1 month: No significant between group differences.
3 months: MLD + physiotherapy and compression: 60% (95%CI 43-78%).
Physiotherapy and compression: 48% (95% CI: 32-65%) Between group difference: p > 0,05
2. MLD + compression bandaging vs compression bandaging (C, D) Lymphedema Volume (excess volume remaining in limb after treatment): Mean difference [95% CI]: -60,73 [-194,43-72,96]
Volume reduction in mL: Mean difference [95% CI]: 26,21 [-1,04-53,45].
Percentage reduction: Mean difference [95% CI]: 7,11 [1,75-12,47].
3. MLD + compression therapy vs. non-MLD + compression therapy MLD + compression vs SLD + compression Lymphedema Volume (excess volume remaining in limb after treatment) (study F): Mean difference [95% CI]: -230[-450.84,-9.16]
Volume reduction in mL (Study F): Mean difference [95% CI]: 10 [-90,54-110,54].
Percentage reduction (Study E): Mean difference [95% CI]: 11,8 [-2,47-26,07].
(Study F): Mean difference [95% CI]: -2.4 [-14,11-9,31].
MLD + compression vs IPC + compression (study B) Lymphedema Volume (excess volume remaining in limb after treatment): Mean difference [95%CI] 122 [-57,59-301,59].
Volume reduction in mL: Mean difference [95% CI]: 47 [15,25-78,75].
Percentage reduction: Mean difference [95% CI]: 8 [-0,75-16,75]. |
|
Study reference |
Study characteristics
|
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
|
Bergmann 2014 |
Type of study RCT
Country Brazil
Source of funding Not reported
Inclusion criteria women who underwent unilateral axillary lymphadenectomy and presented a circumference difference of at least 3cm as compared to the correspondent area of the contralateral limb, six or more months after surgery.
Exclusion criteria active disease, current chemotherapy or radiation treatment, hypertension, congestive heart disease, presence of inflammatory signs in the swollen limb, previous history of allergic reaction to the material used for compressive bandaging, and patients who underwent any compressive therapy in the previous three months. |
N total at baseline (n analysed) 66 (57)
Baseline characteristics Mean age 62 yr. 100% females Mean BMI 29,75 |
Physical treatment (skin care, CB, and remedial exercises) + MLD (Vodder technique) MLD: 9-12 sessions of 30 min during av. 3 weeks
|
Physical treatment (skin care, CB, and remedial exercises) |
Length of follow up None (avg intervention duration 24 days)
Lost to follow up 9 (13,6%) |
Volume (ml) calculated by the truncated cone formula
Absolute volume excess reduction (mL) mean difference (SD) MLD group: -292,21 (251,60) Control group -271,46 (227,57) p = 0,745
Percentage volume excess reduction Mean difference (SD) MLD group -14,53% (11,68) Control group -15,49% (14,72) p = 0,787
VAS pain mean difference (SD) MLD group -1,54 (3,43) Control group -1,17 (3,24) p = 0,682
No statical difference between the intervention groups and subjective feelings and symptoms. |
|
Study reference |
Study characteristics
|
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
|
Cau 2019 |
Type of study: RCT
Country Italy
Source of funding Not reported; authors declare no competing financial interests.
Inclusion criteria Morbid obesity (BMI > 40 Kg/m2), chronic bilateral lymphedema of the lower limbs.
Exclusion criteria Thermal sensitivity disturbances, pacemaker, pregnancy, arterial diseases, history of malignancy, current infections, venous thrombosis, lymphangitis. |
N total at baseline (n analysed): 48 (46)
Baseline characteristics At pre, no statistical difference was present among groups in terms of the functional/VAS assessments and circumferential/volume parameters (p > 0,05) |
Lymphatic drainage + multidisciplinary rehabilitation (n = 12). 6 60-minutes sessions of MLD following Vodder over the 4-week treatment period |
Multidisciplinary rehabilitation only (n = 12): a 4-week program including 3 hours/day of the following standardized interventions: weight management with diet, physical activity and cognitive-behavioural interventions, and physiotherapy
Captive and resistive energy transfer (TECAR) + multidisciplinary rehabilitation (n=12)
Pressure therapy + multidisciplinary rehabilitation (n=12) |
Length of follow-up: 0 Duration of intervention: 4 weeks.
Loss to follow up: 2 in the control group could not be assessed with instrumental measure at the post-session. |
Limb volume Measured by 3D laser scanner Median [QR] MLD group: Pre: 8,1 [2,2] dm3 Post: 7,9 [2,2] dm3 Not significant
Control group: Pre: 7,6 [0,9] dm3 Post: 7,4 [0,8] dm3 Not significant no between group comparison
VAS pain Median [QR] MLD group: Pre: 42,5 [31,4] Post: 30,8 [33,5] p < 0,05
Control group: Pre: 57,5 [30,2] Post: 45,5 [26,1] P < 0,05 no between group comparison
|
|
Study reference |
Study characteristic |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
|
Gradalski 2015
|
Type of study: RCT
Country Poland
Source of funding: This research received no specific funding/grant from any funding agency in the public, commercial, or not-for-profit sectors.
Inclusion criteria: patients with unilateral postmastectomy Stage-II LE, according to the International Society of Lymphology, with a 20% or greater difference between limb volumes.
Exclusion criteria: Participants were excluded if they had any evidence of cancer metastases or local recurrence (oncologist consultation), current chemotherapy or radiotherapy, symptoms or signs of infection in the affected limb, history of contralateral breast cancer, prior physiotherapy for arm lymphedema, signs or symptoms of decompensated heart disease, renal insufficiency (diminished creatinine clearance), or vein thrombosis (positive D-dimer test). |
N total at baseline (n analysed): 60
Baseline characteristics: Female: 60 Male: 0
Mean age (yr.) ±SD: CB group: 62,0 ±12,2 CDT group: 62,2 ±9,2 |
CDT group Patients were treated with: -multilayer compression bandages (three short-stretch bandages six, 10, and 12 cm in width) pressure was standardized between 20 and 30 mm Hg -physically active-assisted exercises 15 minutes a day - deep diaphragmatic breathing - prior to bandaging patients received 30 minutes of MLD based on the Vodder II method.
Patients were treated during 2 weeks, from Monday to Friday.
During the maintenance phase, patients were instructed to wear custom made flat-knitted compression garments daily and perform aerobic exercises during 15 minutes, twice a day. |
CB group Patients were treated with: -multilayer compression bandages (three short-stretch bandages six, 10, and 12 cm in width) pressure was standardized between 20 and 30 mm Hg -physically active-assisted exercises 15 minutes a day - deep diaphragmatic breathing
Patients were treated during 2 weeks, from Monday to Friday.
During the maintenance phase, patients were instructed to wear custom made flat-knitted compression garments daily and perform aerobic exercises during 15 minutes, twice a day |
Length of follow-up: During the 6 months of maintenance treatment, patients were supervised weekly by a physiotherapist
Loss to follow up: 9 patients dropped out during maintenance phase due to non-compliance
|
Limb volume in ml mean ±SD, calculated with circumferential upper limb measurement
At baseline CB group: 3431,4 ± 818,5 CDT group: 3264,8 ± 874,8 P = 0,6
After 6 months: CB group: 2949 ± 630,2 CDT group: 2845,9 ± 68,6 P = 0,3
Edema related quality of life Lymphedema Questionnaire, mean score ± SD Baseline: CB-G group 3,24 ± 1,68 CDT-G group: 3,12 ± 1,45 P = 0,4
After 3 months CB group: 1,80 ± 1,11 CDT group: 1,43 ± 1,07 P = 0,4
No statistically significant differences between the two groups were seen.
|
|
Study reference |
Study characteristic |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
|
Ha 2017
|
Type of study: RCT
Country South Korea
Source of funding: The authors declare that the research was conducted in the absence of any commercial or financial relationships that could be construed as a potential conflict of interest.
Inclusion criteria: Female patients who had been diagnosed with breast cancer and underwent mastectomy. The criterion for entry in the study was a minimum of 2 cm difference in circumference between both arms
Exclusion criteria: Patients with multiple lymphedema sites were excluded from the study.
|
N total at baseline (n analysed): 55 (55)
Baseline characteristics: Female: 55 Male: 0
Mean age (SD): PNF group: 80,76 (0,94)
MLD group
PNF+MLD group: 53,39 (2083) |
MLD group (20) Treatment details not mentioned.
Patients were treated three times a week for 16 weeks. Each session was 30 min.
|
PNF group (17) Proprioceptive neuromuscular facilitation (stretching technique). PNF techniques consisted of rhythmic initiation (RI) and a combination of isotonic, contract-relax, and hold-relax.
PNF+MLD group (18)
All patients were treated three times a week for 16 week. Each session was 30 min.
|
Length of follow-up: None
Loss-to-follow- up: None |
Lymphedema volume: % of change after 16 weeks: MLD group: -13% PNF group: -16% PNF+MLD group: -26%
MLD vs PNF: P < 0,01 MLD vs PNF+MLD: P < 0,01 PNF vs PNF+MLD: No sign difference
Shoulder ROM % of change after 16 weeks months: MLD group: +4% PNF group:+13% PNF+MLD group: +25%
MLD vs PNF: P < 0,01 MLD vs PNF+MLD: P < 0,01 PNF vs PNF+MLD: P < 0,05
Pain % in change of VAS score, from 0-10. MLD group: -40.6% PNF group:-49.6% PNF+MLD group: -71%
MLD vs PNF: No sign. difference MLD vs PNF+MLD: P < 0,01 PNF vs PNF+MLD: P < 0,05 |
|
Study reference |
Study characteristics
|
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
|
Odebiyi 2014 |
Type of study RCT
Country Portugal
Source of funding not reported
Inclusion criteria Participants with stage II-III breast cancer with arm swelling/lymphedema after mastectomy and radiotherapy, they were still on chemotherapy.
Exclusion criteria orthopaedic and neurologic conditions, surgical conditions such as incomplete axillary surgery, transabdominal rectus abdominis muscle reconstruction surgery, and uncontrolled illness that may hinder exercise performance. |
N total at baseline (n analysed) 40 (27)
Baseline characteristics Age (years) mean (SD) MLD group: 46,00 (8,40) Control group: 54,00 (14,00) |
MLD (Vodder method with arm held at a 45° angle) + Exercise (stretching and aerobic exercise) MLD: 12 sessions of 15 min. during 6 weeks.
|
Exercise (stretching and aerobic exercise). |
Length of follow up 0 (intervention duration 6 weeks).
Lost to follow up 13 3 declined to participate. 7 death (3 MLD group, 4 control group). 1 distance constraint ( control group). 2 participants from control group stopped coming for no given reason. |
Upper arm circumference (cm) Measured 13 cm from the olecranon process. Mean difference (SD) MLD group: -2,84 (1,16) Control group: -1,15 (0,62) P = 0,001
Fatigue (energy-fatigue scale, 0-25 with higher scores indicating less fatigue) MLD Pre-treatment: 9,10 (5,00) Post-treatment: 16,70 (3,20) Mean difference 7,6 [95% CI 4,67-10,53]
Control group Pre-treatment: 5,70 (1,00) Post-treatment: 6,80 (1,60) Mean difference 1,10 [95% CI -12,89-15,09] Between group comparison: p < 0,001
QoL (EORTC QLQC30), mean (SD) MLD group: Pre-treatment: 84,17 (22,00) Post-treatment: 49,41 (9,90) Mean difference -34,76; 95% CI -46.68 to -22,84.
Control group: 91,10 (13,70) Post-treatment: 79,50 (12,30) Mean difference -11,60; 95% CI -23,83-0,63
Between group comparison: p < 0,001 |
|
Study reference |
Study characteristics
|
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
|
Tambour 2018 |
Type of study: RCT
Country Denmark
Source of funding: This study was supported by the Region of Southern Denmark and Musculoskeletal Statistics Unit, The Parker Institute, Bispebjerg and Frederiksberg Hospital (RC), which is supported by a core grant from the Oak Foundation (OCAY-13-309).
Inclusion criteria: unilateral breast cancer diagnosis regardless of the date of operation and identified lymphoedema, lymphoedema >2 cm and in stage ll–lll, ultrasound scanning of the axilla in order to exclude local relapse, completed radiotherapy, and/or chemotherapy at least 6 weeks prior inclusion
Exclusion criteria: relapse of breast cancer, untreated infection, untreated heart failure, untreated renal failure, untreated deep venous thrombosis in the arm, inability to participate in physiotherapy treatments, and/or inability to understand the instructions. |
N total at baseline (n analysed): 77 (73)
Baseline characteristics: All participants were female.
Mean age (SD): T+MLD group: 62,0 (11,5) T-MLD group: 60,9 (10,8) |
T+MLD group Patients received: -skincare. -Bandaging (20-30 mmHg). -Guidance on physical activity. -MLD according to Földi’s technique, twice a week.
After 4 weeks patients received a compression sleeve which they were instructed to wear during the day for 6 months. |
T-MLD group Patients received: -skincare. -Bandaging (20-30 mmHg). -Guidance on physical activity.
After 4 weeks patients received a compression sleeve which they were instructed to wear during the day for 6 months. |
Length of follow-up: 6 months
Loss-to-follow- up: T+MLD group: 3 due to allergic reactions ass with bandages (1), erysipelas (1) and death (1).
T-MLD group: 7, due to allergic reactions ass with bandages (5), unknown (2).
|
Reduction of lymphedema Percentage total volume reduction of lymphedema after 1 month, mean (SD) T+MLD group: -4,2% (1,2) T-MLD group: -5,7 (1,2)
After 7 months, mean (SD): T+MLD group: -6,8% (1,2) T-MLD group: -5,7% (1,2) Mean difference: -1,0 (95% CI: -4,3-2,3)
Percentage excess volume reduction 1 month, mean (SD) T+MLD -25,3% (7,3) T-MLD -23,4% (7,7) p = -0,86
Patient reported outcomes such as heaviness, tension in the arm and quality of life (using the EQ-5D-5L questionnaire) did not differ significantly after 7 months between both groups. |
Exclusies na full tekst screening.
|
Artikel |
Reden van exclusie |
|
|
Beck 2012 |
Bevat 1 studie over MLD; retrospectief. |
|
|
Brandao 2020 |
SR van onvoldoende kwaliteit. Primaire studies nageslagen en geïncludeerd wanneer voldeden aan inclusiecriteria. |
|
|
|
Soares 2016 |
Studie meet niet alleen het effect van MLD maar ook andere interventies. |
|
Casley-Smith 1996 |
Studie te oud. |
|
|
Tacani 2012 |
Niet beschikbaar in Engels/Duits/Nederlands. |
|
|
Cho 2016 |
Follow up te kort. |
|
|
De Oliveira 2017 |
MLD preventief gebruikt. |
|
|
Donahue 2017 |
Follow up te kort. |
|
|
Ezzo 2015 |
Studies te oud. |
|
|
Gol 2020 |
patiëntpopulatie voldoet niet aan inclusiecriteria. |
|
|
Huang 2013 |
Alle geïncludeerde studies vóór 2010. |
|
|
Lasinski 2012 |
Alle geïncludeerde studies vóór 2010. |
|
|
Müller 2018 |
SR van onvoldoende kwaliteit. Primaire studies nageslagen en geïncludeerd wanneer voldeden aan inclusiecriteria. |
|
|
|
Dayes 2013 |
Combinatie van meerdere behandelingen. |
|
Bongi 2011 |
Patiëntpopulatie voldoet niet aan inclusiecriteria. |
|
|
Holmes 2014 |
Combinatie van meerdere behandelingen. |
|
|
Santos Crisóstomo 2015 |
Patiëntpopulatie voldoet niet aan inclusiecriteria. |
|
|
Pigott 2018 |
Combinatie van meerdere behandelingen geven. |
|
|
Ridner 2013 |
Slechte kwaliteit, behandelduur en follow-up duur niet beschreven. |
|
|
Sanal-Toprak 2019 |
Full tekst niet beschikbaar. |
|
|
Shao, 2016 |
Geïncludeerde studies in deze SR vóór 2010. Eén studie na 2010 (Dayes, 2013) hierboven reeds geëxcludeerd |
|
|
Thompson 2020 |
SR van onvoldoende kwaliteit. Primaire studies nageslagen en geïncludeerd wanneer voldeden aan inclusiecriteria. |
|
|
|
Anderson 2000 |
Studie vóór 2010 |
|
Johansson 1998 |
Studie vóór 2010 |
|
|
McNeely 2004 |
Studie vóór 2010 |
|
|
Sitzia 2002 |
Studie vóór 2010 |
|
|
Williams 2002 |
Studie vóór 2010 |
|
|
Sanal-Toprak |
Geen full text beschikbaar |
|
|
Tyker 2019 |
Geen vergelijkende onderzoeken geïncludeerd |
|
|
Van Zanten 2014 |
Evidence-based statement o.b.v. systematische search; specifieke uitkomsten niet gerapporteerd derhalve niet te gebruiken |
|
Risico op bias
Randomized controlled trial (RCT)
Beoordeling risk of bias door middel van Cochrane collaboration tool.
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Random sequence generation (selection bias)2
(high/unclear/low risk) |
Allocation concealment (selection bias)3
(high/unclear/low risk) |
Blinding of participants and personnel (performance bias)4,6 All outcomes
(high/unclear/low risk) |
Blinding of outcome assessor (detection bias)5,6 All outcomes
(high/unclear/low risk) |
Incomplete outcome data (attrition bias)7 All outcomes
(high/unclear/low risk) |
Selective reporting (reporting bias)8
(high/unclear/low risk) |
Other bias9
(high/unclear/low risk) |
|
Belmonte 2012 |
A computer-generated randomization list was obtained from the research service. An independent supervisor allocated eligible patients to groups A or B using this list. |
Low risk |
Low risk |
High risk |
Low risk. Quote: Physicians who examined patients and data analysts were blinded for the treatment received. |
Low risk
Reasons for lost to follow up clearly described and similar between groups |
High risk
Only mean differences, without SD or 95% CI are reported, unabling the option to include study in meta analysis |
Low risk |
|
Bergmann 2014 |
After providing informed consent, patients were initially randomized in three treatment groups |
Low risk
Probably done |
Unclear
Not reported |
High risk |
Unclear Not reported |
Unclear
Unclear to which group lost-to-follow-up participants belong and reasons for lost-to-follow-up not reported |
Unclear |
Low risk |
|
Cau 2019 |
The participants were randomized into 4 groups with assignments generated using a computer program and presented in a sealed, sequentially numbered envelope |
Low risk |
Low risk |
High risk |
Unclear Not reported |
Low
2 lost to follow up in control group |
Unclear |
Low risk |
|
Daubert 2011 |
Randomisatie gebeurde extern |
Low risk |
Unclear |
High risk
|
Low risk
Therapist performing measurements at T0 and T3 does not know of patients group allocation and previous measurements |
High risk
16 patients lost to follow up. Unclear to which group patients who dropped out were assigned and if their data was still analysed.
|
unclear
|
High
Only patients with high compliance were included to the study |
|
Gradalski 2015 |
Simple random allocation by random number generator |
Low risk |
Unclear |
High risk |
Low risk
The therapist who took subsequent measurements was blinded to the measurements obtained earlier.
|
Low risk
9 participants (15%) were lost to follow-up. Evenly distributed amongst both groups (CDT group:5, CB group: 4).
|
Unclear |
Low |
|
Ha 2017 |
Not mentioned |
Unclear |
Unclear |
High risk |
High risk |
Low risk |
High risk
Only mean difference in percentages are mentioned; no original data, no SD |
Low |
|
McNeely 2004 |
Subjects were randomized to one of the two treatment groups by use of a computer-generated code. The allocation sequence was concealed from research personnel involved in screening, scheduling and enrolling participants. |
Low risk |
Low risk |
High risk |
Low risk
Quote: Two independent assessors, blinded to the subjects’ treatment assignment, administered the outcome measurements. |
Low risk
Acceptable loss to follow up; reasons for loss to follow up clearly described |
Unclear |
Low |
|
Odebiyi 2014 |
Excel 2007 (Microsoft) was used to generate a list of randomized number sequence, which was used to assign eligible participants randomly into two groups (study and control groups) as they became available |
Low risk |
Unclear |
High risk |
Unclear
Not reported |
High risk
13/40 lost to follow up |
Unclear |
Low |
|
Tambour 2018 |
The included patients were randomised (1:1) using random block sizes of 2, 4, and 6 into group A or B. |
Low risk |
Unclear |
High risk |
Low risk
Test personnel were blinded to the patients’ group allocation. |
Low risk |
Unclear |
Low |
Systematic reviews:
Beoordeling risk of bias door middel van AMSTAR.
|
Study reference
(first author, publication year) |
Appropriate and clearly focused question? 1
Yes/no |
Comprehensive and systematic literature search?2
Yes/partial yes/ no |
Description of included and excluded studies?3
Yes/partial yes/ no |
Description of relevant characteristics of included studies?4
Yes/partial yes/no |
Assessment of scientific quality of included studies?5
Yes/partial yes/no |
Enough similarities between studies to make combining them reasonable?6
Yes/partial yes/ no |
Potential risk of publication bias taken into account?7
Yes/partial yes/ no |
Potential conflicts of interest reported?8
Yes/partial yes/ no |
|
Ezzo 2015 |
Yes |
Yes
|
Yes |
Yes |
Yes
|
Yes |
Yes |
Yes |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 30-01-2024
Beoordeeld op geldigheid : 28-12-2023
Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update).
De Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) is regiehouder van deze richtlijn lymfoedeem en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
Aanleiding
Op initiatief van de Nederlandse Vereniging voor Dermatologie en Venereologie is de richtlijn lymfoedeem in 2020-2023 herzien. Ten opzichte van de richtlijn van 2014 zijn er nieuwe inzichten rondom chronisch oedeem, alsmede vragen rond de effectiviteit van nieuwe en bestaande behandeltechnieken zoals lymfchirurgie en MLD. De benadering van diagnostiek en behandeling is meer in een holistische benadering geplaatst met accent op functioneren van de patiënt in al zijn aspecten (participatie/activiteiten niveau/persoonlijke en omgevingsfactoren).
De benadering van de patiënt hierbij berust meer op een co-activiteit met aandacht voor shared decision making, “ samenmanagement” en coaching.
Afbakening onderwerp
In deze richtlijn worden adviezen gegeven ten aanzien van de diagnostiek en behandeling van lymfoedeem en begeleiding bij lymfoedeem en dient als leidraad voor de dermatoloog en andere zorgprofessionals die in aanraking komen met patiënten met lymfoedeem.
Definities
Oedeemtherapeut
Wanneer in de richtlijn de term ‘oedeemtherapeut’ wordt gebruikt, bedoelt de werkgroep alle
zorgverleners die bevoegd zijn oedeemtherapie te praktiseren. In Nederland zijn hiertoe twee
beroepsgroepen bevoegd: de huid- en oedeemtherapeut en de oedeemfysiotherapeut.
Compressietherapie
Compressietherapie betekent letterlijk drukbehandeling. In deze richtlijn wordt hiermee bedoeld het aanbrengen van drukmiddelen die de veneuze en lymfatische afvloed bevorderen. In de praktijk wordt vaak gesproken van ambulante compressie, omdat het samengaan van de comprimerende werking van het aangelegde verband en de pompwerking van de spieren het beoogde resultaat tot stand brengt. Men onderscheidt verschillende compressiemiddelen, waaronder diverse types zwachtels (niet-elastische compressie), therapeutisch elastische kousen (TEK), intermitterende pneumatische compressie (IPC) pompen en adjustable compression devices (ACD).
Aanmeter
De aanmeter is in deze richtlijn de zorgprofessional die TEK en/of andere compressiehulpmiddelen aanmeet en levert. In Nederland mogen compressiehulpmiddelen alleen aangemeten worden na het behalen van een erkend diploma. Dit is een discipline met aantekening voor compressietherapeut, dit kan bijvoorbeeld een oedeemtherapeut zijn. Het verdient sterk de voorkeur dat de aanmeter direct bij het behandelproces betrokken is om een adequaat compressiehulpmiddel te kunnen verstrekken. Vaak zal de betrokken oedeemtherapeut (huidtherapeut of oedeemfysiotherapeut) uit service oogpunt ook de gewenste compressiehulpmiddelen aanmeten en leveren. In dit geval heeft die persoon ook de functie van aanmeter en wordt die ook zo genoemd.
Overige inleidende teksten
Lymfoedeem is een vorm van de verzamelnaam ‘chronisch oedeem’: oedeem dat langer dan 3 maanden bestaat. Vroeger werd lymfoedeem vaak als diagnose gezien maar dat is niet juist. Het betreft een symptoom van zwelling door lymfstasis met (non) pitting oedeem en/of weefselverandering. Lange tijd werden in epidemiologische studies vooral gelet op chronische zwelling na bijvoorbeeld kanker waarbij de eventueel bijkomende oorzaken van chronisch oedeem niet vermeld worden. Echter, de groep is heterogeen waarbij vele factoren een rol spelen die deels gerelateerd zijn aan de initiële factoren die het lymfesysteem hebben beschadigd (bijvoorbeeld een operatie en bestraling) maar vaak spelen persoons- en omgevingsfactoren een erg belangrijke rol (bijvoorbeeld overgewicht en gebrek aan mobiliteit/spierkracht/conditie).
Deze benadering maakt een goede medische diagnose van het chronische oedeem en een gezondheidsprofiel van de patiënt essentieel voordat een behandelplan wordt gesteld. Een multidisciplinaire samenwerking is hiervoor zeer belangrijk.
De prevalentie van chronisch oedeem wisselt sterk binnen de volgende groepen:
- Veneus oedeem;
- Primair en secundair lymfoedeem;
- Dependency oedeem;
- Chronisch oedeem door vergevorderde kanker;
- Chronische zwelling door obesitas;
- Chronische zwelling bij vasculaire malformaties.
Dit maakt dat als er naar studies rond prevalentie wordt gekeken, het bredere perspectief van chronisch oedeem/lymfoedeem en de complexe oorzaken daarvan dient mee te worden genomen (Moffatt 2019).
Doel en doelgroep
Doel
Deze richtlijn is een document met aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het vaststellen van goed medisch handelen. De richtlijn geeft aanbevelingen over begeleiding en behandeling van patiënten met lymfoedeem.
Doelgroep
De richtlijn is bestemd voor leden van de medische en paramedische beroepsgroep. Daartoe behoren onder andere: NVDV, NVPC, NVOG, NVNG, NVRO, NVvH, NVH, V&VN, NIP, NVFL, KNGF, NVD en andere betrokkenen i.e. dermatologen, huisartsen, verpleegkundig specialisten, physician assistants, fysiotherapeuten, huidtherapeuten en (dermatologie) verpleegkundigen. Voor patiënten is informatie op thuisarts.nl en een patiënten folder ontwikkeld.
Samenstelling werkgroep
|
Werkgroepleden – versie 2023 |
Vereniging |
||
|
Dr. R.J. Damstra (voorzitter) |
NVDV |
||
|
Dr. C. van Montfrans |
NVDV |
||
|
Dr. C.J.M. van der Vleuten |
NVDV |
||
|
Dr. S.S. Qiu Shao |
NVPC |
||
|
Dr. M.E.E. Bröker |
NVVH |
||
|
Drs. E.B.L. van Dorst |
NVOG |
||
|
Drs. N. Groen |
NVNG |
||
|
Dr. B. Kreike |
NVRO |
|
|
|
Mevr. C. Alberts-Hoeben |
NVH |
|
|
|
Mevr. S. van Beusekom |
NVH |
|
|
|
Mevr. W. den Hollander |
V&VN |
|
|
|
Mevr. J.E.W.M. van Dongen-Melman |
NIP |
|
|
|
Mevr. F. Potijk |
NVFL en KNGF |
|
|
|
Mevr. B. Pinkert |
NVD |
|
|
|
Mevr. C. Hovenier |
Stichting Olijf |
|
|
|
Mevr. A Diepstraten |
Stichting Olijf |
|
|
|
Drs. J.M.G. Fijn |
Borstkankervereniging Nederland (BVN) |
|
|
|
Drs. M. Velting |
Borstkankervereniging Nederland (BVN) |
|
|
|
Drs. W.F. Hoelen |
NLNet |
|
|
|
Drs. P.A.M. van den Broek |
Huid Nederland |
|
|
|
Dr. J.J.E. van Everdingen |
NVDV |
|
|
|
Dr. A. van Enst |
NVDV |
|
|
|
Drs. E. de Booij Start t/m juni 2021 |
Arts-onderzoeker NVDV |
|
|
|
Drs. E. van der Veen Sep 2021 t/m apr 2022 |
Arts-onderzoeker NVDV |
|
|
|
Drs. S.L. Wanders Jul 2021 t/m dec 2022 |
Arts-onderzoeker NVDV |
|
|
|
Drs. A.C. de Waal Apr 2022 t/m dec 2022 |
Arts-onderzoeker NVDV |
|
|
|
Drs. C. Smit Dec 2022 t/m heden |
Arts-onderzoeker NVDV |
|
|
* Zie toelichting in ‘Tabel: Overzicht betrokken partijen (modulaire herziening) 2023’
|
Werkgroepleden - versie 2014 |
Vereniging |
|
|
Dr. R.J. Damstra (voorzitter) |
NVDV |
|
|
Drs. A.B. Halk (secreatris) |
NVDV |
|
|
Dr. J.P. van den Berg |
VRA |
|
|
Mevr. Y. Born |
NVH |
|
|
Mevr. E.S.F.A. Butter |
V&VN oncologie |
|
|
Drs. E.B.L. van Dorst |
NVOG |
|
|
Dr. J.J.E. van Everdingen |
NVDV |
|
|
mevr. C. Feenstra |
NVH |
|
|
Drs. P. Gielink |
NVFL |
|
|
Drs. M.J. de Haas |
NVNG |
|
|
Dhr. A. Hendrickx |
Kon. Nederlandse Gen. voor Fysiotherapie |
|
|
Drs. J.T. Hidding |
NVFL |
|
|
Drs. J.B. Storm van Leeuwen |
NVPC |
|
|
Mevr. S. Nijland |
V&VN dermatologie |
|
|
Mevr. E. Oskam |
Borstkankervereniging Nederland (BVN) |
|
|
Mevr. I. Paulusma |
V&VN oncologie |
|
|
Dr. N. Russell |
NVRO |
|
|
Mevr. K. Rutgers- van Wijlen |
BPSW |
|
|
Mevr. I. Sissingh |
VATEK / NVOS-Orthobanda |
|
|
Dr. L.J.A. Strobbe |
NVVH |
|
|
Drs. C.J.A. Verhoeff-Braat |
Nederlands netwerk voor lymfoedeem en lipoedeem |
|
|
Dhr. R. Verwaard |
NVOS |
|
|
Dr. C.J.M. van der Vleuten |
NVDV |
|
|
Drs. H.G.J.M. Voesten |
NVVV |
|
|
Drs. A. Hartog |
Arts-onderzoeker NVDV |
|
|
Drs. M.C. Urgert |
Arts-onderzoeker NVDV |
|
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van de Nederlandse Vereniging voor Dermatologie en Venereologie.
|
Werk-groeplid |
Hoofdfunctie(s) |
Nevenfunctie(s) |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
|
Dhr. R.J. Damstra (voorzitter) |
|
Medisch manager zorgverantwoordelijke eenheid in ziekenhuis Nij Smellinghe (1e dag/week). |
n.v.t. |
n.v.t. |
n.v.t. |
De lymfologie is een klein vakgebied en primair lymfoedeem is internationaal als "Rare disease" erkend(Orphanet). Vanuit de samenwerking op Europees niveau zijn meerdere leden lid van landelijke organisaties op het gebied van lymfoedeem. Ik beschouw dat vooral als bundelen van expertise en kennis wat uiteindelijk de zorg voor de patiënt verbeterd. |
n.v.t. |
02-06-2020 |
|
Mw. C. van Montfrans |
|
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
25-07-2020 |
|
Mw. C. van der Vleuten |
Dermatoloog RadboudUMC (0.8 fte) |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
22-06-2020 |
|
Mw. S.S. Qiu Shao |
|
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
03-06-2020 |
|
Mw. M.E.E. Bröker |
Oncologisch chirurg Franciscus Gasthuis en Vlietland, Rotterdam |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
01-12-2022 |
|
Mw. E.B.L van Dorst |
Staflid gynaecologische oncologie UMC Utrecht |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
18-06-2020 |
|
Dhr. N. Groen |
Nucleair geneeskundige, Amphia ziekenhuis |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
19-06-2020 |
|
Dhr. B. Kreike |
Radiotherapeut, radiotherapie-groep, locatie Arnhem/Ede |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
04-06-2020 |
|
Mw. C. Alberts-Hoeben |
Huid- en oedeemtherapeut Huidtherapie Limburg |
Lid Expertgroep Oedeem NVH (vrijwilligers- en onkostenvergoeding) |
Dienstverband van een bedrijf met doelgroep oedeem-patiënten (Huidtherapie Limburg) |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
15-06-2020 |
|
Mw. S. Beusekom |
Huid- en oedeemtherapeut Heerlen |
NPI zelfmanagement cursus, advies functie bij de NVH, novomundo: examinator opleiding TEK |
Ik werk in een oedeempraktijk; maar conformeer mij aan de richtlijn. Ik verwacht geen toename van financiële stromen door de uitkomst van de richtlijn |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
12-11-2022 |
|
Mw. W. den Hollander |
Verpleegkundig specialist Jeroen Bosch Ziekenhuis, expertisegebied: Mamma-oncologie |
Consulent transmuraal Palliatief Advies Team |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
11-09-2023 |
|
Mw. F. Potijk |
|
Wetenschap Oncologie en Oedeem (WOO) commissie NVFL (vrijwillig met gedeeltelijke vergoeding) |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
18-06-2020 |
|
Mw. B. Pinkert |
Diëtist, Additief voiding diet & leefstijl (zelfstandige praktijk) |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
Ik vertegenwoordig de Nederlandse Vereniging van Diëtisten (NVD) in deze werkgroep. |
n.v.t. |
23-06-2020 |
|
Mw. C. Hovenier |
Volledig arbeidsongeschikt, formeel tot 15-08-2020 in dienst bij EMMA Communicatie te Den Haag als senior redacteur |
Stichting Olijf (vrijwilliger, onbezoldigd). |
n.v.t. |
n.v.t. |
n.v.t. |
Ik ben vrijwilliger bij stichting Olijf. Wij hebben er baat bij dat er een goede richtlijn komt, waarin ook de ervaringen uit de praktijk aan de orde komen, zover dat kan gegeven de stand der wetenschap en praktijk. Daarvoor zijn we gevraagd. Los daarvan hebben Olijf, BVN en onze koepelorganisatie NFK, noch haar vertegenwoordigers, enig gewin bij deze deelname. |
n.v.t. |
23-06-2020 |
|
Mw. A. Diepstraten |
Zelfstandig ondernemer en eigenaar Praktijk ‘de Vormende Hand: consulent hulpverlener & beeldend therapeut. |
n.v.t. |
n.v.t. |
Ik ben betrokken naaste van een persoon met lymfoedeem n.a.v. kankerbehandeling. We hebben ons echter allebei te houden aan het zorgvuldig behandelen van ontvangen informatie via Stichting Olijf, omdat we beiden bij Stichting Olijf zijn aangesloten. |
n.v.t. |
Ik ben vanuit mijn eigen bedrijf ingehuurd als coördinator Kwaliteit van Zorg bij stichting Olijf. Wij hebben er baat bij dat er een goede richtlijn komt, waarin ook de ervaringen uit de praktijk aan de orde komen, zover dat kan gegeven de stand der wetenschap en praktijk. Los daarvan hebben Olijf, BVN en onze koepelorganisatie de NFK, noch haar vertegenwoordigers, enig gewin bij deze deelname. |
n.v.t. |
22-06-2020 |
|
Mw. J.M.G. Fijn |
Gepensioneerd |
Ervaringsdeskundige bij de Expertgroep late Gevolgen bij Borstkankervereniging Nederland (vrijwilligerswerk) |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
16-09-2020 |
|
Mw. M. Velting |
Belangenbehartiger borstkankervereniging Nederland (24 uur). |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
16-11-2022 |
|
Dhr. W.F. Hoelen |
|
(Inter)nationaal docent oedeem en oncologie fysiotherapie, voorzitter oncologisch netwerk (KM) Onco in balans, Vicepresident Casley Smith international adviseur Medi, bestuurslid NLNet. |
Adviseur Medi (compressie hulpmiddelen) en opleidings-directeur Berekuyl Academy |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
12-11-2022 |
|
Dhr. P.A.M. van den Broek |
|
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
21-09-2020 |
|
Mw. E. de Booij |
Arts-onderzoeker NVDV |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
02-06-2020 |
|
Mw. E. van Veen |
Arts-onderzoeker NVDV |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
01-09-2021 |
|
Mw. S.L. Wanders |
Arts-onderzoeker NVDV |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
01-07-2021 |
|
Mw. A.C. de Waal |
Arts-onderzoeker NVDV |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
01-04-2022 |
|
Mw. C. Smit |
Arts-onderzoeker NVDV |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
06-12-2022 |
Inbreng patiëntenperspectief
Er is aandacht besteed aan het patiëntenperspectief door de zitting neming van verschillende patiënten van meerdere patiëntenverenigingen (stichting Olijf, BVN, NLNet, Huid Nederland) in de werkgroep en de opname van informatie over patiëntenvoorlichting. De conceptrichtlijn is tevens voor commentaar voorgelegd aan betreffende patiëntenverenigingen.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (gebaseerd op het stroomschema ontwikkeld door FMS).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst Raming |
Toelichting |
|
Achtergrond (pathofysiologie) (2023) |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Risicofactoren (2023) |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Indocyanine groen lymfografie (2023) |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Conservatieve behandeling (2023) |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Zwachtelen en bandageren (2014) |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Intermitterende Pneumatische Compressie (2023) |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Therapeutische Elastische Kousen (2023) |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Manuele lymfedrainage (2023) |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Oefentherapie (2023) |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Reductiechirurgie (2023) |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Reconstructieve (micro)chirurgie (2023) |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Therapeutische Elastische Kousen (2023) |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Leefstijlinterventies: preventie, ondersteunende zorg en voorlichting (2023) |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
|
Organisatie van zorg (2023) |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn(module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De richtlijn wordt via het internet verspreid onder alle relevante beroepsgroepen en ziekenhuizen en er zal in verschillende specifieke vaktijdschriften aandacht worden besteed aan de richtlijn. Tevens zal een samenvatting worden gemaakt. De voorlichtingsfolder van de NVDV zal worden afgestemd op de richtlijn. Het volledige implementatieplan is opgenomen in het bijlagedocument.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Onderstaand is de methode stapsgewijs beschreven.
Knelpuntenanalyse
In de voorbereidingsfase heeft een bijeenkomst plaatsgevonden waarvoor alle belanghebbenden zijn uitgenodigd. In deze bijeenkomst zijn knelpunten aangedragen door de werkgroepleden; NVDV, NVPC, NVVH, NVOG, NVNG, NVRO, NVH, V&VN, NVFL, NVD, NIP, Stichting Olijf, BVN, NLNet, Huid Nederland. Tevens werden uitgenodigd Zorgverzekeraars Nederland (ZN), Nederlandse Vereniging Ziekenhuizen (NVZ), Zorginstituut Nederland (ZiNL) en de Nederlandse Federatie van Universitair Medische Centra (NFU).
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse heeft de werkgroep uitgangsvragen opgesteld. Daarbij inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen en consultatie van experts. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. Literatuur is geselecteerd op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in bijlage 4.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen zijn overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs (2021)
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE
|
Definitie
|
|
Hoog
|
|
|
Redelijk
|
|
|
Laag
|
|
|
Zeer laag
|
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
C) Voor vragen over de waarde van meet- of classificatie-instrumenten (klinimetrie)
Deze instrumenten werden beoordeeld op validiteit, intra- (test-hertest) en inter-beoordelaarsbetrouwbaarheid, responsiviteit (alleen bij meetinstrumenten) en bruikbaarheid in de praktijk. (naar keuze: optie-1 ‘Bij ontbreken van een gouden standaard, werd een beoordeling van de bewijskracht van literatuurconclusies achterwege gelaten.’ Of optie-2 ‘De kracht van het wetenschappelijk bewijs werd bepaald met de generieke GRADE-methode’).
Beoordelen van het niveau van het wetenschappelijke bewijs (oude modules)
Bij de EBRO-methode (Evidence Based RichtlijnOntwikkeling) wordt een andere classificatie voor de beoordeling van de kwaliteit van studies aangehouden (van Everdingen 2004). Hierbij ligt de belangrijkheid van de uitkomstmaten niet van tevoren vast en is er geen vastgelegde procedure voor upgraden en downgraden van bewijs, zoals die bij GRADE geldt.
|
Kwaliteit |
Interventie |
Diagnostisch accuratesse-onderzoek |
Schade/bijwerkingen*, etiologie, prognose |
|
A1 |
Systematische review van ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau |
||
|
A2 |
Gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang |
Onderzoek ten opzichte van een referentietest (een ‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van de resultaten van test en gouden standaard, betreffende een voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad |
Prospectief cohortonderzoek van voldoende omvang en follow-up, waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten. |
|
B |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiënt-controleonderzoek, cohortonderzoek) |
|
|
|
C |
Niet-vergelijkend onderzoek |
||
|
D |
Mening van deskundigen |
||
* Deze classificatie is alleen van toepassing in situaties waarin om ethische of andere redenen gecontroleerde trials niet mogelijk zijn. Zijn die wel mogelijk dan geldt de classificatie voor interventies.
Bij het werken volgens de EBRO-methode zijn op basis van de beschikbare literatuur een of meerdere conclusies geformuleerd. Afhankelijk van het aantal onderzoeken en de mate van bewijs is een niveau van bewijskracht toegekend aan de conclusie (van Everdingen 2004).
|
Niveau |
Conclusie gebaseerd op |
|
1 |
Onderzoek van niveau A1 of ten minste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2 |
|
2 |
1 onderzoek van niveau A2 of ten minste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
3 |
1 onderzoek van niveau B of C |
|
4 |
Mening van deskundigen |
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in één of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overkoepelende bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overkoepelende conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk. Door gebruik te maken van de Guideline Development Tool werd het Evidence to decision framework conform GRADE methodiek toegepast. Alle werkgroepleden hebben systematisch antwoord gegeven op vragen over de grootte van het effect en grootte van negatieve consequenties, waarden en voorkeuren van de patiënt, kosten en kosteneffectiviteit, beschikbaarheid van voorzieningen, aanvaardbaarheid, en overwegingen voor subgroepen in de patiëntenpopulatie. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Indicatorontwikkeling
Er werden geen indicatoren ontwikkeld voor deze richtlijn.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling beschreven (zie bijlage 11).
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften maar wetenschappelijk onderbouwde en breed gedragen inzichten en aanbevelingen waaraan zorgverleners zouden moeten voldoen om kwalitatief goede zorg te verlenen. Aangezien richtlijnen uitgaan van ‘gemiddelde patiënten’, kunnen zorgverleners in individuele gevallen zo nodig afwijken van de aanbevelingen in de richtlijn. Afwijken van richtlijnen is, als de situatie van de patiënt dat vereist, soms zelfs noodzakelijk. Een richtlijn beschrijft wat goede zorg is, ongeacht de financieringsbron (Zorgverzekeringswet (Zvw), Wet langdurige zorg (Wlz), Wet maatschappelijke ondersteuning (Wmo), aanvullende verzekering of eigen betaling door de cliënt/patiënt). Opname van een richtlijn in een register betekent dus niet noodzakelijkerwijs dat de in de richtlijn beschreven zorg verzekerde zorg is. Informatie over kosten zoals beschreven in de richtlijn is gebaseerd op beschikbare gegevens ten tijde van schrijven.
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de betrokken (wetenschappelijke) verenigingen, (patiënt) organisaties en stakeholders voorgelegd ter becommentariëring. De commentaren zijn verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren is de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn is aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter autorisatie.
Literatuur
- Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
- Higgins JPT, Green S (editors). Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [updated March 2011]. The Cochrane Collaboration, 2011. Available from www.handbook.cochrane.org.
- Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit.. Online beschikbaar op http://richtlijnendatabase.nl/
- Van Everdingen JJE, Burgers JS, Assendelft WJJ, et al. Evidence-based richtlijnontwikkeling. Bohn Stafleu Van Loghum 2004.
- Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html
Zoekverantwoording
zoekstrategieën
Voor alle hoofdstukken geldt dat de zoekstrategieën zijn uitgevoerd in de EMBASE database, Medline database en de Cochrane library. Enkel de keywords gebruikt in de Medline database zijn weergeven. De search is geüpdatet tot 12-10-2020.
De zoekactie is met behulp van de PICO-systematiek opgebouwd. De zoekvragen hebben de P als gemeenschappelijke onderdeel. De overige onderdelen van de PIC(R)O werden geformuleerd op basis van de uitgangsvraag en hieronder weergeven. De volgende afbakening is gebruikt:
Voor de P:
- Patiënten met lymfoedeem of chronisch oedeem
Voor de I:
- Indocyanine groen;
- Het toepassen van IPC;
- Het dragen van een TEK;
- Manuele lymfdrainage;
- Oefentherapie;
- Reductiechirurgie: liposuctie, debulking, excisie;
- Microchirurgie: LVA en VLNT.
Voor de C:
- Geen diagnosticum, placebo diagnosticum, andere diagnostische middelen voor lymfoedeem;
- Geen behandeling, placebo behandeling, andere behandelingen voor lymfoedeem.
Voor de R:
- Lymfscintigrafie.
Voor de O:
- Diagnostische accuratesse (AUC, positief voorspellende waarde, negatief voorspellende
waarde, sensitiviteit en specificiteit), bijwerkingen, kosteneffectiviteit, effectiviteit, patiënttevredenheid.
- Ernst van lymfoedeem volgens behandelaars aan het eind van de studie: objectieve gevalideerde parameters
- Volumetrische veranderingen;
- Duur remissie/duur tot volgende behandeling (bij compressiebehandeling);
- Bewegingsbeperking (met name bij de armen) (goniometrie);
- Kracht (1 Repetitie Maximaal);
- Algehele Conditie (Astrand test, CPET, 6 Minuten Wandel Test);
- Bioimpedance of Tissue Dialectric Constant;
- BMI/buikomvang/taille/heup ratio;
- Huid verschuifbaarheid, oppakbaarheid en turgor (littekens);
- Wonden.
- Ernst van lymfoedeem volgens patiënten aan het eind van de studie.
- Pijn (Margolis pijn diagram, pijn algometrie, Central Sensitisation Inventory, Pain Detect, Numeric Rating Scales / Visual Analoge Scale);
- Vermoeidheid (Multi Dimensionelel Vermoeidheid Vragenlijst);
- DASH voor schouderproblematiek;
- Kwaliteit van leven aan het eind van de studie, gevalideerde QoL lijsten;
- Quality of life measure for limb lymphoedema (LYMQOL);
- Quality of life: Rand/SF36, (CES-D), Distress thermometer/lastmeter, 4DKL);
- the Upper Limb Lymphedema 27 (ULL-27);
- Freiburg Life Quality Assessment-Lymphedema (FLQA-L);
- Lymph-ICF armen en benen (LYMPH-ICF-LL / ARM);
- EQ-5D-5L.
- Patiënttevredenheid t.a.v. behandeling.
- Proportie patiënten met bijwerking;
- Kosteneffectiviteit;
- Onafhankelijkheid/zelfmanagement.
Inclusie- en exclusiecriteria
|
Inclusiecriteria |
Exclusiecriteria |
|
|
Uitgangsvragen:
- Hoe wordt Intermitterende Pneumatische Compressie (IPC) toegepast bij patiënten met lymfoedeem?
- Hoe worden Therapeutisch Elastische Kousen (TEK) toegepast bij patiënten met lymfoedeem?
- Wat is de indicatie van MLD bij patiënten met lymfoedeem?
- Wat is de indicatie voor oefentherapie bij de behandeling van lymfoedeem?
- Wat is de indicatie voor reductiechirurgie bij de behandeling van lymfoedeem?
- Wat is de indicatie voor reconstructieve (micro)chirurgie bij de behandeling van lymfoedeem?
- Hoe kan reconstructieve (micro)chirurgie worden toegepast?
Resultaten
|
Uitgangsvraag |
MEDLINE |
EMBASE |
COCHRANE |
Totaal (na ontdubbelen) |
|
Risicofactoren |
247 |
490 |
119 |
712 |
|
Compressie (IPC+TEK) |
114 |
216 |
92 |
325 |
|
MLD |
49 |
149 |
122 |
232 |
|
Chirurgie |
698 |
669 |
320 |
1.393 |
|
Oefentherapie |
236 |
381 |
278 |
661 |
Module risicofactoren
Database: Cochrane
Zoekdatum: 19/10/2020
|
ID |
Search |
Hits |
|
#1 |
lymphedema |
1.404 |
|
#2 |
risk factors |
76.745 |
|
#3 |
#1 AND #2 with Cochrane Library publication date Between Jan 2010 and Dec 2020 |
119 |
Database: Medline
Zoekdatum: 15/10/2020
|
ID |
Search |
Hits |
|
#1 |
exp Lymphedema/ |
12.285 |
|
#2 |
(meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) |
509.798 |
|
#3 |
(exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) |
2.121.951 |
|
#4 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ |
3.689.685 |
|
#5 |
2 or 3 or 4 |
5.444.019 |
|
#6 |
exp Epidemiologic Factors/ |
1.564.209 |
|
#7 |
1 and 5 and 6 |
384 |
|
#8 |
limit 7 to (yr="2010 -Current" and (dutch or english or german)) |
247 |
Database: Embase
Zoekdatum: 15/10/2020
|
ID |
Search |
Hits |
|
#8 |
#7 AND (2010:py OR 2011:py OR 2012:py OR 2013:py OR 2014:py OR 2015:py OR 2016:py OR 2017:py OR 2018:py OR 2019:py OR 2020:py) |
490 |
|
#7 |
#1 AND #5 AND #6 |
599 |
|
#6 |
'risk factor'/exp OR 'relative risk' OR 'risk factor' OR 'risk factors' |
1.429.102 |
|
#5 |
#2 OR #3 OR #4 |
4.853.545 |
|
#4 |
'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
2.704.596 |
|
#3 |
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it |
2.461.581
|
|
#2 |
('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
523.197
|
|
#1 |
'lymphedema'/exp OR 'lymph edema' OR 'lymph oedema' OR 'lymphatic edema' OR 'lymphedema' OR 'lymphoedema' OR 'lymphooedema' OR 'lymphostatic edema' OR 'lymphostatic oedema' OR 'posttraumatic lymphedema' OR lymphedema |
24.844 |
Module MLD
Database: Cochrane
Zoekdatum: 19/10/2020
|
ID |
Search |
Hits |
|
#1 |
lymphedema |
1.404 |
|
#2 |
manual lymphatic drainage |
227 |
|
#3 |
#1 AND #2 with Cochrane Library publication date Between Jan 2010 and Dec 2020 |
122 |
Database: Medline
Zoekdatum: 15/10/2020
|
ID |
Search |
Hits |
|
#1 |
exp Lymphedema/ |
12.285 |
|
#2 |
(meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) |
509.798 |
|
#3 |
(exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) |
2.121.951 |
|
#4 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ |
3.689.685 |
|
#5 |
2 or 3 or 4 |
5.444.019 |
|
#6 |
exp Massage/ |
6.179 |
|
#7 |
1 and 5 and 6 |
76 |
|
#8 |
limit 7 to (yr="2010 -Current" and (dutch or english or german)) |
49 |
Database: Embase
Zoekdatum: 15/10/2020
|
ID |
Search |
Hits |
|
#8 |
#7 AND (2010:py OR 2011:py OR 2012:py OR 2013:py OR 2014:py OR 2015:py OR 2016:py OR 2017:py OR 2018:py OR 2019:py OR 2020:py) |
149 |
|
#7 |
#1 AND #5 AND #6 |
195 |
|
#6 |
'manual lymphatic drainage'/exp OR 'lymph drainage massage':ti,ab OR 'lymph massage':ti,ab OR 'lymphatic drainage massage':ti,ab OR 'lymphatic manual drainage':ti,ab OR 'lymphatic massage':ti,ab OR 'manual lymph drainage':ti,ab OR 'manual lymph drainage massage':ti,ab OR 'manual lymphatic drainage':ti,ab OR 'manual lymphatic drainage massage':ti,ab |
887 |
|
#5 |
#2 OR #3 OR #4 |
4.853.545 |
|
#4 |
‘clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
2.704.596 |
|
#3 |
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it |
2.461.581
|
|
#2 |
(meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
523.197
|
|
#1 |
'lymphedema'/exp OR 'lymph edema' OR 'lymph oedema' OR 'lymphatic edema' OR 'lymphedema' OR 'lymphoedema' OR 'lymphooedema' OR 'lymphostatic edema' OR 'lymphostatic oedema' OR 'posttraumatic lymphedema' OR lymphedema |
24.844 |
Module MLD – aanvulling
Database: Medline
Zoekdatum: 12/11/2020
|
ID |
Search |
Hits |
|
#1 |
exp Lymphedema/ |
12.325 |
|
#2 |
(meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) |
474539 |
|
#3 |
(exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) |
2046529 |
|
#4 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ |
3564607 |
|
#5 |
2 or 3 or 4 |
5234008 |
|
#6 |
Endermology.mp. |
8 |
|
#7 |
exp Cupping Therapy/ |
23 |
|
#8 |
exp Vacuum/ |
5746 |
|
|
exp Negative-Pressure Wound Therapy/ |
3020 |
|
|
6 or 7 or 8 or 9 |
8721 |
|
|
1 and 5 and 10 |
6 |
Database: Embase
Zoekdatum: 12/11/2020
|
ID |
Search |
Hits |
|
#10 |
#4 AND #8 AND #9 |
3 |
|
#9 |
'lymphedema'/exp OR 'lymph edema' OR 'lymph oedema' OR 'lymphatic edema' OR 'lymphedema' OR 'lymphoedema' OR 'lymphooedema' OR 'lymphostatic edema' OR 'lymphostatic oedema' OR 'posttraumatic lymphedema' OR 'posttraumatic lymphoedema' |
24.979 |
|
#8 |
#5 OR #6 OR #7 |
4.898.339 |
|
#7 |
'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) R 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
2.735.600 |
|
#6 |
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it |
2.477.952 |
|
#5 |
('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
530.208 |
|
#4 |
#1 OR #2 OR #3 |
835 |
|
#3 |
endermology:ab,ti |
12 |
|
#2 |
'vacuum assisted closure device'/exp |
749 |
|
#1 |
'negative pressure'/exp |
74 |
Module compressietherapie (TEK + IPC)
Database: Cochrane
Zoekdatum: 19/10/2020
|
ID |
Search |
Hits |
|
#1 |
lymphedema |
1.404 |
|
#2 |
intermittent pneumatic compression device |
183 |
|
#3 |
compression bandages |
805 |
|
#4 |
#2 OR #3 |
959 |
|
#5 |
#1 AND #4 with Cochrane Library publication date Between Jan 2010 and Dec 2020 |
92 |
Database: Medline
Zoekdatum: 15/10/2020
|
ID |
Search |
Hits |
|
#1 |
exp Lymphedema/ |
12.285 |
|
#2 |
(meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) |
509.798 |
|
#3 |
(exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) |
2.121.951 |
|
#4 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ |
3.689.685 |
|
#5 |
2 or 3 or 4 |
5.444.019 |
|
#6 |
exp Compression Bandages/ |
2.557 |
|
#7 |
exp Intermittent Pneumatic Compression Devices/ |
708 |
|
#8 |
6 or 7 |
3.093 |
|
#9 |
1 and 5 and 8 |
134 |
|
#10 |
limit 9 to (yr="2010 -Current" and (dutch or english or german)) |
114 |
Database: Embase
Zoekdatum: 15/10/2020
|
ID |
Search |
Hits |
|
#11 |
#10 AND (2010:py OR 2011:py OR 2012:py OR 2013:py OR 2014:py OR 2015:py OR 2016:py OR 2017:py OR 2018:py OR 2019:py OR 2020:py) |
216 |
|
#10 |
#1 AND #5 AND #9 |
242 |
|
#9 |
#6 OR #7 OR #8 |
6.381 |
|
#8 |
'pneumatic compression'/exp |
9 |
|
#7 |
'intermittent pneumatic compression device'/exp |
1.157 |
|
#6 |
'compression garment'/exp |
5.637 |
|
#5 |
#2 OR #3 OR #4 |
4.853.545 |
|
#4 |
‘clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
2.704.596 |
|
#3 |
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it |
2.461.581
|
|
#2 |
(meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animale model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
523.197
|
|
#1 |
'lymphedema'/exp OR 'lymph edema' OR 'lymph oedema' OR 'lymphatic edema' OR 'lymphedema' OR 'lymphoedema' OR 'lymphooedema' OR 'lymphostatic edema' OR 'lymphostatic oedema' OR 'posttraumatic lymphedema' OR lymphedema |
24.844 |
Module oefentherapie
Database: Cochrane
Zoekdatum: 19/10/2020
|
ID |
Search |
Hits |
|
#1 |
lymphedema |
1.404 |
|
#2 |
Exercise |
98.244 |
|
#3 |
diet |
62.418 |
|
#4 |
#2 OR #3 |
148.585 |
|
#5 |
#1 AND #4 with Cochrane Library publication date Between Jan 2010 and Dec 2020 |
278 |
Database: Medline
Zoekdatum: 15/10/2020
|
ID |
Search |
Hits |
|
#1 |
exp Lymphedema/ |
12.285 |
|
#2 |
exp Exercise/ |
198.451 |
|
#3 |
exp Diet/ |
282.961 |
|
#4 |
exp Physical Therapy Modalities/ |
154.643 |
|
#5 |
2 or 3 or 4 |
595.305 |
|
#6 |
(meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) |
509.798 |
|
#7 |
(exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) |
2.121.951 |
|
#8 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ |
3.689.685 |
|
#9 |
6 or 7 or 8 |
5.444.019 |
|
#10 |
1 and 5 and 9 |
369 |
|
#11 |
limit 10 to (yr="2010 -Current" and (dutch or english or german)) |
236 |
Database: Embase
Zoekdatum: 15/10/2020
|
ID |
Search |
Hits |
|
#10 |
#9 AND (2010:py OR 2011:py OR 2012:py OR 2013:py OR 2014:py OR 2015:py OR 2016:py OR 2017:py OR 2018:py OR 2019:py OR 2020:py) |
381 |
|
#9 |
#1 AND #5 AND #8 |
481 |
|
#8 |
#6 OR #7 |
1.641.345 |
|
#7 |
'diet'/exp OR 'diet' OR 'diet influence' OR 'diet regimen' OR 'diet surveys' OR 'dietary effect' OR 'dietary influence' OR 'dietary survey' OR 'dietary surveys' OR 'dieting' |
763.914 |
|
#6 |
'physical activity, capacity and performance'/exp OR 'physical activity, capacity and performance' |
953.786 |
|
#5 |
#2 OR #3 OR #4 |
4.853.545 |
|
#4 |
‘clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
2.704.596 |
|
#3 |
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it |
2.461.581
|
|
#2 |
(meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animale model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
523.197
|
|
#1 |
'lymphedema'/exp OR 'lymph edema' OR 'lymph oedema' OR 'lymphatic edema' OR 'lymphedema' OR 'lymphoedema' OR 'lymphooedema' OR 'lymphostatic edema' OR 'lymphostatic oedema' OR 'posttraumatic lymphedema' OR lymphedema |
24.844 |
Module chirurgie (reductiechirurgie + reconstructie (micro)chirurgie)
Database: Cochrane
Zoekdatum: 20/10/2020
|
ID |
Search |
Hits |
|
#1 |
(“lymphedema”):ti;ab |
1.178 |
|
#2 |
(“surgery”):ti;ab |
152.295 |
|
#3 |
#1 AND #2 with Cochrane Library publication date Between Jan 2010 and Jan 2020 |
320 |
Database: Medline
Zoekdatum: 15/10/2020
|
ID |
Search |
Hits |
|
#1 |
exp Lymphedema/ |
12.285 |
|
#2 |
(meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) |
470.374 |
|
#3 |
(exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) |
2.037.432 |
|
#4 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ |
3.545.667 |
|
#5 |
2 or 3 or 4 |
5.206.745 |
|
#6 |
exp Specialties, Surgical/ |
200.553 |
|
#7 |
exp Surgical Procedures, Operative/ |
3.169.428 |
|
#8 |
6 or 7 |
3.308.766 |
|
#9 |
1 and 5 and 8 |
1.156 |
|
#10 |
limit 9 to (yr="2010 -Current" and (dutch or english or german)) |
698 |
Database: Embase
Zoekdatum: 22/10/2020
|
ID |
Search |
Hits |
|
#11 |
#10 AND (2010:py OR 2011:py OR 2012:py OR 2013:py OR 2014:py OR 2015:py OR 2016:py OR 2017:py OR 2018:py OR 2019:py OR 2020:py) |
669 |
|
#10 |
#4 AND #8 AND #9 |
793 |
|
#9 |
'lymphedema'/exp OR 'lymph edema' OR 'lymph oedema' OR 'lymphatic edema' OR 'lymphedema' OR 'lymphoedema' OR 'lymphooedema' OR 'lymphostatic edema' OR 'lymphostatic oedema' OR 'posttraumatic lymphedema' OR 'posttraumatic lymphoedema' |
24.866 |
|
#8 |
#5 OR #6 OR #7 |
4.866.364 |
|
#7 |
'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
2.713.737 |
|
#6 |
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it |
2.465.919 |
|
#5 |
('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
525.211 |
|
#4 |
#1 OR #2 OR #3 |
955.438 |
|
#3 |
'vascular surgery'/exp OR 'angiosurgery' OR 'blood vessel surgery' OR 'great vessel surgery' OR 'peripheral vascular surgery' OR 'small vessel surgery' OR 'surgery, vascular' OR 'vascular reconstruction' OR 'vascular repair' OR 'vascular surgery' OR 'vascular surgical procedures' |
565.968 |
|
#2 |
'plastic surgery'/exp OR 'corrective surgery' OR 'plastic reconstruction' OR 'plastic reconstructive surgery' OR 'plastic surgery' OR 'preposthetic surgery' OR 'reparative surgery' OR 'surgery, plastic' |
346.781 |
|
#1 |
'reconstructive surgery'/exp OR 'operative reconstruction' OR 'reconstruction surgery' OR 'reconstructive surgery' OR 'reconstructive surgical procedures' OR 'surgery, reconstructive' OR 'surgical reconstruction' |
131.482 |
Module ICG
Database: Medline
Zoekdatum: 18/11/2020
|
ID |
Search |
Hits |
|
#1 |
exp Lymphedema/ |
12333 |
|
#2 |
(meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) |
475891 |
|
#3 |
(exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) |
2049276 |
|
#4 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ |
3570328 |
|
#5 |
2 or 3 or 4 |
5242258 |
|
#6 |
exp Indocyanine Green/ |
7844 |
|
#7 |
1 and 5 and 6 |
58 |
|
#8 |
limit 7 to yr="2010 -Current" |
57 |
Database: Embase
Zoekdatum: 15/10/2020
|
ID |
Search |
Hits |
|
#7 |
#1 AND #5 AND #6 |
138 |
|
#6 |
'indocyanine green'/exp OR 'cardio green':ti,ab OR 'cardio-green':ti,ab OR 'cardiogreen':ti,ab OR 'diagnogreen':ti,ab OR 'fox green':ti,ab OR 'ic green':ti,ab OR 'ic-green':ti,ab OR 'icg':ti,ab OR 'indocyanide green':ti,ab OR 'indocyanin green':ti,ab OR 'indocyanin green test':ti,ab OR 'indocyanine':ti,ab OR 'indocyanine green':ti,ab OR 'indocyanine green test':ti,ab OR 'indocyanine test':ti,ab OR 'spy agent green':ti,ab OR 'spy agent green kit':ti,ab OR 'tricarbocyanine ii':ti,ab OR 'ujoviridin':ti,ab OR 'vofaverdin':ti,ab OR 'wofaferdin':ti,ab OR 'wofaverdin':ti,ab |
21.383 |
|
#5 |
#2 OR #3 OR #4 |
4.904.728 |
|
#4 |
'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
2.740.044 |
|
#3 |
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it |
2.480.251 |
|
#2 |
('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
531.166 |
|
#1 |
'lymphedema'/exp OR 'lymph edema' OR 'lymph oedema' OR 'lymphatic edema' OR 'lymphedema' OR 'lymphoedema' OR 'lymphooedema' OR 'lymphostatic edema' OR 'lymphostatic oedema' OR 'posttraumatic lymphedema' OR 'posttraumatic lymphoedema' |
24.993 |