Kans op lymeziekte na een tekenbeet
Uitgangsvraag
Kans op lymeziekte na een tekenbeet.
Aanbeveling
Bij deze module zijn geen aanbevelingen geformuleerd.
Overwegingen
Bij deze module zijn geen overwegingen geformuleerd.
Onderbouwing
Conclusies / Summary of Findings
|
Niveau 2 |
De kans op erythema migrans na een tekenbeet in Europese studies varieert tussen 0,3 en 5,2%, en daarnaast de kans op asymptomatische seroconversie tussen 3,2 en 5,4%
B Nahimana 2004, Jacobs 2008, Fryland 2011, Huegli 2011 |
|
Niveau 3 |
De kans op lymeziekte na een tekenbeet in Nederland is klein. Bij een groep patiënten op Ameland bij wie de teek in de meerderheid (84%) binnen 24 uur werd verwijderd was deze kans kleiner dan 3%.
B Jacobs 2008 |
Samenvatting literatuur
In een overzichtsartikel beschrijft Zdenek Hubalek (2009) het voorkomen en andere epidemiologische factoren van lymeziekte in de diverse werelddelen. Lymeziekte komt voor in Europa tussen de 35 en 60º breedtegraad en in Noord Amerika tussen 30 en 55º breedtegraad, in Afrika alleen in het uiterste Noorden en in Azië in de Noordelijke gebieden (zie figuur 1). Lymeziekte komt weinig voor boven een hoogte van 1000 m. De geografische spreiding van Ixodes ricinus en lymeziekte komen met elkaar overeen. In Noord Amerika, Rusland en Azië wordt de ziekte van Lyme overgebracht door andere tekensoorten.
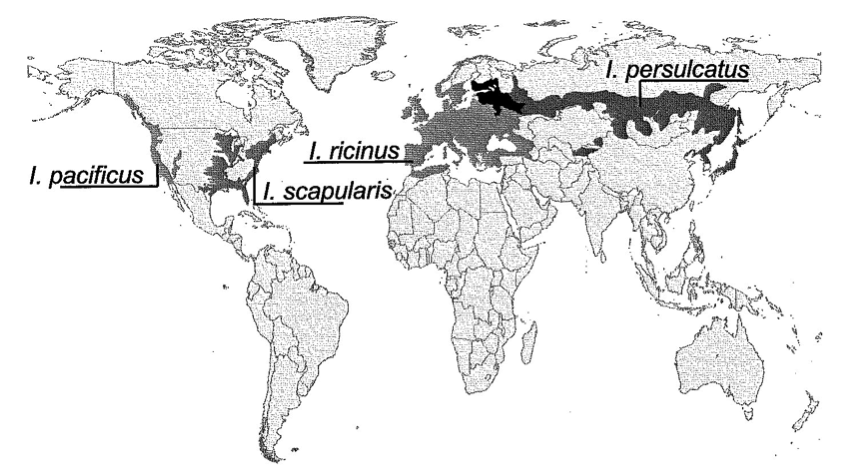
Figuur 1. Approximate geographic distributions of four medically important Ixodes ricinus complex ticks (bron: Swanson 2006)
In Europa wordt het jaarlijks aantal vastgestelde gevallen van lymeziekte geschat op 196.000. De incidentie van lymeziekte (per 100.000 inwoners) verschilt per land en per regio. De laatste tien jaren blijkt de incidentie van lymeziekte in een aantal landen in Europa, waaronder Nederland, sterk toe te nemen. De incidentie van lymeziekte heeft in de meeste landen een piek in mei en juni. Lymeziekte komt het meest voor op de leeftijd van 5-9 jaar en 50-64 jaar (bimodale verdeling) en het minst op de leeftijd van 20-24 jaar. Deze bimodale leeftijdsverdeling komt in veel Europese landen voor.
De incidentie van consulten voor een tekenbeet in Nederland verdrievoudigde van 191 per 100.000 in 1994 naar 564 patiënten met tekenbeet per 100.000 inwoners in 2009. De werkelijke incidentie van tekenbeten ligt waarschijnlijk vele malen hoger want slechts een klein gedeelte van de mensen raadpleegt na een tekenbeet de huisarts. Uit onderzoek in 1996 bleek dat er ongeveer 15 keer zoveel tekenbeten voorkomen in de algemene populatie als door huisartsen worden gezien (Den Boon 2004).
De incidentie van erythema migrans werd in 1994 geschat op 39 per 100.000 personen. In
2009 was deze incidentie ruim verdrievoudigd en opgelopen tot 134 per 100.000 personen (Hofhuis 2006, 2010). Hier kan sprake zijn van overschatting door ‘reporter bias’.
In een Zweeds onderzoek bij 341 personen die zich meldden met een tekenbeet, kreeg 1 persoon (0,3%) een erythema migrans en kregen 10 personen (2,9%) een asymptomatische seroconversie binnen 3 maanden. De frequentie van asymptomatische seroconversie na een beet met een PCR-positieve teek was 4 op 64 (6,3%) en 7/277 (2,5%) na een beet met een PCR-negatieve teek. De laatste bevinding zou verklaard kunnen worden door foutnegativiteit van de PCR of doordat de persoon door meerdere, niet geteste teken is gebeten (Fryland 2011).
In een Zwitsers onderzoek bij 269 personen met een tekenbeet ontstond bij 14 personen (5,2%) een erythema migrans en hadden eveneens 14 personen (5,2%) een asymptomatische seroconversie. Na een beet met een PCR-positieve teek had 5 van 61 personen (8,2%) een erythema migrans of asymptomatische seroconversie. Na een beet door een PCR-negatieve teek was dit percentage 5,6% (7 op 125 personen). De verklaring dat ook na een beet met een PCR-negatieve teek lymeziekte kan optreden, wordt gezocht in het ook gebeten zijn door een niet geteste teek of in een fout-negatief resultaat van de PCR (Huegli 2011).
In een ander Zwitsers onderzoek bij 376 personen met een tekenbeet kregen 3 personen (0,8%) een erythema migrans en 14 personen een asymptomatische seroconversie (3,7%) (Nahimana 2004).
In een studie bij patiënten van een huisartsenpraktijk op Ameland ontwikkelde één van de 167 patiënten (0,60%, 95% betrouwbaarheidsinterval: 0,03-2,92%) tijdens de follow-up na zes maanden griepachtige verschijnselen die op lymeziekte zouden kunnen wijzen (Jacobs 2008). De enige patiënt in dit onderzoek die lymeziekte ontwikkelde had de teek na 24 uur verwijderd. Niemand van de 123/146 (informatie bekend, 84%) patiënten bij wie de teek binnen 24 uur is verwijderd ontwikkelde lymeziekte. In de studie werden 216 teken onderzocht die grotendeels binnen 24 uur van de patiënten waren verwijderd. Er werd een besmettingspercentage met Borrelia gevonden van 20,4% (volwassen teken 21,1%, nimfen 24,6% en larven 3%) wat overeenkomt met de gemiddelde besmettingspercentages van teken in Nederland. De studie suggereert dat de kans op lymeziekte na een tekenbeet klein is. Het tijdig opmerken en verwijderen van de teek bij de patiënten in deze studie heeft de kans op overdracht van Borrelia waarschijnlijk verkleind. Het is goed mogelijk dat bij personen die een tekenbeet niet opmerken, de aanhechting langer duurt en de kans op lymeziekte groter is.
De dichtheid van teken en de besmettingsgraad met Borrelia in Nederland varieert sterk per levensstadium van de teek (larve/nimf/volwassen), per locatie, per seizoen en per jaar. Een grootschalige veldstudie naar tekendichtheid en -besmetting in Nederland in de jaren 2000 tot 2004 op vier locaties met verschillende soorten vegetatie gedurende de maanden april tot september rapporteerde een gemiddeld besmettingspercentage met Borrelia van 7,6% in 3075 teken (Wielinga 2006). In die vijf jaar varieerde de besmettingsgraad van teken tussen de 0,8% en 11,5% in de vier locaties. Zowel in de dichtheid van teken als de besmettingsgraad met Borrelia werd echter geen stijgende of dalende trend gezien over de jaren. Om trends in tijd te bestuderen, is de tekenverzameling tot op heden gecontinueerd op één locatie (Wielinga 2006). In een andere veldstudie onderzochten Takken et al. (2008) 773 nimfen op Borrelia-besmetting uit juli, september en november 2006 en 1193 teken uit januari, maart, mei, juli, september en november 2007, verzameld op tien locaties verspreid over Nederland. In de drie maanden in 2006 varieerde het besmettingspercentage tussen 21,5% en 29,0%. In de zes maanden in 2007 varieerde het besmettingspercentage tussen nul procent en 13,0% (Takken 2008). In een studie van Gassner et al. (2008) werden 1747 teken verzameld in een eikenbos en een dennenbos tussen maart en juli 2005. Het besmettingspercentage met Borrelia varieerde van nul procent in larven, tot 26% in nimfen en 33% in adulte teken (Gassner 2008). Ook door Wielinga et al. (2006) werden oplopende besmettingspercentages gevonden in de verschillende levensstadia van teken, hoewel gemiddeld lagere besmettingspercentages gevonden werden dan bij Gassner et al., wat vooral verklaard kan worden door de verschillen in locatie, tijd en seizoen Gassner 2008).
Referenties
- Angelakis E, Billeter SA, Breitschwerdt EB, Chomel BB, Raoult D. Potential for Tick-borne Bartonelloses. Emerging infectious Diseases. 2010; 16(3): 385-91.
- Alekseev, A. N, H. V. Dubinina, I. Van De Pol, and L. M. Schouls. Identification of Ehrlichia spp. and Borrelia burgdorferi s.l. in Ixodes ticks in the Baltic areas of Russia. J. Clin. Microbiol. 2001; 39: 2237Ð2242.
- Bakken JS, Dumler JS. Clinical diagnosis and treatment of human granulocytotropic anaplasmosis. Ann N Y Acad Sci. 2006; 1078: 236-47
- Boon den S, Schellekens JF, Schouls LM, Suijkerbuijk AW, Docters van Leeuwen B, van Pelt W. Verdubbeling van het aantal consulten voor tekenbeten en Lyme-borreliose in de huisartsenpraktijk in Nederland. Ned Tijdschr Geneeskd. 2004; 148(14): 665-70.
- Dobbenburgh van A, Dam van AP, Fikrig E. Human granulocytic ehrlichiosis in western Europe. N Engl J Med. 1999; 340(15): 1214-6.
- Fehr JS, Bloemberg GV, Ritter C, Hombach M, Lscher TF, Weber R, et al. Septicemia caused by tick-borne bacterial pathogen Candidatus Neoehrlichia mikurensis. Emerg Infect Dis [serial on the Internet]; 2010. Available from http://www.cdc.gov/EID/content/16/7/1127.htm.
- Fingerle V, Schulte-Spechtel UC, Ruzic-Sabljic E, Leonhard S, Hofmann H, Weber K, Pfister K, Strle F, Wilske B. Epidemiological aspects and molecular characterization of Borrelia burgdorferi s.l. s.l. from southern Germany with special respect to the new species Borrelia spielmanii sp. nov. Int J Med Microbiol. 2008; 298(3-4): 279-90.
- Fryland L, Wilhelmsson P, Lindgren PE, Nyman D, Ekerfelt C, Forsberg P. Low risk of developing Borrelia burgdorferi infection in the south-east of Sweden after being bitten by a Borrelia burgdorferi-infected tick. Int J Infect Dis. 2011 Mar;15(3):e174-81. Epub 2010 Dec 17.
- Gassner F, Verbaarschot P, Smallegange RC, Spitzen J, Van Wieren SE, Takken W. Variations in Ixodes ricinus density and Borrelia infections associated with cattle introduced into a woodland in the Netherlands. Appl Environ Microbiol. 2008; 74(23): 7138-44.
- Groen J, Koraka P, Nur YA, Avsic-Zupanc T, Goessens WH, Ott A, Osterhaus AD. Serologic evidence of ehrlichiosis among humans and wild animals in The Netherlands. Eur J Clin Microbiol Infect Dis. 2002; 21(1): 46-9.
- Huegli D, Moret J, Rais O, Moosmann Y, Erard P, Malinverni R, Gern L. Prospective study on the incidence of infection by Borrelia burgdorferi sensu lato after a tick bite in a highly endemic area of Switzerland. Ticks Tick Borne Dis. 2011 Sep;2(3):129-36. doi: 10.1016/j.ttbdis.2011.05.002. Epub 2011 Jul 28.
- Heyman P, Cochez C, Hofhuis A, Giessen JW, et al. A clear and present danger: tick-borne diseases in Europe. Expert Rev Anti Infect Ther. 2010:8(1):33-50.
- Hofhuis A, van der Giessen JW, Borgsteede FH, Wielinga PR, Notermans DW, van Pelt W. Lyme borreliosis in the Netherlands: strong increase in GP consultations and hospital admissions in past 10 years. Euro Surveill. 2006; 11(6): E060622.2.
- Hofhuis A, Harms MG, van der Giessen JWB, Sprong H, Notermans DW, van Pelt W. Ziekte van Lyme in Nederland 1994-2009: Aantal huisartsconsulten blijft toenemen. Is voorlichting en curatief beleid genoeg? Infectieziekten Bulletin 2010; 21(3):84-7.
- Hubalek Z. Epidemiology of Lyme Borreliosis. Curr Probl Dermatol. Basel, Karger. 2009; 37: 31-50.
- Jacobs J.J.W.M, G.T.Noordhoek, J.M.M.Brouwers, P.R.Wielinga, J.P.A.M.Jacobs en A.H.Brandenburg. Kleine kans op lymeborreliose na een tekenbeet op Ameland: onderzoek in een huisartsenpraktijk. Ned Tijdschr Geneeskd. 2008;152: 2022-6.
- Krause PJ,Telford III SR, Spielman A, Sikand V, Ryan R, Christianson D, Burk G, Brassard P, Peck J, Persing DH. Concurrent Lyme Disease and Babesiosis Ð Evidence for Increased Severity and Duration of Illness. JAMA. 1996;275(21):1657-1660.
- Krause PJ, McKay K, Thompson CA, Sikand VK, Lentz R, Lepore T, Closter L, Christianson D, Telford III SR, Persing D, Radolf JD, Spielman A, The Deer-Associated Infection Study Group. Disease-Specific Diagnosis of Coinfecting Tickborne Zoonoses: Babesiosis, Human Granulocytic Ehrlichiosis, and Lyme Disease. Clinical Infectious Diseases 2002;34(9):1184-1191.
- Kuiper H. Klinisch spectrum en indicentie van neuroborreliose in Nederland. Ned Tijdschr Geneeskd. 2004; 148(14): 670-3.
- Nahimana I, Gern L, Blanc DS, Praz G, Francioli P, Pter O. Risk of Borrelia burgdorferi infection in western Switzerland following a tick bite. Eur J Clin Microbiol Infect Dis. 2004 Aug;23(8):603-8. Epub 2004 Jul 24.
- Nijhof AM, Bodaan C, Postigo M, Nieuwenhuijs H, Opsteegh M, Franssen L, Jebbink F, Jongejan F. Ticks and associated pathogens collected from domestic animals in the Netherlands. Vector Borne Zoonotic Dis. 2007; 7(4): 585-96.
- Overbeek van L, Gassner F, van der Plas CL, Kastelein P, Nunes-da Rocha U, Takken W. Diversity of Ixodes ricinus tick-associated bacterial communities from different forests. FEMS Microbiol Ecol. 2008; 66(1): 72-84.
- Schouls LM, Van De Pol I, Rijpkema SG, Schot CS. Detection and identification of Ehrlichia, Borrelia burgdorferi s.l. sensu lato, and Bartonella species in Dutch Ixodes ricinus ticks. J Clin Microbiol. 1999; 37(7): 2215-22.
- Sprong H, Wielinga PR, Fonville M, Reusken C, Brandenburg AH, Borgsteede F, Gaasenbeek C, van der Giessen JW. Ixodes ricinus ticks are reservoir hosts for Rickettsia helvetica and potentially carry flea-borne Rickettsia species. Parasit Vectors. 2009; 2(1): 41.
- Stanek G, Strle F. Lyme disease: European perspective. Infect Dis Clin North Am. 2008; 22(2): 327-39.
- Steere AC. Lyme disease. N Engl J Med 2001; 345: 115-25.
- Strle F. Human granulocytic ehrlichiosis in Europe. Int J Med Microbiol. 2004; 293 Suppl 37: 27-35.
- Strle F, Stanek G. Clinical manifestations and diagnosis of lyme borreliosis. Curr Probl Dermatol. 2009; 37: 51-110.
- Swanson SJ, Neitzel D, Reed KD, Belongia EA. Coinfections acquired from ixodes ticks. Clin Microbiol Rev. 2006; 19(4): 708-27.
- Takken W, Vliet van AJH, Overbeek van L, Gassner F, Jacobs F, Bron WA, Mulder S. Teken, tekenbeten en Borrelia infecties in Nederland. Periode 2006 - 2007. Rapport 2008. Wageningen Universiteit, Laboratorium voor Entomologie.
- Telford III SR, Wormser GP. Bartonella spp. Transmission by Ticks Not Established. Emerging infectious Diseases. 2010; 16(3); 379-83.
- Tijsse-Klasen E, Fonneville M, Nijhof AM, Gassner F, Hovius KE, Jongejan F, Takken W, Reimerink JR, Overgaauw PAM, Sprong H. Absence of zoonotic Bartonella species in questing ticks: First detection of Bartonella clarridgeiae and Ricketrsia felis in cats fleas in the Netherlands.
- Wielinga PR, Gaasenbeek C, Fonville M, de Boer A, de Vries A, Dimmers W, Akkerhuis Op Jagers G, Schouls LM, Borgsteede F, van der Giessen JW. Longitudinal analysis of tick densities and Borrelia, Anaplasma, and Ehrlichia infections of Ixodes ricinus ticks in different habitat areas in The Netherlands. Appl Environ Microbiol. 2006; 72(12): 7594-601.
- Wielinga PR, Fonville M, Sprong H, Gaasenbeek C, Borgsteede F, Giessen JW. Persistent Detection of Babesia EU1 and Babesia microti in Ixodes ricinus in The Netherlands During a 5Year Surveillance: 2003-2007. Vector Borne Zoonotic Dis. 2009; 9 (1): 119-122.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 08-09-2015
Beoordeeld op geldigheid : 01-07-2013
Uiterlijk in 2017 wordt door het CBO na raadpleging van of op advies van de aan de richtlijn participerende verenigingen, bepaald of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om (delen van) de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
Algemene gegevens
INITIATIEF:
Richtlijnconsortium Nederland
ORGANISATIE:
CBO
MANDATERENDE VERENIGINGEN/INSTANTIES:1
- Nederlandse Internisten Vereniging
- Nederlandse Vereniging van Revalidatieartsen
- Nederlandse Vereniging van Spoedeisende Hulp Artsen
- Nederlandse Vereniging van Ziekenhuisapothekers
- Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde
- Nederlandse Vereniging voor Cardiologie
- Nederlandse Vereniging voor Dermatologie en Venereologie
- Nederlandse Vereniging voor Kindergeneeskunde
- Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde
- Nederlandse Vereniging voor Medische Microbiologie
- Nederlandse Vereniging voor Neurologie
- Nederlandse Vereniging voor Psychiatrie
- Nederlandse Vereniging voor Reumatologie
- Nederlandse Vereniging voor Verzekeringsgeneeskunde
- Vereniging voor Infectieziekten, Sectie Infectieziektebestrijding
IN SAMENWERKING MET:
- Centrum Infectieziektebestrijding/RIVM
- Nederlands Huisartsen Genootschap
FINANCIERING:
Deze richtlijn is tot stand gekomen met financiële steun van ZonMw in het kader van het programma ‘Kennisbeleid Kwaliteit Curatieve Zorg’ (KKCZ).
1 De Nederlandse Vereniging voor Lymepatiënten (NVLP) heeft zich teruggetrokken als mandaterende vereniging. Mevr. M. Mud, Mevr. G.M. Pekel en drs. A.W.B. Klusman hebben de NVLP vertegenwoordigd bij de ontwikkeling van de richtlijn. Na vier jaar intensief overleg lag er een concepttekst waar zij achter konden staan. Zij vonden het resultaat van dit concept nog net acceptabel omdat deze aan de behandelend arts voldoende speelruimte bood om op genuanceerde wijze tot maatwerk te komen. In de laatste fase zijn naar aanleiding van de commentaren op voor de NVLP essentiële punten de nuanceringen weer uit de tekst/aanbevelingen verwijderd. Zij kunnen zich daarom niet meer vinden in de inhoud van de uiteindelijke richtlijn. Met name wat betreft de benadering van patiënten met persisterende klachten na behandeling en patiënten die niet eerder behandeld zijn voor lymeziekte maar bij wie diagnostisch laboratoriumonderzoek de diagnose lymeziekte niet bevestigt. Ook voldoet de gevolgde procedure naar hun mening niet aan de afgesproken doelstellingen en werkwijze. Naar de mening van de patiëntenvereniging wordt de zorg aan lymepatiënten met deze richtlijn niet optimaal vormgegeven.
Doel en doelgroep
Doelstelling
Deze herziening van de richtlijn Lyme-borreliose is een document met aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering waarin de werkgroep heeft getracht de impasse rond deze verschillen van inzicht te doorbreken en de wetenschappelijke gegevens, met inachtneming van de argumenten vanuit patiëntenperspectief, op objectieve en genuanceerde wijze te vertalen naar de klinische praktijk. Dat betekent dat de werkgroep zich in de richtlijn voor zover mogelijk baseert op resultaten uit gepubliceerd wetenschappelijk onderzoek. Waar overtuigend en eenduidig onderzoeksmateriaal ontbreekt, heeft de werkgroep met grote inzet getracht ook over de controversiële punten tot consensus te komen. Ten aanzien van de sensitiviteit van serologische testen bij vroege gedissemineerde lymeziekte met langer dan 8 weken bestaande klachten en late lymeziekte (paragraaf 3.1.1) is dit niet gelukt. Ten aanzien van antibiotische behandeling had de NVLP de wens adviezen op te nemen over behandeling van patiënten die niet eerder behandeld zijn voor lymeziekte maar bij wie diagnostisch laboratoriumonderzoek de diagnose lymeziekte niet bevestigt (paragraaf 4.1) en bij patiënten die lymeziekte-geassocieerde klachten hebben zonder organische afwijkingen en al eerder voor lymeziekte zijn behandeld (paragraaf 4.3.5 en 5.3). Er is in de richtlijn geen consensus bereikt over deze onderwerpen. In de genoemde paragraven worden overwegingen voor en tegen behandeling besproken zonder dat een aanbeveling wordt gegeven.
De richtlijn beoogt een leidraad te geven voor de dagelijkse praktijk van de preventie, diagnostiek en behandeling van lymeziekte. De richtlijn is geschreven voor en door de zorgverleners in samenspraak met patiënten. De richtlijn biedt aanknopingspunten voor bijvoorbeeld transmurale afspraken of lokale protocollen, hetgeen voor de implementatie bevorderlijk is.
Gebruikers richtlijn
De richtlijn is ontwikkeld voor alle zorgverleners in de eerste en tweede lijn die bij de diagnostiek, behandeling en begeleiding van patiënten met lymeziekte betrokken zijn zoals: huisartsen, SEH-artsen, internisten, infectiologen, dermatologen, neurologen, kinderartsen, medisch microbiologen, reumatologen, cardiologen, pathologen, bedrijfsartsen, verzekeringsartsen en zorgverleners werkzaam bij de GGD.
Samenstelling werkgroep
Voor de herziening van deze richtlijn is in 2008 een multidisciplinaire werkgroep samengesteld, bestaande uit vertegenwoordigers van alle bij de diagnostiek, behandeling en begeleiding van patiënten met lymeziekte betrokken medische disciplines, vertegenwoordiging van de Nederlandse Vereniging voor Lymepatiënten en adviseurs van het Kwaliteitsinstituut voor de Gezondheidszorg CBO (zie ‘Belangenverklaringen’).
Bij het samenstellen van de werkgroep is rekening gehouden met de geografische spreiding van de werkgroepleden, met een evenredige vertegenwoordiging van de verschillende betrokken verenigingen en instanties, alsmede met een spreiding al dan niet in academische achtergrond. De werkgroepleden hebben onafhankelijk gehandeld en waren gemandateerd door hun vereniging. Een overzicht van de belangenverklaringen van werkgroepleden over mogelijke financiële belangenverstrengeling is als addendum bij de richtlijn gevoegd.
De werkgroep is als volgt samengesteld:
- Dr. J.P.J Bakker, Nederlandse Vereniging van Revalidatieartsen
- Dr. D. van de Beek, Nederlandse Vereniging voor Neurologie
- Dr. A.H. Brandenburg, Nederlandse Vereniging voor Medische Microbiologie
- Prof. dr. P.J. van den Broek, voorzitter, Nederlandse Internisten Vereniging
- Dr. A.P. van Dam, Nederlandse Vereniging voor Medische Microbiologie
- Dr. J.J.E. van Everdingen, Nederlandse Vereniging voor Dermatologie en Venereologie
- Drs. R. Foekens, Nederlandse Vereniging voor Verzekeringsgeneeskunde
- Dr. R.J. Hassink, Nederlandse Vereniging voor Cardiologie
- Dr. P.M. Houtman, Nederlandse Vereniging voor Reumatologie
- Prof. dr. P. Portegies, Nederlandse Vereniging voor Neurologie
- Drs. A.C. Rönnau, Nederlandse Vereniging voor Dermatologie en Venereologie
- Drs. C.J.G.M. Rosenbrand, CBO-TNO
- Dr. J.F.P. Schellekens, Nederlandse Vereniging voor Medische Microbiologie
- Dr. H.N. Sno, Nederlandse Vereniging voor Psychiatrie
- Drs. M.V. Starink, Nederlandse Vereniging voor Dermatologie en Venereologie
- Dr. J.E. van Steenbergen, Centrum Infectieziektebestrijding/RIVM
- Drs. H.P.J. Stinis, Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde
- Drs. M.S. Tat, Nederlandse Vereniging van Spoedeisende Hulp Artsen
- Drs. J.J. Tiessen, Vereniging voor Infectieziekten, Sectie Infectieziektebestrijding
- Dr. D.J. Touw, Nederlandse Vereniging van Ziekenhuisapothekers
- Dr. Th.F.W. Wolfs, Nederlandse Vereniging voor Kindergeneeskunde
- Drs. G. Wielink, Nederlands Huisartsen Genootschap
Prof Dr B.J. Kullberg en Dr H. ter Hofstede (NIV) hebben zich teruggetrokken uit de voorbereidingscommissie omdat zij de conceptrichtlijn niet konden onderschrijven: met name ten aanzien van de klinische benadering van patiënten met persisterende klachten.
Inbreng patiëntenperspectief
Bij het opstellen van de richtlijn is rekening gehouden met het patiëntenperspectief. In de knelpuntanalyse heeft de betrokken patiëntenvereniging, Nederlandse Vereniging voor Lymepatiënten, eigen knelpunten ingebracht. De conceptrichtlijn is tevens voorgelegd aan de Nederlandse Vereniging voor Lymepatiënten voor commentaar.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de herziening van deze richtlijn is zoveel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen. De richtlijn wordt verspreid onder alle relevante beroepsgroepen en ziekenhuizen. Ook wordt een samenvatting van de richtlijn ter publicatie aangeboden aan het Nederlands Tijdschrift voor Geneeskunde en zal er in verschillende specifieke vaktijdschriften aandacht worden besteed aan de richtlijn. Daarnaast wordt de integrale tekst van de richtlijn op de websites van het CBO en de betrokken beroepsverenigingen geplaatst.
Werkwijze
Werkwijze van de werkgroep
Gezien de omvang van het werk werd een aantal subgroepen gevormd met vertegenwoordigers van relevante disciplines. Er werd in 6 subwerkgroepen gewerkt: klinische uitingen, epidemiologie/profylaxe/preventie, diagnostiek, behandeling, persisterende lymeziekte/postlymeziektesyndroom en arbeid.
Daarnaast zorgde de voorzitter samen met adviseurs van het CBO en een ambtelijk secretaris, voor de coördinatie en onderlinge afstemming van de subgroepen.
De werkgroep heeft gedurende een periode van ongeveer tweeënhalf jaar gewerkt aan de concepttekst van de herziening van deze richtlijn. De subgroepen schreven en beoordeelden de door werkgroepleden en epidemiologen geschreven wetenschappelijke onderbouwingen en formuleerden vervolgens de overige overwegingen en aanbevelingen. Tevens schreven de subgroepen consensusteksten wanneer wetenschappelijk bewijs voor het beantwoorden van de uitgangsvraag ontbrak. De teksten werden tijdens plenaire vergaderingen besproken en na verwerking van de commentaren geaccordeerd. De voltallige werkgroep is 17 maal bijeen geweest om de resultaten van de subgroepen in onderling verband te bespreken. De teksten van de subgroepen zijn door een redactieteam samengevoegd en op elkaar afgestemd tot één document: de conceptrichtlijn. Deze werd 1 november 2011 aan verenigingen verstuurd voor commentaar. Na verwerking van het commentaar is de richtlijn in juli 2012 door de werkgroep vastgesteld en ter autorisatie naar de relevante beroepsverenigingen gestuurd.
Wetenschappelijke onderbouwing
De aanbevelingen uit deze richtlijn zijn voor zover mogelijk gebaseerd op bewijs uit gepubliceerd wetenschappelijk onderzoek. Relevante artikelen werden gezocht door het verrichten van systematische zoekacties in de Cochrane Library, Medline, Embase en Psychinfo. Hierbij werd de taal gelimiteerd tot Nederlands, Engels en Duits. Daarnaast werden handmatige zoekacties verricht. Er werd gezocht vanaf 1980 tot 2009. Artikelen van later datum werden wel toegevoegd maar er werd geen systematisch literatuuronderzoek na 2009 gedaan. Als trefwoorden voor de patiëntenpopulatie in Medline werden gebruikt: de MESH (Medical Subject Heading) termen: Lyme disease, Borrelia infections, Borrelia burgdorferi s.l. Group, Borreliosis, Neuroborreliosis, Lyme Neuroborreliosis, Ticks, Ixodidae, Tick-Toxicoses en als vrije tekstwoorden (lyme or borreliosis), Borrelia en Ixodes.
Belangrijke selectiecriteria hierbij waren: vergelijkend onderzoek met hoge bewijskracht, zoals meta-analyses, systematische reviews, randomized controlled trials (RCT’s) en controlled trials (CT). Waar deze niet voorhanden waren, werd verder gezocht naar vergelijkend cohort onderzoek, vergelijkende patiënt-controle studies of niet vergelijkend onderzoek. De kwaliteit van deze artikelen werd door werkgroepleden en/of epidemiologen beoordeeld aan de hand van ‘evidence-based richtlijnontwikkeling’ (EBRO)-beoordelingsformulieren. Artikelen van matige of slechte kwaliteit werden uitgesloten. Na deze selectie bleven de artikelen over die als onderbouwing bij de verschillende conclusies in de richtlijn staan vermeld. De geselecteerde artikelen zijn vervolgens gegradeerd naar de mate van bewijs, waarbij de volgende indeling is gebruikt (Tabel 1). De mate van bewijskracht en niveau van bewijs zijn in de conclusies van de verschillende hoofdstukken weergegeven. De belangrijkste literatuur waarop de conclusies zijn gebaseerd is daarbij vermeld.
Indeling van de onderbouwing naar mate van bewijskracht
(Tabel 1: tabel met niveau van bewijs artikelen en niveau van bewijs van de conclusies)
Tabel 1. Indeling van methodologische kwaliteit van individuele studies
|
|
Interventie |
Diagnostisch accuratesse onderzoek |
Schade of bijwerkingen, etiologie, prognose* |
|
A1 |
Systematische review van tenminste twee onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau |
||
|
A2 |
Gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang |
Onderzoek ten opzichte van een referentietest (een ‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van de resultaten van test en gouden standaard, betreffende een voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad |
Prospectief cohort onderzoek van voldoende omvang en follow-up, waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten. |
|
B |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiënt-controle-onderzoek, cohortonderzoek) |
Onderzoek ten opzichte van een referentietest, maar niet met alle kenmerken die onder A2 zijn genoemd |
Prospectief cohort onderzoek, maar niet met alle kenmerken als genoemd onder A2 of retrospectief cohort onderzoek of patiëntcontrole-onderzoek |
|
C |
Niet-vergelijkend onderzoek |
||
|
D |
Mening van deskundigen |
||
* Deze classificatie is alleen van toepassing in situaties waarin om ethische of andere redenen gecontroleerde trials niet mogelijk zijn. Zijn die wel mogelijk dan geldt de classificatie voor interventies.
Niveau van conclusies
|
|
Conclusie gebaseerd op |
|
1 |
Onderzoek van niveau A1 of tenminste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2, met consistent resultaat |
|
2 |
1 onderzoek van niveau A2 of tenminste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
3 |
1 onderzoek van niveau B of C |
|
4 |
Mening van deskundigen |
De beschrijving en beoordeling van de verschillende artikelen staan in de verschillende teksten onder het kopje ‘Wetenschappelijke onderbouwing’. Het wetenschappelijk bewijs is samengevat in een ‘Conclusie’, waarbij het niveau van het meest relevante bewijs is weergegeven.
Totstandkoming van de aanbevelingen
Voor het komen tot een aanbeveling zijn er naast het wetenschappelijk bewijs vaak andere aspecten van belang, bijvoorbeeld: patiëntenvoorkeuren, beschikbaarheid van speciale technieken of expertise, organisatorische aspecten, maatschappelijke consequenties of kosten. Deze aspecten worden besproken na de ‘Conclusie’ in de ‘Overige overwegingen’. Hierin wordt de conclusie op basis van de literatuur in de context van de dagelijkse praktijk geplaatst en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties. De uiteindelijk geformuleerde aanbeveling is het resultaat van het beschikbare bewijs in combinatie met deze overwegingen. Het volgen van deze procedure en het opstellen van de richtlijn in dit ‘format’ heeft als doel de transparantie van de richtlijn te verhogen. Het bood ruimte voor een efficiënte discussie tijdens de werkgroepvergaderingen en vergroot bovendien de helderheid voor de gebruiker van de richtlijn.
Kosteneffectiviteit
Er is geen kosteneffectiviteitanalyse uitgevoerd.
