Materiaal meshes - Schone littekenbreuken
Uitgangsvraag
Welke mesh dient gebruikt te worden bij een buikwandreconstructie bij patiënten met schone of gecontamineerde ventrale hernia cicatricalis?
Aanbeveling
Houdt bij het kiezen van het type mesh rekening met kenmerken van zowel patiënt, littekenbreuk alsook de gekozen operatietechniek, loss of domain, en de positionering van de mesh.
Streef naar het gebruik van een macroporeuze polypropyleen of een polyester monofilament (lichtgewicht) mesh voor schone littekenbreuken waarbij de mesh extraperitoneaal wordt geplaatst.
Kies bij intraperitoneale plaatsing een mesh met een gunstig profiel ten aanzien van adhesievorming.
Overwegingen
Tijdens de literatuuranalyse om deze uitgangsvraag te beantwoorden bleek er weinig kwalitatief goed vergelijkend onderzoek beschikbaar voor de materiaalkeuze. Ten aanzien van de kans op inkapseling en krimpen of mesh-adhesies van het materiaal zijn er overwegend alleen dierexperimentele onderzoeken gedaan.
Een recente Delphi-studie naar consensus onder herniachirurgen laat zien dat er consensus is omtrent de aanbeveling synthetische mesh te gebruiken ter augmentatie van schone littekenbreuken, hetgeen onderbouwd kan worden met gerandomiseerde studies(Liang, 2017).
Tevens zijn er twee studies die loss of domain benadruken (Liang, 2017; Mommers, 2016).
Voor schone littekenbreuken dient men dan ook augmentatie met synthetische mesh te verkiezen boven een niet geaugmenteerde reconstructie (zie module operatieve behandeling). Voor patiënten met co-morbiditeit maar schone littekenbreuken zijn ook goede resultaten beschreven met synthetische mesh (polypropyleen)(Souza, 2013).
Van de synthetische meshes lijkt macroporeus monofilament “lichtgewicht” polypropyleen zich het meeste te lenen voor buikwandreconstructies. Door de fysieke structuur staat macroporeus polypropyleen relatief snelle incorporering in de buikwand toe, hetgeen de mesh relatief resistent maakt tegen infectie, zeker na plaatsing in de retromusculaire positie waarbij de mesh aan alle zijden ingesloten is door het musculo- aponeurotische deel van de buikwand. Ook heeft macroporeus polypropyleen het meest gunstige profiel mocht de mesh toch geïnfecteerd raken: het is vaker mogelijk macroporeuze polypropyleen deels in situ te laten dan bijvoorbeeld mesh van ePTFE of polyester (Shubinets, 2017). Dit is ook bij schone chirurgie relevant omdat ook bij schone chirurgie bacteriën in de wond komen en later voor infectieuze complicaties kunnen zorgen als gevolg van het vormen van biofilm om de mesh. Op deze manier kunnen bacteriën lang op latente wijze aanwezig blijven, en kan een patiënt zich ook na een lange asymptomatische periode (>17 jaar is beschreven) nog presenteren met een meshinfectie (Shubinets, 2017). Ook zijn er aanwijzingen dat lichtgewicht meshes leiden tot minder pijnklachten (Li, 2015; Conze, 2014; Ladurner, 2011; Schmidbauer; 2005; Ricket, 2012). Macroporeus polypropyleen leent zich echter minder goed voor intraperitoneale plaatsing in verband met adhesievorming (Brown, 2010).
Onderbouwing
Achtergrond
Lange termijn follow-up (gemiddeld meer dan zes jaar) van een gerandomiseerde studie laat zien dat bij een reconstructie zonder augmentatie met synthetische mesh het aantal recidieven bijna twee keer zo hoog is (63% versus 32%, p<0,001)(Burger, 2004).
Als gevolg van het uitgebreide scala aan beschikbare soorten meshes en de heterogene patiëntenpopulatie kan het kiezen van de juiste mesh een uitdaging zijn. Meshes verschillen onderling in kenmerken als het soort materiaal, de fysieke structuur (lightweight versus heavyweight) en eventuele anti-adhesieve lagen.
Men dient zich te beseffen dat elk soort mesh een profiel heeft met zowel voordelen als nadelen en het kiezen van de juiste soort mesh voor een bepaalde casus dus een afweging van deze factoren dient te zijn.
Conclusies / Summary of Findings
Chronische pijn
|
Laag GRADE |
Er is met lage bewijskracht aangetoond dat patiënten met een schone littekenbreuk bij wie lichtgewicht meshes zijn gebruikt minder chronische pijn ervaren dan patiënten bij wie met standaard meshes zijn gebruikt.
Bronnen (Conze, 2014; Ladurner, 2011; Schmidbauer; 2005; Ricket, 2012) |
Complicaties
|
Zeer laag GRADE |
Het is onduidelijk of er een verschil is in complicaties tussen gedeeltelijk oplosbare meshes en niet oplosbare synthetische mesh bij een littekenbreukcorrectie.
Bronnen (Berrevoet, 2010; Conze, 2014; Ladurner, 2011; Schmidbauer, 2005; Welty, 2001; Rickert, 2012) |
Samenvatting literatuur
Beschrijving studies
Zes studies zijn opgenomen in de literatuuranalyse voor schone breuken: drie prospectieve observationele cohortstudies (Berrevoet, 2010; Schmidbauer, 2005; Welty, 2001), één RCT (Conze, 2014) en één retrospectieve case-control studie (Ladurner, 2011). Naar aanleiding van de literatuurlijst uit de zoekactie is er nog één observationele studies hier aan toegevoegd (Ricket, 2012).
In de studies zijn patiënten geïncludeerd waarbij een littekenbreukcorrectie is uitgevoerd. Daarbij werden verschillende soorten meshes gebruikt: lichtgewicht meshes versus standaard meshes (Berrevoet, 2010; Conze, 2014; Ladurner, 2011; Schmidbauer, 2005; Welty, 2001) en gedeeltelijk oplosbare meshes versus onoplosbare meshes (Ricket, 2012). De volgende uitkomsten werden beschreven pijn, erosie en complicaties (wondinfectie, bloedingen seroom, hematoom, vreemd lichaam sensatie, recidief littekenbreuk). De gemiddelde totale leeftijd was in de interventiegroepen 67,4 ± 17,4 jaar en in de controlegroepen 61,4 ± 4,9 jaar. Het gemiddelde percentage mannen in de interventiegroep was 59 ± 27 en in de controlegroep 54 ± 28.
Resultaten
Resultaten chronische pijn
Vier studies onderzochten het effect op chronische pijn na een littekenbreukcorrectie. Een meta-analyse van drie studies (N=364) laat zien dat chronische pijn na een littekenbreukcorrectie significant verschillend is bij gebruik van lichtgewicht meshes ten opzichte van standaard meshes waarbij patiënten met lichtgewicht meshes minder chronische pijn ervaarden (relatief risico=0,27; 95%-BI: 0,12 tot 0,60; I2=0%) (zie figuur 1).
De studie van Ricket (2012) heeft pijn door middel van de SF-36 onderzocht. De SF-36 is een vragenlijst voor het ervaren van gezondheid of gezondheidsgerelateerde kwaliteit van leven. Het instrument bevat schalen voor fysiek functioneren, sociaal functioneren, rolbeperkingen door fysieke of emotionele problemen, mentale gezondheid, energie, pijn en algemene gezondheidsbeleving. Ricket rapporteerde de uitkomsten van pijn specifiek, 21- en 60 dagen na de littekenbreukcorrectie. Pijn was significant hoger op beide meetmomenten in de groep met synthetische meshes ten opzichte van de groep met biologische meshes (21 dagen: P=0,04; 60 dagen: P=0,04). Spreidingsmaten waren niet gepresenteerd.
Figuur 1 Forestplot voor de uitkomst chronische pijn
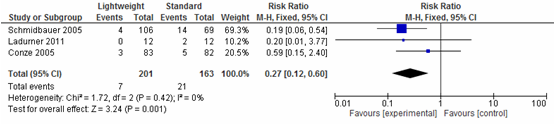
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat chronische pijn begon op het niveau ‘laag’
aangezien de uitkomsten verkregen zijn uit observationeel onderzoek.
Resultaten complicaties bij littekenbreuken: wondinfectie, bloedingen, seroom, hematoom, recidief littekenbreuk, vreemd lichaam sensatie.
Wondinfectie
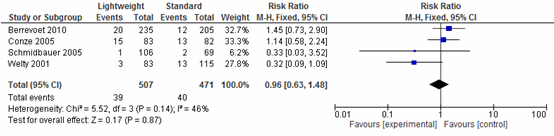
Vier studies in de review van Li (2015) onderzochten het effect op wondinfecties na een littekenbreukcorrectie (N=978). Een meta-analyse van deze resultaten laat zien dat wondinfecties na een littekenbreukcorrectie vrijwel gelijk is voor lichtgewicht meshes en standaard meshes (relatief risico=0,96; 95%-BI: 0,63 tot 1,48; I2=46%) (zie figuur 2).
Figuur 2 Forestplot voor de uitkomst Wondinfectie
Seroom
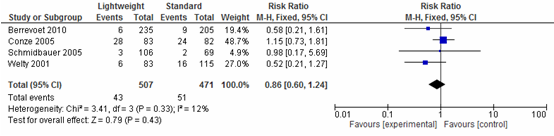
Vier studies (N=978) onderzochten het effect op seroomvorming na een littekenbreukcorrectie. Een meta-analyse van deze resultaten laat zien dat seroom vorming na een littekenbreukcorrectie vrijwel gelijk is voor lichtgewicht meshes en standaard meshes (Risk Ratio=0,86; 95%-BI: 0,60 tot 1,24; I2=12%) (zie figuur 3).
Figuur 3 Forestplot voor de uitkomst Complicaties: Seroom
Hematoom
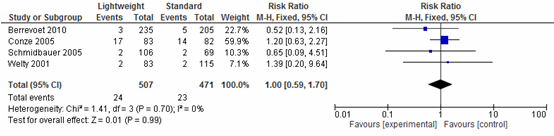
Vier studies (N=978) onderzochten het effect op hematoomvorming na een littekenbreukcorrectie. Een meta-analyse van deze resultaten laat zien dat hematoomvorming na een littekenbreukcorrectie gelijk is voor lichtgewicht meshes en standaard meshes (Risk Ratio=1,00; 95%-BI: 0,59 tot 1,70; I2=0%) (zie figuur 4).
Figuur 4
Recidief littekenbreuk
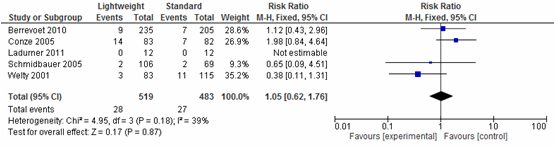
Vijf studies (N=1002) onderzochten het effect op terugkeer van littekenbreuk na een littekenbreukcorrectie. Een meta-analyse van deze resultaten laat zien dat het terugkeren van een littekenbreuk na een littekenbreukcorrectie gelijk is voor lichtgewicht meshes en standaard meshes (Relatief risico=1,05; 95%-BI: 0,62 tot 1,76; I2=39%) (zie figuur 5).
Figuur 5 Forestplot voor de uitkomst Recidief littekenbreuk
Vreemd lichaams-sensatie
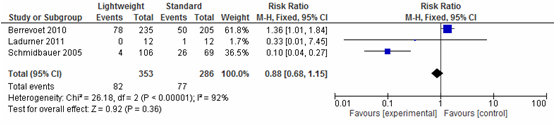
Drie studies (N=639) onderzochten het effect op vreemd lichaams-sensatie na een littekenbreukcorrectie. Een meta-analyse van deze resultaten laat zien dat een vreemd lichaamssensatie na een littekenbreukcorrectie vrijwel gelijk is voor lichtgewicht meshes en standaard meshes (relatief risico=0,88; 95%-BI: 0,68 tot 1,15; I2=92%) (zie figuur 6).
Figuur 6 Forestplot voor de uitkomst Vreemd lichaam-sensatie
De studie van Rickert (2012) onderzocht bij 80 personen na een littekenbreukcorrectie of er significante verschillen in complicaties waren tussen partieel absorbeerbare synthetische meshes en synthetische meshes. Deze studie vond geen significante verschillen op de uitkomsten wondinfectie, bloedingen, hematoom, seroom en recidief littekenbreuk. Spreidingsmaten en p-waardes werden in deze studie niet gepresenteerd.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat complicaties begon op ‘laag’ aangezien de data verkregen zijn uit observationeel onderzoek. Daarna is de bewijskracht met één niveau verlaagd tot ‘zeer laag’ gezien beperkingen in de onderzoeksopzet (de toewijzing van de behandeling was inherent aan de patiënt en het type breuk); en het feit dat het betrouwbaarheidsinterval zowel een klinische relevant effect omvat in het voordeel van de interventie- als de controlegroep (imprecisie).
Zoeken en selecteren
Om de deelvraag ten aanzien van schone buikwandreconstructies te kunnen beantwoorden is er een systematische literatuuranalyse verricht door het kennisinstituut naar de volgende zoekvragen:
1. Wat zijn de (on)gunstige effecten van applicatie van lichtgewicht synthetische mesh ten opzichte van applicatie van standaard synthetische mesh bij patiënten met een ventrale hernia cicatricalis?
P: patiënten met een ventrale hernia cicatricalis; I: applicatie van lichtgewicht synthetische mesh; C: applicatie van standaard synthetische mesh;
O: recidieven, wondinfecties, meshinfecties, opnameduur, terugkeer naar activiteiten, pijnklachten, noodzaak tot verwijderen van mesh.
2. Wat zijn de (on)gunstige effecten van applicatie van (gedeeltelijk) oplosbare synthetische mesh ten opzichte van applicatie van standaard synthetische mesh bij patiënten met een ventrale hernia cicatricalis?
P: patiënten met een ventrale hernia cicatricalis;
I: applicatie van (gedeeltelijk) oplosbare synthetische mesh; C: applicatie van standaard synthetische mesh;
O: recidieven, wondinfecties, meshinfecties, opnameduur, terugkeer naar activiteiten, pijnklachten, noodzaak tot verwijderen van mesh.
De werkgroep achtte het aantal recidieven, wondinfecties, meshinfecties voor de besluitvorming kritieke uitkomstmaten; en opnameduur, return to activities, pijnklachten, en de noodzaak tot het verwijderen van mesh voor de besluitvorming belangrijke uitkomstmaten voor de search naar soorten mesh bij schone breuken.
Zoeken en selecteren (Methode)
Voor de search voor het soort mesh bij schone breuken is in de databases Medline (via OVID) en Embase (via Elsevier) op 18 februari 2016 met relevante zoektermen gezocht naar studies die diverse materialen hebben onderzocht dat gebruikt dient te worden bij littekenbreukcorrecties. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 679 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische reviews, RCT’s of vergelijkend observationeel onderzoek, patiënten met functionele klachten en interne of externe rectumprolaps of littekenbreuken. Op basis van titel en abstract werden in eerste instantie 16 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 14 studies geëxcludeerd (zie exclusietabel) en 2 studies definitief geselecteerd, waarvan een observationeel vergelijkend cohortonderzoek (Ricket, 2012) en een systematische review (Li, 2015). De referenties van de review zijn bekeken en gecontroleerd op de inclusiecriteria. Van de literatuurlijst van Li, 2015 zijn vijf primaire studies opgenomen: drie prospectieve observationele cohortstudies (Berrevoet, 2010; Schmidbauer, 2005; Welty, 2001), één RCT (Conze, 2014) en één retrospectieve case- control studie (Ladurner, 2011).
Zes studies zijn opgenomen in de literatuuranalyse. De evidence-tabellen hiervan en beoordeling van individuele studiekwaliteit kunt u in onder het tabblad Onderbouwing vinden.
Referenties
- Berrevoet F, Maes L, De Baerdemaeker L, et al. Comparable results with 3-year follow-up for large-pore versus small-pore meshes in open incisional hernia repair. Surgery. 2010;148(5):969-75.
- Brown CN, Finch JG. Which mesh for hernia repair? Ann R Coll Surg Engl. 2010;92(4):272-8.
- Conze J, Krones CJ, Schumpelick V, et al. Incisional hernia: challenge of re-operations after mesh repair.) Langenbecks arch surg. 2007;392(4):453-7. Epub 2006 Sep 2.
- Ladurner R, Chiapponi C, Linhuber Q, et al. Long term outcome and quality of life after open incisional hernia repair-light versus heavy weight meshes. BMC Surgery. 2011;11:25.
- Li J, Ji Z, Zhang W, et al. The comparison of lightweight mesh and standard mesh in incisional hernia repair with the open sublay technique: the results of a meta-analysis. Surgical Laparoscopy, Endoscopy & Percutaneous Techniques. 2015;25(3):238-44.
- Liang MK, Holihan JL, Itani K, et al. Ventral Hernia Management: Expert Consensus Guided by Systematic Review. Ann Surg. 2017;265(1):80-89.
- Mommers EHH, Wegdam JA, van der Wolk S, et al. Impact of hernia volume on pulmonary complications following complex hernia repair. J Surg Res. 2017;211:8-13. doi: 10.1016/j.jss.2016.11.051. Epub 2016 Dec 7. PubMed PMID: 28501135.
- Rickert A, Kienle P, Kuthe A, et al. A randomised, multi-centre, prospective, observer and patient blind study to evaluate a non-absorbable polypropylene mesh versus a partly absorbable mesh in incisional hernia repair. Langenbecks Archives of Surgery. 2012;397(8):1225-34.
- Schmidbauer S, Ladurner R, Hallfeldt KK, et al. Heavy-weight versus low-weight polypropylene meshes for open sublay mesh repair of incisional hernia. European Journal of Medical Research. 2005;10(6):247-53.
- Shubinets V, Carney MJ, Colen, DL, et al. Management of Infected Mesh After Abdominal Hernia Repair: Systematic Review and Single-Institution Experience. Annals of Plastic Surgery: February 2018 - Volume 80 - Issue 2 - p 145153.
- Souza JM, Dumanian GA. Routine use of bioprosthetic mesh is not necessary: a retrospective review of 100 consecutive cases of intra-abdominal midweight polypropylene mesh for ventral hernia repair. Surgery. 2013;153(3):393-9.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Li, 2015 |
SR and meta- |
Inclusion criteria |
Lightweight mesh |
Standard mesh |
End-point of follow-up |
Outcome measure-1 |
|
|
|
analysis of RCTs, |
SR: |
|
|
(months mean ± SD) |
Defined as recurrence |
|
|
|
cohort and case- |
|
A: Light-weight |
A: Heavy-weight |
|
|
|
|
|
control studies |
Patients treated |
polypropylene larger |
polypropylene small pore |
A: |
Effect measure: Risk Ratio |
|
|
|
|
with a incisional |
pore mesh |
mesh |
I: 36 |
(95% CI): |
|
|
|
Literature search |
hernia repair. |
|
|
C: 36 |
|
|
|
|
up to 2014 |
|
B: Light- weight |
B: Heavy-weight |
|
A: 1.13 (0.41 to 3.08) |
|
|
|
|
Studies on |
composite mesh |
polypropylene and |
B: |
B: 2.17 (0.83 to 5.70) |
|
|
|
A: Berrevoet, |
incisional hernia |
(multi filaments of |
polyester meshes (33-95 |
I: 24 |
C: Not estimable; no |
|
|
|
2010 |
repairs |
polypropylene with |
g/m2; pore-size 1 mm) |
C: 24 |
recurrence events |
|
|
|
B: Conze, 2014 |
performed with |
additional absorbable |
|
|
D: 0.64 (0.09 to 4.68) |
|
|
|
C Ladurner, 2011 |
lightweight |
Polyglactin; 25 g/m2; |
C: Heavy-weight |
C: |
E: 0.35((0.10 to 1.31) |
|
|
|
D: Schmidbauer, |
versus standard |
pore-size 4-5 mm) |
polypropylene mesh |
I: 75 ± 16 |
|
|
|
|
2005 |
mesh |
|
(108.5 g/m2; pore-size 1.6 |
C: 112 ± 22 |
Pooled effect (fixed effects |
|
|
|
E: Welty, 2001 |
Full-length |
C: Light-weight |
mm) |
|
model): |
|
|
|
|
articles in peer- |
polypropylene mesh |
|
D: |
1.05 (95% CI 0.62 to 1.76) |
|
|
|
Study design: |
reviewed journal |
(54 g/m2; pore-size 4- |
D: Heavy-weight |
I: 46 ± 14 |
favoring standard mesh |
|
|
|
|
|
5 mm) |
polypropylene mesh |
C: 92 ± 20 |
Heterogeneity (I2): 39% |
|
|
|
A: prospective |
|
|
(Monofilament; pore-size |
|
P=0.87 |
|
|
|
observational |
Exclusion criteria |
D: Light-weight |
1.6 mm; 21 tex; weight |
E: |
|
|
|
|
cohort |
SR: |
polypropylene mesh |
109 g/m2) |
I: 8 ± 7 |
Outcome measure-2 |
|
|
|
B: RCT parallel |
Not mentioned |
(non-absorbable |
|
C: 24 ± 13 |
Defined as seroma |
|
|
|
C: Retrospective |
|
multi filaments; |
E: Heavy-weight |
|
|
|
|
|
case-control |
5 studies |
weight 55 g/m2; |
polypropylene mesh |
Loss to follow-up |
Effect measure: Risk Ratio |
|
|
|
study |
included |
pore-size 3 – 5mm; of |
(monofilament; 95g/m2; |
|
(95% CI): |
|
|
|
D: Prospective |
|
6.7 tex) |
pore-size 600µm) |
B: |
A: 00.58 (0.21 to 1.61) |
|
|
|
cohort |
|
|
|
7 % withdrew consent, |
B: 1.15 (0.73 to 1.81) |
|
|
|
E: Prospective |
Important |
E: Light-weight, large- |
|
ten (6 6% were lost to |
C: 0.98 (0.17 to 5.69) |
|
|
|
cohort |
patient |
pore Vypro/mesh |
|
follow-up |
E: 00.52 (0.21 to 1.27) |
|
|
|
|
|
Ethicon |
|
|
|
|
|
Setting and Country: Zhong-Da hospital Nanjing China
Source of funding: |
characteristics at baseline:
N, mean ± SD age (yrs)
A: I: 235, 63.4 ± 17.4 C: 205, 66.9 ± 10.2 B: I: 83, 58.2 ± 12.7 C: 82 57.7 ±11.7 C: I: 12, 58.3 ± 11.1 C: 12, 57.3 ± 11.8 D: I: 106, 60 ± 14 C: 69, 56 ± 13 E: I: 83, 63 ± 10 C: 115, 58 ± 12
Sex (% male): A: not specified in article B: I:47; C: 56 C: I: 95; C: 84 D: I: 59; C: 52 E: I: 67; C: 33
Groups were comparable at baseline |
|
|
N=1 died from pulmonary embolin samenwerking met 4 days after surgery, and 6 % withdrew for other reasons |
Pooled effect (fixed effects model): 0.86 (95% CI 0.60 to 1.24) favoring standard mesh Heterogeneity (I2): 12 % P=0.43
Outcome measure-3 Defined as chronic pain
Effect measure: Risk Ratio (95% CI): B: 0.59 (0.15 to 2.4)) C: 0.20 (0.01 to 3.77) D: 0.19 (0.06 to 0.54)
Pooled effect (fixed effects model): Risk Ratio= 0.27; 95%-BI: 0.12 to 0.60; I2=0% favoring standard mesh Heterogeneity (I2): 0% P=0.001
Outcome measure-4 Defined as hematoma
Effect measure: Risk ratio (95% CI): A: 0.52 (0.13, 2.16) B: 1.20 (0.63, 2.27) D: 0.65 (0.09, 4.51) E: 1.39 (0.20, 9.64)
Pooled effect (fixed effects model): |
|
|
|
|
|
|
|
|
1.00 (95% CI 0.59 to 1.70) |
|
|
favoring standard mesh |
|||||||
|
Heterogeneity (I2): 0% |
|||||||
|
P=0.99 |
|||||||
|
Outcome measure-5 |
|||||||
|
Defined as wound infection |
|||||||
|
Effect measure: Risk ratio |
|||||||
|
(95% CI): |
|||||||
|
A: 1.45 (0.73 to 2.90) |
|||||||
|
B: 1.14 (0.58 to 2.24) |
|||||||
|
D: 0.33 (0.03 to 3.52) |
|||||||
|
E: 0.32 (0.09 to 1.09) |
|||||||
|
Pooled effect (fixed effects |
|||||||
|
model): |
|||||||
|
0.96 (95% CI 0.63 to 1.48) |
|||||||
|
favoring standard mesh |
|||||||
|
Heterogeneity (I2): 47% |
|||||||
|
P=0.87 |
|||||||
|
Outcome measure-6 |
|||||||
|
Defined as stiff abdomen |
|||||||
|
and foreign body sensation. |
|||||||
|
Effect measure: Risk ratio |
|||||||
|
(95% CI): |
|||||||
|
A: 1.36 (1.01 to 1.84) |
|||||||
|
C: 0.33 (0.01 to 7.45) |
|||||||
|
D: 0.10 (0.04 to 0.27) |
|
|
|
|
|
|
|
Pooled effect (fixed effects model): 0.88 (95% CI 0.68to 1.15) favoring standard mesh Heterogeneity (I2): 92% P=0.36 |
|
Evidence table for intervention studies
|
Study reference |
Study characteristics |
Patient character Inclusion criteria: istics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Evans, 2015 |
Type of study:
A retrospective review Setting: Prospective pelvic floor databases from 5 institutions (3 in the United Kingdom: Oxford Pelvic Floor Centre, North Bristol National Health Service Trust Frenchay Hospital, and Queen Elizabeth Hospital; 1 from Australia: Royal Brisbane and Women’s Hospital; and 1 from Italy: University of Rome Tor Vergata).
Country: United Kingdom, Australia, Italy |
Inclusion
Patients undergoing laparoscopic ventral rectopexy
Exclusion criteria: Not mentioned N total at baseline: Intervention: 439 (19.9%) Control: 1764 (80.1%)
Important prognostic factors2:
93 % women
Median patient age mean ± SD |
Biological meshes
Material of the used biological meshes:
|
Synthetic meshes
Material of the used synthetic meshes
|
Median length of follow-up within the registry
Biological Meshes 26 months (range 0–68 months)
Synthetic Meshes 38 months (range 0–162 months) |
Synthetic mesh erosions N=42 (93%)
Biological mesh erosions N= 3 (7%)
Hazard ratio for the risk of erosion
Synthetic meshes were not significantly associated with an increased incidence of erosion compared with biological meshes |
Prognostische factoren zijn over de hele groep beschreven.
Er zijn geen effect- en spreidingmaten gepresenteerd |
|
|
|
59 ± 16 years (range, 15 to 82 years) |
|
|
|
|
|
|
Rickert, 2012 |
Type of study: Prospective, randomised, double-blinded multicentre study
Setting: Six hospitals throughout Germany participated in the study (DRK Hospital Clementinenhaus, Hannover; Helios Clinic, Northeim; Clinical Centre Aschaffenburg; University of Heidelberg; Hospital Salem, Heidelberg; and University Clinical Centre Mannheim).
Country: Germany
Source of funding: The trial was initiated and sponsored by Aesculap AG, Tuttlingen, Germany and conducted in cooperation with the contract research organisation (CRO) Dr. Med Lenhard & Partner GmbH, Overath. Germany. |
Inclusion criteria: Patients with an elective incisional hernia repair in sublay technique were included. Only patients over 18 years with vertical aponeurotic incision and an incisional hernia size of 3 cm or more were suitable for the study.
Exclusion criteria: Previous mesh repair at the same site, acute incarcerated hernia, additional surgical treatment at the same time and anticoagulation therapy.
N total at baseline: Intervention: 39 Control: 41
Important prognostic factors2: For example age ± SD: I: 63.26 ±9.54 C: 61.65 ± 12.2 |
Intervention
Partly absorbable mesh (PP-PG)
Treatment procedure:
Ultrapro Mesh (30×30 cm) manufactured by Johnson & Johnson. This mesh is made of polypropylene plus polyglecaprone (PP- PG) (~1:1), weight 65 g/m2, after absorption of PG weight 28 g/m2, pore size 1.9 to 2.2 mm.
Surgical procedure: The control group received the same surgical procedure as the intervention group |
Control
Non-absorbable mesh (PP)
Treatment procedure:
Optilene Mesh Elastic (30×30 cm) manufactured by B. Braun Aesculap. This mesh is made of pure polypropylene (PP) and is not absorbable, weight 48 g/m2, pore size 2.9 to 3.2 mm. |
Length of follow-up: Baseline, at discharge, 21 days after baseline, 6 months after baseline
Loss-to-follow- up: Intervention: N 8 (21 %) Reasons (describe) Consent withdrawn, death and loss to follow-up
Control: N 7 (17 %) Reasons (describe) Consent withdrawn, death, loss to follow-up and other reasons
Incomplete outcome data: Intention to treat principles |
Outcome measures and effect size (include 95%CI and p-value if available):
Complications:
There were no significant differences in complication rates (including bleeding, hernia recurrence, wound infection/haematoma, seroma formation) in both groups at all measurement points.
Bodily pain (SF-36):
Baseline to 21 days Difference in pain was significant higher in de the PP group P=0.04
Baseline to 60 days Difference in pain was significant higher in de the PP group P=0.04 |
Aantal man/vrouw wordt niet beschreven
Spreidingsmaten zijn niet gepresenteerd |
|
|
|
Sex: Not mentioned
Size of hernia > grade III
I: 70% C: 85 %
Groups were comparable at baseline on the main outcome measures |
|
|
were used in the analyses |
|
|
Risk of bias tabel
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Evans, 215 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Ricket, 2012 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Li, 2015 |
Yes |
Yes |
Yes |
No |
Unclear |
Unclear |
Yes |
Yes |
No |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 07-11-2018
Beoordeeld op geldigheid : 23-11-2018
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep wel/niet in stand gehouden. Uiterlijk in 2023 bepaalt het bestuur van de Nederlandse Vereniging voor Heelkunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse vereniging Voor Heelkunde is regiehouder van deze richtlijn Littekenbreuken en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn Littekenbreuken. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Autorisatie en commentaarfase
De conceptrichtlijn wordt aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (http://www.kennisinstituut.nl) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van het project is het ontwikkelen van een multidisciplinaire evidencebased richtlijn voor de diagnostiek en behandeling van patiënten met complexe littekenbreuken. Met behulp van deze richtlijn kan de praktijkvariatie worden teruggedrongen en kan de zorg aan deze patiëntengroep worden verbeterd. Een evidencebased richtlijn zal bijdragen aan meer uniformiteit in de behandeling en zal waardevol zijn om toegewijde chirurgen en andere gerelateerde zorgverleners te ondersteunen bij een effectieve en veilige behandeling.
Doelgroep
Deze richtlijn geldt voor alle volwassen patiënten met één of meerdere littekenbreuken in de buikwand tussen de laterale zijde van de musculus abdominis recti.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2016 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met Littekenbreuken te maken hebben.
Werkgroep
- Dr. S.W. (Simon) Nienhuijs, chirurg, werkzaam in het Catharina ziekenhuis, Eindhoven, NVvH (voorzitter)
- Dr. T.J. (Theo) Aufenacker, chirurg, werkzaam in het Rijnstate, Arnhem, NVvH
- E. (Elske) Berkvens, MSc, fysiotherapeut, werkzaam in het Elkerliek ziekenhuis, Helmond, KNGF
- Prof. dr. M.A. (Marja) Boermeester, chirurg, werkzaam in het AMC, Amsterdam, NVvH
- S. (Sandra) Janssen MSc, verpleegkundig specialist, werkzaam in het Elkerliek ziekenhuis, Helmond, V&VN
- Dr. R.K.J. (Rogier) Simmermacher, chirurg, werkzaam in het UMC, Utrecht, NVvH
- Dr. T.S. (Tammo) de Vries Reilingh, chirurg, werkzaam in het Elkerliek ziekenhuis, Helmond, NVvH
- P. (Pieter) Zwanenburg MSc., arts onderzoeker, werkzaam in het AMC, Amsterdam
Met ondersteuning van:
- Dr. W.A. van Enst, senior-adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- H. Kooijmans, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- D.P. Gutierrez, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Aufenacker |
Chirurg |
Penningmeester DHS/ werkgroep buikwand chirurgie van NVGIC. Lid Steering committee Herniasurge: International guidelines for groin hernia management |
- |
Geen |
|
Berkvens |
Fysiotherapeut |
Extern beoordelaar scripties bij Fontys Hogeschool opleiding Fysiotherapie |
- |
Geen |
|
Boermeester |
GE Chirurg |
Advisory board member and/of speaker for Acelity/KCI, Bard, Johnson&Johnson Vice-president van |
Grants en pending grants voor investigator-initiated onderzoek (geen contract onderzoek) van Baxter, Ipsen, Bard, Acelity/KCI, Mylan, Johnson&Johnson, LifeCell/Allergan |
Geen |
|
|
|
Surgical Infection Society Europe |
|
|
|
Enst, van |
Senior-adviseur |
Lid van GRADE working group / Dutch GRADE Network |
- |
Geen |
|
Janssen |
Verpleegkundig Specialist wondzorg |
Docent opleiding wondverpleegkundige Zorgacademie Radboud UMC en Zorgacademie Erasmus MC Docent opleiding wondconsulent Zorgacademie Radboud UMC Bestuurslid V&VN Lid Wondplatform Nederland |
- |
Geen |
|
Nienhuijs |
Chirurg |
DHS/ voorzitter werkgroep buikwand chirurgie van NVGIC |
Deelname hernia umbilcalis/epigastrica studie zowel Medtronic als bij Johnson & Johnson. |
Geen |
|
Simmermacher |
Chirurg en Hoofd afdeling Heelkunde |
- |
- |
Geen |
|
Vries, de Reilingh |
Gastro- Intestinaal chirurg en Chirurg Oncoloog |
- |
Multicenter studies geinitieerd elders: Phasix trial, Sanics II trial, Close-up trial |
Geen |
|
Zwanenburg |
Promovendus / onderzoeker |
- |
Promotie traject gefinancierd vanuit een grant voor het AMC als "center of expertise" van Acelity/KCI |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een focusgroep. Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. Tijdens de oriënterende zoekactie werd gezocht op literatuur naar patiëntenperspectief (zie Strategie voor zoeken en selecteren van literatuur).
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft geen interne kwaliteitsindicatoren ontwikkeld maar doet suggesties wat geregisteerd kan worden.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidencebased richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door Nederlandse vereniging voor Heelkunde, Koninklijk Nederlands Genootschap Fysiotherapie, Verpleegkundigen & Verzorgende Nederland, Kenniscentrum Wondzorg, Kenniscentrum Wondzorg, Zorgverzekeraars Nederland via een Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen Nice en Sign richtlijnen, systematische reviews via Medline (OVID). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE- methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE- methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Randvoorwaarden.
Indicatorontwikkeling
Er werden geen interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
van Everdingen JJE, Burgers JS, Assendelft WJJ, et al. Evidence-based richtlijnontwikkeling. Bohn Stafleu Van Loghum. 2004.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit.https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID) 1995 – februari 2016 |
(exp Rectal Prolapse/ or ((rectal or anal or uterus or vaginal or vault) adj3 prolaps*).ti. or rectocele*.ti. or enterocele*.ti. or proctocele*.ti. or sigmoidocele*.ti. or exp Incisional Hernia/ or exp Hernia, Ventral/ or exp Hernia, Umbilical/ or (hernia* adj2 (incision* or cicatrical or ventral or umbilical or epigastrica)).ti. or proctopex*.ab,ti. or rectopex*.ab,ti.) |
679 |
|
|
AND (exp Surgical Mesh/ or mesh.ti. or xenograft*.ti. or ((xenogenic* or polypropyl* or synthetic*) adj2 graft*).ti.) |
|
|
|
limit to (yr="1995 -Current" and (dutch or english)) |
|
|
|
not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) |
|
|
|
Gebruikte filters: |
|
|
|
Systematische reviews: (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) |
|
|
|
RCTs: (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) |
|
|
|
= 341 (340 uniek) |
|
|
Embase (Elsevier) |
('rectum prolapse'/exp/mj OR ((rectal OR anal OR uterus OR vaginal OR vault) NEAR/3 prolaps*):ti OR rectocele*:ti OR enterocele*:ti OR proctocele*:ti OR sigmoidocele*:ti OR 'incisional hernia'/exp/mj OR 'abdominal wall hernia'/exp/mj OR 'umbilical hernia'/exp/mj OR ((incisional OR cicatrical OR ventral OR umbilical OR epigastrica) NEAR/2 hernia*):ti OR 'proctopexy'/exp OR proctopex*:ti OR rectopex*:ti) |
|
|
|
AND ('surgical mesh'/exp/mj OR mesh:ti OR xenograft*:ti OR ((xenogenic OR polypropyl* OR synthetic*) NEAR/2 graft*):ti) |
|
|
|
AND ((dutch)/lim OR (english)/lim) AND (embase)/lim AND (1995-2016)/py NOT 'conference abstract':it |
|
|
|
Gebruikte filters: |
|
|
|
Systematische reviews: 'meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de |
|
|
|
RCTs: 'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti NOT 'conference abstract':it |
|
|
|
= 490 (485 uniek) |
|
Exclusietabel
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Smart, 2013 |
Systematic review van case-series |
|
Abed, 2011 |
Vaginale prolaps -> onderwerp wordt beschreven in richtlijn ‘prolaps’ |
|
Ladurner, 2011 |
Opgenomen in review Li, 2015 |
|
Seiler, 2010 |
Geen relevante uitkomstmaten |
|
Hollinksy, 2010 |
Proefdierstudie |
|
Fortelyn, 2010 |
Geen vergelijkende studie |
|
Schoenmaeckers, 2009 |
Geen vergelijking van twee materialen |
|
Berger, 2009 |
Geen vergelijking van twee materialen |
|
Vuilleumier, 2006 |
Geen origineel onderzoek, reactie op Conze 2005 |
|
Conze, 2006 |
Geen origineel onderzoek, reactie op Vuilleumier |
|
Schmidbauer, 2005 |
Opgenomen in review Li, 2015 |
|
Conze, 2005 |
Opgenomen in review Li, 2015 |
|
Korenkov, 2002 |
Focust op operatietechnieken i.p.v. materiaal matjes. |
|
Quarmby, 2001 |
Case serie, geen vergelijking van twee materialen. |
