Materiaal meshes - Gecontamineerde breuken
Uitgangsvraag
Welke mesh dient gebruikt te worden bij een gecontamineerde buikwandreconstructie bij patiënten met een ventrale hernia cicatricalis?
Aanbeveling
Houdt bij het kiezen van het type mesh rekening met kenmerken van zowel patiënt, littekenbreuk alsook de gekozen operatietechniek, waarbij de mate van contaminatie, loss of domain, en de positionering van de mesh belangrijk zijn.
Houdt bij het kiezen tussen biologische of synthetische mesh tevens rekening met wat voor de patiënt belangrijke uitkomstmaten zijn, omdat deze keuze een balans is tussen de kans op recidief dan wel meshinfectie.
Overweeg bij procedures met (ernstige) contaminatie een niet-gecrosslinkte biologische mesh van varkenshuid.
Wanneer geen biologische mesh voorhanden is kan men bij gecontamineerde littekenbreuken een macroporeuze polypropyleen of polyester mesh of een biosynthetische mesh gebruiken, die dan bij voorkeur extraperitoneaal in de retromusculaire positie wordt geplaatst.
Overwegingen
Bij een schaarste aan vergelijkend en gebrek aan gerandomiseerd onderzoek en heterogene studiepopulaties is het op grond van de literatuur niet mogelijk een simpel en eenduidig antwoord te geven op de vraag welke mesh zich het beste leent voor gecontamineerde littekenbreuken. In een poging deze kwestie op te helderen is een aanvullende search uitgevoerd naar studies die de contaminatiegraad en de gebruikte mesh ten tijde van de operatie rapporteerden. Hieruit werden 22 publicaties geselecteerd.
Ondanks dat de kwaliteit van de literatuur laag is en er sprake is van matige rapportage van belangrijke uitkomstmaten, lijken een aantal zaken uit de literatuur naar voren te komen. Zo ziet men bij gecrosslinkte biomesh relatief vaak noodzaak tot verwijdering in verband met infectieuze complicaties, hetgeen impliceert dat deze soort mesh niet geschikt is voor gebruik bij gecontamineerde procedures. Bij het gebruik van niet- gecrosslinkte biologische mesh van varkenshuid is er zo goed als nooit noodzaak tot het verwijderen van de mesh in verband met infectieuze complicaties. Deze soort mesh leent zich goed dus voor (ernstig) gecontamineerde procedures met intraperitoneale plaatsing van de mesh.
Bij een extraperitoneaal geplaatste mesh worden met macroporeus polypropyleen of biosynthetische mesh tevens acceptabele resultaten behaald, ongeacht de aanwezigheid van contaminatie, echter is ook deze evidence van zeer lage kwaliteit. Het gebruik van synthetische mesh bij gecontamineerde procedures blijft gepaard gaan met een verhoogd risico op meshinfectie, hetgeen zich nog lang na de operatie kan presenteren. Dit risico moet men dan ook afwegen tegen de verhoogde kans op recidieven dat gepaard lijkt te gaan met het gebruik van niet-gecrosslinkte biologische mesh van varkenshuid.
Wat opvalt is dat zo goed als alle studies retrospectieve, niet-vergelijkende studies betreffen en er sprake is van een matige uitkomstrapportage, waarbij essentiële uitkomstmaten als bijvoorbeeld het aantal postoperatieve wondcomplicaties of meshinfecties vaak niet gerapporteerd worden. Ook is de lengte van follow-up vaak beperkt, terwijl dit relevant is met het oog op meshinfecties, die zich nog lang na de operatie kunnen presenteren (>17 jaar is beschreven) (Shubinets, 2017).
Ook wordt de literatuur gekenmerkt door onder meer selectiebias, waarbij er voor uitgesproken gecontamineerde defecten (CDC IV) meer literatuur beschikbaar is over biologische mesh dan over de alternatieven (Atema, 2016).
Wat tevens meespeelt is dat naast de gekozen mesh, er vele factoren zijn die van invloed zijn op de uitkomsten na een buikwandreconstructie. Door de heterogeniteit aan gebruikte technieken is het dan ook moeilijk een valide vergelijking te doen. Het is dan ook belangrijk dat bij de keuze van het type mesh, de karakteristieken van zowel de patiënten, de breuk en de operatietechniek mee te wegen. Ook patiënten kunnen hierbij hun voorkeur aangeven. Een biomesh lijkt voordelen te hebben wanneer gekeken wordt naar het risico op heroperatie. Echter, de prijs van biomeshes is hoger. Het is aannemelijk dat dit opweegt tegen de kosten van een voorkomen heroperatie.
Onderbouwing
Achtergrond
Lange termijn follow-up (gemiddeld meer dan zes jaar) van een gerandomiseerde studie laat zien dat bij een reconstructie zonder augmentatie met synthetische mesh het aantal recidieven bijna twee keer zo hoog is (63% versus 32%, p<0,001) (Burger, 2004).
Alhoewel het gebruik van synthetische mesh het aantal recidieven aanzienlijk heeft verlaagd, werd het gebruik synthetische meshes geassocieerd met complicaties als meshinfecties, erosies, adhesies en fistels. Aan adhesie en infectie gerelateerde complicaties kunnen zich daarbij nog lang na de oorspronkelijke operatie presenteren, bijvoorbeeld als een meshinfectie of obstructie (Shubinets, 2017).
Met het oog op infectieuze complicaties zijn chirurgen over het algemeen dan ook terughoudend geweest in het plaatsen van synthetische mesh in een gecontamineerd veld, hetgeen leidde tot de introductie van alternatieven als de biologische en later ook biosynthetische meshes. Men dient zich echter te realiseren dat ook binnen elk van deze drie groepen (synthetisch, biosynthetisch en biologisch) er aanzienlijke verschillen kunnen zijn ten aanzien van het profiel van een specifieke mesh binnen die groep. Elk type mesh, los van tot welk groep deze behoort, heeft dus zijn eigen profiel, hetgeen dat type mesh meer of minder geschikt maakt voor een bepaalde klinische situatie. Dit profiel wordt niet alleen bepaald door het soort materiaal, maar tevens door de fysieke structuur van de mesh (bijvoorbeeld de porositeit). De kwestie welk type mesh het meest aangewezen is bij gecontamineerde procedures is nog niet beslecht: er worden acceptabele resultaten behaald met zowel biologische mesh (Itani, 2012), biosynthetische mesh(Buell, 2017; Rosen, 2017), als polypropyleen (mits men deze in een hiervoor geschikte positie zoals bijvoorbeeld de retromusculaire positie plaatst)(Birolini, 2016; Majumder, 2016).
Conclusies / Summary of Findings
|
- GRADE |
Bij niet-gecrosslinkte biologische mesh van varkenshuid is er ondanks aanwezigheid van contaminatie of infectieuze complicaties zelden noodzaak tot het verwijderen van de mesh
Bronnen (Atema, 2017; Chamiek, 2017; Itani, 2012; Krpata, 2013; Majumder, 2016; Sbitany, 2015; Singh, 2014; Skipworth, 2014) |
Samenvatting literatuur
Beschrijving studies
22 onderzoeken zijn opgenomen in de aanvullende literatuuranalyse voor gecontamineerde breuken, waaronder 4 prospectieve cohorten (Itani, 2012; Limura, 2017; Rosen, 2017; Sbitany, 2015) en 18 retrospectieve studies, waaronder 15 retrospectieve cohorten (Abdelfatah, 2015; Atema, 2017; Basta, 2015; Birolini, 2015; Birolini, 2000; Carbonell, 2013; Giordano, 2015; Heartsill, 2005; Ion, 2013; Krpata, 2013; Madani, 2017; Shahan, 2016; Singh, 2014; Skipworth, 2014; Slater, 2015) en drie retrospectieve vergelijkende studies (Buell, 2017; Chamieh, 2017; Majumder, 2016). Er werden geen prospectieve gerandomiseerde studies geïdentificeerd. Wat opvalt is dat het veel niet-vergelijkende studies betreffen en er vaak sprake is van een matige uitkomstrapportage, waarbij essentiële uitkomstmaten als bijvoorbeeld het aantal postoperatieve wondcomplicaties of meshinfecties vaak niet gerapporteerd worden (of alleen voor een cohort met daarin ook schone breuken). Ook is de lengte van follow-up vaak beperkt, terwijl dit relevant is met het oog op meshinfecties, die zich nog lang na de operatie kunnen presenteren (>17 jaar is beschreven) (Shubinets, 2017). Ook wordt de literatuur gekenmerkt door onder meer selectiebias, waarbij er voor uitgesproken gecontamineerde defecten (CDC IV) meer literatuur beschikbaar is over biologische mesh dan over de alternatieven (Atema, 2016).
Biologische mesh van niet-gecrosslinkte varkenshuid
Itani (2012) betrof een prospectieve studie over 80 patiënten (CDC II 39/80 (49%), CDC III 39/80 (49%), CDC IV 2/90 (2%)) waarvan 80/80 (100%) een biomesh van niet-gecrosslinkte varkenshuid kregen. Het defect was gemiddeld 236 cm2. Bij 52/80 (65%) werd een anterieure component separatie gedaan. Bij 64/80 (80%) kon de linea alba gereconstrueerd worden. Follow-up was bij alle patiënten 24 maanden. 28/80 (35%) van de patiënten ontwikkelde een wondinfectie, 2/80 (3%) van de patiënten ontwikkelde een fistel. Preoperatief had 9% (7/80) van de patiënten een fistel. Geen enkele patiënt ontwikkelde een meshinfectie of noodzaak tot het verwijderen van de mesh. 22/80 (28%) van de patiënten ontwikkelde een recidief littekenbreuk 24 maanden follow-up. Van de 22 recidieven waren er 7 waarbij heroperatie voor het recidief als geïndiceerd werd beschouwd gedurende de follow-up van 24 maanden.
Krpata (2013) betrof een retrospectieve studie over 37 patiënten (CDC III 27/37 (73%), CDC IV 10/37 (27%)) waarbij bij een groot deel een niet-gecrosslinkte biologische mesh van varkenshuid (27/37) in de retromusculaire positie geplaatst werd; de overige patiënten hadden een andere soort biomesh. Het defect was gemiddeld 426 cm2. Bij 35/37 (94.6%) werd een posterieure component separatie gedaan. Bij 33/37 (89%) kon de linea alba gereconstrueerd worden. 24/37 (65%) van de patiënten ontwikkelde een wondinfectie, één patiënt ontwikkelde een fistel (2.7%). Preoperatief hadden alle patiënten een fistel (37/37). Het aantal meshinfecties of de noodzaak tot het verwijderen van de mesh werd niet gerapporteerd. Het aantal recidieven was 12/37 (32%) na een gemiddelde follow-up van 20 maanden (range 3 tot 73 maanden).
Sbitany (2015) betrof een prospectieve studie over 41 patiënten (CDC II 36/41 (87.8%), CDC IV 5/41 (12.2%)) waarbij 41/41 (100%) een niet-gecrosslinkte biomesh van varkenshuid als intraperitoneale underlay geplaatst kregen. Het defect was gemiddeld 384 cm2. Bij 41/41 (100%) van de patiënten werd een perforator-sparende, anterieure component separatie gedaan. Bij 39/41 (95%) van de patiënten kon de linea alba gereconstrueerd worden. De gemiddelde follow-up betrof 25 maanden. 6/41 (14.6%) van de patiënten ontwikkelde een wondinfectie; geen van de patiënten een meshinfectie. Fistelvorming werd niet gerapporteerd. Bij 1/41 van de patiënten werd de mesh verwijderd. In 1/36 (2.7%) van de CDC II en 4/5 (80%) van de CDC IV werd een recidief littekenbreuk na een gemiddelde follow-up van 25 maanden. Bij 3/41 (7.3%) was er noodzaak tot heroperatie.
Singh (2014) betrof een retrospectieve studie over 58 patiënten. De CDC klasse wordt niet gerapporteerd, wel de VHWG gradatie (VHWG II 31/58 (54%), VHWG III 14/58 (24%), VHWG IV 13/58 (22%). Bij alle patiënten werd een niet-gecrosslinkte biomesh van varkenshuid als subcutane onlay geplaatst. De gemiddelde defectgrootte werd niet gerapporteerd. Bij 58/58 (100%) werd een anterieure component separatie gedaan en kon de linea alba gereconstrueerd worden. De gemiddelde follow-up was 13.7 maanden (tussen 4.5 tot 23.7). Bij 3/14 (24%) van de VHWG III en bij 3/13 (22%) van de VHWG IV ontwikkelde zich een wondinfectie. Fistelvorming of meshinfectie werd niet gerapporteerd. Er was geen noodzaak tot het verwijderen van de mesh. Bij 1/14 (7.1%) van de VHWG III en bij 1/13 (7.7%) van de VHWG IV trad er een recidief littekenbreuk op na een gemiddelde follow-up van 13.7 maanden.
Skipworth (2014) betrof een retrospectieve studie over 58 patiënten. De CDC klasse wordt niet gerapporteerd, wel de VHWG gradatie (VHWG II 28/58 (48%), VHWG III 19/58 (33%), VHWG IV 11/58 (19%). Bij alle patiënten werd een niet-gecrosslinkte biomesh van varkenshuid als intraperitoneale underlay geplaatst. De gemiddelde defectgrootte werd niet gerapporteerd, noch het aantal patiënten waarbij een component separatie werd gedaan. Wel rapporteerden ze een anterieure component separatie te doen waar dit nodig werd geacht en werd bij 52/58 (90%) de linea alba gereconstrueerd. De gemiddelde follow-up was 17 maanden (tussen 2 en 45). In het gehele cohort ontwikkelde 15/58 (25%) een wondinfectie (niet gerapporteerd per VHWG graad). 3 (15.7%) van de VHWG III ontwikkelden een recidief littekenbreuk na een gemiddelde follow-up van 17 maanden. Bij één patiënt was er noodzaak tot heroperatie.
Atema (2017) betrof een retrospectieve studie over 80 patiënten. De CDC klasse werd niet gerapporteerd, wel de VHWG gradatie (VHWG III 66/80 (83%), VHWG IV 14/80 (18%)) en dat alle patiënten een gecontamineerde procedure ondergingen. Bij het merendeel van de patiënten werd de niet-gecrosslinkte biomesh van varkenshuid als intraperitoneale underlay geplaatst (67/80 (84%)). De mediane defectgrootte was 143 cm2 (IQR 70 tot 256). Bij 55/80 (69%) van de patiënten werd een anterieure component separatie verricht. De linea alba kon bij 59/80 (74%) gereconstrueerd worden. De mediane follow-up was 7 maanden (IQR 4 tot 15). 36/80 (45%) van de patiënten ontwikkelde een wondinfectie. 7/80 (9%) ontwikkelde een postoperatief een fistel. Preoperatief had 62,5% (50/80) een fistel. Er was geen meshinfectie of noodzaak tot het verwijderen van de mesh. 10/76 (13.2%) ontwikkelde een recidief na een follow-up van mediaan 7 maanden. Bij 3/80 (4%) van de patiënten was er noodzaak tot heroperatie in verband met wondinfectie en fistelvorming.
Biologische mesh van gecrosslinkte varkenshuid
Abdelfatah (2015) betrof een retrospectieve studie over 65 patiënten (CDC I 32/65 (49%), CDC II 21/65 (32%), CDC III 8/65 (12%), CDC IV 4/65 (6%) waarbij een gecrosslinkte biologische mesh van varkenshuid geplaatst werd als subcutane onlay 10/65 (15.4%), 6/65 (9.2%) als inlay, 47/65 (72.3%) retromusculair, en 2/65 (3.1%) als sandwich (retromusculair en onlay). Alle defecten waren groter dan 10x7 cm2. Het aantal component separaties is niet gerapporteerd. Bij 31/65 (47.7%) kon de linea alba niet gereconstrueerd worden. Alle patiënten hadden een follow-up van meer dan vijf jaar. 4/31 (12.9%) van CDC I, 5/21 (23.8%) van CDC II, 4/8 (50%) van CDC III, en 2/4 (50%) van
CDC IV ontwikkelden een wondinfectie. Fistelvorming werd niet gerapporteerd. 8/30 (27%) van CDC I, 4/19 (21%) van CDC II, 2/7 (29%) van CDC III, en 1/3 (33.3%) van CDC IV
ontwikkelden een meshinfectie met noodzaak tot het verwijderen van (een deel van) de mesh. 19/30 (63%) van CDC I, 12/19 (63%) van CDC II, 5/7 (71%) van CDC III, en 3/3 (100%)
van CDC IV ontwikkelde een recidief littekenbreuk na een follow-up van meer dan vijf jaar.
Basta (2015) betrof een retrospectieve studie over 37 patiënten (CDC I 9/37 (24,3%), CDC II 16/37 (43,2%), CDC III 7/37 (18,9%), CDC IV 5/37 (13,5%)), waarbij een gecrosslinkte biologische mesh van varkenshuid geplaatst werd als intraperitoneale underlay (100%). Het defect was gemiddeld 322 cm2. Bij alle patiënten werd een anterieure component separatie gedaan. Alle reconstructies betrof een overbrugde reconstructie waar de linea alba niet gereconstrueerd kon worden. De mediane follow-up was 13 maanden. 8/37 (21%) van de patiënten ontwikkelde een wondinfectie. Er werd 0 fistelvorming of meshinfectie gerapporteerd. Het aantal recidieven was 1/9 (11,1%) voor CDC I, 2/16 (12,5%) voor CDC II, 2/7 (28,6%) voor CDC III, en 2/5 (40%) voor CDC IV na een mediane follow-up van 13 maanden. Bij 9/37 (24.3%) van de patiënten was er noodzaak tot heroperatie.
Giordano (2015) betrof een retrospectieve studie over 109 patiënten (CDC I 37/109 33.9%, CDC II 43/109 (39.4%), CDC III 21/109 (19.3%) en CDC IV 8/109 (7.4%) waarbij een
gecrosslinkte biologische mesh van varkenshuid geplaatst werd als subcutane onlay 30/109 (27.5%), 12/109 (11%) als inlay, 30/109 (27.5%) retromusculair, en 42/109 (39.4%) als intraperitoneale underlay. De gemiddelde grootte van het defect werd niet gerapporteerd. Bij 26/109 (23.9%) van de patiënten werd een anterieure component separatie verricht. Bij 74/109 (69.2%) kon de linea alba gereconstrueerd worden. Mediane follow-up was 25.7 maanden (tussen 13-102). 15/109 (13.8%) van de patiënten ontwikkelde een wondinfectie. 3/109 (2.8%) ontwikkelde een fistel. Het aantal meshinfecties werd niet gerapporteerd, noch het aantal patiënten waarbij er noodzaak was tot het verwijderen van de mesh. 10/37 (27%) van de CDC I, 8/42 (18.6%) van de CDC II, 2/21 (9.5%) van de CDC III, en 0/8 (0%) van de CDC IV ontwikkelde een recidief littekenbreuk na een mediane follow-up van 25.7 maanden. Het aantal heroperaties werd niet gerapporteerd.
Limura (2017) (Limura & Giordano, 2017) betrof een prospectieve studie over 56 patiënten (CDC I 18/56 (32%), CDC II 11/56 (20%), CDC III 11/56 (20%), CDC IV 16/56 (29%))
waarbij een gecrosslinkte biologische mesh van varkenshuid geplaatst werd als subcutane onlay 1/56 (2%), retromusculair 5/56 (9%), en intraperitoneale underlay 50/56 (89%). Het mediane defect was 625 cm2 (tussen 70-900). Bij 10/56 (17.9%) van de patiënten werd een component separatie verricht (ACS 9/56 (16.1%), PCS 1/56 (1.8%)). Bij 33/56 (59%) van de patiënten kon de linea alba gereconstrueerd worden. De gemiddelde follow-up was 44 maanden (tussen 4-123). 12/56 (22%) van de patiënten ontwikkelde een wondinfectie. 6/56 (11%) van de patiënten ontwikkelde een fistel. Meshinfectie of verwijdering werd niet gerapporteerd. 14/56 (26%) van de patiënten ontwikkelde een recidief na een gemiddelde follow-up van 44 maanden. 5/56 (8.9%) had noodzaak tot heroperatie.
Synthetische mesh
Ion (2013) betrof een retrospectieve studie over 56 patiënten (CDC II) waarvan 50/56 (89%) polypropyleen of ePTFE in de retromusculaire positie hadden gekregen, en 6/56 (10.7%) intraperitoneale plaatsing. De defectgrootte werd niet gerapporteerd, noch in hoeveel gevallen een component separatie gedaan werd of de linea alba gereconstrueerd kon worden. 46/56 (82%) van de patiënten had een follow-up van meer dan 1 jaar. Hierbij ontwikkelde 2/56 (3.6%) een oppervlakkige wondinfectie en 2/56 (3.6%) een diepe wondinfectie. 0 patiënten ontwikkelde een fistel, meshinfectie, of noodzaak tot het verwijderen van de mesh. Het aantal recidieven werd niet gerapporteerd.
Birolini (2015) betrof een retrospectieve studie over 41 patiënten (CDC IV) waarvan 40/41 (97.6%) macroporeus polypropyleen in de subcutane onlay positie had gekregen, en 1/41 (2.4%) preperitoneale plaatsing. Al deze patiënten betrof patiënten met een meshinfectie. De defectgrootte werd niet gerapporteerd, noch in hoeveel gevallen een component separatie gedaan werd of de linea alba gereconstrueerd kon worden. De gemiddelde follow-up was 74 maanden (tussen de 12 en de 174). Hierbij ontwikkelde 6/41 (14.6%) een kleine wondinfectie en 5/41 (12%) een grote wondinfectie. Één (2.4%) patiënt ontwikkelde een fistel met noodzaak tot het verwijderen van de mesh. Bij één patiënt was het nodig de mesh deels te verwijderen. 3/41 (7.3%) van de patiënten ontwikkelde een littekenbreuk, 2/41 (4.9%) van de patiënten had noodzaak tot heroperatie.
Birolini (2000) betrof een retrospectieve studie waarbij 20 patiënten (CDC II) een polypropyleen onlay mesh kregen na concomitante colorectale chirurgie. De defectgrootte werd niet gerapporteerd. Met een follow-up tussen 1 en 7 jaar ontwikkelde 3/20 (15%) een wondinfectie. Géén van de patiënten ontwikkelde een meshinfectie of noodzaak tot het verwijderen van de gehele mesh (één mesh werd partieel verwijderd). Het aantal fistels werd niet gerapporteerd. Géén van de patiënten ontwikkelde een recidief.
Carbonell (2013) betrof een retrospectieve studie over 100 patiënten (CDC II 42/100, CDC III 58/100) met allemaal macroporeus polypropyleen in de retromusculaire positie. Het defect was gemiddeld 246 cm2. Bij 49/100 (49%) werd een component separatie (5/100 (5%) ACS, 44/100 (44%) PCS). De linea alba kon in 91/100 (91%) van de gevallen gereconstrueerd worden. Na een follow-up van gemiddeld 10.8 maanden (tussen de 1-63 maanden) ontwikkelde 3/42 CDC II en 11/58 (19%) van de CDC III een wondinfectie. Één van de patiënten ontwikkelde een fistel met noodzaak tot het verwijderen van de mesh. Bij 3 andere patiënten moest er tevens mesh verwijderd worden (4/100, 4%). 3/42 (7.1%) van de CDC II en 4/58 (6.8%) van de CDC III patiënten ontwikkelde een recidief.
Heartsill (2005) betrof een retrospectieve studie over 80 patiënten (CDC I 22/80 (27.5%), CDC II 33/80 (41.3%), CDC III 25/80 (31.3%) met plaatsing van ePTFE (67/80 83%) of polypropyleen (10/80 (13%) intraperitoneaal. Het defect was gemiddeld 7.4 cm in diameter. Bij alle patiënten kon de linea alba gereconstrueerd worden zonder component separatie. Gemiddelde follow-up was 30 maanden. 13 patiënten in het gehele cohort ontwikkelden een wondinfectie, 0% een fistel, 3/80 (3.8%) een meshinfectie met noodzaak tot het verwijderen van de mesh. 4/22 (18.1%) van de CDC I, 4/33 (12.1%) van de CDC II, 4/25 (16%) van de CDC III ontwikkelden een recidief littekenbreuk.
Slater (2015) betrof een retrospectieve studie over 137 patiënten (CDC I 56/137 (40.9%), CDC II 34/137 (24.8%), CDC III 19/137 (13.9%), CDC IV 28/137 (20.4%)) met plaatsing van
verschillende soorten polypropyleen (licht tot zwaar) in verschillende posities (onlay 19/137 (13.9%), retrorectus 100/137 (73%), intraperitoneaal 23/137 (16.9%), sandwich intraperitoneaal/onlay 5/137 (3.6%)). Het defect was gemiddeld 236 cm2. Al deze patiënten hadden een anterieure component separatie ondergaan, maar er werd niet gerapporteerd hoe vaak de linea alba gereconstrueerd kon worden. Mediane follow-up was 15 maanden (tussen de 1 en 127). Hierbij had 5/56 (9.1%) van de CDC I, 5/34 (14.7%) van de CDC II, 3/19 (15.8%) van de CDC III, en 9/28 (32.1%) van de CDC IV een wondinfectie. 5/137 (3.6%) in het gehele cohort ontwikkelde een fistel, en 4/137 (2.9%) een meshinfectie. Bij 3/137 (2.2%) was er noodzaak tot het verwijderen van de mesh. 24/137 (17.5%) van de patiënten in dit cohort had een recidief, en 13/137 (9.5%) noodzaak tot heroperatie.
Shahan (2016) betrof een retrospectieve studie over 22 patiënten (CDC II 21/22 (95.5%), één CDC III) die macroporeus polypropyleen als onlay kregen. Het defect was gemiddeld 150 cm2. Er werd niet gerapporteerd of er gebruik werd gemaakt van een component separatie of hoe vaak de linea alba gereconstrueerd kon worden. Gemiddeld was de follow-up 13.8 maanden. Infectieuze complicaties werden niet gerapporteerd, alleen dat er geen recidief of noodzaak tot het verwijderen van de mesh was.
Retrospectieve cohorten van zowel biologische als synthetische meshes
Er werden twee studies geïdentificeerd die cohorten met het gebruik van synthetische mesh vergeleken met biologische mesh bij meer dan twintig gecontamineerde littekenbreuken (Chamieh, 2017; Majumder, 2016).
Chamieh (2017) betrof een retrospectieve studie. Het biologische cohort betrof 34 patiënten waarbij verschillende soorten biologische mesh gebruikt werd (grotendeels niet-gecrosslinkte biomesh van varkenshuid, 19/34 (64.9%)). 17/34 (50%) betrof CDC II, 10/34 (29.4%) CDC III, en 7/34 (20.6%) CDC IV. De mesh werd bij 6/34 (17.6%) als subcutane onlay geplaatst, bij 10/34 (29.4%) retromusculair, en bij 18/34 (53%) als intraperitoneale underlay. Het defect was minstens 100 cm2. Bij alle patiënten werd een vorm van component separatie gedaan, maar welke variant werd niet gerapporteerd. De follow-up bedroeg gemiddeld 11.3 maanden (allen >5 maanden). De helft van de patiënten, 17/34 (50%) ontwikkelde een wondinfectie. 1/34 (2.9%) ontwikkelde een fistel, waarbij 17,6% (6/34) preoperatief een fistel had. Meshinfectie was niet gerapporteerd, bij één mesh 1/34 (2.9%) was er noodzaak tot verwijdering. Het aantal recidieven werd niet gerapporteerd. Bij 9/34 (26.5%) van de patiënten was er noodzaak tot heroperatie.
Het synthetische cohort betrof 24 patiënten waarbij polypropyleen geplaatst werd als onlay 3/24 (12.5%), of retromusculair 21/24 (87.5%). 10/24 (41.7%) was CDC II, 8/24 (33.3%) CDC III, en 6/24 (25%) CDC IV. Het defect was minstens 100 cm2. Bij alle patiënten werd een vorm van component separatie gedaan, maar welke techniek werd niet gerapporteerd. Bij 7/24 (24%) van de patiënten ontwikkelde zich een wondinfectie, bij nul patiënten een fistel. Meshinfectie werd niet gerapporteerd, maar er was geen noodzaak tot het verwijderen van mesh. Het aantal recidieven werd niet gerapporteerd. Het aantal heroperaties was 8/24 (33,3%). Omdat dit geen gerandomiseerde studie betreft en bijvoorbeeld de soort component separatie niet gerapporteerd werd moet men oppassen met conclusies trekken uit deze studie. Zo verschillen de cohorten aanzienlijk ten aanzien van de positie waar de mesh geplaatst werd, waarvan bekend is dat dit resultaten beïnvloed (Holihan, 2016).
Majumder (2016) is een retrospectieve studie waarbij biologische mesh met synthetische mesh werd vergelijken bij gecontamineerde defecten (CDC II-III). Het biologische cohort betrof 69 patiënten waarbij een ”porcine xenograft” (vreemd genoeg niet nader omschreven) gebruikt werd. 41/69 (59,5%) betrof CDC II, 28/69 (40,5%) CDC III. 68/69 (98.6%) werd retromusculair geplaatst, en 1/69 (1,4%) als intraperitoneale underlay. Het defect was gemiddeld 343 cm2. Bij 61/69 (88,4%) werd een component separatie gedaan, grotendeels posterieur (PCS 56/69 (81,2%), ACS 5/69 (7,2%)) De gemiddelde follow-up was 21,5 maanden. 22/69 (31,9%) van het gehele cohort ontwikkelde een wondinfectie. Het aantal fistels of meshinfecties werd niet gerapporteerd. Bij 2/69 (2,9%) was er noodzaak tot verwijdering van de mesh. Bij 15/69 (26,3%) was er een recidief van de littekenbreuk.
Het synthetische cohort betrof 57 patiënten waarbij bij 48/57 (84,2%) midweight macroporeus polypropyleen, en bij 4/57 (7,0%) heavyweight microporeus polypropyleen geplaatst werd. Bij de overige patiënten werd polyester 5/57 (8,8%) geplaatst. Bijna alle mesh werd retromusculair geplaatst 56/57 (98,2%), met één onlay 1/57 (1,8%). 37/57 (64,9%) was CDC II, 20/57 (34,1%) CDC III. Het defect was gemiddeld 356 cm2. Bij 51/57 (89,5%) werd een component separatie gedaan (PCS 49/56 (87.5%), ACS 2/56 (3,6%). De gemiddelde follow-up was 18,4 maanden. 7/57 (12,3%) van de patiënten ontwikkelde een wondinfectie. Het aantal fistels of meshinfecties werd niet gerapporteerd. 1/57 (1,8%) van de meshes moest worden verwijderd. Bij 4/57 (8,9%) was er een recidief van de littekenbreuk.
Beide cohortstudies hadden een vergelijkbare techniek (grotendeels posterieure component separatie met retromusculaire plaatsing van de mesh). Deze studie lijkt te suggereren dat bij retromusculaire plaatsing van mesh na een posterieure component separatie macroporeus polypropyleen leidt tot goede uitkomsten. Er is geen valide vergelijking tussen biologisch en synthetisch in deze studie mogelijk vanwege de retrospectieve design en omdat het biologische cohort een groter aandeel aan CDC III littekenbreuken had dus selectie waarschijnlijk is. De bewijskracht van deze studie is zeer laag.
Resultaten
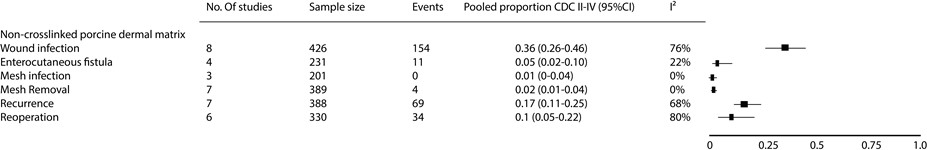
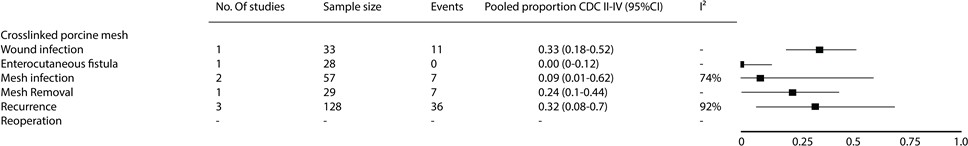
Niet-gecrosslinkte biologische mesh van varkenshuid
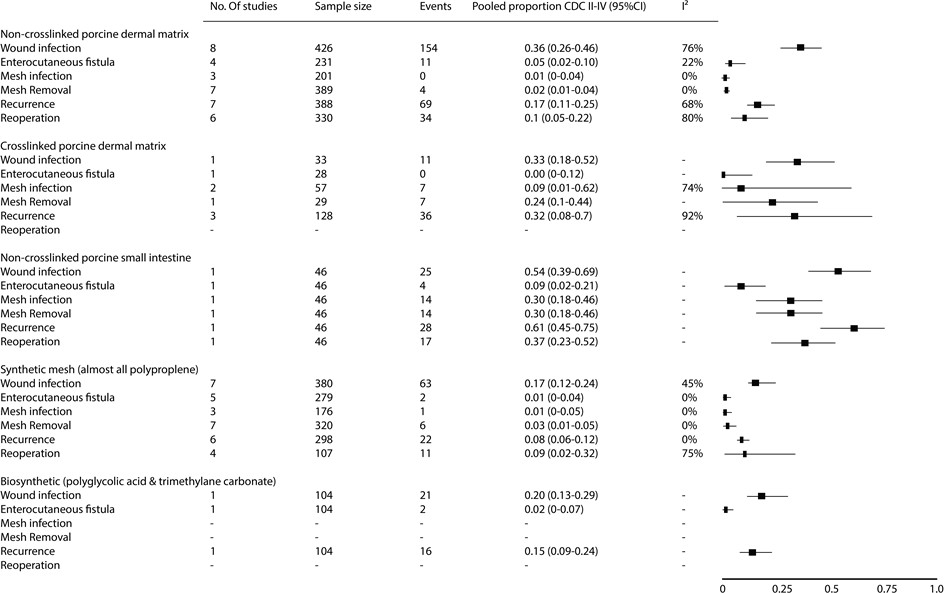
Er werden acht cohortestudies geïdentificeerd die >20 gecontamineerde (CDC II-IV) littekenbreuken beschrijven met het gebruik van niet-gecrosslinkte biomesh van varkenshuid (Atema, 2017; Itani, 2012; Sbitany, 2015; Singh, 2014; Skipworth, 2014;
Krpata, 2013; Chamieh, 2017; Majumder, 2016).
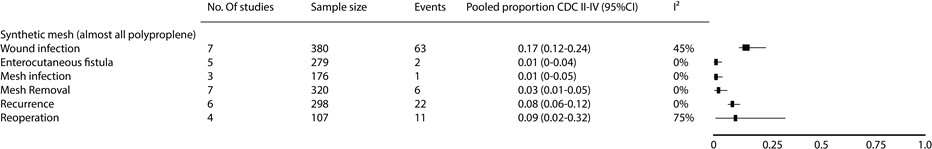
Wondinfectie
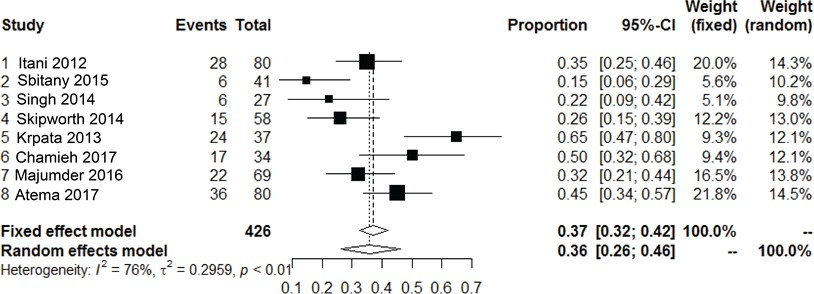
Er werden acht cohortstudies geïdentificeerd die de incidentie van wondinfecties na een gecontamineerde littekenbreukcorrectie met niet-gecrosslinkte biologische mesh van varkenshuid beschreven (N=426). (Atema, 2017; Chamieh, 2017; Itani, 2012; Krpata, 2013; Majumder, 2016; Sbitany, 2015; Singh, 2014; Skipworth, 2014) Samengenomen
ontwikkelde 36% (95% CI, 26 tot 46, I2 = 76%) van deze patiënten een wondinfectie (zie
figuur 1).
Figuur 1 Meta-analyse van de incidentie van wondinfectie na het gebruik van niet-gecrosslinkte biologische mesh van varkenshuid bij gecontamineerde (CDC II-IV) buikwandreconstructies
Bewijskracht van de literatuur
Observationele studies beginnen op ‘laag’ in bewijskracht volgens de GRADE-methodiek. De bewijskracht is met verder verlaagd gezien de beperkingen in de studieopzet en het daarmee gepaarde risico op bias. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Fistelvorming
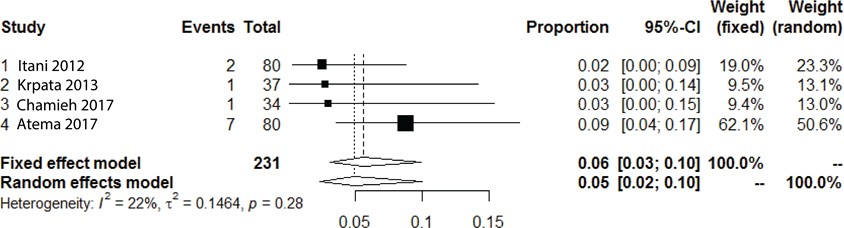
Vier cohortstudies beschreven fistelvorming als uitkomstmaat na een gecontamineerde littekenbreukcorrectie met niet-gecrosslinkte biologische mesh van varkenshuid (N=231) (Atema, 2017; Krpata, 2013, Itani, 2012; Chamieh, 2017).
Samengenomen ontwikkelde 5% (95% CI, 2 tot 10, I2 = 22%) een fistel. Al deze studies rapporteerden de preoperatieve aanwezigheid van fistels, gemiddeld 43,3% (100/231) van de patiënten.
Figuur 2 Meta-analyse van de incidentie van fistelvorming na het gebruik van niet-gecrosslinkte biologische mesh van varkenshuid bij gecontamineerde (CDC II-IV) buikwandreconstructies
Bewijskracht van de literatuur
Observationele studies beginnen op ‘laag’ in bewijskracht volgens de GRADE-methodiek. De bewijskracht is met verder verlaagd gezien de beperkingen in de studieopzet en het daarmee gepaarde risico op bias. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Meshinfectie
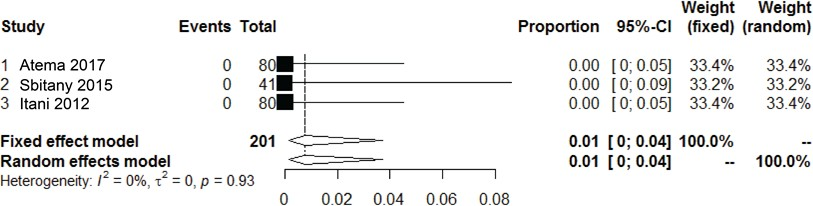
Drie cohortstudies beschreven meshinfectie als uitkomstmaat na een gecontamineerde littekenbreukcorrectie met niet-gecrosslinkte biologische mesh van varkenshuid (N=201) (Atema, 2017; Sbitany, 2015; Itani, 2012).
Géén van de patiënten ontwikkelde een meshinfectie, 0% (95% CI, 0 tot 4, I2 = 0%). Deze studies illustreren dat er bij het gebruik een niet-gecrosslinkte biomesh van varkenshuid zo goed als nooit een meshinfectie (of noodzaak tot het verwijderen van de mesh ontstaat), ondanks de aanwezigheid van (ernstige) contaminatie of infectieuze complicaties postoperatief. Dit type mesh lijkt zich dus goed te lenen voor uitgesproken gecontamineerde procedures.
Figuur 3 Meta-analyse van de incidentie van meshinfectie na het gebruik van niet-gecrosslinkte biologische mesh van varkenshuid bij gecontamineerde (CDC II-IV) buikwandreconstructies
Bewijskracht van de literatuur
Observationele studies beginnen op ‘laag’ in bewijskracht volgens de GRADE-methodiek. De bewijskracht is met verder verlaagd gezien de beperkingen in de studieopzet en het daarmee gepaarde risico op bias. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Noodzaak tot mesh verwijdering
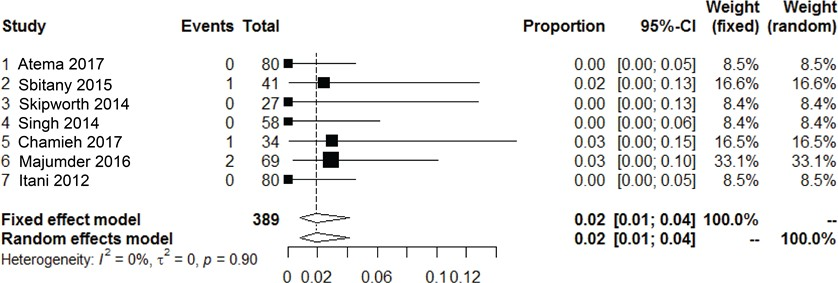
Zeven cohortstudies beschreven het verwijderen van de mesh als uitkomstmaat na een gecontamineerde littekenbreukcorrectie met niet-gecrosslinkte biologische mesh van varkenshuid (N=389) (Atema, 2017; Itani, 2012; Sbitany, 2015; Singh, 2014; Skipworth,
2014; Chamieh, 2017; Majumder, 2016).
Maar bij enkele patiënten werd er noodzaak gezien de mesh te verwijderen, 2% (95% CI, 1 tot 4, I2 = 0%)). Dit was om andere redenen dan meshinfectie.
Figuur 4 Meta-analyse van de incidentie van noodzaak tot mesh verwijdering na het gebruik van niet- gecrosslinkte biologische mesh van varkenshuid bij gecontamineerde (CDC II-IV) buikwandreconstructies
Bewijskracht van de literatuur
Observationele studies beginnen op ‘laag’ in bewijskracht volgens de GRADE-methodiek. De bewijskracht is met verder verlaagd gezien de beperkingen in de studieopzet en het daarmee gepaarde risico op bias. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
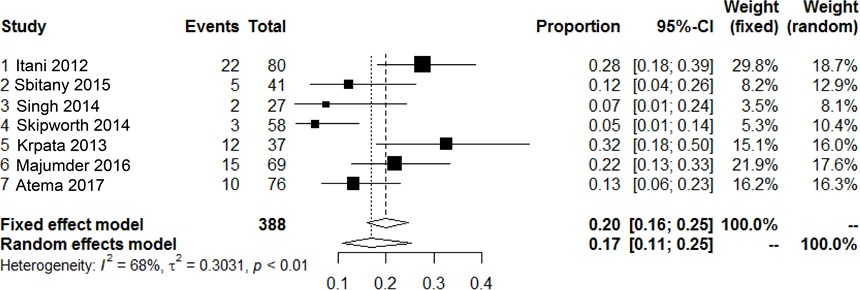
Recidieven
Zeven cohortstudies beschreven het aantal recidieven na een gecontamineerde littekenbreukcorrectie met niet-gecrosslinkte biologische mesh van varkenshuid (N=388) (Atema, 2017; Itani, 2012; Sbitany, 2015; Singh, 2014; Skipworth, 2014; Krpata, 2013;
Majumder, 2016). 17% (95% CI, 11 tot 25, I2 = 68%) van de patiënten ontwikkelde een recidief. Vijf studies rapporteerden de gemiddelde follow-up (gemiddeld 20 maanden alle studies samengenomen) (Itani, 2012; Krpata, 2013; Majumder, 2016; Sbitany, 2015; Singh, 2014). Twee studies rapporteerden een mediane follow-up van 17 maanden (Skipworth, 2014) en 7 maanden (Atema, 2017). De range van follow-up werd niet consistent gerapporteerd.
Figuur 5 Meta-analyse van de incidentie van recidieven na het gebruik van niet-gecrosslinkte biologische mesh van varkenshuid bij gecontamineerde (CDC II-IV) buikwandreconstructies
Bewijskracht van de literatuur
Observationele studies beginnen op ‘laag’ in bewijskracht volgens de GRADE-methodiek. De bewijskracht is met verder verlaagd gezien de beperkingen in de studieopzet en het daarmee gepaarde risico op bias. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
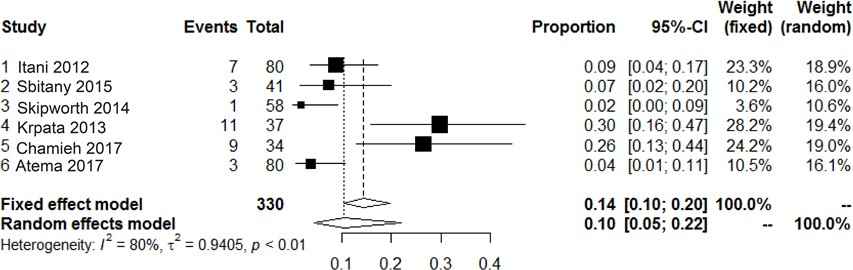
Heroperatie
Zes cohortstudies beschreven noodzaak tot heroperatie na een gecontamineerde littekenbreukcorrectie met niet-gecrosslinkte biologische mesh van varkenshuid als uitkomstmaat (N=330) (Atema, 2017; Itani, 2012; Sbitany, 2015; Skipworth, 2014; Krpata,
2013; Chamieh, 2017).
Tezamen genomen had 10% (95% CI, 5 tot 22, I2 = 80%) van de patiënten noodzaak tot heroperatie.
De mediane follow-up was respectievelijk 7 maanden(Atema, 2017), 11 maanden (Chamieh, 2017) en 17 maanden (Skipworth, 2014). De gemiddelde follow-up was respectievelijk 24 maanden (Itani, 2012), 20 maanden (Krpata, 2013) en 25 maanden (Sbitany, 2015.) De range van de follow-up werd niet consistent gerapporteerd.
Figuur 6 Meta-analyse van de incidentie van heroperatie na het gebruik van niet-gecrosslinkte biologische mesh van varkenshuid bij gecontamineerde (CDC II-IV) buikwandreconstructies
Figuur 7 Meta-analyse met een overzicht van de gepoolde uitkomsten na het gebruik van niet-gecrosslinkte biologische mesh van varkenshuid tijdens een gecontamineerde (CDC II-IV) buikwandreconstructie bij patiënten met een ventrale hernia cicatricalis
Gecrosslinkte biologische mesh van varkenshuid
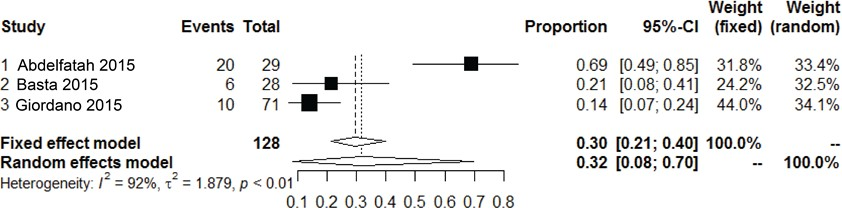
Er werden 4 studies geïdentificeerd die >20 gecontamineerde littekenbreuk beschrijven met het gebruik van gecrosslinkte biomesh van varkenshuid (Abdelfatah, 2015; Basta, 2015; Giordano, 2015; Limura, 2017).
Wondinfectie
Eén studie rapporteerde de hoeveelheid wondinfecties als uitkomstmaat na een gecontamineerde littekenbreukcorrectie met gecrosslinkte biologische mesh van varkenshuid (11/33, 33%) (Abdelfatah, 2015).
Bewijskracht van de literatuur
Observationele studies beginnen op ‘laag’ in bewijskracht volgens de GRADE-methodiek. De bewijskracht is met verder verlaagd gezien de beperkingen in de studieopzet en het daarmee gepaarde risico op bias. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Fistelvorming
Eén studie rapporteerde de hoeveelheid fistels als uitkomstmaat na een gecontamineerde littekenbreukcorrectie met gecrosslinkte biologische mesh van varkenshuid (0/37, 0%), waarbij 7/37 (28%) een fistel als operatie-indicatie had (Basta, 2015).
Bewijskracht van de literatuur
Observationele studies beginnen op ‘laag’ in bewijskracht volgens de GRADE-methodiek. De bewijskracht is met verder verlaagd gezien de beperkingen in de studieopzet en het daarmee gepaarde risico op bias. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
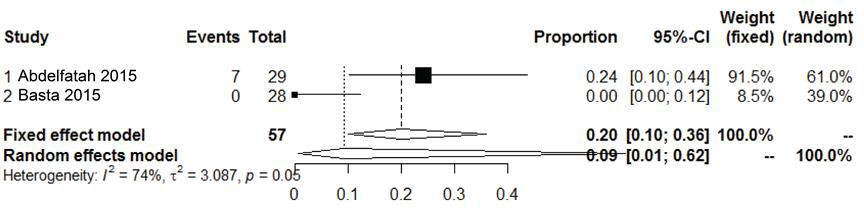
Meshinfectie
Twee studies beschreven de hoeveelheid meshinfecties als uitkomstmaat na een gecontamineerde littekenbreukcorrectie met gecrosslinkte biologische mesh van varkenshuid (Abdelfatah, 2015; Basta, 2015). Bij 9% (95% CI, 1 tot 62, I2 = 74%) van de patiënten ontwikkelde zich een meshinfectie.
Figuur 8 Meta-analyse van de incidentie van meshinfectie na het gebruik van gecrosslinkte biologische mesh van varkenshuid bij gecontamineerde (CDC II-IV) buikwandreconstructies
Bewijskracht van de literatuur
Observationele studies beginnen op ‘laag’ in bewijskracht volgens de GRADE-methodiek. De bewijskracht is met verder verlaagd gezien de beperkingen in de studieopzet en het daarmee gepaarde risico op bias. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Noodzaak tot het verwijderen van mesh
Eén studie rapporteerde de noodzaak tot het verwijderen van de mesh als uitkomstmaat na een gecontamineerde littekenbreukcorrectie met gecrosslinkte biologische mesh van varkenshuid (Abdelfatah, 2015). Bij 24% (95% CI, 10 tot 44) van de patiënten was er noodzaak tot het verwijderen van de mesh.
Bewijskracht van de literatuur
Observationele studies beginnen op ‘laag’ in bewijskracht volgens de GRADE-methodiek. De bewijskracht is met verder verlaagd gezien de beperkingen in de studieopzet en het daarmee gepaarde risico op bias. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Recidieven
Drie studies rapporteerden het aantal recidieven als uitkomstmaat na een gecontamineerde littekenbreukcorrectie met gecrosslinkte biologische mesh van varkenshuid (Abdelfatah, 2015; Basta, 2015; Giordano, 2015). Bij 32% (95% CI, 8 tot 70, I2
= 92%) was er een recidief van de littekenbreuk. Twee studies rapporteerden een mediane follow-up van 13 maanden (Basta, 2015), respectievelijk 25 maanden (Giordano, 2015). Één studie rapporteerde dat elke patiënt een follow-up had van meer dan vijf jaar (Abdelfatah, 2015).
Figuur 9 Meta-analyse van de incidentie van recidieven na het gebruik van gecrosslinkte biologische mesh van varkenshuid bij gecontamineerde (CDC II-IV) buikwandreconstructies
Bewijskracht van de literatuur
Observationele studies beginnen op ‘laag’ in bewijskracht volgens de GRADE-methodiek. De bewijskracht is met verder verlaagd gezien de beperkingen in de studieopzet en het daarmee gepaarde risico op bias. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Heroperatie
Er zijn geen studies over gecrosslinkte biologische mesh van varkenshuid geïdentificeerd die heroperaties als uitkomstmaat rapporteerden.
Samenvattende resultaten
Één studie rapporteerde de hoeveelheid wondinfecties van de gecontamineerde patiënten (CDC II-IV) met gecrosslinkte biologische mesh (11/33, 33%).(Abdelfatah, 2015) Één studie rapporteerde de hoeveelheid fistels van de gecontamineerde patiënten (CDC II-IV) met gecrosslinkte biologische mesh (0/37, 0%), waarbij 7/37 (28%) een fistel als operatie-indicatie had (Basta, 2015). Bij 9% (95% CI, 1 tot 62, I2 = 74%) van de patiënten ontwikkelde zich een meshinfectie, en bij 24% (95% CI, 10 tot 44) van de patiënten was er noodzaak tot het verwijderen van de mesh. Bij 32% (95% CI, 8 tot 70, I2 = 92%) was er een recidief van de littekenbreuk.
De lengte van follow-up werd niet consistent gerapporteerd als gemiddelde of mediaan, ook werd de range niet door alle studies gerapporteerd. Twee studies rapporteerden een mediane follow-up van 13 maanden (Basta, 2015) en respectievelijk 25 maanden (Giordano, 2015). Één studie rapporteerde dat elke patiënt een follow-up had van meer dan vijf jaar (Abdelfatah, 2015), een andere studie rapporteerde een gemiddelde follow- up van 44 maanden (Limura, 2017). De range varieerde van 4 tot 123 maanden (Giordano, 2015; Limura, 2017).
Deze studies illustreren dat er bij het gebruik een gecrosslinkte biomesh van varkenshuid relatief vaak een meshinfectie of noodzaak tot het verwijderen van de mesh ontwikkelt, hetgeen ook in overeenkomst is met een publicatie naar gerapporteerde complicaties na het gebruik van biomeshes uit de database van de Food and Drug Administration, waaruit blijkt dat dat 75% (112/150) van de gerapporteerde complicaties een gecrosslinkte biomesh betrof (Harth, 2009). Dit type mesh leent zich dus niet goed voor gebruik bij gecontamineerde procedures.
Figuur 10 Meta-analyse met een overzicht van de gepoolde uitkomsten na het gebruik van gecrosslinkte biologische mesh van varkenshuid tijdens een gecontamineerde (CDC II-IV) buikwandreconstructie bij patiënten met een ventrale hernia cicatricalis
Biologische mesh van darm submucosa
Er werd één studie geïdentificeerd waarbij een biologische mesh gemaakt van submucosa van darmen van een varken beschreven werd (Madani, 2017).
Madani (Madani, 2017) betrof een retrospectieve studie over 46 patiënten (CDC II 16/46 (35%), CDC III 11/46 (24%), CDC IV (41%)) waarbij een niet-gecrosslinkte biologische mesh gemaakt van submucosa van darmen van een varken grotendeels geplaatst werd als intraperitoneale underlay 39/46 (84%), en de rest als onlay 7/46 (15%). Het defect was gemiddeld 100 cm2. Bij 9/46 (20%) werd een anterieure component separatie gedaan. Bij 28/46 (61%) kon de linea alba gereconstrueerd worden. De mediane follow-up was 47 maanden. 25/46 (56%) van de patiënten ontwikkelde een wondinfectie. 4/46 (9%) ontwikkelde een fistel. 14/46 (30%) van de patiënten ontwikkelde een meshinfectie, die in alle gevallen verwijderd moest worden. Bij 16 van de 18 (89%) overbrugde patiënten trad er een recidief van de breuk op en bij 12/28 (43%) van de overige patiënten na een mediane follow-up van 47 maanden. Bij 17/46 (37%) patiënten was er noodzaak tot heroperatie voor een andere reden dan een recidief.
Deze studie laat zien dat er ook bij dit type mesh vaak een meshinfectie en noodzaak tot het verwijderen van de mesh ontstaat. De resultaten van dit materiaal maken het ongeschikt voor gebruik bij gecontamineerde procedures.
Bewijskracht van de literatuur
Observationele studies beginnen op ‘laag’ in bewijskracht volgens de GRADE-methodiek. De bewijskracht is met verder verlaagd gezien de beperkingen in de studieopzet en het daarmee gepaarde risico op bias. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Synthetische mesh
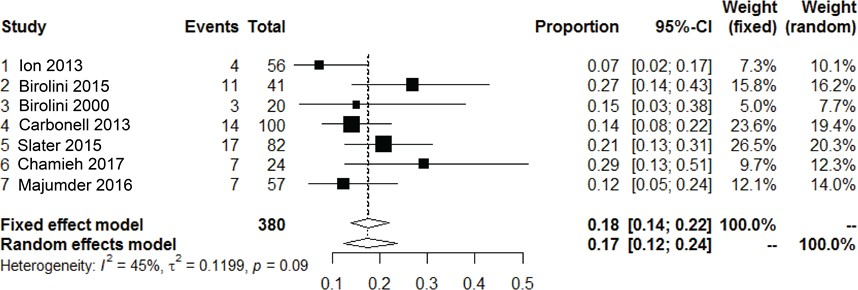
Er werden negen cohortstudies geïdentificeerd die het gebruik van synthetische mesh bij gecontamineerde littekenbreuken (CDC II-IV) beschreven bij meer dan 20 patiënten (Birolini, 2015; Birolini, 2000; Carbonell, 2013; Chamieh, 2017; Heartsill, 2005; Ion, 2013;
Majumder, 2016; Shahan, 2016; Slater, 2015).
Wondinfectie
Zeven studies beschreven de hoeveelheid wondinfecties als uitkomstmaat na een gecontamineerde littekenbreukcorrectie met synthetische mesh (Birolini, 2015; Birolini, 2000; Carbonell, 2013; Chamieh, 2017; Ion, 2013; Majumder, 2016; Slater, 2015).
Gemiddeld ontwikkelde 17% (95% CI, 12 tot 24, I2 = 45%) van de patiënten met van synthetische mesh een wondinfectie. Per graad was dit 15/174 (8.6%) voor CDC II, 16/92 (17.4%) voor CDC III, en 20/69 (29%) voor CDC IV.
Figuur 11 Meta-analyse van de incidentie van wondinfecties na het gebruik van synthetische mesh bij gecontamineerde (CDC II-IV) buikwandreconstructies
Bewijskracht van de literatuur
Observationele studies beginnen op ‘laag’ in bewijskracht volgens de GRADE-methodiek. De bewijskracht is met verder verlaagd gezien de beperkingen in de studieopzet en het daarmee gepaarde risico op bias. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Fistelvorming
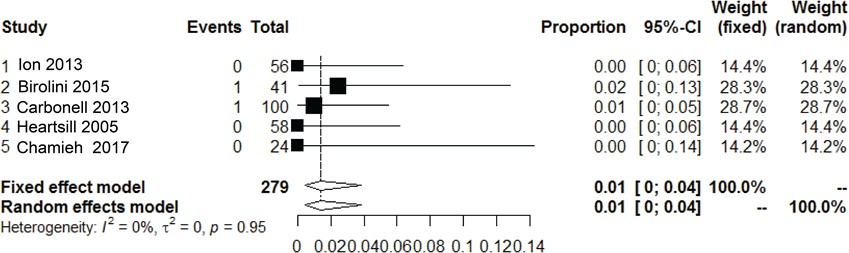
Vijf studies rapporteerden fistelvorming als uitkomstmaat na een gecontamineerde littekenbreukcorrectie met synthetische mesh (Birolini, 2015; Carbonell, 2013; Chamieh, 2017; Heartsill, 2005; Ion, 2013).
1% (95% CI, 0 tot 4, I2 = 0%) van de patiënten ontwikkelde een fistel, maar vier van de vijf studies die postoperatieve fistelvorming rapporteerden hadden geen enkele patiënt met een fistel als operatie-indicatie, bij de vijfde studie had 19% (26/137) van de patiënten een fistel als operatie-indicatie.
Figuur 12 Meta-analyse van de incidentie van fistelvorming na het gebruik van synthetische mesh bij gecontamineerde (CDC II-IV) buikwandreconstructies
Bewijskracht van de literatuur
Observationele studies beginnen op ‘laag’ in bewijskracht volgens de GRADE-methodiek. De bewijskracht is met verder verlaagd gezien de beperkingen in de studieopzet en het daarmee gepaarde risico op bias. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Meshinfectie
Drie studies rapporteerden meshinfectie als uitkomstmaat na een gecontamineerde littekenbreukcorrectie met synthetische mesh (Birolini, 2000; Ion, 2013; Slater, 2015) 1%
(95% CI, 0 tot 5, I2 = 0%) ontwikkelde een meshinfectie.
Figuur 13 Meta-analyse van de incidentie van meshinfectie na het gebruik van synthetische mesh bij gecontamineerde (CDC II-IV) buikwandreconstructies
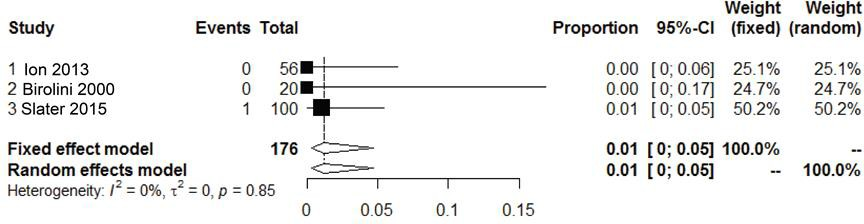
Bewijskracht van de literatuur
Observationele studies beginnen op ‘laag’ in bewijskracht volgens de GRADE-methodiek. De bewijskracht is met verder verlaagd gezien de beperkingen in de studieopzet en het daarmee gepaarde risico op bias. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Noodzaak tot verwijderen van de mesh
Zeven studies rapporteerden noodzaak tot het verwijderen van de mesh als uitkomstmaat na een gecontamineerde littekenbreukcorrectie met synthetische mesh (Birolini, 2015; Birolini, 2000; Chamieh, 2017; Ion, 2013; Majumder, 2016; Shahan, 2016; Carbonell,
2013).
Bij 3% (95% CI, 1 tot 5, I2 = 0%) moest de mesh verwijderd worden.
Figuur 14 Meta-analyse van de incidentie van noodzaak tot het verwijderen van mesh na het gebruik van synthetische mesh bij gecontamineerde (CDC II-IV) buikwandreconstructies
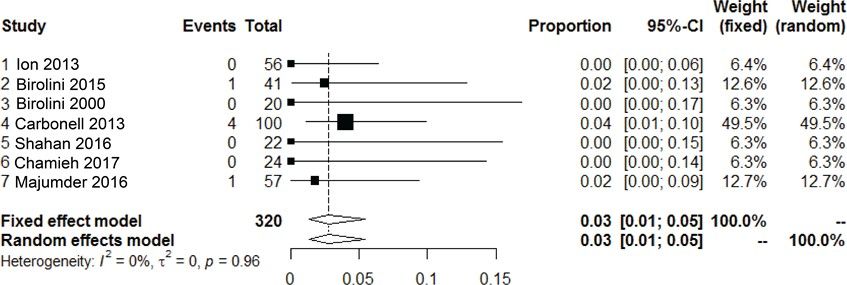
Bewijskracht van de literatuur
Observationele studies beginnen op ‘laag’ in bewijskracht volgens de GRADE-methodiek. De bewijskracht is met verder verlaagd gezien de beperkingen in de studieopzet en het daarmee gepaarde risico op bias. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Recidieven
Zes studies rapporteerden het aantal recidieven als uitkomstmaat na een gecontamineerde littekenbreukcorrectie met synthetische mesh (Birolini, 2015; Birolini, 2000; Carbonell, 2013; Heartsill, 2005; Majumder, 2016; Shahan, 2016).
8% (95% CI, 6 tot 12, I2 = 0%) van de patiënten ontwikkelde een recidief littekenbreuk. Voor ernstig gecontamineerde defecten (CDC IV) was dit 3/41 (7.3%).
De gemiddelde lengte van follow-up noch de range werd niet consistent door alle studies gerapporteerd. Birolini (2015) had een gemiddelde follow-up van 74 maanden, Carbonell (2013) van 10.8 maanden, Heartsill van 30 maanden, Slater van 26 maanden, en Shahan van 12 maanden (Birolini, 2015; Carbonell, 2013; Heartsill, 2005; Shahan, 2016; Slater, 2015). De gerapporteerde range van de follow-up was 1 tot 174 maanden (Birolini, 2015; Birolini, 2000; Carbonell, 2013).
Figuur 15 Meta-analyse van de incidentie van het aantal recidieven na het gebruik van synthetische mesh bij gecontamineerde (CDC II-IV) buikwandreconstructies
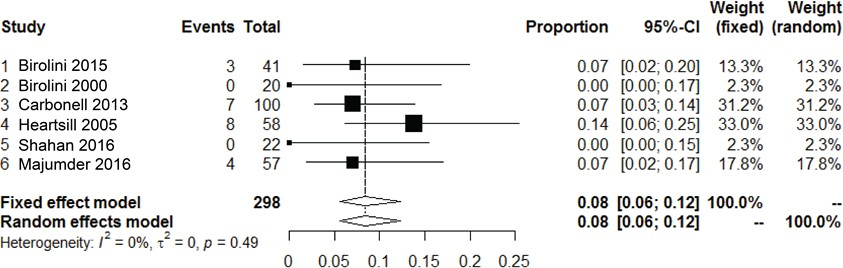
Bewijskracht van de literatuur
Observationele studies beginnen op ‘laag’ in bewijskracht volgens de GRADE-methodiek. De bewijskracht is met verder verlaagd gezien de beperkingen in de studieopzet en het daarmee gepaarde risico op bias. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Heroperatie
Vier studies rapporteerden het aantal heroperaties als uitkomstmaat na een gecontamineerde littekenbreukcorrectie met synthetische mesh (Birolini, 2015; Birolini, 2000; Shahan, 2016; Chamieh, 2017).
Bij 9% (95% CI, 2 tot 32, I2 = 75%) van de patiënten was er noodzaak tot heroperatie.
Figuur 16 Meta-analyse van de incidentie van het heroperaties na het gebruik van synthetische mesh bij gecontamineerde (CDC II-IV) buikwandreconstructies
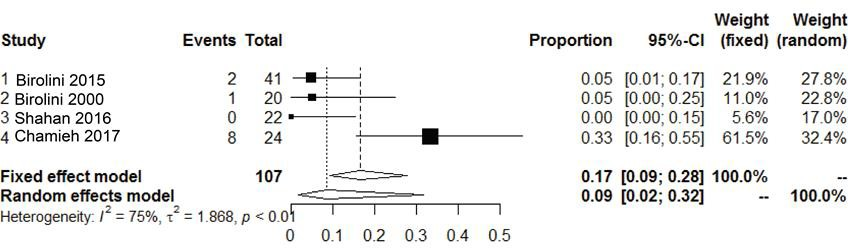
Bewijskracht van de literatuur
Observationele studies beginnen op ‘laag’ in bewijskracht volgens de GRADE-methodiek. De bewijskracht is met verder verlaagd gezien de beperkingen in de studieopzet en het daarmee gepaarde risico op bias. Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Samenvattende resultaten
Gemiddeld ontwikkelde 17% (95% CI, 12 tot 24, I2 = 45%) van de patiënten met plaatsing van synthetische mesh een wondinfectie. Per graad was dit 15/174 (8.6%) voor CDC II, 16/92 (17.4%) voor CDC III, en 20/69 (29%) voor CDC IV. 1% (95% CI, 0 tot 4, I2 = 0%) van
de patiënten ontwikkelde een fistel, maar vier van de vijf studies die postoperatieve fistelvorming rapporteerden hadden geen enkele patiënt met een fistel als operatie- indicatie, bij de vijfde studie had 19% (26/137) van de patiënten een fistel als operatie- indicatie. 1% (95% CI, 0 tot 5, I2 = 0%) ontwikkelde een meshinfectie. Bij 3% (95% CI, 1 tot
5, I2 = 0%) moest de mesh verwijderd worden. 8% (95% CI, 6 tot 12, I2 = 0%) van de patiënten ontwikkelde een recidief littekenbreuk. Voor ernstig gecontamineerde defecten (CDC IV) was dit 3/41 (7.3%). Bij 9% (95% CI, 2 tot 32, I2 = 75%) van de patiënten was er noodzaak tot heroperatie.
De gemiddelde lengte van follow-up noch de range werd niet consistent door alle studies gerapporteerd. Birolini (2015) had een gemiddelde follow-up van 74 maanden, Carbonell (2013) van 10.8 maanden, Heartsill van 30 maanden, Slater van 26 maanden, en Shahan van 12 maanden (Birolini, 2015; Carbonell, 2013; Heartsill, 2005; Shahan, 2016). De gerapporteerde range van de follow-up was 1 tot 174 maanden (Birolini, 2015; Birolini, 2000; Carbonell, 2013).
Deze studies illustreren dat er ook met synthetische mesh acceptabele resultaten te behalen zijn bij gecontamineerde procedures, mits de mesh extraperitoneaal geplaatst wordt, zelfs bij uitgesproken gecontamineerde defecten zoals na het verwijderen van geïnfecteerde mesh. Omdat meshinfecties zich echter nog lang na de operatie kunnen presenteren blijft het echter onduidelijk wat de lange termijn resultaten zijn van het gebruik van synthetische mesh bij gecontamineerde littekenbreuken.
Figuur 17 Meta-analyse met een overzicht van de gepoolde uitkomsten na het gebruik van synthetische mesh tijdens een gecontamineerde (CDC II-IV) buikwandreconstructie bij patiënten met een ventrale hernia cicatricalis
Biosynthetische mesh
Dit type mesh lijkt een te overwegen optie voor matig gecontamineerde littekenbreuken (CDC II-III), maar omdat de literatuur over biosynthetische mesh beperkt is, is er geen zekere uitspraak te doen.
Rosen (2017) (de COBRA studie) betrof een prospectieve studie over 104 patiënten (CDC II 24/104 (23%), CDC III 80/104 (77%)) waarbij een biosynthetische mesh van polyglycolzuur en trimethaleencarbonaat grotendeels in de retromusculaire positie (94/104 (90%), 10/1044 (10%) als onlay) geplaatst werd. Het defect was gemiddeld 137 cm2. Bij 71/104 (68.3%) werd een component separatie gedaan (21/104 (20.2%) ACS, 50/104 (48.1%) PCS). De linea alba kon in alle gevallen (100%) gereconstrueerd worden. De gemiddelde follow-up was 24 maanden. 21/104 (20.2%) ontwikkelden een wondinfectie. Twee patiënten (1.9%) ontwikkelden een fistel. Het aantal meshinfecties of de noodzaak tot het verwijderen van de mesh werd niet gerapporteerd. 16/104 (17%) van de patiënten ontwikkelde een recidief na een gemiddelde follow-up van 24 maanden.
Buell rapporteerden de uitkomsten van poly-4-hydroxyboterzuur (31 patiënten) en vergeleken dit met een historisch cohort waar zij biomesh gebruikten (42 patiënten). Alhoewel deze studie lagere recidief en wondcomplicatiepercentages voor de biosynthetische mesh in verhouding tot de biomesh rapporteert, namelijk 22,6% versus 40,5% voor de wondcomplicaties en 6,5% versus 23,8% voor het percentage recidieven, rapporteert deze studie niets over de grootte van de breuk, de contaminatiegraad in beide
groepen, noch de positionering van de mesh, hetgeen een valide vergelijking onmogelijk maakt.
Figuur 18 Overzicht van de gepoolde resultaten per uitkomst bij het gebruik van de verschillende categorieën mesh tijdens een gecontamineerde (CDC II-IV) buikwandreconstructie bij patiënten met een ventrale hernia cicatricalis
Zoeken en selecteren
Om deze uitgangsvraag te kunnen beantwoorden is er een aanvullende systematische literatuuranalyse verricht naar de volgende zoekvragen:
Wat zijn de (on)gunstige effecten van applicatie van de verschillende soorten mesh tijdens een gecontamineerde buikwandreconstructie bij patiënten met een ventrale hernia cicatricalis?
1.
P: patiënten met een gecontamineerde ventrale hernia cicatricalis; I: applicatie van synthetische mesh;
C: buikwandreconstructie zonder toepassing van mesh;
O: recidieven/ wondinfecties/ meshinfecties/ noodzaak tot verwijderen van mesh/ heroperatie.
2.
P: patiënten met een gecontamineerde ventrale hernia cicatricalis; I: applicatie van biosynthetische mesh;
C: buikwandreconstructie zonder toepassing van mesh;
O: recidieven/ wondinfecties/ meshinfecties/ noodzaak tot verwijderen van mesh/ heroperatie.
3.
P: patiënten met een gecontamineerde ventrale hernia cicatricalis; I: applicatie van biologische mesh;
C: buikwandreconstructie zonder toepassing van mesh;
O: recidieven/ wondinfecties/ meshinfecties/ noodzaak tot verwijderen van mesh/ heroperatie.
4.
P: patiënten met een gecontamineerde ventrale hernia cicatricalis; I: applicatie van biologische mesh;
C: buikwandreconstructie met biosynthetische mesh;
O: recidieven/ wondinfecties/ meshinfecties/ noodzaak tot verwijderen van mesh/ heroperatie.
5.
P: patiënten met een gecontamineerde ventrale hernia cicatricalis; I: applicatie van biologische mesh;
C: buikwandreconstructie met synthetische mesh;
O: recidieven/ wondinfecties/ meshinfecties/ noodzaak tot verwijderen van mesh/ heroperatie.
6.
P: patiënten met een gecontamineerde ventrale hernia cicatricalis; I: applicatie van biosynthetische mesh;
C: buikwandreconstructie met synthetische mesh;
O: recidieven/ wondinfecties/ meshinfecties/ noodzaak tot verwijderen van mesh/ heroperatie.
De werkgroep achtte het aantal meshinfecties en recidieven voor de besluitvorming kritieke uitkomstmaten; en wondinfecties, fistelvorming, meshinfecties en de noodzaak tot het verwijderen van mesh voor de besluitvorming belangrijke uitkomstmaten voor de aanvullende search naar soorten mesh bij gecontamineerde breuken.
Zoeken en selecteren (Methode)
Voor de aanvullende search voor gecontamineerde breuken werd in de databases Medline, Embase en de Cochrane Library met relevante zoektermen gezocht naar literatuur. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. Een belangrijke variabele voor keuze van mesh soort is de mate van contaminatie. Veel studies zijn gecentreerd rondom dit thema, en derhalve is dit het uitgangspunt van de literatuursearch. De literatuurzoekactie leverde 6704 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
Inclusiecriteria:
- Studies die de uitkomsten van een gecontamineerde buikwandreconstructie voor patiënten met een ventrale hernia cicatricalis rapporteren per Ventral Hernia Working Group graad dan wel Centers for Disease Control graad, of van een cohort met alleen maar gecontamineerde casus.
- >20 patiënten.
- Identificeerbaar type mesh (biologisch, biosynthetisch, synthetisch).
Exclusiecriteria:
- Publicaties van voor 1990.
- Talen die niet het Latijnse alfabet gebruiken.
- Studies over biologische mesh van menselijke origine (niet verkrijgbaar in Europa).
- Andere soorten hernia.
- Profylactische mesh.
- Open buiken.
- Gefaseerde reconstructies.
Op basis van titel en abstract werden in eerste instantie 618 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 598 studies geëxcludeerd, en 22 studies definitief geselecteerd.
De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de literatuurtabellen.
Referenties
- Abdelfatah MM, Rostambeigi N, Podgaetz E, et al. Long-term outcomes (>5-year follow-up) with porcine acellular dermal matrix (Permacol) in incisional hernias at risk for infection. Hernia, 2015;19(1):135-140. doi:10.1007/s10029-013-1165-9.
- Atema JJ, de Vries FE, Boermeester MA. Systematic review and meta-analysis of the repair of potentially contaminated and contaminated abdominal wall defects. Am J Surg, 2016;212(5):982-995 e981. doi:10.1016/j.amjsurg.2016.05.003.
- Atema JJ, Furnee EJ, Maeda Y, et al. Major Complex Abdominal Wall Repair in Contaminated Fields with Use of a Non-cross-linked Biologic Mesh: A Dual-Institutional Experience. World journal of surgery. doi:10.1007/s00268-017-3962-2.
- Basta MN, Fischer JP, Kovach SJ. Assessing complications and cost-utilization in ventral hernia repair utilizing biologic mesh in a bridged underlay technique. Am J Surg. 2015;209(4):695-702. doi:10.1016/j.amjsurg.2014.04.017.
- Birolini C, de Miranda JS, Utiyama EM, et al. A retrospective review and observations over a 16-year clinical experience on the surgical treatment of chronic mesh infection. What about replacing a synthetic mesh on the infected surgical field? Hernia. 2015;19(2):239-246. doi:10.1007/s10029-014-1225-9.
- Birolini C, de Miranda JS, Utiyama EM, et al. Active Staphylococcus aureus infection: Is it a contra-indication to the repair of complex hernias with synthetic mesh? A prospective observational study on the outcomes of synthetic mesh replacement, in patients with chronic mesh infection caused by Staphylococcus aureus. Int J Surg. 2016;28:56-62. doi:10.1016/j.ijsu.2016.02.062.
- Birolini C, Utiyama EM, Rodrigues AJ, et al. Elective colonic operation and prosthetic repair of incisional hernia: does contamination contraindicate abdominal wall prosthesis use? J Am Coll Surg. 2000;191(4):366-372.
- Brown CN, Finch JG. Which mesh for hernia repair? Ann R Coll Surg Engl. 2010;92(4):272-278. doi:10.1308/003588410X12664192076296.
- Buell JF, Sigmon D, Ducoin C, et al. Initial Experience With Biologic Polymer Scaffold (Poly-4-hydroxybuturate) in Complex Abdominal Wall Reconstruction. Ann Surg. 2017;266(1):185-188. doi:10.1097/SLA.0000000000001916.
- Burger JW, Luijendijk RW, Hop WC, et al. Long-term follow-up of a randomized controlled trial of suture versus mesh repair of incisional hernia. Ann Surg. 2004;240(4):578-583; discussion 583-575.
- Carbonell AM, Cobb WS. Safety of prosthetic mesh hernia repair in contaminated fields. Surg Clin North Am. 2013;93(5):1227-1239. doi:10.1016/j.suc.2013.06.012.
- Carbonell AM, Criss CN, Cobb WS, et al. Outcomes of synthetic mesh in contaminated ventral hernia repairs. J Am Coll Surg. 2013;217(6):991-998. doi:10.1016/j.jamcollsurg.2013.07.382.
- Chamieh J, Tan WH, Ramirez R, et al. Synthetic versus Biologic Mesh in Single-Stage Repair of Complex Abdominal Wall Defects in a Contaminated Field. Surg Infect (Larchmt) 2017;18(2):112-118. doi:10.1089/sur.2016.106. Giordano P, Pullan RD, Ystgaard B, et al. The use of an acellular porcine dermal collagen implant in the repair of complex abdominal wall defects: a European multicentre retrospective study. Tech Coloproctol. 2015;19(7):411-417. doi:10.1007/s10151-015-1307-4.
- Harth KC, Rosen MJ. Major complications associated with xenograft biologic mesh implantation in abdominal wall reconstruction. Surg Innov. 2009;16(4):324-329. doi:10.1177/1553350609353609.
- Heartsill L, Richards ML, Arfai N, et al. Open Rives-Stoppa ventral hernia repair made simple and successful but not for everyone. Hernia. 2005;9(2):162-166. doi:10.1007/s10029-005-0319-9.
- Holihan JL, Nguyen DH, Nguyen MT, et al. Mesh Location in Open Ventral Hernia Repair: A Systematic Review and Network Meta-analysis. World J Surg. 2016;40(1):89-99. doi:10.1007/s00268-015-3252-9.
- Ion D, Stoian RV, Bolocan A, et al. Is prosthetic repair of the abdominal wall in clean-contaminated surgical interventions possible? Chirurgia (Bucur). 2013;108(6): 855-858.
- Itani KM, Rosen M, Vargo D, et al. Prospective study of single-stage repair of contaminated hernias using a biologic porcine tissue matrix: the RICH Study. Surgery. 2012;152(3):498-505. doi:10.1016/j.surg.2012.04.008.
- Krpata DM, Stein SL, Eston M, et al. Outcomes of simultaneous large complex abdominal wall reconstruction and enterocutaneous fistula takedown. Am J Surg. 2013;205(3):354-358; discussion 358-359. doi:10.1016/j.amjsurg.2012.10.013.
- Liang MK, Holihan JL, Itani K, et al. Ventral Hernia Management: Expert Consensus Guided by Systematic Review. Ann Surg. 2017;265(1):80-89. doi:10.1097/SLA.0000000000001701.
- Limura E, Giordano P. Biological Implant for Complex Abdominal Wall Reconstruction: A Single Institution Experience and Review of Literature. World J Surg. 2017. doi:10.1007/s00268-017-4066-8.
- Madani A, Niculiseanu P, Marini W, et al. Biologic mesh for repair of ventral hernias in contaminated fields: long- term clinical and patient-reported outcomes. Surg Endosc. 2017;31(2):861-871. doi:10.1007/s00464-016- 5044-1.
- Majumder A, Winder JS, Wen Y, et al. Comparative analysis of biologic versus synthetic mesh outcomes in contaminated hernia repairs. Surgery. 2016;160(4):828-838. doi:10.1016/j.surg.2016.04.041.
- Montgomery A, Kallinowski F, Kockerling, F. (2015). Evidence for Replacement of an Infected Synthetic by a Biological Mesh in Abdominal Wall Hernia Repair. Front Surg. 2015;2: 67. doi:10.3389/fsurg.2015.00067.
- Rosen MJ, Bauer JJ, Harmaty M, et al. Multicenter, Prospective, Longitudinal Study of the Recurrence, Surgical Site Infection, and Quality of Life After Contaminated Ventral Hernia Repair Using Biosynthetic Absorbable Mesh: The COBRA Study. Ann Surg. 2017;265(1):205-211. doi:10.1097/SLA.0000000000001601.
- Sbitany H, Kwon E, Chern H, et al. Outcomes Analysis of Biologic Mesh Use for Abdominal Wall Reconstruction in Clean-Contaminated and Contaminated Ventral Hernia Repair. Ann Plast Surg 2015;75(2):201-204. doi:10.1097/SAP.0000000000000030.
- Shahan CP, Stoikes NF, Webb DL, et al. Sutureless onlay hernia repair: a review of 97 patients. Surg Endosc. 2016;30(8):3256-3261. doi:10.1007/s00464-015-4647-2.
- Shubinets V, Carney MJ, Colen DL, et al. Management of Infected Mesh After Abdominal Hernia Repair: Systematic Review and Single-Institution Experience. Ann Plast Surg. 2017. doi:10.1097/SAP.0000000000001189.
- Singh DP, Zahiri HR, Gastman B, et al. A modified approach to component separation using biologic graft as a load- sharing onlay reinforcement for the repair of complex ventral hernia. Surg Innov. 2014;21(2):137-146. doi:10.1177/1553350613492585.
- Skipworth JR, Vyas S, Uppal L, et al. Improved outcomes in the management of high-risk incisional hernias utilizing biological mesh and soft-tissue reconstruction: a single center experience. World J Surg. 2014;38(5):1026- 1034. doi:10.1007/s00268-013-2442-6.
- Slater NJ, Knaapen L, Bokkerink WJ, et al. Large Contaminated Ventral Hernia Repair Using Component Separation Technique with Synthetic Mesh. Plast Reconstr Surg. 2015;36(6):796e-805e. doi:10.1097/PRS.0000000000001793.
- Souza JM, Dumanian GA. Routine use of bioprosthetic mesh is not necessary: a retrospective review of 100 consecutive cases of intra-abdominal midweight polypropylene mesh for ventral hernia repair. Surgery. 2013;153(3):393-399. doi:10.1016/j.surg.2012.08.003.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
Research question: mesh type in open abdominal wall reconstruction for contaminated ventral incisional hernia
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
|
Itani 2012 |
Type of study: prospective cohort
Setting: Clinical multicentre setting (12 sites)
Country: USA
Source of funding: LifeCell |
Inclusion criteria: Patients aged >17 years with hernias >9 cm2 by physical examination and reparable using a single sheet (up to 20 x 20 cm) of Non-crosslinked porcine dermal matrix were recruited when they underwent open repair of a CDC II-IV hernia.
Exclusion criteria: Clean procedure Laparoscopic procedure Systemic infection at time of repair Chronic conditions Renal failure Malignancy Collagen disorder BMI>40 Life expectancy < 24 months |
non-crosslinked mesh |
porcine |
NA |
Length of follow-up: 24 months
Loss-to-follow- up: 20 patients
Incomplete outcome data: 60 patients were analyzed |
28/80 (35%) van de patiënten ontwikkelde een wondinfectie, 2/80 (3%) van de patiënten ontwikkelde een fistel. Geen enkele patiënt ontwikkelde een meshinfectie of noodzaak tot het verwijderen van de mesh. 22/80 (28%) van de patiënten ontwikkelde een recidief littekenbreuk na xx jaarfollow- up, bij 7/80 (8.8%) was er noodzaak tot heroperatie. |
|
|
|
|
N total at baseline: 80 |
|
|
|
|
|
|
|
|
|
Analyzed: |
|
|
|
|
|
|
|
|
|
60 |
|
|
|
|
|
|
|
Sbitany 2015 |
Type of study: Retrospective analysis of prospective database
Setting: Clinical single centre setting Country: USA Source of funding: No funding |
Inclusion criteria: patients undergoing ventral hernia repair and abdominal wall reconstruction using biologic mesh, who fell under the Ventral Hernia Working Group classification of grade 3 and grade 4 hernia defects.
Exclusion criteria: All patients not matching these criteria were excluded from the analysis, including those with grade 1 and grade 2 hernias. |
non-crosslinked mesh |
porcine |
NA |
Length of follow-up: mean follow-up 25 months |
6/41 (14.6%) van de patiënten ontwikkelde een wondinfectie;, geen van de patiënten een meshinfectie. Fistelvorming werd niet gerapporteerd. Bij 1/41 van de patiënten werd de mesh verwijderd. In 1/36 (2.7%) van de CDC II, en 4/5 (80%) van de CDC IV ontwikkelde werd een recidief littekenbreuk gevonden na 25 follow-up. Bij 3/41 (7.3%) was er noodzaak tot heroperatie. |
|
|
Krpata 2013 |
Type of study: Retrospective cohort |
Inclusion criteria: Patients undergoing simultaneous AWR and ECF takedown |
non-crosslinked mesh |
porcine |
NA |
Length of follow-up: mean follow-up 20 months (range 3-73) |
24/37 (65%) van de patiënten ontwikkelde een wondinfectie,. één patiënt ontwikkelde een fistel (2.7%). H, het aantal meshinfecties of de noodzaak tot het verwijderen van de mesh werd niet gerapporteerd. Het aantal recidieven was 12/37 (32%) na gemiddeld 20 maanden follow-up. |
|
|
Singh 2014 |
Retrospective cohort
4 University of Maryland Medical Center |
Inclusion criteria: required patients to undergo either a unilateral or bilateral components separation reinforced with an onlay of noncrosslinked PADM. Eligible patients’ wounds were all graded as contaminated, potentially contaminated, or at high risk for infection according to Ventral Hernia Working Group definitions. |
non-crosslinked mesh |
porcine |
NA |
De gemiddelde follow-up was 13.7 maanden (tussen 4.5- 23.7). |
Bij 3/14 (24%) van de VHWG III en bij 3/13 (22%) van de VHWG IV ontwikkelde zich een wondinfectie. Fistelvorming of meshinfectie werd niet gerapporteerd. Er was geen noodzaak tot het verwijderen van de mesh. Bij 1/14 (7.1%) van de VHWG III en bij 1/13 (7.7%) van de VHWG IV trad er een recidief littekenbreuk op |
|
|
|
|
|
|
|
|
na gemiddeld 13.7 maanden follow-up. |
|
|
Skipworth 2014 |
Retrospective cohort Single center |
Ventral Hernia Working Group grade 2– 4 |
non-crosslinked porcine mesh |
NA |
17 months (range 2–45) |
In het gehele cohort ontwikkelde 15/58 (25%) een wondinfectie (niet gerapporteerd per VHWG graad). 3 (15.7%) van de VHWG III ontwikkelden een recidief littekenbreuk na gemiddeld 17 maanden follow-up, verder waren er geen recidieven. Bij één patiënt was er noodzaak tot heroperatie. |
|
|
Abdelfatah 2014 |
Retrospective cohort, single center |
All consecutive repairs of ventral abdominal wall hernias using crosslinked porcine mesh between October 2004 to June 2008 at high risk for infection |
Crosslinked porcine mesh |
NA |
mean >5 year |
4/31 (12.9%) van CDC I, 5/21 (23.8%) van CDC II, 4/8 (50%) van CDC III, en 2/4 (50%) van CDC IV ontwikkelden een wondinfectie. Fistelvorming werd niet gerapporteerd. 8/30 (27%) van CDC I, 4/19 (21%) van CDC II, 2/7 (29%) van CDC III, en 1/3 (33.3%) van CDC IV ontwikkelden een meshinfectie met noodzaak tot het verwijderen van (een deel van) de mesh. 19/30 (63%) van CDC I, 12/19 (63%) van CDC II, 5/7 (71%) van CDC III, en 3/3 (100%) van CDC IV ontwikkelde een recidief littekenbreuk na gemiddeld meer dan vijf jaar follow-up. |
|
|
Basta 2015 |
Retrospective cohort Single center |
Patients were included who underwent CVH repair utilizing biologic mesh in a bridging technique. |
mostly crosslinked porcine mesh (Permacol 29/37, SurgiMend 6/37 or XenMatrix 2/37) |
NA |
median follow- up 13 months |
8/37 (21%) van de patiënten ontwikkelde een wondinfectie. Er werd 0 fistelvorming of meshinfectie gerapporteerd. Het aantal recidieven was 1/9 |
|
|
|
|
|
|
|
|
(11,1%) voor CDC I, 2/16 (12,5%) voor CDC II, 2/7 (28,6%) voor CDC III, en 2/5 (40%) voor CDC IV na een mediane follow- up van 13 maanden. Bij 9/37 (24.3%) van de patiënten was er noodzaak tot heroperatie. |
|
|
Giordano |
Multicentre |
Patients receiving crosslinked porcine |
Crosslinked porcine mesh |
NA |
median follow- |
15/109 (13.8%) van de |
|
|
2015 |
retrospective |
mesh with a follow-up longer than 12 |
|
|
up was 25.7 |
patiënten ontwikkelde een |
|
|
|
study |
months. |
|
|
months (range |
wondinfectie. 3/109 (2.8%) |
|
|
|
|
|
|
|
13-102) |
ontwikkelde een fistel. Het |
|
|
|
|
|
|
|
|
aantal meshinfecties werd niet |
|
|
|
|
|
|
|
|
gerapporteerd, noch het aantal |
|
|
|
|
|
|
|
|
patiënten waarbij er noodzaak |
|
|
|
|
|
|
|
|
was tot het verwijderen van de |
|
|
|
|
|
|
|
|
mesh. 10/37 (27%) van de CDC |
|
|
|
|
|
|
|
|
I, 8/42 (18.6%) van de CDC II, |
|
|
|
|
|
|
|
|
2/21 (9.5%) van de CDC III, en |
|
|
|
|
|
|
|
|
0/8 (0%) van de CDC IV |
|
|
|
|
|
|
|
|
ontwikkelde een recidief |
|
|
|
|
|
|
|
|
littekenbreuk na een |
|
|
|
|
|
|
|
|
gemiddelde follow-up van 25.7 |
|
|
|
|
|
|
|
|
maanden. Het aantal |
|
|
|
|
|
|
|
|
heroperaties werd niet |
|
|
|
|
|
|
|
|
gerapporteerd. |
|
|
Limura |
Prospective |
age of 18 years or more with CAWD and |
Crosslinked porcine mesh |
NA |
mean follow-up |
12/56 (22%) van de patiënten |
|
|
2017 |
cohort |
placement of crosslinked porcine mesh |
|
|
44 months |
ontwikkelde een wondinfectie. |
|
|
|
|
|
|
|
(range 4-123) |
6/56 (11%) van de patiënten |
|
|
|
|
|
|
|
|
ontwikkelde een fistel. |
|
|
|
|
|
|
|
|
Meshinfectie of verwijdering |
|
|
|
|
|
|
|
|
werd niet gerapporteerd. |
|
|
|
|
|
|
|
|
14/56 (26%) van de patiënten |
|
|
|
|
|
|
|
|
ontwikkelde een recidief na |
|
|
|
|
|
|
|
|
gemiddeld 44 maanden follow- |
|
|
|
|
|
|
|
|
up. 5/56 (8.9%) had noodzaak |
|
|
|
|
|
|
|
|
tot heroperatie. |
|
Madani 2017 |
Retrospective cohort |
Patients undergoing CAWR with placement of non-crosslinked porcine small intestine submucosa |
non-crosslinked porcine small intestine submucosa |
NA |
47 months median (interquartile range: 31–79) |
25/46 (56%) van de patiënten ontwikkelde een wondinfectie. 4/46 (9%) ontwikkelde een fistel. 14/46 (30%) van de patiënten ontwikkelde een meshinfectie, die in alle gevallen verwijderd moest worden. Bij 16 van de 18 (89%) overbrugde patiënten trad er een recidief van de breuk op en bij 12/28 (43%) van de overige patiënten na een mediane follow-up van 47 maanden. Bij 17/46 (37%) patiënten was er noodzaak tot heroperatie voor een andere reden dan een recidief. |
|
|
Ion 2013 |
Retrospective cohort |
Patients undergoing potentially contaminated open hernia repair with synthetic mesh |
Polypropylene or dualmesh |
NA |
82% of patients had a follow-up of >1 year |
2/56 (3.6%) een oppervlakkige wondinfectie en 2/56 (3.6%) een diepe wondinfectie. 0 patiënten ontwikkelde een fistel, meshinfectie, of noodzaak tot het verwijderen van de mesh. Het aantal recidieven werd niet gerapporteerd. |
|
|
Birolini 2015 |
Retrospective cohort |
Patients undergoing infected mesh removal with placement of a new synthetic mesh |
heavyweight macroporous polypropylene |
NA |
mean 74 months (range 12 and 174 months) |
6/41 (14.6%) een kleine wondinfectie en 5/41 (12%) een grote wondinfectie. Één (2.4%) patiënt ontwikkelde een fistel met noodzaak tot het verwijderen van de mesh. Bij één patiënt was het nodig de mesh deels te verwijderen. 3/41 (7.3%) van de patiënten ontwikkelde een littekenbreuk, |
|
|
|
|
|
|
|
|
2/41 (4.9%) van de patiënten had noodzaak tot heroperatie. |
|
|
Birolini 2000 |
Retrospective cohort |
Patients undergoing open ventral hernia repair and concomitant colorectal surgery |
heavyweight macroporous polypropylene |
NA |
Follow-up ranged between 1-7 years |
3/20 (15%) ontwikkelde een wondinfectie. Géén van de patiënten ontwikkelde een meshinfectie of noodzaak tot het verwijderen van de gehele mesh (één mesh werd partieel verwijderd). Het aantal fistels werd niet gerapporteerd. Géén van de patiënten ontwikkelde een recidief. |
|
|
Carbonell |
Retrospective |
Potentially contaminated or |
low weight large pore |
NA |
mean follow-up |
3/42 CDC II en 11/58 (19%) van |
|
|
2013 |
cohort |
contaminated open ventral hernia repair |
polypropylene |
|
of 10.8 months |
de CDC III ontwikkelde een |
|
|
|
|
|
|
|
(range 1 to 63 |
wondinfectie. Één van de |
|
|
|
|
|
|
|
months) |
patiënten ontwikkelde een |
|
|
|
|
|
|
|
|
fistel met noodzaak tot het |
|
|
|
|
|
|
|
|
verwijderen van de mesh. Bij 3 |
|
|
|
|
|
|
|
|
andere patiënten moest er |
|
|
|
|
|
|
|
|
tevens mesh verwijderd |
|
|
|
|
|
|
|
|
worden (4/100, 4%). 3/42 |
|
|
|
|
|
|
|
|
(7.1%) van de CDC II en 4/58 |
|
|
|
|
|
|
|
|
(6.8%) van de CDC III patiënten |
|
|
|
|
|
|
|
|
ontwikkelde een recidief. |
|
|
Heartsill |
Retrospective |
Patients undergoing open ventral hernia |
ePTFE (67/80 83%) or |
NA |
mean follow-up |
13 patiënten in het gehele |
|
|
2005 |
cohort |
repair with placement of synthetic mesh |
polypropylene (10/80 (13%) |
|
30 months (sd |
cohort ontwikkelden een |
|
|
|
|
in the retromuscular position |
|
|
24) |
wondinfectie, 0% een fistel, |
|
|
|
|
|
|
|
|
3/80 (3.8%) een meshinfectie |
|
|
|
|
|
|
|
|
met noodzaak tot het |
|
|
|
|
|
|
|
|
verwijderen van de mesh. 4/22 |
|
|
|
|
|
|
|
|
(18.1%) van de CDC I, 4/33 |
|
|
|
|
|
|
|
|
(12.1%) van de CDC II, 4/25 |
|
|
|
|
|
|
|
|
(16%) van de CDC III |
|
|
|
|
|
|
|
|
ontwikkelden een recidief |
|
|
|
|
|
|
|
|
littekenbreuk. |
|
Slater 2015 |
Retrospective cohort |
Ventral hernia repair with component separation and placement of synthetic mesh |
Proceed 62/137 (45.6%), or Vypro 42/137 (30.7%) (mediumweight macroporous polypropylene), UltraPro 9/137 (6.6%), SepraMesh 5/137 (3.6%)(lightweight), Marlex 9/137 (6.6%), Prolene 7/137 (5.1%), Composix 3/137 (2.2%) (heavyweight) |
NA |
median follow- up 15 months, mean follow-up 26.1 months (range 1-127 months) |
5/56 (9.1%) van de CDC I, 5/34 (14.7%) van de CDC II, 3/19 (15.8%) van de CDC III, en 9/28 (32.1%) van de CDC IV ontwikkelde een wondinfectie. 5/137 (3.6%) in het gehele cohort ontwikkelde een fistel, en 4/137 (2.9%) een meshinfectie. Bij 3/137 (2.2%) was er noodzaak tot het verwijderen van de mesh. 24/137 (17.5%) van de patiënten in dit cohort had een recidief, en 13/137 (9.5%) noodzaak tot heroperatie. |
|
|
Shahan 2016 |
Retrospective cohort |
All patients receiving open onlay placement of synthetic mesh |
macroporous, medium- weight polypropylene |
NA |
Mean follow-up 13.8 months |
Infectieuze complicaties werden niet gerapporteerd, alleen dat er geen recidief of noodzaak tot het verwijderen van de mesh was. |
|
|
Rosen 2017 |
Prospective cohort multicenter |
Patients with a contaminated or clean- contaminated operative field and a hernia defect at least 9 cm who had a biosynthetic mesh (open, sublay, retrorectus, or intraperitoneal) repair with fascial closure |
67% polyglycolic acid and 33% trimethylene carbonate biosynthetic mesh |
NA |
mean 24 months +/-1 month |
21/104 (20.2%) ontwikkelden een wondinfectie. Twee patiënten (1.9%) ontwikkelden een fistel. Het aantal meshinfecties of de noodzaak tot het verwijderen van de mesh werd niet gerapporteerd. 16/104 (17%) van de patiënten ontwikkelde een recidief na gemiddeld 24 maanden follow- up. |
|
|
Chamieh 2017 |
Retrospective cohort |
Patients receiving contaminated CAWR with placement of either biologic or synthetic mesh |
Bio: nine human dermis (FlexHD, Musculoskeletal Transplant Foundation, Edison, NJ), two porcine small intestinal submucosa |
NA |
Median follow- up 11.3 months (all>5) |
De helft van de patiënten, 17/34 (50%) ontwikkelde een wondinfectie. 1/34 (2.9%) ontwikkelde een fistel. Meshinfectie was niet gerapporteerd, bij één mesh |
|
|
|
|
|
(Biodesign, Cook Medical, |
|
|
1/34 (2.9%) was er noodzaak |
|
|
Bloomington, IN), |
tot verwijdering. Het aantal |
||||||
|
and the rest were porcine |
recidieven werd niet |
||||||
|
dermis (two XenMatrix, |
gerapporteerd. Bij 9/34 (26.5%) |
||||||
|
(Bard, Warwick, RI), two |
van de patiënten was er |
||||||
|
XCM (DePuy Synthes, West |
noodzaak tot heroperatie. |
||||||
|
Chester, PA), two Fortiva, |
|
||||||
|
(RTI Surgical, Alachua, FL), |
|
||||||
|
15 Non-crosslinked porcine |
|
||||||
|
dermal matrix, |
|
||||||
|
(Acelity, San Antonio, TX), |
|
||||||
|
two not recorded |
|
||||||
|
Chamieh |
Retrospective |
Patients receiving contaminated CAWR |
Syn: 19 lightweight |
NA |
Median follow- |
Bij 7/24 (24%) van de patiënten |
|
|
2017 |
cohort |
with placement of either biologic or |
polypropylene, five |
|
up 7.9 months |
ontwikkelde zich een |
|
|
|
|
synthetic mesh |
heavyweight polypropylene |
|
(all>5) |
wondinfectie, bij nul patiënten |
|
|
|
|
|
|
|
|
een fistel. Meshinfectie werd |
|
|
|
|
|
|
|
|
niet gerapporteerd, maar er |
|
|
|
|
|
|
|
|
was geen noodzaak tot het |
|
|
|
|
|
|
|
|
verwijderen van mesh. Het |
|
|
|
|
|
|
|
|
aantal recidieven werd niet |
|
|
|
|
|
|
|
|
gerapporteerd. Het aantal |
|
|
|
|
|
|
|
|
heroperaties was 8/24 (33.3%). |
|
|
Majumder |
Retrospective |
patients undergoing open ventral hernia |
Bio: |
NA |
mean follow-up |
22/69 (31.9%) van het gehele |
|
|
2016 |
cohort |
repair in clean- |
“porcine xenograft” |
|
21.5 months (sd |
cohort ontwikkelde een |
|
|
|
Multicenter |
contaminated/contaminated fields |
|
|
10.5) |
wondinfectie. Het aantal fistels |
|
|
|
|
using biologic or synthetic mesh |
|
|
|
of meshinfecties werd niet |
|
|
|
|
|
|
|
|
gerapporteerd. Bij 2/69 (2.9%) |
|
|
|
|
|
|
|
|
was er noodzaak tot |
|
|
|
|
|
|
|
|
verwijdering van de mesh. Bij |
|
|
|
|
|
|
|
|
15/69 (26.3%) was er een |
|
|
|
|
|
|
|
|
recidief van de littekenbreuk. |
|
|
Majumder |
Retrospective |
patients undergoing open ventral hernia |
Syn: midweight, |
NA |
mean follow-up |
7/57 (12.3%) van de patiënten |
|
|
2016 |
cohort |
repair in clean- |
macroporous (92%), 8% |
|
18.4 months (sd |
ontwikkelde een wondinfectie. |
|
|
|
Multicenter |
contaminated/contaminated fields |
heavyweight, microporous, |
|
9.6) |
Het aantal fistels of |
|
|
|
|
using biologic or synthetic mesh |
polyester 5/57 (8.8%) |
|
|
meshinfecties werd niet |
|
|
|
|
|
|
|
|
gerapporteerd. 1/57 (1.8%) van |
|
|
|
|
|
|
|
|
de meshes moest worden |
|
|
|
|
|
|
|
verwijderd. Bij 4/57 (8.9%) was er een recidief van de littekenbreuk. |
|
|||
|
Atema 2017 |
Retrospective cohort Multicenter |
Patients contaminated reconstruction |
undergoing abdominal |
major wall |
Non-crosslinked dermal matrix |
porcine |
NA |
Median follow- up 7 months (IQR 4-15) |
36/80 (45%) van de patiënten ontwikkelde een wondinfectie. 7/80 (9%) ontwikkelde een postoperatief een fistel. Er was geen meshinfectie of noodzaak tot het verwijderen van de mesh. 10/76 (13.2%) ontwikkelde een recidief na een follow-up van mediaan 7 maanden. Bij 3/80 (4%) van de patiënten was er noodzaak tot heroperatie in verband met wondinfectie en fistelvorming. |
|
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 07-11-2018
Beoordeeld op geldigheid : 23-11-2018
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep wel/niet in stand gehouden. Uiterlijk in 2023 bepaalt het bestuur van de Nederlandse Vereniging voor Heelkunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse vereniging Voor Heelkunde is regiehouder van deze richtlijn Littekenbreuken en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn Littekenbreuken. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Autorisatie en commentaarfase
De conceptrichtlijn wordt aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (http://www.kennisinstituut.nl) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van het project is het ontwikkelen van een multidisciplinaire evidencebased richtlijn voor de diagnostiek en behandeling van patiënten met complexe littekenbreuken. Met behulp van deze richtlijn kan de praktijkvariatie worden teruggedrongen en kan de zorg aan deze patiëntengroep worden verbeterd. Een evidencebased richtlijn zal bijdragen aan meer uniformiteit in de behandeling en zal waardevol zijn om toegewijde chirurgen en andere gerelateerde zorgverleners te ondersteunen bij een effectieve en veilige behandeling.
Doelgroep
Deze richtlijn geldt voor alle volwassen patiënten met één of meerdere littekenbreuken in de buikwand tussen de laterale zijde van de musculus abdominis recti.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2016 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met Littekenbreuken te maken hebben.
Werkgroep
- Dr. S.W. (Simon) Nienhuijs, chirurg, werkzaam in het Catharina ziekenhuis, Eindhoven, NVvH (voorzitter)
- Dr. T.J. (Theo) Aufenacker, chirurg, werkzaam in het Rijnstate, Arnhem, NVvH
- E. (Elske) Berkvens, MSc, fysiotherapeut, werkzaam in het Elkerliek ziekenhuis, Helmond, KNGF
- Prof. dr. M.A. (Marja) Boermeester, chirurg, werkzaam in het AMC, Amsterdam, NVvH
- S. (Sandra) Janssen MSc, verpleegkundig specialist, werkzaam in het Elkerliek ziekenhuis, Helmond, V&VN
- Dr. R.K.J. (Rogier) Simmermacher, chirurg, werkzaam in het UMC, Utrecht, NVvH
- Dr. T.S. (Tammo) de Vries Reilingh, chirurg, werkzaam in het Elkerliek ziekenhuis, Helmond, NVvH
- P. (Pieter) Zwanenburg MSc., arts onderzoeker, werkzaam in het AMC, Amsterdam
Met ondersteuning van:
- Dr. W.A. van Enst, senior-adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- H. Kooijmans, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- D.P. Gutierrez, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Aufenacker |
Chirurg |
Penningmeester DHS/ werkgroep buikwand chirurgie van NVGIC. Lid Steering committee Herniasurge: International guidelines for groin hernia management |
- |
Geen |
|
Berkvens |
Fysiotherapeut |
Extern beoordelaar scripties bij Fontys Hogeschool opleiding Fysiotherapie |
- |
Geen |
|
Boermeester |
GE Chirurg |
Advisory board member and/of speaker for Acelity/KCI, Bard, Johnson&Johnson Vice-president van |
Grants en pending grants voor investigator-initiated onderzoek (geen contract onderzoek) van Baxter, Ipsen, Bard, Acelity/KCI, Mylan, Johnson&Johnson, LifeCell/Allergan |
Geen |
|
|
|
Surgical Infection Society Europe |
|
|
|
Enst, van |
Senior-adviseur |
Lid van GRADE working group / Dutch GRADE Network |
- |
Geen |
|
Janssen |
Verpleegkundig Specialist wondzorg |
Docent opleiding wondverpleegkundige Zorgacademie Radboud UMC en Zorgacademie Erasmus MC Docent opleiding wondconsulent Zorgacademie Radboud UMC Bestuurslid V&VN Lid Wondplatform Nederland |
- |
Geen |
|
Nienhuijs |
Chirurg |
DHS/ voorzitter werkgroep buikwand chirurgie van NVGIC |
Deelname hernia umbilcalis/epigastrica studie zowel Medtronic als bij Johnson & Johnson. |
Geen |
|
Simmermacher |
Chirurg en Hoofd afdeling Heelkunde |
- |
- |
Geen |
|
Vries, de Reilingh |
Gastro- Intestinaal chirurg en Chirurg Oncoloog |
- |
Multicenter studies geinitieerd elders: Phasix trial, Sanics II trial, Close-up trial |
Geen |
|
Zwanenburg |
Promovendus / onderzoeker |
- |
Promotie traject gefinancierd vanuit een grant voor het AMC als "center of expertise" van Acelity/KCI |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een focusgroep. Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. Tijdens de oriënterende zoekactie werd gezocht op literatuur naar patiëntenperspectief (zie Strategie voor zoeken en selecteren van literatuur).
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft geen interne kwaliteitsindicatoren ontwikkeld maar doet suggesties wat geregisteerd kan worden.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidencebased richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door Nederlandse vereniging voor Heelkunde, Koninklijk Nederlands Genootschap Fysiotherapie, Verpleegkundigen & Verzorgende Nederland, Kenniscentrum Wondzorg, Kenniscentrum Wondzorg, Zorgverzekeraars Nederland via een Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen Nice en Sign richtlijnen, systematische reviews via Medline (OVID). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE- methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE- methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Randvoorwaarden.
Indicatorontwikkeling
Er werden geen interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
van Everdingen JJE, Burgers JS, Assendelft WJJ, et al. Evidence-based richtlijnontwikkeling. Bohn Stafleu Van Loghum. 2004.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit.https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
||||
|
Medline (OVID) – 27 07 2017 |
PUBMED 4007 hits ("Hernia, Abdominal"(Majr) OR "Hernia, Ventral"(Majr) OR "Herniorrhaphy"(Mesh) OR "Incisional Hernia"(Majr) OR abdominal hernia*(tiab) OR abdominal wall(tiab) OR abdominal wall defect*(tiab) OR ventral hernia*(tiab) OR incisional hernia*(tiab) OR hernia repair*(tiab) OR incisional hernia repair*(tiab) OR abdominal wall repair*(tiab) OR abdominal wall reconstruction*(tiab)) AND ("Intestinal Fistula"(Mesh) OR "Enterostomy"(Mesh) OR complex(tiab) OR dirty(tiab) OR contamination(tiab)OR contaminated(tiab) OR clean-contaminated(tiab) OR septic dehiscence*(tiab) OR grade 3(tiab) OR grade 4(tiab) OR grades 3(tiab) OR grades 4(tiab) OR infected(tiab) OR mesh infection*(tiab) OR infected mesh*(tiab) OR fistula*(tiab) OR enterostom*(tiab)) |
22 na selectie. 598 studies werden geëxcludeerd op basis van de full- text. |
||||
|
Embase (Elsevier) |
EMBASE (Ovid): Database(s): Embase Classic+Embase 1947 to 2017 July 26 Search Strategy: |
|||||
|
|
# |
Searches |
Results |
|
||
|
1 |
exp *abdominal wall hernia/ or *incisional hernia/ or exp *abdominal wall defect/ or hernioplasty/ or herniorrhaphy/ or (abdominal hernia* or abdominal wall or abdominal wall defect* or abdominal wall repair* or abdominal wall reconstruction* or ventral hernia* or incisional hernia* or hernia repair*).ti,ab,kw. |
57898 |
||||
|
2 |
exp *digestive system fistula/ or *intestine fistula/ or exp *enterostomy/ or (complex or dirty or contaminated or clean-contaminated or septic dehiscence* or grade 3 or grade 4 or grades 3 or grades 4 or infected or mesh infection* or infected mesh* or fistula* or enterostom* or contamination).ti,ab,kw. |
2065958 |
||||
|
3 |
1 and 2 |
5709 |
||||
|
Cochrane |
Cochrane library 487 hits ID Search Hits #1 MeSH descriptor: (Hernia, Abdominal) explode all trees 1408 #2 MeSH descriptor: (Hernia, Ventral) explode all trees 224 #3 MeSH descriptor: (Herniorrhaphy) explode all trees 371 #4 MeSH descriptor: (Incisional Hernia) explode all trees 11 #5 abdominal hernia* or abdominal wall or abdominal wall defect* or ventral hernia* or incisional hernia* or hernia repair* or incisional hernia repair* or abdominal wall repair* or abdominal wall reconstruction*:ti,ab,kw (Word variations have been searched) 3395 #6 #1 or #2 or #3 or #4 or #5 3773 #7 MeSH descriptor: (Intestinal Fistula) explode all trees 194 #8 MeSH descriptor: (Enterostomy) explode all trees 457 #9 complex or dirty or contaminated or clean-contaminated or septic dehiscence* or grade 3 or grade 4 or grades 3 or grades 4 or infected or mesh infection* or infected mesh* or fistula* or enterostom* or contamination:ti,ab,kw (Word variations have been searched) 65077 #10 #7 or #8 or #9 65458 |
|
||||
|
|
#11 #6 and #10 487 |
|
Exclusietabel
Omdat er voor de aanvullende search 598 artikelen full-text gelezen en daarop geëxcludeerd zijn, acht de werkgroep het niet bijdragend deze hier te vermelden. Artikelen werden met name geëxcludeerd omdat men niet rapporteerde of er sprake was van contaminatie, de resultaten gepresenteerd werden voor een cohort met daarin zowel schone als gecontamineerde casus, of het niet duidelijk was welk type mesh bij gebruikt was voor de gepresenteerde resultaten.
