Preventie chronische pijn na liesbreukchirurgie
Uitgangsvraag
Hoe kan de incidentie van chronische pijn na liesbreukchirurgie worden verlaagd?
De uitgangsvraag omvat de volgende deelvragen:
- Gaat het herkennen van de lieszenuwen gepaard met een reductie in de incidentie van acute en chronische pijn na open liesbreukchirurgie?
Resectie:
- Leidt een profylactische neurectomie van de n. ilio-inguinalis, n. ilio-hypogastricus of de genitale tak van de n. genito-femoralis tot minder acute en chronische pijn na open liesbreukchirurgie?
- Leidt een pragmatische neurectomie (indien de zenuw interfereert met de matplaatsing) tot minder postoperatieve pijn?
- Leidt breukzakresectie en ligatie tot meer acute en/of chronische pijn bij open liesbreukchirurgie?
- Leidt matfixatie op het os pubis tot meer acute en/ of chronische pijn?
Aanbeveling
Schenk tijdens liesbreukchirurgie aandacht aan het verloop van de lieszenuwen om de kans op chronische pijn te reduceren.
Een profylactische IIN of IHN neurectomie biedt weinig klinisch voordeel op chronische pijn en hoeft dan ook niet standaard uitgevoerd te worden.
Overweeg om een pragmatische neurectomie van één of meerdere lieszenuwen uit te voeren in het geval van een iatrogene beschadiging tijdens matplaatsing.
Voer niet standaard een breukzakresectie en -ligatie uit tijdens open liesbreukchirurgie aangezien dit tot meer postoperatieve pijn leidt. In het geval van een grote breukzak kan vanwege de verhoogde recidiefkans toch voor breukzakresectie gekozen worden.
Vermijd het plaatsen van hechtingen door het periost van het os pubis aangezien dit tot chronische pijn kan leiden.
Overwegingen
Neurectomie
De inguinale zenuwen spelen een belangrijke rol in de ontwikkeling van chronische pijn na liesbreukchirurgie. Het herkennen van het verloop van deze zenuwen lijkt de kans op iatrogene zenuwbeschadiging te verminderen (Wijsmuller, 2011). Hoewel bewijs hiervoor in gerandomiseerde studies ontbreekt, is de werkgroep toch van mening dat een zenuwbewuste operatietechniek van groot belang is om chronische pijn te voorkomen.
Naast een zenuwbewuste operatietechniek behoort een profylactische neurectomie van de n. iliohypogastricus, n. ilio-inguinalis en de genitale tak van de n. genito-femoralis tot de mogelijkheden. Volgens een meta-analyse uit 2014 (Barazanchi) zou een profylactische neurectomie van de n. ilio-inguinalis een mogelijke pijnreductie tussen 3 en 12 maanden opleveren. Na 12 maanden is er geen significant verschil aantoonbaar. Daarentegen is er geen verschil in sensibiliteit stoornissen gevonden. Dit betrof vaak wel een subjectieve registratie van de patiënten. Vergeleken met de vorige meta-analyse van Hsu uit 2012 over dit onderwerp is de conclusie grotendeels aangepast. In 2012 was namelijk de conclusie dat er geen effect op pijnreductie zou zijn, maar wel een toename van sensibiliteitsstoornissen. Dit verschil in conclusies komt vooral doordat er twee RCT’s in de laatste meta-analyse zijn geëxcludeerd en er 2 oude en 6 nieuwe RCT’s zijn geïncludeerd. Hier zitten veelal kleine studies bij uit niet-westerse landen. De uitkomsten zijn tevens erg heterogeen. Een profylactische neurectomie zou een positief effect hebben tot 12 maanden. Daarnaast valt onder de dichotome waarde wel/ geen pijn iedere VAS/ NRS waarde >0. Dit betreft dan ook veelal patiënten met slechts milde pijn. Men kan zich sterk afvragen of dit klinisch relevante verschillen zijn.
Bewijs omtrent een profylactische neurectomie van de n ilio-hypogastricus is zeer beperkt en betreft slechts 2 studies (Caliskan en Karakayali). Hieruit zou blijken dat een neurectomie op de korte termijn tot minder pijn zou leiden. Er is een trend inaar minder pijn op de lange termijn.
Concluderend is er geen bewijs voor het effect van het herkennen van lieszenuwen op chronische of acute pijn na liesbreukchirurgie. De (on)zekerheid over de effecten van profylactische neurectomie is groot. De bewijskracht is laag tot zeer laag.
Het bewijs voor een positief effect van een profylactische neurectomie van de n-ilioinguinalis op korte en middellange termijn is matig. Op de lange termijn lijkt er geen voordeel te zijn voor een profylactische neurectomie. Bewijs omtrent een profylactische neurectomie van de n. iliohypogastricus is zeer beperkt. Een mogelijke complicatie die niet beschreven wordt in de huidige meta-analyse is potentiele neuroomvorming met het optreden van chronische pijn tot gevolg. De werkgroep is dan ook van mening dat een profylactische neurectomie niet standaard uitgevoerd dient te worden om chronische pijn te voorkomen.
Een alternatief vormt een pragmatische neurectomie. Hierbij wordt een zenuw die een iatrogene beschadiging ondervindt door dissectie, hechtingen of mat plaatsing toch verwijderd zodat de kans op neuropathische pijn verkleind wordt. Uit enkele cohort studies blijkt dat dit tot minder chronische pijnklachten leidt (Smeds). Het bewijs hiervan is laag. Echter, er zijn behoudens het ontstaan van hypo-esthesie geen evidente nadelen beschreven van een pragmatische neurectomie. De werkgroep is derhalve van mening dat dit gerechtvaardigd is in de hierboven beschreven situaties.
Kosten
Er zijn geen kosten-baten analyses omtrent profylactische of pragmatische neurectomie bekend. De extra kosten zullen minimaal zijn aangezien de betreffende zenuwen tijdens de Lichtenstein operatie direct verwijderd kunnen worden. De mogelijke baten zijn zojuist uiteengezet.
Breukzakresectie
Tijdens open liesbreukoperatie kan een breukzakresectie worden uitgevoerd. Uit een gerandomiseerde studie onder 110 patiënten blijkt dat het achterwege laten van een breukzakresectie niet tot meer recidieven leidt, wel tot minder ernstige postoperatieve pijn (Smedberg, 1984). In 2007 verscheen er een studie onder 477 patiënten waaruit blijkt dat er significant minder vroege postoperatieve pijn optreedt in de groep zonder breukzakresectie. (Delikoukos). Deze bevinding werd nog eens bevestigd in een studie van Othman uit 2014. Uit een grote cohort studie uit Zweden is het aantal recidieven wel iets groter indien er geen breukzakresectie plaatsvindt (1.7 versus 2.7%) (stylianidis).
Hoewel er dus een iets grotere kans is op recidieven is de werkgroep toch van mening dat een breukzakresectie indien mogelijk vermeden moet worden. De bewijslast hiervoor is beperkt.
Periostitis pubis
Periostitis pubis vormt naast neuropathische pijn ook een belangrijke oorzaak van chronische pijn na liesbreukchirurgie. De oorzaak hiervan kan liggen in het hechten van de mat op het os pubis. Het voorkomen van hechtingen door het periost van het tuberculum pubicum is dan ook belangrijk om dit pijnbeeld te voorkomen. Het bewijs voor deze bewering is zwak, maar wordt door de werkgroep wel als sterk afgegeven omdat hiermee de kans op periostitis relatief eenvoudig verlaagd kan worden. (Cunningham, 1996; Loos, 2007).
Onderbouwing
Achtergrond
Chronische pijn komt frequent voor na een scala aan chirurgische ingrepen. Echter, de oorzaak is niet altijd bekend. In het geval van liesbreukchirurgie kan de symptomatologie variëren doordat er verschillende anatomische structuren in de lies mogelijk zijn aangedaan. Dit hangt vaak samen met de initiële operatietechniek.
Terwijl sommige factoren zoals iatrogene zenuwbeschadiging voorkomen kunnen worden, blijft chronische liespijn na liesbreukchirurgie een complex probleem dat veel patiënten treft.
Conclusies / Summary of Findings
|
- GRADE |
Er is geen bewijs voor het effect van een zenuwbewuste aanpak op de incidentie van chronische pijn, acute pijn en sensibiliteitsstoornissen na een Lichtenstein operatie.
Bronnen: - |
|
Laag/ Zeer laag GRADE |
Vergeleken met een zenuwsparende aanpak kan een profylactische n. ilio-inguinalis (IIN) neurectomie ten tijde van Lichtenstein operatie resulteren in een klein, maar klinisch minimale reductie in chronische pijn tussen 3 tot 12 maanden postoperatief
Vergeleken met zenuwsparende aanpak is het onduidelijk of ten tijde van een Lichtenstein operatie een profylactische n. ilio-hypogastricus (IHN) neurectomie resulteert in een reductie van chronische pijn tussen 3 en 12 maanden postoperatief.
Bronnen: (Barazanchi, 2016) |
|
Zeer laag GRADE |
Vergeleken met een zenuwsparende aanpak is het onduidelijk of ten tijde van een Lichtenstein operatie een profylactische IIN of IHN neurectomie resulteert in een klein tot acceptabele reductie van milde chronische pijn na 12 maanden.
Bronnen: (Barazanchi, 2016) |
|
- GRADE |
Er is geen bewijs dat een profylactische neurectomie effect heeft op acute pijn na een Lichtenstein operatie.
Bronnen: - |
|
Laag GRADE |
Een profylactische neurectomie (IIN of IHN) ten tijde van een Lichtenstein operatie lijkt geen invloed te hebben op het ontstaan van sensibiliteitsstoornissen.
Bronnen: (Barazanchi, 2016) |
Samenvatting literatuur
A search using the PICO 1 criteria did not identify studies relevant for the subject of CICP after nerve-recognition. The search using PICO 2 criteria identified one systematic review with meta-analysis (Brazanchi 2016) relevant for the subject of chronic pain after nerve resection. This review included a total of 13 RCTs. Eleven RCTs performed ilioinguinal nerve (IIN) neurectomies and three RCTs performed iliohypogastric nerve (IHN) neurectomies. There was no RCT that performed a GFN neurectomy. Three studies stated that all 3 nerves (IIN, IHN, and GFN) were identified; the remainder of the studies only mentioned the identification of either IIN or IHN. Over half the studies specified ‘‘care’’ or ‘‘extreme care’’ taken with and minimal handling of the nerves in the preservation group; the remainder only stated that the nerves were ‘‘preserved’’. Barazanchi (2016) recorded pain scores either during normal daily activities or during walking if the former was not available.
A total of 1241 patients were recruited in all the study groups. For investigation of IIN, 1031 patients were recruited with 506 patients receiving a prophylactic neurectomy. For IHN, 270 patients were recruited with 137 neurectomy patients. The authors of the review stated that the follow-up was near complete with the various groups at different follow-up periods, but numbers were not reported.
Results
Nerve-recognition
No studies were found that met the inclusion criteria and assessed the effect of nerve-recognition on the incidence of CPIP.
Nerve resection
Chronic pain (critical outcome)
Pain (yes/ no) and pain score (VAS 0 tot 10) were reported at 3 months to less than 12 months and at 12 months or longer.
Ilioinguinal pain
3 months to less than 12 months
A total of 8 RCTs (n=670) (Bansal, 2013; Chatterjee, 2014; Crea, 2010; Hokkam, 2009; Ibrahim, 2006; Malekpour, 2008; Mui, 2016; Nasir, 2014) reported on IIN chronic pain (yes/ no) at 3 months to less than 12 months (Figure 1). Chronic pain was reported in 7% (24/332) of the patients receiving neurectomy versus 25% (83/338) of those with nerve preservation (RR 0.30, 95% CI 0.20 to 0.46). On average, 5.6 patients would have to receive IIN nerve resection (instead of nerve preservation) for one additional patient to not have IIN chronic pain in the time period from 3 to 12 months post-operative.
A total of 7 RCTs (n=664) (Chatterjee, 2014; Hokkam, 2009; Ibrahim, 2006; Khoshmohabat, 2012; Malekpour, 2008; Mui, 2016; Nasir, 2014) reported chronic pain score (VAS 0 to 10) at 3 months to less than 12 months (Figure 2). Mean chronic pain score ranged from 0.33 to 0.8 in the nerve resection group, the mean chronic pain score ranged from 0.17 to 1.63 in the nerve preservation group, indicating that on average patients in both groups could be classified as having mild pain. The SMD was -0.44 (95% CI -0.66 to -0.21), indicating a small to reasonable difference in favour of nerve resection within the category ‘mild pain’.
Quality of the evidence
Evidence originated from RCTs and the level of the quality of the evidence comparing nerve resection versus nerve preservation started therefore at ‘High’. However, the quality of the evidence for chronic pain at 3 months to less than 12 was downgraded with two levels to ‘Low’ for serious methodological limitations of the studies (Risk of Bias due to selective reporting and unclear allocation concealment).
12 months or longer
Three RCTs (n=312) (Crea, 2010; Karakayali, 2010; Malekpour, 2008) reported on chronic pain (yes/no) at 12 months or longer (Figure 3). Chronic pain was reported in 7% (10/150) of the patients receiving neurectomy versus 14% (22/162) of those with nerve preservation (RR 0.50, 95% CI 0.25 to 1.01). On average, 14.3 patients would have to receive nerve resection (instead of nerve preservation) for one additional patient to not have chronic pain at 12 months or longer. Although the RR is substantial, the confidence interval crossing 1 indicates imprecision in this effect estimate and the probability of no clinical relevant difference between both groups.
Quality of the evidence
Evidence originated from RCTs and the level of the quality of the evidence comparing nerve resection versus nerve preservation started therefore at ‘High’. However, the quality of the evidence was downgraded with three levels to ‘Very low’, two levels for serious methodological limitations of the studies (Risk of Bias due to selective reporting and unclear allocation concealment) and one level for considerable heterogeneity (minimal or no overlap of confidence intervals in studies and indicating either an effect or no effect, I2 statistic 86%).
Iliohypogastric pain
3 months to less than 12 months
One study (Caliskan, 2010) assessed the efficacy of IHN neurectomy and subcutaneous transposition of the spermatic cord and ilioinguinal and genital nerves about 6 months after the operation (n=54). The incidence and severity of chronic pain were at this timepoint not significantly different between the neurectomy group and the control group at rest (VAS score, 0 versus 1.6 ± 4.8, p=0.103). None of the patients in the neurectomy group complained about chronic pain after walking and climbing up stairs. The mean VAS score after walking was 0 in the neurectomy group versus 6.0 in the control group (SD 10.9) (p=0.013).
Quality of the evidence
Evidence originated from one RCT and the level of the quality of the evidence comparing IHN resection versus nerve preservation from 3 to less than 12 months started therefore at ‘High’. However, the quality of the evidence was downgraded with three levels to ‘Very low’, due to serious imprecision (one study with a very small sample size and a very low number of events).
12 months or longer
One study (Karakayali, 2010) (n=120) assessed the presence of chronic pain at 1 year after IHN neurectomy versus nerve preservation. In the nerve preservation group, a total of 14 patients reported pain (23.3%) versus10 (16.7%) (p=0.36) in the IHN neurectomy group. Mild pain during daily activities after nerve preservation or IHN neurectomy was reported by 6 versus 4 patients, respectively. For moderate pain this was 2 vs 1 patient, respectively.
Quality of the evidence
Evidence originated from one RCT and the level of the quality of the evidence comparing IHN resection versus nerve preservation started therefore at ‘High’. However, the quality of the evidence was downgraded with three levels to ‘Very low’, due to serious imprecision (one study with a very small sample size and a very low number of events).
Acute pain (critical outcome)
The outcome measure acute pain was not reported in the systematic review (Barazanchi, 2016).
Sensory disturbances (important outcome)
Ilioinguinal sensory changes
Ilioinguinal sensory changes were subjectively measured (subjective sensory change) and objectively measured (objective numbness) at 3 months to less than 12 months and at 12 months or longer. A total of 6 RCTs (n=419) (Bansal, 2013; Chatterjee, 2014; Hokkam, 2009; Ibrahim, 2006; Malekpour, 2008; Mui, 2006) reported subjective sensory change at 3 to less than 12 months and did not find differences between the groups (RD -0.02, 95% CI -0.02 to 0.06). Three RCTs (n=247) (Bansal, 2013; Crea, 2010; Mui, 2006) did not find differences in objective numbness (RD 0.00, 95% CI -0.03 to 0.03) between groups.
Two RCTs (n=161) (Ibrahim, 2006; Malekpour, 2008) reported subjective sensory change at 12 months or longer (RD -0.06, 95% CI -0.22 to 0.35) and did not find differences between the groups. Crea (2010) and Karakayali (2010) (n=207) did not find differences in objective numbness (RD 0.00, 95% CI -0.03 to 0.04) between groups.
Iliohypogastric sensory changes
Only 1 RCT (Karakayali, 2010) reported subjective sensory change at 12 months or longer and showed a trend, which was not significant towards reduction in sensation with neurectomy (values were not reported).
Quality of the evidence
Evidence originated from RCTs and the level of the quality of the evidence comparing nerve resection versus nerve preservation started therefore at ‘High’. However, the quality of the evidence was downgraded with one level to ‘Low’ for some methodological limitations of the studies (Risk of Bias due to selective reporting and unclear allocation concealment) and for imprecision (confidence interval includes zero and sample size <2000).
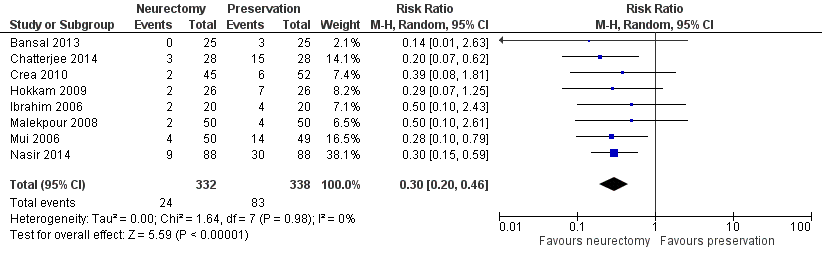
Figure 1 IIN neurectomy versus preservation. Outcome: chronic pain at 3 months to less than 12 months
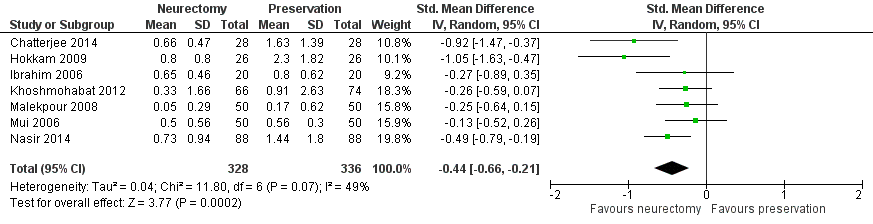
Figure 2 IIN neurectomy versus preservation. Outcome: chronic pain score at 3 months to less than 12 months
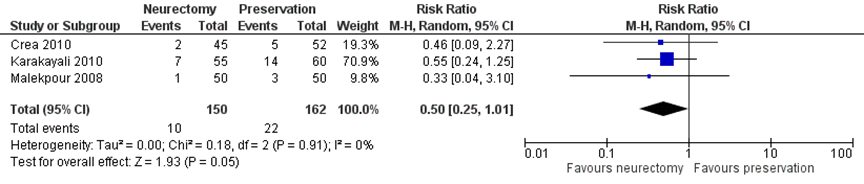
Figure 3 IIN neurectomy versus preservation. Outcome: chronic pain at >12 months
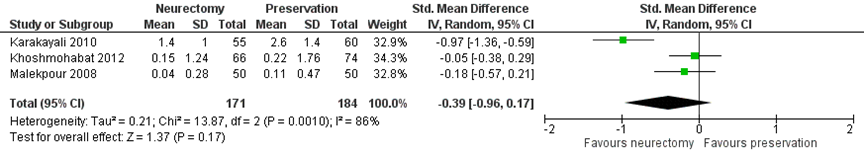
Figure 4 IIN neurectomy versus preservation. Outcome: chronic pain score at >12 months
Zoeken en selecteren
In order to answer the clinical ‘question’, a systematic literature search was done for the following research questions:
How can the incidence of CPIP be reduced? (nerve-recognition, nerve resection)
PICO 1
P: adult patients with an inguinal hernia and an indication for surgery;
I: groin hernia repair with nerve recognition;
C: groin hernia repair without nerve recognition8;
O: chronic pain (>3 months), acute pain, sensory disturbances.
PICO 2
P: adult patients with an inguinal hernia and an indication for surgery;
I: groin hernia repair with prophylactic resection;
C: groin hernia repair without prophylactic resection;
O: chronic pain (>3 months), acute pain, sensory disturbances.
Relevant outcome measures
The working group decided that chronic pain was a crucial outcome measure for decision-making and acute pain and sensory disturbances important outcome measures for decision-making.
Searching and selecting (Methods)
The information specialist from the Cochrane Centre in the Netherlands searched Medline and Embase on April 11th 2017 and the Cochrane Register on April 12th 2017 for systematic reviews (SRs) and randomized controlled trials (RCTs) about inguinal hernias, without restrictions on publication date. All duplicates (including duplicates from the former search on the 30th of June 2015) were removed. The search details can be found in the tab Acknowledgement.
Literature experts excluded studies that were clearly not relevant for answering clinical questions about inguinal hernias. Therefore, 66 SRs and 241 RCTs remained to be judged by the working group.
The working group selected 11 studies (SRs and RCTs) based on title-abstract. Among these studies were two SRs that could be included for this research question. After reading the full text of those two studies, one was excluded (see exclusion table in the tab Acknowledgement). Finally, one SR was included for analysis.
One SR (Barazanchi, 2016) containing 13 RCTs was included for the literature analysis for answering the second PICO. No studies could be included for answering the first PICO.
The most important study characteristics and results were extracted from the SRs or original studies (in case of missing information in the review). The most important study characteristics and results are shown in the evidence tables. The judgement of the individual study quality (Risk of Bias) is shown in the Risk of Bias tables.
Data extraction and analysis
The most important study characteristics and results were extracted from the SRs or original studies (in case of missing information in the review). The most important study characteristics and results are shown in the evidence tables. The judgement of the individual study quality (Risk of Bias) is shown in the Risk of Bias tables.
Relevant pooled and/or standardised effect measures were, if useful, calculated using Review Manager 5.3 (Cochrane Collaboration, Oxford, United Kingdom). If pooling results was not possible, the outcomes and results of the original study were used as reported by the authors.
The working group defined clinical (patient) relevant differences for the outcome chronic pain based on the severity of the pain. Different severities were subdivided according to a previously validated classification (Kelly, 2001), which was also used to evaluate different severities among adult patients (≥18 years) who underwent groin hernia repair by Loos (2007): 0 = no pain, <3 = mild pain, 3–7 = moderate pain, >7 = severe pain. The working group defined chronic pain as any VAS ≥ 3.
The working group used the following boundaries for relevance, if applicable: for continue outcome measures: RR<0.75 or > 1.25 (GRADE recommendation) or standardized mean difference (SMD=0.2 (small); SMD 0.5 (reasonable); SMD=0.8 (large). These boundaries were compared with the results of our analysis. The interpretation of dichotomous outcome measures is strongly related to context; therefore, no clinical relevant boundaries were set beforehand. For dichotomous outcome measures, the absolute effect was calculated (Number Needed to Treat (NNT) or Number Needed to Harm (NNH)).
Referenties
- Barazanchi AW, Fagan PV, Smith BB, et al. (2016) Routine Neurectomy of Inguinal Nerves During Open Onlay mesh Hernia Repair: A Meta-analysis of Randomized Trials. Ann Surg 264(1):64-72. doi: 10.1097/SLA.0000000000001613. PubMed PMID: 26756767.
- Bansal A, Rabha S, Griwan M, et al. (2013) Comparative Evaluation Of Preservation Versus Elective Division Of The Ilioinguinal Nerve In Open mesh Repair Of Inguinal Hernias. Internet J Surg 30(1).
- Basimbe F, Ongom PA, Kijjambu SC, et al. (2013) Postoperative pain in Lichtenstein repair with iliohypogastric neurectomy compared to standard Lichtenstein repair for inguinal hernias at Mulago Hospital, a sub-Saharan Africa tertiary centre. J Gen Pract 1:17.
- Caliskan K, Nursal TZ, Caliskan E, et al. (2010) A method for the reduction of chronic pain after tension-free repair of inguinal hernia: iliohypogastric neurectomy and subcutaneous transposition of the spermatic cord. Hernia 14(1):51-5. doi: 10.1007/s10029-009-0571-5. Epub 2009 Oct 14. PubMed PMID: 19826895.
- Chatterjee S, Kumar R. (2014) A comparative study of inguinodynia following Lichtenstein hernioplasty with or without elective neurectomy of ilioinguinal nerve. Hellenic J Surg 86:137141.
- Crea N, Pata G. (2010) Effects of prophylactic ilioinguinal nerve excision in mesh groin hernia repair: short- and long-term follow-up of a randomized clinical trial. Am Surg 76(11):1275-81. PubMed PMID: 21140698.
- Cunningham J, Temple WJ, Mitchell P, et al. Cooperative hernia study. (1996) Pain in the postrepair patient. Ann Surg 224:598-602.
- Delikoukos S, Lavant L, Hlias G, et al. (2007) The role of hernia sac ligation in postoperative pain in patients with elective tension-free indirect inguinal hernia repair: A prospective randomized study. Hernia 11:425-428.
- Hokkam E. (2009) The effect of ilioinguinal neurectomy in elective inguinal hernia repair on chronic postoperative pain. Egypt J Surg 4:156162.
- Hsu W, Chen C-S, Lee H-C et al (2012) Preservation versus division of ilioinguinal nerve on open mesh repair of inguinal hernia: a meta-analysis of randomized controlled trials. World J Surg 36(10):23112319
- Ibrahim M, Fayed W, Soliman K, et al. (2006) A randomized controlled study to compare the effect of ilioinguinal neurectomy or preservation of the ilioinguinal nerve in Lichtenstein tension free hernioplasty for inguinal hernia. J Med Res Inst 27:283288.
- Jatoi A, Younus S, Ghayassuddin M, et al. (2014) Postoperative pain: comparison after preservation and elective division of ilioinguinal nerve in inguinal hernioplasty. Professional Med J 21:559565.
- Karakayali F, Oksuz E, Turk E, et al. (2010) Effectiveness of multiple neurectomies to prevent chronic groin pain after tension-free hernia repair. Int Surg 95(1):40-8. PubMed PMID: 20480839.
- Kelly AM. (2001) The minimum clinically significant difference in visual analogue scale pain score does not differ with severity of pain. Emerg Med J 18:205207.
- Khoshmohabat H, Panahi F, Alvandi AA, et al. (2012) Effect of Ilioinguinal Neurectomy on Chronic Pain following Herniorrhaphy. Trauma Mon 17(3):323-8. doi: 10.5812/traumamon.6581. Epub 2012 Oct 10. PubMed PMID: 24350117.
- Loos MJ, Roumen RM, Scheltinga MR. (2007) Chronic sequelae of common elective groin hernia repair. Hernia 11(2):169-73. Epub 2007 Feb 6.
- Loos MJA, Roumen RMH, Scheltinga MRM. (2007) Classifying post-herniorrhaphy pain syndromes following elective inguinal hernia repair. World J Surg 31(9):1760-1767. doi:10.1007/s00268-007-9121-4.
- Malekpour F, Mirhashemi SH, Hajinasrolah E, et al. (2008) Ilioinguinal nerve excision in open mesh repair of inguinal hernia--results of a randomized clinical trial: simple solution for a difficult problem? Am J Surg 195(6):735-40. doi: 10.1016/j.amjsurg.2007.09.037. Epub 2008 Apr 28. PubMed PMID: 18440489.
- Mui WL, Ng CS, Fung TM, et al. Prophylactic ilioinguinal neurectomy in open inguinal hernia repair: a double-blind randomized controlled trial. Ann Surg. 2006 Jul;244(1):27-33. PubMed PMID: 16794386; PubMed Central PMCID: PMC1570605.
- Nasir I, Iftikhar M, Aslam R, et al. (2014) Chronic postoperative pain following groin hernia repair: a comparison between nerve preservation and nerve excision. J Med Sci 7:226230.
- Othman I, Hady HA. (2014) Hernia sac of indirect inguinal hernia: Invagination, excision, or ligation? Hernia 18:199-204. doi:http://dx.doi.org/10.1007/s10029-013-1081-z.
- Smedberg SG, Broome AE, Gullmo A. (1984) Ligation of the hernial sac? Surg Clin North Am 64:299-306.
- Smeds S, Löfström L, Eriksson O (2010) Influence of nerve identification and the resection of nerves at risk on postoperative pain in open inguinal hernia repair. Hernia 14(3):265-70.
- Stylianidis G, Haapamäki MM, Sund M, et al. (2010) Management of the hernial sac in inguinal hernia repair. Br J Surg.;97(3):415-419. doi:10.1002/bjs.6890.
- Wijsmuller AR, Van Veen RN, Bosch JL et al. (2007) Nerve management during open hernia repair. Br J Surg 94(1):1722.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: How can the incidence of CPIP be reduced? (nerve resection)
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Barazanchi 2016 |
Yes |
Yes |
No |
Yes |
Not applicable |
Yes |
Yes |
Yes, funnel plot |
SR: yes, individual studies: unclear |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, Risk of Bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 05-04-2019
Beoordeeld op geldigheid : 11-12-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep in stand gehouden. Uiterlijk in 2022 bepaalt het bestuur van de NVvH of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVvH is regiehouder van deze richtlijn(modules) en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn(modules). De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het hoofddoel van de richtlijn is de patiëntresultaten te verbeteren en de meest voorkomende problemen na een liesbreukoperatie te verminderen, met name recidivering en chronische pijn.
Doelgroep
De richtlijn wordt geschreven voor de medisch specialisten die betrokken zijn bij de zorg voor patiënten met liesbreuk.
Samenstelling werkgroep
Werkgroep
- Dr. B. (Baukje) van den Heuvel, chirurg, Pantein Zorggroep, Radboudumc, Nijmegen, NVvH (voorzitter)
- Dr. M.P. (Maarten) Simons, chirurg, OLVG, Amsterdam, NVvH
- Dr. Th.J. (Theo) Aufenacker, chirurg, Rijnstate, Arnhem, NVvH
- Dr. J.P.J. (Ine) Burgmans, chirurg, Diakonessenhuis Utrecht, Utrecht, NVvH
- Mw. R. (Rinie) Lammers, beleidsadviseur, Patiëntenfederatie Nederland, Utrecht
- Dr. M.J.A. (Maarten) Loos, chirurg, Maxima Medisch Centrum, Veldhoven, NVvH
- Dr. M. (Marijn) Poelman, chirurg, Sint Franciscus Vlietland Groep, Rotterdam, NVvH
- Dr. G.H. (Gabriëlle) van Ramshorst, chirurg, NKI-Antoni van Leeuwenhoek Ziekenhuis/VU Medisch Centrum, Amsterdam, NVvH
- Drs. J.W.L.C. (Ronald) Schapendonk, anesthesioloog-pijnspecialist, Diakonessenhuis Utrecht, Utrecht, NVA
- Dr. E.J.P. (Ernst) Schoenmaeckers, chirurg, Meander MC, Amersfoort, NVvH
- Dr. N. (Nelleke) Schouten, AIOS heelkunde regio Maastricht, NVvH
- Dr. R.K.J. (Rogier) Simmermacher, chirurg, UMC Utrecht, Utrecht, NVvH
Met medewerking van
- Drs. W. (Wouter) Bakker, arts-onderzoeker heelkunde, Diakonessenhuis Utrecht, Utrecht
Met ondersteuning van
- Dr. J.S. (Julitta) Boschman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. W.A. (Annefloor) van Enst, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. Ing. R. (Rene) Spijker, Informatie Specialist, Cochrane Netherlands
- Dr. C. (Claudia) Orelio, Cochrane Netherlands
- Drs. P. (Pauline) Heus, Cochrane Netherlands
- Prof. dr. R. (Rob) Scholten, Cochrane Netherlands
- Dr. L. (Lotty) Hooft, Cochrane Netherlands
- D.P. (Diana) Gutierrez, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
- J. (Jill) Heij, junior projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
|
Van den Heuvel |
Chirurg |
Onbetaald: - Advies-commissie Kwaliteit EHS (European Hernia Society) - Dutch Hernia Society - International Guidelines Groin Hernia Management (ontwikkeling gesponsord door BARD en Johnson&Johnson - |
geen (03/03/2017) |
niet van toepassing |
|
|
Simons |
Chirurg |
Onbetaald: - Bestuur EHS (European Hernia Society) - Dutch Hernia Society - International Guidelines Groin Hernia Management (ontwikkeling gesponsord door BARD en Johnson&Johnson |
Lid Board van de European Hernia Society (20/7/2017) |
geen |
|
|
Aufenacker |
Chirurg |
Penningmeester DHS (Dutch Hernia Society), onbetaald |
Prevent Studie, (Preventieve matplaatsing bij aanleggen colostoma) ZonMW gesponsord (19/3/2018) |
geen |
|
|
Bakker |
Chirurg io |
- |
- |
niet van toepassing |
|
|
Burgmans |
Chirurg |
Lid bestuur Dutch Hernia Society |
geen (19/3/2018) |
niet van toepassing |
|
|
Lammers |
Beleidsadviseur |
- |
geen (19/6/2017) |
|
|
|
Loos |
Chirurg |
- |
geen (13/6/2017) |
niet van toepassing |
|
|
Poelman |
Chirurg |
Lid bestuur Dutch Hernia Society |
geen (11/7/2017) |
geen |
|
|
van Ramshorst |
Fellow Chirurgie |
|
Sponsor van mijn fellowship, KWF, heeft geen belangen bij deze richtlijn. Publicaties waar ik auteur van ben zouden gebruikt kunnen worden als referentie. (16/4/2018) |
geen |
|
|
Schapendonk |
Anesthesioloog-pijnspecialist |
|
Niet persoonlijk, maar mijn instelling heeft deelgenomen/ neemt deel aan wetenschappelijk onderzoek gesponsord door Medtronic, Spinal Modulaton of St. Jude Medical thans Abbott. Fee ontvangen van St. Jude Medical voor voordracht op scholing pijnverpleegkundigen inzake DRG stimulatie. Daarnaast in 2015 congres bezocht op kosten Spinal Modulation. (3/5/2017) |
geen |
|
|
Schoenmaeckers |
Chirurg |
|
geen (20/6/2017) |
niet van toepassing |
|
|
Schouten |
AIOS Heelkunde |
- |
geen (6/6/2017) |
niet van toepassing |
|
|
Simmermacher |
Chirurg |
- |
geen (21/5/2017 |
niet van toepassing |
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door inbreng van: 1) patiëntenvereniging Meshed-up tijdens de invitational conference; 2) door de deelname van mevrouw. Lammers (Patiëntenfederatie Nederland) in de werkgroep en 3) door het raadplegen van volwassenen behandeld voor liesbreuk via een door de Patiëntenfederatie uitgezette enquête. De reacties naar aanleiding van deze invitational en enquête (zie aanverwante producten) zijn besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft geen interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken (zie Indicatorontwikkeling).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten en onderwerpen beschreven in de internationale richtlijn (HerniaSurge Group 2018) die in aanmerking kwamen voor de Nederlandse adaptatie en update. De aanwezigen tijdens de invitational conference bevestigden deze knelpunten en onderwerpen. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
De knelpunten en onderwerpen beschreven in de internationale richtlijn (HerniaSurge Group, 2018) die in aanmerking kwamen voor de Nederlandse adaptatie en update zijn met de werkgroep besproken. Daarna heeft de werkgroep de definitieve uitgangsvragen en modules vastgesteld en vastgesteld welke modules volledig zouden worden geupdate met ondersteuning van het Kennisinstituut en welke modules uit de internationale richtlijn zouden worden geadapteerd door de werkgroep. Voor alle modules, ook de modules die geadapteerd zijn, heeft de werkgroep de recente en relevante literatuur doorgenomen. In de geadapteerde modules zijn nieuwe studies verwerkt bij het formuleren van overwegingen en aanbevelingen. In de volledig geupdate modules zijn nieuwe studies geïntegreerd in de literatuuranalyse, risk of bias assessment en gradering. Hieronder is per module aangegeven of de module volledig is ge-update of geadapteerd:
- Risicofactoren (geadapteerd)
- Diagnostiek (geadapteerd)
- Indicatie behandeling asymptomatische liesbreuken (volledig geupdate)
- Chirurgische behandeling unilaterale liesbreuk (volledig geupdate)
- Mat of Shouldice (volledig geupdate)
- Lichtenstein of een andere open anterieure techniek (geadapteerd)
- Lichtenstein of een open pre-peritoneale techniek (geadapteerd)
- Endoscopische techniek (geadapteerd)
- Lichtenstein of een laparo-endoscopische techniek (geadapteerd)
- Een open posterieure techniek of laparo-endoscopisch (geadapteerd)
- Geïndividualiseerde behandeling (geadapteerd)
- Matten (volledig geupdate)
- Matfixatie (volledig geupdate)
- Open anterieure benadering
- TEP/TAPP
- Liesbreuken bij vrouwen (geadapteerd)
- Femoraalbreuken (geadapteerd)
- Antibioticaprofylaxe (volledig geupdate)
- Anesthesie (volledig geupdate)
- Postoperatieve pijn (geadapteerd)
- Chronische pijn
- Definitie, risicofactoren en preventie (geadapteerd)
- Reductie incidentie CPIP (volledig geupdate)
- Behandeling CPIP (volledig geupdate)
- Behandeling van recidief liesbreuk (geadapteerd)
- Na een anterieure benadering
- Na een posterieure benadering
- Na een anterieure en posterieure benadering
- Acute liesbreukchirurgie (geadapteerd)
- Organisatie van zorg (nieuw)
Vervolgens inventariseerde de werkgroep voor de uitgangsvragen van de modules die waren geselecteerd voor een volledige update welke uitkomstmaten voor de patiënt relevant zijn. Er werd zowel naar gewenste als ongewenste effecten gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal, belangrijk (maar niet cruciaal) en onbelangrijk. Tevens poogde de werkgroep tenminste voor de cruciale uitkomstmaten te definiëren welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
De informatiespecialist van Cochrane Nederland doorzocht Medline en Embase (op 11 april 2017) en het Cochrane Register (op 12 april 2017) naar artikelen over de diagnostiek of behandeling van volwassenen met liesbreuk zonder beperkingen op de publicatiedatum. Dit betrof een herhaling van de searches uitgevoerd voor de 2013 European Hernia Society Guidelines on the treatment of inguinal hernia in adult patients en de 2018 International Guidelines for Groin Hernia Management: The HerniaSurge Group (literatuursearch tot 1 januari 2015 en 1 juli 2015 voor level 1 publicaties (RCTs). De literatuurzoekactie leverde voor reviews 583 unieke treffers (waarvan 339 reviews reeds gescreend voor de vorige richtlijnen) op (Medline n=419; Embase n=378; en de Cochrane Library n=12) en voor RCTs 2174 unieke treffers (Medline n=1376; Embase n=1537; en de Cochrane Library n=160).
De werkgroepleden selecteerden per uitgangsvraag in duplo de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria en in eerste instantie de studies met de hoogste bewijskracht. De gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Voor de modules die volledig werden ge-update, zijn de geselecteerde artikelen systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (Risk of Bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
Voor de modules die volledig werden ge-update, zijn de geselecteerde artikelen toegevoegd aan de set relevante artikelen genoemd in de internationale richtlijn. De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de Engelstalige samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor Risk of Bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere Nederlandstalige literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Indicatorontwikkeling
Er werden geen interne kwaliteitsindicatoren ontwikkeld. In de module Organisatie van Zorg is een suggestie opgenomen voor een toekomstige registratie.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven .
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. (2010) AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ 182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Zoekverantwoording
Exclusion table after reading full text
|
Author, year |
Reason for exclusion |
|
Lange 2016
|
SR that included RCTs, but the randomization factor in those studies was not surgical expertise |
