OCT-angiografie
Uitgangsvraag
Wat is de rol van OCT-angiografie bij de diagnostiek en follow-up van neovasculaire LMD?
Aanbeveling
Overweeg het maken van een OCTA voor start van behandeling ter ondersteuning van diagnostiek.
Maak bij twijfel aan de diagnose neovasculaire LMD zo mogelijk een OCTA. Indien de neovascularisatie duidelijk zichtbaar is op OCTA is FAG/ICG niet nodig.
Behandel niet bij een neovascularisatie op OCTA zonder lekkage op de structurele OCT en zonder symptomen (quiescent neovascularization). Wel dient follow-up plaats te vinden.
Voor de toegevoegde waarde van OCTA tijdens de follow-up fase van neovasculaire LMD bestaat op dit moment te weinig bewijs.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Het was onduidelijk of er verschillen zijn in diagnostische accuratesse tussen optical coherence tomography angiography (OCTA) en optical coherence tomography (OCT) met fluoresceïne-angiografie (FAG) bij de diagnose van LMD bij patiënten verdacht van nLMD en tussen OCTA en OCT bij de follow-up van patiënten met nLMD. Er is daarom een systematische search verricht om naar literatuur te zoeken.
OCTA voor diagnose van neovasculaire LMD
Er zijn een systematische review (Chen, 2020) en 3 prospectieve studies (Cavichini 2020; Corvi 2020; Ghanchi, 2021,) gevonden die OCTA hebben vergeleken met FAG, maar de kwaliteit van het bewijs is gegradeerd als laag, omdat de patiënten aantallen in de onderliggende studies over het algemeen relatief gering zijn. Naast de eerder genoemde onderzoeken zijn er echter verschillende studies verricht, met name case series, die OCTA hebben vergeleken met FAG en/of ICGA en OCT bij de beoordeling van neovascularisaties bij LMD.
Ahmed (2021) keek in een prospectieve studie met SS-OCT-A naar 158 ogen van 142 patiënten met een onbehandelde neovascularisatie bij LMD. Diagnose neovascularisatie was gesteld met FAG, ICGA en SD-OCT. Bevestiging van een neovascularisatie met alleen en-face SS-OCT-A gaf een sensitiviteit van 79,8%. Wanneer er tevens naar abnormale flow in cross-sectional SS-OCT-A B-scans werd gekeken dan steeg de sensitiviteit naar 94,3%.
Een retrospectieve studie van Yeo (2019) waarin met SS-OCT-A werd gekeken naar 52 ogen van 47 patiënten met neovasculaire LMD, liet bij de detectie van een actieve CNV een sensitiviteit van 80.7% zien.
Laesie types en OCTA
Er zijn ook studies verricht, die met OCTA in vergelijking met de andere imaging technieken (FAG, ICGA, OCT) hebben gekeken of de verschillende typen neovascularisaties bij LMD een invloed hadden op de uitkomst van beoordeling. In ogen met een neovascularisatie en maculaire atrofie werd zowel een sensitiviteit als specificiteit van 95,2% gezien voor OCT-A en deze was hoger dan die voor FAG, ICGA of OCT (Corvi, 2020). In verschillende studies werd gezien dat met OCT-A de detectie van type 2 MNV (klassieke nLMD) hoger was dan voor type 1 MNV (occulte nLMD) en type 3 MNV (RAP) en dat bij type 1 MNV en bij een PEL ≥300 μm de OCT-A inferieur was aan FAG en ICGA bij nLMD (Ahmed, 2021; Malamos, 2017; Soomro, 2018; Yeo, 2019).
In een prospectieve studie van Corvi (2020) werd OCT-A vergeleken met FAG, ICGA en OCT bij ogen met maculaire neovascularisatie (MNV) en maculaire atrofie (MA) bij LMD.
Ogen met een MNV en atrofie en ogen met geografische atrofie (GA) zonder MNV werden vergeleken met multimodal imaging. Morfologische karakteristieken van de MNV werden geëvalueerd op de custom OCT-A slab. Er werden 21 patiënten met MA+MNV en 21 patiënten met alleen GA vergeleken. Manuele segmentatie op OCT-A liet detectie van de MNV zien bij 95.2% van de ogen met MA+MNV en bij 4.7% van de ogen met GA, uitkomend op een hoge specificiteit (95.2%) en sensitiviteit (95.2%). FAG, ICGA, en OCT detecteerde MNV in 57.1%, 52.3%, en 66.7% van de ogen met MA+MNV en in 14.2%, 9.5%, en 42.8% met GA. Sensitiviteit en specificiteit waren 85.7% en 57.1% voor FAG, 90.5% en 52.4% voor ICGA, en 66.7% en 57.1% voor OCT. In deze studie lijkt OCT-A superieur te zijn ten opzichte van andere imaging technieken voor de identificatie van MNV in ogen met maculaire atrofie.
In een retrospectieve observationele cohortstudie van Soomro (2018) werd multimodal imaging (FAG en/of ICGA en OCT) vergeleken met OCT-A. In een subgroep analyse van OCT-A versus FAG voor de detectie type II CNV (klassieke nLMD) was de sensitiviteit 100% en de specificiteit 76% (p<0.05). OCT-A versus FAG voor detectie van type-I CNV (occulte nLMD) toonde sensitiviteit van 47% en specificiteit van 76%, (p=0.248). In deze studie was OCT-A beter in het detecteren van type II CNV vergeleken met FAG en voor definiëring van een vasculair netwerk in nLMD vergeleken met FAG en ICGA.
In een studie van Yeo (2019) werd retrospectief met swept-source OCT-A gekeken naar de sensitiviteit bij verschillende laesietypen MNV bij LMD. Bij 52 ogen van 47 patiënten met MNV secundair aan actieve neovasculaire LMD werden de OCT-A plaatjes geanalyseerd en geclassificeerd in 3 groepen: Groep A (well-circumscribed vascular complex); Groep B (moderately circumscribed vascular complex); and Groep C (poorly circumscribed vascular complex). Achttien ogen (34.6%) vielen in groep A, 24 (46.2%) in groep B, and 10 (19.2%) in groep C. Statistische analyse liet geen significante verschillen zien in demografische eigenschappen of OCT parameters tussen de drie groepen. Overall sensitiviteit van actieve MNV detectie was 80.7% (42/52 ogen). In 73.5% (25/34) van de ogen met type 1 MNV (sub-RPE type), 100.0% (9/9) van de ogen met type 2 MNV (sub-retinale type), en 88.9% (8/9) van de ogen met type 3 MNV (retinale angiomateuze proliferatie type), werd het vasculaire complex goed gevisualiseerd op OCT-A. In deze studie werd met name type 2 MNV goed gedetecteerd met OCT-A in vergelijking met type 1 en type 3 MNV.
In een prospectieve, observationele case serie van Ahmed (2021) werd bij 158 ogen van 142 patiënten met nLMD gekeken naar de sensitiviteit van SS-OCT-A vergeleken met de standaard multimodal imaging (FAG en ICGA). Tevens werd een anatomische analyse van MNV in relatie tot het retinale pigment epitheel gemaakt. En-face SS-OCT-A bevestigde een MNV in 126 ogen (sensitiviteit: 79.8%), 32 ogen (20.2%) bleven ongedetecteerd. In 23 van deze 32 ogen (71.9%) werd abnormale flow in cross-sectional SS-OCT-A B-scans geïdentificeerd, hierdoor ontstond een overall SS-OCT-A sensitiviteit van 94.3%. Ogen met een PEL ≥ 300 μm hadden een kleinere kans voor correcte MNV detectie (p = 0.015). Type 1 MNV liet een trend zien (p = 0.051) naar een kleinere kans voor de correcte detectie vergeleken met alle andere subtypen. Andere relevante factoren voor non-detectie van MNV met SS-OCT-A waren image artefacten bij 3 van 32 ogen (9.4%). SS-OCT-A bevestigde de anatomische localisatie bij 93 van 126 MNVs in vergelijking met FAG (sensitiviteit: 73.8%). Er was geen invloed van leeftijd, gender, pseudofakie, visus, centrale foveale dikte, of subfoveale choroidale dikte op de detectie van MNV. Bij type 1 MNV en bij een PEL ≥300 μm was in deze studie de SS-OCT-A inferieur aan FAG en ICGA.
In een prospectieve observationele studie van Malamos (2017) werd het gecombineerde gebruik van OCT en OCT-A voor imaging van MNV bij nLMD geëvalueerd. Op baseline, was de detectie (overall sensitiviteit) van OCT-A om MNV te bepalen 64,4% (75.7 en 48.0% voor respectievelijk type 2 en type 1 MNV), dit was onafhankelijk van eerdere behandelstatus.
In bovenstaande studies werd een sensitiviteit van 76 tot 94,3% en een specificiteit van 79,3 tot 91% gemeten, waarbij werd gezien dat een manuele segmentatie een betere sensitiviteit gaf dan geautomatiseerde segmentatie, en dat de combinatie van OCT-A samen met OCT een hogere sensitiviteit liet zien. Ook wanneer er naast de en-face OCT-A er tevens naar abnormale flow in cross-sectionele OCT-A B-scans werd gekeken gaf dit een verbetering in sensitiviteit.
Samenvattend kan worden gesteld dat OCT-A-imaging:
- Een goede specificiteit heeft, dat betekent dat als er een neovascularisatie gezien wordt deze ook daadwerkelijk aanwezig is.
- Een redelijke sensitiviteit heeft. Veel neovascularisaties kunnen worden opgespoord, maar indien er geen neovascularisatie gezien wordt op OCT-A, betekent dit niet automatisch dat deze er ook niet is. De sensitiviteit van OCT-A voor type 2 MNV is over het algemeen het beste.
- Manuele segmentatie van de OCT-A beelden over het algemeen betere resultaten geeft dan automatische segmentatie. Tevens geeft OCT-A het beste resultaat bij gebruik van alle beschikbare OCT-A beelden (flow B-scan; en-face OCT-A).
OCT-A voor follow-up van neovasculaire LMD
Er zijn geen systematische reviews of gecontroleerde gerandomiseerde studies gevonden die de vergelijking hebben gemaakt tussen OCT-A en OCT bij follow-up. De bewijskracht kon daarom niet worden gegradeerd. Wel zijn er verschillende studies die hebben gekeken of OCT-A bijdragend kan zijn voor follow-up tijdens een behandelproces, die worden hieronder beschreven.
Er werd gekeken naar vasculaire parameters van neovascularisaties zoals de omvang en het vaatoppervlak van de CNV (Altinisik, 2021; Faatz, 2019). Tevens werd gekeken naar laesie eigenschappen om een verschil tussen actieve en inactieve laesies te bepalen. Hierbij werden als parameters gebuikt de aanwezigheid van een prominent centraal vat, kleine aftakkende vaten en perifere arcades (Al Sheikh, 2017; Coscas, 2019). En werd OCT-A vergeleken met traditionele multimodal imaging (FAG, ICGA en OCT) om te kijken of er verschillen waren in behandel besluiten (Coscas, 2015).
Echter tot op heden werd geen bewijs gevonden dat oppervlakte maten of laesie karakteristieken op OCTA een goede voorspeller zijn van activiteit van het neovasculaire netwerk. Daarnaast wordt follow-up middels OCTA momenteel beperkt doordat de verschillende OCTA apparaten (door verschil in decorrelatie algoritmes, scan koppen, segmentatiealgoritmes) niet onderling vergelijkbaar zijn.
Mogelijk kan OCTA in de toekomst gebruikt gaan worden om biomarkers van activiteit te meten en behulpzaam te zijn bij de evaluatie en behandeling en monitoring van neovascularisaties bij LMD. Op dit moment is er meer onderzoek nodig voordat OCTA in de reguliere praktijk ingezet kan worden voor follow-up.
Conclusie OCTA bij diagnostiek van neovasculaire LMD
Uit de analyse van de onderliggende studies van de systematische review blijkt dat OCTA een zeer hoge specificiteit heeft en daaraan gekoppeld een positief voorspellende waarde van bijna 100%. Dit betekent dat als er op de OCTA een neovascularisatie gezien wordt deze vrijwel altijd aanwezig zal zijn. De sensitiviteit (en negatief voorspellende waarde) van OCTA zijn duidelijk lager, met andere woorden als er geen neovascularisatie gezien wordt op OCTA dan hoeft dit niet te betekenen dat er geen neovascularisatie aanwezig zal zijn.
Een potentieel nadeel van OCTA bestaat bij patiënten met een neovascularisatie in een pigmentepitheel loslating (PEL), deze zijn door verstoring van de retinale structuur moeilijker te diagnosticeren met OCTA. Tevens kan OCTA onderzoek bemoeilijkt worden door slechte fixatie van de patiënt (Spaide, 2015).
Er zijn twee situaties waar OCTA een bijdrage kan leveren aan de diagnostiek van neovasculaire LMD. Ten eerste in het geval van de verdenking op een neovascularisatie waarbij niet alle typische kenmerken van een LMD aanwezig zijn kan een OCTA helpen om de diagnose te stellen. Door de hoge specificiteit van de OCTA bij neovascularisaties zal indien er een neovascularisatie zichtbaar is op OCTA de kans ook zeer hoog zijn dat er daadwerkelijk een neovascularisatie aanwezig is (Chen, 2020; Perrott-Reynolds, 2019). Ten tweede heeft OCTA daarnaast door zijn hoge specificiteit een aanvullende waarde bij patiënten waar op FAG/ICGA twijfel bestaat over de aanwezigheid van een neovascularisatie. Indien er een neovascularisatie zichtbaar is op OCTA dan is de kans ook zeer hoog dat er daadwerkelijk een neovascularisatie aanwezig is.
Een voordeel van OCTA ten opzichte van FAG/ICGA is dat de OCTA afbeeldingen met een zeer hoog contrast geeft. Het heeft geen last van lekkage van kleurstof die de beoordeling van onderliggende pathologie kan bemoeilijken. Tevens kan met OCTA de positie van de pathologie in de retina vastgesteld worden, doordat OCTA een beeld geeft van de microvasculatuur in de retina met een exacte diepte resolutie. Dit in tegenstelling tot FAG en ICGA, die beide grotendeels twee dimensionale beelden geven (Spaide, 2018).
Niet-exsudatieve MNV
In het niet aangedane oog van patiënten met neovasculaire LMD kunnen op OCTA neovascularisaties worden gedetecteerd die geen lekkage vertonen (prevalentie van 6,25% - 27%). Deze ‘rustige’ of ‘slapende‘neovascularisaties kunnen echter wel ‘actief’ worden en lekkage gaan vertonen. In een systematic review van Lauginhas (2020) wordt beschreven dat ongeveer 25% van de niet-exsudatieve neovascularisaties lekkage gaan vertonen (range 6 – 20 maanden).
Behandeling van deze quiscent (‘rustige’) neovascularisaties is niet geïndiceerd. Controle van deze ogen is aanbevolen om een vroege detectie van lekkage te onderkennen en om op dat moment anti-VEGF therapie te starten.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Voor de patiënt is het maken van een OCTA minder ingrijpend dan het ondergaan van een FAG/ICGA omdat er geen infuus met fluorescerende stof nodig is. Bij een FAG zijn er potentiële risico’s op complicaties, zoals allergische reacties op de toegediende kleurstoffen en infuus gerelateerde zoals een hematoom. Tevens is het maken van een OCTA minder tijdrovend dan het maken van een FAG/ICGA.
Kosten (middelenbeslag)
Er is momenteel geen studie bekend die een kosteneffectiviteitsanalyse heeft gedaan naar OCTA, maar OCTA onderzoek is relatief goedkoop. Een OCTA module is beschikbaar op de meeste OCT apparatuur die al aanwezig is in de algemene oogheelkunde praktijk. Het maken van een OCTA vraagt minder tijd en minder personeel dan het maken van een FAG/ICGA.
Aanvaardbaarheid, haalbaarheid en implementatie
OCTA is beschikbaar voor de meeste OCT apparaten die in de algemene oogheelkundige praktijk aanwezig zijn. Om de beschikking te krijgen over OCTA is in het algemeen alleen een software upgrade nodig. Personeel dat de OCT scan bedient kan ook de OCTA scans maken, er is geen extra personeel nodig. Wel vraagt zowel het maken als het beoordelen van de OCTA meer tijd dan het maken/beoordelen van een OCT. Hierdoor is het niet haalbaar om bij ieder bezoek waar een OCT scan gemaakt wordt ook een OCTA te verrichten. Dit is gezien het eerder beschreven toepassingsgebied van de OCTA ook niet nodig.
Beoordeling van OCTA scans vraagt specifieke kennis van de beoordelend oogarts. Deze moet getraind zijn in het op de goede wijze instellen van de beoordelingssoftware (onder andere het correct instellen van het segmentatievlak voor de te diagnosticeren pathologie), het herkennen van artefacten en het beoordelen van de pathologie op de OCTA scans.
Aanbeveling-1
Rationale van de aanbeveling: weging van argumenten voor en tegen de diagnostische procedure
OCTA heeft een goede specificiteit voor het opsporen van de aanwezigheid van neovascularisaties bij LMD. Een op het OCTA aangetoonde neovascularisatie is ook daadwerkelijk aanwezig.
OCTA heeft voor dit doel een redelijke sensitiviteit. Veel neovascularisaties kunnen worden opgespoord, maar als er geen neovascularisatie gezien wordt op OCTA, betekent dit niet automatisch dat deze er ook niet is.
Voor de patiënt is het maken van een OCTA is minder ingrijpend en zonder risico’s op complicaties.
Dit maakt OCTA geschikt als aanvullend onderzoek dat de behandelaar kan helpen bij het stellen van de diagnose nLMD.
Met OCTA kunnen ook niet-actieve neovascularisaties aangetoond worden, welke geen behandeling nodig hebben.
Op het moment van schrijven van deze richtlijn is er nog geen goede data beschikbaar over de follow-up van neovascularisaties bij LMD met OCTA.
Onderbouwing
Achtergrond
Optical coherence tomography angiography (OCTA) is een recente technologie en is ontwikkeld voor het in beeld brengen van de retinale en choroidale vasculatuur. OCTA kan de microcirculatie van het netvlies kwantitatief en op een 3-dimensionale manier beoordelen. Het is de vraag of OCTA het meer invasieve diagnostische hulpmiddel fluoresceïne-angiografie (FAG) zou kunnen vervangen om neovascularisaties bij LMD te detecteren. Deze module heeft tot doel de algehele diagnostische waarde van OCTA bij de detectie van neovascularisaties en bij de follow-up van deze neovascularisaties na behandeling bij LMD-patiënten te evalueren.
Conclusies / Summary of Findings
OCT-A for diagnosis
Diagnostic accuracy (critical)
|
Low GRADE |
The sensitivity, specificity, positive predictive value and negative predictive value of OCT-A compared to OCT, FA, and/or multimodal imaging seems comparable to detect CNV in patients with AMD.
Sources: Ahmed, 2018; Carnevali, 2016; Cavichini, 2020; Corvi, 2020; Faridi, 2017; Ghanchi, 2021; Gong, 2016; Moult, 2014; Nikolopoulou, 2018; Usman, 2019 |
OCT-A for follow-up
|
- GRADE |
No evidence was found about the added value of OCT-A compared to OCT during follow-up of patients with AMD on diagnostic accuracy outcomes.
Sources: - |
Samenvatting literatuur
Description of studies
OCT-A for diagnosis
Chen (2020) performed a systematic review with meta-analysis to evaluate the overall diagnostic value of OCT-A in the detection of CNV in (early or late) AMD patients. The literature search was performed until April 15, 2020 in PubMed, Science Direct, Embase and Web of Science. Studies were included only when the following four criteria are met: 1) the subjects should be AMD patients, regardless of early AMD or late AMD, 2) the diagnose method should be OCT-A, 3) At least one gold standard should be used for CNV diagnosis. Either FFA or ICGA would qualify, and any study using both measurements would qualify too, 4) there should be extractable data for sensitivity and specificity calculation. Studies were excluded if any of the following criteria is met: 1) patients of other diseases, 2) only OCT-A was used for CNV diagnosis, without gold standard to make a comparison, 3) study design is case report, letter, editorials, or reviews, 4) study was not written in English, 5) studies without extractable data. A total of 1168 studies were identified and eventually 7 studies were included for quantitative meta-analysis (four cross-sectional studies (Ahmed, 2018; Moult, 2014; Nikolopoulou, 2018; Usman, 2019), one case-control (Faridi, 2017), one diagnostic test (Carnevali, 2016), and one case-series study (Gong, 2016)). In the pooled study, 517 eyes were included in the analysis. The mean age of subjects in each study ranged from 58.5 years to 81.7 years. Percentage male participants varied between 35.7% and 60%. Fluorescein angiography was applied as the gold standard in 6 studies and ICGA in 3 studies.
Ghanchi (2021) conducted a retrospective cohort study to evaluate the ability of OCT-A to identify the presence or absence of CNV and CNV activity in AMD patients, compared to FA. Automated OCT-A was compared to manual OCT-A and SD-OCT and OCT-A. In total, 43 eyes from 26 patients were included. The prevalence of active CNV was 58%, 65% of patients were female and the mean age of the patients was 80.2 years.
Corvi (2020) conducted prospective observational case series to evaluate the ability of OCT-A to detect macular neovascularization (MNV) in eyes with atrophy compared with FA, ICGA and OCT, in eyes with macular atrophy (MA) secondary to AMD, and in AMD eyes with geographic atrophy (GA) without MNV. Gold standard reference was considered all imaging modalities evaluated by senior retina specialists. Patients with MNV and atrophy (termed macular atrophy or MA) secondary to AMD, and AMD eyes with geographic atrophy (GA) without MNV were included. In total, 42 patients were included, with 21 eyes with MA and MNV and 21 eyes with GA. The mean age was 79.7 years (range 71-89) in patients with MA+MNV, and 78.6 (range 67-84) years in patients with GA, and 67% were female in patients with MA and MNV and 15% were female in patients with GA.
Cavichini (2020) conducted a retrospective case study to evaluate the ability of OCT-A to identify the presence or absence of CNV and CNV activity in AMD. Clinical parameters, fundus fluorescein angiogram and spectral-domain optical coherence tomography (SD-OCT) were used as the gold standard to determine disease activity. In total, 152 eyes of 106 patients were included, of which 59 eyes had wet AMD and 93 had dry AMD with high-risk drusen. The mean age was 75.5 years (range, 42–97, SD 9.8), and 51% were female.
OCT-A for follow-up
No studies were included investigating the value of OCT-A for follow-up.
Results
OCT-A for diagnosis
Diagnostic accuracy (critical)
Sensitivity and specificity
The sensitivity was reported in ten studies (Ahmed, 2018; Carnevali, 2016; Cavichini, 2020; Corvi, 2020; Faridi, 2017; Ghanchi, 2021; Gong, 2016; Moult, 2014; Nikolopoulou, 2018; Usmanm 2019), see Figure 1.
Figure 1 – Results on sensitivity and specificity
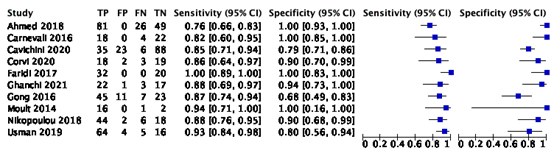
The pooled sensitivity and specificity were reported in Chen (2020), who performed a meta-analysis based on Bayesian theory of the seven included studies (Ahmed, 2018; Carnevali, 2016; Faridi, 2017; Gong, 2016; Moult, 2014; Nikolopoulou, 2018; Usman, 2019). The pooled sensitivity was 0.89 (95% CI: 0.82, 0.94), and he pooled specificity was 0.96 (95% CI: 0.85, 1.00).
In the three other studies (Cavichini, 2020; Corvi, 2020; Ghanchi, 2021) the sensitivity was 0.85, 0.86 and 0.88 respectively, and the specificity was 0.79, 0.90 and 0.94 respectively.
Positive predictive value
The positive predictive value (PPV) and negative predictive value (NPV) were not reported in the systematic review of Chen (2020), but could be calculated for ten studies (Ahmed, 2018; Carnevali, 2016; Cavichini, 2020; Corvi, 2020; Faridi, 2017; Ghanchi, 2021; Gong, 2016; Moult, 2014; Nikolopoulou, 2018; Usman, 2019), see Table 1.
Table 1 – Outcomes positive predictive value and negative predictive value
|
Author (year) |
TP |
FP |
TN |
FN |
Prevalence |
Positive predictive value |
Negative predictive value |
|
Ahmed (2018) |
81 |
0 |
49 |
26 |
69% |
1.00 |
0.65 |
|
Carnevali (2016) |
18 |
0 |
22 |
4 |
50% |
1.00 |
0.85 |
|
Cavichini (2020) |
35 |
23 |
88 |
6 |
27% |
0.60 |
0.94 |
|
Corvi (2020) |
18 |
2 |
19 |
3 |
50% |
0.90 |
0.86 |
|
Faridi (2017) |
32 |
0 |
20 |
0 |
62% |
1.00 |
1.00 |
|
Ghanchi (2021) |
22 |
1 |
17 |
3 |
58% |
0.96 |
0.85 |
|
Gong (2016) |
45 |
11 |
23 |
7 |
60% |
0.80 |
0.77 |
|
Moult (2014) |
16 |
0 |
2 |
1 |
89% |
1.00 |
0.67 |
|
Nikolopoulou (2018) |
44 |
2 |
18 |
6 |
71% |
0.96 |
0.75 |
|
Usman (2019) |
65 |
4 |
16 |
5 |
78% |
0.94 |
0.76 |
OCT-A for follow-up
No studies were found that reported on diagnostic accuracy outcomes of OCT-A versus OCT in the follow-up of patients with AMD.
Level of evidence of the literature
OCT-A for diagnosis
Diagnostic accuracy
The certainty of the evidence started high, as the evidence originated from a systematic review of diagnostic accuracy studies and observational studies. The level of evidence regarding the outcome measure visual acuity was downgraded by one level for risk of bias (high risk of bias), and one level for inconsistency (heterogeneity between studies). The level of evidence was therefore graded as low.
OCT-A for follow-up
Diagnostic accuracy
No studies were identified that reported on diagnostic accuracy measures for OCT-A during follow-up, and therefore, GRADE could not be applied, and no conclusion could be drawn on the added value of OCT-A versus OCT.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
- What is the diagnostic accuracy of Optical Coherence Tomography Angiography (OCT-A) compared with fluorescein angiography (FA) + Optical Coherence Tomography (OCT) to detect CNV in patients with AMD?
- What is the diagnostic accuracy of OCT-A compared with FA + OCT during follow-up of CNV in patients with AMD?
OCT-A for diagnosis
P: Patients at risk for nAMD
I: OCT-A for diagnosis of nAMD
C/R: FA + OCT
O: Diagnostic test accuracy (sensitivity, specificity, positive predictive value, negative predictive value)
OCT-A for follow-up
P: Patients with nAMD
I: OCT-A during follow-up for monitoring of disease activity
C/R: OCT
O: Diagnostic test accuracy (sensitivity, specificity, positive predictive value, negative predictive value)
Relevant outcome measures
The guideline development group considered diagnostic accuracy of OCT-A as a critical outcome measure for decision making, with true positives and false negatives as critical outcome measures and true negatives and false positives as important outcome measures for decision making.
Table 1 - consequences of diagnostic test properties
|
Outcome |
Consequence |
Relevance |
|
True positives (TP) |
Patient is correctly diagnosed with AMD, and gets relevant treatment |
Critical |
|
True negatives (TN) |
Patient is not diagnosed with AMD correctly and will get other diagnostic test to diagnose correct condition. |
Important |
|
False positives (FP) |
Patient is wrongly diagnosed with LMD and gets treatment which is not necessary, and symptoms of condition may persist. |
Important |
|
False negatives (FN) |
Patient is wrongly not diagnosed with AMD and does not get relevant treatment and symptoms of AMD may persist or get worse. |
Critical |
|
Inconclusive outcome |
Patient is subjected to other diagnostic tests, but will get treatment according to the guideline |
Important |
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 2015 until June 23rd, 2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 430 hits. Studies were selected based on the following criteria: systematic reviews or RCTs on the added value of OCT-A in the diagnosis or follow-up of AMD. 44 studies were initially selected based on title and abstract screening. After reading the full text, 40 studies were excluded (see the table with reasons for exclusion under the tab Methods), and 4 studies were included.
Results
OCT-A for diagnosis
Four studies (one systematic review and three observational studies) were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
OCT-A for follow-up
No studies were included in the analysis of the literature.
Referenties
- Ahmed D, Stattin M, Haas AM, Kickinger S, Gabriel M, Graf A, Krepler K, Ansari-Shahrezaei S. The Diagnostic Capability of Swept Source OCT Angiography in Treatment-Naive Exudative Neovascular Age-Related Macular Degeneration. J Ophthalmol. 2021 Feb 16;2021:6695918. doi: 10.1155/2021/6695918. PMID: 34513087; PMCID: PMC8429016.
- Ahmed, D., Stattin, M., Graf, A., Forster, J., Glittenberg, C., Krebs, I., & Ansari-Shahrezaei, S. (2018). Detection of treatment-naive choroidal neovascularization in age-related macular degeneration by swept source optical coherence tomography angiography. Retina, 38(11), 2143-2149.
- Al-Sheikh, M., Iafe, N. A., Phasukkijwatana, N., Sadda, S. R., & Sarraf, D. (2018). Biomarkers of neovascular activity in age-related macular degeneration using optical coherence tomography angiography. Retina, 38(2), 220-230.
- Altinisik M, Kurt E, Kayikcioglu O, Yildirim A. Quantitative Analysis of the Activity in Choroidal Neovascularizations after a Single Anti-VEGF Injection: OCT Versus OCT Angiography. Semin Ophthalmol. 2021 Oct 3;36(7):573-581. doi: 10.1080/08820538.2021.1903944. Epub 2021 Mar 30. PMID: 33784223.
- Carnevali, A., Cicinelli, M. V., Capuano, V., Corvi, F., Mazzaferro, A., Querques, L., ... & Querques, G. (2016). Optical coherence tomography angiography: a useful tool for diagnosis of treatment-naïve quiescent choroidal neovascularization. American journal of ophthalmology, 169, 189-198.
- Cavichini M, Dans KC, Jhingan M, Amador-Patarroyo MJ, Borooah S, Bartsch DU, Nudleman E, Freeman WR. Evaluation of the clinical utility of optical coherence tomography angiography in age-related macular degeneration. Br J Ophthalmol. 2021 Jul;105(7):983-988. doi: 10.1136/bjophthalmol-2020-316622. Epub 2020 Aug 21. PMID: 32826223.
- Chen, C. X., Liu, M. L., Cao, K., Yusufu, M., & Wang, J. D. (2020). Diagnostic value of optical coherence tomography angiography for choroidal neovascularization in age-related macular degeneration: A systematic review and meta-analysis. Ophthalmic Research.
- Corvi F, Cozzi M, Invernizzi A, Pace L, Sadda SR, Staurenghi G. Optical coherence tomography angiography for detection of macular neovascularization associated with atrophy in age-related macular degeneration. Graefes Arch Clin Exp Ophthalmol. 2021 Feb;259(2):291-299. doi: 10.1007/s00417-020-04821-6. Epub 2020 Jul 3. PMID: 32620993.
- Coscas F, Lupidi M, Boulet JF, Sellam A, Cabral D, Serra R, Français C, Souied EH, Coscas G. Optical coherence tomography angiography in exudative age-related macular degeneration: a predictive model for treatment decisions. Br J Ophthalmol. 2019 Sep;103(9):1342-1346. doi: 10.1136/bjophthalmol-2018-313065. Epub 2018 Nov 22. PMID: 30467129; PMCID: PMC6709766.
- Coscas, G. J., Lupidi, M., Coscas, F., Cagini, C., & Souied, E. H. (2015). Optical coherence tomography angiography versus traditional multimodal imaging in assessing the activity of exudative age-related macular degeneration: a new diagnostic challenge. Retina, 35(11), 2219-2228.
- Faatz H, Farecki ML, Rothaus K, Gutfleisch M, Pauleikhoff D, Lommatzsch A. Changes in the OCT angiographic appearance of type 1 and type 2 CNV in exudative AMD during anti-VEGF treatment. BMJ Open Ophthalmol. 2019 Dec 10;4(1):e000369. doi: 10.1136/bmjophth-2019-000369. PMID: 31909194; PMCID: PMC6936421.
- Faridi, A., Jia, Y., Gao, S. S., Huang, D., Bhavsar, K. V., Wilson, D. J., ... & Bailey, S. T. (2017). Sensitivity and specificity of OCT angiography to detect choroidal neovascularization. Ophthalmology retina, 1(4), 294-303.
- Ghanchi FD, Fulcher C, Madanat Z, Mdanat F. Optical coherence tomography angiography for identifying choroidal neovascular membranes: a masked study in clinical practice. Eye (Lond). 2021 Jan;35(1):134-141. doi: 10.1038/s41433-020-01285-0.
- Gong, J., Yu, S., Gong, Y., Wang, F., & Sun, X. (2016). The diagnostic accuracy of optical coherence tomography angiography for neovascular age-related macular degeneration: a comparison with fundus fluorescein angiography. Journal of ophthalmology, 2016.
- Laiginhas R., Yang J., Rosenfeld P.J., Falcão M. Nonexudative Macular Neovascularization - A Systematic Review of Prevalence, Natural History, and Recent Insights from OCT Angiography. Ophthalmology Retina. 2020 Jul;4(7):651-661. doi: 10.1016/j.oret.2020.02.016.
- Malamos P, Tsolkas G, Kanakis M, Mylonas G, Karatzenis D, Oikonomopoulos N, Lakoumentas J, Georgalas I. OCT-Angiography for monitoring and managing neovascular age-related macular degeneration. Curr Eye Res. 2017 Dec;42(12):1689-1697. doi: 10.1080/02713683.2017.1356336. Epub 2017 Sep 22. PMID: 28937833.
- Moult, E., Choi, W., Waheed, N. K., Adhi, M., Lee, B., Lu, C. D., ... & Fujimoto, J. G. (2014). Ultrahigh-speed swept-source OCT angiography in exudative AMD. Ophthalmic Surgery, Lasers and Imaging Retina, 45(6), 496-505.
- Nikolopoulou, E., Lorusso, M., Micelli Ferrari, L., Cicinelli, M. V., Bandello, F., Querques, G., & Micelli Ferrari, T. (2018). Optical coherence tomography angiography versus dye angiography in age-related macular degeneration: sensitivity and specificity analysis. BioMed research international, 2018.
- Perrott-Reynolds R, Cann R, Cronbach N, Neo YN, Ho V, McNally O, Madi HA, Cochran C, Chakravarthy U. The diagnostic accuracy of OCT angiography in naive and treated neovascular age-related macular degeneration: a review. Eye,2019.
- Soomro T, Talks J; Medscape. The use of optical coherence tomography angiography for detecting choroidal neovascularization, compared to standard multimodal imaging. Eye (Lond). 2018 Apr;32(4):661-672. doi: 10.1038/eye.2018.2. Epub 2018 Mar 30. PMID: 29600987; PMCID: PMC5898879.
- Spaide RF, Fujimoto JG, Waheed NK, Sadda SR, Staurenghi G. Optical coherence angiography. Progress in Retinal Eye Research, 2018
- Spaide RF, Fujimoto JG, Waheed NK. Image artefacts in optical coherence angiography. Retina, 2015.
- Usman, M., Iqbal, K., Ali, M. H., & Nafees, K. (2019). Features and diagnostic accuracy of optical coherence tomography angiography in neovascular age-related macular degeneration. Cureus, 11(12).
- Yeo JH, Chung H, Kim JT. Swept-Source Optical Coherence Tomography Angiography According to the Type of Choroidal Neovascularization. J Clin Med. 2019 Aug 22;8(9):1272. doi: 10.3390/jcm8091272. PMID: 31443399; PMCID: PMC6780989.
Evidence tabellen
Evidencetabellen
Systematic reviews
Observational studies
|
Study reference |
Study characteristics |
Patient characteristics |
Index test (test of interest) |
Reference test |
Follow-up |
Outcome measures and effect size |
Comments |
|
Ghanchi, 2021 |
Type of study[1]: retrospective cohort study
Setting and country: patients referred to the Bradford Macula Centre with suspected nAMD, United Kingdom.
Funding and conflicts of interest: Funding was not reported. One of the authors received a lecture fee from Heidelberg Ltd. |
Inclusion criteria: Not reported
Exclusion criteria: - poor quality OCT-A images due to excessive motion artefact
N=26 patients (43 eyes)
Prevalence: 58%
Mean age ± SD: 80.2 years (sd not reported)
Sex: 35% M / 65% F
Other important characteristics: Not reported |
Describe index test: combined SD-OCT and OCT-A
Cut-off point(s): Not applicable.
Comparator test[2]: Not applicable.
|
Describe reference test[3]: FA
Cut-off point(s): Not applicable.
|
Time between the index test and reference test: not reported.
For how many participants were no complete outcome data available? Not reported.
Reasons for incomplete outcome data described? No. |
Outcome measures and effect size (include 95%CI and p-value if available)4:
Sensitivity 88%
Specificity 96% |
Results reported in the study: Overall, combined for all the 3 clinicians, the pooled sensitivity and specificity values of OCT-A were 84% and 100%, respectively, for the automated segmentation, 92% and 94% for the manual segmentation and 88% and 94% for the combined SD-OCT and OCT-A (see Table 1). Thus, the average sensitivity for OCT-A was 88% with specificity of 96% for detecting a CNV in treatment naïve AMD patients. |
|
Cavichini, 2020 |
Type of study: retrospective case study
Setting and country: tertiary retina centre (Jacobs Retina Center, Shiley Eye Institute, University of California San Diego, San Diego, La Jolla, California, USA.
Funding and conflicts of interest: This study was partly supported by an unrestricted grant from Research to Prevent Blindness, NY. None of the authors declared competing interests. |
Inclusion criteria: (1) presence of intermediate AMD and worse, of total follow-up for a minimum of 2 years without missed follow-up, intravitreal anti-vascular growth endothelium factor (anti- VEGF) injections for the nv-AMD eyes and of OCT-A on the database.
Exclusion criteria: (1) eyes with CNV secondary to a disease other than nvAMD. retinal vascular diseases, glaucomatous optic atrophy, corneal opacities (4) eyes with poor-quality images that were deemed Ungradable.
N=106 patients (152 eyes)
Prevalence: 27%
Mean age ± SD: 75.5 years (range, 42–97, SD 9.8)
Sex: 49% M / 51% F
Other important characteristics: not reported.
|
Describe index test: RTVue-XR Avanti SD-OCT-A
Cut-off point(s): Not applicable.
Comparator test (1) SD-OCT
Comparator test (2) FFA
Cut-off point(s): not applicable.
|
Describe reference test: Clinical parameters along with retinal imaging were used as a gold standard to determine disease activity.
Cut-off point(s): Not applicable.
|
Time between the index test and reference test: same day.
For how many participants were no complete outcome data available? 75
Reasons for incomplete outcome data described? Yes (poor quality of images, previous vitrectomy, ocular comorbidities) |
Outcome measures and effect size (include 95%CI and p-value if available):
Sensitivity 79.28%
Specificity 85.37%
Positive predictive value 60.35%
Negative predictive value 93.62% |
|
|
Corvi, 2020 |
Type of study: prospective observational case series (paired control cohort of patients with GA secondary to AMD without MNV)
Setting and country: Consecutive patients with MA secondary to AMD with concomitant MNV, at the Eye Clinic, Department of Biomedical and Clinical Sciences, Luigi Sacco Hospital, University of Milan (Italy).
Funding and conflicts of interest: Funding: not reported.
CoI: the first and second authors declared no conflict of interest, but other authors declared conflicts of interest (consultant and/or financial support). |
Inclusion criteria: - intervention group: presence of both MA and MNV in the same eye due to AMD only. - control cohort: patients with GA secondary to AMD without any evidence - both groups: atrophy lesions could be multifocal or unifocal, but at least 1 lesion had to be 1.27 mm2 or larger (≥ 0.5 disc areas). of MNV by a multimodal imaging
Exclusion criteria: - any previous treatment for MNV (in the group with MNV) - ocular media Opacity - inadequate pupillary dilation - poor fixation or cooperation, precluding capture of clear images.
N= 42 eyes in 42 patients ((21 MA and MNV, 21 GA)
Prevalence: 50%
Mean age (range): I: 79.7 (71–89) C: 78.6 (67–84)
Sex: I: 29% M / 71% F C: 33% M / 67% F
Other important characteristics: Not reported.
|
Describe index test: swept-source OCTA (SS-OCTA, Plex Elite 9000, Carl Zeiss Meditec, Dublin, CA)
Cut-off point(s): Not applicable.
Comparator test (1) spectral domain- OCT (SD-OCT, Spectralis; Heidelberg Engineering, Heidelberg, Germany)
Cut-off point(s): Not applicable.
Comparator test (2) FA, ICGA (Spectralis; Heidelberg Engineering, Heidelberg, Germany)
Cut-off point(s): Not applicable.
|
Describe reference test: The presence/absence ofMNV in all cases was determined by a senior retinal specialist (GS) using a multimodal imaging approach based on the combination of FA, ICGA, SD-OCT, and OCTA. This multimodal image assessment by the senior retinal specialist was deemed to be the reference or gold standard for comparison of the performance of the individual modalities. |
Time between the index test and reference test: Not reported.
For how many participants were no complete outcome data available? Not reported.
Reasons for incomplete outcome data described? No. |
Outcome measures and effect size (include 95%CI and p-value if available):
Sensitivity 86%
Specificity 90%
Positive predictive value 90%
Negative predictive value 86% |
Results for OCTA were reported as: - ORCC (outer retina-choriocapillaris) - Avascular - Choriocapillaris - Choroid - Manual The results of ORCC were taken into account for our analyses. |
Risk of bias assessment diagnostic accuracy studies (QUADAS II, 2011)
|
Study reference |
Patient selection
|
Index test |
Reference standard |
Flow and timing |
Comments with respect to applicability |
|
Ahmed, 2018 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? Not applicable
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? Unclear
Did patients receive the same reference standard? Unclear
Were all patients included in the analysis? Yes
|
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: UNCLEAR |
CONCLUSION Could the patient flow have introduced bias?
RISK: UNCLEAR |
|
|
|
Cavichini, 2021 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Not applicable.
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? No
|
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: LOW
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
|
Carnevali, 2016 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? Not applicable.
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? No |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: UNCLEAR |
CONCLUSION Could the patient flow have introduced bias?
RISK: HIGH |
|
|
|
Corvi, 2020 |
Was a consecutive or random sample of patients enrolled? Yes, consecutive.
Was a case-control design avoided? No
Did the study avoid inappropriate exclusions? Unclear
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Not applicable.
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? Unclear
Did patients receive the same reference standard? Unclear
Were all patients included in the analysis? Unclear
|
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: LOW
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: UNCLEAR |
|
|
|
Faridi, 2017 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? No
Did the study avoid inappropriate exclusions? Yes |
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? Not applicable |
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear |
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? No |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: HIGH |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: UNCLEAR |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
|
Ghanchi, 2021 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Not applicable.
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? No
|
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: LOW
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: LOW |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
|
Gong, 2016 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? No
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? Not applicable.
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? No |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: UNCLEAR |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
||
|
Moult, 2014 |
Was a consecutive or random sample of patients enrolled? Unclear
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Unclear |
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? Not applicable.
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? No |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: UNCLEAR |
CONCLUSION Could the patient flow have introduced bias?
RISK: HIGH |
||
|
Nikolopoulou, 2018 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? Not applicable.
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR
|
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: UNCLEAR |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
||
|
Usman, 2019 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? Not applicable.
|
Is the reference standard likely to correctly classify the target condition? Yes
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear
|
Was there an appropriate interval between index test(s) and reference standard? Unclear
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: UNCLEAR |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: UNCLEAR |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
Judgments on risk of bias are dependent on the research question: some items are more likely to introduce bias than others, and may be given more weight in the final conclusion on the overall risk of bias per domain:
Patient selection:
- Consecutive or random sample has a low risk to introduce bias.
- A case control design is very likely to overestimate accuracy and thus introduce bias.
- Inappropriate exclusion is likely to introduce bias.
Index test:
- This item is similar to “blinding” in intervention studies. The potential for bias is related to the subjectivity of index test interpretation and the order of testing.
- Selecting the test threshold to optimise sensitivity and/or specificity may lead to overoptimistic estimates of test performance and introduce bias.
Reference standard:
- When the reference standard is not 100% sensitive and 100% specific, disagreements between the index test and reference standard may be incorrect, which increases the risk of bias.
- This item is similar to “blinding” in intervention studies. The potential for bias is related to the subjectivity of index test interpretation and the order of testing.
Flow and timing:
- If there is a delay or if treatment is started between index test and reference standard, misclassification may occur due to recovery or deterioration of the condition, which increases the risk of bias.
- If the results of the index test influence the decision on whether to perform the reference standard or which reference standard is used, estimated diagnostic accuracy may be biased.
- All patients who were recruited into the study should be included in the analysis, if not, the risk of bias is increased.
Judgement on applicability:
Patient selection: there may be concerns regarding applicability if patients included in the study differ from those targeted by the review question, in terms of severity of the target condition, demographic features, presence of differential diagnosis or co-morbidity, setting of the study and previous testing protocols.
Index test: if index tests methods differ from those specified in the review question there may be concerns regarding applicability.
Reference standard: the reference standard may be free of bias but the target condition that it defines may differ from the target condition specified in the review question.
Exclusietabel
|
Auteur en jaartal |
Redenen van exclusie |
|
Wang (2021) |
Does not add relevant studies to Chen (2020) |
|
Altinisik (2021) |
Wrong comparison (effect anti-VEGF) |
|
Borelli (2021) |
Wrong comparison (effect loading treatment) |
|
Fuskushima (2021) |
No comparison with OCT or FAG |
|
Iacono (2021) |
Wrong patient population (myopic CNV) |
|
Ng (2021) |
Wrong comparison (multimodal imaging) |
|
Querques (2021) |
No comparison with OCT or FAG |
|
Rabinovitch (2021) |
Wrong patient population (AMD and diabetic retinopathy (DR)) and outcome (agreement between clinicians) |
|
Sodhi (2021) |
No comparison with OCT or FAG |
|
Solecki (2021) |
No comparison with OCT or FAG |
|
Song (2021) |
No comparison with OCT or FAG |
|
Ahmed (2021) |
Included in SR of Chen (2020) |
|
Siggel (2020) |
Wrong comparison (automated versus manually modified OCT-A) |
|
Babiuch (2020) |
No comparison with OCT or FAG |
|
Choi (2020) |
Wrong study design (predictive model) |
|
Giocanti-Auregan (2020) |
Wrong comparison (article about changes in practice over the years) |
|
Guo (2020) |
Wrong comparison (effect of PDT) |
|
Laiginhas (2020) |
Wrong outcomes (no sensitivity or specificity) |
|
Levine (2020) |
No comparison with OCT or FAG |
|
Rispoli (2020) |
Wrong comparison (effect of anti-VEGF) |
|
Roh (2020) |
Wrong outcomes (no sensitivity or specificity) |
|
Wang (2020) |
No comparison with OCT or FAG |
|
Carbral (2020) |
No comparison with OCT or FAG |
|
Cicinelli (2020) |
Wrong comparison (dye angiography) |
|
Corvi (2020) |
Wrong comparison (indocyanine green angiography and four different optical coherence tomography angiography (OCT-A) devices) |
|
Shen (2020) |
Wrong comparison (effect anti-VEGF) |
|
Singh (2020) |
Wrong comparison (ICGA vs OCTA) |
|
Coscas (2019) |
Before search date of SR of Chen (2020) |
|
Perrott-Reynolds (2019) |
Before search date of SR of Chen (2020) |
|
Usman (2019) |
Included in SR of Chen (2020) |
|
Wang (2019) |
Before search date of SR of Chen (2020) |
|
Bae (2019) |
Wrong comparison (stop group vs. non-stop group) |
|
Bailey (2019) |
No comparison with OCT or FAG |
|
Bansal (2019) |
Before search date of SR of Chen (2020) |
|
De Jong (2019) |
Wrong outcomes (no sensitivity or specificity) |
|
de Oliveira (2019) |
Before search date of SR of Chen (2020) |
|
Faatz (2019) |
Wrong outcomes (no sensitivity or specificity) |
|
Miere (2019) |
Wrong comparison (effect of anti-VEGF) |
|
Shi (2019) |
Wrong comparison (detection of double layer sign) |
|
Sulzbacher (2019) |
Wrong outcomes (no sensitivity or specificity) |
|
Wang (2019) |
Before search date of SR of Chen (2020) |
|
Woetzel (2019) |
No comparison with OCT or FAG |
|
Ahmed (2019) |
Included in SR of Chen (2020) |
|
De Carlo (2019) |
Before search date of SR of Chen (2020) |
|
Faes (2019) |
Wrong patient population (also other diseases than AMD) |
|
Fotis (2019) |
Wrong publication type (protocol for SR) |
|
Yang (2019) |
Before search date of SR of Chen (2020) |
|
Yeo (2019) |
Before search date of SR of Chen (2020) |
|
Nikolopoulou (2018) |
Included in SR of Chen (2020) |
|
Soomro (2018) |
Before search date of SR of Chen (2020) |
|
Souedan (2018) |
Before search date of SR of Chen (2020) |
|
Al-Sheikh (2018) |
No comparison with OCT or FAG |
|
McClintic (2018) |
Wrong comparison and outcomes (effect of anti-VEGF) |
|
Schneider (2018) |
No comparison with OCT or FAG |
|
Xu (2018) |
No comparison with OCT or FAG |
|
de Carlo (2018) |
Wrong comparison (optical coherence tomography angiography (OCT-A) with indocyanine green angiography (ICGA)) |
|
Tan (2018) |
Before search date of SR of Chen (2020) |
|
Told (2018) |
Wrong comparison (ICGA vs OCT-A) |
|
Faridi (2017) |
Included in SR of Chen (2020) |
|
Malamos (2017) |
Before search date of SR of Chen (2020) |
|
Capuano (2017) |
Before search date of SR of Chen (2020) |
|
Cheung (2017) |
Before search date of SR of Chen (2020) |
|
Demirel (2017) |
Before search date of SR of Chen (2020) |
|
Eandi (2017) |
Wrong comparison (ICGA vs OCT-A) |
|
Miere (2017) |
Wrong comparison (effect of anti-VEGF) |
|
Huang (2017) |
Before search date of SR of Chen (2020) |
|
Takayama (2017) |
Wrong comparison (ICGA vs OCT-A) |
|
Costanzo (2016) |
Before search date of SR of Chen (2020) |
|
Lindner (2016) |
Before search date of SR of Chen (2020) |
|
Gong (2016) |
Included in SR of Chen (2020) |
|
Inoue (2016) |
Before search date of SR of Chen (2020) |
|
Coscas (2015) |
Before search date of SR of Chen (2020) |
|
De Carlo (2015a) |
Before search date of SR of Chen (2020) |
|
De Carlo (2015b) |
Wrong publication type (narrative review) |
[1] In geval van een case-control design moeten de patiëntkarakteristieken per groep (cases en controls) worden uitgewerkt. NB; case control studies zullen de accuratesse overschatten (Lijmer et al., 1999)
[2] Comparator test is vergelijkbaar met de C uit de PICO van een interventievraag. Er kunnen ook meerdere tests worden vergeleken. Voeg die toe als comparator test 2 etc. Let op: de comparator test kan nooit de referentiestandaard zijn.
[3] De referentiestandaard is de test waarmee definitief wordt aangetoond of iemand al dan niet ziek is. Idealiter is de referentiestandaard de Gouden standaard (100% sensitief en 100% specifiek). Let op! dit is niet de “comparison test/index 2”.
4 Beschrijf de statistische parameters voor de vergelijking van de indextest(en) met de referentietest, en voor de vergelijking tussen de indextesten onderling (als er twee of meer indextesten worden vergeleken).
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 07-08-2023
Beoordeeld op geldigheid : 17-07-2023
Algemene gegevens
De herziening van deze richtlijn werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Werkgroep
- Dr. R. van Leeuwen, oogarts, Universitair Medisch Centrum Utrecht, Utrecht (NOG, voorzitter)
- Prof. dr. C.C.W. Klaver, oogarts en hoogleraar, Erasmus Medisch Centrum, Rotterdam (NOG)
- Dr. P.H.B. Kok, oogarts, Bergman Clinics, Amsterdam (NOG)
- Dr. J.J.C. van Lith-Verhoeven, oogarts, Elisabeth-TweeSteden Ziekenhuis, Tilburg (NOG)
- Dr. F.D. Verbraak, oogarts, Amsterdam Universitair Medisch Centrum, Amsterdam (NOG)
- Dr. A.C. Lambooij, oogarts, Reinier de Graaf Gasthuis, Delft (NOG)
- Drs. E.A. Huiskamp, oogarts, Universitair Medisch Centrum Groningen, Groningen (NOG)
- Drs. O.A.M. Tigchelaar-Besling, oogarts, Amphia Ziekenhuis, Breda (NOG)
- Drs. L.J. Noordzij, oogarts, Oog Op Zuid, Rotterdam (NOG)
Klankbordgroep
- M.E. Diepman-Leerdam, optometrist, Bergman Clinics, Doetichem (OVN)
- H.J. Jansen-Molenaar, adviseur oogzorg (Oogvereniging) (tot 01-09-2022)
- P. Kortenhoeven, waarnemend coördinator oogzorg (Oogvereniging) (vanaf 01-09-2022)
- H.M.M.J. Schoots, voorzitter MaculaVereniging (MaculaVereniging)
Met ondersteuning van
- Dr. A. van der Hout, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. B.L. Gal-de Geest, adviseur Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen acties |
|
van Leeuwen * |
Oogarts, netvliesspecialist, in het UMC Utrecht. |
Bestuur Vitreoretinale werkgroep, onbetaald Voorzitter Projectgroep Duurzame Oogheelkunde Vertegenwoordiger namens NOG in Landelijke Netwerk Groene OK, onbetaald |
* Ik doe op dit moment niet mee aan door industrie gesponsorde studies. Wel begeleid ik op dit moment wetenschappelijk onderzoek naar LMD welke betaald wordt door een particulier fonds (Stichting AmphoraEst). Deze stichting heeft geen belang bij het advies of de richtlijn, anders dan optimale zorg voor LMD patiënten. Ik heb geen intellectuele of reputatie belangen bij deze richtlijn commissie, anders dan erkenning als professional. * Ik zet mij actief en publiekelijk in voor verduurzaming van de gezondheidszorg, zowel binnen mijn eigen ziekenhuis als landelijk. Hierbij zijn er raakvlakken met de onderhavige richtlijn. * In het verleden heb ik een financiële vergoeding voor presentaties op gesponsord symposium of nascholing ontvangen. Sinds 2018 niet meer. |
Geen restricties |
|
Noordzij |
Werkzaam als oogarts o.a. in het zelfstandig behandelcentrum Oog op Zuid Oogkliniek. Lid van de Coöperatie Oogheelkunde op Zuid U.A. en voorzitter van het bestuur van de Coöperatie Oogheelkunde op Zuid U.A. Bestuurder bij de Stichting Oogheelkunde op Zuid. Medisch directeur bij het zelfstandig behandel Oog op Zuid Oogkliniek. |
De afgelopen maanden in samenwerking met Novartis een enquete opgesteld voor uirvragen hoe er in Nederland intravitreaal geïnjecteerd wordt. Names het Maasstad Ziekenhuis lid van de werkgroep "Santeon dure geneesmiddelen maculadegeneratie". Lid FMS/ NOG werkgroep Cluster Oog (onbetaald). |
Het Maasstad Ziekenhuis nam deel aan de Raven studie van Novartis to 2020. Ik was daarvan voor de locatie Maasstad ziekenhuis de principal investigator. |
Geen restricties |
|
Verbraak |
Oogarts, Amsterdam Universitair Medisch Centrum |
Voorzitter stuurgroep FRB!NL, niet betaald.Ik ben onbezoldigd voorzitter FRB!NL, een project dat gesteund wordt door Bayer, waar nu alleen nog financiering gaat naar advocaten kantoor (via Oogfonds) voor uitwerking agreement tussen deelnemende NL centra en universiteit van Sydney (SSR project). |
Betaald adviseur: Bayer, Novartis, IDxDR, UCB. vergoeding voor deelname (voorzitter) aan werkgroep die de toekomst van oogheelkunde in kaart wil brengen, project van Novartis, dit beslaat gehele oogheelkunde. Ontwikkeling Qualiteit van Visueel Functioneren questionair, AUMC, grant van Bayer. Ik werk mee aan project om een computer assisted test toe te passen als maat voor kwaliteit van leven/visus bij patiënten, die anti-VEGF injecties krijgen, dit wordt gesteund door Bayer, PI is Ruth van Nispen, onderzoekster wordt (deels) betaald. |
Uitgesloten van besluitvorming bij modules over anti-VEGF. Novartis project over toekomst oogheelkunde: geen belangenverstrengeling. |
|
Van Lith-Verhoeven |
Oogarts ETZ (medisch manager oogheelkunde ETZ) |
Lasik centrum Boxtel: ooglidcorrecties |
Adviescommissie Novartis, Bayer en allergan Organisatie congres Novartis en Bayer Honarium voor eigen presentatie Bayer. 1 advies bijeenkomst oogvitaal bv 1 advies bijeenkost horus pharma (betaald) 1 advies bijeenkomst Roche 1 advies bijeenkomst Roche en co-auteur aan expert opinion T & E.
Extern gefinancierd onderzoek: Novartis, Roche, Chengdu Kanghong biological science, Bayer. Het zijn studies van verschillende sponsoren met verschillende medicijnen, zowel op gebied AMD, DME en RVO. We hebben maar enkele deelnemers per studie. Het geld wat we ontvangen gedurende de studieduur gebruiken we om de studie coordinator (trial nurse) en de medewerkers (TOA's, optometristen) te betalen voor de tijd die ze in het onderzoek stoppen. Dat verekenen we dus met het ziekenhuis.
1 advies bijeenkomst oogvitaal bv 1 advies bijeenkost horus pharma (betaald) 1 advies bijeenkomst Roche 1 advies bijeenkomst Roche en co-auteur aan expert opinion T & E. |
Uitgesloten van besluitvorming bij modules over anti-VEGF.
|
|
Huiskamp |
Oogarts, netvliesspecialist in het Universitair Medisch Centrum Groningen |
Geen |
*Annexin Pharmaceuticals, Onderzoek naar moleculair imaging bij patiënten met retinale veneuze occlusie of diabetische retinopathie. SIGHT studie. Kosten voor de afdeling oogheelkunde worden gefinancierd door Annexin Pharmaceuticals. Deelname als onderzoeker aan deze studie (geen projectleider). * Bayer, Multicenter onderzoek naar medicijn voor diabetische retinopathie. NEON-NPDR studie. Kosten voor de afdeling oogheelkunde worden gefinancierd door Bayer. Deelname als onderzoeker aan deze studie (geen projectleider). * Heidelberg Engineering, Onderzoek naar moleculair imaging bij patiënten met neovasculaire LMD. LEAF studie. Financiering door het UMCG zelf. Apparatuur is voor deze studie ter beschikking gesteld door Heidelberg Engineering. Deelname als onderzoeker aan deze studie (geen projectleider). |
Geen restricties |
|
Kok |
Oogarts, medisch retina speciliast Bergamn Clinics Ogen Amsterdam UMC |
Geen |
Geen |
Geen restricties |
|
Lambooij |
Oogarts, Reinier de Graaf ziekenhuis Delft |
Gastdocent TOA opleiding Dutch Health Tec Academy Utrecht, betaald |
Geen |
Geen restricties |
|
Tigchelaar |
Oogarts |
Consultent oogarts bij visio R&A, betaald Consultent oogarts bij visio school, betaald Werkgroep FRB, onbetaald Eenmalige meet the expert bijeenkomst, uren vergoeding Voor novartis voorafgaand introductie van broculizumab. Broculizumab wordt gebruikt bij amd, in het voorstadium van de introductie was een meet the expert bijeenkomst om van een oogarts in het veld te horen wat overwegingen zijn voor beslissingen in de praktijk. Introductie in nederland in 2020. Honorering was alleen uren vergoeding. |
Geen |
Uitgesloten van besluitvorming bij modules over anti-VEGF, mocht wel meelezen als er geen andere experts waren. |
|
Klaver |
Erasmus MC, 0.6FTE, Hoogleraar Radboudumc, 0.4FTE, Oogarts University of Basel (locatie IOB, Basel), 0.15FTE, Hoogleraar |
Lid bestuur van Euretina, Europese vereniging voor retina specialisten, onbetaald Lid bestuur Landelijke Stichting voor Blinden en Slechtzienden (LSBS), onbetaald Lid bestuur Rotterdamse Oogheelkundig Onderzoek Stichting (ROOS), onbetaald Lid bestuur Collaborative Ophthalmic Research Rotterdam (CORR), onbetaald,
Betaald op projectbasis: Consultant voor TheaPharma Consultant voor Bayer |
* Ik maak geen deel uit van onderzoek geïnitieerd door het bedrijfsleven. Wel financiert Bayer een deel van de ontwikkeling van AI algoritmen die wij gebruiken voor het beoordelen van oogheelkundige beelden in ons EyeNED reading center. Bayer heeft geen invloed op deze algoritmen. Algoritmen hebben deels betrekking op LMD. Echter, Bayer is geen producent/leverancier van AI software. * Ik heb geen persoonlijk gewin bij, ander dan persoonlijke erkenning van mijn expertise als clinicus en als wetenschappelijk onderzoeker in dit vakgebied. De LSBS is een slechtziendenstichting die weinig patiënten met maculadegenratie als lid heeft. Mijn grootste inbreng voor de commissie is mijn expertise op het gebied van genetica, voeding en leefstijl. * Ik organiseer 1x per jaar nascholingsdagen voor de werkgroep Medische Retina. Deze nascholingen worden door Bayer gefinancierd. Bayer heeft geen invloed op de inhoud van deze nascholing. Ik geef 1x per jaar lezingen die georganiseerd worden door de firma Thea Pharma voor Europese oogartsen. Deze lezingen gaan over dieet adviezen voor maculadegeneratie. *Het IOB instituut in Basel is opgericht als een samenwerking tussen de Universiteit van Basel, het universiteitsziekenhuis van Basel, en Novartis. Novartis heeft geen zeggenschap over de wetenschappelijke koers en de onderzoeken die IOB uitvoert. Werknemers van IOB hebben geen financiele relatie met Novartis en leggen geen verantwoording af aan deze partij. |
Uitgesloten van besluitvorming bij modules over anti-VEGF.
|
|
Diepman-Leerdam |
Optometrist werkzaam bij Berman Clinics Doetinchem |
Niet van toepassing |
Geen |
Geen restricties |
|
Jansen Molenaar |
Adviseur oogzorg |
Niet van toepassing |
Geen |
Geen restricties |
|
Schoots-Wilke |
Voorzitter MD |
Vrienden van Walstede - onbetaald |
Voorzitter patiëntenvereniging |
Geen restricties |
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Symptomen van LMD |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Fasering diagnostiek van LMD |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module OCT |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module FAG |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module ICG-angiografie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module OCT-angiografie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Indicaties en contra-indicaties voor anti-VEGF behandeling bij neovasculaire LMD |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Keuze van anti-VEGF middel |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Chirurgie bij submaculaire bloeding |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Photodynamic therapy bij polypoidale choroidale vasculopathie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Photodynamic therapy bij retinale angiomateuze proliferatie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Photodynamic therapy bij chronische centrale sereuze chorioretinopathie met subretinale neovascularisatie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Photodynamic therapy bij non-responders op anti-VEGF therapie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Thermische laserbehandeling |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Cataractextractie bij patiënt met neovasculaire LMD |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Behandelstrategie voor anti-VEGF medicatie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Instructies aan patiënt voor herkennen reactivatie van maculaire neovascularisatie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Criteria om te stoppen met anti-VEGF behandeling |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Criteria voor het veranderen van anti-VEGF middel |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Voedingsadvies ter preventie van LMD progressie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Leefstijladviezen ter preventie van LMD progressie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Bloedverdunners bij LMD |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Advies aan familieleden van een patiënt met LMD |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Intravitreale injecties |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Verwijzing naar oogarts |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Verwijzing voor hulpmiddelen en revalidatie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Informed Consent |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Informed consent voor de behandeling met off-label bevacizumab (Avastin®) |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Informatievoorziening aan patiënten en naasten |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Rol van de patiëntenvereniging |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Patiëntenfederatie Nederland, MaculaVereniging en Oogvereniging voor de schriftelijke knelpuntenanalyse en het afgevaardigde patiëntenverenigingen in de klankbordgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de MaculaVerening en Oogvereniging en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg voor patiënten met leeftijdsgebonden maculadegeneratie (LMD). De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijnmodule (NOG, 2014]) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door de IGJ, Zorginstituut, OVN en Oogvereniging via enquête.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zou de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J [corrected to Schünemann, Holger J]. PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
|
Database(s): Ovid/Medline, Embase |
Datum: 23-06-2021 |
|
Periode: 2015 - heden |
Talen: Engels, Nederlands |
Embase
|
No. |
Query |
Results |
|
#11 |
#7 AND #8 AND (#9 OR #10) AND ([english]/lim OR [dutch]/lim) AND [2015-2021]/py NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) |
341 |
|
#10 |
'follow up'/exp/mj OR 'follow up':ti,ab,kw OR followup:ti,ab,kw |
1683696 |
|
#9 |
'sensitivity and specificity'/de OR sensitiv*:ti,ab,kw OR specific*:ti,ab,kw OR 'roc curve':ti,ab,kw OR 'receiver operator*':ti,ab,kw OR 'diagnostic accuracy'/exp OR 'diagnostic test accuracy study'/exp OR validity:ti,ab,kw OR reliability:ti,ab,kw OR 'reproducibility'/exp OR accuracy:ti,ab,kw OR 'validation study'/de OR 'measurement precision'/exp OR 'diagnostic value'/exp OR 'reliability'/exp OR 'predictive value'/exp OR 'predictive value*':ti,ab,kw OR ppv:ti,ab,kw OR npv:ti,ab,kw OR nnt:ti,ab,kw OR 'number needed to':ti,ab,kw OR 'diagnostic value':ti,ab,kw OR 'diagnostic accuracy':ti,ab,kw OR 'diagnostic test accuracy':ti,ab,kw OR 'regression analysis'/exp OR regression*:ti,ab,kw |
7686381 |
|
#8 |
'optical coherence tomography angiography'/exp/mj OR 'optical coherence tomography angiography':ti,ab,kw OR OCT-A:ti,ab,kw OR 'oct-a':ti,ab,kw OR 'oct-angiography':ti,ab,kw |
9154 |
|
#7 |
'age related macular degeneration'/exp OR 'wet macular degeneration'/exp OR (('macula* degeneration' NEAR/3 ('age-related' OR exsudative OR neovascular)):ti,ab,kw) OR amd:ti,ab,kw OR wamd:ti,ab,kw OR warmd:ti,ab,kw OR armd:ti,ab,kw OR namd:ti,ab,kw OR 'subretinal neovascularization'/exp OR ((neovasculari*ation NEAR/3 (choroid* OR subretinal)):ti,ab,kw) OR cnv:ti,ab,kw |
55089 |
Ovid/Medline
|
# |
Searches |
Results |
|
8 |
5 and (6 or 7) |
394 |
|
7 |
Follow-Up Studies/ or follow up.ti,ab,kf. or followup.ti,ab,kf. |
1424809 |
|
6 |
exp "Sensitivity and Specificity"/ or sensitiv*.ti,ab,kf. or specific*.ti,ab,kf. or 'roc curve'.ti,ab,kf. or 'receiver operator*'.ti,ab,kf. or validity.ti,ab,kf. or reliability.ti,ab,kf. or Reproducibility of Results/ or accuracy.ti,ab,kf. or Validation Study/ or 'predictive value*'.ti,ab,kf. or ppv.ti,ab,kf. or npv.ti,ab,kf. or nnt.ti,ab,kf. or 'number needed to'.ti,ab,kf. or ('diagnostic value' or 'diagnostic accuracy' or 'diagnostic test accuracy').ti,ab,kf. or exp Regression Analysis/ or regression*.ti,ab,kf. |
6096967 |
|
5 |
limit 4 to yr="2015 -Current" |
779 |
|
4 |
limit 3 to (english or dutch) |
823 |
|
3 |
1 and 2 |
860 |
|
2 |
(exp *Tomography, Optical Coherence/ and 'angiography'.ti,kf.) or 'optical coherence tomography angiography'.ti,ab,kf. or OCT-A.ti,ab,kf. or 'oct-a'.ti,ab,kf. or 'oct-angiography'.ti,ab,kf. |
11472 |
|
1 |
(exp Macular Degeneration/ and 'age related'.ti,ab,kf.) or Wet Macular Degeneration/ or ('macula* degeneration' adj3 ('age-related' or exsudative or neovascular)).ti,ab,kf. or AMD.ti,ab,kf. or WAMD.ti,ab,kf. or WARMD.ti,ab,kf. or armd.ti,ab,kf. or namd.ti,ab,kf. or Choroidal Neovascularization/ or (neovasculari*ation adj3 (choroid* or subretinal)).ti,ab,kf. or CNV.ti,ab,kf. |
34827 |
