Opslag en bewaren van plasma bij analyse bloedingsneiging
Uitgangsvraag
Hoe lang mogen (on)gecentrifugeerde bloedafname buizen bewaard worden zonder de uitkomst van bloedstollingstesten te beïnvloeden?
Wat zijn de optimale tijden en temperaturen waarbij volbloed, plasma en plaatjesrijk plasma bewaard kunnen worden?
Aanbeveling
De bewaartermijnen uit de CLSI richtlijn/SKS Voorschrift worden aanbevolen als minimale criteria voor de meest aangevraagd stollingsbepalingen (zie tabel Plasma en tabel Volbloed).
Voor het bewaren van plasma op de langere termijn wordt de temperatuur van -70 °C (of lager) aanbevolen.
Recentere literatuur (2008-2018) laat zien dat de bewaartermijnen voor plasma voor sommige test/reagens/apparatuur combinaties langer mogen en kunnen zijn.
Aanbevolen wordt om afwijkingen van CLSI/SKS richtlijn te onderbouwen middels relevante bestaande literatuurstudies (passende bij de gebruikte test/reagens/apparaat) eventueel in combinatie met eigen validatieresultaten.
Overwegingen
Zoals Toulon et al. (2017) al beschreef kan diversiteit tussen de verschillende studies veroorzaakt worden door het verschillend definiëren van de aanvaardbare grenzen van verandering. Ook het gebruik van verschillende apparaten, reagentia en de onderzoekspopulatie kunnen hiertoe bijdragen. Daarnaast geeft van Geest-Daaldrop et al. (2005) aan dat de ene reagens-apparaat combinatie gevoeliger is dan de andere. Daarom wordt in de pre-analytische voorschriften van de SKS/SKML (2016) geadviseerd om afwijkingen van de CLSI/SKS voor eigen reagens en stollingsapparatuur te onderbouwen aan de hand van relevante literatuurstudies en/of eigen onderzoek.
Onderbouwing
Conclusies / Summary of Findings
|
Opslag en bewaren Plasma |
Conclusies (gradatie, aantal studies) |
|
PT |
Over het algemeen kan men concluderen op basis van de literatuur dat er een grote diversiteit heerst hoe bewaartijden en bewaartemperaturen de opslag van volbloed en plasma, beïnvloeden. Zie ook Tabel: Preanalytische voorschriften voor de stollingsbepalingen: PT, PT-INR, aPTT, fibrinogeen, FV, FVIII, antitrombine, D-dimeer en lupus anticoagulans. 2016. Stichting Kwaliteitsbevordering Stollingsonderzoek. Opslag bij kamertemperatuur wordt aanbevolen. |
|
aPTT |
|
|
D-dimeren |
|
|
Fibrinogeen |
|
|
Stollingsfactoren |
|
|
vWF |
Weinig studies. Richtlijn SKS aanhouden (conform stollingsfactoren) |
|
Trombinetijd |
Weinig studies. Richtlijn SKS aanhouden (conform aPTT) |
|
TEG |
N.v.t. volbloedtesten |
|
LTA |
|
|
PFA |
Samenvatting literatuur
De recentste versie van de CLSI-standaard (2008: H21-A5) beschrijft aanbevelingen hoe laboratoria kunnen omgaan met de opslag van hun patiëntmateriaal. De gebruikte literatuur geeft een duidelijke samenvatting van de bewaartijden en -temperaturen van de twee belangrijkste routine bepalingen, de PT en aPTT. De CLSI heeft op basis van deze literatuurbronnen aanbevelingen gedaan waarbij onderscheid wordt gemaakt tussen volbloed en plasma. Daarnaast beschrijft de CLSI ook nog enkele opslag aanbevelingen voor verschillende trombocyten functie testen. Deze bewaartijden en temperaturen zijn overgenomen door de Stichting Kwaliteitsbevordering Stollingsonderzoek (SKS) en gepubliceerd voor PT, INR, aPTT, fibrinogeen, FV, FVIII, antitrombine, D-dimeer en Lupus anticoagulans (LAC) in 2016.
Tabel: Bewaartemperatuur van gecentrifugeerd en afgepipetteerd citraatplasma en ingevroren citraatplasma en maximum bewaartermijnen zoals aanbevolen door CLSI (H21-A5).
|
Test |
|
Plasma |
|
|
|
18-24 ˚C |
2-4 ˚C |
-20 ˚C* |
-70 ˚C* |
|
|
PT/PT-INR |
24 uur |
Niet acceptabel |
2 wk |
12 mnd |
|
aPTT |
4 uur |
4 uur |
2 wk# |
12 mnd# |
|
Fibrinogeen |
4 uur |
4 uur |
2 wk |
12 mnd |
|
FV en FVIII |
4 uur |
4 uur |
2 wk |
12 mnd |
|
Antitrombine |
4 uur |
4 uur |
2 wk |
12 mnd |
|
LAC |
4 uur |
4 uur |
2 wk |
NB |
|
D-dimeer |
6 uur |
1 week |
2 wk |
12 mnd |
* Goed mengen voor testen
# Gehepariniseerd: trombocyten < 10*109/L
NB Niet bekend
In vergelijking met het bewaren van volbloed, kan plasma bestemd voor PT en aPTT analyses ook bewaard worden bij kamertemperatuur, voor 24 en 4 uur respectievelijk (CLSI, 2008: H21-A5; van Geest-Daalderop et al., 2005; Ridyard et al., 1998; Adcock et al., 1998; Awad et al., 2004; Baglin et al., 1997; Davis et al., 1998; Froom et al., 2001; Leeming et al., 1998). Hierbij kan het plasma in de ongeopende, gecentrifugeerde buizen bewaard blijven, rustend op de cellaag (Heil et al., 1998; Neofotistos et al., 1998; Omran et al., 1996). De CLSI geeft daarbij aan dat er weinig literatuur beschikbaar is dat aliquoteren van plasma ondersteunt. Toch beveelt de CLSI wel aan om het plasma van de cellaag te verwijderen en te aliquoteren (2008: H58-A). Plasma van patiënten die heparine gebruiken moet binnen 1 uur geanalyseerd worden voor de aPTT (Adcock et al., 1998). Het plasma voor aPTT gebaseerde testen en overige testen kan voor maximaal 4 uur bewaard worden bij kamertemperatuur. Het grote verschil met volbloed, is dat plasma voor de aPTT en aPTT gebaseerde testen bewaard kunnen worden bij 2 tot 8 °C. Wanneer plasma voor langere tijd bewaard moet worden, dient er gebruikt gemaakt te worden van PPP. Het plasma dat bestemd is voor PT en aPTT analyses kan twee weken bewaard worden bij -20 °C en of twaalf maanden bij -70 °C (CLSI, 2008: H21-A5). De CLSI geeft daarbij aan dat dit niet bekend is voor langere termijn opslag (-70 °C) van plasma monsters van patiënten die heparine gebruiken voor aPTT-analyses. Plasma monsters die onderzocht worden voor von Willebrandfactor en FVIII-deficiëntie kunnen 6 maanden bewaard worden bij -70 °C, bij ontdooien dient er goed gemengd te worden (CLSI, 2008: H21-A5). Plasma voor D-dimeren kan 2 jaar tussen de -24 en -74 °C (CLSI, 2011: H59-A; Caliezi et al., 2000; Woodhams et al., 2001) bewaard blijven.
Ten slotte wordt aangegeven dat monsterstabiliteit per laboratorium kan verschillen, afhankelijk van het soort reagentia, meetapparatuur, collectie systeem en combinaties van testen er gebruikt worden. Daarom raadt de CSLI aan om de monsterstabiliteit in het eigen laboratorium te testen wanneer men monsters (anders dan PT-INR) langer dan 4 uur wil bewaren bij kamertemperatuur (CLSI, 2008: H21A5; van Geest-Daalderop et al., 2005).
Na de laatste herziening van de CLSI H21-A5, in 2008, hebben er meerdere nieuwe studies plaats gevonden op het gebied van opslag en stabiliteit van patiëntmateriaal in het stollingsonderzoek. Zo onderzocht Zhoa et al. (2013) de effecten van bewaren bij kamertemperatuur en bij 4 °C, tot 24 uur na bloedafname. Bij kamertemperatuur vonden de auteurs dat plasma voor de TT, PT, D-dimeren en fibrinogeen tot 24 uur na bloedafname stabiel blijft. Daarbij bleef de aPTT echter maar 8 uur stabiel na bloedafname bij kamertemperatuur. Vergelijkbare resultaten werden gevonden wanneer het plasma bewaard werd bij 4 °C. In een iets uitgebreidere studie, uitgevoerd door collega Feng et al. (2014) concludeerde men ook dat de PT/INR en fibrinogeen tot 24 uur houdbaar is bij 4 °C en kamertemperatuur. Daarnaast toonde deze studie aan dat plasma goed blijft voor het bepalen van FVIII en FIX, bewaard bij 4 °C en kamertemperatuur voor respectievelijk, 2 en 4 uur. Verder bleef de aPTT 12 uur stabiel bij 4 °C en 8 uur bij kamertemperatuur. Een studie door Rimac et al. (2017) onderzocht de mogelijkheid om plasma te bewaren in ongeopende gecentrifugeerde buizen, waarbij plasma op de cellaag rust, bij kamertemperatuur tot 24 uur na bloedafname. Daarnaast werd ook plasma 24 uur bewaard bij 4 °C. Onderzoek wees uit dat plasma prima bewaard kan worden in ongeopende gecentrifugeerde buizen waarna er stabiele testen uitgevoerd kunnen worden voor de PT, fibrinogeen en antitrombine. Ook concludeerden de auteurs dat D-dimeren nog stabiel gemeten kunnen worden, in ongeopende gecentrifugeerde buizen, bij 4 °C tot 24 uur na bloedafname. Een studie door Linskens en Devreese (2018) beschreef de effecten van bewaarintervallen tot 48 uur na bloedafname bij kamertemperatuur en vergeleek deze met de aanbevelingen van de CLSI (2008: H21-A5). Plasma dat bewaard blijft bij kamertemperatuur is voor de routine stollingstesten, fibrinogeen, D-dimeren en PT tot 48 uur stabiel. Plasma aPTT bleef tot 4 uur stabiel bij kamertemperatuur. Plasma dat verdacht wordt op vWF-deficiëntie kan tot 48 uur betrouwbaar gemeten worden wanneer het plasma bewaard wordt bij kamertemperatuur. Bij stollingsfactoren kunnen plasma monsters voor het bepalen van FV en FVIII tot 2 uur bewaard worden bij kamertemperatuur. Plasma voor FVII-bepaling blijft stabiel wanneer plasma bewaard wordt bij kamertemperatuur tussen de 8 en 12 uur. FXII kan betrouwbaar gemeten worden in plasma dat bewaard is tussen de 8 en 24 uur bij kamertemperatuur. De stollingsfactoren FII, FX, en FIX, FXI zijn 24 en 48 uur stabiel, respectievelijk. Deze resultaten laten nadrukkelijk langere bewaartijden zien, in vergelijking tot de door de CLSI standaard (2018: H21A5)aanbevolen bewaartijden.
Lange termijn opslag van plasma
Met betrekking tot de lange termijn opslag van patiëntmateriaal is weinig bekend op het gebied van stollingstesten. In 2013, onderzocht van den Besselaar et al. (2013) in een klein studiepopulatie het effect van langere termijn opslag in bevroren plasma monsters. Over een periode van 3 jaar, observeerden de auteurs een significante verhoging in INR-waarde, wanneer plasma wordt opgeslagen bij -20 en -40 °C. Deze significante verschillen werden niet geobserveerd wanneer deze monsters werden bewaard bij -70 °C. Op basis van deze resultaten kan geconcludeerd worden dat temperaturen rond de -20 en -40 °C geen optimale bewaarcondities zijn wanneer patiëntmateriaal voor langere tijd bewaard moet worden. In een andere studie (Foshat et al. (2015) onderzocht men de effecten van bewaartijden op plasma van gezonde vrijwilligers en patiënten met een stollingsdefect, bij -20 °C. Het bewaren van plasma 2 weken bij -20 °C had geen klinisch relevante consequenties voor de uitslagen van verschillende stollingstesten; PT, aPTT en D-dimeren. Deze resultaten komen overeen met de aanbevelingen van de CLSI (2008: H21-A5). Gosselin en Dwyre (2015) vonden wel significante verschillen wanneer plasma voor PT, aPTT, FV, FVIII en antitrombine 1 week wordt bewaard bij -70 °C; deze verschillen werden door de auteurs echter beschouwd als niet-klinisch relevant. Verder onderzocht Gosselin et al. (2015) in een andere studie de effecten van verschillende invriesmethodes, of plasma monster gesloten of ontdopt moeten worden wanneer het monster ontdooid moet worden. Ook is er gekeken naar verschillende bewaarbuisjes waarin het plasma bewaard kan worden. De auteurs concludeerden dat buistype, invriesmethode en ontdooistrategie kunnen bijdragen aan de verschillen in stollingsonderzoek, maar in deze studie leiden de geobserveerde verschillen niet tot een verandering in de klinische besluitvorming. Een belangrijke vraag die men hierbij kan stellen is of de mogelijkheid bestaat of het plasmamonster blootgesteld kan worden aan meerdere vries-ontdooi stappen en wat het effect hiervan is op de stollingstesten. Echter, hier is weinig literatuur over bekend. Daarnaast beschikken ziekenhuislaboratoria over bevroren plasma dat wordt gebruikt voor transfusie.
Twee studies hebben onderzocht of het mogelijk is om na ontdooien deze plasma’s weer opnieuw in te vriezen (Ben-Tal et al., 2003; Philip et al., 2013). Plasma monsters werden afgenomen na eerste ontdooiing waarna het plasma 24 uur werd bewaard bij 4 °C, vervolgens werd het plasma weer opnieuw ingevroren (Philip et al. 2013; < -18 °C, Ben-Tal et al. 2003; -80 °C). Na één week werd deze procedure nogmaals herhaald en werden verschillende stollingsfactoren en fibrinogeen bepaald. Zowel Philip et al. (2013), als Ben-Tal et al. (2003) vonden dat FII, FVII, FIX, FX en fibrinogeen waarden stabiel bleven in her-ingevroren plasma monsters en dat deze plasma’s gebruikt konden worden voor transfusie. De vraag natuurlijk blijft of dit te extrapoleren is naar ingevroren citraat-plasma monsters, sinds plasma voor transfusie uit een andere samenstelling bestaat.
Zoeken en selecteren
De zoekverantwoording is weergegeven onder het tabblad Verantwoording. Zie de zoekverantwoording voor de uitgebreide zoekstrategieën per module.
Referenties
- Adcock D, Kressin D, Marlar RA. The effect of time and temperature variables on routine coagulation tests. Blood Coagul Fibrinolysis. 1998;9(6):463-70.
- Adcock Funk DM, Lippi G, Favaloro EJ. Quality standards for sample processing, transportation, and storage in hemostasis testing. Semin Thromb Hemost. 2012;38(6):576-85.
- Awad MA, Selim TE, Al-Sabbagh FA. Influence of storage time and temperature on international normalized ratio (INR) levels and plasma activities of vitamin K dependent clotting factors. Hematology. 2004;9(5-6):333-7.
- Baglin T, Luddington R. Reliability of delayed INR determination: implications for decentralized anticoagulant care with off-site blood sampling. Br J Haematol. 1997;96(3):431-4.
- Ben-Tal O, Zwang E, Eichel R, Badalbev T, Hareuveni M. Vitamin K-dependent coagulation factors and fibrinogen levels in FFP remain stable upon repeated freezing and thawing. Transfusion. 2003;43(7):873-7.
- Bohm M, Taschner S, Kretzschmar E, Gerlach R, Favaloro EJ, Scharrer I. Cold storage of citrated whole blood induces drastic time-dependent losses in factor VIII and von Willebrand factor: potential for misdiagnosis of haemophilia and von Willebrand disease. Blood Coagul Fibrinolysis. 2006;17(1):39-45.
- Caliezi C, Reber G, Lammle B, de Moerloose P, Wuillemin WA. Agreement of D-dimer results measured by a rapid ELISA (VIDAS) before and after storage during 24h or transportation of the original whole blood samples. Thromb Haemost. 2000;83(1):177-8.
- Christensen TD, Jensen C, Larsen TB, Maegaard M, Christiansen K, Sorensen B. International Normalized Ratio (INR), coagulation factor activities and calibrated automated thrombin generation - influence of 24 h storage at ambient temperature. Int J Lab Hematol. 2010;32(2):206-14.
- CLSI. Collection, transport, and processing of blood specimens for testing plasma-based coagulation assays and molecular hemostasis assays; approved guideline – fifth edition. CLSI Document H21-A5. Wayne, PA: Clinical and Laboratory Standards Institute; 2008.
- CLSI. Platelet function testing by aggregometry; approved guideline. CLSI Document H58-A. Wayne, PA: Clinical and Laboratory Standards Institute; 2008.
- CLSI. Quantitative D-dimer for the exclusion of venous thromboembolic disease; approved guideline. CLSI Document H59-A. Wayne, PA: Clinical and Laboratory Standards Institute; 2011.
- Coller BS, Franza BR, Jr., Gralnick HR. The pH dependence of quantitative ristocetin-induced platelet aggregation: theoretical and practical implications-a new device for maintenance of platelet-rich plasma pH. Blood. 1976;47(5):841-54.
- Davis KD, Danielson CF, May LS, Han ZQ. Use of different thromboplastin reagents causes greater variability in international normalized ratio results than prolonged room temperature storage of specimens. Arch Pathol Lab Med. 1998;122(11):972-7.
- Engbers MJ, Cushman M, Rosendaal FR, Van Hylckama Vlieg A. The effect of time between venipuncture, processing and freezing on the measurement of coagulation factor levels. J Thromb Haemost. 2012;10(8):1691-3.
- Favaloro EJ, Soltani S, McDonald J. Potential laboratory misdiagnosis of hemophilia and von Willebrand disorder owing to cold activation of blood samples for testing. Am J Clin Pathol. 2004;122(5):686-92.
- Feng L, Zhao Y, Zhao H, Shao Z. Effects of storage time and temperature on coagulation tests and factors in fresh plasma. Sci Rep. 2014;4:3868.
- Foshat M, Bates S, Russo W, Huerta A, Albright K, Giddings K, Indrikovs A, Qian YW. Effect of freezing plasma at -20 degrees C for 2 weeks on prothrombin time, activated partial thromboplastin time, dilute Russell viper venom time, activated protein C resistance, and D-dimer levels. Clin Appl Thromb Hemost. 2015;21(1):41-7.
- Froom P, Abramova D, Bar-El M, Barak M. Reliability of delayed prothrombin time INR determinations in a central laboratory using off-site blood sampling. Clin Lab Haematol. 2001;23(3):189-92.
- Gosselin RC, Dwyre DW. Determining the effect of freezing on coagulation testing: comparison of results between fresh and once frozen-thawed plasma. Blood Coagul Fibrinolysis. 2015;26(1):69-74.
- Gosselin RC, Honeychurch K, Kang HJ, Dwyre DM. Effects of storage and thawing conditions on coagulation testing. Int J Lab Hematol. 2015;37(4):551-9.
- Han P, Ardlie NG. The influence of pH, temperature, and calcium on platelet aggregation: maintenance of environmental pH and platelet function for in vitro studies in plasma stored at 37 degrees C. Br J Haematol. 1974;26(3):373-89.
- Harrison P, Mackie I, Mumford A, Briggs C, Liesner R, Winter M, Machin S; British Committee for Standards in Haematology. Guidelines for the laboratory investigation of heritable disorders of platelet function. Br J Haematol. 2011;155(1):30-44.
- Heil W, Grunewald R, Amend M, Heins M. Influence of time and temperature on coagulation analytes in stored plasma. Clin Chem Lab Med. 1998;36(7):459-62.
- Jilma B. Platelet function analyzer (PFA-100): a tool to quantify congenital or acquired platelet dysfunction. J Lab Clin Med. 2001;138(3):152-63.
- Kaiser AF, Neubauer H, Franken CC, Kruger JC, Mugge A, Meves SH. Which is the best anticoagulant for whole blood aggregometry platelet function testing? Comparison of six anticoagulants and diverse storage conditions. Platelets. 2012;23(5):359-67.
- Kattlove HE, Alexander B. The effect of cold on platelets. I. Cold-induced platelet aggregation. Blood. 1971;38(1):39-48.
- Kemkes-Matthes B, Fischer R, Peetz D. Influence of 8 and 24-h storage of whole blood at ambient temperature on prothrombin time, activated partial thromboplastin time, fibrinogen, thrombin time, antithrombin and Ddimer. Blood Coagul Fibrinolysis. 2011;22(3):215-20.
- Kim YA, Lewandrowski KB, Lucien FA, Van Cott EM. The effects of transport temperature and time on routine and specialized coagulation assays. Blood Coagul Fibrinolysis. 2018;29(2):184-8.
- Leeming DR, Craig S, Stevenson KJ, Taberner DA. The determination of INR in stored whole blood. J Clin Pathol. 1998;51(5):360-3.
- Linskens EA, Devreese KMJ. Pre-analytical stability of coagulation parameters in plasma stored at room temperature. Int J Lab Hematol. 2018.
- Meesters MI, Koch A, Kuiper G, Zacharowski K, Boer C. Instability of the non-activated rotational thromboelastometry assay (NATEM) in citrate stored blood. Thromb Res. 2015;136(2):481-3.
- Neofotistos D, Oropeza M, Ts'ao CH. Stability of plasma for add-on PT and APTT tests. Am J Clin Pathol. 1998;109(6):758-63.
- Omran S, Hallouda M, Essawi F, el Attar I, Aboul Enein A, Gaafar T, Afifi N. Effect of cold storage on the haemostatic cascade systems. Transfus Sci. 1996;17(3):407-14.
- Palmer RN, Gralnick HR. Cold-induced contact surface activation of the prothrombin time in whole blood. Blood. 1982;59(1):38-42.
- Philip J, Sarkar RS, Pathak A. The effect of repeated freezing and thawing on levels of vitamin K-dependent coagulation factors and fibrinogen in fresh frozen plasma. Asian J Transfus Sci. 2013;7(1):11-5.
- Preanalytische voorschriften voor de stollingsbepalingen: PT, PT-INR, aPTT, fibrinogeen, FV, FVIII, antitrombine, D-dimeer en lupus anticoagulans. 2016. Stichting Kwaliteitsbevordering Stollingsonderzoek. https://www.skml.nl/uploads/e5/52/e552f33a7e9d98261cd81966c4da96b6/Pre-Analytische-voorschriften2016.pdf
- Richtlijn LTA-VHL t.b.v. analyse bloedingsneiging (24-1-2016). http://de-vhl.nl/docs/hemostaseb/Richtlijn%20LTA-VHL%20t.b.v.%20analyse%20bloedingsneiging.pdf
- Ridyard J, Bhavnani M, Seal LH. Laboratory control of oral anticoagulant therapy: preservation of prothrombin time specimens using a polypropylene collection system. Clin Lab Haematol. 1998;20(6):369-72.
- Rimac V, Coen Herak D. Is it acceptable to use coagulation plasma samples stored at room temperature and 4degreeC for 24 hours for additional prothrombin time, activated partial thromboplastin time, fibrinogen, antithrombin, and D-dimer testing? International Journal of Laboratory Hematology. 2017;39(5):475-81.
- Salvagno GL, Lippi G, Montagnana M, Franchini M, Poli G, Guidi GC. Influence of temperature and time before centrifugation of specimens for routine coagulation testing. Int J Lab Hematol. 2009;31(4):462-7.
- Silver WP, Keller MP, Teel R, Silver D. Effects of donor characteristics and platelet in vitro time and temperature on platelet aggregometry. J Vasc Surg. 1993;17(4):726-33.
- Theusinger OM, Nurnberg J, Asmis LM, Seifert B, Spahn DR. Rotation thromboelastometry (ROTEM) stability and reproducibility over time. European journal of cardio-thoracic surgery : official journal of the European Association for Cardio-thoracic Surgery. 2010;37(3):677-83.
- Toulon P, Metge S, Hangard M, Zwahlen S, Piaulenne S, Besson V. Impact of different storage times at room temperature of unspun citrated blood samples on routine coagulation tests results. Results of a bicenter study and review of the literature. Int J Lab Hematol. 2017;39(5):458-68.
- Ts'ao CH, Lo R, Raymond J. Critical importance of citrate--blood ratio in platelet aggregation studies. Am J Clin Pathol. 1976;65(4):518-22.
- van Balveren JA, Huijskens MJ, Gemen EF, Pequeriaux NC, Kusters R. Effects of time and temperature on 48 routine chemistry, haematology and coagulation analytes in whole blood samples. Ann Clin Biochem. 2017;54(4):448-62.
- van den Besselaar AM, Witteveen E, van der Meer FJ. Long-term stability of frozen pooled plasmas stored at 70 degrees C, -40 degrees C, and -20 degrees C for prothrombin time and International Normalized Ratio (INR) assessment. Thromb Res. 2013;131(4):349-51.
- van Geest-Daalderop JH, Mulder AB, Boonman-de Winter LJ, Hoekstra MM, van den Besselaar AM. Preanalytical variables and off-site blood collection: influences on the results of the prothrombin time/international normalized ratio test and implications for monitoring of oral anticoagulant therapy. Clin Chem. 2005;51(3):561-8.
- Woodhams B, Girardot O, Blanco MJ, Colesse G, Gourmelin Y. Stability of coagulation proteins in frozen plasma. Blood Coagul Fibrinolysis. 2001;12(4):229-36.
- Zhao Y, Lv G. Influence of temperature and storage duration on measurement of activated partial thromboplastin time, D-dimers, fibrinogen, prothrombin time and thrombin time, in citrate-anticoagulated whole blood specimens. Int J Lab Hematol. 2013;35(5):566-70.
- Zucker MB. Platelet aggregation measured by the photometric method. Methods Enzymol. 1989;169:117-33.
- Zürcher M, Sulzer I, Barizzi G, Lammle B, Alberio L. Stability of coagulation assays performed in plasma from citrated whole blood transported at ambient temperature. Thrombosis & Haemostasis. 2008;99(2):416-26.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 05-11-2020
Voor het beoordelen van de actualiteit van deze richtlijn wordt (een deel van) de werkgroep in stand gehouden. Op modulair niveau is een onderhoudsplan beschreven. Bij het afronden van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten. De NVKC is regiehouder van deze richtlijn(module) en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn(module).
Algemene gegevens
De richtlijnontwikkeling werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
- Het opstellen van laboratorium technische adviezen, voor zover mogelijk Evidence-Based met betrekking tot de pre-analyse van minimaal 10 testen die veel gebruikt worden in Nederland en die noodzakelijk zijn voor de analyse, diagnose en behandeling van patiënten met bloedingsneiging.
- Een bijdrage leveren aan de standaardisatie van hemostase testen en de grotere uitwisselbaarheid van uitslagen en hemostase laboratoriumdiagnostiek tussen ziekenhuislaboratoria.
- Een handreiking geven van de bekende literatuur op het gebied van de pre-analytische fase op het gebied van hemostase (t/m juli 2018).
Doelgroep
Deze richtlijn is een handreiking voor alle laboratoriumspecialisten klinische chemie (NVKC/VHL) die nauw in contact staan met de medisch specialist, waarbij de klinisch chemicus op het gebied van analyse bloedingsneigingen consultaties geeft en (eind)verantwoordelijk is voor de bloedafname, analyse en rapportage van stollingstesten. Indirecte gebruikers van deze voorschriften kunnen artsen en verpleegkundigen zijn, die de diagnose stellen en/of bloed afnemen ten behoeve van stollingsonderzoek. Hierbij kan onderscheid gemaakt worden tussen de huisartsen die basale testen aanvragen en aanvragers van het uitgebreide stollingspakket zoals internisten, internist-hematologen, gynaecologen, anesthesisten, kinderartsen, radiologen, tandartsen, en (kaak)chirurgen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een werkgroep ingesteld. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dr.ir. Y.M.C. (Yvonne) Henskens, laboratoriumspecialist klinische chemie, Maastricht UMC+, Maastricht (voorzitter), namens NVKC/VHL
- Dr. Dr. M.L.J (Mike) Jeurissen, onderzoeker, Maastricht UMC+, Maastricht, namens NVKC
- Dr. A.K. (An) Stroobants, laboratoriumspecialist klinische chemie, Amsterdam UMC, locatie AMC, Amsterdam, namens NVKC/VHL
- Dr. M.P.M. (Moniek) de Maat, biochemicus, Erasmus MC, Rotterdam, namens VHL
- C.A.M. (Caroline) Klopper, vakanalist, Amsterdam UMC, locatie AMC, namens NVTH werkgroep Hemostase
- P.W.M. (Paul) Verhezen, vakanalist, Maastricht UMC+, Maastricht, namens NVTH werkgroep Hemostase
- Dr. K.M.T. (Kim) de Bruyn, laboratoriumspecialist klinische chemie, Tergooi, Hilversum, Blaricum, namens NVKC/VHL
- Dr. R.W.L.M. (René) Niessen, laboratoriumspecialist klinische chemie, OLVG, Amsterdam, namens NVKC/SKML
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben. Een overzicht van de belangen van werkgroepleden is in onderstaande tabel weergegeven; er zijn geen restricties m.b.t. deelname aan de werkgroep.
|
Naam |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Y. Henskens |
Klinisch chemicus |
Lid LGR Sanquin Voorzitter gebruikersraad Sanquin ZON/Limburg Voorzitter concilium NVKC (opleiding) Lid Kennisplatform Transfusiegeneeskunde ZO Bestuurslid VHL Lid werkgroep Hemostase VHL (allen onbetaald) Richtlijn commissie Antitrombotisch beleid FMS/NIV namens NVKC Richtlijn werkgroep FMS Bloedtransfusie (massaal bloedverlies) (vacatiegeld) |
Voor alle studies in het kader van MUMC+ onderzoekslijn “laboratory predictors of bleeding” worden IVD gebruikt die geheel of gedeeltelijk worden gesponsord door IVD firma’s |
Geen: het betreft geen IVD in het kader van preanalyse |
|
M. Jeurissen |
Onderzoeker |
Geen |
Geen |
Geen |
|
A. Stroobants |
Klinisch chemicus |
Bestuurslid VHL Voorzitter werkgroep Hemostase VHL Richtlijn commissie Antitrombotisch beleid FMS/NIV namens NVKC |
Geen |
Geen |
|
M. de Maat |
Biochemicus |
Lid RvT ECAT (vacatievergoeding) Lid Council International Fibrinogen Research (onbetaald) |
Geen |
Geen |
|
C. Klopper |
Vakanalist |
Lid WHD: Werkgroep Hemostase Diagnostiek NVTH (onbetaald) |
Geen |
Geen |
|
P. Verhezen |
Vakanalist |
Lid WHD: Werkgroep Hemostase Diagnostiek NVTH (onbetaald) |
Geen |
Geen |
|
K. de Bruyn |
Klinisch chemicus |
ISO 15189 auditor (betaald) |
Geen |
Geen |
|
R. Niessen |
Klinisch chemicus |
Bestuurslid: SKML sectie Hematologie Sectie SKS-SKML FNT (allen onbetaald) |
Geen |
Geen |
Inbreng patiëntenperspectief
De richtlijn richt zich voornamelijk op de bloedstollingstesten die ingezet kunnen worden bij patiënten die verdacht worden van een congenitale (stollingsfactoren, trombopathie) of verworven (anticoagulantia, massaal bloedverlies) bloedingsneiging. In samenspraak met de Nederlandse Vereniging van Hemofilie Patiënten (NVHP) is uitleg opgesteld voor patiënten waarbij bloed wordt afgenomen voor stollingsonderzoek. De uitleg is op B1 niveau geformuleerd, met kernbegrippen waarop een patiënt zelf verder kan zoeken, indien gewenst.
Methode ontwikkeling
Evidence based
Implementatie
Tijdens de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is opgenomen bij de aanverwante producten.
Werkwijze
Knelpuntenanalyse
Tijdens de voorbereidende fase werden de knelpunten geïnventariseerd en een lange lijst van uitgangsvragen opgesteld. Tijdens een bijeenkomst werd door alle werkgroepleden een prioritering ingevuld van de verzamelde uitgangsvragen. De vragen met de hoogste prioriteit werden vervolgens gebruikt voor deze richtlijn.
Uitgangsvragen
De werkgroep heeft de volgende uitgangsvragen geprioriteerd:
- Welke patiënten kenmerken (biologische status) kunnen de uitkomsten van bloedstollingstesten beïnvloeden?
- Welke factoren kunnen invloed hebben op de (kwaliteit van de) bloedafname en hebben daardoor invloed op de uitkomsten van bloedstollingstesten?
- Welke factoren kunnen invloed hebben op het transport van patiëntmateriaal waardoor ze hebben de uitkomst van bloedstollingstesten kunnen beïnvloeden?
- Welke factoren kunnen invloed hebben op de verwerking van patiëntmateriaal tot plasma of plaatjes-rijk plasma waardoor ze de uitkomst van bloedstollingstesten kunnen beïnvloeden?
- Hoe lang kan volbloed en plasma bewaard worden, zonder de uitkomst van bloedstollingstesten te beïnvloeden?
Strategie voor zoeken en selecteren van literatuur
De zoekstrategieën die zijn verricht in het kader van de uitgangsvragen zijn systematisch uitgevoerd. De zoekstrategieën hebben plaats gevonden in het database Pubmed en/of Medline. Enkele zoektermen die veelvoudig zijn gebruikt zijn: blood coagulation, blood coagulation tests, blood clotting, hemostasis, blood collection, blood specimen. Deze zoektermen werden in combinatie gebruikt met specifiekere zoektermen gericht op het onderwerp. Zie de zoekverantwoording voor de uitgebreide zoek strategieën per module.
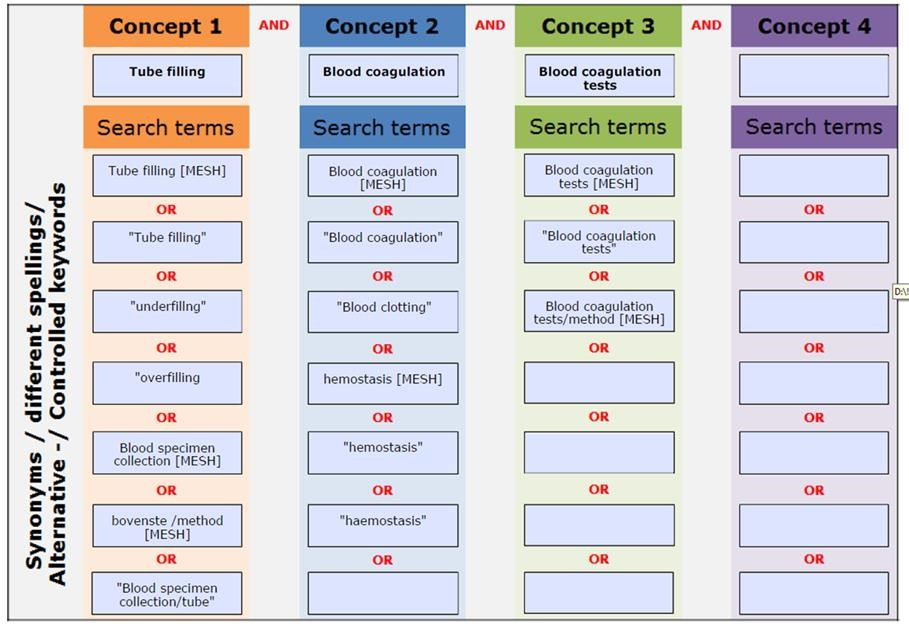
Samenvatten van de literatuur
De belangrijkste bevindingen uit de wetenschappelijke literatuur zijn beschreven in de samenvatting van de literatuur.
De intentie voor het graderen van literatuur voor deze richtlijn was om gebruik te maken van GRADE. De beschikbare stollingstesten om de primaire en secondaire hemostase te analyseren zijn sterk afhankelijk van pre-analytische variabelen, die de uitslagen van deze testen sterk kunnen beïnvloeden. De literatuur biedt geen consensus in de optimale pre-analytische omstandigheden waarbij bloedstolling testen uitgevoerd kunnen worden. Om kwaliteit en de sterkte van aanbevelingen te kwantificeren werd eerst onderzocht of het GRADE-systeem implementeerbaar is in deze richtlijn. De vraag die wij ons hierbij eerst gesteld hebben is: is GRADE toepasbaar in een pre-analytische setting van de laboratoriumdiagnostiek? Bij GRADE wordt de kwaliteit van de studie per uitkomstmaat bepaald, geformuleerd via het PICO-principe. Vijf factoren bepalen de kwaliteit per uitkomstmaat: publicatiebias, beperking in studieopzet, imprecisie, indirectheid en inconsistentie (Guyatt et al., 2011, Boluyt et al., 2012). Om te kijken of GRADE toepasbaar is hebben we een kleine zoekopdracht uitgevoerd, waarbij gekeken is naar de interferentie van hemolyse op bloedstollingstesten om knelpunten van GRADE te identificeren. Knelpunten werden gevonden in de formulering van de PICO; keuze van populatie (patiënt en gezond), aangezien pre-analytische variaties in elke populatie kan voorkomen en daarbij de keuze van de juiste uitkomstmaat. De zoekopdracht resulteerde in drie studies die de juiste uitkomstmaat gebruikte uit een selectie van ±600 hits. Daarbij toonde de gekozen studies grote verschillen in apparatuur, reagentia, en methode van inductie en definitie van hemolyse. Op basis van de criteria volgens GRADE zou deze uitkomstmaten een zeer lage of geen gradatie krijgen. Onze conclusie was dat de PICO’s binnen GRADE zeer klinisch en patiëntgericht zijn waarbij voornamelijk gekeken wordt naar interventies; daardoor is GRADE niet toepasbaar binnen een preanalytische setting.
Op basis hiervan werd de literatuur gegradeerd m.b.v. het gradatiesysteem dat gebruikt is in de aanverwante richtlijn “Diagnostiek en behandeling van hemofilie en aanverwante hemostasestoornissen 2009”. Het gradatiesysteem dat in deze richtlijn wordt beschreven is gebaseerd op de US Agency for Health Care Policy and Research”. Zie voorbeeld in de onderstaande tabellen.
Tabel 1: Indeling van de literatuur naar mate van bewijskracht
|
Bewijskracht |
Soort bewijs |
|
Graad 1 |
Bewijs verkregen van meta-analyse van gerandomiseerd gecontroleerde onderzoeken (1a) of ten minste één geblindeerd gerandomiseerd gecontroleerd onderzoek (1b) |
|
Graad 2 |
Bewijs verkregen uit ten minste een goed gedefinieerd gecontroleerd onderzoek, zonder randomisatie (2a) of een cohort- of patiëntcontrole-onderzoek van goede kwaliteit (2b) of een systematisch review zonder meta-analyse |
|
Graad 3 |
Bewijs verkregen uit goed gedefinieerde, niet experimentele beschrijvende onderzoeken, zoals vergelijkende onderzoeken, correlatieonderzoeken of patiëntcontroleonderzoeken van slechte kwaliteit |
|
Graad 4 |
Bewijs verkregen van expertpanels of opinies van deskundigen |
Tabel 2: Niveau van aanbeveling
|
Niveau |
Soort bewijs |
|
A |
Een onderzoek van graad 1a of 1b |
|
B |
Ten minste twee onderzoeken van graad 2a, 2b of graad 3 |
|
C |
Berustend op bewijs van graad 4 |
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald. De werkgroepleden maakten de balans op van elke interventie (conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt gewogen. De bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje ‘Overwegingen’.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast wetenschappelijke publicaties ook andere aspecten belangrijk om te worden meegewogen, zoals de expertise van de werkgroepleden, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld onder het kopje ‘Overwegingen’.
Kennislacunes
Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van de aanbevelingen voor nader/vervolgonderzoek is opgenomen onder het kopje ‘Kennislacunes’ (bij Aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de leden van de NVKC, VHL, SKML subcommissie stolling, NIV en aan Patiëntenfederatie Nederland voorgelegd ter commentaar. De commentaren zijn verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren is de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De autorisatieversie van de richtlijn is ter stemming gebracht tijdens de algemene ledenvergadering van de NVKC, en voorgelegd aan Patiëntenfederatie Nederland ter autorisatie c.q. instemming.
Literatuur
Boluyt N, Rottier BL, Langendam MW. [Guidelines are made more transparent with the GRADE method: considerations for recommendations are explicit in the new method]. Ned Tijdschr Geneeskd. 2012; 156: A4379.
Guyatt G, Oxman AD, Akl EA, Kunz R, Vist G, Brozek J, Norris S, Falck-Ytter Y, Glasziou P, DeBeer H, Jaeschke R, Rind D, Meerpohl J, Dahm P, Schünemann HJ. GRADE guidelines: 1. Introduction-GRADE evidence profiles and summary of findings tables. J Clin Epidemiol. 2011; 64: 383-394.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
