Kweekafname en transport voor het vaststellen van dragerschap van vancomycine resistente Enterococcus faecium
Uitgangsvraag
Wat is het beleid rond kweekafname en transport voor het vaststellen van dragerschap van vancomycine resistente Enterococcus faecium?
Aanbeveling
Gebruik minimaal feces of een rectale uitstrijk voor de detectie van dragerschap van VRE. In situaties waarin dit niet kan worden afgenomen is een perirectale uitstrijk een alternatief.
Gebruik voor een rectale of perirectale uitstrijk een swab met een adequaat transportmedium (bijvoorbeeld Stuart of Amies).
Overwegingen
Kwaliteit van bewijs
Multi-site screening versus enkel rectale uitstrijk of fecesmonster
De algehele kwaliteit van het bewijs is zeer laag vanwege het observationele karakter van de studies, de aanwezigheid van statistische heterogeniteit en de vraag of de studieresultaten extrapoleerbaar zijn naar de Nederlandse situatie.
Perirectale screening versus rectale uitstrijk of fecesmonster
De algehele kwaliteit van het bewijs is zeer laag vanwege beperkingen in onderzoeksopzet, indirectheid en imprecisie.
Waarden en voorkeuren
Voor het opsporen van VRE+ patiënten is het afnemen van rectale uitstrijken / feces de standaard praktijk. Volgens de werkgroep is de bijkomende bemonstering van andere anatomische locaties, zoals huid, keel, urine of wonden weinig of niet belastend, omdat het voor de patiënt minder ongemakkelijk en invasief is.
Kosten en middelen
Multi-site screening versus enkel rectale uitstrijk of fecesmonster
Structurele kosten zijn afhankelijk van detectiemethode en het aantal extra gescreende sites. De grootste kostenposten zijn verbruik van media en/of reagentia (PCR, chromogene agar, …) en bijkomende arbeid voor analisten. De verhouding tussen de kosten en de netto-baten zal sterk afhangen van de waarde van screening van bijkomende anatomische locaties om extra VRE gevallen te ontdekken: indien verspreiding van VRE in een uitbraaksituatie en bijkomende screeningsrondes kunnen worden voorkomen, zou de kosten/baten verhouding gunstig uitvallen. Op basis van het beschikbare bewijs kan de werkgroep geen uitspraak doen over de kosten/baten verhouding van multi-site screening tegenover rectale screening.
Perirectale screening versus rectale uitstrijk of fecesmonster
Er worden geen verschillen in structurele kosten verwacht: het gebruik van afnamemateriaal en reagentia blijft gelijk. Indien het afnemen van een perirectale uitstrijk toelaat om VRE te detecteren in een patiënt bij wie geen rectale uitstrijk zou kunnen worden afgenomen kan de kosten/baten verhouding gunstig uitdraaien. Op basis van het beschikbare bewijs kan de werkgroep geen uitspraak doen over de kosten/baten verhouding van perirectale tegenover rectale screening.
Professioneel perspectief
Multi-site screening versus enkel rectale uitstrijk of fecesmonster
De bewijskracht is zeer laag dat multi-site screening (inclusief rectale screening) geassocieerd is met een klinisch relevant hogere detectiepercentage VRE-gekoloniseerde patiënten in vergelijking met alleen rectale screening.
Bijkomend is het niet duidelijk wat de significantie is van het vinden van geïsoleerde VRE kolonisatie op de huid. Negatieve rectale uitstrijken hebben een goede negatief predictieve waarde voor het ontwikkelen van klinische VRE infectie en kunnen bijgevolg gebruikt worden als leidraad voor antibiotische therapie (Liou et al., 2014). Kolonisatie op de huid kan wel persisteren en mogelijk een bron zijn voor de verspreiding van VRE op een afdeling (Bonten et al., 1996; Jackson et al., 2019).
In bepaalde populaties kan het wel aangewezen zijn om op basis van klinische symptomen bijkomende relevante anatomische sites of monsters te screenen voor VRE (bijv. sputum bij longtransplantatie patiënten, urine (bij patiënten met een katheter), of wonden.
Toegevoegde waarde van afzonderlijke anatomische locaties
Verschillende studies rapporteerden gegevens over de waarde van screening op specifieke locaties als toevoeging op rectale screening. Voor de meest klinisch relevante locaties (perineum, liezen, urine, wonden en drains) werd onvoldoende bewijs gevonden om een toegevoegde waarde van screening op deze locaties aan te tonen (Wade, 1995; Yamaguchi et al., 1994; Beezhold et al., 1995; Nurse et al., 2017; Heidenreich et al., 2017).
Europese richtlijnen
De Ierse richtlijnen (HPSC, 2014) vermelden dat screeningsmonsters van bijkomende anatomische sites (urine en drainvloeistoffen) ook geschikt kunnen zijn voor surveillance. De Belgische richtlijnen (HGR, 2019) geven geen advies omtrent screening op bijkomende anatomische locaties en raden enkel een rectale uitstrijk of feces aan. Zwitserse richtlijnen (Swissnoso, 2018) vermelden dat screening op urine bij patiënten met urinekatheters en uitstrijken van open wonden ook kunnen worden overwogen. Duitse richtlijnen (RKI, 2018) vermelden dat VRE soms wordt gedetecteerd in de neus, keel of de mond (waarbij de studie van Wade (1995) wordt aangehaald), maar stellen dat het nut van screenen op deze locaties bedenkelijk is.
Andere richtlijnen
De HICPAC/CDC (2006) raadt aan om in een periode van geintensiveerde interventies (bijvoorbeeld bij een niet dalende prevalentie van BRMO of een eerste uitbraak) actieve surveillance van VRE te doen doormiddel van (peri)rectale screening en screening van huidlaesies en drainerende wonden. In het Verenigd Koninkrijk vermeldt de Healthcare Infection Society (HIS) (2006) dat bijkomende VRE positieve patiënten kunnen worden gedetecteerd door middel van screening op anatomische lokaties buiten het rectum, met als voorbeelden wonden en vasculaire catheters. Regionale National Health Service (NHS) richtlijnen in het Verenigd Koninkrijk (Royal Devon and Exeter NHS Trust, 2017; Mid Essex Hospital Services NHS Trust, 2018; Portsmouth Hospitals NHS Trust, 2017) vermelden urine uit een katheter en uitstrijken van centraal veneuze katheters als bijkomende mogelijkeden. Mid Essex Hospital Services raden als enige richtlijn ook het gebruik van een perineale, een mond- en een keelswab aan. De Australische richtlijnen (NHMRC, 2010) raden specifiek een screening aan op multipele anatomische locaties. Voorbeelden van bijkomende anatomische locaties worden gegeven (bijvoorbeeld inguinaal, wonden,…) zonder specifieke aanbevelingen te doen. In dezelfde richtlijn wordt echter in een voorbeeld van een succesvolle strategie voor het voorkomen van VRE verspreiding enkel een rectale uitstrijk gebruikt. Nieuw-Zeelandse richtlijnen (ARAG, 2007) raden bijkomend screening van chronische ulcera of wonden en urine (bij gekatheteriseerde patiënten) aan.
Perirectale screening versus rectale uitstrijk of fecesmonster
De bewijskracht voor het gebruik van een perirectale uitstrijk als alternatief voor een rectale uitstrijk of fecesmonster is zeer laag. De werkgroep vindt dat de grootte van het gevonden effect klinisch relevant is. De sensitiviteit en specificiteit van perirectale uitstrijken zijn veelbelovend. Het gebruik van perirectale uitstrijken voor de detectie van VRE is in lijn met verschillende internationale richtlijnen (HICPAC/CDC, 2006; NHMRC, 2010).
In een studie van Linfield et al. (2018) werd de sensitiviteit van perirectale uitstrijken in combinatie met feces onderzocht. Een positieve VRE screening werd gedefinieerd als een positieve perirectale uitstrijk óf fecesmonster. Met deze definitie had het gebruik van enkel perirectale uitstrijken een sensitiviteit van 95,5% (64/67) en het gebruik van enkel feces een sensitiviteit van 83,6% (56/67) (Linfield et al., 2018).
Perirectale uitstrijken zouden tevens een voordeel kunnen bieden voor de moleculaire detectie van VRE: Usacheva et al. onderzochten de diagnostische waarde van moleculaire technieken (BD GeneOhm VanR Assay) in perirectale en rectale uitstrijken, met kweek gebaseerde methoden als referentietest. De sensitiviteit van perirectale en rectale uitstrijken was gelijkaardig (95,2% en 91,6%), maar de specificiteit van de perirectale uitstrijken was hoger (87,1% vs. 74,7% (p<0,001) door minder vals-positieve vanB resultaten (Usacheva et al., 2010). Vergelijkbare resultaten werden ook gemeld door Paule et al., waarbij vals positieve vanB resultaten met een multiplex PCR enkel in rectale uitstrijken werden waargenomen (Paule et al., 2010).
Flocked swabs met Amies liquid (ESwab) versus andere afnamematerialen
Er werden geen studies gevonden die verschillende soorten afnamematerialen met elkaar vergeleken voor de detectie van VRE.
Swabs verschillen onderling in het aantal bacteriën dat ze kunnen opnemen en afgeven bij het enten. Kunststof swabs hebben een verbeterd afgifteprofiel en bevatten geen inhiberende substanties in vergelijking met katoenen swabs. Bepaalde soorten kunststof swabs, flocked swabs, hebben een verbeterd afgifteprofiel en kunnen zorgen voor een betere diagnostiek van verschillende soorten bacteriën (Warnke et al. 2014; Tan et al. 2014). In de huidige Nederlandse setting worden flocked swabs veelvuldig gebruikt voor microbiologische diagnostiek. De werkgroep acht het waarschijnlijk dat deze algemene prestatiekenmerken te extrapoleren zijn naar de specifieke detectie van VRE, maar maakt wegens gebrek aan relevante studies geen aanbevelingen voor wat betreft het soort swab.
Verschillende transportmedia beïnvloeden de overleving van bacteriën. De flocked swab wordt in de Nederlandse setting meestal in combinatie met vloeibaar Amies medium gebruikt (Copan Eswab).
Aanvaardbaarheid en haalbaarheid van de aanbevelingen
De aanbevelingen sluiten aan op de huidige klinische praktijk en de vorige NVMM richtlijnen. De werkgroep verwacht bijgevolg dat de aanbevelingen aanvaardbaar en haalbaar zijn voor alle betrokken partijen.
Rationale van de aanbeveling(en)
Multi-site screening versus enkel rectale uitstrijk of fecesmonster
Leidend bij het opstellen van de aanbevelingen is het feit dat het heel onzeker is dat multi-site screening de detectie van het aantal VRE+ patiënten relevant kan verhogen. De aanbeveling sluit aan bij de Nederlandse praktijk en is in lijn met internationale richtlijnen.
Perirectale screening versus rectale uitstrijk of fecesmonster
Leidend bij het opstellen van de aanbevelingen was het feit dat het gebruik van perirectale uitstrijken een veelbelovende sensitiviteit en specificiteit kent en in lijn is met internationale richtlijnen. Omdat de kwaliteit van bewijs zeer laag is de werkgroep van mening dat perirectale uitstrijken echter niet als eerste keus kunnen worden aangeraden.
Flocked swabs met Amies liquid (ESwab) versus andere afnamemateriale
Leidend bij het opstellen van de aanbevelingen was het feit dat er geen studies werden gevonden die verschillende soorten afnamematerialen met elkaar vergeleken voor de detectie van VRE.
Onderbouwing
Achtergrond
De gangbare monsters voor surveillancescreening van vancomycine-resistente enterokokken (VRE) zijn rectale of stoma uitstrijken, en feces. In sommige richtlijnen wordt ook de mogelijkheid vermeld om andere anatomische locaties te screenen als toevoeging op de rectale screening, zoals swabs van de huid ter hoogte van de liezen (National Health and Medical Research Council (NHMRC), 2010), het perineum (Mid Essex Hospital Services NHS trust, 2018) of klinische monsters (wonden, vasculaire katheters, urine etc.) (Healthcare Infection Society, 2006; Swissnoso, 2018; Healthcare Infection Control Practices Advisory Committee (HICPAC/CDC), 2006). Conform sommige richtlijnen (HICPAC/CDC, 2006; NHMRC, 2010) kan ook een perirectale uitstrijk worden afgenomen als alternatief voor een rectale uitstrijk.
In deze module wordt uitgezocht wat de toegevoegde waarde is van VRE screening op anatomische locaties buiten het rectum. Daarnaast wordt onderzocht of perirectale of perineumuitstrijken geschikte alternatieven zijn voor rectale uitstrijken en/of feces en wat het geschikte afnamemateriaal is om VRE dragerschap aan te tonen.
Voor de definities ‘rectale uitstrijk’, ‘perirectale uitstrijk’ en ‘perineumuitstrijk’: zie de bijlage Definities en begrippen.
Conclusies / Summary of Findings
Ad PICO-vraagstelling 1: review multi-site screening versus enkel rectale uitstrijk of fecesmonster
|
Zeer laag GRADE |
Aantal gedetecteerde VRE+ patiënten Het is heel onzeker dat multi-site screening (inclusief rectale screening) geassocieerd is met een klinisch relevant hogere detectiepercentage VRE-gekoloniseerde patiënten in vergelijking met alleen rectale screening.
Bron: Wade, 1995; Yamaguchi et al., 1994; Beezhold et al., 1995; Nurse et al., 2017; Heidenreich et al., 2017 |
Ad PICO-vraagstelling 2: review perirectale of perineumuitstrijk versus rectale uitstrijk of fecesmonster
|
Zeer laag |
Er lijkt geen verschil te zijn tussen het gebruik van een perirectale en een rectale uitstrijk voor de diagnostiek van VRE. Bron: Weinstein et al., 1996 |
Ad PICO-vraagstelling 3: review - Nylon-flocked swabs met Amies liquid (ESwab) versus andere afnamematerialen
|
- |
Er werden geen studies gevonden die verschillende soorten afnamemateriaal om VRE dragerschap aan te tonen, vergeleken. |
Samenvatting literatuur
Ad PICO-vraagstelling 1: review multi-site screening versus enkel rectale uitstrijk of fecesmonster
Ter informatie:
- Zie de evidence tabellen voor gedetailleerde informatie over het risico op bias per studie. Voor gedetailleerde informatie betreffende studiepopulatie, interventie, uitkomstmaten en resultaten zie de evidence tabellen. Voor deze samenvatting zijn in elke studie alleen de data geëxtraheerd die betrekking hebben op de huidige PICO vraagstelling.
- De PICO-vraag is een interventievraag op het domein van diagnostiek en valt niet onder het paradigma diagnostisch accuraatheidsonderzoek, omdat dit laatste veronderstelt dat de referentietest onfeilbaar is.
Onderzoeksdesign
Alle geïncludeerde studies zijn observationele niet-gerandomiseerde studies. Zie de evidence tabellen voor de oorspronkelijke opzet van de studies.
Land waar studie is verricht
Tabel 2. Land waar studie is verricht
|
Studie verricht in |
Aantal studies |
|
Duitsland |
1 studie (Heidenreich et al., 2017) |
|
Verenigd Koninkrijk |
1 studie (Wade, 1995) |
|
Verenigde staten |
3 studies (Yamaguchi et al., 1994; Beezhold et al., 1997; Nurse et al., 2017) |
Studiepopulaties
Tabel 3. Studiepopulaties waarover data geëxtraheerd is
|
Studie referentie |
Studiepopulatie |
|
Yamaguchi et al. 1994 |
Patiënten met VRE in een klinisch of screeningsmonster (n=20). De controle en interventie werden uitgevoerd in dezelfde populatie. |
|
Beezhold et al. 1997 |
Patiënten met bacteriemie en VRE in een klinisch of screeningsmonster (n=25). De controle en interventie werden uitgevoerd in dezelfde populatie. |
|
Wade 1995 |
Patiënten met leveraandoeningen in ‘high dependency beds’ en gekende VRE kolonisatie (n=46). De controle en interventie werden uitgevoerd in dezelfde populatie. |
|
Heidenreich et al. 2017 |
Patiënten die allogene stamceltransplantatie ondergingen (n=98). De controle en interventie werden uitgevoerd in dezelfde populatie. |
|
Nurse et al. 2017 |
Patïenten die werden opgenomen in een ‘long term acute care’ hospital (langdurige medisch complexe zorg) (n=594). De controle en interventie werden uitgevoerd in dezelfde populatie. |
De studiepopulaties zijn zeer heterogeen ten aanzien van het achtergrondrisico op VRE-positiviteit. Drie studies (Yamaguchi et al., 1994; Beezhold et al., 1997; Wade, 1995) onderzochten patiënten die al gekend waren met VRE kolonisatie. Twee studies onderzochten patiënten zonder dat de VRE kolonisatie status bekend was (Heidenreich et al. 2017, Nurse et al. 2017).
Definitie VRE
Twee studies definieerden VRE als vancomycine resistente E. faecium (Yamaguchi et al., 1994; Wade, 1995). Één studie hanteerde een bredere definitie en includeerde ook E. faecalis en intrinsiek vancomycine resistente enterokokken (deze maakten respectievelijk 20% en 3% uit van alle isolaten) (Beezhold et al., 1997). Twee studies rapporteerden de definitie van VRE niet (Heidenreich et al., 2017; Nurse et al., 2017).
Afnamemateriaal
Twee studies (Yamaguchi et al., 1994; Beezhold et al., 1997) maakten gebruik van katoenen swabs (Culturette (BD) en Culturette II (BD) systemen). Één studie gebruikte een swab set met kunststof (viscose) swabs (Nerbe Plus) (Heidenreich et al., 2017). Twee studies specificeerden het afnamemateriaal niet (Wade, 1995; Heidenreich et al., 2017).
Detectiemethodes
Alle vijf studies detecteerden VRE op basis van kweek (zie de evidence tabellen). Twee studies gebruikten commerciële selectieve agars (Beezhold et al., 1997; Heidenreich et al., 2017). Yamaguchi et al. gebruikten Campylobacter agar en Wade (1995) gebruikte MacConkey agar. Één studie maakte geen vermelding van de gebruikte agar en identificatiemethoden (Nurse et al., 2017). Geen enkele studie maakte gebruik van een ophopingsmedium.
Ter info: Geen van de studies gebruikte moleculaire methoden voor de detectie van VRE
Interventies
Alle vijf studies vergeleken multi-site screening (inclusief rectale screening) met rectale screening alleen. De anatomische locaties die deel uitmaakten van een multi-site screening verschilden tussen de studies (zie tabel 4 hieronder).
Definities
Rectale screening werd gedefinieerd als een rectale uitstrijk, feces, of een combinatie van beide.
Tabel 4. Definitie van multi-site screening in de verschillende studies
|
Studie referentie |
Yamaguchi 1994 |
Beezhold 1997
|
Wade 1995 |
Heidenreich 2017 |
Nurse 2017 |
|
Anatomische sites die deel uitmaken van multi-site screening |
|
|
|
|
|
Resultaten voor de uitkomstmaat ‘aantal patiënten positief voor VRE’
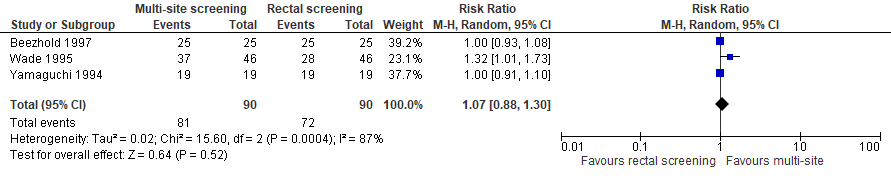
a) Multi-site screening in een populatie van VRE positieve patiënten
Drie studies onderzochten de methode van screening in een VRE-positieve populatie. Twee studies lieten geen verschil zien tussen multi-site screening en enkel rectale screening (Yamaguchi et al., 1994; Beezhold et al., 1997). Bij eén studie (Wade, 1995) waren de resultaten in het voordeel van multi-site screening: relatief risico (RR) 1,32; 95% betrouwbaarheidsinterval (BI) 1,01 tot 1,73.
Pooling van de drie studies liet een 7% toename in het aantal VRE+ gedetecteerde patiënten zien ten voordele van multi-site screening: RR 1,07; 95% BI 0,88 tot 1,30. Zeven % toename is de beste schatting van het effect van multi-site screening. De ondergrens (RR: 0,88) van het betrouwbaarheidsinterval laat echter zien dat de omvang van de studies te gering was om een gunstig effect van ‘alleen rectale screening’ uit te sluiten.
In absolute termen geformuleerd: een absolute toename van 56 per 1000 (95% BI: -0.096 tot +0.240) is de beste schatting van het effect van multi-site screening (toename van 800 per 1000 naar 856 per 1000). De ondergrens (-96 per 1000) van het betrouwbaarheidsinterval laat echter zien dat de omvang van de studies te gering was om een gunstig effect van ‘alleen rectale screening’ uit te sluiten. Ter info: de werkgroep zou een toename van 56 per 1000 klinisch relevant vinden.
b) Multi-site screening in een populatie waarin de VRE kolonisatie status niet bekend was
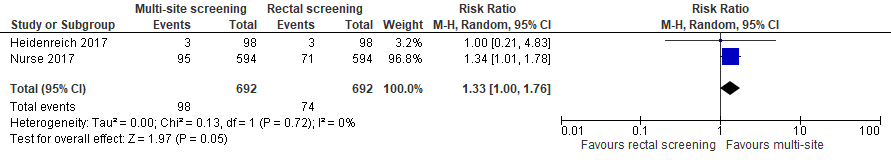
Twee studies onderzochten een populatie waarin de VRE-status niet bekend was. Pooling van de twee studies liet een 33% toename in het aantal VRE+ patiënten zien ten voordele van de multi-site screening, met een spreiding van maximaal 76% toename en minimaal geen verschil: RR 1,33; 95% BI 1,00 tot 1,76 (zie figuur hieronder).
In absolute termen betekent dat dat de detectie van het aantal VRE+ patiënten toeneemt van 107 per 1000 naar 142 per 1000 wanneer men multi-site screent in plaats van alleen rectaal (95% BI 0,000 tot 0,081). De ondergrens van het betrouwbaarheidsinterval laat echter zien dat de omvang van de studies te gering was om geen effect van multi-site screening uit te sluiten. Ter info: de werkgroep zou een toename van 35/1000 klinisch relevant vinden.
Bewijskracht van de literatuur
De werkgroep heeft de kwaliteit van bewijs beoordeeld volgens de GRADE-methodiek. Voor studies over interventies (multi-site screening versus rectale screening) starten gerandomiseerde onderzoeken in de categorie hoog en observationele studies in de categorie laag. De evidence werd per uitkomstmaat getoetst aan de volgende criteria: beperkingen in studie opzet (risico op bias), inconsistentie, indirectheid, onnauwkeurigheid en publicatiebias.
Aantal VRE-gekoloniseerde patiënten
a. ten aanzien van screening in een VRE+ populatie
Vanwege het observationele karakter van de onderzoeken start de kwaliteit van het bewijs voor de uitkomstmaat laag. De bewijskracht werd afgewaardeerd van laag naar zeer laag vanwege de aanwezigheid van statistische heterogeniteit (inconsistentie) (I2 = 87%, 71%). Daarnaast is het onzeker of de studieresultaten extrapoleerbaar zijn naar de Nederlandse situatie, omdat in de klinische praktijk niet gescreend wordt in een VRE+ populatie en de detectiemethoden in Nederland niet overeenkomen met deze in de studies (indirectheid).
b. ten aanzien van screening in een populatie waarin de VRE kolonisatie status niet bekend was
Vanwege het observationele karakter van de onderzoeken start de kwaliteit van het bewijs voor de uitkomstmaat laag. De bewijskracht werd afgewaardeerd van laag naar zeer laag, omdat het 95% BI geen effect (RR=1) insluit en de optimal information size niet wordt gehaald (200 – 300 events).
Ad PICO-vraagstelling 2: review perirectale of perineumuitstrijk versus rectale uitstrijk of fecesmonster
Ter informatie:
- Zie de evidence tabellen voor gedetailleerde informatie over het risico op bias per studie (beoordeling met QUADAS-2). Voor gedetailleerde informatie betreffende studiepopulatie, interventie, uitkomstmaten en resultaten zie de evidence tabellen. Voor deze samenvatting zijn in elke studie alleen de data geëxtraheerd die betrekking hebben op de huidige PICO vraagstelling.
Onderzoeksdesign
De geïncludeerde studie is een cross-sectioneel onderzoek (zie de evidence tabellen).
Land waar studie is verricht
De studie werd uitgevoerd in de Verenigde Staten (Weinstein et al., 1996).
Studiepopulaties
Weinstein (1996) geeft geen informatie over de populatie waarin de screening is verricht.
Definitie VRE
Op basis van de vermelde gegevens over de detectiemethodes kunnen we aannemen dat enterokokken enkel tot op species niveau werden geïdentificeerd (Weinstein et al., 1996). De definitie van VRE omvat hierdoor waarschijnlijk ook E. faecalis en intrinsiek resistente enterokokken.
Afnamemateriaal
De gebruikte swabs werden niet gespecifieerd (Weinstein et al., 1996).
Detectiemethodes
Weinstein et al. maakten gebruik van Campylobacter agar met 10 µg/ml vancomycin (Becton Dickinson) als selectief medium voor VRE. Een vermoedelijke VRE werd geïdentificeerd op basis van Gramkleuring, gal-esculine test en de pyroglutamyl-b-naphthylamide (PYR) test. Er zijn geen gegevens over de methode van gevoeligheidsbepaling. Er werd geen ophopingsmedium gebruikt.
Resultaten
Perirectale uitstrijken hadden een sensitiviteit van 100% (95% betrouwbaarheidsinterval (BI) 81% tot 100%) en een specificiteit van 100% (95% betrouwbaarheidsinterval (BI) 85% tot 100%) met de rectale uitstrijk als referentietest (Weinstein et al., 1996).

Bewijskracht van de literatuur
De werkgroep heeft de kwaliteit van bewijs beoordeeld volgens een GRADE-like methodiek. Ten aanzien van diagnostisch accuratessevragen starten studies met een cross-sectioneel design in de categorie hoog. De evidence werd getoetst aan de volgende criteria: beperkingen in studie opzet (risico op bias), inconsistentie, indirectheid, onnauwkeurigheid en publicatiebias.
De bewijskracht werd afgewaardeerd van hoog naar zeer laag wegens 1) mogelijke selectiebias: een gekend aantal VRE-positieve / VRE-negatieve patiënten werd geselecteerd (beperkingen in onderzoeksopzet); 2) de onzekerheid of de studieresultaten extrapoleerbaar zijn naar de Nederlandse situatie, omdat de detectiemethoden in Nederland niet overeenkomen met deze in de studies (indirectheid); 3) de kleine omvang van de studie (imprecisie).
Ad PICO-vraagstelling 3: review - Nylon-flocked swabs met Amies liquid (ESwab) versus andere afnamematerialen
Er werden geen studies gevonden die verschillende soorten afnamemateriaal om VRE dragerschap aan te tonen, vergeleken.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden heeft de werkgroep drie systematische literatuuranalyses verricht met de volgende PICO-vraagstellingen:
- Wat is het effect van multi-site screening* op het aantal gedetecteerde VRE patiënten in vergelijking met screening met enkel een rectale uitstrijk of feces?
multi-site: rectale screening plus minimaal bemonstering van een andere anatomische locatie (huid, keel, urine, wonde ect.) - Kan de rectale uitstrijk worden vervangen door een perirectale of een perineumuitstrijk om VRE dragerschap aan te tonen?
- Wat is geschikt afnamemateriaal om VRE dragerschap aan te tonen?
Tabel 1 Selectiecriteria PICO 1/2/3
|
Type studies |
Review 1 over multi-site screening
Review 2 over vervanging rectale uitstrijk Review 3 over afnamemateriaal
|
|
Type patiënten |
|
|
Interventie resp. Indextest |
Review 1 over multi-site screening
Review 2 over vervanging rectale uitstrijk
Review 3 over afnamemateriaal
|
|
Controle resp. Referentietest |
Review 1 over multi-site screening
Review 2 over vervanging rectale uitstrijk
Review 3 over afnamemateriaal
|
|
Type uitkomstmaten |
Review 1 over multi-site screening
Review 2 over vervanging rectale uitstrijk Review 3 over afnamemateriaal
|
|
Type setting |
|
|
Exclusiecriteria |
|
Review 1 over multi-site screening
In de databases Medline (OVID), Embase and Cochrane is een systematische search verricht. Zie de zoekverantwoording. Na ontdubbeling van de zoekresultaten leverde de literatuurzoekactie 890 treffers op. Studies die voldeden aan de selectiecriteria in tabel 1 zijn opgenomen in de samenvatting van de literatuur. 38 studies werden geselecteerd op basis van titel en abstract. Bijkomend werden 5 studies gevonden door middel van handmatig zoeken (referentielijsten van gevonden studies en richtlijnen). Na het lezen van de volledige artikelen werden uit een totaal van 43 studies uiteindelijk 5 studies opgenomen in de literatuuranalyse (Yamaguchi et al., 1994; Beezhold et al., 1997; Wade, 1995; Heidenreich et al., 2017; Nurse et al., 2017). In de evidence tabellen staan de redenen van exclusie van de andere 38 studies vermeld.
Review 2 over vervanging rectale uitstrijk
In de databases Medline (OVID), Embase and Cochrane is een systematische search verricht. De zoekverantwoording is weergegeven in de evidence tabellen. Na ontdubbeling van de zoekresultaten leverde de literatuurzoekactie 298 treffers op. Studies die voldeden aan de selectiecriteria in tabel 1 zijn opgenomen in de samenvatting van de literatuur. Zeven studies werden geselecteerd op basis van titel en abstract. Na het lezen van de volledige artikelen werd hiervan uiteindelijk 1 studie opgenomen in de literatuuranalyse (Weinstein et al., 1996). In de evidence tabellen staan de redenen van exclusie van de andere 6 studies vermeld. Referentiecheck leverde geen extra artikelen op
Review 3 over afnamemateriaal
In de databases Medline (OVID), Embase and Cochrane is een systematische search verricht. De zoekverantwoording is weergegeven in de evidence tabellen. Na ontdubbeling van de zoekresultaten leverde de literatuurzoekactie 577 treffers op. Er werden geen studies gevonden die voldeden aan de selectiecriteria.
Referenties
- Antibiotic Resistance Advisory Group (ARAG). 2007. Guidelines for the Control of Multidrug-resistant Organisms in New Zealand. New Zealand.
- Beezhold DW, Slaughter S, Hayden MK, Matushek M, Nathan C, Trenholme GM, Weinstein RA. 1997. Skin colonization with vancomycin-resistant enterococci among hospitalized patients with bacteremia. Clin Infect Dis 24:704–706.
- Health Protection Surveillance Centre (HPSC). 2014. Guidelines for the Prevention and Control of Multi-drug resistant organisms (MDRO) excluding MRSA in the healthcare setting. Ireland.
- Healthcare Infection Control Practices Advisory Committee (HICPAC). 2006. Management of Multidrug-Resistant Organisms in Healthcare Settings. United States of America.
- Healthcare Infection Society (HIS)/ Infection Control Nurses Association (ICNA). 2006. Guidelines for the control of glycopeptide-resistant enterococci in hospitals. United Kingdom.
- Heidenreich D, Kreil S, Nolte F, Hofmann WK, Miethke T, Klein SA. 2017. Multidrug-resistant organisms in allogeneic hematopoietic cell transplantation. Eur J Haematol 98:485–492.
- Hoge Gezondheidsraad (HGR). 2019. Aanbevelingen inzake preventie, beheersing en aanpak van patiënten die drager zijn van tegen antibiotica multiresistente organismen (mdro) in zorginstellingen. België.
- Jackson SS, Harris AD, Magder LS, Stafford KA, Johnson JK, Miller LG, Calfee DP, Thom KA. 2019. Bacterial burden is associated with increased transmission to health care workers from patients colonized with vancomycin-resistant Enterococcus. Am J Infect Control 47:13–17.
- Liou DZ, Barmparas G, Ley EJ, Salim A, Tareen A, Casas T, Lee D, Bukur M. 2014. To swab or not to swab? A prospective analysis of 341 SICU VRE screens. J Trauma Acute Care Surg 76:1192–200.
- Mid Essex Hospital Services (UK). 2017. Glycopeptide resistant enterococci (GRE) Clinical Guideline. United Kingdom.
- National Health and Medical Research Council (NHMRC). 2010. Australian Guidelines for the Prevention and Control of Infection in Healthcare. Australia
- Nurse BA, Barton RW, Larose DT. 2017. The Role of Patient History and Body Site Surveillance Cultures as Predictors of Colonization in a Long-Term Acute Care Hospital Setting. Conn Med 81:81–85.
- Paule SM, Trick WE, Tenover FC, Lankford M, Cunningham S, Stosor V, Cordell RL, Peterson LR. 2003. Comparison of PCR assay to culture for surveillance detection of vancomycin-resistant enterococci. J Clin Microbiol 41:4805–7.
- Portsmouth Hospitals NHS Foundation Trust. 2017. Prevention & management of Glycopeptide-resistant enterococci (GRE). United Kingdom
- Robert Koch-Institut (RKI). 2018. Hygienemaßnahmen zur Prävention der Infektion durch Enterokokken mit speziellen Antibiotikaresistenzen Empfehlung der Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) beim Robert Koch-Institut. Deutschland
- Royal Devon and Exeter NHS Foundation Trust. 2017. Glycopeptide/Vancomycin Resistant Enterococci (GRE/VRE) Policy. United Kingdom.
- Swissnoso. 2018. Temporary expert guidance for healthcare institutions to contain the spread of vancomycinresistant enterococci (VRE) in Switzerland. Switserland.
- Tan TY, Yong Ng LS, Fang Sim DM, Cheng Y, Hui Min MO. 2014. Evaluation of bacterial recovery and viability from three different swab transport systems. Pathology 46:230–233.
- Wade JJ. 1995. The emergence of Enterococcus faecium resistant to glycopeptides and other standard agents-a preliminary report. J Hosp Infect 30:483–493.
- Warnke P, Warning L, Podbielski A. 2014. Some Are More Equal - A Comparative Study on Swab Uptake and Release of Bacterial Suspensions. PLoS One 9:e102215.
- Weinstein JW, Tallapragada S, Farrel P, Dembry LM, Linfield RY, Campeau S, Injean P, Gregson A, Kaldas F, Rubin Z, Kim T, Kunz D, Chan A, Lee DJ, Humphries RM, McKinnell JA. 2018. Comparison of rectal and perirectal swabs for detection of colonization with vancomycin-resistant enterococci. Infect Control Hosp Epidemiol 34:210–212.
- Yamaguchi E, Valens F, Smith SM, Simmons A, Eng RHK. 1994. Colonization pattern of resistant enterococcus faecium. Am J Infect Control 21:101.
Evidence tabellen
PICO 1
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Yamaguchi 1994 |
Type of study: Cross-sectional (period prevalence)
Setting: East Orange Department of Veterans Affairs Medical Center, April 1992 to February 1993.
Country: United States
Source of funding: NR |
Inclusion criteria: Patients with VRE in any clinical or screening sample and receiving multi-site screening
Exclusion criteria: NR
N total at baseline (total 20): I: 20 C: 20 Patients in the control- and intervention group were the same.
Important prognostic factors2: NA
Groups comparable at baseline? NA |
VRE screening at all of the following anatomical sites:
Samples taken with a Twin cotton applicator Culturette II (BD) and VRE isolated with Campylobacter agar (10 µg/ml vancomycin). Identification and susceptibility testing of VRE with API 205 system (Analytab Products) and API 205 system (Analytab Products). |
VRE screening in only a feces sample
Isolation of VRE with Campylobacter agar. Identification and susceptibility testing of VRE with API 205 system (Analytab Products) and API 205 system (Analytab Products). |
Length of follow-up: NA
Loss-to-follow-up: NA
Incomplete outcome data: 1 patient was excluded from the analysis in this review due to not receiving VRE screening in a feces sample
|
VRE+ patients detected: I: 18/19 C: 18/19
|
|
|
Beezhold 1997
|
Type of study: Cross-sectional (Original study design was a case-control design. Cross-sectional data were extracted)
Setting: Cook County Hospital and Rush-Presbyterian St. Luke's Medical Center August 1994 and July 1995 Country: United States
Source of funding: NR
|
Inclusion criteria: Patients with bactermia and VRE in any clinical or screening sample and receiving multi-site screening
Exclusion criteria: NR
N total at baseline (total 25): I: 25 C: 25 Patients in the control- and intervention group were the same
Important prognostic factors: NA
Groups comparable at baseline? NA |
VRE screening during hospital stay at all of the following anatomical sites:
Samples taken with Sterile cotton swab with modified Stuart's medium (Culturette System BD). Isolation of VRE with Enterococcosel agar (6 µg/mL vancomycin). Method of identification and susceptibility testing not reported. |
VRE screening in only a rectal swab
Samples taken with Sterile cotton swab with modified Stuart's medium (Culturette System BD). Isolation of VRE with Enterococcosel agar (6 µg/mL vancomycin). Method of identification and susceptibility testing not reported. |
Length of follow-up: NA
Loss-to-follow-up: NA
Incomplete outcome data: NR |
VRE+ patients detected: I: 25/25 C: 25/25
|
(Original study design was a case-control design matching patients with VRE bacteremia with patients with non-VRE bacteremia. Cross-sectional data were extracted for all patients with VRE in a clinical or screening sample (a population of VRE+ patients similar to Yamaguchi 1994 and Wade 1995, so that they can be analyzed in the same subpopulation)
|
|
Wade 1995 |
Type of study: Cross-sectional (period prevalence)
Setting:High-dependency beds at The Institute of Liver studies January 1991 to April 1993
Country: United Kingdom
Source of funding: NR
|
Inclusion criteria: Patients with VRE in any clinical or screening sample and receiving multi-site screening
Exclusion criteria: NR
N total at baseline (total 46): I: 46 C: 46 Patients in the control- and intervention group were the same
Important prognostic factors: NA
Groups comparable at baseline? NA |
VRE screening during hospital stay at all of the following anatomical sites:
Samples taken with screening swabs (not further identified). Isolation of VRE with MacConkey agar plates (Oxoid) and identification and susceptibility testing with API STREP (BioMerieux), Disk diffusion on DST Agar (Oxoid) and Broth dilution testing in Mueller-Hinton broth
|
VRE screening in only a rectal swab.
Samples taken with screening swabs (not further identified). Isolation of VRE with MacConkey agar plates (Oxoid) and identification and susceptibility testing with API STREP (BioMerieux), Disk diffusion on DST Agar (Oxoid) and Broth dilution testing in Mueller-Hinton broth
|
Length of follow-up: NA
Loss-to-follow-up: NA
Incomplete outcome data: NR |
VRE+ patients detected: I: 37/46 C: 28/46
|
Approx. 840 screened patients were screened in this study. However, data about multi-site screening was only reported for a subpopulation of 46 patients. This data were extracted for our review.
|
|
Heidenreich 2017 |
Type of study: Cross-sectional (period prevalence) (Originally retrospective cohort)
Setting: Institut für Medizinische Mikrobiologie und Hygiene, Universitätsmedizin Mannheim June 2010 to December 2014
Country: Germany
Source of funding: supported by the Alfred & Angelika Gutermuth-Stiftung. |
Inclusion criteria: Patients receiving multi-site screening for VRE
Exclusion criteria: NR
N total at baseline (total 98): I: 98 C: 98 Patients in the control- and intervention group were the same
Important prognostic factors: NA
Groups comparable at baseline? NA |
VRE admission screening at all of the following anatomical sites:
Samples taken with swab set containing Amies transport medium (Nerbe plus). Isolation of VRE with VRESelect agar (8 µg/ml vancomycin) (BIORAD) and identification and susceptibility testing with maldi-TOF and VITEK-II. |
VRE screening in only a rectal swab or feces sample.
Samples taken with swab set containing Amies transport medium (Nerbe plus). Isolation of VRE with VRESelect agar (8 µg/ml vancomycin) (BIORAD) and identification and susceptibility testing with maldi-TOF and VITEK-II. |
Length of follow-up: NA
Loss-to-follow-up: NA
Incomplete outcome data: NR |
VRE+ patients detected:
I: 3/98 C: 3/98
|
|
|
Nurse 2017 |
Type of study: Cross-sectional (period prevalence)
Setting: Long-term acute care hospital; randomly chosen time periods in 2011 and 2013
Country: United States
Source of funding: NR
|
Inclusion criteria: Patients receiving multi-site screening for VRE
Exclusion criteria: NR
N total at baseline (total 594): I: 594 C: 594 Patients in the control- and intervention group were the same
Important prognostic factors: NA
Groups comparable at baseline? NA |
VRE admission screening at all of the following anatomical sites:
Methods of VRE identification, isolation and susceptibility testing not reported (carried out in an external laboratory) |
VRE screening in only a rectal swab
Methods of VRE identification, isolation and susceptibility testing not reported (carried out in an external laboratory) |
Length of follow-up: NA
Loss-to-follow-up: NA
Incomplete outcome data: NR |
VRE+ patients detected:
I: 95/594 C: 71/594
|
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
PICO 2
|
First author, year of publication |
Type of study |
Population (setting); study size |
Inclusion criteria |
Diagnostic test (indextest) |
Controle (reference test/gold standard) |
Outcome
|
Results |
Comments |
|
Weinstein 1996 |
Cross-sectional (extracted data) |
Hospitalized patients; n=13 (82 paired rectal and perirectal swabs (41 pairs of two swabs)) |
Paired swabs must include index and reference test
(Original inclusion criteria of study: patients likely to remain hospitalized, previously known colonization status) |
Perirectal swab (type of swab not specified) |
Rectal swab (type of swab not specified) |
Sensitivity and specificity
|
Sensitivity: 82/82 100% Specificity: 82/82 100% |
Analysis with rectal swab as gold standard (differs from main outcome original study) |
Risk of bias table
PICO 1
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear)
|
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Yamaguchi 1994 |
Unlikely |
Unlikely |
Unclear (No information about blinding) |
Unlikely (multi-site screening and rectal screening were carried out in the same group) |
|
Wade 1995 |
Unlikely |
Unlikely |
Unclear (No information about blinding) |
Unlikely (multi-site screening and rectal screening were carried out in the same group) |
|
Beezhold 1997 |
Unlikely |
Unlikely |
Unclear (No information about blinding) |
Unlikely (multi-site screening and rectal screening were carried out in the same group) |
|
Heidenreich 2017 |
Unlikely |
Unlikely |
Unclear (No information about blinding) |
Unlikely (multi-site screening and rectal screening were carried out in the same group) |
|
Nurse 2017 |
Unlikely |
Unlikely |
Unclear (No information about blinding) |
Unlikely (multi-site screening and rectal screening were carried out in the same group) |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
PICO 2
Kwaliteit van bewijs met QUADAS-2
|
RISK OF BIAS |
APPLICABILITY CONCERNS |
||||||
|
Patient selection |
Index Test |
Reference standard |
Flow and Timing |
Patient selection |
Index Test |
Reference standard |
|
|
Weinstein 1996 |
H |
L |
L |
L |
H |
? |
? |
L = laag risico; H = hoog risico; ? = onduidelijk risico
Comments regarding high and unclear bias and applicability concerns:
High bias and concerns regarding applicability in patient selection: A case-control design was not avoided and only patients that were likely to remain hospitalized were included. Results may not be applicable to a broader population.
Unclear applicability regarding index test and reference standard: The results of the VRE isolation and culture methods used in this study differ from the methods used in the Netherlands.
Tabel exclusie na het lezen van het volledige artikel
PICO 1
|
Auteur |
Redenen van exclusie |
|
Akgun Karapinar et al. 2013 |
Onvoldoende informatie over resultaten van interventie en controle. |
|
Altoparlak et al. 2011 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Bonten et al. 1996 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Brasg et al. 2017 |
Enkel rectale screening |
|
Chadwick et al. 1996 |
Onvoldoende informatie over resultaten van interventie en controle. |
|
D’Agata 2002 |
Multi-site screening enkel uitgevoerd bij patiënten met positieve rectale screening. |
|
Dumford et al. 2011 |
Onvoldoende informatie over resultaten van interventie en controle. |
|
Esposito et al. 2003 |
Onvoldoende informatie over resultaten van interventie en controle. |
|
Ferstl et al. 2018 |
Enkel rectale screening |
|
Gardiner et al. 2002 |
Onvoldoende informatie over resultaten van interventie en controle. |
|
Geraud de Galassus et al. 2017 |
Onvoldoende informatie over resultaten van interventie en controle. |
|
Gozdowska et al. 2016 |
Onvoldoende informatie over resultaten van interventie en controle. |
|
Heidenreich et al. 2016 |
Onvoldoende informatie over resultaten van interventie en controle. |
|
Hendrix et al. 2001 |
Onvoldoende informatie over resultaten van interventie en controle. |
|
Hermann et al. 2011 |
Onvoldoende informatie over resultaten van interventie en controle. |
|
Lee et al. 2018 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Mahida et al. 2014; |
Multi-site screening enkel uitgevoerd bij patiënten met positieve rectale screening. |
|
March et al. 2010 |
Onvoldoende informatie over resultaten van interventie en controle. |
|
March et al. 2017 |
Onvoldoende informatie over resultaten van interventie en controle. |
|
Matar et al. 2006 |
Enkel rectale screening |
|
McDermott et al. 2018 |
Enkel rectale screening |
|
Ndubuisi et al. 2017 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Nucleo et al. 2018 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Papathanasiou et al. 2018 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Patel et al. 2001 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Patel et al. 2001 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Rossini et al. 2010 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Schoevaerdts et al. 2011 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Shenoy et al. 2014 |
Enkel rectale screening |
|
Sirkhazi et al. 2014 |
Geen rectale screening |
|
Takata et al. 2013 |
Enkel rectale screening |
|
Tellis et al. 2012 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Ulrich et al. 2017 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Yameen et al. 2013 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Young et al. 2014 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Zacharioudakis et al. 2015 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Ziakas et al. 2014 |
Enkel rectale screening |
|
Zuckerman et al. 1999 |
Onvoldoende informatie over resultaten van interventie en controle |
PICO 2
|
Auteur |
Redenen van exclusie |
|
Cohen et al. 2009 |
Niet elke patiënt heeft de index- en referentietest gehad |
|
Linfield et al. 2018 |
De referentietest in deze studie is de combinatie van een perirectale uitstrijk en feces |
|
Monsalvo et al. 2018 |
Geen informatie over de prestatie van perirectale uitstrijk tegenover rectale uitstrijk en/of feces |
|
Shone et al. 2012 |
Geen informatie over de prestatie van perirectale uitstrijk tegenover rectale uitstrijk en/of feces |
|
Usacheva et al. 2010 |
Geen informatie over de prestatie van perirectale uitstrijk tegenover rectale uitstrijk en/of feces |
|
Werner et al. 2011 |
Niet elke patiënt heeft de index- en referentietest gehad |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 27-07-2021
Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Vereniging voor Medische Microbiologie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Medische Microbiologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door B.S. Niël-Weise, zelfstandig richtlijnmethodoloog, en werd gefinancieerd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De richtlijn is ontwikkeld in samenwerking met de Vereniging voor Hygiëne en Infectiepreventie in de Gezondheidszorg.
Doel en doelgroep
Doel
Het doel van het project is het herzien van de huidige richtlijn Laboratoriumdiagnostiek van BRMO die dateert uit 2012. Afgezien van het verstrijken van de reguliere termijn voor herziening zijn er nieuwe inzichten en methoden beschikbaar gekomen die de diagnostiek kunnen optimaliseren.
Doelgroep
De richtlijn is met name bedoeld voor artsen-microbioloog, deskundigen infectiepreventie, internisten-infectioloog en medisch moleculair microbiologen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de pre-analytische (afname, transport en bewaaromstandigheden) en de analytische fase van de laboratorium detectie van BRMO inclusief de rapportage naar de aanvrager danwel naar het patiëntendossier.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 2 jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep:
- Prof. dr. J.A.J.W. Kluytmans, arts-microbioloog, Amphia Ziekenhuis Breda/Oosterhout; Elisabeth-TweeSteden Ziekenhuis, Tilburg; Universitair Medisch Centrum Utrecht
- Drs. W. van den Bijllaardt, arts-microbioloog, Amphia Ziekenhuis Breda
- Dr. E. Bathoorn, arts-microbioloog, Universitair Medisch Centrum Groningen
- Dr. J. Cohen Stuart, arts-microbioloog, Noordwest Ziekenhuis Alkmaar
- Dr. J. J. Verweij, medisch moleculair microbioloog/parasitoloog, Elisabeth-Tweesteden Ziekenhuis, Tilburg
- Dr. W. H.F. Goessens, microbioloog, Erasmus MC Universitair Medisch Centrum Rotterdam
- Dr. N. al Naiemi, arts-microbioloog, Labmicta, Hengelo
- Prof. Dr. M.C. Vos, arts-microbioloog, Erasmus MC Universitair Medisch Centrum, Rotterdam
- Dr. L. van Dommelen, arts-microbioloog, PAMM, Veldhoven
- Dr. P. Croughs, arts-microbioloog, Erasmus MC Universitair Medisch Centrum, Rotterdam
- Drs. A. Klak, arts-microbioloog in opleiding, Universitair Medisch Centrum Groningen
Meelezers:
- Dr. M.K. Bomers, internist-infectioloog, Amsterdam UMC, locatie VUmc
- Mv. M. Molenaar, deskundige infectiepreventie, OLVG Amsterdam
- Mv. S. Cremers-Pijpers, deskundige infectiepreventie, Radboudumc, Nijmegen
Met ondersteuning van:
- Mw. B.S. Niël-Weise, zelfstandig richtlijnmethodoloog, Deventer
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancieerd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij de Nederlandse Vereniging voor Medische Microbiologie, een overzicht vindt u hieronder:
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
|
Jan Kluytmans |
|
|
Geen |
Geen |
Subsidiegevers zijn Euopese commissie, Nederlandse overheid en provincies. Geen belangen bij deze richtlijn |
Geen |
Geen |
|
Erik Bathoorn |
Arts-microbioloog, UMCG Groningen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Wouter van den Bijllaardt |
Arts-microbioloog Amphia ziekenhuis Breda |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
James Cohen Stuart |
Arts-microbioloog Noordwest Ziekenhuisgroep |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Jaco Verweij |
Medisch moleculair microbioloog, ETZ Ziekenhuis, Tilburg |
|
Geen |
Geen |
Geen |
Geen |
Geen |
|
Wil Goessens |
Medisch microbioloog Erasmus Medisch Centrum Rotterdam |
Geen |
Patent: detectie van carbapenemase middels maldi-TOF |
Geen |
Geen |
Geen |
Geen |
|
Nashwan al Naiemi |
Arts-microbioloog LabMicTA Bestuurder LabMicTA |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Greet Vos |
Arts-microbioloog MC Rotterdam |
|
Geen |
Geen |
Unrestricted grant 3m, Pentax |
Geen |
Geen |
|
Adrian Klak |
AIOS Medische Microbiologie UMCG |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Peter Croughs |
Arts-microbioloog, Erasmus Medisch Centrum |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Laura van Dommelen |
Arts-microbioloog, Stichting PAMM te Veldhoven |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Marije Bomers |
Internist- infectioloog, Amsterdam UMC, locatie VUmc |
Geen |
Financieel belang farmaceutisch bedrijf Shionogi |
Geen |
Subsidiegevers zijn ZonMW en Amsterdam UMC corona research fonds. Geen belangen bij deze richtlijn |
Geen |
Geen |
|
Myrte Molenaar |
Deskundige Infectiepreventie OLVG Amsterdam |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Suzan Cremers |
Deskundige |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door in de voorbereidende fase de Patiëntenfederatie Nederland te vragen om schriftelijke input omtrent knelpunten en aandachtspunten. De Patiëntenfederatie gaf aan geen knelpunten aan te leveren vanwege het technisch karakter van de richtlijn. De werkgroep heeft de conceptrichtlijn ook tijdens de commentaarfase voorgelegd aan de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren (zie het Implementatieplan in de bijlagen).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwalitieit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (https://www.agreetrust.org/), dat een internationaal breed geaccepteerd instrument is en op ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur welke onderwerpen moesten worden herzien. Deze werden met de werkgroep besproken. Tevens werd aan de volgende organisaties gevraagd om knelpunten aan te dragen: het Zorginstituut Nederland, Inspectie Gezondheidszorg en Jeugd, Vereniging voor Hygiëne & Infectiepreventie in de Gezondheidszorg, Patiëntenfederatie Nederland en Zorgverzekeraars Nederland.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep uitgangsvragen opgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant waren, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar relevante buitenlandse richtlijnen en naar systematische reviews. Voor (internationale) richtlijnen is gezocht in de databases van National Guideline Clearinghouse (NGC), Guidelines International Network (GIN), World Health Organisation (WHO) en Centers for Disease Control and Prevention (CDC). Voor bestaande systematic reviews is gezocht in de databases Ovid Medline en Embase (zie de zoekverantwoording).
Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kwaliteit van bewijs (‘quality of evidence’) werd beoordeeld met behulp van GRADE (Guyatt et al., 2008). GRADE is een methode die per uitkomstmaat van een interventie, of voor een risico- of prognostische factor, een gradering aan de kwaliteit van bewijs toekent op basis van de mate van vertrouwen in de schatting van de effectgrootte (tabel 1 en 2).
Tabel 1 Indeling van de kwaliteit van bewijs volgens GRADE
|
Hoog |
Er is veel vertrouwen dat het werkelijke effect dicht in de buurt ligt van het geschatte effect. |
|
|
|
|
Matig |
Er is matig vertrouwen in het geschatte effect: het werkelijk effect ligt waarschijnlijk dicht bij het geschatte effect, maar er is een mogelijkheid dat het hiervan substantieel afwijkt. |
|
|
|
|
Laag |
Er is beperkt vertrouwen in het geschatte effect: het werkelijke effect kan substantieel verschillen van het geschatte effect. |
|
|
|
|
Zeer laag |
Er is weinig vertrouwen in het geschatte effect: het werkelijke effect wijkt waarschijnlijk substantieel af van het geschatte effect. |
Tabel 2 De kwaliteit van bewijs wordt bepaald op basis van de volgende criteria
|
Type bewijs |
Voor studies over interventies: RCT start in de categorie ‘hoog’. Observationele studie start in de categorie ‘laag’. Alle overige studietypen starten in de categorie ‘zeer laag’.
Voor studies over een risico- of prognostische factor: Prospectieve of retrospectieve cohortstudie start in de categorie ‘hoog’. Voor andere studieontwerpen wordt afgewaardeerd via ‘risk of bias’. |
|
|
Afwaarderen |
‘Risk of bias’ |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Inconsistentie |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Indirect bewijs |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Onnauwkeurigheid |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Publicatiebias |
- 1 Waarschijnlijk - 2 Zeer waarschijnlijk |
|
Opwaarderen |
Groot effect |
+ 1 Groot + 2 Zeer groot |
|
|
Dosis-respons relatie |
+ 1 Bewijs voor gradiënt |
|
|
Alle plausibele ‘confounding’ |
+ 1 zou een effect kunnen reduceren + 1 zou een tegengesteld effect kunnen suggereren terwijl de resultaten geen effect laten zien. |
Formuleren van de conclusies
Een conclusie verwijst niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence).
Overwegingen
Voor het komen tot een aanbeveling zijn naast de kwaliteit van het wetenschappelijk bewijs over de gewenste en ongewenste effecten van een interventie, of over de effectgrootte van een risico- of prognostische factor, vaak ook nog andere factoren van belang (Alonso-Coello et al., 2016).
Genoemd kunnen worden:
- kosten,
- waarden, voorkeuren en ervaringen van patiënten en behandelaars met betrekking tot interventies en uitkomsten van zorg,
- balans van gewenste en ongewenste effecten van interventies ten opzichte van geen of andere interventies,
- aanvaardbaarheid van interventies,
- haalbaarheid van een aanbeveling.
Bij voorkeur wordt ook voor deze aspecten naar wetenschappelijk bewijs gezocht. De werkgroep die deze richtlijn heeft opgesteld, heeft hiervan afgezien omdat de hiervoor benodigde tijd in geen enkele verhouding zou staan tot de verwachte opbrengst. De werkgroep heeft, daar waar dit noodzakelijk werd geacht, op basis van eigen ervaring en expertise de hiervoor genoemde aspecten geïnventariseerd.
Deze aspecten worden besproken na de ‘conclusie’ onder het kopje ‘overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. Dit is afhankelijk van het gewicht dat wordt toegekend aan kosten, gewenste of ongewenste effecten en andere onder de overwegingen genoemde factoren.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de bijlage Kennislacunes.
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. Tevens is de richtlijn voorgelegd aan de organisaties die ook tijdens de knelpuntanalyse betrokken waren. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Literatuurlijst
- Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089.
- Guyatt et al., 2008Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, Schünemann HJ; GRADE Working Group (2008). GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 336: 924-6.
- Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
