Gerichte detectie van dragerschap van vancomycine resistente Enterococcus faecium
Uitgangsvraag
Op welke wijze wordt gerichte detectie van dragerschap uitgevoerd in het geval van contactonderzoek?
Aanbeveling
Screening op VRE
- Gebruik voor gerichte VRE screening een selectief ophopingsmedium.
- Verricht na incubatie overnacht een PCR op vanA en vanB op dit medium, of ent af op een selectieve VRE-screeningsagar.
- Indien de PCR positief is bevestig deze middels kweek.
- Gebruik amoxicilline in selectieve ophopingsmedia om de groei van Gram-positieven en anaëroben te onderdrukken. Gebruik hiervoor geen vancomycine.
- Incubeer de selectieve VRE-screeningsagar minstens 48 uur.
- Indien de PCR op aankweek positief is, maar het niet gelukt is de VRE te isoleren bij menggroei: selecteer meerdere kolonies bij groei op een selectieve VRE-agar.
- Gebruik bij voorkeur maldi-TOF of PCR voor species determinatie van E. faecium.
- Verricht moleculaire typering van de index stam als het contactonderzoek nieuwe isolaten oplevert.
Overwegingen
Kwaliteit van bewijs
Niet van toepassing, omdat er geen systematic review verricht is.
Kosten en middelen
Het toepassen van de aanbevelingen zal geen effect op de structurele kosten hebben, omdat de aanbevelingen grotendeels al aansluiten op de bestaande praktijk.
Professioneel perspectief
Gerichte screening
Detectie resultaten van VRE kweken zijn relatief vaak fout-negatief (Frakking et al., 2018). Het analyseren van 1 sample sluit VRE dragerschap dan ook niet uit. De sensitiviteit van de kweek wordt verhoogd door het sample overnacht te incuberen in een selectief aankweek medium. Het heeft de voorkeur om in het selectieve medium amoxicilline (over het algemeen 16mg/L) voor onderdrukking van Gram-positieve bacteriën te gebruiken, en geen vancomycine, aangezien VREs een lage vancomycine MIC kunnen hebben (Zhou et al., 2014). Verder kunnen in het medium antimicrobiële middelen worden toegevoegd om de groei van Gram-negatieve staven, schimmels en eventueel anaerobe bacteriën te remmen.
Na incubatie overnacht kan een vanA/vanB gendetectie en eventueel een Enterococcus faecium PCR op het aankweekmedium worden verricht, of meteen worden afgeënt op een VRE-screeningsagar. Het voordeel van gendetectie op aankweekmedium is dat de detectie van VRE wordt versneld, en de sensitiviteit van de diagnostiek toeneemt. Hierdoor is de negatieve voorspellende waarde hoger (Fonville et al., 2017). De nadelen zijn het frequent voorkomen van fout-positieve uitslagen, en het vergt extra capaciteit voor moleculaire diagnostiek. Samples met negatieve PCR uitslagen hoeven niet te worden gekweekt. Een positief vanA signaal kan bijna altijd worden bevestigd met een positieve VRE kweek. VanB kan met name bij hogere Ct-waarden fout-positief zijn, waarschijnlijk door anaeroben die vanB bij zich dragen (Ballard et al., 2005). Per centrum kan de methode variëren bij welke CT-afkapwaarde het zinvol is kweken in te zetten.
Voor de kweek op vast medium adviseren we specifieke chromogene agars voor VRE-detectie. De specificiteit van kweek van VRE van chromogene agars is hoger dan bile esculin azide vancomycin (BEAV) agar- of campylobacter-agars (Ledeboer et al., 2007; Jenkins et al., 2011). Verschillende chromogene agars zijn hier voor geschikt en commerciëel verkrijgbaar (Ledeboer et al., 2007; Anderson et al., 2013; Peterson et al., 2010; Klare et al., 2012). De screeningsagar platen worden op dag 1 en dag 2 na incubatie bij een temperatuur van 35 graden afgelezen. Incubatie bij 42 graden heeft geen toegevoegde waarde (Nguyen et al., 2012). In principe is een incubatie duur van 48 uur voldoende, maar langere incubatieduur kan worden overwogen indien VREs met afwijkende groei in een centrum voorkomen (eigen data, to be published). Op VRE screeningsagars kunnen verschillende species groeien. Ook kunnen vancomycine-gevoelige Enterococcus faecium doorgroeien op de VRE-agar. Bij groei van kolonies dient een species determinatie te worden verricht. Species determinatie met behulp van maldi-TOF of PCR-gebaseerde methoden zijn hiervoor het meest betrouwbaar, VITEK2 is minder geschikt (Fang et al., 2012).
Indien de PCR op de aankweek positief was, maar er geen VRE is geïsoleerd, kunnen als vervolg stap meerdere isolaten worden geanalyseerd. De reden hier voor is dat een patiënt zowel VRE en vancomycine-gevoelige E faecium bij zich kan dragen. Op basis van kolonie morfologie kan soms hier geen onderscheid tussen gemaakt worden, waardoor de kans bestaat dat in eerste instantie de verkeerde kolonie was uitgewerkt (zie figuur 1).
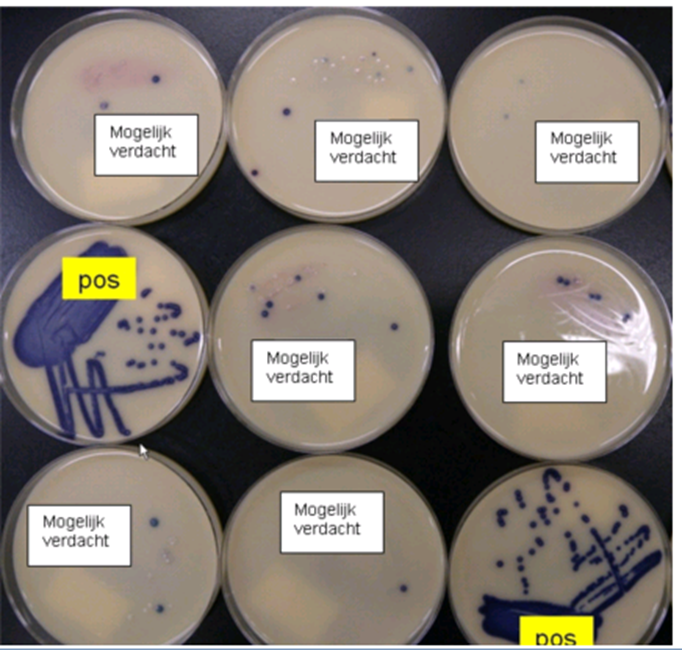
Figuur 1. Bij een mogelijke verdenking op VRE is onderscheid tussen VRE en vancomycine-gevoelige Enterococcus faecium op basis van kolonie morfologie niet te maken.
In het geval van een contact onderzoek is het van belang om de index stam fenotypisch en genotypisch te karakteriseren. VREs kunnen afwijkende groei-eigenschappen tonen, het glycopeptide resistentie gen wisselend tot expressie brengen (silenced) of een lage MIC hebben voor vancomycine, waardoor ze niet binnen 48 uur op VRE-platen groeien. De kweekstrategie kan worden aangepast op deze eigenschappen. Om verspreiding aan te tonen, is typering noodzakelijk. Er zijn talrijke gevallen bekend dat de typering laat zien dat een stam ondanks een sterke epidemiologische link toch niet clonaal verwant blijkt te zijn. Dit kan gebaseerd zijn op een toevalsbevinding en een samenlopende uitbraak aan het licht brengen, of door in zeldzame gevallen door horizontale overdracht van een transposon met het van-gen naar een andere Enterococcus faecium stam binnen een patiënt (Zhou et al., 2018). Bij een uitbraak met veel patiënten is het niet altijd nodig ieder isolaat middels whole genome sequencing te typeren, als de epidemiologische link tussen de patiënten sterk is. Wel is het aanbevolen om VRE isolaten in te vriezen bij -80 graden, zodat de mogelijkheid voor aanvullende gevoeligheidsbepalingen en typering op een later moment blijft bestaan.
De VREs die uitbraken veroorzaken zijn ziekenhuis bacteriën die genetisch sterk op elkaar kunnen lijken. Om overdracht aan tonen zijn typeringsmethoden nodig met een hoog discriminatief vermogen. Op basis van whole genome sequences kunnen de chromosomale genen die isolaten gezamenlijk hebben onderling worden vergeleken op verschillen (de Been et al., 2015). Identieke cluster types in combinatie met een epidemiologische link duiden op transmissie. Sommige VRE lineages zijn hyperepidemisch. In Duitsland is bijvoorbeeld over grote regios verspreiding vastgesteld van een ST117 vanB clone, met op basis van cgMLST hetzelfde clustertype CT71 (Falgenhauer et al., 2019). De uitgebreide verspreiding van dergelijke hyperepidemische lineages maakt het aantonen van directe VRE transmissie tussen ziekenhuizen op basis van whole genome sequencing onmogelijk, aangezien het aanwezig zijn van VREs met hetzelfde cluster type ook verklaart kan worden op basis van onafhankelijke externe introducties.
In grote ongecontroleerde uitbraken is het ook mogelijk om unique marker PCRs in te zetten als snelle typerings methode. Op basis van whole genome sequencing data kunnen PCRs worden ontworpen die locaties in het genoom detecteren, die specifiek zijn voor de uitbraakstam. Door middel van deze methode kan de tijd tot een typeringsuitslag met enkele dagen worden bekort (Deurenberg et al., 2016).
Aanvaardbaarheid en haalbaarheid van de aanbeveling(en)
Onderstaande aanbevelingen zijn haalbaar en aanvaardbaar voor medisch microbiologische laboratoria, omdat zij grotendeels aansluiten bij de huidige klinische praktijk.
Onderbouwing
Zoeken en selecteren
Er is geen systematische literatuuranalyse verricht. De werkgroepleden maakten gebruik van door hen zelf verzamelde artikelen (zie overwegingen).
Referenties
- de Been M, Pinholt M, Top J, Bletz S, Mellmann A, van Schaik W, Brouwer E, Rogers M, Kraat Y, Bonten M, Corander J, Westh H, Harmsen D, Willems RJ. Core Genome Multilocus Sequence Typing Scheme for High- Resolution Typing of Enterococcus faecium. J Clin Microbiol. 2015 Dec;53(12):3788-97.
- Deurenberg RH, Bathoorn E, Chlebowicz MA, Couto N, Ferdous M, García-Cobos S, Kooistra-Smid AM, Raangs EC, Rosema S, Veloo AC, Zhou K, Friedrich AW, Rossen JW. Application of next generation sequencing in clinical microbiology and infection prevention. J Biotechnol. 2017 Feb 10;243:16-24. doi: 10.1016/j.jbiotec.2016.12.022. Epub 2016 Dec 29.
- Falgenhauer L, Fritzenwanker M, Imirzalioglu C, Steul K, Scherer M; Rhine-Main VREfm study group, Heudorf U, Chakraborty T. Near-ubiquitous presence of a vancomycin-resistant Enterococcus faecium ST117/CT71/vanB -clone in the Rhine-Main metropolitan area of Germany. Antimicrob Resist Infect Control. 2019 Jul 29;8:128. doi: 10.1186/s13756-019-0573-8. eCollection 2019.
- Zhou X, Chlebowicz MA, Bathoorn E, Rosema S, Couto N, Lokate M, Arends JP, Friedrich AW, Rossen JWA. Elucidating vancomycin-resistant Enterococcus faecium outbreaks: the role of clonal spread and movement of mobile genetic elements. J Antimicrob Chemother. 2018 Dec 1;73(12):3259-3267. doi: 10.1093/jac/dky349.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 27-07-2021
Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Vereniging voor Medische Microbiologie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Medische Microbiologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door B.S. Niël-Weise, zelfstandig richtlijnmethodoloog, en werd gefinancieerd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De richtlijn is ontwikkeld in samenwerking met de Vereniging voor Hygiëne en Infectiepreventie in de Gezondheidszorg.
Doel en doelgroep
Doel
Het doel van het project is het herzien van de huidige richtlijn Laboratoriumdiagnostiek van BRMO die dateert uit 2012. Afgezien van het verstrijken van de reguliere termijn voor herziening zijn er nieuwe inzichten en methoden beschikbaar gekomen die de diagnostiek kunnen optimaliseren.
Doelgroep
De richtlijn is met name bedoeld voor artsen-microbioloog, deskundigen infectiepreventie, internisten-infectioloog en medisch moleculair microbiologen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de pre-analytische (afname, transport en bewaaromstandigheden) en de analytische fase van de laboratorium detectie van BRMO inclusief de rapportage naar de aanvrager danwel naar het patiëntendossier.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 2 jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep:
- Prof. dr. J.A.J.W. Kluytmans, arts-microbioloog, Amphia Ziekenhuis Breda/Oosterhout; Elisabeth-TweeSteden Ziekenhuis, Tilburg; Universitair Medisch Centrum Utrecht
- Drs. W. van den Bijllaardt, arts-microbioloog, Amphia Ziekenhuis Breda
- Dr. E. Bathoorn, arts-microbioloog, Universitair Medisch Centrum Groningen
- Dr. J. Cohen Stuart, arts-microbioloog, Noordwest Ziekenhuis Alkmaar
- Dr. J. J. Verweij, medisch moleculair microbioloog/parasitoloog, Elisabeth-Tweesteden Ziekenhuis, Tilburg
- Dr. W. H.F. Goessens, microbioloog, Erasmus MC Universitair Medisch Centrum Rotterdam
- Dr. N. al Naiemi, arts-microbioloog, Labmicta, Hengelo
- Prof. Dr. M.C. Vos, arts-microbioloog, Erasmus MC Universitair Medisch Centrum, Rotterdam
- Dr. L. van Dommelen, arts-microbioloog, PAMM, Veldhoven
- Dr. P. Croughs, arts-microbioloog, Erasmus MC Universitair Medisch Centrum, Rotterdam
- Drs. A. Klak, arts-microbioloog in opleiding, Universitair Medisch Centrum Groningen
Meelezers:
- Dr. M.K. Bomers, internist-infectioloog, Amsterdam UMC, locatie VUmc
- Mv. M. Molenaar, deskundige infectiepreventie, OLVG Amsterdam
- Mv. S. Cremers-Pijpers, deskundige infectiepreventie, Radboudumc, Nijmegen
Met ondersteuning van:
- Mw. B.S. Niël-Weise, zelfstandig richtlijnmethodoloog, Deventer
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancieerd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij de Nederlandse Vereniging voor Medische Microbiologie, een overzicht vindt u hieronder:
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
|
Jan Kluytmans |
|
|
Geen |
Geen |
Subsidiegevers zijn Euopese commissie, Nederlandse overheid en provincies. Geen belangen bij deze richtlijn |
Geen |
Geen |
|
Erik Bathoorn |
Arts-microbioloog, UMCG Groningen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Wouter van den Bijllaardt |
Arts-microbioloog Amphia ziekenhuis Breda |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
James Cohen Stuart |
Arts-microbioloog Noordwest Ziekenhuisgroep |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Jaco Verweij |
Medisch moleculair microbioloog, ETZ Ziekenhuis, Tilburg |
|
Geen |
Geen |
Geen |
Geen |
Geen |
|
Wil Goessens |
Medisch microbioloog Erasmus Medisch Centrum Rotterdam |
Geen |
Patent: detectie van carbapenemase middels maldi-TOF |
Geen |
Geen |
Geen |
Geen |
|
Nashwan al Naiemi |
Arts-microbioloog LabMicTA Bestuurder LabMicTA |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Greet Vos |
Arts-microbioloog MC Rotterdam |
|
Geen |
Geen |
Unrestricted grant 3m, Pentax |
Geen |
Geen |
|
Adrian Klak |
AIOS Medische Microbiologie UMCG |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Peter Croughs |
Arts-microbioloog, Erasmus Medisch Centrum |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Laura van Dommelen |
Arts-microbioloog, Stichting PAMM te Veldhoven |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Marije Bomers |
Internist- infectioloog, Amsterdam UMC, locatie VUmc |
Geen |
Financieel belang farmaceutisch bedrijf Shionogi |
Geen |
Subsidiegevers zijn ZonMW en Amsterdam UMC corona research fonds. Geen belangen bij deze richtlijn |
Geen |
Geen |
|
Myrte Molenaar |
Deskundige Infectiepreventie OLVG Amsterdam |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Suzan Cremers |
Deskundige |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door in de voorbereidende fase de Patiëntenfederatie Nederland te vragen om schriftelijke input omtrent knelpunten en aandachtspunten. De Patiëntenfederatie gaf aan geen knelpunten aan te leveren vanwege het technisch karakter van de richtlijn. De werkgroep heeft de conceptrichtlijn ook tijdens de commentaarfase voorgelegd aan de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren (zie het Implementatieplan in de bijlagen).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwalitieit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (https://www.agreetrust.org/), dat een internationaal breed geaccepteerd instrument is en op ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur welke onderwerpen moesten worden herzien. Deze werden met de werkgroep besproken. Tevens werd aan de volgende organisaties gevraagd om knelpunten aan te dragen: het Zorginstituut Nederland, Inspectie Gezondheidszorg en Jeugd, Vereniging voor Hygiëne & Infectiepreventie in de Gezondheidszorg, Patiëntenfederatie Nederland en Zorgverzekeraars Nederland.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep uitgangsvragen opgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant waren, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar relevante buitenlandse richtlijnen en naar systematische reviews. Voor (internationale) richtlijnen is gezocht in de databases van National Guideline Clearinghouse (NGC), Guidelines International Network (GIN), World Health Organisation (WHO) en Centers for Disease Control and Prevention (CDC). Voor bestaande systematic reviews is gezocht in de databases Ovid Medline en Embase (zie de zoekverantwoording).
Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kwaliteit van bewijs (‘quality of evidence’) werd beoordeeld met behulp van GRADE (Guyatt et al., 2008). GRADE is een methode die per uitkomstmaat van een interventie, of voor een risico- of prognostische factor, een gradering aan de kwaliteit van bewijs toekent op basis van de mate van vertrouwen in de schatting van de effectgrootte (tabel 1 en 2).
Tabel 1 Indeling van de kwaliteit van bewijs volgens GRADE
|
Hoog |
Er is veel vertrouwen dat het werkelijke effect dicht in de buurt ligt van het geschatte effect. |
|
|
|
|
Matig |
Er is matig vertrouwen in het geschatte effect: het werkelijk effect ligt waarschijnlijk dicht bij het geschatte effect, maar er is een mogelijkheid dat het hiervan substantieel afwijkt. |
|
|
|
|
Laag |
Er is beperkt vertrouwen in het geschatte effect: het werkelijke effect kan substantieel verschillen van het geschatte effect. |
|
|
|
|
Zeer laag |
Er is weinig vertrouwen in het geschatte effect: het werkelijke effect wijkt waarschijnlijk substantieel af van het geschatte effect. |
Tabel 2 De kwaliteit van bewijs wordt bepaald op basis van de volgende criteria
|
Type bewijs |
Voor studies over interventies: RCT start in de categorie ‘hoog’. Observationele studie start in de categorie ‘laag’. Alle overige studietypen starten in de categorie ‘zeer laag’.
Voor studies over een risico- of prognostische factor: Prospectieve of retrospectieve cohortstudie start in de categorie ‘hoog’. Voor andere studieontwerpen wordt afgewaardeerd via ‘risk of bias’. |
|
|
Afwaarderen |
‘Risk of bias’ |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Inconsistentie |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Indirect bewijs |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Onnauwkeurigheid |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Publicatiebias |
- 1 Waarschijnlijk - 2 Zeer waarschijnlijk |
|
Opwaarderen |
Groot effect |
+ 1 Groot + 2 Zeer groot |
|
|
Dosis-respons relatie |
+ 1 Bewijs voor gradiënt |
|
|
Alle plausibele ‘confounding’ |
+ 1 zou een effect kunnen reduceren + 1 zou een tegengesteld effect kunnen suggereren terwijl de resultaten geen effect laten zien. |
Formuleren van de conclusies
Een conclusie verwijst niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence).
Overwegingen
Voor het komen tot een aanbeveling zijn naast de kwaliteit van het wetenschappelijk bewijs over de gewenste en ongewenste effecten van een interventie, of over de effectgrootte van een risico- of prognostische factor, vaak ook nog andere factoren van belang (Alonso-Coello et al., 2016).
Genoemd kunnen worden:
- kosten,
- waarden, voorkeuren en ervaringen van patiënten en behandelaars met betrekking tot interventies en uitkomsten van zorg,
- balans van gewenste en ongewenste effecten van interventies ten opzichte van geen of andere interventies,
- aanvaardbaarheid van interventies,
- haalbaarheid van een aanbeveling.
Bij voorkeur wordt ook voor deze aspecten naar wetenschappelijk bewijs gezocht. De werkgroep die deze richtlijn heeft opgesteld, heeft hiervan afgezien omdat de hiervoor benodigde tijd in geen enkele verhouding zou staan tot de verwachte opbrengst. De werkgroep heeft, daar waar dit noodzakelijk werd geacht, op basis van eigen ervaring en expertise de hiervoor genoemde aspecten geïnventariseerd.
Deze aspecten worden besproken na de ‘conclusie’ onder het kopje ‘overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. Dit is afhankelijk van het gewicht dat wordt toegekend aan kosten, gewenste of ongewenste effecten en andere onder de overwegingen genoemde factoren.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de bijlage Kennislacunes.
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. Tevens is de richtlijn voorgelegd aan de organisaties die ook tijdens de knelpuntanalyse betrokken waren. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Literatuurlijst
- Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089.
- Guyatt et al., 2008Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, Schünemann HJ; GRADE Working Group (2008). GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 336: 924-6.
- Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
