Laboratoriummethodes voor de detectie van ESBL
Uitgangsvraag
Welke laboratoriummethodes worden gebruikt voor de detectie van ESBL producerende Enterobacterales?
Aanbeveling
Screening op ESBL-E (niet gericht)
- Bepaal de antimicrobiële gevoeligheid van Enterobacterales door middel van bouillon dilutie, agar dilutie, agar diffusie of een geautomatiseerd system.
- Gebruik de gevoeligheid voor cefotaxim (or ceftriaxon) en ceftazidim als indicator voor de aanwezigheid van ESBL.
- Hanteer voor zowel cefotaxim (ceftriaxon) als ceftazidim een screeningsbreekpunt van > 1 mg/L.
Fenotyische confirmatie
- Gebruik de combinatie disk diffusiemethode, de antibiotica gradiënt methode of de bouillon microdilutie voor de fenotypische confirmatie van ESBL.
- Gebruik zowel cefotaxim (of ceftriaxon) als ceftazidim voor de fenotypische ESBL confirmatie voor groep I Enterobacterales.
- Voer voor groep I Enterobacterales een additionele ESBL confirmatie uit met cefepime indien de testresultaten voor cefotaxim (of ceftriaxon) of ceftazidim onbepaald zijn of bij een cefoxitine MIC > 8 mg/L.
- Gebruik cefepime + clavulaanzuur voor de fenotypische ESBL confirmatie in groep II Enterobacterales.
Genotypische confirmatie
- Bevestig de aanwezigheid van ESBL genen door middel van moleculaire detectie om fout-positieve uitslagen te voorkomen of op epidemiologische indicatie.
Kwaliteitscontrole
- Suggesties voor stammen te gebruiken voor kwaliteitscontrole zijn: K. pneumoniae ATCC 700603 (ESBL-positief); en E. coli ATCC 25922 (ESBL-negatief); lokaal fenotypisch en genotypisch gevalideerde stammen zijn ook bruikbaar.
Overwegingen
Kwaliteit van bewijs
Niet van toepassing, omdat geen systematic review verricht is.
Kosten en middelen
Het toepassen van de aanbevelingen zal geen effect op de structurele kosten hebben, omdat de aanbevelingen grotendeels al aansluiten op de bestaande praktijk.
Professioneel perspectief
Leeswijzer: onderstaande tekst is als volg ingedeeld:
- Screening op ESBL-E
- Confirmatie van ESBL-E
Fenotypische confirmatie
- Combinatie disk diffusiemethode
- Gradiëntmethode
- Bouillon microdilutiemethode
- Fenotypische confirmatie in groep I Enterobacterales
- Fenotypische confirmatie in groep II Enterobacterales
Genotypische confirmatie
- Kwaliteitscontrole
Screening op ESBL-E
Detectie van ESBL-E is een twee staps-procedure: een screeningstap gevolgd door een bevestigingstap (figuur 1). In de eerste stap wordt gescreend op de verminderde gevoeligheid voor een derde generatie cefalosporine. De gevoeligheid wordt vergeleken met deze van de ‘wild-type’ populatie. Het screening-breekpunt van > 1 mg / L is conform de richtlijnen van de CLSI en EUCAST (tabel 2) (CLSI 2011, EUCAST 2013).
Het wordt aanbevolen altijd gebruik te maken van 2 indicator cefalosporines; b.v. cefotaxim (of ceftriaxon) en ceftazidim. De reden voor gebruik van 2 cefalosporines is omdat de MICs voor de verschillende types ESBL verschillend kunnen zijn voor deze twee cefalosporines (Biedenbach et al., 2006; Hirakata et al., 2005, Hope et al., 2007; Kim et al., 2004]. Het gebruik van cefpodoxim als indicator cefalosporine is minder specifiek dan de combinatie van cefotaxim (of ceftriaxon) en ceftazidim en wordt niet aangeraden (Hope et al. 2007).
Figuur 1. Algoritme voor de detectie van ESBL-E
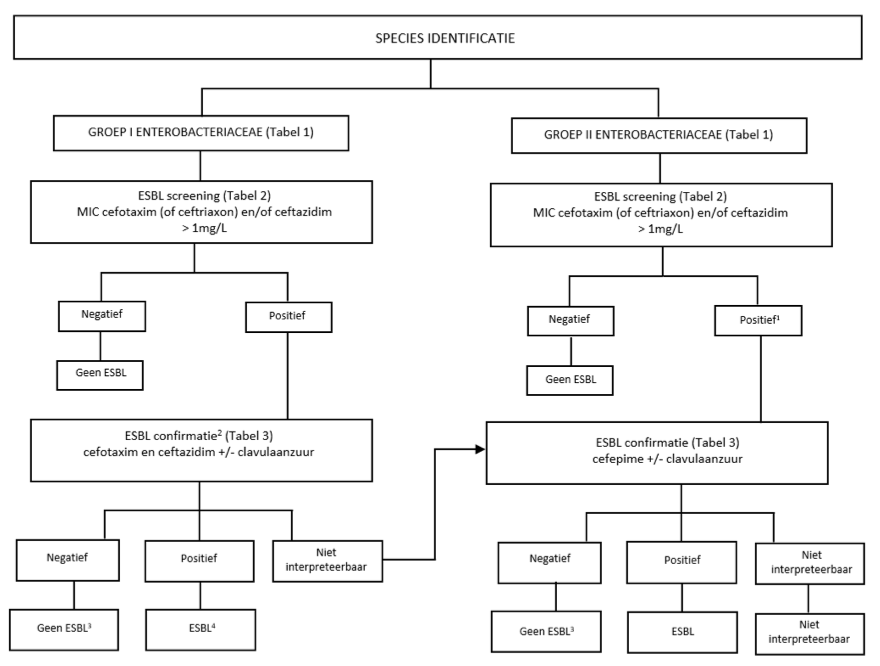
1 Gederepresseerde chromosomosomaal AmpC beta-lactamase gen kan resulteren in een fout-positief resultaat.
2 Als cefoxitine MIC >8mg/l, dan moet ESBL-bevestiging aanvullend worden uitgevoerd met cefepime als indicator
cefalosporine.
3 Clavulaanzuur-resistente klasse D (OXA) ESBL kan niet worden uitgesloten.
4 Hyperproductie van K1 beta-lactamase in Klebsiella oxytoca kan resulteren in een fout-positief resultaat. Een positief testresultaat voor ceftazidim duidt op ESBL-productie.
Tabel 2. Screening op ESBL-E
|
Methode |
Antibioticum |
Disk/tablet lading |
Screening positief indien |
|
Bouillon dilutie |
cefotaxim |
|
MIC > 1 mg/L |
|
|
ceftriaxon |
|
MIC > 1 mg/L |
|
|
ceftazidim |
|
MIC > 1 mg/L |
|
Agar dilutie |
cefotaxim |
|
MIC > 1 mg/L |
|
|
ceftriaxon |
|
MIC > 1 mg/L |
|
|
ceftazidim |
|
MIC > 1 mg/L |
|
Disk diffusie |
cefotaxim |
30 ug |
remmingzone < 28 mm |
|
|
cefotaxim |
5 ug |
remmingzone < 21 mm |
|
|
ceftriaxon |
30 ug |
remmingzone < 23 mm |
|
|
ceftazidim |
30 ug |
remmingzone < 23 mm |
|
|
ceftazidim |
10 ug |
remmingzone < 22 mm |
|
Geautomatiseerd systemen |
cefotaxim |
|
MIC > 1 mg/L |
|
|
ceftazidim |
|
MIC > 1 mg/L |
MIC = minimal inhibitory concentration;
References: CLSI 2011, EUCAST 2013, Hope et al., 2007; Leverstein-van Hall et al., 2002, Spanu et al., 2006; Thomson et al., 2007
Confirmatiemehoden voor ESBL-E
Fenotypische confirmatie
De fenotypische confirmatiestap is gebaseerd op de in vitro remming van ESBL-activiteit door de toevoeging van clavulaanzuur. Alleen screening zonder confirmatie is onvoldoende voor een betrouwbare detectie van ESBL-E.
Er zijn verschillende methoden beschikbaar voor de fenotypische confirmatie van ESBL-E. Deze zijn allemaal gebaseerd op de in vitro remming van ESBL-activiteit door clavulaanzuur. Drie methoden hebben hierbij de voorkeur: 1) de combinatie disk diffusiemethode, 2) de gradiëntmethode, of 3) bouillon microdilutiemethode (tabel 3) (Drieux et al., 2008; Jeong et al., 2009; Paterson et al., 2005). Vergeleken met de gradiëntmethode heeft de combinatie disk diffusiemethode een hogere specificiteit (Platteel et al., 2013)
De VITEK 2 ESBL bevestigingstest wordt niet aanbevolen voor ESBL confirmatie, omdat het aantal gegevens beperkt is en de gepubliceerde resultaten uiteenlopend zijn (Leverstein-van Hall et al., 2002; Spanu et al., 2006; Thomson et al., 2007). Bij de 'double disk approximation test' is de gevoeligheid afhankelijk van de optimale disk/tablet-afstand. Bovendien is in verschillende onderzoeken aangetoond dat de gevoeligheid hiervan laag is (Bedenic et al., 2007, Paterson et al., 2005, Tzelepi et al., 2000). Om die reden wordt afgeraden om de 'double disk approximation test' te gebruiken.
a) Combinatie disk diffusiemethode
Remmingszones rond cefalosporine disks/tabletten in combinatie met clavulaanzuur worden vergeleken met remmingszones rond de disks/tabletten met cefalosporines alleen. De test is positief als de remmingszone rond de disk/tablet met clavulaanzuur ³5 mm groter is dan rond de disk zonder clavulaanzuur (op voorwaarde dat de ESBL-screening positief is) (Tabel 3) (HPA 2008; M'Zali et al., 2000). Voor applicatie van de disks/tabletten wordt verwezen naar de gebruiksaanwijzing van de fabrikant.
MICs van cefalosporine alleen worden vergeleken met MICs van cefalosporine gecombineerd met clavulaanzuur. De test is positief als de MIC van het cefalosporine met clavulaanzuur ³8 keer lager is dan de MIC van het cefalosporine alleen of bij aanwezigheid van een deformatie-ellips / fantoomzone (op voorwaarde dat de ESBL-screening positief is) (Tabel 3). Het testresultaat is niet interpreteerbaar als de strip niet kan worden afgelezen vanwege groei buiten bereik van de strip. Alle overige uitslagen zijn niet indicatief voor productie van ESBL. Voor applicatie van de gradiënttesten wordt verwezen naar de gebruiksaanwijzing van de fabrikant. De gradiënttesten zijn niet te gebruiken voor het bepalen van de MIC.
c) Bouillon microdilutiemethode
MICs van cefalosporine alleen worden vergeleken met MICs van cefalosporine gecombineerd met clavulaanzuur. De test is positief als de MIC van het cefalosporine met clavulaanzuur ³8 keer lager is dan de MIC van het cefalosporine alleen (op voorwaarde dat de ESBL-screening positief is) (Tabel 3). Voor de uitvoering wordt aanbevolen om twee seriële tweevoudige verdunningen te maken van cefotaxim (of ceftriaxon), ceftazidim en cefepime in Mueller-Hinton-bouillon (concentratiereeks van 0,25 tot 512 mg/L) waarbij in een van de reeksen clavulaanzuur in een vaste concentratie van 4 mg/L is toegevoegd. Een bacteriesuspensie wordt in elk putje van de microtiterplaat geïnoculeerd (Jeong et al., 2009). De microtiterplaat wordt gedurende 18 tot 24 uur bij 37 ° C geïncubeerd.
Tabel 3. ESBL confirmatie methode voor Enterobacterales welke positief zijn in de ESBL screening (Zie Tabel 2)
|
Groep I Enterobacterales (zie Tabel 1) |
|||
|
Methode |
Antibioticum |
Disk/tablet lading |
Confirmatie positief indien |
|
Gradiëntmethode ESBL |
cefotaxim +/- clavulaanzuur |
- |
MIC ratio1 ≥ 8 of deformatie-ellips / fantoomzone |
|
|
ceftazidim +/- clavulaanzuur |
- |
MIC ratio1 ≥ 8 of deformatie-ellips / fantoomzone |
|
Combinatie disk diffusie test |
cefotaxim +/- clavulaanzuur |
cefotaxim 30 ug |
≥ 5 mm toename in remmingzone2 |
|
|
|
clavulaanzuur 10 ug |
|
|
|
ceftazidim +/- clavulaanzuur |
ceftazidim 30 ug |
≥ 5 mm toename in remmingzone2 |
|
|
|
clavulaanzuur 10 ug |
|
|
Bouillon microdilutie |
cefotaxim +/- clavulaanzuur |
- |
MIC ratio1 ≥ 8 |
|
|
ceftazidim +/- clavulaanzuur |
- |
MIC ratio1 ≥ 8 |
|
|
cefepime +/- clavulaanzuur |
- |
MIC ratio1 ≥ 8 |
|
Groep II Enterobacterales (zie Tabel 1) |
|||
|
Methode |
Antibioticum |
|
Confirmatie positief indien |
|
Gradiëntmethode ESBL |
cefepime +/- clavulaanzuur |
- |
MIC ratio1 ≥ 8 of deformatie-ellips / fantoomzone |
|
Combinatie disk diffusie test |
cefepime +/- clavulaanzuur
|
cefepime 30 ug |
≥ 5 mm toename in remmingzone2 |
|
clavulaanzuur10 ug |
|
||
|
Bouillon microdilutie |
cefepime +/- clavulaanzuur |
- |
MIC ratio1 ≥ 8 |
ESBL = extended-spectrum beta-lactamase; MIC = minimal inhibitory concentration
1 MIC indicator cefalosporine / MIC indicator cefalosporine + clavulaanzuur
2 Indicator cefalosporine + clavulaanzuur ten opzichte van indicator cefalosporine alleen
Referenties: CLSI 2011, HPA 2006, Jeong 2009, M’Zali 2000, Paterson 2005, Stürenburg 2004
d) Fenotypische confirmatie in groep I Enterobacterales
Voor de definitie van groep I Enterobacterales: zie inleiding van de module ‘Extended-spectrum beta-lactamases / plasmidaal AmpC-detectie’.
Gebruik zowel cefotaxim (of ceftriaxon) als ceftazidim voor de bevestiging van ESBL in groep I Enterobacterales (Tabel 3), omdat de hydrolyse van de verschillende klassen van ESBLs voor cefotaxim en ceftazidim verschillend is. Synergie met clavulaanzuur van één van beide cefalosporines is voldoende om de aanwezigheid van ESBL te bevestigen (CLSI 2011).
Niet interpreteerbare testresultaten kunnen het gevolg zijn van de aanwezigheid van een carbapenemase-gen (March et al., 2010). Niet interpreteerbare testresultaten (gradiëntmethode) en fout-negatieve testresultaten (combinatie disk diffusiemethode, gradiëntmethode en bouillon microdilutiemethode) kunnen ook het gevolg zijn van de aanwezigheid van AmpC beta-lactamasen (Drieux et al., 2008; Jacoby et al., 2009; Munier et al., 2010). Een cefoxitine MIC >8 mg / L is vaak indicatief voor stabiele derepressie van het AmpC betalactamase-gen (Jacoby et al., 2009). Als de testresultaten voor cefotaxim (of ceftriaxon) of ceftazidim niet interpreteerbaar zijn (gradiëntmethode) of als het isolaat een cefoxitine MIC >8 mg / L heeft, wordt het daarom aanbevolen om een extra ESBL-bevestigingstest uit te voeren met cefepime als indicator cefalosporine. Reden hiervoor is dat cefepime niet afgebroken wordt door AmpC beta-lactamasen (Drieux et al., 2008).
Een alternatieve methode om het maskerende effect van AmpC te voorkomen is om de combinatie disk diffusie methode uit te voeren op Mueller-Hinton agar platen die 200-250 mg/L cloxacilline bevatten (Drieux et al., 2008). Cloxacilline werkt als remmer van AmpC beta-lactamasen. Voor een ander alternatief, het gebruik van disks die naast de indicator antibiotica (cefotaxim en ceftazidim +/- clavulaanzuur) tevens cloxacilline bevatten, zijn onvoldoende gepubliceerde validaties beschikbaar.
Andere oorzaken van fout-negatieve testresultaten zijn de aanwezigheid van clavulaanzuur-ongevoelige klasse D (OXA) ESBL's (Naas et al., 2008) of clavulaanzuur-ongevoelige TEM beta-lactamasen (Sirot et al., 1997).
ESBL-confirmatietesten die cefotaxime als indicator cefalosporine gebruiken, kunnen fout-positief zijn in Klebsiella oxytoca-stammen met hyperproductie van het chromosomale K1 beta-lactamase (Livermore et al., 1995; Paterson et al., 2005; Sanders et al., 1996). Daarom is bij K. oxytoca-isolaten die een positief fenotypisch ESBL-confirmatietestresultaat hebben, genotypische ESBL-confirmatie aanbevolen, tenzij sprake is van een verhoogde ceftazidime MIC en ceftazidim-clavulaanzuur confirmatie test. Dan is er sprake van ESBL productie. K1 hydrolyseert immers geen ceftazidim. Een soortgelijk fenotype kan ook worden aangetroffen in Proteus vulgaris, Proteus penneri, Citrobacter koseri en Kluyvera spp. en in sommige C. koseri-verwante soorten zoals C.sedlakii, C.farmeri en C.amalonaticus, die chromosomale beta-lactamasen hebben die eveneens worden geremd door clavulaanzuur (Petrella et al., 2006; Stürenburg et al., 2004).
Andere minder vaak voorkomende oorzaken van fout-positieve testresultaten zijn hyperproductie van SHV-1 beta-lactamasen in Klebsiella pneumoniae of de aanwezigheid van klasse A-carbapenemasen (inclusief KPC) (Nordmann et al., 2009; Wu et al., 2001).
e) Fenotypische confirmatie in groep II Enterobacterales
De synergie tussen indicator cefalosporine en clavulaanzuur kan gemaskeerd worden door de aanwezigheid van chromosomale AmpC beta-lactamasen.
Cefepime + clavulaanzuur kan voor confirmatie gebruikt worden, omdat cefepime niet wordt afgebroken door chromosomale AmpC beta-lactamasen. Ter confirmatie van ESBL in groep II Enterobacterales kan de combinatiedisk, gradient-, of bouillon microdilutie methode worden toegepast met cefepime als susbstraat (Cohen Stuart et al., 2011; Stürenburg et al., 2004; Towne et al., 2010) (Tabel 3).
Een alternatieve methode om het maskerende effect van AmpC te voorkomen is om de combinatie disk diffusie of gradientmethode uit te voeren op Mueller-Hinton agar platen die 200-250 mg/L cloxacilline bevatten (Drieux et al., 2008), met cefotaxim en ceftazidim als substraat. Cloxacilline werkt als remmer van AmpC beta-lactamasen. Voor een ander alternatief, het gebruik van disks die naast de indicator antibiotica (cefotaxim en ceftazidim +/- clavulaanzuur) tevens cloxacilline bevatten, zijn onvoldoende gepubliceerde validaties beschikbaar.
Genotypische confirmatie
Bevestig de aanwezigheid van ESBL-genen door middel van PCR- en/of ESBL-gensequencing (Bradford et al., 2001) of een op DNA-microarray gebaseerde methode (Cohen Stuart et al., 2010; Endimiani et al., 2010; Naas et al., 2010; Platteel et al., 2011; Willemsen et al., 2011). Met deze technieken worden fout-positieve uitslagen voorkomen. Deze moleculaire methodes maken gebruik van panels van targets, waarin de meest voorkomende ESBLs-genen als target zijn opgenomen. Enkele minder vaak voorkomende ESBL-types zijn niet als target aanwezig in deze panels, hetgeen kan resulteren in fout-negatieve genotypering. Detectie van deze zeldzame ESBLs is wel mogelijk door middel van whole genome sequencing.
Kwaliteitscontrole
Gebruik K. pneumoniae ATCC 700603 (ESBL-positief), E. coli ATCC 25922 (ESBL-negatief) en Enterobacter cloacae NCTC 13464 (ESBL-positief) als kwaliteitscontrole. Dit zijn internationaal erkende referentiestammen voor de kwaliteitscontrole voor ESBL-detectie. Lokaal fenotypisch en genotypisch gevalideerde referentiestammen zijn ook bruikbaar.
Aanvaardbaarheid/haalbaarheid van de aanbeveling(en)
Onderstaande aanbevelingen zijn haalbaar en aanvaardbaar voor medisch microbiologische laboratoria, omdat zij grotendeels aansluiten bij de huidige klinische praktijk.
Onderbouwing
Zoeken en selecteren
Er is geen systematische literatuuranalyse verricht. De werkgroepleden maakten gebruik van door hen zelf verzamelde artikelen (zie overwegingen).
Referenties
- Bedenic B, Vranes J, Mihaljevic LJ, Tonkic M, Sviben M, Plecko V, Kalenic S. Sensitivity and specificity of various beta-lactam antibiotics and phenotypical methods for detection of TEM, SHV and CTX-M extended-spectrum beta-lactamases. J Chemother 2007;19:127-39.
- Biedenbach DJ, Toleman M, Walsh TR, Jones RN. Analysis of Salmonella spp. with resistance to extended-spectrum cephalosporins and fluoroquinolones isolated in North America and Latin America: report from the SENTRY Antimicrobial Surveillance Program (1997-2004). Diagn Microbiol Infect Dis 2006;54:13-21.
- Bradford PA. Extended-spectrum beta-lactamases in the 21st century: characterization, epidemiology, and detection of this important resistance threat. Clin Microbiol Rev 2001;14:933-51.
- Clinical and Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing; twenty-first informational supplement. 2011. M100-S21.
- Cohen Stuart J, Dierikx C, Al Naiemi N, Karcmarek A, Van Hoek AH, Vos P, Fluit AC, Scharringa J, Duim B, Mevius D, Leverstein-van Hall MA. Rapid detection of TEM, SHV and CTX-M extended-spectrum beta-lactamases in Enterobacteriaceae using ligation-mediated amplification with microarray analysis. J Antimicrob Chemoth 2010;65:1377-81.
- Cohen Stuart J, Diederen B, al Naiemi N, Fluit A, Arents N, Thijsen S, Vlaminckx B, Mouton JW, Leverstein-van Hall M. Method for phenotypic detection of extended-spectrum beta-lactamases in Enterobacter species in the routine clinical setting. J Clin Microbiol 2011;49:2711-13.
- Drieux L, Brossier F, Sougakoff W, Jarlier V. Phenotypic detection of extended-spectrum beta-lactamase production in Enterobacteriaceae: review and bench guide. Clin Microbiol Infect 2008;14 (Suppl.1):90-103.
- Endimiani A, Hujer AM, Hujer KM, Gatta JA, Schriver AC, Jacobs MR, Rice LB, Bonomo RA. Evaluation of a commercial microarray system for detection of SHV-, TEM-, CTX-M, and KPC-type beta-lactamase genes in Gram-negative isolates. J Clin Microbiol 2010;48:2618-22.
- European Committee on Antimicrobial Susceptibility Testing. Breakpoint tables for interpretation of MICs and zone diameters. EUCAST; 2013. Version 3.0 http://www.eucast.org/clinical_breakpoints/
- Hirakata Y, Matsuda J, Miyazaki Y, Kamihira S, Kawakami S, Miyazawa Y, Ono Y, Nakazaki N, Hirata Y, Inoue M, Turnidge JD, Bell JM, Jones RN, Kohno S, the SENTRY Asia-Pacific participants. Regional variation in the prevalence of extended-spectrum beta-lactamase-producing clinical isolates in the Asia-Pacific region (SENTRY 1998-2002). Diagn Microbiol Infect Dis 2005;52:323-9.
- Health Protection Agency (HPA). Laboratory detection and reporting of bacteria with extended spectrum beta-lactamases. 2008. National Standard Method QSOP 51 Issue 2.2. Available at http://www.hpa-standardmethods.org.uk
- Hope R, Potz NAC, Warner M, Fagan EJ, Arnold E, Livermore DM. Efficacy of practiced screening methods for detection of cephalosporin-resistant Enterobacteriaceae. J Antimicrob Chemother 2007;59:110-3.
- Jacoby GA. AmpC beta-lactamases. Clin Microbiol Rev 2009;22:161-82.
- Jeong SH, Song W, Kim JS, Kim HS, Lee KM. Broth microdilution method to detect extended-spectrum beta-lactamases and AmpC beta-lactamases in Eenterobacteriaceae isolates by use of clavulanic acid and boronic acid as inhibitors. J Clin Microbiol 2009;47:3409-12
- Kim S, Kim J, Kang Y, Park Y, Lee B. Occurrence of extended-spectrum beta-lactamases in members of the genus Shigella in the Republic of Korea. J Clin Microbiol 2004;42:5264-9.
- Leverstein-van Hall MA, Fluit AC, Paauw A, Box ATA, Brisse S, Verhoef J. Evaluation of the Etest ESBL and the BD Phoenix, VITEK 1, and VITEK 2 automated instruments for detection of extended-spectrum beta-lactamases in multiresistant Escherichia coli and Klebsiella spp. J Clin Microbiol 2002;40:3703-11.
- Livermore DM. Beta-lactamases in laboratory and clinical resistance. Clin Microbiol Rev 1995;8:557- 84.
- March A, Aschbacher R, Dhanji H, Livermore DM, Böttcher A, Sleghel F, Maggi S, Noale M, Larcher C, Woodford N. Colonization of residents and staff of a long-term-care facility and adjacent acute-care hospital geriatric unit by multiresistant bacteria. Clin Microbiol Infect 2010;16:934-44.
- Munier GK, Johnson CL, Snyder JW, Moland ES, Hanson ND, Thomson KS. Positive extended-spectrum-beta-lactamase (ESBL) screening results may be due to AmpC beta-lactamases more often than to ESBLs. J Clin Microbiol 2010;48:673-4.
- M'Zali FH, Chanawong A, Kerr KG, Birkenhead D, Hawkey PM. Detection of extended-spectrum beta-lactamases in members of the family Enterobacteriaceae: comparison of the MAST DD test, the double disc and the Etest ESBL. J Antimicrob Chemother 2000;45:881-5.
- Naas T, Poirel L, Nordmann P. Minor extended-spectrum beta-lactamases. Clin Microbiol Infect 2008 14 (Suppl 1):42-52.
- Naas T, Cuzon G, Truong H, Bernabeu S, Nordmann P. Evaluation of a DNA microarray, the Check-Points ESBL/KPC array, for rapid detection of TEM, SHV, and CTX-M extended-spectrum beta-lactamases and KPC carbapenemases. Antimicrob Agents Chemother 2010;54:3086-92.
- Nordmann P, Cuzon G, Naas T. The real threat of Klebsiella pneumoniae carbapenemase-producing bacteria. Lancet Infect Dis 2009;9:228-36.
- Paterson DL, Bonomo RA. Extended-spectrum beta-lactamases: a clinical update. Clin Microbiol Rev 2005;18:657-86.
- Petrella S, Renard M, Ziental-Gelus N, Clermont D, Jarlier V, Sougakoff W. Characterization of the chromosomal class A β-lactamase CKO from Citrobacter koseri. FEMS Microbiology Letters, Volume 254, Issue 2, January 2006, Pages 285–292, https://doi.org/10.1111/j.1574-6968.2005.00028.x.
- Platteel TN, Leverstein-Van Hall MA, Cohen Stuart JC, Voets GM, van den Munckhof MP, Scharringa J, van de Sande N, Fluit AC, Bonten MJM, ESBL National Surveillance Working Group. Differences in the antibiotic susceptibility of human Escherichia coli with poultry-associated and non-poultry-associated extended-spectrum beta-lactamases. Eur J Clin Microbiol Infect Dis. 2013 Aug;32(8):1091-5. doi: 10.1007/s10096-013-1855-3. Epub 2013 Mar 22.
- Platteel TN, Cohen Stuart JW, Voets GM, Scharringa J, van de Sande N, Fluit AC, Leverstein-Van Hall MA; on behalf of the ESBL national surveillance working group. Evaluation of a commercial microarray as a confirmation test for the presence of extended-spectrum beta-lactamases in isolates from the routine clinical setting. Clin Microbiol Infect 2011.
- Sanders C C, Barry A L, Washington J A, Shubert C, Moland ES, Traczewski M M, Knapp C, and Mulder R. Detection of extended-spectrum-beta-lactamase-producing members of the family Enterobacteriaceae with Vitek ESBL test. J Clin Microbiol. 1996 Dec; 34(12): 2997–3001.
- Sirot D, Recule C, Chaibi EB, Bret L, Croize J, Chanal-Claris C, Labia R, Sirot J. A complex mutant of TEM-1 beta-lactamase with mutations encountered in both IRT-4 and extended-spectrum TEM-15, produced by an Escherichia coli clinical isolate. Antimicrob Agents Chemother 1997;41:1322-5.
- Spanu T, Sanguinetti M, Tumbarello M, D'Inzeo T, Fiori B, Posteraro B, Santangelo R, Cauda R, Fadda G. Evaluation of the new VITEK 2 extended-spectrum beta-lactamase (ESBL) test for rapid detection of ESBL production in Enterobacteriaceae isolates. J Clin Microbiol 2006;44:3257-62.
- Stürenburg E, Sobottka I, Noor D, Laufs R, Mack D. Evaluation of a new cefepime-clavulanate ESBL Etest to detect extended-spectrum beta-lactamases in an Enterobacteriaceae strain collection. J Antimicrob Chemother 2004;54:134-8.
- Thomson KS, Cornish NE, Hong SG, Hemrick K, Herdt C, Moland ES. Comparison of Phoenix and VITEK 2 extended-spectrum-beta-lactamase detection tests for analysis of Escherichia coli and Klebsiella isolates with well-characterized beta-lactamases. J Clin Microbiol 2007;45:2380-4.
- Towne TG, Lewis JS II2nd, Herrera M, Wickes B, Jorgenson JH. Detection of SHV-type extended-spectrum beta-lactamase in Enterobacter isolates. J Clin Microbiol 2010;48:298-9.
- Tzelepi E, Giakkoupi P, Sofianou D, Loukova V, Kemeroglou A, Tsakris A. Detection of extended-spectrum beta-lactamases in clinical isolates of Enterobacter cloacae and Enterobacter aerogenes. J Clin Microbiol 2000;38:542-6.
- Willemsen I, Overdevest I, al Naiemi N, Rijnsburger M, Savelkoul P, Vandenbroucke-Grauls C, Kluytmans J; on behalf of the TRIANGLe study group. A new diagnostic microarray (Check-KPC ESBL) for detection and identification of extended-spectrum beta-lactamases in highly resistant Enterobacteriaceae. J Clin Microbiol 2011;49:2985-7.
- Wu TL, Siu LL, Siu LH, Lauderdale TL, Lin FM, Leu HS, Lin TY, Ho M. Outer membrane protein change combined with co-existing TEM-1 and SHV-1 beta-lactamases lead to false identification of ESBL-producing Klebsiella pneumoniae. J Antimicrob Chemother 2001;47:755-61.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 27-07-2021
Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Vereniging voor Medische Microbiologie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Medische Microbiologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door B.S. Niël-Weise, zelfstandig richtlijnmethodoloog, en werd gefinancieerd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De richtlijn is ontwikkeld in samenwerking met de Vereniging voor Hygiëne en Infectiepreventie in de Gezondheidszorg.
Doel en doelgroep
Doel
Het doel van het project is het herzien van de huidige richtlijn Laboratoriumdiagnostiek van BRMO die dateert uit 2012. Afgezien van het verstrijken van de reguliere termijn voor herziening zijn er nieuwe inzichten en methoden beschikbaar gekomen die de diagnostiek kunnen optimaliseren.
Doelgroep
De richtlijn is met name bedoeld voor artsen-microbioloog, deskundigen infectiepreventie, internisten-infectioloog en medisch moleculair microbiologen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de pre-analytische (afname, transport en bewaaromstandigheden) en de analytische fase van de laboratorium detectie van BRMO inclusief de rapportage naar de aanvrager danwel naar het patiëntendossier.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 2 jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep:
- Prof. dr. J.A.J.W. Kluytmans, arts-microbioloog, Amphia Ziekenhuis Breda/Oosterhout; Elisabeth-TweeSteden Ziekenhuis, Tilburg; Universitair Medisch Centrum Utrecht
- Drs. W. van den Bijllaardt, arts-microbioloog, Amphia Ziekenhuis Breda
- Dr. E. Bathoorn, arts-microbioloog, Universitair Medisch Centrum Groningen
- Dr. J. Cohen Stuart, arts-microbioloog, Noordwest Ziekenhuis Alkmaar
- Dr. J. J. Verweij, medisch moleculair microbioloog/parasitoloog, Elisabeth-Tweesteden Ziekenhuis, Tilburg
- Dr. W. H.F. Goessens, microbioloog, Erasmus MC Universitair Medisch Centrum Rotterdam
- Dr. N. al Naiemi, arts-microbioloog, Labmicta, Hengelo
- Prof. Dr. M.C. Vos, arts-microbioloog, Erasmus MC Universitair Medisch Centrum, Rotterdam
- Dr. L. van Dommelen, arts-microbioloog, PAMM, Veldhoven
- Dr. P. Croughs, arts-microbioloog, Erasmus MC Universitair Medisch Centrum, Rotterdam
- Drs. A. Klak, arts-microbioloog in opleiding, Universitair Medisch Centrum Groningen
Meelezers:
- Dr. M.K. Bomers, internist-infectioloog, Amsterdam UMC, locatie VUmc
- Mv. M. Molenaar, deskundige infectiepreventie, OLVG Amsterdam
- Mv. S. Cremers-Pijpers, deskundige infectiepreventie, Radboudumc, Nijmegen
Met ondersteuning van:
- Mw. B.S. Niël-Weise, zelfstandig richtlijnmethodoloog, Deventer
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancieerd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij de Nederlandse Vereniging voor Medische Microbiologie, een overzicht vindt u hieronder:
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
|
Jan Kluytmans |
|
|
Geen |
Geen |
Subsidiegevers zijn Euopese commissie, Nederlandse overheid en provincies. Geen belangen bij deze richtlijn |
Geen |
Geen |
|
Erik Bathoorn |
Arts-microbioloog, UMCG Groningen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Wouter van den Bijllaardt |
Arts-microbioloog Amphia ziekenhuis Breda |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
James Cohen Stuart |
Arts-microbioloog Noordwest Ziekenhuisgroep |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Jaco Verweij |
Medisch moleculair microbioloog, ETZ Ziekenhuis, Tilburg |
|
Geen |
Geen |
Geen |
Geen |
Geen |
|
Wil Goessens |
Medisch microbioloog Erasmus Medisch Centrum Rotterdam |
Geen |
Patent: detectie van carbapenemase middels maldi-TOF |
Geen |
Geen |
Geen |
Geen |
|
Nashwan al Naiemi |
Arts-microbioloog LabMicTA Bestuurder LabMicTA |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Greet Vos |
Arts-microbioloog MC Rotterdam |
|
Geen |
Geen |
Unrestricted grant 3m, Pentax |
Geen |
Geen |
|
Adrian Klak |
AIOS Medische Microbiologie UMCG |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Peter Croughs |
Arts-microbioloog, Erasmus Medisch Centrum |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Laura van Dommelen |
Arts-microbioloog, Stichting PAMM te Veldhoven |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Marije Bomers |
Internist- infectioloog, Amsterdam UMC, locatie VUmc |
Geen |
Financieel belang farmaceutisch bedrijf Shionogi |
Geen |
Subsidiegevers zijn ZonMW en Amsterdam UMC corona research fonds. Geen belangen bij deze richtlijn |
Geen |
Geen |
|
Myrte Molenaar |
Deskundige Infectiepreventie OLVG Amsterdam |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Suzan Cremers |
Deskundige |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door in de voorbereidende fase de Patiëntenfederatie Nederland te vragen om schriftelijke input omtrent knelpunten en aandachtspunten. De Patiëntenfederatie gaf aan geen knelpunten aan te leveren vanwege het technisch karakter van de richtlijn. De werkgroep heeft de conceptrichtlijn ook tijdens de commentaarfase voorgelegd aan de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren (zie het Implementatieplan in de bijlagen).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwalitieit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (https://www.agreetrust.org/), dat een internationaal breed geaccepteerd instrument is en op ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur welke onderwerpen moesten worden herzien. Deze werden met de werkgroep besproken. Tevens werd aan de volgende organisaties gevraagd om knelpunten aan te dragen: het Zorginstituut Nederland, Inspectie Gezondheidszorg en Jeugd, Vereniging voor Hygiëne & Infectiepreventie in de Gezondheidszorg, Patiëntenfederatie Nederland en Zorgverzekeraars Nederland.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep uitgangsvragen opgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant waren, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar relevante buitenlandse richtlijnen en naar systematische reviews. Voor (internationale) richtlijnen is gezocht in de databases van National Guideline Clearinghouse (NGC), Guidelines International Network (GIN), World Health Organisation (WHO) en Centers for Disease Control and Prevention (CDC). Voor bestaande systematic reviews is gezocht in de databases Ovid Medline en Embase (zie de zoekverantwoording).
Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kwaliteit van bewijs (‘quality of evidence’) werd beoordeeld met behulp van GRADE (Guyatt et al., 2008). GRADE is een methode die per uitkomstmaat van een interventie, of voor een risico- of prognostische factor, een gradering aan de kwaliteit van bewijs toekent op basis van de mate van vertrouwen in de schatting van de effectgrootte (tabel 1 en 2).
Tabel 1 Indeling van de kwaliteit van bewijs volgens GRADE
|
Hoog |
Er is veel vertrouwen dat het werkelijke effect dicht in de buurt ligt van het geschatte effect. |
|
|
|
|
Matig |
Er is matig vertrouwen in het geschatte effect: het werkelijk effect ligt waarschijnlijk dicht bij het geschatte effect, maar er is een mogelijkheid dat het hiervan substantieel afwijkt. |
|
|
|
|
Laag |
Er is beperkt vertrouwen in het geschatte effect: het werkelijke effect kan substantieel verschillen van het geschatte effect. |
|
|
|
|
Zeer laag |
Er is weinig vertrouwen in het geschatte effect: het werkelijke effect wijkt waarschijnlijk substantieel af van het geschatte effect. |
Tabel 2 De kwaliteit van bewijs wordt bepaald op basis van de volgende criteria
|
Type bewijs |
Voor studies over interventies: RCT start in de categorie ‘hoog’. Observationele studie start in de categorie ‘laag’. Alle overige studietypen starten in de categorie ‘zeer laag’.
Voor studies over een risico- of prognostische factor: Prospectieve of retrospectieve cohortstudie start in de categorie ‘hoog’. Voor andere studieontwerpen wordt afgewaardeerd via ‘risk of bias’. |
|
|
Afwaarderen |
‘Risk of bias’ |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Inconsistentie |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Indirect bewijs |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Onnauwkeurigheid |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Publicatiebias |
- 1 Waarschijnlijk - 2 Zeer waarschijnlijk |
|
Opwaarderen |
Groot effect |
+ 1 Groot + 2 Zeer groot |
|
|
Dosis-respons relatie |
+ 1 Bewijs voor gradiënt |
|
|
Alle plausibele ‘confounding’ |
+ 1 zou een effect kunnen reduceren + 1 zou een tegengesteld effect kunnen suggereren terwijl de resultaten geen effect laten zien. |
Formuleren van de conclusies
Een conclusie verwijst niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence).
Overwegingen
Voor het komen tot een aanbeveling zijn naast de kwaliteit van het wetenschappelijk bewijs over de gewenste en ongewenste effecten van een interventie, of over de effectgrootte van een risico- of prognostische factor, vaak ook nog andere factoren van belang (Alonso-Coello et al., 2016).
Genoemd kunnen worden:
- kosten,
- waarden, voorkeuren en ervaringen van patiënten en behandelaars met betrekking tot interventies en uitkomsten van zorg,
- balans van gewenste en ongewenste effecten van interventies ten opzichte van geen of andere interventies,
- aanvaardbaarheid van interventies,
- haalbaarheid van een aanbeveling.
Bij voorkeur wordt ook voor deze aspecten naar wetenschappelijk bewijs gezocht. De werkgroep die deze richtlijn heeft opgesteld, heeft hiervan afgezien omdat de hiervoor benodigde tijd in geen enkele verhouding zou staan tot de verwachte opbrengst. De werkgroep heeft, daar waar dit noodzakelijk werd geacht, op basis van eigen ervaring en expertise de hiervoor genoemde aspecten geïnventariseerd.
Deze aspecten worden besproken na de ‘conclusie’ onder het kopje ‘overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. Dit is afhankelijk van het gewicht dat wordt toegekend aan kosten, gewenste of ongewenste effecten en andere onder de overwegingen genoemde factoren.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de bijlage Kennislacunes.
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. Tevens is de richtlijn voorgelegd aan de organisaties die ook tijdens de knelpuntanalyse betrokken waren. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Literatuurlijst
- Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089.
- Guyatt et al., 2008Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, Schünemann HJ; GRADE Working Group (2008). GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 336: 924-6.
- Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
