Kweekafname en transport voor het vaststellen van dragerschap van ESBL en pAmpC
Uitgangsvraag
Wat is het beleid rond kweekafname en transport voor het vaststellen van dragerschap van ESBL/plasmidaal AmpC-producerende Enterobacterales bij patiënten?
Aanbeveling
Gebruik minimaal feces of een rectale uitstrijk voor de detectie van dragerschap van resistente Enterobacterales. In situaties waarin dit niet kan worden afgenomen is een perirectale uitstrijk een alternatief.
Kweek daarnaast voor de follow-up van patiënten met gekende kolonisatie met resistente Enterobacterales ook de anatomische locatie waar de resistente Enterobacterales eerder werd geïsoleerd als dat relevant is.
Gebruik voor een rectale of perirectale uitstrijk een swab met een adequaat transportmedium (Stuart of Amies).
Overwegingen
Kwaliteit van bewijs
Review over multi-site screening
a) Multi-site screening in een populatie van patiënten met gekende kolonisatiestatus voor resistente Enterobacterales
De algehele kwaliteit van het bewijs is zeer laag vanwege het observationele karakter van de studies en indirectheid.
b) Multi-site screening in een populatie waarin de kolonisatie status voor resistente Enterobacterales niet bekend was
De algehele kwaliteit van het bewijs is zeer laag vanwege het observationele karakter van de studies, de geringe omvang van de studies (imprecisie) en indirectheid.
Review over vervanging rectale uitstrijk
Perineale screening versus rectale uitstrijk of feces
De algehele kwaliteit van het bewijs is matig vanwege indirectheid.
Review 3 over afnamemateriaal
De kwaliteit van bewijs is niet te beoordelen, omdat geen studie gevonden is die deze vraag heeft onderzocht.
Waarden en voorkeuren
Voor het opsporen van patiënten met kolonisatie met resistente Enterobacterales is het afnemen van rectale uitstrijken / feces de standaard praktijk. Volgens de werkgroep is de bijkomende bemonstering van andere anatomische locaties, zoals huid, keel, urine of wonden weinig of niet belastend, omdat het voor de patiënt minder ongemakkelijk en invasief is. Ook is perineale of perirectale bemonstering minder belastend, omdat het voor de patiënt minder ongemakkelijk en invasief is.
Kosten en middelen
Multi-site screening versus enkel rectale uitstrijk of feces
Structurele kosten zijn afhankelijk van detectiemethode en het aantal extra gescreende sites. De grootste kostenposten zijn verbruik van media en/of reagentia (PCR, chromogene agar, …) en bijkomende arbeid voor analisten. De verhouding tussen de kosten en de netto-baten zal sterk afhangen van de waarde van screening van bijkomende anatomische locaties om extra gevallen van kolonisatie met resistente Enterobacterales te ontdekken: indien verspreiding van resistente Enterobacterales in een uitbraaksituatie en bijkomende screeningsrondes kunnen worden voorkomen, zou de kosten/baten verhouding gunstig uitvallen. Op basis van het beschikbare bewijs kan de werkgroep geen uitspraak doen over de kosten/baten verhouding van multi-site screening tegenover rectale screening.
Vervanging rectale uitstrijk
Er worden geen verschillen in structurele kosten verwacht: het gebruik van afnamemateriaal en reagentia blijft gelijk. Indien het afnemen van een perirectale uitstrijk toelaat om resistente Enterobacterales te detecteren in een patiënt bij wie geen rectale uitstrijk zou kunnen worden afgenomen kan de kosten/baten verhouding gunstig uitdraaien. Op basis van het beschikbare bewijs kan de werkgroep geen uitspraak doen over de kosten/baten verhouding van perineale tegenover rectale screening.
Professioneel perspectief
Multi-site screening versus enkel rectale uitstrijk of feces
De bewijskracht is zeer laag dat multi-site screening (inclusief rectale screening) geassocieerd is met een klinisch relevant hoger detectiepercentage van patiënten met kolonisatie met resistente Enterobacterales in vergelijking met alleen rectale screening.
Multi-site screening in een populatie van patiënten met gekende kolonisatiestatus voor resistente Enterobacterales
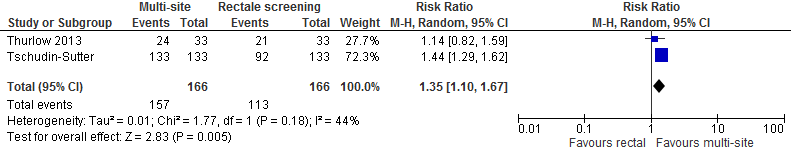
In een populatie van patiënten met gekende kolonisatie met ESBL-producerende Enterobacterales rapporteren Tschudin-Sutter et al. dat beduidend meer gekoloniseerde patiënten worden gedetecteerd als ook inguinaal en in de urine wordt gescreend versus enkel het rectum (133/133 versus 92/133). De meeste winst viel te behalen door toevoegen van urinescreening (detectie van 131/133 patiënten) (Tschudin-Sutter et al., 2012). In de studie van Thurlow et al. (eveneens in patiënten met een gekende kolonisatiestatus) en March et al. was het effect van toevoegen van urinescreening minder groot (March et al., 2010; Thurlow et al., 2013). De studie van Tchudin-Sutter et al. includeerde patiënten met een ESBL-producerende Enterobacterales in klinische monsters (afgenomen wegens verdenking infectie), wat mogelijk een verklaring kan zijn voor de hoge prevalentie in urinemonsters. Van Prehn et al vonden in een groep van 588 patiënten met gekende kolonisatie met ESBL-producerende Enterobacterales dat 86,1% van de patiënten een positieve rectale screening had. De patiënten met een negatieve rectale screening waren voornamelijk positief in respiratoire monsters, urine en puskweken (van Prehn et al., 2018). De werkgroep vindt op basis van deze gegevens dat er onvoldoende aanwijzingen zijn voor een aanpassing van de algemene screening naar resistente Enterobacterales. Bij de opvolging van patiënten met gekende kolonisatie kan het aangeraden zijn om te blijven screenen op de locatie waar de resistente Enterobacterales oorspronkelijk zijn geïsoleerd (met name in het geval van urine en sputum) (Prehn et al., 2018).
Multi-site screening in een populatie waarin de kolonisatie status voor resistente Enterobacterales niet bekend was
Er zijn onvoldoende aanwijzingen om standaard bijkomende screening op huidlokalisaties (zoals inguinale uitstrijken), keelmonsters of urine aan te raden voor de detectie van resistente Enterobacterales.
In bepaalde populaties kan het wel zijn om op basis van klinische symptomen bijkomende relevante anatomische sites of monsters te screenen voor resistente Enterobacterales (bijv. sputum bij longtransplantatie patiënten, urine (bij patiënten met een katheter), of wonden bij patiënten met chronische wonden of brandwonden.
Europese richtlijnen
De richtlijnen van de European Society of Clinical Microbiology and Infectious Diseases (ESCMID) raden een rectale of perirectale uitstrijk aan samen met bemonstering van het inguinaal gebied en sites zoals katheters en wonden (Taconelli et al., 2014). De Ierse richtlijnen (HPSC, 2014) vermelden dat screeningsmonsters van bijkomende anatomische sites (urine en drainvloeistoffen) ook geschikt kunnen zijn voor surveillance. De Belgische richtlijnen (HGR, 2019) geven aan dat afhankelijk van klinische tekens kweken van sputum, wonden of urine kunnen worden uitgevoerd. Duitse richtlijnen (RKI, 2018) vermelden dat urine en chronische wonden ook kunnen worden gescreend.
Andere richtlijnen
De HICPAC/CDC (2006) raadt aan om in een periode van geintensiveerde interventies (bijvoorbeeld bij een niet dalende prevalentie van BRMO of een eerste uitbraak) actieve surveillance uit te voeren van screening van huidlaesies, drainerende wonden, en sputum bij verdenking van een respiratoir reservoir. Canadese richtlijnen geven aan dat urinemonsters, uitstrijken van open wonden en (op indicatie) sputum en uitstrijken van kathetersites ook aangewezen kunnen zijn (PIDAC, 2013). De Australische richtlijnen voor bestrijding van CPE producerende Enterobacterales raden aan om urine te includeren in de screening, aangezien de meeste CPE-producerende Enterobacterales in de nationale Australische surveillanceprogramma’s zijn teruggevonden in urinemonsters (ACSQHC, 2013). Bijkomende Australische richtlijnen (NHMRC, 2010) raden een screening aan op multipele anatomische locaties. Voorbeelden van bijkomende anatomische locaties worden gegeven (bijvoorbeeld inguinaal, wonden,…) zonder specifieke aanbevelingen te doen. Nieuw-Zeelandse richtlijnen (ARAG, 2007) raden ook screening van chronische ulcera of wonden en urine (bij gekatheteriseerde patiënten) aan.
Vervanging rectale uitstrijk
Perineale screening versus rectale uitstrijk of feces
De bewijskracht voor het gebruik van een perineumuitstrijk als alternatief voor een rectale uitstrijk of feces is matig. Het effect is klinisch relevant en de sensitiviteit van een perineumuitstrijk is niet geschikt voor de detectie van resistente Enterobacterales. In Belgische richtlijnen wordt het gebruik van een perineumuitstrijk afgeraden voor de detectie van carbapenemase producerende Enterobacterales wegens een lage sensitiviteit (HGR, 2019).
Perirectale screening versus rectale uitstrijk of feces
De bewijskracht voor het gebruik van een perirectale uitstrijk als alternatief voor een rectale uitstrijk of feces is laag. Het gebruik van perirectale uitstrijken voor de detectie van resistente Enterobacterales is in lijn met verschillende internationale richtlijnen (HICPAC/CDC, 2006; NHMRC, 2010) waaronder ook Europese richtlijnen van ESCMID (Tacconelli et al., 2014). In enkele richtlijnen wordt het gebruik van perirectale uitstrijken echter ook afgeraden wegens een lagere sensitiviteit (ACSQHC, 2013; HGR, 2019).
Warnke et al. bestudeerden de opbrengst van perirectale en rectale uitstrijken voor Gram-negatieve organismen. Rectale uitstrijken (1 cm intra-anaal) hadden een hogere opbrengst (42,039 CFU) dan perirectale uitstrijken (16,041 CFU) (p<0,001). Het is niet duidelijk hoe deze lagere opbrengst zich vertaalt naar de detectie van specifieke microörganismen met een selectieve agar en/of ophopingsmedium.
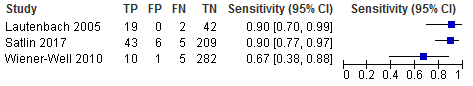
Vanwege verschillende resultaten voor E. coli en K. pneumoniae werden aparte conclusies voor deze micro-organismen geformuleerd: In studies waarbij de resistente Enterobacterales voornamelijk bestonden uit E. coli hadden perirectale uitstrijken een veelbelovende sensitiviteit (Lautenbach et al., 2005; Satlin et al., 2017). Voor de detectie van carbapenem resistente K. pneumoniae werd echter een lagere sensitiviteit (67%) gevonden voor perirectale uitstrijken in vergelijking met rectale uitstrijken (Wiener-Well et al., 2010). Mogelijk kennen verschillende soorten Enterobacterales een verschillend kolonisatiepatroon: Warnke et al. vonden in een studie naar de opbrengst van perirectale en rectale uitstrijken lagere aantallen K. pneumoniae op perirectale en rectale monsters in vergelijking met E. coli (Warnke et al., 2016). Wiener-well. et al. vermelden niet of zichtbare bevuiling van de perirectale uitstrijk een criterium was voor de verwerking van deze monsters in deze studie. Gezien de hoge klinische relevantie van de detectie van resistente K. pneumoniae weegt deze mogelijke tekortkoming van perirectale uitstrijken relatief zwaar door.
Bij het gebruik van rectale uitstrijken is zichtbare bevuiling met feces een frequent gebruikt kwaliteitscriterium, waarbij uitstrijken met zichtbare bevuiling ook een hogere opbrengst hebben voor de detectie van ESBL-producerende Enterobacteriacea (Shorten et al., 2016). In een studie voor de detectie van C. difficile met perirectale uitstrijken was de meerderheid van de perirectale uitstrijken ook zichtbaar bevuild (Rogers et al., 2013). Het is echter onduidelijk hoe vaak dit kwaliteitscriterium in de klinische praktijk kan worden gehaald en wat de rol hiervan is. De werkgroep zou het gebruik van dit kwaliteitscriterium aanraden om het risico op fout-negatieve perirectale uitstrijken te minimaliseren.
Afnamemateriaal
Swabs verschillen onderling in het aantal bacteriën dat ze kunnen opnemen en afgeven bij het enten. Kunststof swabs hebben een verbeterd afgifteprofiel en bevatten geen inhiberende substanties in vergelijking met katoenen swabs (Dadd et al., 1970). Bepaalde soorten kunststof swabs, flocked swabs, hebben een verbeterd afgifteprofiel en kunnen zorgen voor een betere diagnostiek van verschillende soorten bacteriën (Warnke et al. 2014; Tan et al. 2014). Warnke et al. vonden een hogere bacteriële opbrengst van Gram-negatieve microörganismen met flocked swabs dan met kunststof rayon swabs (50063 CFU versus 1,188 CFU) bij bemonstering van het rectum (perirectaal en rectaal) (Warnke et al., 2016).
In de huidige Nederlandse setting worden flocked swabs veelvuldig gebruikt voor microbiologische diagnostiek. De werkgroep acht het waarschijnlijk dat deze algemene prestatiekenmerken te extrapoleren zijn naar de specifieke detectie van resistente Enterobacterales, maar maakt wegens gebrek aan relevante studies geen aanbevelingen voor wat betreft het soort swab.
Verschillende transportmedia beïnvloeden de overleving van bacteriën. De flocked swab wordt in de Nederlandse setting meestal in combinatie met vloeibaar Amies medium gebruikt (Copan Eswab).
Aanvaardbaarheid en haalbaarheid van de aanbevelingen
De aanbevelingen sluiten aan op de huidige klinische praktijk en de vorige NVMM richtlijnen. De werkgroep verwacht bijgevolg dat de aanbevelingen aanvaardbaar en haalbaar zijn voor alle betrokken partijen.
Rationale van de aanbeveling(en)
Multi-site screening versus enkel rectale uitstrijk of feces
Leidend bij het opstellen van de aanbevelingen is het feit dat het heel onzeker is dat multi-site screening de detectie van het aantal patiënten gekoloniseerd met resistente Enterobacterales relevant kan verhogen in een populatie waarvan de kolonisatiestatus niet gekend is.
In een patiëntenpopulatie die gekend is met kolonisatie met resistente Enterobacterales was het feit doorslaggevend dat meerdere studies aantoonden dat rectale screening alleen een relatief lage sensitiviteit kent bij de opvolging van patiënten waarbij de resistente Enterobacterales oorspronkelijk op een andere anatomische locatie werden geïsoleerd.
De aanbeveling sluit aan bij de Nederlandse praktijk en is in lijn met internationale richtlijnen.
Vervanging rectale uitstrijk
Het feit dat perirectale uitstrijken mogelijk een lagere sensitiviteit hebben voor de detectie van resistente K. pneumoniae, een klinisch zeer relevante species, weegt zwaar door bij het formuleren van de aanbeveling.
Afnamemateriaal
Leidend bij het opstellen van de aanbevelingen was het feit dat er geen studies werden gevonden die verschillende soorten afnamematerialen met elkaar vergeleken voor de detectie van resistente Enterobacterales.
Onderbouwing
Achtergrond
De frequentst aanbevolen monsters voor surveillancescreening van resistente Enterobacterales (met name ESBL en carbapenemase producerende organismen) zijn rectale uitstrijken en feces. In sommige richtlijnen wordt ook de mogelijkheid vermeld om op andere anatomische locaties te screenen als toevoeging op de rectale screening, zoals uitstrijken ter hoogte van de liezen (HICPAC, 2006; ACSQHC, 2013) of klinische monsters (wonden, vasculaire katheters, urine etc.) (HICPAC, 2006; ACSQHC, 2013; HGR, 2019). Conform sommige richtlijnen (HICPAC, 2006; NHMRC, 2010) kan ook een perirectale uitstrijk worden afgenomen als alternatief voor een rectale uitstrijk.
In deze module wordt onderzocht wat de toegevoegde waarde is van screening voor resistente Enterobacterales op anatomische locaties buiten het rectum. Daarnaast wordt onderzocht of een perirectale uitstrijk of perineumuitstrijk geschikte alternatieven zijn voor rectale uitstrijken en/of feces en wat het geschikte afnamemateriaal is om dragerschap van resistente Enterobacterales aan te tonen.
Voor de definities ‘rectale uitstrijk’, ‘perirectale uitstrijk’, ‘perineumuitstrijk’ en ‘resistente Enterobacterales’ zie de bijlage Definities en begrippen.
Conclusies / Summary of Findings
Ad PICO-vraagstelling 1: review multi-site screening versus enkel rectale uitstrijk of feces
|
Zeer laag GRADE |
Populatie van patiënten met gekende kolonisatiestatus voor resistente Enterobacterales
Aantal gedetecteerde patiënten met kolonisatie met resistente Enterobacterales Multisite screening lijkt de detectie van het aantal patiënten positief voor resistente Enterobacterales aanzienlijk te verhogen in vergelijking met alleen rectale screening in een populatie met een positieve kolonisatiestatus op multiresistente Enterobacterales.
Bron: Thurlow et al., 2013; Tschudin-Sutter et al., 2012 |
|
Zeer laag GRADE |
Populatie waarin de kolonisatie status voor resistente Enterobacterales niet bekend was
Aantal gedetecteerde patiënten met kolonisatie met resistente Enterobacterales Het is heel onzeker dat multisite screening de detectie van het aantal patiënten positief voor resistente Enterobacterales verhoogt in vergelijking met alleen rectale screening in een populatie waarin de kolonisatiestatus niet gekend is.
Bron: March et al., 2010; Rattanaumpawan et al., 2018 |
Ad PICO-vraagstelling 2: review perirectale of perineumuitstrijk versus rectale uitstrijk of feces
|
Matig |
Perineumuitstrijk versus rectale uitstrijk of feces
Het gebruik van een perineumuitstrijk voor de detectie van resistente Enterobacterales (voornamelijk E. coli) heeft waarschijnlijk een lagere sensitiviteit dan een rectale uitstrijk.
Bron: Dyakova et al., 2017 |
|
Matig |
Perirectale uitstrijk versus rectale uitstrijk of feces
Het gebruik van een perirectale uitstrijk voor de diagnostiek van (voornamelijk) resistente E. Coli lijkt een vergelijkbare sensitiviteit te hebben als feces of een rectale uitstrijk
Bron: Lautenbach et al., 2005; Satlin et al., 2017
Het gebruik van een perirectale uitstrijk voor de diagnostiek van resistente Klebsiella pneumoniae heeft mogelijk een lagere sensitiviteit dan feces of rectale uitstrijk
Bron: Wiener-Well et al., 2010 |
Ad PICO-vraagstelling 3: review - Flocked swabs met Amies liquid (ESwab) versus andere afnamematerialen
|
- |
Er werden geen studies gevonden die verschillende soorten afnamemateriaal vergeleken voor de detectie van dragerschap met resistente Enterobacterales. |
Samenvatting literatuur
Ad PICO-vraagstelling 1: review multi-site screening versus enkel rectale uitstrijk of feces
Ter informatie:
- Zie de evidence tabellen voor gedetailleerde informatie over het risico op bias per studie. Voor gedetailleerde informatie betreffende studiepopulatie, interventie, uitkomstmaten en resultaten zie de evidence tabellen. Voor deze samenvatting zijn in elke studie alleen de data geëxtraheerd die betrekking hebben op de huidige PICO vraagstelling.
- De PICO-vraag is een interventievraag op het domein van diagnostiek en valt niet onder het paradigma diagnostisch accuraatheidsonderzoek, omdat dit laatste veronderstelt dat de referentietest onfeilbaar is.
Onderzoeksdesign
Alle geïncludeerde studies zijn observationele niet-gerandomiseerde studies. Zie de evidence tabellen voor de oorspronkelijke opzet van de studies.
Land waar studie is verricht
Tabel 2. Land waar studie is verricht
|
Studie verricht in |
Aantal studies |
|
Italië |
1 studie (March et al., 2010) |
|
Thailand |
1 studie (Rattanaumpawan et al., 2018) |
|
Verenigde staten |
1 studies (Thurlow et al., 2013) |
|
Zwitserland |
1 studie (Tschudin-Sutter et al., 2012) |
Studiepopulaties
Tabel 3. Studiepopulaties waarover data geëxtraheerd is
|
Studie referentie |
Studiepopulatie |
|
Thurlow et al., 2013 |
Patiënten met een gekende kolonisatiestatus voor K. pneumoniae carbapenemase (KPC)-producerende Enterobacterales (n=33). De controle en interventie werden uitgevoerd in dezelfde populatie. |
|
March et al., 2010 |
Inwoners van een ‘long term care facility’ (n=111). De controle en interventie werden uitgevoerd in dezelfde populatie. |
|
Rattanaumpawan et al., 2018 |
Patiënten die werden opgenomen in het ziekenhuis (n=487). De controle en interventie werden uitgevoerd in dezelfde populatie. |
|
Tschudin-Sutter et al., 2012 |
Patiënten met ESBL producerende Enterobacterales in een klinische kweek (n = 133). De controle en interventie werden uitgevoerd in dezelfde populatie. |
De studiepopulaties zijn heterogeen ten aanzien van het achtergrondrisico op dragerschap van resistente Enterobacterales. Twee studies onderzochten patiënten waarvan de kolonisatiestatus met resistente Enterobacterales gekend was: Thurlow (2013) maakten een selectie van patiënten op basis van gekende kolonisatiepatronen in het rectum en klinische monsters en Tschudin-Sutter (2012) includeerden alleen patiënten waarbij ESBL-producerende Enterobacterales in klinische kweken werden gevonden. Twee studies onderzochten patiënten zonder dat de kolonisatie status bekend was (March et al., 2010; Rattanaumpawan et al., 2018).
Afnamemateriaal
Één studie maakte gebruik van kunststof (Dacron) swabs in Stuart transportmedium (Thurlow et al., 2013). Drie studies specificeerden het afnamemateriaal niet (March et al., 2010; Rattanaumpawan et al., 2018; Tschudin-Sutter et al., 2012).
Detectiemethodes
Alle vijf studies detecteerden resistente Enterobacterales op basis van kweek (zie de evidence tabellen). Twee studies gebruikten commerciële selectieve agars (March 2010 et al., Tschudin-Sutter et al., 2012). Thurlow et al. (2013) gebruikten een direct-ertapenem disk methode voor de detectie van KPC-producerende Enterobacterales en Rattanaumpawan et al. (2018) gebruikten MacConkey agar met ceftriaxon. Één studie maakte gebruik van een ophopingsmedium (Thurlow et al., 2013).
Interventies
Alle vier studies vergeleken multi-site screening (inclusief rectale screening) met rectale screening alleen. De anatomische locaties die deel uitmaakten van een multi-site screening verschilden tussen de studies (zie tabel 4 hieronder).
Definities
Rectale screening werd gedefinieerd als een rectale uitstrijk, feces, of een combinatie van beide.
Tabel 4. Definitie van multi-site screening in de verschillende studies
|
Studie referentie |
Thurlow et al., 2013
|
March et al., 2010
|
Rattanaumpawan et al., 2018 |
Tschudin-Sutter et al., 2012 |
|
Anatomische sites die deel uitmaken van multi-site screening |
|
|
|
|
Definitie resistente Enterobacterales
|
Studie referentie |
Definitie resistente Enterobacterales |
|
Thurlow et al., 2013 |
KPC-producerende Enterobacterales (verificatie met PCR voor KPC) |
|
March et al., 2010 |
ESBL-producerende Enterobacterales (verificatie met fenotypische methoden) |
|
Rattanaumpawan et al., 2018 |
ESBL-producerende Enterobacterales (verificatie met fenotypische methoden) |
|
Tschudin-Sutter et al., 2012 |
ESBL-producerende Enterobacterales (verificatiemethode niet gerapporteerd) |
Resultaten voor de uitkomstmaat ‘aantal patiënten positief voor kolonisatie met resistente Enterobacterales’
a) Multi-site screening in een populatie van patiënten met gekende kolonisatiestatus voor resistente Enterobacterales
Twee studies onderzochten de methode van screening in een populatie waarvan de kolonisatiestatus van resistente Enterobacterales gekend was. Bij beide studies waren de resultaten in het voordeel van multi-site screening. Pooling van de twee studies liet een 35% toename zien in het aantal gedetecteerde patiënten met kolonisatie met resistente Enterobacterales ten voordele van multi-site screening, met een spreiding van minimaal 10% toename tot maximaal 67% toename: RR 1,35; BI 1,10 tot 1,67.
In absolute termen betekent dat dat het aantal BRMO detecties toeneemt van 680 per 1000 naar 918 per 1000 wanneer men naast rectale screening ook op andere anatomische locaties screent. Het 95% BI geeft aan dat screening op ook andere anatomische locaties in het beste geval resulteert in een toename van 456 per 1000 en in het slechtste geval in een toename van 68 per 1000. Ter informatie: de werkgroep zou een toename van 68/1000 klinisch relevant vinden.
b) Multi-site screening in een populatie waarin de kolonisatie status voor resistente Enterobacterales niet bekend was
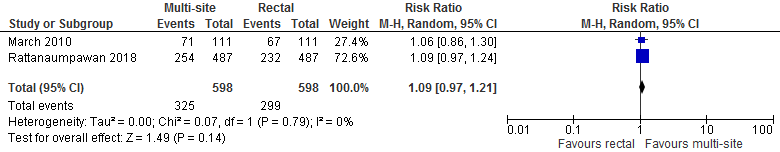
Twee studies onderzochten een populatie waarin de kolonisatiestatus met resistente Enterobacterales niet bekend was. Pooling van de twee studies liet een 9% toename in het aantal gekoloniseerde patiënten zien ten voordele van de multi-site screening: RR 1,09; 95% BI 0,97 tot 1,21 (zie figuur hieronder). 9% reductie is de beste schatting van het effect van multisite screening. De ondergrens ((RR: 0.97) van het 95% betrouwbaarheidsinterval laat echter zien dat de omvang van de studies te gering was om een ongunstig effect van multisite screening uit te sluiten.
In absolute termen geformuleerd: een absolute reductie van 45 per 1000 (95% BI: -0.015; +0.105) is de beste schatting van het effect van multi-site screening. De ondergrens (-15 per 1000) van het betrouwbaarheidsinterval laat echter zien dat de omvang van de studies te gering was om een ongunstig effect van multi-site screening uit te sluiten. Ter info: de werkgroep zou een toename van 45/1000 klinisch relevant vinden.
Bewijskracht van de literatuur
De werkgroep heeft de kwaliteit van bewijs beoordeeld volgens de GRADE-methodiek. Voor studies over interventies (multi-site screening versus rectale screening) starten gerandomiseerde onderzoeken in de categorie hoog en observationele studies in de categorie laag. Het bewijs werd per uitkomstmaat getoetst aan de volgende criteria: beperkingen in studie opzet (risico op bias), inconsistentie, indirectheid, onnauwkeurigheid en publicatiebias.
Aantal patiënten gekoloniseerd met resistente Enterobacterales
a. ten aanzien van screening in een populatie van patiënten met gekende kolonisatiestatus voor resistente Enterobacterales
Vanwege het observationele karakter van de onderzoeken start de kwaliteit van het bewijs voor de uitkomstmaat laag. De bewijskracht werd afgewaardeerd van laag naar zeer laag omdat men resistente Enterobacterales in Nederland op een andere manier detecteert dan in de studies (enkel in één studie werd een ophopingsmedium gebruikt). Er is sprake van matige statistische heterogeniteit (I2 = 44%). De werkgroep heeft hiervoor echter niet afgewaardeerd, omdat beide puntschatters in dezelfde richting wijzen. De studies onderzochten CPE- en ESBL-producerende Enterobacterales. De werkgroep denkt dat de studieresultaten ook extrapoleerbaar zijn naar plasmidaal AmpC-producerende Enterobacterales, omdat er niet wordt verwacht dat het kolonisatiepatroon gebonden is aan resistentiemechanismen.
b) ten aanzien van screening waarin de kolonisatie status niet bekend was
Vanwege het observationele karakter van de onderzoeken start de kwaliteit van het bewijs voor de uitkomstmaat laag. De bewijskracht werd afgewaardeerd van laag naar zeer laag, omdat het 95% BI geen effect (RR=1) insluit en men resistente Enterobacterales in Nederland op een andere manier detecteert dan in de studies (gebruik van een ophopingsmedium) (indirectheid). De studies onderzochten CPE- en ESBL-producerende Enterobacterales. De werkgroep denkt dat de studieresultaten ook extrapoleerbaar zijn naar plasmidaal AmpC-producerende Enterobacterales, omdat er niet wordt verwacht dat het kolonisatiepatroon gebonden is aan resistentiemechanismen.
Ad PICO-vraagstelling 2: review perirectale of perineumuitstrijk versus rectale uitstrijk of feces
Ter informatie:
- Zie de evidence tabellen voor gedetailleerde informatie over het risico op bias per studie (beoordeling met QUADAS-2). Voor gedetailleerde informatie betreffende studiepopulatie, interventie, uitkomstmaten en resultaten zie de evidence tabellen. Voor deze samenvatting zijn in elke studie alleen de data geëxtraheerd die betrekking hebben op de huidige PICO vraagstelling.
Onderzoeksdesign
Alle geïncludeerde studies zijn cross-sectionele onderzoeken (of cross-sectionele data werd geëxtraheerd). Zie de evidence tabellen voor de oorspronkelijke opzet van de studies.
Land waar studie is verricht
Tabel 2. Land waar studie is verricht
|
Studie verricht in |
Aantal studies |
|
Verenigd Koninkrijk |
1 studie (Dyakova et al., 2017) |
|
Verenigde staten |
2 studies (Satlin et al., 2017; Lautenbach et al., 2005) |
|
Israël |
1 studie (Wiener-Well et al., 2010) |
Studiepopulaties
Tabel 3. Studiepopulaties waarover data geëxtraheerd is
|
Studie referentie |
Studiepopulatie |
|
Dyakova et al. 2017 |
In ziekenhuis opgenomen patiënten waarbij een rectale en een perineumuitstrijk werden afgenomen (n=4006) (Prevalentie resistente Enterobacterales: 6,9%) |
|
Lautenbach et al. 2005 |
In ziekenhuis opgenomen patiënten waarbij feces en een perirectale uitstrijk werden afgenomen (n=63) (Prevalentie resistente Enterobacterales: 33,3%) |
|
Satlin et al. 2017 |
Patiënten met acute leukemie en stamceltransplantatiepatiënten waarbij feces en een perirectale uitstrijk werden afgenomen (n=137) (161 gepaarde monsters) (Prevalentie resistente Enterobacterales: 20,5%) |
|
Wiener-Well et al., 2010 |
In ziekenhuis opgenomen patiënten waarbij een rectale en perirectale uitstrijk werden afgenomen (n=298) (Prevalentie resistente Enterobacterales: 5,0%) |
Definitie resistente Enterobacterales
Tabel 4. Definitie van resistente Enterobacterales
|
Studie referentie |
Definitie resistente Enterobacterales |
|
Dyakova et al. 2017 |
ESBL-producerende Enterobacterales (fenotypisch) |
|
Lautenbach et al. 2005 |
Fluoroquinolone resistente E. coli |
|
Satlin et al. 2017 |
Fluoroquinolone resistente Enterobacterales; Ceftriaxon resistente Enterobacterales |
|
Wiener-Well et al. 2010 |
Carbapenem-resistente K. pneumoniae |
Afnamemateriaal
Twee studies maakten gebruik van flocked swabs (Becton Dickinson en Copan) (Dyakova et al. 2017; Satlin et al., 2017). Twee studies specifieerden het afnamemateriaal niet (Lautenbach et al. 2005; Wiener-Well et al., 2010).
Detectiemethodes
Alle vier studies detecteerden resistente Enterobacterales op basis van kweek (zie de evidence tabellen). Voor de detectie van Enterobacterales met een ESBL fenotype werden commerciële chromogene media gebruikt (Dyakova et al. 2017; Satlin et al. 2017). De detectie van fluoroquinolone resistente Enterobacterales gebeurde met MacConkey agar gesupplementeerd met een fluoroquinolone (Lautenbach et al. 2005; Satlin et al. 2017). Detectie van carbapenemase producerende K. pneumoniae gebeurde met MacConkey agar gesupplementeerd met 1µg/ml meropenem (Wiener-Well et al., 2010). Één studie maakte gebruik van een ophopingsmedium (Wiener-Well et al., 2010).
Resultaten
a. Resultaten voor perineumuitstrijk versus rectale uitstrijk of feces
Perineumuitstrijken hadden een sensitiviteit van 42% (95% betrouwbaarheidsinterval (BI) 37% tot 48%). De referentietest was een rectale uitstrijk (Dyakova et al., 2017). De resistente Enterobacterales in deze studie bestonden voornamelijk uit E. coli (79,3%).

b. Resultaten voor perirectale uitstrijk versus rectale uitstrijk of feces
Drie studies onderzochten de diagnostische waarde van perirectale uitstrijken voor de opsporing van resistente Enterobacterales. In studies waarbij de resistente Enterobacterales voornamelijk bestonden uit E. coli (Lautenbach (2005): 100% E. coli; Satlin (2017): 70% E. coli) werd in beide studies een sensitiviteit gevonden van 90% (95% BI 70-77% tot 97-99%). In één studie waarbij de resistente Enterobacterales voornamelijk bestonden uit K. pneumoniae (Wiener-Well (2010): 100% K. pneumoniae) werd een sensitiviteit gevonden van 67% (95% BI 38% tot 88%).
Bewijskracht van de literatuur
De werkgroep heeft de kwaliteit van bewijs beoordeeld volgens een GRADE-like methodiek. Ten aanzien van diagnostisch accuratessevragen starten studies met een cross-sectioneel design in de categorie hoog. Het bewijs werd getoetst aan de volgende criteria: beperkingen in studie opzet (risico op bias), inconsistentie, indirectheid, onnauwkeurigheid en publicatiebias.
Perineumuitstrijk versus rectale uitstrijk of feces
De bewijskracht werd afgewaardeerd van hoog naar matig wegens de onzekerheid of de studieresultaten extrapoleerbaar zijn naar de Nederlandse situatie, omdat de detectiemethoden in Nederland niet volledig overeenkomen met deze in de studies (er werd geen ophopingsmedium gebruikt) (indirectheid).
De studies onderzochten CPE- en ESBL-producerende Enterobacterales. De werkgroep denkt dat de studieresultaten ook extrapoleerbaar zijn naar plasmidaal AmpC-producerende Enterobacterales, omdat er niet wordt verwacht dat het kolonisatiepatroon gebonden is aan resistentiemechanismen.
Perirectale uitstrijk versus rectale uitstrijk of feces
De bewijskracht werd afgewaardeerd van hoog naar matig wegens de onzekerheid of de studieresultaten extrapoleerbaar zijn naar de Nederlandse situatie, omdat de detectiemethoden in Nederland niet volledig overeenkomen met deze in de studies (er werd geen ophopingsmedium gebruikt in de meeste studies) (indirectheid).
De studies onderzochten CPE- en ESBL-producerende Enterobacterales. De werkgroep denkt dat de studieresultaten ook extrapoleerbaar zijn naar plasmidaal AmpC-producerende Enterobacterales, omdat er niet wordt verwacht dat het kolonisatiepatroon gebonden is aan resistentiemechanismen.
Ad PICO-vraagstelling 3: review - Flocked swabs met Amies liquid (ESwab) versus andere afnamematerialen
Er werden geen studies gevonden die verschillende soorten afnamemateriaal vergeleken voor de detectie van patiënten gekoloniseerd met resistente Enterobacterales
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden heeft de werkgroep drie systematische literatuuranalyses verricht met de volgende PICO-vraagstellingen:
- Wat is het effect van multi-site screening* op het aantal gedetecteerde patiënten met dragerschap van resistente Enterobacterales in vergelijking met screening met enkel een rectale uitstrijk of feces?
- Kan de rectale uitstrijk worden vervangen door een perirectale of een perineumuitstrijk om dragerschap van resistente Enterobacterales aan te tonen?
- Wat is geschikt afnamemateriaal om dragerschap van resistente Enterobacterales aan te tonen?
* multi-site: rectale screening plus minimaal bemonstering van een andere anatomische locatie (huid, keel, urine, wonde etc.)
Tabel 1. Selectiecriteria PICO 1/2/3
|
Type studies |
Review 1 over multi-site screening
Review 2 over vervanging rectale uitstrijk, Review 3 over afnamemateriaal
|
|
Type patiënten |
|
|
Interventie resp. Indextest |
Review 1 over multi-site screening
Review 2 over vervanging rectale uitstrijk
Review 3 over afnamemateriaal
|
|
Controle resp. Referentietest |
Review 1 over multi-site screening
Review 2 over vervanging rectale uitstrijk
Review 3 over afnamemateriaal
|
|
Type uitkomstmaten |
Review 1 over multi-site screening
Review 2 over vervanging rectale uitstrijk, Review 3 over afnamemateriaal
|
|
Type setting |
|
|
Exclusiecriteria |
|
Ter info (review 3): voor deze diagnostische vraagstelling wordt de sensitiviteit gerapporteerd. Voor de specificiteit geldt: in de klinische praktijk vertegenwoordigt een positieve perirectale uitstrijk en een negatieve rectale uitstrijk of feces geen ‘false positive maar een ‘true positive’. De specificiteit wordt dus niet als nuttige parameter gezien in deze context.
Review 1 over multi-site screening
In de databases Medline (OVID), Embase and Cochrane is een systematische search verricht. Zie de zoekverantwoording. Na ontdubbeling van de zoekresultaten leverde de literatuurzoekactie 1027 treffers op. Studies die voldeden aan de selectiecriteria in tabel 1 zijn opgenomen in de samenvatting van de literatuur. 16 studies werden geselecteerd op basis van titel en abstract. Bijkomend werden 3 studies gevonden door middel van handmatig zoeken (referentielijsten van gevonden studies en richtlijnen). Na het lezen van de volledige artikelen werden uit een totaal van 19 studies uiteindelijk 4 studies opgenomen in de literatuuranalyse (March et al., 2010; Rattanaumpawan et al., 2018; Thurlow et al., 2013; Tschudin-Sutter et al., 2012). In de evidence tabellen staan de redenen van exclusie van de andere 15 studies vermeld.
Review 2 over vervanging rectale uitstrijk
In de databases Medline (OVID), Embase and Cochrane is een systematische search verricht. Zie de zoekverantwoording. Na ontdubbeling van de zoekresultaten leverde de literatuurzoekactie 580 treffers op. Studies die voldeden aan de selectiecriteria in tabel 1 zijn opgenomen in de samenvatting van de literatuur. 4 studies werden geselecteerd op basis van titel en abstract. Na het lezen van de volledige artikelen werd hiervan uiteindelijk 1 studie opgenomen in de literatuuranalyse (Dyakova et al., 2017). In de evidence tabellen staan de redenen van exclusie van de andere 3 studies vermeld. Referentiecheck leverde 3 extra artikelen op (Lautenbach et al., 2005; Satlin et al., 2017; Wiener-Well et al., 2010).
Review 3 over afnamemateriaal
In de databases Medline (OVID), Embase and Cochrane is een systematische search verricht. De zoekverantwoording is weergegeven in de evidence tabellen. Na ontdubbeling van de zoekresultaten leverde de literatuurzoekactie 701 treffers op. Er werden geen studies gevonden die voldeden aan de selectiecriteria.
Referenties
- Antibiotic Resistance Advisory Group (ARAG). 2007. Guidelines for the Control of Multidrug-resistant Organisms in New Zealand. New Zealand.
- Australian Commission on Safety and Quality in Health Care (ACSQHC). 2017. Recommendations for the control of carbapenemase-producing Enterobacteriaceae (CPE). A guide for acute care health facilities. Sydney, Australia
- Dadd, A., Dagnall, V., Everall, P. and Jones, A. 1970. The Survival Of Streptococcus Pyogenes On Bacteriological SwaBs Made From Various Fibres. Journal of Medical Microbiology, 3(4), pp.561-572
- Dyakova, E., Bisnauthsing, K., Querol-Rubiera, A., Patel, A., Ahanonu, C., Tosas Auguet, O., Edgeworth, J., Goldenberg, S. and Otter, J. 2017. Efficacy and acceptability of rectal and perineal sampling for identifying gastrointestinal colonization with extended spectrum β-lactamase Enterobacteriaceae. Clinical Microbiology and Infection, 23(8), pp.577.e1-577.e3.
- Health Protection Surveillance Centre (HPSC). 2014. Guidelines for the Prevention and Control of Multi-drug resistant organisms (MDRO) excluding MRSA in the healthcare setting. Ireland.
- Healthcare Infection Control Practices Advisory Committee (HICPAC). 2006. Management of Multidrug-Resistant Organisms in Healthcare Settings. United States of America.
- Hoge Gezondheidsraad (HGR). 2019. Aanbevelingen inzake preventie, beheersing en aanpak van patiënten die drager zijn van tegen antibiotica multiresistente organismen (mdro) in zorginstellingen. België.
- Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) beim Robert Koch-Institut (RKI). 2012. Hygienemaßnahmen bei Infektionen oder Besiedlung mit multiresistenten gramnegativen Stäbchen.Deutschland.
- Lautenbach, E., Harris, A., Perencevich, E., Nachamkin, I., Tolomeo, P. and Metlay, J. (2005). Test Characteristics of Perirectal and Rectal Swab Compared to Stool Sample for Detection of Fluoroquinolone-Resistant Escherichia coli in the Gastrointestinal Tract. Antimicrobial Agents and Chemotherapy, 49(2), pp.798-800
- March, A., Aschbacher, R., Dhanji, H., Livermore, D., Böttcher, A., & Sleghel, F. et al. 2010. Colonization of residents and staff of a long-term-care facility and adjacent acute-care hospital geriatric unit by multiresistant bacteria. Clinical Microbiology And Infection, 16(7), 934-944
- National Health and Medical Research Council (NHMRC). 2010. Australian Guidelines for the Prevention and Control of Infection in Healthcare. Australia
- Ontario Agency for Health Protection and Promotion, Provincial Infectious Diseases Advisory Committee (PIDAC). 2013. Annex A – Screening, testing and surveillance for antibiotic-resistant organisms (AROs). Annexed to: Routine Practices and Additional Precautions in All Health Care Settings. Toronto, Canada
- Rattanaumpawan, P., Choorat, C., Takonkitsakul, K., Tangkoskul, T., Seenama, C., & Thamlikitkul, V. 2018. A prospective surveillance study for multidrug-resistant bacteria colonization in hospitalized patients at a Thai University Hospital. Antimicrobial Resistance & Infection Control, 7(1).
- Rogers, D., Kundrapu, S., Sunkesula, V., & Donskey, C. 2013. Comparison of Perirectal versus Rectal Swabs for Detection of Asymptomatic Carriers of Toxigenic Clostridium difficile. Journal Of Clinical Microbiology, 51(10), 3421-3422. doi: 10.1128/jcm.01418-13
- Satlin, M., Hovan, M., Westblade, L., Calfee, D., Walsh, T., Kreiswirth, B. and Jenkins, S. 2017. Comparison of Perianal Swab and Stool Samples for Detection of Gastrointestinal Colonization with Ceftriaxone-Resistant and Fluoroquinolone-Resistant Enterobacteriaceae. Open Forum Infectious Diseases, 4(suppl_1), pp.S605-S606
- Shorten, R., Ashcroft, P., & Dodgson, A. 2016. Rectal swab screening for the detection of carriage of carbapenemase-producing Enterobacteriaceae. Journal Of Hospital Infection, 94(2), 131-132.
- Tacconelli, E., Cataldo, M., Dancer, S., De Angelis, G., Falcone, M., & Frank, U. et al. 2014. ESCMID guidelines for the management of the infection control measures to reduce transmission of multidrug-resistant Gram-negative bacteria in hospitalized patients. Clinical Microbiology And Infection, 20, 1-55.
- Tan TY, Yong Ng LS, Fang Sim DM, Cheng Y, Hui Min MO. 2014. Evaluation of bacterial recovery and viability from three different swab transport systems. Pathology 46:230–233.
- Thurlow, C., Prabaker, K., Lin, M., Lolans, K., Weinstein, R., & Hayden, M. 2013. Anatomic Sites of Patent Colonization and Environmental Contamination with Klebsiella pneumoniae Carbapenemase—Producing Enterobacteriaceae at Long-Term Acute Care Hospitals. Infection Control & Hospital Epidemiology, 34(1), 56-61.
- Tschudin-Sutter, S., Frei, R., Dangel, M., Stranden, A., & Widmer, A. 2012. Sites of Colonization with Extended-Spectrum β-Lactamases (ESBL)-Producing Enterobacteriaceae: The Rationale for Screening. Infection Control & Hospital Epidemiology, 33(11), 1170-1171.
- van Prehn, J., Kaiser, A., van der Werff, S., van Mansfeld, R., & Vandenbroucke-Grauls, C. 2018. Colonization sites in carriers of ESBL-producing Gram-negative bacteria. Antimicrobial Resistance & Infection Control, 7(1).
- Warnke P, Warning L, Podbielski A. 2014. Some Are More Equal - A Comparative Study on Swab Uptake and Release of Bacterial Suspensions. PLoS One 9:e102215.
- Warnke, P., Johanna Pohl, F., Kundt, G., & Podbielski, A. 2016. Screening for Gram-negative bacteria: Impact of preanalytical parameters. Scientific Reports, 6(1). doi: 10.1038/srep30427
- Wiener-Well, Y., Rudensky, B., Yinnon, A., Kopuit, P., Schlesinger, Y., & Broide, E. et al. 2010. Carriage rate of carbapenem-resistant Klebsiella pneumoniae in hospitalised patients during a national outbreak. Journal Of Hospital Infection, 74(4), 344-349. doi: 10.1016/j.jhin.2009.07.022
Evidence tabellen
PICO 1
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Thurlow 2013
|
Type of study: Cross-sectional
Setting: Long-term acute care hospital in Chicago metropolitan area.
Country: United States
Source of funding: NR |
Inclusion criteria: Patients with known colonization status receiving multi-site screening for resistant Enterobacterales (KPC-producing Enterobacterales)
Exclusion criteria: NR
N total at baseline (total 33): I: 33 C: 33 Patients in the control- and intervention group were the same.
Important prognostic factors2: NA
Groups comparable at baseline? NA |
Screening for resistant Enterobacterales (KPC-producing Enterobacterales) at all of the following anatomical sites:
|
Screening for resistant Enterobacterales (KPC-producing Enterobacterales)with only a rectal swab
|
Length of follow-up: NA
Loss-to-follow-up: NA
Incomplete outcome data: NA
|
Patients colonized with resistant Enterobacterales: I: 24/33 C: 21/33
Subpopulation in which intervention was inguinal swab + rectal swab: I: 24/33 C: 21/33
|
Population chosen in advance on the basis of negative/positive rectal swabs and clinical samples. |
|
March 2010
|
Type of study: Cross-sectional
Setting: Long-term care facility in Bolzano Country: Italy
Source of funding: NR
|
Inclusion criteria: Residents receiving multi-site screening for resistant Enterobacterales (ESBL producing Enterobacterales)
Exclusion criteria: NR
N total at baseline (total 111): I: 111 C: 111 Patients in the control- and intervention group were the same
Important prognostic factors: NA
Groups comparable at baseline? NA |
Screening for resistant Enterobacterales (ESBL) at all of the following anatomical sites:
|
Screening for resistant Enterobacterales (ESBL) in only a rectal swab
|
Length of follow-up: NA
Loss-to-follow-up: NA
Incomplete outcome data: NR |
Patients colonized with resistant Enterobacterales: I: 71/111 C: 67/111
Subpopulation in which intervention was inguinal swab + rectal swab I: 69/111 C: 67/111
Subpopulation in which intervention was urine+ rectal swab I: 70/111 C: 67/111
Subpopulation in which intervention was oropharyngeal swab + rectal swab I: 67/111 C: 67/111
|
Amount of patients calculated with given percentages and total number of patients |
|
attanaumpawan 2018 |
Type of study: Cross-sectional (extracted data)
Setting: eight general medical wards at Siriraj Hospital(university hospital)
Country: Thailand
Source of funding: Faculty of Medicine Siriraj Hospital and Health Systems Research Institute (Thailand)
|
Inclusion criteria: Patients receiving multi-site screening for resistant Enterobacterales (ESBL).
Exclusion criteria: NR
N total at baseline (total 487): I: 487 C: 487 Patients in the control- and intervention group were the same
Important prognostic factors: NA
Groups comparable at baseline? NA |
Screening for resistant Enterobacterales (ESBL) at all of the following anatomical sites:
|
Screening for resistant Enterobacterales (ESBL) in only a rectal swab
|
Length of follow-up: NA
Loss-to-follow-up: NA
Incomplete outcome data: NR |
Patients colonized with resistant Enterobacterales: I: 254/487 C: 232/487
|
|
|
Tschudin-Sutter 2012 |
Type of study: Cross-sectional (period prevalence)
Setting: University Hospital Basel
Country: Switzerland
Source of funding: University Hospital Basel funded in part the microbiological analyses of the samples as part of the quality improvement program |
Inclusion criteria: Patients with resistant Enterobacterales (ESBL) in a clinical specimen and receiving multi-site screening
Exclusion criteria: NR
N total at baseline (total 133): I: 133 C: 133 Patients in the control- and intervention group were the same
Important prognostic factors: NA
Groups comparable at baseline? NA |
Screening for resistant Enterobacterales (ESBL) in only a rectal swab
|
Screening for resistant Enterobacterales (ESBL) in only a rectal swab
|
Length of follow-up: NA
Loss-to-follow-up: NA
Incomplete outcome data: NR |
Patients colonized with resistant Enterobacterales: I: 133/133 C: 92/133
Rectal swab + urine I: 131/133 C: 92/133
Rectal swab + inguinal I: 93/133 C: 92/133
|
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
|
Study references |
Collection material |
Isolation method |
Method of identification |
Method of susceptibility testing |
Use of enrichment broth? |
Definition of resistant Enterobacterales: |
|
Thurlow 2013 |
Sterile double Dacron swabs (Becton Dickinson) moistened in modified Stuart’s medium (skin sites) Single Dacron swabs (Becton Dickinson) were used for rectal swabbing. For urine sampling, swabs were dipped in urine. |
Direct-ertapenem disk method. Growth in enrichment broth was plated on MacConkey agar (Remel) |
MicroScan Walkaway System (Siemens) |
blaKPC was identified with PCR |
Tryptic soy broth with 2µg/mL meropenem (only for skin sites) |
KPC producing Enterobacteriacea (verified by PCR) |
|
March 2010 |
Swabs and other collection material not further specified. |
ChromID ESBL (BioMérieux) |
Vitek 2 System (bioMérieux) |
Vitek 2 System (bioMérieux) b-lactamase-diag-nostic Etests (cefotetan/cefotetan + cloxacillin for AmpC; im-ipenem/imipenem + EDTA for MBLs; and cefotaxime/cefotaxime + clavulanate, ceftazidime/ceftazidime + clavula-nate and cefepime/cefepime + clavulanate for ESBLs; all threewere from AB Biodisk, Solna, Sweden). In addition, Hodge/clover leaf plates were used for carbapenem-resistant iso-lates. MICs for MBL producers and ESBL-producing E. coli isolates were reconfirmed by agar dilution |
No |
ESBL producing Enterobacterales
|
|
Rattanaumpawan 2018 |
Swabs not specified. Stuart transport medium |
MacConkey agar supplemented with ceftriaxone |
Species identification was performed using conventional biochemical tests. Identification of ESBL-producing bacteria was confirmed using the combination disc method |
Antimicrobial susceptibility testing was performed using the disc diffusion method |
No |
ESBL-producing Enterobacterales |
|
Tschudin-Sutter 2012 |
Swabs not further specified |
chromID ESBL medium (bioMerieux) |
Not reported (“the guidelines of the Clinical and Laboratory Standards Institute were followed.”) |
Not reported Sequencing was also done with ABI 3130 Genetic Analyzer (Applied Biosystems) |
No |
ESBL-producing Enterobacterales |
PICO 2
|
First author, year of publication |
Type of study |
Population (setting); study size |
Inclusion criteria |
Diagnostic test (indextest) |
Controle (reference test/gold standard) |
Outcome
|
Results |
Comments |
|
Dyakova 2017 |
Cross-sectional |
All admissions to a large hospital (London, England) (n=4567) |
Consent to both rectal and perineal swab (n=4006) |
Perineal swab (streaked on ChromID ESBL) |
Rectal swab (patient and staff collected) (streaked on ChromID ESBL) |
Sensitivity and specificity for detection of resistant Enterobacterales (ESBL phenotype) |
Sensitivity: 42,4% (133/314) Specificity: 99,4% (3671/3692)* |
|
|
Satlin 2017 |
Cross-sectional (extracted data) |
Patients with acute leukemia and hematopoietic stem cell transplant recipients (n=?) |
Patients with simultaneous perianal and stool swabs (n=137 patients; 161 paired swabs) |
Perirectal swab (streaked on chromogenic ESBL agar and MacConkey agar with 1µg/mL ciprofloxacin) |
Stool sample (streaked on chromogenic ESBL agar and MacConkey agar with 1µg/mL ciprofloxacin) |
Sensitivity and specificity for detection of resistant Enterobacterales (Fluoroquinolone resistant Enterobacterales and ceftriaxone resistant Enterobacterales)
|
Sensitivity: 90% (43/48) Specificity: 97% (209/215)
|
Only percentages were given for sensitivity and specificity. Absolute numbers were calculated for this review. Data for FQ and ceftriaxone resistant were combined. |
|
Lautenbach 2005 |
Cross-sectional (extracted data) |
Hospitalized patients (n=?) (University of Pennsylvania Health System, United States of America) |
Patients with both a stool sample and perirectal swab (n=63) |
Perirectal swab (streaked on MacConkey agar with levofloxacin) |
Stool sample (streaked on MacConkey agar with levofloxacin) |
Sensitivity and specificity for detection of resistant Enterobacterales (Fluoroquinolone resistant E. Coli)
|
Detection of FQ resistant organisms: Sensitivity: 90% (19/21) Specificity: 100% (42/42)
|
|
|
Wiener-Well 2010 |
Cross-sectional |
Hospitalized patients (Jerusalem, Isreal) (n=526) |
Patients with a rectal and perirectal swab (n=298) |
Perirectal swab (streaked on MacConkey agar with 1 µg/mL meropenem) |
Rectal swab (streaked on MacConkey agar with 1 µg/mL meropenem) |
Sensitivity and specificity for detection of resistant Enterobacterales (KPC-producing Enterobacteriacea) |
Sensitivity: 66,7% (10/15) Specificity 99,6% (282/283) |
Comparison of perirectal vs. rectal swab calculated with data from paper. Analysis not performed in original paper. |
|
Study references |
Collection material |
Isolation method |
Method of identification |
Method of susceptibility testing |
Use of enrichment broth? |
Definition resistant Enterobacterales |
|
Dyakova 2017 |
Rectal/perineal swabs: Eswabs (Copan) |
chromID ESBL (bioMérieux)
|
Maldi-TOF MS (Bruker Diagnostics) |
Vitek 2 (bioMérieux) |
No |
ESBL phenotype Enterobacterales were defined by the VITEK result. |
|
Lautenbach 2005 |
Not further specified |
MacConkey agar with levofloxacin at a concentration of 0,125 μg/ml |
Vitek 2 (bioMérieux) |
Vitek 2 (bioMérieux) |
No |
Fluoroquinolone resistant E. Coli |
|
Satlin 2017 |
Perirectal swab: Nylon flocked swabs with Amies liquid (Becton Dickinson Eswab) Stool samples: not further specified |
MacConkey agar with 1µg/mL ciprofloxacin (Hardy Diagnostics)
Hardychrom ESBL plate (Hardy Diagnostics) |
Maldi-TOF MS (Bruker Diagnostics) |
Microscan Walkaway plus System (Beckman Coulter) |
No |
Fluoroquinolone resistant Enterobacterales: resistant to ciprofloxacin or levofloxacin
Ceftriaxon resistant Enterobacterales: Resistant to ceftriaxone (CLSI 2016 breakpoints) |
|
Wiener-Well 2010 |
Rectal and perirectal swabs not further specified |
MacConkey agar with 1µg/mL meropenem |
Crystal Identification Systems (Becton Dickinson) |
E-test (AB Biodisk) |
Yes: brain–heart infusion broth with 1 μg/mL meropenem and 30 mg/mL of vancomycin and incubated at 37 °C for 48 h |
Carbapenem resistant K. pneumoniae |
Risk of bias tabel
PICO 1
|
Study reference (first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Thurlow 2013 |
Unlikely |
Unlikely |
Unclear (No information about blinding) |
Unlikely (multi-site screening and rectal screening were carried out in the same group) |
|
March 2010 |
Unlikely |
Unlikely |
Unclear (No information about blinding) |
Unlikely (multi-site screening and rectal screening were carried out in the same group) |
|
Rattanaumpawan 2018 |
Unlikely |
Unlikely |
Unclear (No information about blinding) |
Unlikely (multi-site screening and rectal screening were carried out in the same group) |
|
Tschudin-Sutter 2012 |
Unlikely |
Unlikely |
Unclear (No information about blinding) |
Unlikely (multi-site screening and rectal screening were carried out in the same group) |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
PICO 2
Kwaliteit van bewijs met QUADAS-2
|
Patient selection |
Index Test |
Reference standard |
Flow and Timing |
Patient selection |
Index Test |
Reference standard |
|
|
Dyakova 2017 |
L |
? |
? |
L |
L |
L |
L |
|
Lautenbach 2005 |
? |
? |
? |
? |
? |
L |
L |
|
Satlin 2017 |
? |
? |
? |
? |
L |
L |
L |
|
Wiener-Well 2010 |
L |
? |
? |
? |
L |
L |
L |
L = laag risico; H = hoog risico; ? = onduidelijk risico
Comments regarding high and unclear bias and applicability concerns:
Patient selection: Lautenbach et al. over-sampled known carriers of resistant Enterobacterales in order to achieve a prevalence of (at least) 25%. Satlin et al. did not give adequate information on patient selection.
Index test and reference standard: None of the studies explicitly stated that the results of both tests were processed independently of each other.
Tabel exclusie na het lezen van het volledige artikel
PICO 1
|
Auteur |
Redenen van exclusie |
|
Andremont 2018 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Baudel 2018 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Cortegiani 2016 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Depuydt 2008 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Freire 2017 |
Controle kwam niet overeen met rectale uitstrijk of feces |
|
Glupczynski |
Niet elke patiënt heeft controle en interventie gehad (cf. opzet van de review) |
|
Nseir 2010 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Reglier-Poupet 2008 |
Niet elke patiënt heeft controle en interventie gehad (cf. opzet van de review) |
|
Silva 2017 |
Niet elke patiënt heeft controle en interventie gehad (cf. opzet van de review) |
|
Snyder 2012 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Thouverez 2004 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Tschudin-Sutter 2012 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Viviani 2010 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Young 2014 |
Onvoldoende informatie over resultaten van interventie en controle |
|
Zaidah 2017 |
Niet elke patiënt heeft controle en interventie gehad (cf. opzet van de review) |
PICO 2
|
Auteur |
Redenen van exclusie |
|
Freire 2017 |
Geen informatie over perirectale of perineumuitstrijken |
|
Nucleo 2018 |
Geen informatie over perirectale of perineumuitstrijken |
|
Thurlow 2013 |
Geen informatie over perirectale of perineumuitstrijken |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 23-12-2021
Beoordeeld op geldigheid : 27-07-2021
Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Vereniging voor Medische Microbiologie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Medische Microbiologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door B.S. Niël-Weise, zelfstandig richtlijnmethodoloog, en werd gefinancieerd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De richtlijn is ontwikkeld in samenwerking met de Vereniging voor Hygiëne en Infectiepreventie in de Gezondheidszorg.
Doel en doelgroep
Doel
Het doel van het project is het herzien van de huidige richtlijn Laboratoriumdiagnostiek van BRMO die dateert uit 2012. Afgezien van het verstrijken van de reguliere termijn voor herziening zijn er nieuwe inzichten en methoden beschikbaar gekomen die de diagnostiek kunnen optimaliseren.
Doelgroep
De richtlijn is met name bedoeld voor artsen-microbioloog, deskundigen infectiepreventie, internisten-infectioloog en medisch moleculair microbiologen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de pre-analytische (afname, transport en bewaaromstandigheden) en de analytische fase van de laboratorium detectie van BRMO inclusief de rapportage naar de aanvrager danwel naar het patiëntendossier.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 2 jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep:
- Prof. dr. J.A.J.W. Kluytmans, arts-microbioloog, Amphia Ziekenhuis Breda/Oosterhout; Elisabeth-TweeSteden Ziekenhuis, Tilburg; Universitair Medisch Centrum Utrecht
- Drs. W. van den Bijllaardt, arts-microbioloog, Amphia Ziekenhuis Breda
- Dr. E. Bathoorn, arts-microbioloog, Universitair Medisch Centrum Groningen
- Dr. J. Cohen Stuart, arts-microbioloog, Noordwest Ziekenhuis Alkmaar
- Dr. J. J. Verweij, medisch moleculair microbioloog/parasitoloog, Elisabeth-Tweesteden Ziekenhuis, Tilburg
- Dr. W. H.F. Goessens, microbioloog, Erasmus MC Universitair Medisch Centrum Rotterdam
- Dr. N. al Naiemi, arts-microbioloog, Labmicta, Hengelo
- Prof. Dr. M.C. Vos, arts-microbioloog, Erasmus MC Universitair Medisch Centrum, Rotterdam
- Dr. L. van Dommelen, arts-microbioloog, PAMM, Veldhoven
- Dr. P. Croughs, arts-microbioloog, Erasmus MC Universitair Medisch Centrum, Rotterdam
- Drs. A. Klak, arts-microbioloog in opleiding, Universitair Medisch Centrum Groningen
Meelezers:
- Dr. M.K. Bomers, internist-infectioloog, Amsterdam UMC, locatie VUmc
- Mv. M. Molenaar, deskundige infectiepreventie, OLVG Amsterdam
- Mv. S. Cremers-Pijpers, deskundige infectiepreventie, Radboudumc, Nijmegen
Met ondersteuning van:
- Mw. B.S. Niël-Weise, zelfstandig richtlijnmethodoloog, Deventer
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancieerd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij de Nederlandse Vereniging voor Medische Microbiologie, een overzicht vindt u hieronder:
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
|
Jan Kluytmans |
|
|
Geen |
Geen |
Subsidiegevers zijn Euopese commissie, Nederlandse overheid en provincies. Geen belangen bij deze richtlijn |
Geen |
Geen |
|
Erik Bathoorn |
Arts-microbioloog, UMCG Groningen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Wouter van den Bijllaardt |
Arts-microbioloog Amphia ziekenhuis Breda |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
James Cohen Stuart |
Arts-microbioloog Noordwest Ziekenhuisgroep |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Jaco Verweij |
Medisch moleculair microbioloog, ETZ Ziekenhuis, Tilburg |
|
Geen |
Geen |
Geen |
Geen |
Geen |
|
Wil Goessens |
Medisch microbioloog Erasmus Medisch Centrum Rotterdam |
Geen |
Patent: detectie van carbapenemase middels maldi-TOF |
Geen |
Geen |
Geen |
Geen |
|
Nashwan al Naiemi |
Arts-microbioloog LabMicTA Bestuurder LabMicTA |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Greet Vos |
Arts-microbioloog MC Rotterdam |
|
Geen |
Geen |
Unrestricted grant 3m, Pentax |
Geen |
Geen |
|
Adrian Klak |
AIOS Medische Microbiologie UMCG |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Peter Croughs |
Arts-microbioloog, Erasmus Medisch Centrum |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Laura van Dommelen |
Arts-microbioloog, Stichting PAMM te Veldhoven |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Marije Bomers |
Internist- infectioloog, Amsterdam UMC, locatie VUmc |
Geen |
Financieel belang farmaceutisch bedrijf Shionogi |
Geen |
Subsidiegevers zijn ZonMW en Amsterdam UMC corona research fonds. Geen belangen bij deze richtlijn |
Geen |
Geen |
|
Myrte Molenaar |
Deskundige Infectiepreventie OLVG Amsterdam |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Suzan Cremers |
Deskundige |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door in de voorbereidende fase de Patiëntenfederatie Nederland te vragen om schriftelijke input omtrent knelpunten en aandachtspunten. De Patiëntenfederatie gaf aan geen knelpunten aan te leveren vanwege het technisch karakter van de richtlijn. De werkgroep heeft de conceptrichtlijn ook tijdens de commentaarfase voorgelegd aan de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren (zie het Implementatieplan in de bijlagen).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwalitieit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (https://www.agreetrust.org/), dat een internationaal breed geaccepteerd instrument is en op ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur welke onderwerpen moesten worden herzien. Deze werden met de werkgroep besproken. Tevens werd aan de volgende organisaties gevraagd om knelpunten aan te dragen: het Zorginstituut Nederland, Inspectie Gezondheidszorg en Jeugd, Vereniging voor Hygiëne & Infectiepreventie in de Gezondheidszorg, Patiëntenfederatie Nederland en Zorgverzekeraars Nederland.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep uitgangsvragen opgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant waren, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar relevante buitenlandse richtlijnen en naar systematische reviews. Voor (internationale) richtlijnen is gezocht in de databases van National Guideline Clearinghouse (NGC), Guidelines International Network (GIN), World Health Organisation (WHO) en Centers for Disease Control and Prevention (CDC). Voor bestaande systematic reviews is gezocht in de databases Ovid Medline en Embase (zie de zoekverantwoording).
Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kwaliteit van bewijs (‘quality of evidence’) werd beoordeeld met behulp van GRADE (Guyatt et al., 2008). GRADE is een methode die per uitkomstmaat van een interventie, of voor een risico- of prognostische factor, een gradering aan de kwaliteit van bewijs toekent op basis van de mate van vertrouwen in de schatting van de effectgrootte (tabel 1 en 2).
Tabel 1 Indeling van de kwaliteit van bewijs volgens GRADE
|
Hoog |
Er is veel vertrouwen dat het werkelijke effect dicht in de buurt ligt van het geschatte effect. |
|
|
|
|
Matig |
Er is matig vertrouwen in het geschatte effect: het werkelijk effect ligt waarschijnlijk dicht bij het geschatte effect, maar er is een mogelijkheid dat het hiervan substantieel afwijkt. |
|
|
|
|
Laag |
Er is beperkt vertrouwen in het geschatte effect: het werkelijke effect kan substantieel verschillen van het geschatte effect. |
|
|
|
|
Zeer laag |
Er is weinig vertrouwen in het geschatte effect: het werkelijke effect wijkt waarschijnlijk substantieel af van het geschatte effect. |
Tabel 2 De kwaliteit van bewijs wordt bepaald op basis van de volgende criteria
|
Type bewijs |
Voor studies over interventies: RCT start in de categorie ‘hoog’. Observationele studie start in de categorie ‘laag’. Alle overige studietypen starten in de categorie ‘zeer laag’.
Voor studies over een risico- of prognostische factor: Prospectieve of retrospectieve cohortstudie start in de categorie ‘hoog’. Voor andere studieontwerpen wordt afgewaardeerd via ‘risk of bias’. |
|
|
Afwaarderen |
‘Risk of bias’ |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Inconsistentie |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Indirect bewijs |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Onnauwkeurigheid |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Publicatiebias |
- 1 Waarschijnlijk - 2 Zeer waarschijnlijk |
|
Opwaarderen |
Groot effect |
+ 1 Groot + 2 Zeer groot |
|
|
Dosis-respons relatie |
+ 1 Bewijs voor gradiënt |
|
|
Alle plausibele ‘confounding’ |
+ 1 zou een effect kunnen reduceren + 1 zou een tegengesteld effect kunnen suggereren terwijl de resultaten geen effect laten zien. |
Formuleren van de conclusies
Een conclusie verwijst niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence).
Overwegingen
Voor het komen tot een aanbeveling zijn naast de kwaliteit van het wetenschappelijk bewijs over de gewenste en ongewenste effecten van een interventie, of over de effectgrootte van een risico- of prognostische factor, vaak ook nog andere factoren van belang (Alonso-Coello et al., 2016).
Genoemd kunnen worden:
- kosten,
- waarden, voorkeuren en ervaringen van patiënten en behandelaars met betrekking tot interventies en uitkomsten van zorg,
- balans van gewenste en ongewenste effecten van interventies ten opzichte van geen of andere interventies,
- aanvaardbaarheid van interventies,
- haalbaarheid van een aanbeveling.
Bij voorkeur wordt ook voor deze aspecten naar wetenschappelijk bewijs gezocht. De werkgroep die deze richtlijn heeft opgesteld, heeft hiervan afgezien omdat de hiervoor benodigde tijd in geen enkele verhouding zou staan tot de verwachte opbrengst. De werkgroep heeft, daar waar dit noodzakelijk werd geacht, op basis van eigen ervaring en expertise de hiervoor genoemde aspecten geïnventariseerd.
Deze aspecten worden besproken na de ‘conclusie’ onder het kopje ‘overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. Dit is afhankelijk van het gewicht dat wordt toegekend aan kosten, gewenste of ongewenste effecten en andere onder de overwegingen genoemde factoren.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de bijlage Kennislacunes.
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. Tevens is de richtlijn voorgelegd aan de organisaties die ook tijdens de knelpuntanalyse betrokken waren. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Literatuurlijst
- Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089.
- Guyatt et al., 2008Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, Schünemann HJ; GRADE Working Group (2008). GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 336: 924-6.
- Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
Zoekverantwoording
PICO 1
|
Database |
Zoektermen |
Totaal |
|
Medline (Ovid) <1946 to April 05, 2019> |
1 MDR-GNB.kf. (3) 2 MDR-GNB.ti. (1) 3 "Multi-Drug Resistant Gram-negative Bacilli (MDR-GNB)".kw. (1) 4 (antibacterial agent? adj5 Multi-drug adj3 resistant adj3 Gram-negative).tw. (2) 5 (antibio* adj5 Multi-drug resistant adj5 Gram-negative).tw. (8) 6 from 5 keep 8 (1) 7 exp Drug Resistance, Microbial/ (154041) 8 ((resistance adj3 antibiotic) or (antimicrobial adj3 drug adj3 resistance?) or (antibiotic adj3 resistant adj3 organism) or (multidrug adj3 resistant adj3 organism) or (healthcare adj3 associat* adj3 infect*) or (drug adj3 resistant adj3 infect*)).tw. (34292) 9 ((resistance adj3 antibiotic) or (antimicrobial adj3 drug adj3 resistance?) or (antibiotic adj3 resistant adj3 organism) or (multidrug adj3 resistant adj3 organism) or (healthcare adj3 associat* adj3 infect*) or (drug adj3 resistant adj3 infect*)).kf. (5566) 10 Methicillin Resistance/ (10172) 11 Vancomycin Resistance/ (3235) 12 (vancomycin adj3 resista*).tw. (8073) 13 (vancomycin adj3 resista*).kf. (401) 14 (penicillin* adj3 resista*).tw. (8292) 15 (penicillin* adj3 resista*).kf. (191) 16 ((extended-spectrum adj3 beta-lactamase?) or ESBL?).tw. (10148) 17 ((extended-spectrum adj3 beta-lactamase?) or ESBL?).kf. (1696) 18 ((carbapenem? adj3 resist*) or cre).tw. (22360) 19 ((carbapenem? adj3 resist*) or cre).kf. (1640) 20 plasmid-mediated AmpC.tw. (349) 21 plasmid-mediated AmpC.kf. (11) 22 pAmpC.tw. (145) 23 pAmpC.kf. (21) 24 (colistin adj resistance).tw. (765) 25 (colistin adj resistance).kf. (186) 26 Colistin/ (3792) 27 exp Quinolones/ (44689) 28 exp Aminoglycosides/ (150290) 29 ((colistin* or colimycin or colisticin or quinolon* or aminoglycos*) adj3 resis*).tw. (8044) 30 ((colistin* or colimycin or colisticin or quinolon* or aminoglycos*) adj3 resis*).kf. (452) 31 (methicillin* adj3 resis*).tw. (28356) 32 (methicillin* adj3 resis*).kf. (1693) 33 or/7-32 (384990) 34 Ceftazidime/ (3734) 35 Piperacillin/ (2653) 36 exp beta-Lactamases/ (21846) 37 Trimethoprim, Sulfamethoxazole Drug Combination/ (6656) 38 ((co adj trimoxazole?) or co?trimoxazole? or abactrim or biseptol or centr?n).tw. (6200) 39 ((co adj trimoxazole?) or co?trimoxazole? or abactrim or biseptol or centr?n).kf. (128) 40 (ceftazimidin* or piperacillin* or beta?lactam*).tw. (7194) 41 (ceftazimidin* or piperacillin* or beta?lactam*).kf. (237) 42 (quinolon* or aminoglycos*).tw. (30223) 43 (quinolon* or aminoglycos*).kf. (1283) 44 or/34-43 (69316) 45 33 or 44 (410278) 46 Enterobacteriaceae Infections/ (9192) 47 Enterobacteriaceae/ (18167) 48 enterobacter*.tw. (30800) 49 enterobacter*.kf. (2003) 50 or/46-49 (44374) 51 exp Staphylococcal Infections/ (62789) 52 (Vancomycin-Resistant adj2 Enterococc*).tw. (4565) 53 (Vancomycin-Resistant adj2 Enterococc*).kf. (263) 54 from 53 keep 8 (1) 55 (carbapenem-resistant adj2 acinetobacter*).tw. (651) 56 (carbapenem-resistant adj2 acinetobacter*).kf. (26) 57 46 or 47 or 48 or 49 or 51 or 52 or 53 or 55 or 56 (110616) 58 Feces/ (86618) 59 (feces or faeces or stool).tw. (71185) 60 (feces or faeces or stool).kf. (3363) 61 Feces/mi (32750) 62 mi.fs. (719947) 63 surveillance cultur*.tw. (1037) 64 surveillance cultur*.kf. (22) 65 "Public Health Surveillance"/ (2457) 66 Carrier State/ (21102) 67 (carrier adj2 state*).tw. (3582) 68 (carrier adj2 state*).kf. (401) 69 or/58-68 (819884) 70 57 and 69 (54754) 71 exp Gram-Negative Bacterial Infections/ (352023) 72 (gram?negative adj2 bacter*).tw. (200) 73 (gram?negative adj2 bacter*).kf. (1) 74 exp Gram-Negative Bacteria/ (761202) 75 or/71-74 (902370) 76 75 and 45 (95866) 77 ((rectal or stool or faec* or fec*) adj3 (swab? or screening or isolati* or carriag* or sampl* or cultur*)).tw. (35988) 78 ((rectal or stool or faec* or fec*) adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).tw. (40460) 79 ((rectal or stool or faec* or fec*) adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).kf. (255) 80 exp Bodily Secretions/ (243234) 81 exp Specimen Handling/ (331566) 82 or/78-81 (608061) 83 76 and 82 (4171) 84 "filter systematic reviews".ti. (0) 85 meta analysis.pt. (99232) 86 (meta-anal$ or metaanal$).tw,kf. (146583) 87 (quantitativ$ adj10 (review$ or overview$)).tw. (8174) 88 (systematic$ adj10 (review$ or overview$)).tw. (156156) 89 (methodologic$ adj10 (review$ or overview$)).tw. (10562) 90 (quantitativ$ adj10 (review$ or overview$)).kf. (53) 91 (systematic$ adj10 (review$ or overview$)).kf. (14041) 92 (methodologic$ adj10 (review$ or overview$)).kf. (61) 93 medline.tw. and review.pt. (74958) 94 (pooled adj3 analy*).tw. (16816) 95 (pooled adj3 analy*).kf. (196) 96 "cochrane$".fc_jour. (14106) 97 or/85-96 (304363) 98 83 and 97 (10) 99 "diagnose filter".ti. (0) 100 exp "Sensitivity and Specificity"/ (548874) 101 sensitivity.tw. (733869) 102 sensitivity.kf. (13339) 103 specificity.tw. (428873) 104 specificity.kf. (6043) 105 ((pre-test or pretest) adj probability).tw. (2018) 106 ((pre-test or pretest) adj probability).kf. (49) 107 ((post-test or posttest) adj probability).tw. (791) 108 ((post-test or posttest) adj probability).kf. (14) 109 predictive value$.tw. (98959) 110 predictive value$.kf. (1018) 111 likelihood ratio$.tw. (14092) 112 likelihood ratio$.kf. (460) 113 or/100-112 (1376140) 114 "Filter observationele studies".ti. (0) 115 epidemiologic studies/ (7921) 116 exp case-control studies/ (982671) 117 exp cohort studies/ (1842098) 118 cross-sectional studies/ (290186) 119 (case adj3 control).tw,kf. (120758) 120 (cohort adj5 (study or studies or analy$)).tw,kf. (228250) 121 (follow-up adj5 (study or studies)).tw,kf. (83533) 122 (longitudinal or retrospective or prospective or (cross adj5 sectional)).tw,kf. (1398844) 123 (observational adj5 (study or studies)).tw,kf. (122517) 124 or/115-123 (2907777) 125 75 and 45 and 82 (4171) 126 (125 and 124) not 97 (885) 127 126 and 113 (108) 128 69 and 126 (823) 129 128 not 127 (720) 130 1 or 2 or 3 or 4 or 5 (12) 131 "Colonization sites in carriers of ESBL-producing Gram-negative bacteria".fc_titl. (1) 132 "11".fc_issue. and "33".fc_vol. and "sites of colonization".fc_titl. and "2012".fc_pubyr. and "1170".fc_pg. (1) 133 131 or 132 (2) 134 130 or (45 and 57) (43168) 135 133 and 134 (1) 136 133 not 135 (1) 137 (Extended-Spectrum adj3 Beta-Lactamase-producing adj5 Gram-negative).tw. (108) 138 (Extended-Spectrum adj3 Beta-Lactamase-producing adj5 Gram-negative).kf. (2) 139 (ESBL adj3 producing adj5 Gram-negative).tw. (133) 140 (ESBL adj3 producing adj5 Gram-negative).kf. (0) 141 (ESBL?GNB or (ESBL adj3 GNB)).tw. (25) 142 ((multidrug-resistant adj3 Gram-negative adj3 bac*) or MDR).tw. (19931) 143 ((multidrug-resistant adj3 Gram-negative adj3 bac*) or MDR).kf. (1175) 144 or/137-143 (20537) 145 134 or 144 (62575) 146 (dutch or english or german or french).la. (26454068) 147 145 and 146 (58042) 148 comparative study/ (1826050) 149 mi.fs. (719947) 150 82 or 149 (1264189) 151 147 and 150 and 97 (262) 152 151 and 82 (11) 153 exp Bodily Secretions/mi (29023) 154 exp Respiratory System/mi [Microbiology] (29099) 155 exp Digestive System/mi [Microbiology] (63763) 156 153 or 154 or 155 (112921) 157 82 or 156 (683781) 158 exp Abdomen/mi [Microbiology] (1701) 159 157 or 158 (684982) 160 97 and 147 and 159 (28)=SR 161 147 and 159 and 113 and 124 (195)= observat 162 (147 and 159 and 113 and 148) not 161 (97)=comp 163 (147 and 159 and 113) not (161 or 162) (309)=rest diagn |
623 studies |
|
Embase <1974 to 2019 April 03> |
1 MDR-GNB.tw. (151) 2 MDR-GNB.kw. (3) 3 "Multi-Drug Resistant Gram-negative Bact* (MDR-GNB)".kw. (0) 4 "Multi-Drug Resistant Gram-negative Bact* (MDR-GNB)".tw. (5) 5 "extended spectrum beta lactamase producing Enterobacteriaceae"/ (1894) 6 (Extended-Spectrum adj3 Beta-Lactamase-producing adj5 Gram-negative).tw. (135) 7 (Extended-Spectrum adj3 Beta-Lactamase-producing adj5 Gram-negative).kw. (1) 8 (ESBL adj3 producing adj5 Gram-negative).tw. (230) 9 (ESBL adj3 producing adj5 Gram-negative).kw. (2) 10 exp antibiotic resistance/ (149159) 11 ((resistance adj3 antibiotic) or (antimicrobial adj3 drug adj3 resistance?) or (antibiotic adj3 resistant adj3 organism) or (multidrug adj3 resistant adj3 organism) or (healthcare adj3 associat* adj3 infect*) or (drug adj3 resistant adj3 infect*)).tw. (42579) 12 ((resistance adj3 antibiotic) or (antimicrobial adj3 drug adj3 resistance?) or (antibiotic adj3 resistant adj3 organism) or (multidrug adj3 resistant adj3 organism) or (healthcare adj3 associat* adj3 infect*) or (drug adj3 resistant adj3 infect*)).kw. (10832) 13 (vancomycin adj3 resista*).tw. (10280) 14 (vancomycin adj3 resista*).kw. (1173) 15 (penicillin* adj3 resista*).tw. (9307) 16 (penicillin* adj3 resista*).kw. (402) 17 ((extended-spectrum adj3 beta-lactamase?) or ESBL?).tw. (14233) 18 ((extended-spectrum adj3 beta-lactamase?) or ESBL?).kw. (3813) 19 ((carbapenem? adj3 resist*) or cre).tw. (36976) 20 ((carbapenem? adj3 resist*) or cre).kw. (3877) 21 plasmid-mediated AmpC.tw. (427) 22 plasmid-mediated AmpC.kw. (37) 23 pAmpC.tw. (165) 24 pAmpC.kw. (25) 25 (colistin adj resistance).tw. (858) 26 (colistin adj resistance).kw. (180) 27 ((colistin* or colimycin or colisticin or quinolon* or aminoglycos*) adj3 resis*).tw. (9645) 28 ((colistin* or colimycin or colisticin or quinolon* or aminoglycos*) adj3 resis*).kw. (815) 29 (methicillin* adj3 resis*).tw. (35642) 30 (methicillin* adj3 resis*).kw. (4983) 31 ceftazidime/ (38515) 32 piperacillin/ (18653) 33 beta lactamase/ (18176) 34 (ceftazimidin* or piperacillin* or beta?lactam*).tw. (12217) 35 (ceftazimidin* or piperacillin* or beta?lactam*).kw. (999) 36 cotrimoxazole/ (75186) 37 ((co adj trimoxazole?) or co?trimoxazole? or abactrim or biseptol or centr?n).tw. (8596) 38 ((co adj trimoxazole?) or co?trimoxazole? or abactrim or biseptol or centr?n).kw. (564) 39 (quinolon* or aminoglycos*).tw. (38815) 40 (quinolon* or aminoglycos*).kw. (5701) 41 or/10-40 (345437) 42 exp Gram negative infection/ (23796) 43 exp Gram negative infection/dr (1011) 44 exp Enterobacteriaceae/ (453073) 45 enterobacter*.tw. (36754) 46 enterobacter*.kw. (4013) 47 (Vancomycin-Resistant adj2 Enterococc*).tw. (5706) 48 (Vancomycin-Resistant adj2 Enterococc*).kw. (742) 49 (carbapenem-resistant adj2 acinetobacter*).tw. (841) 50 (carbapenem-resistant adj2 acinetobacter*).kw. (40) 51 exp Gram negative bacterium/ (753634) 52 exp Enterobacteriaceae infection/ (47321) 53 or/42-52 (800147) 54 or/1-9 (2334) 55 54 or (42 and 53) (26020) 56 (dutch or english or german or french).la. (28887855) 57 55 and 56 (22638) 58 ((rectal or stool or faec* or fec*) adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).tw. (51758) 59 ((rectal or stool or faec* or fec*) adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).kw. (519) 60 exp Bodily Secretions/ (284115) 61 exp Specimen Handling/ (1156) 62 exp microbiological examination/ (442541) 63 or/58-62 (753136) 64 "filter systematic reviews & meta-analyses Embase ".ti. (0) 65 meta analysis/ (159370) 66 "systematic review"/ (198178) 67 (meta-analy$ or metaanaly$).tw. (189844) 68 (meta-analy$ or metaanaly$).kw. (45481) 69 (systematic$ adj4 (review$ or overview$)).tw. (190730) 70 (systematic$ adj4 (review$ or overview$)).kw. (23283) 71 (quantitativ$ adj5 (review? or overview?)).tw,kw. (4729) 72 (methodologic adj5 (overview? or review?)).tw,kw. (350) 73 (review$ adj3 (database? or medline or embase or cinahl)).tw,kw. (24413) 74 (pooled adj3 analy$).tw,kw. (25766) 75 (extensive adj3 review$ adj3 literature).tw,kw. (3370) 76 (meta or synthesis or (literature adj8 database?) or extraction).tw,kw. (1333640) 77 review.pt. (2422094) 78 76 and 77 (139109) 79 or/65-75,78 (484420) 80 57 and 63 and 79 (49) 81 "diagnose filter embase".ti. (0) 82 "sensitivity and specificity"/ (319603) 83 exp "prediction and forecasting"/ (1172416) 84 reproducibility/ (201503) 85 evaluation/ (163963) 86 feasibility study/ (106789) 87 validation study/ (75760) 88 (diagnos$ or validity or validat$ or effect$ or evidence or method or select$ or evaluat$ or identificat$ or useful or reliable or reliability or predict$ or reproduc$ or specific$ or sensitiv$ or feasib$ or outcome).ti,ab. (18469756) 89 (diagnos$ or validity or validat$ or effect$ or evidence or method or select$ or evaluat$ or identificat$ or useful or reliable or reliability or predict$ or reproduc$ or specific$ or sensitiv$ or feasib$ or outcome).kw. (774009) 90 or/82-89 (18817628) 91 "filter observationele studies emb sign".ti. (0) 92 Clinical study/ (153650) 93 Case control study/ (138118) 94 Family study/ (25945) 95 Longitudinal study/ (123397) 96 Retrospective study/ (752414) 97 Prospective study/ (507552) 98 Randomized controlled trials/ (157193) 99 97 not 98 (502427) 100 Cohort analysis/ (451361) 101 (Cohort adj (study or studies)).tw,kw. (255213) 102 (Case control adj (study or studies)).tw,kw. (122921) 103 (follow up adj (study or studies)).tw,kw. (62279) 104 (observational adj (study or studies)).tw,kw. (142232) 105 (epidemiologic$ adj (study or studies)).tw,kw. (101229) 106 (cross sectional adj (study or studies)).tw,kw. (185821) 107 92 or 93 or 94 or 95 or 96 or 99 or 100 or 101 or 102 or 103 or 104 or 105 or 106 (2319225) 108 57 and 63 and 90 and 107 (612) 109 exp comparative study/ (1304658) 110 Major Clinical Study/ (3334473) 111 57 and 63 and 90 and 107 (612) 112 111 not 80 (608) 113 exp *Bodily Secretions/ (117535) 114 exp *Specimen Handling/ (176) 115 exp *microbiological examination/ (78102) 116 ((rectal or stool or faec* or fec*) adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).ti. (3777) 117 59 or 113 or 114 or 115 or 116 (198486) 118 57 and 117 and 90 and 107 (70) 119 (57 and 117 and 90 and 109) not 118 (42) 120 (57 and 117 and 90) not (107 or 109) (254) |
404 studies |
|
Cochrane Library (CENTRAL) <to 05/04/2019>
|
#1 MeSH descriptor: [Drug Resistance, Bacterial] explode all trees #2 ((resistance NEAR/3 antibiotic) or (antimicrobial NEAR/3 drug adj3 resistance) or (antibiotic NEAR/3 resistant NEAR/3 organism) or (multidrug NEAR/3 resistant NEAR/3 organism)):ti,ab #3 ((resistance NEAR/3 antibiotic) or (antimicrobial NEAR/3 drug adj3 resistance) or (antibiotic NEAR/3 resistant NEAR/3 organism) or (multidrug NEAR/3 resistant NEAR/3 organism)):kw #4 #1 or #2 or #3 #5 screening:ti,ab #6 screening:kw #7 MeSH descriptor: [Data Collection] explode all trees #8 #5 or #6 or #7 #9 MeSH descriptor: [Enterococcus] explode all trees #10 MeSH descriptor: [Gram-Negative Bacterial Infections] explode all trees #11 #4 and #8 #12 #4 and #9 #13 (sample* or swab*):ti,ab,kw #14 #4 and #13 #15 #4 AND #13 AND (#9 OR #10) #16 (surveillance or screening or isolation):ti,ab #17 MeSH descriptor: [Clinical Laboratory Techniques] explode all trees #18 MeSH descriptor: [Laboratory Chemicals] explode all trees #19 #16 or #17 or #18 #20 #4 and #19 #21 (enterobacter* OR enterococco* OR gram-negative* OR gramnegativ*):ti,ab,kw #22 #20 AND #21 #23 MeSH descriptor: [Vancomycin Resistance] explode all trees #24 (vancomycin NEAR/3 resista*):ti,ab #25 (vancomycin NEAR/3 resista*):kw #26 Vancomycin-Resistant NEAR/2 Enterococc*:ti,ab #27 Vancomycin-Resistant NEAR/2 Enterococc*:kw #28 MeSH descriptor: [Vancomycin-Resistant Enterococci] explode all trees #29 #23 or #24 or #25 or #26 or #27 or #28 #30 MeSH descriptor: [Specimen Handling] explode all trees #31 MeSH descriptor: [Bodily Secretions] explode all trees #32 swab* or screening or isolati* or carriag* or sampl* or cultur*:ti,ab #33 #30 or #31 or #32 #34 #29 and #33 #35 rectal or stool:ti,ab,kw #36 #34 and #35 #37 MDR-GNB:ti,ab,kw #38 ((gram-negative NEAR/2 bacter*) OR (gram NEAR/2 negative NEAR/2 bacter*)):ti,ab,kw #39 MeSH descriptor: [Gram-Negative Bacteria] explode all trees #40 MeSH descriptor: [Gram-Negative Bacterial Infections] explode all trees #41 (#38 OR #39 OR #40) AND #4 #42 #41 AND #8 #43 #41 AND #33 #44 (Extended-Spectrum NEAR/3 Beta-Lactamase-producing NEAR/5 Gram-negative):ti,ab #45 multidrug-resistant NEAR/3 Gram-negative NEAR/3 bac*:ti,ab #46 MDR NEAR/bact*:ti,ab #47 (#38 OR #39 OR #40) AND (#4 OR #44 OR #45 OR #46) #48 MeSH descriptor: [Specimen Handling] explode all trees #49 #47 AND (#35 or #48) #50 accuracy:ti,ab,kw #51 MeSH descriptor: [Bodily Secretions] explode all trees and with qualifier(s): [microbiology - MI] #52 MeSH descriptor: [Respiratory System] explode all trees and with qualifier(s): [microbiology - MI] #53 MeSH descriptor: [Digestive System] explode all trees and with qualifier(s): [microbiology - MI] #54 MeSH descriptor: [Abdomen] explode all trees and with qualifier(s): [microbiology - MI] #55 #13 OR #51 OR #52 OR #53 OR #54 #56 #47 AND #55 #57 (#51 OR #52 OR #53 OR #54) AND (#13 OR #48 OR #33) #58 #57 AND #13 #59 MeSH descriptor: [Specimen Handling] explode all trees #60 #58 AND #59 |
148 studies
|
PICO 2
|
Database |
Zoektermen |
Totaal |
|
Medline (Ovid) <1946 to April 05, 2019> |
1 MDR-GNB.kf. (3) 2 MDR-GNB.ti. (1) 3 "Multi-Drug Resistant Gram-negative Bacilli (MDR-GNB)".kw. (1) 4 (antibacterial agent? adj5 Multi-drug adj3 resistant adj3 Gram-negative).tw. (2) 5 (antibio* adj5 Multi-drug resistant adj5 Gram-negative).tw. (8) 6 from 5 keep 8 (1) 7 exp Drug Resistance, Microbial/ (154041) 8 ((resistance adj3 antibiotic) or (antimicrobial adj3 drug adj3 resistance?) or (antibiotic adj3 resistant adj3 organism) or (multidrug adj3 resistant adj3 organism) or (healthcare adj3 associat* adj3 infect*) or (drug adj3 resistant adj3 infect*)).tw. (34292) 9 ((resistance adj3 antibiotic) or (antimicrobial adj3 drug adj3 resistance?) or (antibiotic adj3 resistant adj3 organism) or (multidrug adj3 resistant adj3 organism) or (healthcare adj3 associat* adj3 infect*) or (drug adj3 resistant adj3 infect*)).kf. (5566) 10 Methicillin Resistance/ (10172) 11 Vancomycin Resistance/ (3235) 12 (vancomycin adj3 resista*).tw. (8073) 13 (vancomycin adj3 resista*).kf. (401) 14 (penicillin* adj3 resista*).tw. (8292) 15 (penicillin* adj3 resista*).kf. (191) 16 ((extended-spectrum adj3 beta-lactamase?) or ESBL?).tw. (10148) 17 ((extended-spectrum adj3 beta-lactamase?) or ESBL?).kf. (1696) 18 ((carbapenem? adj3 resist*) or cre).tw. (22360) 19 ((carbapenem? adj3 resist*) or cre).kf. (1640) 20 plasmid-mediated AmpC.tw. (349) 21 plasmid-mediated AmpC.kf. (11) 22 pAmpC.tw. (145) 23 pAmpC.kf. (21) 24 (colistin adj resistance).tw. (765) 25 (colistin adj resistance).kf. (186) 26 Colistin/ (3792) 27 exp Quinolones/ (44689) 28 exp Aminoglycosides/ (150290) 29 ((colistin* or colimycin or colisticin or quinolon* or aminoglycos*) adj3 resis*).tw. (8044) 30 ((colistin* or colimycin or colisticin or quinolon* or aminoglycos*) adj3 resis*).kf. (452) 31 (methicillin* adj3 resis*).tw. (28356) 32 (methicillin* adj3 resis*).kf. (1693) 33 or/7-32 (384990) 34 Ceftazidime/ (3734) 35 Piperacillin/ (2653) 36 exp beta-Lactamases/ (21846) 37 Trimethoprim, Sulfamethoxazole Drug Combination/ (6656) 38 ((co adj trimoxazole?) or co?trimoxazole? or abactrim or biseptol or centr?n).tw. (6200) 39 ((co adj trimoxazole?) or co?trimoxazole? or abactrim or biseptol or centr?n).kf. (128) 40 (ceftazimidin* or piperacillin* or beta?lactam*).tw. (7194) 41 (ceftazimidin* or piperacillin* or beta?lactam*).kf. (237) 42 (quinolon* or aminoglycos*).tw. (30223) 43 (quinolon* or aminoglycos*).kf. (1283) 44 or/34-43 (69316) 45 33 or 44 (410278) 46 Enterobacteriaceae Infections/ (9192) 47 Enterobacteriaceae/ (18167) 48 enterobacter*.tw. (30800) 49 enterobacter*.kf. (2003) 50 or/46-49 (44374) 51 exp Staphylococcal Infections/ (62789) 52 (Vancomycin-Resistant adj2 Enterococc*).tw. (4565) 53 (Vancomycin-Resistant adj2 Enterococc*).kf. (263) 54 from 53 keep 8 (1) 55 (carbapenem-resistant adj2 acinetobacter*).tw. (651) 56 (carbapenem-resistant adj2 acinetobacter*).kf. (26) 57 46 or 47 or 48 or 49 or 51 or 52 or 53 or 55 or 56 (110616) 58 Feces/ (86618) 59 (feces or faeces or stool).tw. (71185) 60 (feces or faeces or stool).kf. (3363) 61 Feces/mi (32750) 62 mi.fs. (719947) 63 surveillance cultur*.tw. (1037) 64 surveillance cultur*.kf. (22) 65 "Public Health Surveillance"/ (2457) 66 Carrier State/ (21102) 67 (carrier adj2 state*).tw. (3582) 68 (carrier adj2 state*).kf. (401) 69 or/58-68 (819884) 70 57 and 69 (54754) 71 exp Gram-Negative Bacterial Infections/ (352023) 72 (gram?negative adj2 bacter*).tw. (200) 73 (gram?negative adj2 bacter*).kf. (1) 74 exp Gram-Negative Bacteria/ (761202) 75 or/71-74 (902370) 76 75 and 45 (95866) 77 ((rectal or stool or faec* or fec*) adj3 (swab? or screening or isolati* or carriag* or sampl* or cultur*)).tw. (35988) 78 ((rectal or stool or faec* or fec*) adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).tw. (40460) 79 ((rectal or stool or faec* or fec*) adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).kf. (255) 80 exp Bodily Secretions/ (243234) 81 exp Specimen Handling/ (331566) 82 or/78-81 (608061) 83 76 and 82 (4171) 84 "filter systematic reviews".ti. (0) 85 meta analysis.pt. (99232) 86 (meta-anal$ or metaanal$).tw,kf. (146583) 87 (quantitativ$ adj10 (review$ or overview$)).tw. (8174) 88 (systematic$ adj10 (review$ or overview$)).tw. (156156) 89 (methodologic$ adj10 (review$ or overview$)).tw. (10562) 90 (quantitativ$ adj10 (review$ or overview$)).kf. (53) 91 (systematic$ adj10 (review$ or overview$)).kf. (14041) 92 (methodologic$ adj10 (review$ or overview$)).kf. (61) 93 medline.tw. and review.pt. (74958) 94 (pooled adj3 analy*).tw. (16816) 95 (pooled adj3 analy*).kf. (196) 96 "cochrane$".fc_jour. (14106) 97 or/85-96 (304363) 98 83 and 97 (10) 99 "diagnose filter".ti. (0) 100 exp "Sensitivity and Specificity"/ (548874) 101 sensitivity.tw. (733869) 102 sensitivity.kf. (13339) 103 specificity.tw. (428873) 104 specificity.kf. (6043) 105 ((pre-test or pretest) adj probability).tw. (2018) 106 ((pre-test or pretest) adj probability).kf. (49) 107 ((post-test or posttest) adj probability).tw. (791) 108 ((post-test or posttest) adj probability).kf. (14) 109 predictive value$.tw. (98959) 110 predictive value$.kf. (1018) 111 likelihood ratio$.tw. (14092) 112 likelihood ratio$.kf. (460) 113 or/100-112 (1376140) 114 "Filter observationele studies".ti. (0) 115 epidemiologic studies/ (7921) 116 exp case-control studies/ (982671) 117 exp cohort studies/ (1842098) 118 cross-sectional studies/ (290186) 119 (case adj3 control).tw,kf. (120758) 120 (cohort adj5 (study or studies or analy$)).tw,kf. (228250) 121 (follow-up adj5 (study or studies)).tw,kf. (83533) 122 (longitudinal or retrospective or prospective or (cross adj5 sectional)).tw,kf. (1398844) 123 (observational adj5 (study or studies)).tw,kf. (122517) 124 or/115-123 (2907777) 125 75 and 45 and 82 (4171) 126 (125 and 124) not 97 (885) 127 126 and 113 (108) 128 69 and 126 (823) 129 128 not 127 (720) 130 1 or 2 or 3 or 4 or 5 (12) 131 "Colonization sites in carriers of ESBL-producing Gram-negative bacteria".fc_titl. (1) 132 "11".fc_issue. and "33".fc_vol. and "sites of colonization".fc_titl. and "2012".fc_pubyr. and "1170".fc_pg. (1) 133 131 or 132 (2) 134 130 or (45 and 57) (43168) 135 133 and 134 (1) 136 133 not 135 (1) 137 (Extended-Spectrum adj3 Beta-Lactamase-producing adj5 Gram-negative).tw. (108) 138 (Extended-Spectrum adj3 Beta-Lactamase-producing adj5 Gram-negative).kf. (2) 139 (ESBL adj3 producing adj5 Gram-negative).tw. (133) 140 (ESBL adj3 producing adj5 Gram-negative).kf. (0) 141 (ESBL?GNB or (ESBL adj3 GNB)).tw. (25) 142 ((multidrug-resistant adj3 Gram-negative adj3 bac*) or MDR).tw. (19931) 143 ((multidrug-resistant adj3 Gram-negative adj3 bac*) or MDR).kf. (1175) 144 or/137-143 (20537) 145 134 or 144 (62575) 146 (dutch or english or german or french).la. (26454068) 147 145 and 146 (58042) 148 comparative study/ (1826050) 149 mi.fs. (719947) 150 82 or 149 (1264189) 151 147 and 150 and 97 (262) 152 151 and 82 (11) 153 exp Bodily Secretions/mi (29023) 154 exp Respiratory System/mi [Microbiology] (29099) 155 exp Digestive System/mi [Microbiology] (63763) 156 153 or 154 or 155 (112921) 157 82 or 156 (683781) 158 exp Abdomen/mi [Microbiology] (1701) 159 157 or 158 (684982) 160 97 and 147 and 159 (28) 161 147 and 159 and 113 and 124 (195) 162 (147 and 159 and 113 and 148) not 161 (97) 163 (147 and 159 and 113) not (161 or 162) (309) 164 ((periana* or perinea*) adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).tw. (341) 165 ((periana* or perinea*) adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).kf. (1) 166 164 or 165 (342) 167 (rectal adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).tw. (3673) 168 (rectal adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).kf. (39) 169 167 or 168 (3678) 170 166 or 169 (3992) 171 147 and 159 and 113 and 170 (113)= Pico 4 spec 172 147 and 170 and (97 or 124 or 113) (345) 173 (147 and 170 and (97 or 124 or 113)) not 171 (232) 174 (147 and 170 and (97 or 124 or 148)) not 171 (254))= Pico4 observat comp SR |
366 studies |
|
Embase <1974 to 2019 April 05> |
1 MDR-GNB.tw. (151) 2 MDR-GNB.kw. (3) 3 "Multi-Drug Resistant Gram-negative Bact* (MDR-GNB)".kw. (0) 4 "Multi-Drug Resistant Gram-negative Bact* (MDR-GNB)".tw. (5) 5 "extended spectrum beta lactamase producing Enterobacteriaceae"/ (1894) 6 (Extended-Spectrum adj3 Beta-Lactamase-producing adj5 Gram-negative).tw. (135) 7 (Extended-Spectrum adj3 Beta-Lactamase-producing adj5 Gram-negative).kw. (1) 8 (ESBL adj3 producing adj5 Gram-negative).tw. (230) 9 (ESBL adj3 producing adj5 Gram-negative).kw. (2) 10 exp antibiotic resistance/ (149159) 11 ((resistance adj3 antibiotic) or (antimicrobial adj3 drug adj3 resistance?) or (antibiotic adj3 resistant adj3 organism) or (multidrug adj3 resistant adj3 organism) or (healthcare adj3 associat* adj3 infect*) or (drug adj3 resistant adj3 infect*)).tw. (42579) 12 ((resistance adj3 antibiotic) or (antimicrobial adj3 drug adj3 resistance?) or (antibiotic adj3 resistant adj3 organism) or (multidrug adj3 resistant adj3 organism) or (healthcare adj3 associat* adj3 infect*) or (drug adj3 resistant adj3 infect*)).kw. (10832) 13 (vancomycin adj3 resista*).tw. (10280) 14 (vancomycin adj3 resista*).kw. (1173) 15 (penicillin* adj3 resista*).tw. (9307) 16 (penicillin* adj3 resista*).kw. (402) 17 ((extended-spectrum adj3 beta-lactamase?) or ESBL?).tw. (14233) 18 ((extended-spectrum adj3 beta-lactamase?) or ESBL?).kw. (3813) 19 ((carbapenem? adj3 resist*) or cre).tw. (36976) 20 ((carbapenem? adj3 resist*) or cre).kw. (3877) 21 plasmid-mediated AmpC.tw. (427) 22 plasmid-mediated AmpC.kw. (37) 23 pAmpC.tw. (165) 24 pAmpC.kw. (25) 25 (colistin adj resistance).tw. (858) 26 (colistin adj resistance).kw. (180) 27 ((colistin* or colimycin or colisticin or quinolon* or aminoglycos*) adj3 resis*).tw. (9645) 28 ((colistin* or colimycin or colisticin or quinolon* or aminoglycos*) adj3 resis*).kw. (815) 29 (methicillin* adj3 resis*).tw. (35642) 30 (methicillin* adj3 resis*).kw. (4983) 31 ceftazidime/ (38515) 32 piperacillin/ (18653) 33 beta lactamase/ (18176) 34 (ceftazimidin* or piperacillin* or beta?lactam*).tw. (12217) 35 (ceftazimidin* or piperacillin* or beta?lactam*).kw. (999) 36 cotrimoxazole/ (75186) 37 ((co adj trimoxazole?) or co?trimoxazole? or abactrim or biseptol or centr?n).tw. (8596) 38 ((co adj trimoxazole?) or co?trimoxazole? or abactrim or biseptol or centr?n).kw. (564) 39 (quinolon* or aminoglycos*).tw. (38815) 40 (quinolon* or aminoglycos*).kw. (5701) 41 or/10-40 (345437) 42 exp Gram negative infection/ (23796) 43 exp Gram negative infection/dr (1011) 44 exp Enterobacteriaceae/ (453073) 45 enterobacter*.tw. (36754) 46 enterobacter*.kw. (4013) 47 (Vancomycin-Resistant adj2 Enterococc*).tw. (5706) 48 (Vancomycin-Resistant adj2 Enterococc*).kw. (742) 49 (carbapenem-resistant adj2 acinetobacter*).tw. (841) 50 (carbapenem-resistant adj2 acinetobacter*).kw. (40) 51 exp Gram negative bacterium/ (753634) 52 exp Enterobacteriaceae infection/ (47321) 53 or/42-52 (800147) 54 or/1-9 (2334) 55 54 or (42 and 53) (26020) 56 (dutch or english or german or french).la. (28887855) 57 55 and 56 (22638) 58 ((rectal or stool or faec* or fec*) adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).tw. (51758) 59 ((rectal or stool or faec* or fec*) adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).kw. (519) 60 exp Bodily Secretions/ (284115) 61 exp Specimen Handling/ (1156) 62 exp microbiological examination/ (442541) 63 or/58-62 (753136) 64 "filter systematic reviews & meta-analyses Embase ".ti. (0) 65 meta analysis/ (159370) 66 "systematic review"/ (198178) 67 (meta-analy$ or metaanaly$).tw. (189844) 68 (meta-analy$ or metaanaly$).kw. (45481) 69 (systematic$ adj4 (review$ or overview$)).tw. (190730) 70 (systematic$ adj4 (review$ or overview$)).kw. (23283) 71 (quantitativ$ adj5 (review? or overview?)).tw,kw. (4729) 72 (methodologic adj5 (overview? or review?)).tw,kw. (350) 73 (review$ adj3 (database? or medline or embase or cinahl)).tw,kw. (24413) 74 (pooled adj3 analy$).tw,kw. (25766) 75 (extensive adj3 review$ adj3 literature).tw,kw. (3370) 76 (meta or synthesis or (literature adj8 database?) or extraction).tw,kw. (1333640) 77 review.pt. (2422094) 78 76 and 77 (139109) 79 or/65-75,78 (484420) 80 57 and 63 and 79 (49) 81 "diagnose filter embase".ti. (0) 82 "sensitivity and specificity"/ (319603) 83 exp "prediction and forecasting"/ (1172416) 84 reproducibility/ (201503) 85 evaluation/ (163963) 86 feasibility study/ (106789) 87 validation study/ (75760) 88 (diagnos$ or validity or validat$ or effect$ or evidence or method or select$ or evaluat$ or identificat$ or useful or reliable or reliability or predict$ or reproduc$ or specific$ or sensitiv$ or feasib$ or outcome).ti,ab. (18469756) 89 (diagnos$ or validity or validat$ or effect$ or evidence or method or select$ or evaluat$ or identificat$ or useful or reliable or reliability or predict$ or reproduc$ or specific$ or sensitiv$ or feasib$ or outcome).kw. (774009) 90 or/82-89 (18817628) 91 "filter observationele studies emb sign".ti. (0) 92 Clinical study/ (153650) 93 Case control study/ (138118) 94 Family study/ (25945) 95 Longitudinal study/ (123397) 96 Retrospective study/ (752414) 97 Prospective study/ (507552) 98 Randomized controlled trials/ (157193) 99 97 not 98 (502427) 100 Cohort analysis/ (451361) 101 (Cohort adj (study or studies)).tw,kw. (255213) 102 (Case control adj (study or studies)).tw,kw. (122921) 103 (follow up adj (study or studies)).tw,kw. (62279) 104 (observational adj (study or studies)).tw,kw. (142232) 105 (epidemiologic$ adj (study or studies)).tw,kw. (101229) 106 (cross sectional adj (study or studies)).tw,kw. (185821) 107 92 or 93 or 94 or 95 or 96 or 99 or 100 or 101 or 102 or 103 or 104 or 105 or 106 (2319225) 108 57 and 63 and 90 and 107 (612) 109 exp comparative study/ (1304658) 110 Major Clinical Study/ (3334473) 111 57 and 63 and 90 and 107 (612) 112 111 not 80 (608) 113 exp *Bodily Secretions/ (117535) 114 exp *Specimen Handling/ (176) 115 exp *microbiological examination/ (78102) 116 ((rectal or stool or faec* or fec*) adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).ti. (3777) 117 59 or 113 or 114 or 115 or 116 (198486) 118 57 and 117 and 90 and 107 (70) 119 (57 and 117 and 90 and 109) not 118 (42) 120 (57 and 117 and 90) not (107 or 109) (254) 121 from 118 keep 1-70 (70) 122 from 119 keep 1-42 (42) 123 from 120 keep 1-254 (254) 124 ((periana* or perinea*) adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).tw. (485) 125 ((periana* or perinea*) adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).kw. (2) 126 124 or 125 (485) 127 63 and 126 (211) 128 57 and 126 (16) 129 bacterium examination/ or feces culture/ or strain identification/ or throat culture/ or urine culture/ (31450) 130 57 and 63 and (126 or 129) (366) 131 (rectal adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).tw. (5295) 132 57 and (126 or 131) and 90 (173) 133 132 and 129 (11) 134 128 or 133 (26)=spec 135 132 and (107 or 109 or 79) (88)= observat comp SR |
66 studies |
|
Cochrane Library (CENTRAL) < to 05/04/2019> |
The Cochrane search for PICO 1,2 and 3 used the same criteria. See search criteria PICO 1 |
148 studies
|
PICO 3
|
Database |
Zoektermen |
Totaal |
|
Medline (Ovid) <1946 to April 08, 2019> |
1 MDR-GNB.kf. (3) 2 MDR-GNB.ti. (1) 3 "Multi-Drug Resistant Gram-negative Bacilli (MDR-GNB)".kw. (1) 4 (antibacterial agent? adj5 Multi-drug adj3 resistant adj3 Gram-negative).tw. (2) 5 (antibio* adj5 Multi-drug resistant adj5 Gram-negative).tw. (8) 6 from 5 keep 8 (1) 7 exp Drug Resistance, Microbial/ (154061) 8 ((resistance adj3 antibiotic) or (antimicrobial adj3 drug adj3 resistance?) or (antibiotic adj3 resistant adj3 organism) or (multidrug adj3 resistant adj3 organism) or (healthcare adj3 associat* adj3 infect*) or (drug adj3 resistant adj3 infect*)).tw. (34322) 9 ((resistance adj3 antibiotic) or (antimicrobial adj3 drug adj3 resistance?) or (antibiotic adj3 resistant adj3 organism) or (multidrug adj3 resistant adj3 organism) or (healthcare adj3 associat* adj3 infect*) or (drug adj3 resistant adj3 infect*)).kf. (5583) 10 Methicillin Resistance/ (10172) 11 Vancomycin Resistance/ (3235) 12 (vancomycin adj3 resista*).tw. (8074) 13 (vancomycin adj3 resista*).kf. (401) 14 (penicillin* adj3 resista*).tw. (8293) 15 (penicillin* adj3 resista*).kf. (191) 16 ((extended-spectrum adj3 beta-lactamase?) or ESBL?).tw. (10153) 17 ((extended-spectrum adj3 beta-lactamase?) or ESBL?).kf. (1698) 18 ((carbapenem? adj3 resist*) or cre).tw. (22384) 19 ((carbapenem? adj3 resist*) or cre).kf. (1647) 20 plasmid-mediated AmpC.tw. (349) 21 plasmid-mediated AmpC.kf. (11) 22 pAmpC.tw. (146) 23 pAmpC.kf. (22) 24 (colistin adj resistance).tw. (766) 25 (colistin adj resistance).kf. (189) 26 Colistin/ (3792) 27 exp Quinolones/ (44694) 28 exp Aminoglycosides/ (150308) 29 ((colistin* or colimycin or colisticin or quinolon* or aminoglycos*) adj3 resis*).tw. (8050) 30 ((colistin* or colimycin or colisticin or quinolon* or aminoglycos*) adj3 resis*).kf. (455) 31 (methicillin* adj3 resis*).tw. (28374) 32 (methicillin* adj3 resis*).kf. (1694) 33 or/7-32 (385101) 34 Ceftazidime/ (3734) 35 Piperacillin/ (2653) 36 exp beta-Lactamases/ (21846) 37 Trimethoprim, Sulfamethoxazole Drug Combination/ (6656) 38 ((co adj trimoxazole?) or co?trimoxazole? or abactrim or biseptol or centr?n).tw. (6201) 39 ((co adj trimoxazole?) or co?trimoxazole? or abactrim or biseptol or centr?n).kf. (128) 40 (ceftazimidin* or piperacillin* or beta?lactam*).tw. (7195) 41 (ceftazimidin* or piperacillin* or beta?lactam*).kf. (236) 42 (quinolon* or aminoglycos*).tw. (30230) 43 (quinolon* or aminoglycos*).kf. (1287) 44 or/34-43 (69326) 45 33 or 44 (410391) 46 Enterobacteriaceae Infections/ (9193) 47 Enterobacteriaceae/ (18168) 48 enterobacter*.tw. (30816) 49 enterobacter*.kf. (2008) 50 or/46-49 (44394) 51 exp Staphylococcal Infections/ (62797) 52 (Vancomycin-Resistant adj2 Enterococc*).tw. (4565) 53 (Vancomycin-Resistant adj2 Enterococc*).kf. (263) 54 from 53 keep 8 (1) 55 (carbapenem-resistant adj2 acinetobacter*).tw. (651) 56 (carbapenem-resistant adj2 acinetobacter*).kf. (26) 57 46 or 47 or 48 or 49 or 51 or 52 or 53 or 55 or 56 (110644) 58 Feces/ (86626) 59 (feces or faeces or stool).tw. (71209) 60 (feces or faeces or stool).kf. (3367) 61 Feces/mi (32756) 62 mi.fs. (720069) 63 surveillance cultur*.tw. (1037) 64 surveillance cultur*.kf. (22) 65 "Public Health Surveillance"/ (2459) 66 Carrier State/ (21103) 67 (carrier adj2 state*).tw. (3582) 68 (carrier adj2 state*).kf. (401) 69 or/58-68 (820032) 70 57 and 69 (54767) 71 exp Gram-Negative Bacterial Infections/ (352059) 72 (gram?negative adj2 bacter*).tw. (200) 73 (gram?negative adj2 bacter*).kf. (1) 74 exp Gram-Negative Bacteria/ (761306) 75 or/71-74 (902482) 76 75 and 45 (95881) 77 ((rectal or stool or faec* or fec*) adj3 (swab? or screening or isolati* or carriag* or sampl* or cultur*)).tw. (36014) 78 ((rectal or stool or faec* or fec*) adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).tw. (40487) 79 ((rectal or stool or faec* or fec*) adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).kf. (257) 80 exp Bodily Secretions/ (243254) 81 exp Specimen Handling/ (331653) 82 or/78-81 (608193) 83 76 and 82 (4171) 84 "filter systematic reviews".ti. (0) 85 meta analysis.pt. (99262) 86 (meta-anal$ or metaanal$).tw,kf. (146732) 87 (quantitativ$ adj10 (review$ or overview$)).tw. (8179) 88 (systematic$ adj10 (review$ or overview$)).tw. (156360) 89 (methodologic$ adj10 (review$ or overview$)).tw. (10571) 90 (quantitativ$ adj10 (review$ or overview$)).kf. (53) 91 (systematic$ adj10 (review$ or overview$)).kf. (14075) 92 (methodologic$ adj10 (review$ or overview$)).kf. (61) 93 medline.tw. and review.pt. (74994) 94 (pooled adj3 analy*).tw. (16832) 95 (pooled adj3 analy*).kf. (197) 96 "cochrane$".fc_jour. (14108) 97 or/85-96 (304645) 98 83 and 97 (10) 99 "diagnose filter".ti. (0) 100 exp "Sensitivity and Specificity"/ (548963) 101 sensitivity.tw. (734248) 102 sensitivity.kf. (13362) 103 specificity.tw. (429078) 104 specificity.kf. (6054) 105 ((pre-test or pretest) adj probability).tw. (2018) 106 ((pre-test or pretest) adj probability).kf. (49) 107 ((post-test or posttest) adj probability).tw. (791) 108 ((post-test or posttest) adj probability).kf. (14) 109 predictive value$.tw. (99013) 110 predictive value$.kf. (1018) 111 likelihood ratio$.tw. (14103) 112 likelihood ratio$.kf. (460) 113 or/100-112 (1376692) 114 "Filter observationele studies".ti. (0) 115 epidemiologic studies/ (7921) 116 exp case-control studies/ (983035) 117 exp cohort studies/ (1842602) 118 cross-sectional studies/ (290276) 119 (case adj3 control).tw,kf. (120831) 120 (cohort adj5 (study or studies or analy$)).tw,kf. (228474) 121 (follow-up adj5 (study or studies)).tw,kf. (83573) 122 (longitudinal or retrospective or prospective or (cross adj5 sectional)).tw,kf. (1399842) 123 (observational adj5 (study or studies)).tw,kf. (122639) 124 or/115-123 (2909234) 125 75 and 45 and 82 (4171) 126 (125 and 124) not 97 (885) 127 126 and 113 (108) 128 69 and 126 (823) 129 128 not 127 (720) 130 1 or 2 or 3 or 4 or 5 (12) 131 "Colonization sites in carriers of ESBL-producing Gram-negative bacteria".fc_titl. (1) 132 "11".fc_issue. and "33".fc_vol. and "sites of colonization".fc_titl. and "2012".fc_pubyr. and "1170".fc_pg. (1) 133 131 or 132 (2) 134 130 or (45 and 57) (43180) 135 133 and 134 (1) 136 133 not 135 (1) 137 (Extended-Spectrum adj3 Beta-Lactamase-producing adj5 Gram-negative).tw. (108) 138 (Extended-Spectrum adj3 Beta-Lactamase-producing adj5 Gram-negative).kf. (2) 139 (ESBL adj3 producing adj5 Gram-negative).tw. (133) 140 (ESBL adj3 producing adj5 Gram-negative).kf. (0) 141 (ESBL?GNB or (ESBL adj3 GNB)).tw. (25) 142 ((multidrug-resistant adj3 Gram-negative adj3 bac*) or MDR).tw. (19936) 143 ((multidrug-resistant adj3 Gram-negative adj3 bac*) or MDR).kf. (1178) 144 or/137-143 (20544) 145 134 or 144 (62594) 146 (dutch or english or german or french).la. (26464193) 147 145 and 146 (58061) 148 comparative study/ (1826171) 149 mi.fs. (720069) 150 82 or 149 (1264430) 151 147 and 150 and 97 (262) 152 151 and 82 (11) 153 exp Bodily Secretions/mi (29026) 154 exp Respiratory System/mi [Microbiology] (29104) 155 exp Digestive System/mi [Microbiology] (63773) 156 153 or 154 or 155 (112938) 157 82 or 156 (683922) 158 exp Abdomen/mi [Microbiology] (1701) 159 157 or 158 (685123) 160 97 and 147 and 159 (28) 161 147 and 159 and 113 and 124 (195) 162 (147 and 159 and 113 and 148) not 161 (97) 163 (147 and 159 and 113) not (161 or 162) (309) 164 exp Clinical Laboratory Techniques/ (2497899) 165 ((amies adj3 liquid) or ((nylon?flocked or nylon) adj3 flocked)).tw. (57) 166 ((amies adj3 liquid) or ((nylon?flocked or nylon) adj3 flocked)).kf. (3) 167 ((dry adj3 swab?) or (cotton adj3 swab?)).tw. (1243) 168 ((dry adj3 swab?) or (cotton adj3 swab?)).kf. (15) 169 ((dry adj3 swab?) or (cotton adj3 swab?)).tw.. (24435) 170 (transport adj3 (medi?? or system?)).kf. (195) 171 ((Liquid adj2 Stuart) or (rayon adj2 fiber) or (wrapped adj3 swab?) or (collection adj3 device?)).tw. (1018) 172 ((Liquid adj2 Stuart) or (rayon adj2 fiber) or (wrapped adj3 swab?) or (collection adj3 device?)).kf. (15) 173 (swab? or (transport* adj2 medium)).tw. (28947) 174 (swab? or (transport* adj2 medium)).kf. (406) 175 data accuracy/ (1517) 176 exp Quality Control/ (47284) 177 accuracy.tw,kf. (357880) 178 (quality adj3 control*).tw,kf. (52416) 179 164 or 165 or 166 or 167 or 168 or 169 or 170 or 171 or 172 or 173 or 174 (2540166) 180 or/165-174 (53342) 181 175 or 176 or 177 or 178 (438560) 182 147 and 180 and 181 (21) 183 mt.fs. (3541476) 184 147 and 179 and 183 (3664) 185 exp Clinical Laboratory Techniques/mt (286001) 186 184 and 185 (2394) 187 113 and 186 (896) 188 113 and 147 and 180 and 183 (181) 189 exp *Clinical Laboratory Techniques/mt (152851) 190 188 and 189 (91)=diagnose swabs gram- 191 exp Clinical Laboratory Techniques/is (43304) 192 exp *Clinical Laboratory Techniques/is (22219) 193 (147 and 179 and 192) not 190 (41)= instrumentation 194 from 182 keep 1-21 (21) 195 from 190 keep 1-91 (91) 196 from 193 keep 1-41 (41) 197 147 and 156 (3019) 198 179 and 197 (1725) 199 97 and 198 (4) 200 198 and (97 or 124 or 148) (704) 201 exp Specimen Handling/is, mt, st, td [Instrumentation, Methods, Standards, Trends] (64623) 202 200 and 201 (13) 203 183 and 200 (195) 204 165 or 166 or 167 or 168 or 171 or 172 (2292) 205 201 or 204 (66444) 206 200 and 205 (14) 207 200 and 113 (182)= diagn SR observat comp 208 200 and (201 or 204) (14)= swab gram- 209 181 and 200 (23)= accuracy |
288 studies |
|
Embase <1974 to 2019 April 03> |
1 MDR-GNB.tw. (151) 2 MDR-GNB.kw. (3) 3 "Multi-Drug Resistant Gram-negative Bact* (MDR-GNB)".kw. (0) 4 "Multi-Drug Resistant Gram-negative Bact* (MDR-GNB)".tw. (5) 5 "extended spectrum beta lactamase producing Enterobacteriaceae"/ (1898) 6 (Extended-Spectrum adj3 Beta-Lactamase-producing adj5 Gram-negative).tw. (135) 7 (Extended-Spectrum adj3 Beta-Lactamase-producing adj5 Gram-negative).kw. (1) 8 (ESBL adj3 producing adj5 Gram-negative).tw. (230) 9 (ESBL adj3 producing adj5 Gram-negative).kw. (2) 10 exp antibiotic resistance/ (149190) 11 ((resistance adj3 antibiotic) or (antimicrobial adj3 drug adj3 resistance?) or (antibiotic adj3 resistant adj3 organism) or (multidrug adj3 resistant adj3 organism) or (healthcare adj3 associat* adj3 infect*) or (drug adj3 resistant adj3 infect*)).tw. (42599) 12 ((resistance adj3 antibiotic) or (antimicrobial adj3 drug adj3 resistance?) or (antibiotic adj3 resistant adj3 organism) or (multidrug adj3 resistant adj3 organism) or (healthcare adj3 associat* adj3 infect*) or (drug adj3 resistant adj3 infect*)).kw. (10840) 13 (vancomycin adj3 resista*).tw. (10285) 14 (vancomycin adj3 resista*).kw. (1173) 15 (penicillin* adj3 resista*).tw. (9307) 16 (penicillin* adj3 resista*).kw. (402) 17 ((extended-spectrum adj3 beta-lactamase?) or ESBL?).tw. (14245) 18 ((extended-spectrum adj3 beta-lactamase?) or ESBL?).kw. (3816) 19 ((carbapenem? adj3 resist*) or cre).tw. (36985) 20 ((carbapenem? adj3 resist*) or cre).kw. (3878) 21 plasmid-mediated AmpC.tw. (427) 22 plasmid-mediated AmpC.kw. (37) 23 pAmpC.tw. (165) 24 pAmpC.kw. (25) 25 (colistin adj resistance).tw. (858) 26 (colistin adj resistance).kw. (180) 27 ((colistin* or colimycin or colisticin or quinolon* or aminoglycos*) adj3 resis*).tw. (9647) 28 ((colistin* or colimycin or colisticin or quinolon* or aminoglycos*) adj3 resis*).kw. (815) 29 (methicillin* adj3 resis*).tw. (35654) 30 (methicillin* adj3 resis*).kw. (4985) 31 ceftazidime/ (38517) 32 piperacillin/ (18654) 33 beta lactamase/ (18178) 34 (ceftazimidin* or piperacillin* or beta?lactam*).tw. (12221) 35 (ceftazimidin* or piperacillin* or beta?lactam*).kw. (999) 36 cotrimoxazole/ (75188) 37 ((co adj trimoxazole?) or co?trimoxazole? or abactrim or biseptol or centr?n).tw. (8597) 38 ((co adj trimoxazole?) or co?trimoxazole? or abactrim or biseptol or centr?n).kw. (564) 39 (quinolon* or aminoglycos*).tw. (38820) 40 (quinolon* or aminoglycos*).kw. (5703) 41 or/10-40 (345507) 42 exp Gram negative infection/ (23798) 43 exp Gram negative infection/dr (1011) 44 exp Enterobacteriaceae/ (453153) 45 enterobacter*.tw. (36765) 46 enterobacter*.kw. (4013) 47 (Vancomycin-Resistant adj2 Enterococc*).tw. (5710) 48 (Vancomycin-Resistant adj2 Enterococc*).kw. (742) 49 (carbapenem-resistant adj2 acinetobacter*).tw. (841) 50 (carbapenem-resistant adj2 acinetobacter*).kw. (40) 51 exp Gram negative bacterium/ (753784) 52 exp Enterobacteriaceae infection/ (47332) 53 or/42-52 (800309) 54 or/1-9 (2338) 55 54 or (42 and 53) (26026) 56 (dutch or english or german or french).la. (28895308) 57 55 and 56 (22644) 58 ((rectal or stool or faec* or fec*) adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).tw. (51777) 59 ((rectal or stool or faec* or fec*) adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).kw. (519) 60 exp Bodily Secretions/ (284198) 61 exp Specimen Handling/ (1157) 62 exp microbiological examination/ (442566) 63 or/58-62 (753257) 64 "filter systematic reviews & meta-analyses Embase ".ti. (0) 65 meta analysis/ (159470) 66 "systematic review"/ (198370) 67 (meta-analy$ or metaanaly$).tw. (189952) 68 (meta-analy$ or metaanaly$).kw. (45515) 69 (systematic$ adj4 (review$ or overview$)).tw. (190867) 70 (systematic$ adj4 (review$ or overview$)).kw. (23313) 71 (quantitativ$ adj5 (review? or overview?)).tw,kw. (4730) 72 (methodologic adj5 (overview? or review?)).tw,kw. (350) 73 (review$ adj3 (database? or medline or embase or cinahl)).tw,kw. (24427) 74 (pooled adj3 analy$).tw,kw. (25773) 75 (extensive adj3 review$ adj3 literature).tw,kw. (3370) 76 (meta or synthesis or (literature adj8 database?) or extraction).tw,kw. (1334053) 77 review.pt. (2422561) 78 76 and 77 (139165) 79 or/65-75,78 (484677) 80 57 and 63 and 79 (49) 81 "diagnose filter embase".ti. (0) 82 "sensitivity and specificity"/ (319670) 83 exp "prediction and forecasting"/ (1172705) 84 reproducibility/ (201533) 85 evaluation/ (163965) 86 feasibility study/ (106844) 87 validation study/ (75771) 88 (diagnos$ or validity or validat$ or effect$ or evidence or method or select$ or evaluat$ or identificat$ or useful or reliable or reliability or predict$ or reproduc$ or specific$ or sensitiv$ or feasib$ or outcome).ti,ab. (18474614) 89 (diagnos$ or validity or validat$ or effect$ or evidence or method or select$ or evaluat$ or identificat$ or useful or reliable or reliability or predict$ or reproduc$ or specific$ or sensitiv$ or feasib$ or outcome).kw. (774350) 90 or/82-89 (18822528) 91 "filter observationele studies emb sign".ti. (0) 92 Clinical study/ (153650) 93 Case control study/ (138140) 94 Family study/ (25945) 95 Longitudinal study/ (123426) 96 Retrospective study/ (752716) 97 Prospective study/ (507753) 98 Randomized controlled trials/ (157250) 99 97 not 98 (502624) 100 Cohort analysis/ (451593) 101 (Cohort adj (study or studies)).tw,kw. (255329) 102 (Case control adj (study or studies)).tw,kw. (122942) 103 (follow up adj (study or studies)).tw,kw. (62287) 104 (observational adj (study or studies)).tw,kw. (142289) 105 (epidemiologic$ adj (study or studies)).tw,kw. (101257) 106 (cross sectional adj (study or studies)).tw,kw. (185927) 107 92 or 93 or 94 or 95 or 96 or 99 or 100 or 101 or 102 or 103 or 104 or 105 or 106 (2320000) 108 57 and 63 and 90 and 107 (613) 109 exp comparative study/ (1304757) 110 Major Clinical Study/ (3335440) 111 57 and 63 and 90 and 107 (613) 112 111 not 80 (609) 113 exp *Bodily Secretions/ (117578) 114 exp *Specimen Handling/ (176) 115 exp *microbiological examination/ (78112) 116 ((rectal or stool or faec* or fec*) adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).ti. (3777) 117 59 or 113 or 114 or 115 or 116 (198538) 118 57 and 117 and 90 and 107 (71) 119 (57 and 117 and 90 and 109) not 118 (42) 120 (57 and 117 and 90) not (107 or 109) (254) 121 from 118 keep 1-70 (70) 122 from 119 keep 1-42 (42) 123 from 120 keep 1-254 (254) 124 ((periana* or perinea*) adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).tw. (485) 125 ((periana* or perinea*) adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).kw. (2) 126 124 or 125 (485) 127 63 and 126 (211) 128 57 and 126 (16) 129 bacterium examination/ or feces culture/ or strain identification/ or throat culture/ or urine culture/ (31451) 130 57 and 63 and (126 or 129) (366) 131 (rectal adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).tw. (5295) 132 57 and (126 or 131) and 90 (173) 133 132 and 129 (11) 134 128 or 133 (26) 135 132 and (107 or 109 or 79) (88) 136 from 134 keep 1-26 (26) 137 from 135 keep 1-88 (88) 138 (rectal adj3 (identify* or collect* or swab? or screening or isolati* or carriag* or sampl* or cultur*)).kw. (61) 139 57 and (138 or 131 or 126) and 90 (173) 140 ((amies adj3 liquid) or ((nylon?flocked or nylon) adj3 flocked)).tw. (107) 141 ((amies adj3 liquid) or ((nylon?flocked or nylon) adj3 flocked)).kw. (6) 142 ((dry adj3 swab?) or (cotton adj3 swab?)).tw. (1698) 143 ((dry adj3 swab?) or (cotton adj3 swab?)).kw. (48) 144 (transport adj3 (medi?? or system?)).tw. (25653) 145 (transport adj3 (medi?? or system?)).kw. (625) 146 ((Liquid adj2 Stuart) or (rayon adj2 fiber) or (wrapped adj3 swab?) or (collection adj3 device?)).tw. (1448) 147 ((Liquid adj2 Stuart) or (rayon adj2 fiber) or (wrapped adj3 swab?) or (collection adj3 device?)).kw. (48) 148 *"assay"/ (16056) 149 *"bacterium detection"/ (8311) 150 "intermethod comparison"/ (245911) 151 accuracy/ (161734) 152 accuracy.tw,kw. (450035) 153 exp quality control/ (365790) 154 (quality adj3 control*).tw,kw. (80203) 155 or/151-154 (900442) 156 57 and 150 and 63 (125) 157 140 or 141 or 142 or 143 or 144 or 145 or 146 or 147 (28973) 158 or/140-149 (53152) 159 57 and 150 and 158 (16)= swab afname intermethod comp 160 57 and 90 and (107 or 109 or 79) (2885) 161 158 and 160 (29)= diagnose SR observat comp 162 57 and 90 and 63 and 157 (6) 163 specimen handling/ (1157) 164 dr.fs. (94287) 165 57 and 90 and 63 and (157 or 163 or 164) (239) 166 exp *microbiological examination/ (78112) 167 exp *Specimen Handling/ (176) 168 59 or 166 or 167 (78699) 169 165 and 168 (13) 170 148 or 149 or 168 (94541) 171 165 and 170 (13)= diagnose swab 172 swab?.tw. (37799) 173 swab?.kw. (936) 174 172 or 173 (37896) 175 165 and 174 (14)=swab materialen 176 57 and 90 and 63 and 174 (236) 177 168 and 176 (19) 178 limit 177 to (embase and journal) (18) 179 limit 165 to (embase and journal) (236)= emb20190409 embase diagn SR observat comp. |
255 studies |
|
Cochrane Library (CENTRAL) < to 05/04/2019>
|
The Cochrane search for PICO 1,2 and 3 used the same criteria.. See search criteria PICO 1 |
148 studies
|
