Laboratoriummethodes voor de detectie van CPE
Uitgangsvraag
Welke laboratoriummethodes worden gebruikt voor de detectie van carbapenemases-producerende Enterobacterales?
Aanbeveling
Screening op CPE
- Bepaal de antimicrobiële gevoeligheid van Enterobacterales door middel van bouillon dilutie, agar dilutie, agar diffusie, gradient methode of een geautomatiseerd systeem.
- Gebruik de gevoeligheid voor meropenem en imipenem als indicator voor de aanwezigheid van carbapenemase productie.
- Hanteer een meropenem MIC screeningsbreekpunt van > 0.25 mg/L of een zonediameter van < 24 mm.
- Hanteer een imipenem MIC screeningsbreekpunt van > 1.0 mg/L of een zonediameter van < 22 mm, behoudens voor Morganellaceae (Morganella, Providencia, Proteus) en Serratia.
Genotypische confirmatie
- Confirmeer carbapenemase productie met een PCR-gebaseerde test bij het eerste isolaat met een positieve screeningstest, per species, per patiënt.
Fenotyische confirmatie
- Gebruik voor de fenotypische confirmatie de (gemodificeerde) CIM, een lateral flow test, een colorimetrische test, of detectie van carbapenem hydrolyse met maldi-TOF.
Kwaliteitscontrole
- Suggesties voor kwaliteitscontrole zijn de volgende stammen: K. pneumoniae ATCC BAA-1705 (KPC positief), E. coli ATCC 25922 (carbapenemase negatief), K. pneumoniae ATCC BAA-1706 (carbapenem-resistent op basis van een ander mechanisme dan carbapenemase). Voor de CIM test kan de set van stammen gebruikt worden die door het RIVM is rondgestuurd (zie https://secure.rivm.nl/mpf/database/cpe/documentatie/cim_protocol_en_brief). Ook lokaal fenotypisch en genotypisch geconfirmeerde stammen kunnen gebruikt worden.
Overwegingen
Kwaliteit van bewijs
Niet van toepassing, omdat geen systematic review verricht is.
Kosten en middelen
Het toepassen van de aanbevelingen zal geen effect op de structurele kosten hebben, omdat de aanbevelingen grotendeels al aansluiten op de bestaande praktijk.
Professioneel perspectief
Screening op CPE
De detectiestrategie bevat een screening-stap en vervolgens een fenotypische en/of genetische confirmatie-stap (zie figuur 1). De carbapenem MICs van CPEs kunnen variëren van laag (d.w.z. wildtype MIC) tot zeer hoog, afhankelijk van het species, het carbapenemase gen, de mate van expressie, en de aanwezigheid van overige resistentie mechanismen. De geadviseerde screeningsbreekpunten zijn daarom een compromis tussen specificiteit en sensitiviteit. Voor meropenem blijft op basis van dit uitgangspunt voor alle Enterobacterales een screeningsbreekpunt gehandhaafd van >0,25 mg/L. Hiermee kan de meerderheid van CPEs gedetecteerd worden in de Nederlandse epidemiologische situatie (87% o.b.v. RIVM data 2017-2018, persoonlijke communicatie). Met name OXA-48 producerende E. coli stammen kunnen gemist worden met dit screenbreekpunt (Fattouh et al, 2016). Het door EUCAST geadviseerde meropenem CPE screenbreekpunt (> 0,125 mg/L) is niet bruikbaar met de meest gebruikte automatische systemen voor gevoeligheidsbepalingen. Een verlaging van het screeningsbreekpunt van >0,25 mg/L naar >0,125 mg/L zou voor de Nederlandse epidemiologie van carbapenemase genen slechts een geringe toename opleveren van de sensitiviteit (van 87% naar 92% o.b.v. RIVM data 2017-2018). Het zone diameter screenbreekpunt voor meropenem blijft daarom ook ongewijzigd <24mm ten opzichte van de vorige versie van de richtlijn. Voor imipenem is een gemeenschappelijk breekpunt voor alle Enterobacterales niet mogelijk, omdat sommige species (Proteus spp., Serratia spp., Providencia spp. en Morganella morganii) een verhoogde imipenem MIC hebben op basis van intrinsieke resistentiemechanismen (https://eucast.org/). In deze richtlijn is er om pragmatische redenen en de beschikbare wildtype MIC distributies voor gekozen een tweedeling te maken in species waarvoor de MIC voor imipenem wel en niet als screeningsbreekpunt kan worden gebruikt. Voor E. coli, Klebsiella spp., Salmonella spp., Enterobacter spp., en Citrobacter spp. is een imipenem screeningsbreekpunt van >1.0 mg/L vastgesteld of een zone diameter van <22mm en voor Proteus spp., Serratia spp., Providencia spp. en Morganella morganii is het advies alleen het meropenem screeningsbreekpunt te hanteren.
Het imipenem screeningsbreekpunt van >1.0 mg/L heeft een sensitiviteit die varieert tussen de 79% en 100% (Pasteran et al., 2009, Tsakris et al., 2010, Vading et al, 2010). Een lager imipenem breekpunt heeft niet de voorkeur omdat de imipenem MIC distributie van de wildtype populatie 1 mg/L als hoogste waarde heeft (https://eucast.org/).
Ertapenem is niet als indicator carbapenem in deze richtlijn opgenomen omdat ertapenem ten opzichte van imipenem en meropenem een lagere specificiteit heeft (Fattouh et al., 2015). Hoewel de sensitiviteit van screening met ertapenem hoog is, is dit antibioticum minder specifiek omdat isolaten die AmpC/ESBL produceren en verminderd permeabel zijn, hogere MICs hebben voor ertapenem dan voor meropenem of imipenem (www.eucast.org, Woodford et al., 2007).
Methoden voor carbapenemase screening
De carbapenemase screening dient onderdeel uit te maken van de standaard gevoeligheidsbepalingen in de routine diagnostiek. Deze screening kan plaatsvinden door het beoordelen van gemeten carbapenem MICs, zone diameters, of door een waarschuwing van een expertsysteem (zie figuur 1).
Opgemerkt dient te worden dat carbapenem gevoelig gemeten stammen met een MIC boven het carbapenemase screeningsbreekpunt een carbapenemase gen kunnen hebben. Stammen met een meropenem MIC van 0,5 mg/l, 1 mg/l of 2 mg/l of een MIC voor imipenem van 2 mg/l zijn gevoelig (S) volgens de klinische EUCAST breekpunten, maar dienen dus wel nader te worden onderzocht op de aanwezigheid van carbapenemases. Idealiter wordt het laboratorium informatie systeem zo geprogrammeerd dat op basis van de carbapenem MICs bij screen positieve isolaten een waarschuwing verschijnt.
Confirmatie (figuur 1)
Confirmatie van carbapenemase aanwezigheid dient te geschieden bij het eerste isolaat met een positieve screeningstest, per species, per patiënt. Bij een positieve fenotypische confirmatie test dient altijd genotypische confirmatie plaats te vinden (lokaal of in het RIVM). Genotypische confirmatie zonder fenotypische confirmatie is ook mogelijk.
Genotypische confirmatie
Genotypische confirmatie bestaat uit PCR detectie (conventionele PCR of Real-Time PCR) en eventueel sequencing van carbapenemase genen. Er zijn diverse commerciële kits beschikbaar. Ook zijn micro-arrays verkrijgbaar voor detectie van de meest voorkomende carbapenemases (OXA-48, KPC, VIM, NDM en IMP) (Naas et al., 2011). In het kader van de nationale surveillance van CPE wordt aan laboratoria verzocht om de stammen op te sturen, die aan de actuele criteria van het surveillance programma voldoen.
Figuur 1. Genotypische confirmatie
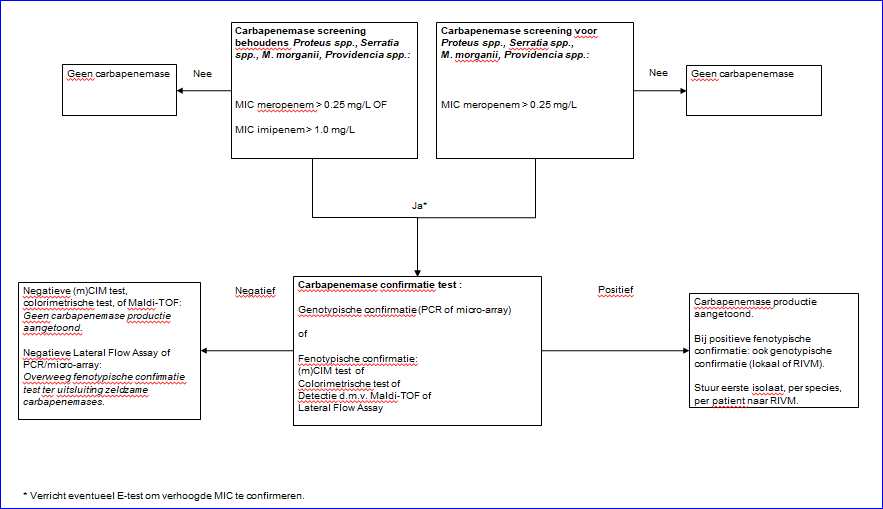
(m)CIM: (gemodificeerde) carbapenemase inhibition method
Fenotyische confirmatie
Fenotypische confirmatie kan geschieden door middel van
- CIM
- Lateral flow test
- Colorimetrische test
- Detectie van carbapenem hydrolyse d.m.v. maldi-TOF
De (gemodificeerde) Hodge test en de carbapenemase synergie testen met combinatiedisks worden niet meer geadviseerd vanwege de moeizame interpretatie. Bovendien geldt voor de combinatiedisks dat een specifieke methode of remmer ontbreekt voor het aantonen van OXA-48-like carbapenemases.
CIM
De CIM (Van der Zwaluw et al., 2015; www.rivm.nl) werkt volgens het volgende principe: een meropenem disk wordt ondergedompeld in een suspensie van het te testen isolaat en geïncubeerd. Indien dit isolaat een carbapenemase produceert, zal de meropenem in de disk geïnactiveerd worden. De disk wordt vervolgens op een Mueller‐Hinton agarplaat geplaatst, waarop een suspensie van een meropenem gevoelige E. coli (ATCC 25922) is aangebracht. Indien na incubatie geen remmingszone rondom de disk zichtbaar is, dan is het onderzochte isolaat een CPE. Als het te onderzoeken isolaat geen carbapenemase produceert, ontstaat er een remmingszone rondom de disk omdat de meropenem in de disk niet is afgebroken. Een remmingszone ≥ 4 mm kleiner dan de zone van de negatieve controle dient als (mogelijk) positief beschouwd te worden.
Inmiddels is ook een gemodificeerde variant van de CIM test ontwikkeld met een grotere sensitiviteit voor OXA-48 producers (Pierce 2017, Beresford 2019). Deze modificatie, die ontwikkeld is door de CLSI, bestaat uit verlenging van de carbapenem inactivatie fase van 2 naar 4 uur en gebruik van TSB i.p.v. water voor de bacteriële suspensie (CLSI M100-S30).
Lateral flow Assays
Deze immunochromatografische tests zijn gebaseerd op detectie van carbapenemase epitopen d.m.v. monoklonale antistoffen die zijn gefixeerd op een nitrocellulose membraan in een lateral flow systeem. Er zijn multiplex lateral flow assays ontwikkeld voor de detectie van KPC, NDM, OXA-48, VIM en IMP en voor KPC, NDM, OXA-48,VIM en IMP (Greissl et al., 2019, Hopkins et al., 2018; Volland et al., 2019). De testen leveren een resultaat na 15 minuten. Een recente vergelijking liet een 100% concordantie zien met PCR en sequencing (Bogaerts et al., 2020)
Colorimetrische methodes
De colorimetrische methodes zijn gebaseerd op detectie van in vitro carbapenem hydrolyse door bacteriële extracten waardoor pH verlaging optreedt die leidt tot kleurverandering van de indicator phenol rood naar geel (Carba NP test en varianten) of tot kleurverandering van de indicator bromothymol blauw naar de kleur groen/oranje (Blue Carba test). Er bestaan diverse modificaties en commerciële varianten van deze testen. De doorlooptijd van beide testen is minder dan 2 uur. De sensitiveit van de tests varieren tussen 65%-97% en de specificiteit van 85,7-100%, afhankelijk van de testmethode en onderzoekspopulatie (Vasoo et al., 2013; Nordmann et al., 2012; Tijet et al., 2013; Yusuf et al., 2014; Chan et al., 2020; Cunningham et al., 2017; Huang et al., 2014; Noël et al., 2017; Pasteran et al., 2015; Pires et al., 2013; Baeza et al., 2019; Bernabeu et al., 2017; Chan, 2020; Mancini et al., 2017; Noel et al., 2017). Beperkingen kunnen zijn fout-negatieve resultaten bij OXA-48 producerende stammen en onjuiste (visuele) interpretatie van de kleurverandering met als gevolg verminderde reproduceerbaarheid. Daarnaast zijn een verminderde gevoeligheid voor detectie van niet-KPC klasse A carbapenemase producerende stammen zoals GES en SME gemeld.
Fenotypische confirmatie d.m.v. maldi-TOF
Deze methode is gebaseerd op maldi-TOF detectie van imipenem en detectie van het gehydrolyseerde imipenem na incubatie van de test-stam met imipenem. Voor deze methode is een commerciële kit beschikbaar met een gerapporteerde sensitiviteit en specificiteit van respectievelijk 100% en 98,2-100% (Dortet et al., 2018; Rapp et al., 2018; Anantharajah et al., 2019) voor Enterobacterales.
Kwaliteitscontrole
De volgende stammen worden gesuggereerd om te gebruiken voor kwaliteitscontroles: K. pneumoniae ATCC BAA-1705 (KPC positief), en E. coli ATCC 25922 (carbapenemase negatief), K. pneumoniae ATCC BAA-1706 (carbapenem-resistent op basis van een ander mechanisme dan carbapenemase). Voor de CIM test kan de set van stammen gebruikt worden die door het RIVM is rondgestuurd (zie https://secure.rivm.nl/mpf/database/cpe/documentatie/cim_protocol_en_brief). Ook lokaal fenotypisch en genotypisch geconfirmeerde stammen kunnen gebruikt worden.
Aanvaardbaarheid/haalbaarheid van de aanbeveling(en)
Onderstaande aanbevelingen zijn haalbaar en aanvaardbaar voor medisch microbiologische laboratoria, omdat zij grotendeels aansluiten bij de huidige klinische praktijk.
Onderbouwing
Zoeken en selecteren
Er is geen systematische literatuuranalyse verricht. De werkgroepleden maakten gebruik van door hen zelf verzamelde artikelen (zie overwegingen).
Referenties
- Anantharajah A, Tossens B, Olive N, Kabamba-Mukadi B, Rodriguez-Villalobos H, Verroken A. Performance Evaluation of the MBT STAR®-Carba IVD Assay for the Detection of Carbapenemases With MALDI-TOF MS. Front Microbiol. 2019 Jun 20;10:1413.
- Baeza LL, Pfennigwerth N, Greissl C, et al. Comparison of five methods for detection of carbapenemases in Enterobacterales with proposal of a new algorithm. Clin Microbiol Infect. 2019;25(10):1286.e9-1286.e15.
- Beresford RW, Maley M. Reduced Incubation Time of the Modified Carbapenem Inactivation Test and Performance of Carbapenem Inactivation in a Set of Carbapenemase-Producing Enterobacteriaceae with a High Proportion of blaIMP Isolates. J Clin Microbiol. 2019;57(7):e01852-18. Published 2019 Jun 25.
- Bernabeu S, Dortet L, Naas T. Evaluation of the β-CARBA™ test, a colorimetric test for the rapid detection of carbapenemase activity in Gram-negative bacilli. J Antimicrob Chemother. 2017;72(6):1646-1658.
- Bogaerts P, Berger AS, Evrard S, Huang TD. Comparison of two multiplex immunochromatographic assays for the rapid detection of major carbapenemases in Enterobacterales. J Antimicrob Chemother. 2020 Jun 1;75(6):1491-1494.
- Chan WW, Campbell L, Doyle D, Pitout JD. Rapid detection of Enterobacterales that produce carbapenemases. Diagn Microbiol Infect Dis. 2020;98(2):115120.
- Cunningham SA, Limbago B, Traczewski M, et al. Multicenter Performance Assessment of Carba NP Test. J Clin Microbiol. 2017;55(6):1954-1960.
- Dortet L, Tandé D, de Briel D, Bernabeu S, Lasserre C, Gregorowicz G, Jousset AB, Naas T. MALDI-TOF for the rapid detection of carbapenemase-producing Enterobacteriaceae: comparison of the commercialized MBT STAR®-Carba IVD Kit with two in-house MALDI-TOF techniques and the RAPIDEC® CARBA NP. J Antimicrob Chemother. 2018 Sep 1;73(9):2352-2359.
- Fattouh R, Tijet N, McGeer A, Poutanen SM, Melano RG, Patel SN. What Is the Appropriate Meropenem MIC for Screening of Carbapenemase-Producing Enterobacteriaceae in Low-Prevalence Settings?. Antimicrob Agents Chemother. 2015;60(3):1556-1559. Published 2015 Dec 28.
- Greissl C, Saleh A, Hamprecht A. Rapid detection of OXA-48-like, KPC, NDM, and VIM carbapenemases in Enterobacterales by a new multiplex immunochromatographic test. Eur J Clin Microbiol Infect Dis. 2019;38(2):331-335.
- Hopkins KL, Meunier D, Naas T, Volland H, Woodford N. Evaluation of the NG-Test CARBA 5 multiplex immunochromatographic assay for the detection of KPC, OXA-48-like, NDM, VIM and IMP carbapenemases. J Antimicrob Chemother. 2018;73(12):3523-3526.
- Huang TD, Berhin C, Bogaerts P, Glupczynski Y. Comparative evaluation of two chromogenic tests for rapid detection of carbapenemase in Enterobacteriaceae and in Pseudomonas aeruginosa isolates. J Clin Microbiol. 2014;52(8):3060-3063.
- Mancini S, Kieffer N, Poirel L, Nordmann P. Evaluation of the RAPIDEC® CARBA NP and β-CARBA® tests for rapid detection of Carbapenemase-producing Enterobacteriaceae. Diagn Microbiol Infect Dis. 2017;88(4):293-297.
- Naas T, Oueslati S, Bonnin RA, et al. Beta-lactamase database (BLDB) - structure and function. J Enzyme Inhib Med Chem. 2017;32(1):917-919.
- Noël A, Huang TD, Berhin C, et al. Comparative Evaluation of Four Phenotypic Tests for Detection of Carbapenemase-Producing Gram-Negative Bacteria. J Clin Microbiol. 2017;55(2):510-518.
- Nordmann P, Poirel L, Dortet L. 2012. Rapid detection of carbapenemase-producing Enterobacteriaceae. Emerg Infect Dis 18:1503–1507.
- Pasteran F, Veliz O, Ceriana P, et al. Evaluation of the Blue-Carba test for rapid detection of carbapenemases in gram-negative bacilli. J Clin Microbiol. 2015;53(6):1996-1998.
- Pasteran, F., T. Mendez, L. Guerriero, M. Rapoport, and A. Corso. 2009. Sensitive screening tests for suspected class A carbapenemase production in species of Enterobacteriaceae. J.Clin.Microbiol. 47:1631-1639. 23.
- Pierce VM, Simner PJ, Lonsway DR, et al. Modified Carbapenem Inactivation Method for Phenotypic Detection of Carbapenemase Production among Enterobacteriaceae. J Clin Microbiol. 2017;55(8):2321-2333.
- Pires J, Novais A, Peixe L. 2013. Blue-Carba, an easy biochemical test for detection of diverse carbapenemase producers directly from bacterial cultures. J Clin Microbiol 51:4281– 4283.
- Rapp E, Samuelsen Ø, Sundqvist M. Detection of carbapenemases with a newly developed commercial assay using Matrix Assisted Laser Desorption Ionization-Time of Flight. J Microbiol Methods. 2018 Mar;146:37-39.
- Tijet N, Boyd D, Patel SN, Mulvey MR, Melano RG. 2013. Evaluation of the Carba NP test for rapid detection of carbapenemase-producing Enterobacteriaceae and Pseudomonas aeruginosa. Antimicrob Agents Chemother 57:4578–4580.
- Tsakris, A., A. Poulou, S. Pournaras, E. Voulgari, G. Vrioni, K. Themeli-Digalaki, D. Petropoulou, and D. Sofianou. 2010. A simple phenotypic method for the differentiation of metallo-beta-lactamases and class A KPC carbapenemases in Enterobacteriaceae clinical isolates. J.Antimicrob.Chemother. 65:1664-1671.
- Vading M, Samuelsen Ø, Haldorsen B, Sundsfjord AS, Giske CG. Comparison of disk diffusion, Etest and VITEK2 for detection of carbapenemase-producing Klebsiella pneumoniae with the EUCAST and CLSI breakpoint systems. Clin Microbiol Infect. 2011;17(5):668-674.
- Van der Zwaluw K, de Haan A, Pluister GN, Bootsma HJ, de Neeling AJ, Schouls LM. The carbapenem inactivation method (CIM), a simple and low-cost alternative for the Carba NP test to assess phenotypic carbapenemase activity in gram-negative rods. PLoS One. 2015;10(3):e0123690. Published 2015 Mar 23.
- Vasoo S, Cunningham SA, Kohner PC, Simner PJ, Mandrekar JN, Lolans K, Hayden MK, Patel R. 2013. Comparison of a novel, rapid chromogenic biochemical assay, the Carba NP test, with the modified Hodge test for detection of carbapenemase-producing Gram-negative bacilli. J Clin Microbiol 51:3097–3101.
- Volland H, Girlich D, Laguide M, et al. Improvement of the Immunochromatographic NG-Test Carba 5 Assay for the Detection of IMP Variants Previously Undetected. Antimicrob Agents Chemother. 2019;64(1):e01940-19. Published 2019 Dec 20.
- Woodford, N., J. W. Dallow, R. L. Hill, M. F. Palepou, R. Pike, M. E. Ward, M. Warner, and D. M. Livermore. 2007. Ertapenem resistance among Klebsiella and Enterobacter submitted in the UK to a reference laboratory. Int.J.Antimicrob.Agents 29:456-459.
- Yusuf E, Van Der Meeren S, Schallier A, Pierard D. 2014. Comparison of the Carba NP test with the Rapid Carb screen kit for the detection of carbapenemase-producing Enterobacteriaceae and Pseudomonas aeruginosa. Eur J Clin Microbiol Infect Dis 33:2237–2240.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 27-07-2021
Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Vereniging voor Medische Microbiologie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Medische Microbiologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door B.S. Niël-Weise, zelfstandig richtlijnmethodoloog, en werd gefinancieerd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De richtlijn is ontwikkeld in samenwerking met de Vereniging voor Hygiëne en Infectiepreventie in de Gezondheidszorg.
Doel en doelgroep
Doel
Het doel van het project is het herzien van de huidige richtlijn Laboratoriumdiagnostiek van BRMO die dateert uit 2012. Afgezien van het verstrijken van de reguliere termijn voor herziening zijn er nieuwe inzichten en methoden beschikbaar gekomen die de diagnostiek kunnen optimaliseren.
Doelgroep
De richtlijn is met name bedoeld voor artsen-microbioloog, deskundigen infectiepreventie, internisten-infectioloog en medisch moleculair microbiologen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de pre-analytische (afname, transport en bewaaromstandigheden) en de analytische fase van de laboratorium detectie van BRMO inclusief de rapportage naar de aanvrager danwel naar het patiëntendossier.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 2 jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep:
- Prof. dr. J.A.J.W. Kluytmans, arts-microbioloog, Amphia Ziekenhuis Breda/Oosterhout; Elisabeth-TweeSteden Ziekenhuis, Tilburg; Universitair Medisch Centrum Utrecht
- Drs. W. van den Bijllaardt, arts-microbioloog, Amphia Ziekenhuis Breda
- Dr. E. Bathoorn, arts-microbioloog, Universitair Medisch Centrum Groningen
- Dr. J. Cohen Stuart, arts-microbioloog, Noordwest Ziekenhuis Alkmaar
- Dr. J. J. Verweij, medisch moleculair microbioloog/parasitoloog, Elisabeth-Tweesteden Ziekenhuis, Tilburg
- Dr. W. H.F. Goessens, microbioloog, Erasmus MC Universitair Medisch Centrum Rotterdam
- Dr. N. al Naiemi, arts-microbioloog, Labmicta, Hengelo
- Prof. Dr. M.C. Vos, arts-microbioloog, Erasmus MC Universitair Medisch Centrum, Rotterdam
- Dr. L. van Dommelen, arts-microbioloog, PAMM, Veldhoven
- Dr. P. Croughs, arts-microbioloog, Erasmus MC Universitair Medisch Centrum, Rotterdam
- Drs. A. Klak, arts-microbioloog in opleiding, Universitair Medisch Centrum Groningen
Meelezers:
- Dr. M.K. Bomers, internist-infectioloog, Amsterdam UMC, locatie VUmc
- Mv. M. Molenaar, deskundige infectiepreventie, OLVG Amsterdam
- Mv. S. Cremers-Pijpers, deskundige infectiepreventie, Radboudumc, Nijmegen
Met ondersteuning van:
- Mw. B.S. Niël-Weise, zelfstandig richtlijnmethodoloog, Deventer
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancieerd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij de Nederlandse Vereniging voor Medische Microbiologie, een overzicht vindt u hieronder:
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
|
Jan Kluytmans |
|
|
Geen |
Geen |
Subsidiegevers zijn Euopese commissie, Nederlandse overheid en provincies. Geen belangen bij deze richtlijn |
Geen |
Geen |
|
Erik Bathoorn |
Arts-microbioloog, UMCG Groningen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Wouter van den Bijllaardt |
Arts-microbioloog Amphia ziekenhuis Breda |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
James Cohen Stuart |
Arts-microbioloog Noordwest Ziekenhuisgroep |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Jaco Verweij |
Medisch moleculair microbioloog, ETZ Ziekenhuis, Tilburg |
|
Geen |
Geen |
Geen |
Geen |
Geen |
|
Wil Goessens |
Medisch microbioloog Erasmus Medisch Centrum Rotterdam |
Geen |
Patent: detectie van carbapenemase middels maldi-TOF |
Geen |
Geen |
Geen |
Geen |
|
Nashwan al Naiemi |
Arts-microbioloog LabMicTA Bestuurder LabMicTA |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Greet Vos |
Arts-microbioloog MC Rotterdam |
|
Geen |
Geen |
Unrestricted grant 3m, Pentax |
Geen |
Geen |
|
Adrian Klak |
AIOS Medische Microbiologie UMCG |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Peter Croughs |
Arts-microbioloog, Erasmus Medisch Centrum |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Laura van Dommelen |
Arts-microbioloog, Stichting PAMM te Veldhoven |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Marije Bomers |
Internist- infectioloog, Amsterdam UMC, locatie VUmc |
Geen |
Financieel belang farmaceutisch bedrijf Shionogi |
Geen |
Subsidiegevers zijn ZonMW en Amsterdam UMC corona research fonds. Geen belangen bij deze richtlijn |
Geen |
Geen |
|
Myrte Molenaar |
Deskundige Infectiepreventie OLVG Amsterdam |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Suzan Cremers |
Deskundige |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door in de voorbereidende fase de Patiëntenfederatie Nederland te vragen om schriftelijke input omtrent knelpunten en aandachtspunten. De Patiëntenfederatie gaf aan geen knelpunten aan te leveren vanwege het technisch karakter van de richtlijn. De werkgroep heeft de conceptrichtlijn ook tijdens de commentaarfase voorgelegd aan de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren (zie het Implementatieplan in de bijlagen).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwalitieit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (https://www.agreetrust.org/), dat een internationaal breed geaccepteerd instrument is en op ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur welke onderwerpen moesten worden herzien. Deze werden met de werkgroep besproken. Tevens werd aan de volgende organisaties gevraagd om knelpunten aan te dragen: het Zorginstituut Nederland, Inspectie Gezondheidszorg en Jeugd, Vereniging voor Hygiëne & Infectiepreventie in de Gezondheidszorg, Patiëntenfederatie Nederland en Zorgverzekeraars Nederland.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep uitgangsvragen opgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant waren, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar relevante buitenlandse richtlijnen en naar systematische reviews. Voor (internationale) richtlijnen is gezocht in de databases van National Guideline Clearinghouse (NGC), Guidelines International Network (GIN), World Health Organisation (WHO) en Centers for Disease Control and Prevention (CDC). Voor bestaande systematic reviews is gezocht in de databases Ovid Medline en Embase (zie de zoekverantwoording).
Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kwaliteit van bewijs (‘quality of evidence’) werd beoordeeld met behulp van GRADE (Guyatt et al., 2008). GRADE is een methode die per uitkomstmaat van een interventie, of voor een risico- of prognostische factor, een gradering aan de kwaliteit van bewijs toekent op basis van de mate van vertrouwen in de schatting van de effectgrootte (tabel 1 en 2).
Tabel 1 Indeling van de kwaliteit van bewijs volgens GRADE
|
Hoog |
Er is veel vertrouwen dat het werkelijke effect dicht in de buurt ligt van het geschatte effect. |
|
|
|
|
Matig |
Er is matig vertrouwen in het geschatte effect: het werkelijk effect ligt waarschijnlijk dicht bij het geschatte effect, maar er is een mogelijkheid dat het hiervan substantieel afwijkt. |
|
|
|
|
Laag |
Er is beperkt vertrouwen in het geschatte effect: het werkelijke effect kan substantieel verschillen van het geschatte effect. |
|
|
|
|
Zeer laag |
Er is weinig vertrouwen in het geschatte effect: het werkelijke effect wijkt waarschijnlijk substantieel af van het geschatte effect. |
Tabel 2 De kwaliteit van bewijs wordt bepaald op basis van de volgende criteria
|
Type bewijs |
Voor studies over interventies: RCT start in de categorie ‘hoog’. Observationele studie start in de categorie ‘laag’. Alle overige studietypen starten in de categorie ‘zeer laag’.
Voor studies over een risico- of prognostische factor: Prospectieve of retrospectieve cohortstudie start in de categorie ‘hoog’. Voor andere studieontwerpen wordt afgewaardeerd via ‘risk of bias’. |
|
|
Afwaarderen |
‘Risk of bias’ |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Inconsistentie |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Indirect bewijs |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Onnauwkeurigheid |
- 1 Ernstig - 2 Zeer ernstig |
|
|
Publicatiebias |
- 1 Waarschijnlijk - 2 Zeer waarschijnlijk |
|
Opwaarderen |
Groot effect |
+ 1 Groot + 2 Zeer groot |
|
|
Dosis-respons relatie |
+ 1 Bewijs voor gradiënt |
|
|
Alle plausibele ‘confounding’ |
+ 1 zou een effect kunnen reduceren + 1 zou een tegengesteld effect kunnen suggereren terwijl de resultaten geen effect laten zien. |
Formuleren van de conclusies
Een conclusie verwijst niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence).
Overwegingen
Voor het komen tot een aanbeveling zijn naast de kwaliteit van het wetenschappelijk bewijs over de gewenste en ongewenste effecten van een interventie, of over de effectgrootte van een risico- of prognostische factor, vaak ook nog andere factoren van belang (Alonso-Coello et al., 2016).
Genoemd kunnen worden:
- kosten,
- waarden, voorkeuren en ervaringen van patiënten en behandelaars met betrekking tot interventies en uitkomsten van zorg,
- balans van gewenste en ongewenste effecten van interventies ten opzichte van geen of andere interventies,
- aanvaardbaarheid van interventies,
- haalbaarheid van een aanbeveling.
Bij voorkeur wordt ook voor deze aspecten naar wetenschappelijk bewijs gezocht. De werkgroep die deze richtlijn heeft opgesteld, heeft hiervan afgezien omdat de hiervoor benodigde tijd in geen enkele verhouding zou staan tot de verwachte opbrengst. De werkgroep heeft, daar waar dit noodzakelijk werd geacht, op basis van eigen ervaring en expertise de hiervoor genoemde aspecten geïnventariseerd.
Deze aspecten worden besproken na de ‘conclusie’ onder het kopje ‘overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. Dit is afhankelijk van het gewicht dat wordt toegekend aan kosten, gewenste of ongewenste effecten en andere onder de overwegingen genoemde factoren.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de bijlage Kennislacunes.
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. Tevens is de richtlijn voorgelegd aan de organisaties die ook tijdens de knelpuntanalyse betrokken waren. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Literatuurlijst
- Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089.
- Guyatt et al., 2008Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, Schünemann HJ; GRADE Working Group (2008). GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 336: 924-6.
- Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
