Inconclusieve diagnose CF
Uitgangsvraag
- Wat zijn de diagnostische vervolgstappen bij een inconclusieve diagnose CF*?
- Hoe vervolg je patiënten met een inconclusieve diagnose CF*?
*CF Screen Positive, Inconclusive Diagnosis (CFSPID)/CFTR-related metabolic syndrome (CRMS) en CFTR related disorder (CFTR-RD)
Aanbeveling
Definitie
Er is sprake van CRMS/CFSPID indien er een positieve hielprikscreening is EN
- Groep 1: Een normale zweettest (Cl < 30 mmol/L) en twee CFTR-mutaties, waarvan tenminste één met onduidelijke klinische consequentie
OF
- Groep 2: Intermediate zweettest (Cl 30 tot 59 mmol/L) en één of geen CF-veroorzakende mutatie.
Er is sprake van een CFTR-related disorder (CFTR-RD) bij kinderen die niet via hielprikscreening zich presenteren of volwassen patiënten indien er klinische sprake is van CBAVD, pancreatitis of bronchiectasieën EN
- Groep 1: Een normale zweettest (Cl < 30 mmol/L) en twee CFTR-mutaties, waarvan tenminste één met onduidelijke klinische consequentie
OF
- Groep 2: Intermediate zweettest (Cl 30 tot 59 mmol/L) en één of geen CF veroorzakende mutatie.
Volg de volgende aanvullende diagnose stappen bij CRMS/CFSPID of CFTR-RD (follow-up volgens ANS-CF-protocol (zie overwegingen)
Voer EGA/MLPA analyse uit bij een inconclusieve CF-diagnose met één CFTR-mutatie.
Overweeg de uitvoer van ICM of CFTR-functiemeting in organoids.
Het uiteindelijke besluit om kinderen met CRMS/CFSPID te herdiagnosticeren met CF is een geïntegreerde beslissing die meerdere componenten bevat:
- functionele beoordeling van CFTR (zweettest en mogelijk ICM of CFTR-functiemeting in organoids);
- CFTR genetische analyse (inclusief EGA/MLPA);
- klinische beoordeling door CF-team.
Overwegingen
Diagnostiek
Een bijvangst van de hielprikscreening is dat er kinderen zijn waarbij de diagnose CF niet helemaal duidelijk is. Hierbij zijn meerdere groepen te onderscheiden: zie Figuur 1.
Sinds 2015 is de term CFSPID hiervoor geïntroduceerd door de ECFS. In de VS spreekt men van CRMS (CFTR related metabolic syndrome). In 2019 is de definitie aangescherpt en geharmoniseerd en is de term CRMS/CFSPID aangenomen in een consensus Delphi meeting met ECFS en CFF (Southern, 2019).
Er is sprake van CFSPID indien er een positieve hielprikscreening voor CF is EN
- Groep 1: Een normale zweettest (Cl < 30 mmol/L) en twee CFTR mutaties, waarvan tenminste één met onduidelijke klinische consequentie.
OF
- Groep 2: Intermediate zweettest (Cl 30 tot 59 mmol/L) en één of geen CF veroorzakende mutatie (hierbij kan ook één CF veroorzakende mutatie en één mutatie met onduidelijke klinische consequentie zijn).
NB zweettest: De gouden standaard voor een zweettest is de bepaling van chloride concentratie in het zweet. Het zweet kan verkregen worden door middel van de macroduct of de Gibson and Cooke-methode. Laboratoria die de zweettest uitvoeren, dienen te voldoen aan internationale criteria zoals gedefinieerd in de ECFS best practice guidelines uit 2018 (Castellani, 2018). De zweettest door middel van geleiding kan slechts als voorscreening gebruikt worden, maar kan in geen geval gebruikt worden om de diagnose te bevestigen. Zeker bij de inconclusieve diagnose zal de geleidingstest tekort schieten. Bij kinderen onder de 6 maanden moet altijd chloride in het zweet gemeten worden; ook al is de geleiding normaal.
Figuur 1 Een algoritme voor de diagnose van kinderen na een positief resultaat van de hielprikscreening
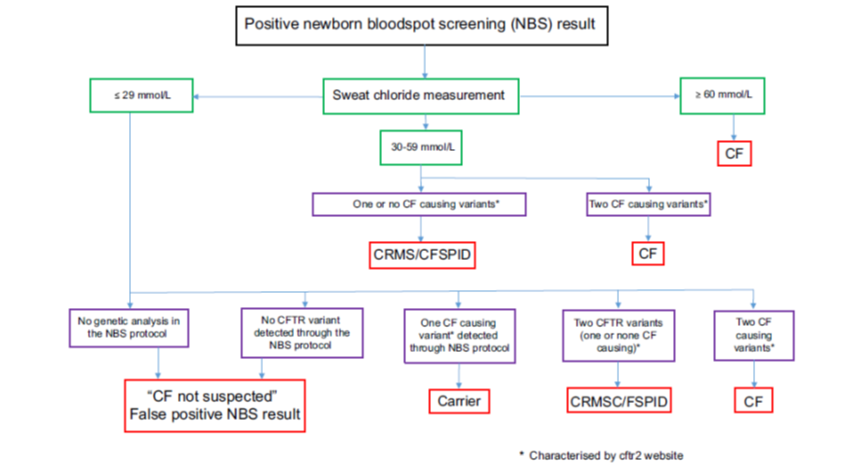
CF=Cystic Fibrosis; CFTR=CF transmembrane conductance regulator (gene); CRMS, CFTR-related metabolic syndrome; CFSPID, CF sreening positive, inconclusive diagnosis; CRMS/CFSPID=harmonised definition
Bron: Southern, 2019
Kinderen met een intermediate zweettest en twee CF mutaties, waarvan één CF veroorzakend en waarvan één met onduidelijke klinische consequentie zoals R117H worden in de nieuwe definitie van 2019 ook gezien als CRMS/CFSPID.
Patiënten die niet via de hielprikscreening zijn gevonden maar wel voldoen aan de criteria voor CRMS/CFSPID vallen ook onder deze definitie. Zij presenteren zich meestal met mildere symptomen. Indien dan maar één orgaan aangedaan is zoals CBAVD, pancreatitis of bronchiectasiëen, spreken we van CFTR-related disease (Bombieri JCF 2011).
Internationaal is veel discussie rondom de kinderen met CFSPID over de intensiteit van de follow-up, welke mutaties wel of niet geïncludeerd moeten worden in de hielprikscreening, en welke mutaties meer at risk zijn voor het ontwikkelen van bronchiëctasieën. Het algemene idee is dat de hielprikscreening niet opgezet is om zogenaamde “milde” CF op te sporen. In 2016 is daarom de R117H-7T uit het DNA-screeningspanel verwijderd in Nederland. Echter, omdat ook dragers, gevonden via de hielprikscreening worden verwezen naar een CF centrum, kunnen bij deze groep de kinderen met één R117H nog steeds opgepikt worden uit de screening, als er alsnog een DNA-test wordt verricht bij een afwijkende zweettest.
ICM kan mogelijk een bijdrage leveren aan het beter classificeren in geval van een onzekere diagnose (CRMS/CFSPID). Een afwijkende ICM lijkt voorspellend voor het ontwikkelen van CF symptomen. De zekerheid van de literatuurconclusies hierover is zeer laag door de lage aantallen patiënten, daarom wordt hier een zwakke aanbeveling gedaan.
In de CFF consensus guideline voor diagnostiek (Farrell, 2017) is de aanbeveling opgenomen over CRMS/CFSPID dat wanneer functionele CF testen nodig zijn (zoals ICM en NPD), dit uitgevoerd moet worden in een gevalideerd referentie centrum met getrainde staf.
In de CFF consensus guideline voor diagnostiek (Farrell, 2017) is ook de aanbeveling opgenomen dat het uiteindelijke besluit om kinderen met CRMS/CFSPID te diagnosticeren met CF, een geïntegreerde beslissing is die de functionele beoordeling van CFTR (zweettest en indien mogelijk ICM en NPD) omvat, CFTR genetische analyse en een klinische beoordeling door het CF-team.
De nasal potential difference (NPD) is een methode die de CFTR functie in het neusslijmvlies meet. Echter, omdat de NPD niet uitvoerbaar is onder de 6 jaar en er op dit moment geen mogelijkheid meer is om dat te doen binnen Nederland wordt deze methode hier buiten beschouwing gelaten. De NPD kan op latere leeftijd wel als additionele test dienen voor het bepalen van de CFTR functie. Eventueel kan dit nog in België gedaan worden.
Follow-up
Het precieze percentage van kinderen met een CRMS/CFSPID dat later CF ontwikkelt of CF gerelateerde klachten krijgt, is nog onbekend in Nederland, echter in andere landen lijkt er een substantieel percentage uiteindelijk een CF diagnose te krijgen. Dit percentage is ook afhankelijk van de uitgebreidheid van screeningsmethodes, kwaliteit van registratie/definitie en geografische variatie in mutaties. Hier is nog meer onderzoek voor nodig, bijvoorbeeld uit de registratiedata. De kans op ontwikkeling van CRMS/CFSPID naar CF is waarschijnlijk groter indien de zweettest tussen 30 en 59 mmol/l is, en /of de ICM afwijkend is. Dit geeft aan dat het regelmatig vervolgen van deze patiënten in CF centra belangrijk is om de minderheid te identificeren die mogelijk klinische symptomen gaat ontwikkelen.
In een consensus guideline voor diagnostiek (Farrell, 2017) bij CF van de CFF, en de ECFS Delphi consensus over CRMS/CFSPID (Munck, 2015) zijn meerdere aanbevelingen opgenomen over follow-up bij kinderen met CRMS/CFSPID :
- ten minste één keer herhalen van de zweettest bij een CF-centrum;
- klinische evaluatie door CF zorgverleners;
- genetische counseling dient te worden aangeboden aan de familie van de index-patiënt.
Daarnaast wordt in verschillende artikelen ook benadrukt dat een onzekere diagnose ook veel stress bij de ouders oplevert. Het bespreekbaar maken van de zorgen en psychologische begeleiding hierbij is daarom erg belangrijk.
Tot slot, benoemd de CFF consensus richtlijn ook dat verder onderzoek belangrijk is om de prognose van deze groep beter te begrijpen en best-practices voor frequentie en duur van follow-up verzameld dienen te worden. Om dit type onderzoek op te zetten is opname van dit type patiënten in een apart deel van de CF databases essentieel.
Follow-up bij CRMS/CFSPID volgens ANS-CF protocol
• Vervolg patiënten met CRMS/CFSPID in een CF-centrum.
• Vervolg kinderen vanaf twee maanden met een klinische beoordeling, de frequentie van deze follow-up is individueel bepaald op grond van klachten en presentatie.
Groep 1 en 2*
- Controle in CF-centrum door kinderlongarts, op indicatie door overige CF-team leden. Voorkom kruisinfectie.
- Jaarlijks raadpleging CFTR2-website ten behoeve van nieuwe inzichten met betrekking tot betekenis/relevantie mutaties.
- Instructie familie + huisarts ten aanzien van wanneer contact op te nemen. (> 2 weken luchtwegklachten, dunne ontlasting en/of matige groei).
- Aanbieden consult klinische genetica en indien gewenst (psychologische) counseling.
- 2e zweettest op leeftijd van 6 tot 12 maanden (overweeg 3e zweettest op leeftijd van 2 jaar).
- Jaarlijks onderzoek: lengtegroei, gewichtstoename, luchtwegklachten (laboratoriumdiagnostiek / beeldvorming uitsluitend op indicatie).
- Bespreek met familie: geen definitieve diagnose CF, jaarlijks herevaluatie.
- Registreer deze patiënten in Neorah en NCFS database als CFSPID
Aanvullend beleid groep 1*
- Controle op de leeftijd van 6 tot 12 maanden, waarna 1x/jaar.
Aanvullend beleid groep 2*
- Aanvullende diagnostiek conform algoritme bij inconclusieve diagnose (onder andere ICM, CFTR functiemeting in organoids).
- Bij hoesten laagdrempeliger kweek + oraal antibiotica.
- Routinematig sputumkweek bij elk poliklinisch bezoek en op klinische indicatie.
- Jaarlijks vaccinatie influenza.
- Bespreken zweettestuitslag en effect van zweetverlies op zoutbalans (zoutsuppletie)
- Controle a 3 maanden in eerste levensjaar, waarna tenminste 1x/jaar of vaker indien nodig.
*Groep 1: Een normale zweettest (Cl < 30 mmol/L) en twee CFTR mutaties, waarvan tenminste één met onduidelijke klinische consequentie
*Groep 2: Intermediate zweettest (Cl 30 tot 59 mmol/L) en één of geen CFTR mutatie (hierbij kan ook één CF veroorzakende mutatie en één mutatie met onduidelijke klinische consequentie zijn).
Onderbouwing
Achtergrond
Sinds mei 2011 is CF toegevoegd aan de hielprikscreening. In Nederland is gekozen voor een 4 stappen protocol (RIVM, screeningsprotocol CF, 2018) met IRT/PAP/DNA/EGA (extended gene analysis)
Kinderen met één of twee klinisch relevante of onbekende CF mutaties worden verwezen naar een CF-centrum voor een zweettest om de diagnose CF te bevestigen of uit te sluiten. Kinderen met één mutatie en een negatieve zweettest worden geregistreerd als dragers, en behoeven geen verdere follow-up. Kinderen met twee bekende CF mutaties en een positieve zweettest krijgen de diagnose CF en zullen vervolgd worden volgens de daarvoor geldende richtlijnen. Een consequentie van de hielprikscreening is dat er kinderen zijn waarbij de diagnose CF niet helemaal duidelijk is. Dat zijn de kinderen met CFSPID (CF screen positive inconclusive diagnosis). De internationale term die hiervoor gebruikt wordt is nu CRMS/CFSPID (referentie Southern, 2019, zie Figuur 1)), echter de term CFSPID is nu in Nederland de algemene term die hiervoor gebruikt wordt. Bij patiënten waarbij twijfel bestaat over de diagnose na verrichting van zweettest dient in ieder geval een aanvullende DNA analyse gedaan te worden: dit betreft een EGA inclusief de MLPA. De MLPA is niet opgenomen in de DNA analyse van de hielprikscreening. Hierdoor kunnen grote deleties in het CFTR gen gemist worden.
LET OP: Sinds invoering van de hielprikscreening zijn er minstens 20 patiënten alsnog later gediagnosticeerd met CF na een vals-negatieve hielprikscreening. Let op dat bij patiënten met meconiumileus vaak vals-negatieve hielprikscreening voor CF is. Daarnaast zijn er natuurlijk ook nog patiënten die voor de invoering van de hielprikscreening zijn geboren (voor mei 2011), of immigranten uit landen waar geen newbornscreening neonatale screening gedaan wordt, waarbij bij klachten aan CF gedacht moet worden.
Er zijn ook oudere patiënten met een inconclusieve CF diagnose. Zij presenteren zich vaak met mildere symptomen. Als deze patiënten zich presenteren met symptomen in één orgaansysteem, zoals CBAVD, pancreatitis of bronchiectasieën, met CFTR dysfunctie dan noemen we dit CFTR-related disorder (Bombieri, 2011).
Over de afspraken omtrent diagnostiek en follow-up van patiënten met CRMS/CFSPID zijn nog onduidelijkheden. Voor deze groep patiënten blijft daarom een aantal vragen onbeantwoord. De volgende vragen worden in deze module besproken.
- Diagnostiek: Welke diagnostiek is nodig bij een inconclusieve CF diagnose, en wat is de waarde daarvan? Over de eerste stappen als een zweettest en DNA diagnostiek is eenduidigheid, maar wat is de rol van een intestinal current measurement (ICM) in de diagnostiek bij een inconclusieve CF diagnose? Deze vraag geldt ook voor oudere kinderen of volwassenen met een inconclusieve diagnose.
- Follow-up: Hoe vervolg je patiënten met een inconclusieve diagnose CF?
Samenvatting literatuur
Er zijn twee studies samengevat over de diagnostische waarde van ICM bij patiënten met een twijfelachtige CF diagnose. Er is gekozen voor een beschrijving van de studies zonder GRADE-beoordeling en conclusies vanwege de aard van de studies en omdat ze niet helemaal voldoen aan de PICO. Er zijn geen evidence en risk of bias tabellen gemaakt.
Derichs (2010) beschrijft een prospectieve studie naar de diagnostische waarde van ICM voor twijfelachtige CF bij alle leeftijdscategorieën. De correlatie van ICM met de zweettest (n=130), uitgebreide CFTR genotypering (n=61) en transcript analyse (n=19) werd onderzocht. Dit onderzoek werd uitgevoerd in een cohort van 130 kinderen, adolescenten en volwassenen. De gemiddelde leeftijd was 16,9 sd 12,5 jaar; range 0,4 tot 60 jaar; 23% < 6 jaar; 35% ≥ 18 jaar en 54% was man.
Er werd een groep onderzocht van 34 pancreasinsufficiënte patiënten met CF, 7 pancreassufficiënte patiënten met CF en 28 volwassen gezonde vrijwilligers. Daarnaast werden 61 patiënten met een twijfelachtige CF diagnose geïncludeerd (milde of monosymptomatisch fenotype met sinopulmonale, gastrointestinale of urogenitale symptomen horende bij niet klassiek CF). De zweettest en/of CFTR mutatie screening waren inconclusief, waarbij 26% één CFTR mutatie had.
In totaal werden 309 rectale biopten afgenomen bij de 130 patiënten voor ICM.
Er werden referentiewaarden verkregen via de bekende patiënten met CF en gezonde controles. De cut-off value tussen bekende pancreassufficiënte CF en controles lag bij de cumulatieve chloride secretie respons voor carb+cAMP+hista op 34microA/cm2.
Met deze waarde konden patiënten met twijfelachtige CF gedifferentieerd worden in een pancreassufficiënte CF groep (n=6) en een groep ‘CF onwaarschijnlijk’ (n=55).
De correlatie (Pearson correlatie coëfficiënt) tussen de zweettest en ICM was laag voor de ‘CF onwaarschijnlijk’ groep en de pancreasinsufficiënte groep en matig voor de hele CF groep.
In de intermediate groepen PS-CF diagnostisch en bekende PS-CF, was de correlatie redelijk goed voor de ICM parameter Isc,carb+cAMP+hista, met de zweettest, dit bevestigt de gradiënt van de CFTR dysfunctie in aanvulling op de zweettest alleen.
In 100% van de patiënten die door ICM als pancreassufficiënt-CF werden ingedeeld werden met uitgebreide genotypering twee CFTR mutaties gevonden tegenover 1,8% in de ‘CF onwaarschijnlijk’ groep.
De auteurs concluderen dat de diagnostische waarde van ICM relevant is, met name voor de bevestiging van CF in de afwezigheid van twee CFTR mutaties, en uitsluitsel geven van CF in patiënten met een intermediate zweettest of voor leeftijdsgroepen waarbij een nasal potential difference (NPD) measurement niet mogelijk is (met de NPD wordt de CFTR functie in het neusslijmvlies gemeten).
Cohen (2013) onderzocht in een cohort de diagnostische waarde van ICM voor CF. Rectale biopten werden afgenomen van drie groepen: patiënten met CF (n=21), gezonde controles (n=16) en patiënten met verdenking op CF (n=71) met op CF lijkende symptomen zoals chronische luchtwegklachten, stagnerende groei, maar geen positieve zweettest. De patiënten met CF waren gemiddeld 3 jaar (sd 3,8) de controlegroep 15,6 jaar (sd 15,1). Met behulp van een ROC curve werd een cut-off waarde voor carb+hist+cAMP/forskoline gevonden van 7.19 microA/cm2 tussen CF versus niet-CF. Met behulp van deze waarde werd de twijfelachtige CF groep ingedeeld in 66 patiënten met een normale ICM waarde en vijf patiënten met abnormale ICM waarden. De gemiddelde leeftijd in de ICM groep met normale waarden was 4,0 jaar (sd 5,0), en gemiddeld 3,8 jaar (sd 3,6) in de groep met abnormale ICM waarden.
Er was in beide groepen geen correlatie met de zweettest. In de ICM groep met abnormale waarden waren de zweettestwaarden tussen de 33 en 57 mEq/L, gemiddeld 46 (sd 7). De twijfelachtige CF groep werd zes jaar gevolgd en geen enkele patiënt in de groep met normale ICM waarden ontwikkelde CF symptomen. De vijf patiënten met abnormale ICM waarden worden nog steeds gezien in een CF kliniek en zijn behandeld als CF, voor chronisch hoesten, exacerbaties, kolonisatie van de luchtwegen of sinusklachten en één patiënt is overleden aan respiratoire insufficiëntie. De auteurs concluderen dat ICM een goed discriminerend vermogen heeft om CF te diagnosticeren in een groep patiënten met een twijfelachtige CF diagnose. Het is een veilige methode en kan gebruikt worden als diagnosticum, ook in baby’s en jonge kinderen.
Follow-up/Prognose
Beschrijving studies lange-termijn uitkomsten bij patiënten met een R117H gen-mutatie
Er zijn vier studies samengevat over de lange-termijn uitkomsten van patiënten met een R117H gen-mutatie.
Er is gekozen voor een beschrijving van de studies zonder GRADE-beoordeling en conclusies vanwege de aard van de studies en omdat ze niet helemaal voldoen aan de PICO. Er zijn geen evidence en risk of bias tabellen gemaakt.
Scotet (2006) beschrijft dat sinds de pasgeborenen screening in Frankrijk in 1995, 360.466 pasgeborenen zijn gescreend voor CF, waarvan 124 met verhoogd immunoreactief trypsine en twee CFTR genmutaties. Negen van deze 124 kinderen (7,3%) hadden een heterozygote samenstelling met R117H, vijf jongens en vier meisjes. Na gemiddeld 7,0 jaar (range 4 tot 11 jaar) (één lost to follow-up) heeft geen van deze kinderen CF klachten ontwikkeld. Allen bleken een goede voedingsstatus te hebben en pancreassufficiënt te zijn, longfunctie (slechts bij twee gemeten) bleek normaal.
In een Britse retrospectieve cohort studie van Lording (2006) werden 11 patiënten onderzocht met een heterozygote DF508 mutatie en een tweede milde mutatie, voornamelijk R117H. Zeven patiënten waren bekend uit de pasgeborenen screening, twee via eerstegraads familie genetisch onderzoek en twee vanwege suggestieve CF symptomen. De patiënten werden gevolgd in de kliniek tussen de 1 tot 7 jaar, gemiddeld 5,2 jaar. Allen waren pancreassufficiënt. Er is een vergelijking gemaakt met een gematchte (voor leeftijd en geslacht) groep met DF508 homozygote patiënten.
10/11 patiënten in de milde mutatie groep hadden positieve bacterie sputumkweken, echter de frequentie was significant lager dan in de CF groep (respectievelijk 2,8/jaar versus 6,1/jaar, p < 0,05). Longfunctie (FEV1) was gelijk in beide groepen, echter kon dit alleen gemeten worden in vier gematchte paren vanwege de leeftijd.
Roussey (2007) beschrijft in een short report dat 19/196 gediagnostiseerde patiënten met CF via pasgeboren screening in Groot-Brittannië werden beschreven als atypisch, met als meest voorkomende mutatie R117H ISV8-7T(50%). In een follow-up periode van gemiddeld 4,6 jaar (range 0,25 tot 19,8 jaar) in deze groep is voor alle patiënten de voedingsstatus normaal en iedereen pancreassufficiënt. Eén patiënt had respiratoire infecties en 7/19 hadden intermittent respiratoire infecties (waarvan twee met Pseudomonas aeruginosa). Bij acht kinderen is de longfunctie gemeten, met een gemiddelde FVC van 99% en FEV1 van 101%, echter één patiënt had een FEV1 van 48%.
Thauvin (2009) heeft de ziekte penetrantie van R117H geëvalueerd in Frankrijk met als doel de klinische praktijk te verbeteren. Klinische gegevens werden verzameld voor 184 patiënten met een R117H+F508del gen-mutatie, waarvan 72 via NBS gediagnosticeerd.
In de hele groep had maar één kind klassiek CF met ernstige pulmonale klachten, kolonisatie, positieve zweettest, pancreasinsufficiëntie en afwijkende NPD, waardoor de penetrantie voor klassiek CF op kinderleeftijd voor de mutatie R117H/T7+F508del werd geschat op 0,03%. Twee volwassen patiënten hadden ernstige pulmonale symptomen met bronchiectasieën wat resulteerde in een geschatte penetrantie bij volwassenen op 0,06%.
Prognose CRMS/CFSPID
Naast de R117H studies zijn handmatig nog vier recente studies toegevoegd over de prognose van patiënten met een CFSPID of CFTR related metabolic syndrome (CRMS) bij pasgeborenen. Hier is echter niet systematisch naar gezocht met behulp van een zoekstrategie, echter deze literatuur is wel relevant voor het formuleren van de overwegingen en aanbevelingen voor deze module.
Groves (2015) onderzocht de lange termijn uitkomsten van kinderen die bij NBS een intermediate zweettest hadden, in een retrospectieve review in één Australisch ziekenhuis. In een periode van 15 jaar waren er 29 kinderen gevonden via NBS met een intermediate zweettest en één F508del CF mutatie, waarvan 14 (48%) later alsnog de diagnose CF kregen (‘vertraagde CF’) op basis van een positieve ZT, pancreasinsufficientie of recidiverende exacerbaties met Pseudomomas of Stafylococcen. Deze groep werd gematcht (2:1) met 28 patiënten die meteen een positieve pasgeborenen screening hadden (zweettest ≥ 60 mmol/L en/of F508del heterozygoot of homozygoot.
In de vertraagde CF groep was er statistisch significant minder pancreas insufficiëntie (OR 0,06; 95% BI 0,01 tot 0,44), minder incidentie van isolatie en kolonisatie van non-mucoid P. aeruginosa (OR 0,04; 95% BI 0,01 tot 0,38), milde obstructieve longziekte na 10 jaar (FEV1/FVC ratio) met een gemiddeld verschil van MD 5,93, 95% BI 0,39 tot 11,46, betere korte termijn (twee jaar) gewicht, lengte en BMI z-scores, een betere totale ernst van de ziekte (Shwachman score) na 10 jaar, met een gemiddeld verschil van MD 4,72, 95% BI 0,9-8,53.
Voor FEV1%, FVC% en FEF25-75% na vijf en tien jaar en FEV1/FVC ratio na vijf jaar, S. aureus (in beide groepen > 80% isolatie) en mucoid P. aeruginosa, gewicht, lengte en BMI z-scores na vijf en tien jaar, klinische bezoeken, intraveneuze antibiotica kuren, totale ziekenhuis opnamedagen na twee, vijf of tien jaar, en de totale ernst van de ziekte (Shwachman score) na 2 en 5 jaar, gaven allen geen statistisch significant verschillen tussen de CF en de vertraagde CF groep.
Ren (2015) analyseerde data van de Amerikaanse CF registratie van 2010 tot 2012. Er werd een vergelijking gemaakt tussen 1540 kinderen met CF en kinderen met 309 kinderen met CRMS voor een altijd korte termijn uitkomsten. Kinderen met CRMS hadden gemiddeld normale antropometrische waarden, rond het 50e percentiel, significant beter dan in de CF groep. 11% (95% BI 7 tot 15) van de kinderen met CRMS had ten minste één positieve P. aeruginosa respiratoire kweek in het eerste jaar, vergeleken met 21% (95% BI 19 tot 23). Er waren significant minder positieve kweken voor S. aureus en H. influenza in de CRMS groep vergeleken met de CF groep, en minder S. aureus, echter niet significant. Er zijn ook data over behandelingen met pancreasenzymen, inhalatie antibiotica, dornase alfa, bronchodilatoren en aanvullende orale voeding, dit was ook significant minder in de CRMS groep vergeleken met CF groep, echter dit zijn allemaal korte termijn data.
41% van de kinderen met CRMS stond in de registratiedata met een klinische diagnose CF. De auteurs geven aan dat dit kan duiden op misclassificatie of dat bepaalde klinische karakteristieken niet juist zijn verzameld.
Ooi (2015) onderzocht in een prospectieve cohort studie in acht CF centra in Canada en Italië 82 patiënten met CFSPID en 80 patiënten met CF na de pasgeborenen screening met een follow-up periode van drie jaar. De ratio’s van CF tot CFSPID en deelname aan de studie verschilden tussen de centra.
9/82 (11%) met CFSPID werd gediagnosticeerd met CF op basis van de zweettest en/of genotypen. Al deze patiënten hadden initieel een intermediate zweettest en twee CFTR mutaties (waarvan niet meer dan één CF-causing). De abnormale zweettest waardes in deze groep werd gemiddeld gevonden bij een leeftijd van 21 (sd 14) maanden.
Er waren significant meer positieve kweken van P. aeruginosa (31% versus12%) en S. aureus (71% versus 40%) in de CFSPID groep vergeleken met de CF groep, maar niet voor H. influenzae en S. maltophilia. In de CFSPID groep die later de CF diagnose kreeg (CFSPIDàCF) lijken er meer positieve kweken voor P. aeruginosa (33% versus 10%; P = 0,07) en S. maltophilia (22% versus 3%; P =0,05), vergeleken met de CFSPID groep die geen CF kreeg (CFSPIDàCFSPID) , dit verschil was echter niet significant.
De zelf gerapporteerde klinische symptomen (door ouders) benauwdheid, hoesten, obstipatie en buikpijn werden minder gerapporteerd in de CF groep, dan de CFSPID groep, er was geen verschil voor reflux klachten tussen de groepen. Er was ook geen verschil tussen de CFSPIDàCF groep en de CFSPIDàCFSPID groep in zelf gerapporteerde klinische symptomen. De chloorconcentraties in het zweet stegen significant in de tijd voor zowel de CF en CFSPID groep. Geen van de kinderen in de CFSPID groep kreeg pancreasinsufficiëntie binnen 36 maanden, vergeleken met 18 van de 73 (24,7%) in de CF groep.
Seriële serum trypsinogeen waarden waren significant lager in de CFSPID groep vergeleken met de CF groep, en serum trypsinogeen daalde significant over de tijd in beide groepen. Echter, seriële serum trypsinogen levels waren significant hoger in de CFSPID→CF groep vergeleken met de CFSPID→CFSPID groep.
Terlizzi (2019) onderzocht in een retrospectieve studie met data van 2011 en 2016 de prevalentie van CFSPID en de klinische uitkomsten van deze groep in een evaluatie van twee verschillende methodes voor pasgeborenen screening in Italië
In totaal werden 32 patiënten met CF en 50 patiënten met CFSPID geïncludeerd. Van de CFSPID patiënten werd 40% enkel via het IRT-DNA-SC algoritme gevonden en 32% enkel via IRT-meconiumlactase-IRT2-SC en 28% met beide algoritmes (SC = Sweat Chloride).
Alle CFSPID patiënten kregen bij baseline twee zweettesten en na zes maanden, dit werd herhaald elke zes maanden totdat er tenminste twee negatieve of pathologische waardes waren of tot 31 december 2017 (mediane follow-up van 199 dagen (range 21 tot 2190 dagen). Op 31 december 2017 had 10% de diagnose CF, 34% gezond en 30% gezonde drager, 26% was asymptomatisch met een aanhoudende intermediate zweettest, zij werden als CFSPID vervolgd.
Alle patiënten met CFSPID waren pancreassufficiënt na één jaar, vergeleken met 8/32 met CF (p < 0,001).
Follow-up
Om de vraag over follow-up te beantwoorden is geen systematische literatuur zoekactie uitgevoerd en literatuursamenvatting gemaakt. De werkgroep gaat hier zoveel mogelijk uit van de CFF/ECFS consensus guideline. De literatuursamenvatting over prognose is ook behulpzaam bij het bepalen van de follow-up van deze groep patiënten.
Zoeken en selecteren
Om de twee uitgangsvragen te kunnen beantwoorden is er een systematische literatuuranalyse verricht met de volgende zoekvragen:
1: Diagnostiek
Wat is de aanvullende diagnostische waarde van ICM bij kinderen die na de hielprikscreening een CFSPID diagnose hebben, of bij oudere kinderen/ volwassenen die een inconclusieve diagnose krijgen vergeleken met patiënten die alleen een zweettest en DNA diagnostiek (EGA/MLPA) krijgen?
2. Follow-up
Aangezien de grootste groep kinderen die onder de CFSPID vallen de kinderen zijn met een R117H mutatie werd de zoekopdracht ook specifiek op deze groep gericht.
De zoekvraag werd als volgt geformuleerd:
Wat zijn de lange-termijn uitkomsten (prevalentie van CF klachten) bij patiënten met een R117H mutatie of andere variant of unknown significance (VUS)?
PICO bij zoekvraag 1
P (Patiënten): patiënten met een CFSPID (Cystic Fibrosis Screen Positive, Inconclusive Diagnosis) of inconclusieve diagnose (CRMS), zowel pasgeborenen als op latere leeftijd;
I (Interventie): intestinal current measurement (ICM);
C (Comparison): alleen zweettest (en/of EGA/MLPA);
Referentietest: CF diagnose of CF symptomen;
O (Outcomes): Diagnostische accuratesse maten, associaties met CF diagnose of CF symptomen (bronchiectasis, FEV1, chronic rhinosinusitis, nasal polyps, infertility).
PICO bij zoekvraag 2
P (Patiënten): patiënten met R117h of CRMS/CFSPID;
I (Interventie): niet van toepassing;
C (Comparison): niet van toepassing;
O (Outcomes): klinische uitkomsten, Cystic Fibrosis, CF gerelateerde symptomen.
Relevante uitkomstmaten
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 24 april 2019 met relevante zoektermen gezocht naar:
- Systematische reviews, gerandomiseerde gecontroleerde trials (RCT’s) en observationeel onderzoek over ICM bij CFSPID/CRMS of een inconclusieve CF diagnose.
- Systematische reviews, gerandomiseerde gecontroleerde trials (RCT’s) en observationeel onderzoek over R117H.
De zoekverantwoordingen zijn weergegeven onder het tabblad Verantwoording.
De literatuurzoekactie leverde respectievelijk 91 en 212 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- Studies waarin accuratessematen of associaties met CF zijn gepresenteerd voor ICM bij patiënten met een twijfelachtige CF diagnose.
- Studies waarin de prognose van R117H wordt beschreven.
Op basis van titel en abstract werden in eerste instantie respectievelijk zes en vijf studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens respectievelijk vier en één studie geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en respectievelijk twee en vier studies definitief geselecteerd.
Twee onderzoeken over ICM en vier onderzoeken over de prognose van R117H zijn opgenomen in de literatuuranalyse. Naast de R117H studies zijn handmatig nog vier recente studies toegevoegd over de prognose van patiënten met een CFSPID of een inconclusieve diagnose (CRMS) bij pasgeborenen. Hier is echter niet systematisch naar gezocht met behulp van een zoekstrategie, echter deze literatuur is wel relevant voor het formuleren van de overwegingen en aanbevelingen voor deze module.
Referenties
- Castellani C, Duff AJA, Bell SC, Heijerman HGM, Munck A, Ratjen F, Sermet-Gaudelus I, Southern KW, Barben J, Flume PA, Hodková P, Kashirskaya N, Kirszenbaum MN, Madge S, Oxley H, Plant B, Schwarzenberg SJ, Smyth AR, Taccetti G, Wagner TOF, Wolfe SP, Drevinek P. ECFS best practice guidelines: the 2018 revision. J Cyst Fibros. 2018 Mar;17(2):153-178.
- Cohen-Cymberknoh M, Yaakov Y, Shoseyov D, Shteyer E, Schachar E, Rivlin J, Bentur L, Picard E, Aviram M, Israeli E, Kerem E, Wilschanski M. Evaluation of the intestinal current measurement method as a diagnostic test for cystic fibrosis. Pediatr Pulmonol. 2013 Mar;48(3):229-35. doi: 10.1002/ppul.22586.
- Derichs N, Sanz J, Von Kanel T, Stolpe C, Zapf A, Tümmler B, Gallati S, Ballmann M. Intestinal current measurement for diagnostic classification of patients with questionable cystic fibrosis: validation and reference data. Thorax. 2010 Jul;65(7):594-9. doi: 10.1136/thx.2009.125088.
- Farrell PM, White TB, Ren CL, Hempstead SE, Accurso F, Derichs N, Howenstine M, McColley SA, Rock M, Rosenfeld M, Sermet-Gaudelus I, Southern KW, Marshall BC, Sosnay PR. Diagnosis of Cystic Fibrosis: Consensus Guidelines from the Cystic Fibrosis Foundation. J Pediatr. 2017 Feb;181S:S4-S15.e1. doi:10.1016/j.jpeds.2016.09.064. Erratum in: J Pediatr. 2017 May;184:243.
- Lording A, McGaw J, Dalton A, Beal G, Everard M, Taylor CJ. Pulmonary infection in mild variant cystic fibrosis: implications for care. J Cyst Fibros. 2006 May;5(2):101-4. Epub 2006 Jan 19.
- Munck A, Mayell SJ, Winters V, Shawcross A, Derichs N, Parad R, Barben J, Southern KW; ECFS Neonatal Screening Working Group. Cystic Fibrosis Screen Positive, Inconclusive Diagnosis (CFSPID): A new designation and management recommendations for infants with an inconclusive diagnosis following newborn screening. J Cyst Fibros. 2015 Nov;14(6):706-13.
- Murphy J, Salinas D, McColley SA, Ren CL, Farrell PM. Inconclusive diagnosis after a positive newborn bloodspot screening result for cystic fibrosis; clarification of the harmonised international definition. J Cyst Fibros. 2019 Apr 24. pii: S1569-1993(19)30070-0. doi: 10.1016/j.jcf.2019.04.010.
- Ooi CY, Castellani C, Keenan K, Avolio J, Volpi S, Boland M, Kovesi T, Bjornson C, Chilvers MA, Morgan L, van Wylick R, Kent S, Price A, Solomon M, Tam K, Taylor L, Malitt KA, Ratjen F, Durie PR, Gonska T. Inconclusive diagnosis of cystic fibrosis after newborn screening. Pediatrics. 2015 Jun;135(6):e1377-85. doi: 10.1542/peds.2014-2081.
- Ren CL, Fink AK, Petren K, Borowitz DS, McColley SA, Sanders DB, Rosenfeld M, Marshall BC. Outcomes of infants with indeterminate diagnosis detected by cystic fibrosis newborn screening. Pediatrics. 2015 Jun;135(6):e1386-92. doi: 10.1542/peds.2014-3698.
- RIVM. Toelichting op het screeningsprotocol Cystic Fibrosis, juni 2013 https://www.rivm.nl/sites/default/files/2018-11/005592%20Screeningsprotocol_CF_Web.pdf.
- Scotet V, Audrézet MP, Roussey M, Rault G, Dirou-Prigent A, Journel H, Moisan-Petit V, Roussey M, Le Bihannic A, Scotet V, Audrezet MP, Blayau M, Dagorne M, David V, Deneuville E, Giniès JL, Laurans M, Moisan-Petit V, Rault G, Vigneron P, Férec C. Neonatal screening of cystic fibrosis: diagnostic problems with CFTR mild mutations. J Inherit Metab Dis. 2007 Aug;30(4):613. Epub 2007 Jul 12.
- Storni V, Férec C. Immunoreactive trypsin/DNA newborn screening for cystic fibrosis: should the R117H variant be included in CFTR mutation panels? Pediatrics. 2006 Nov;118(5):e1523-9. Epub 2006 Oct 2.
- Southern KW, Barben J, Gartner S, Munck A, Castellani C, Mayell SJ, Davies JC,Winters V, Thauvin-Robinet C, Munck A, Huet F, Génin E, Bellis G, Gautier E, Audrézet MP, Férec C, Lalau G, Georges MD, Claustres M, Bienvenu T, Gérard B, Boisseau P, Cabet-Bey F, Feldmann D, Clavel C, Bieth E, Iron A, Simon-Bouy B, Costa C, Medina R, Leclerc J, Hubert D, Nové-Josserand R, Sermet-Gaudelus I, Rault G, Flori J, Leroy S, Wizla N, Bellon G, Haloun A, Perez-Martin S, d'Acremont G, Corvol H, Clément A, Houssin E, Binquet C, Bonithon-Kopp C, Alberti-Boulmé C, Morris MA, Faivre L, Goossens M, Roussey M; Collaborating Working Group on R117H, Girodon E. The very low penetrance of cystic fibrosis for the R117H mutation: a reappraisal for genetic counselling and newborn screening. J Med Genet. 2009 Nov;46(11):752-8. doi: 10.1136/jmg.2009.067215. Groves T, Robinson P, Wiley V, Fitzgerald DA. Long-term outcomes of children with intermediate sweat chloride values in infancy. J Pediatr. 2015 Jun;166(6):1469-74.e1-3. doi:10.1016/j.jpeds.2015.01.052.
- Terlizzi V, Mergni G, Buzzetti R, Centrone C, Zavataro L, Braggion C. Cystic fibrosis screen positive inconclusive diagnosis (CFSPID): Experience in Tuscany, Italy. J Cyst Fibros. 2019 Jul;18(4):484-490. doi: 10.1016/j.jcf.2019.04.002.
Evidence tabellen
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Bagheri-Hanson, 2014 |
Zeer kleine studie gericht op verschil NPD en ICM en impact van roken |
|
Farrel, 2017 |
Niet relevant, gaat niet over juiste populatie |
|
Hug, 2004 |
Geen vergelijkende studie, beschrijvend stuk over ICM, niet specifiek gericht op CF SPID. |
|
Wilschanski, 2016 |
NPD versus ICM, niet onderzocht in twijfelachtige CF groep, bedoeld voor trials in plaats van praktijk. |
|
Ren, 2011 |
Geen aparte data voor R117h |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 03-07-2020
Beoordeeld op geldigheid : 28-10-2019
Voor het beoordelen van de actualiteit van deze kwaliteitsstandaard is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepalen de besturen van de NVALT, NVK en NCFS of de modules van deze kwaliteitsstandaard nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de kwaliteitsstandaard heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de kwaliteitsstandaard komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVALT, NVK en NCFS zijn regiehouders van deze Kwaliteitsstandaard en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de modules. De andere aan deze kwaliteitsstandaard deelnemende wetenschappelijke verenigingen of gebruikers van de kwaliteitsstandaard delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Inconclusieve CF diagnose |
NVK en NVALT |
2020 |
2025 |
Eens in de vijf jaar |
NVK en NVALT |
- |
Algemene gegevens
Deze richtlijn is ontwikkeld in samenwerking met:
- Landelijke Vereniging Medische Psychologie
- Nederlands Instituut van Psychologen
- Nederlandse Vereniging van Diëtisten
De ontwikkeling van de medisch inhoudelijke modules binnen deze Kwaliteitsstandaard werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De module over psychosociale zorg en de organisatie van zorg modules werden ondersteund vanuit de Samenwerkende Ouder- en Patiëntenorganisaties (VSOP) en gefinancierd vanuit ZonMW. De financierders hebben geen enkele invloed gehad op de inhoud van de kwaliteitsstandaard.
Doel en doelgroep
Doel
Het tot stand brengen van een evidence-based kwaliteitsstandaard Cystic Fibrosis, een combinatie van een zorgstandaard en een medisch specialistische richtlijn om patiënten met Cystic Fibrosis optimale afgestemde zorg te bieden.
Doelgroep
De doelgroep zijn alle patiënten met Cystic Fibrosis. De kwaliteitsstandaard behelst de gebieden van diagnostiek, behandeling en follow-up conform de diverse stadia van de aandoening en de verschillende leeftijdscategorieën.
Samenstelling werkgroep
Voor het ontwikkelen van de kwaliteitsstandaard is in 2016 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met CF en vertegenwoordigers van de NCFS.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze kwaliteitsstandaard.
Werkgroep
- Drs. G.D. (George) Nossent, longarts, UMCG te Groningen, NVALT (voorzitter)
- Dr. O.W. (Onno) Akkerman, longarts, UMCG te Groningen, NVALT
- S. (Sigrid) Amstelveen-Bökkerink, diëtist, Radboud UMC te Nijmegen, NVD
- Dr. H.G.M. (Bert) Arets, kinderlongarts, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, NVK
- Dr. M. (Marleen) Bakker, longarts, Erasmus MC te Rotterdam, NVALT
- Drs. J.M.W. (Annemarie) van den Berg, longarts, Hagaziekenhuis te Den Haag, NVALT
- Dr. M.C. (Maaike) Berkhout, KNO arts, OLVG te Amsterdam, NVKNO
- Dr. F.A.J.A. (Frank) Bodewes, kinderarts-MDL, UMCG te Groningen, NVK
- A. (Annet) Bongen, maatschappelijk werker, UMC Utrecht te Utrecht, BPSW
- J. (Jacqueline) Boekhoff, maatschappelijk werker, Amsterdam UMC, locatie VUMC te Amsterdam, BPSW
- Drs. L.H. (Hassan) el Bouzzaoui, longarts, Hagaziekenhuis te Den Haag, NVALT
- D. (Dagmar) Brocke, maatschappelijker werker, UMC Utrecht te Utrecht, BPSW
- Drs. E.J. Brokaar, poliklinisch apotheker, Hagaziekenhuis te Den Haag, NVZA
- Dr. I. (Inez) Bronsveld, longarts, UMC Utrecht te Utrecht, NVALT
- Drs. A. (Agnes) Clement-de Boer, kinderarts (endocrinologie), Hagaziekenhuis te Den Haag, NVK
- W. (Wytze) Doeleman, fysiotherapeut, UMC Utrecht te Utrecht, KNFG
- Dr. M.M. (Menno) van der Eerden, longarts, Erasmus MC te Rotterdam, NVALT
- Prof. Dr. C.K. (Kors) van der Ent, Kinderlongarts, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, NVK
- Dr. B.C.T. (Boudien) Flapper, kinderarts-sociale pediatrie, UMCG te Groningen, NVK
- Dr. L. (Lianne) van der Giessen, kinderfysiotherapeut, Erasmus MC Sophia Kinderziekenhuis te Rotterdam, KNGF
- Drs. N. (Nanko) de Graaf, kinderradioloog, Erasmus MC te Rotterdam, NVvR
- Dr. V. (Vincent) Gulmans, Hoofd Onderzoek en Kwaliteit van zorg NCFS te Baarn, NCFS
- Prof. dr. H.G.M. (Harry) Heijerman, longarts, UMC Utrecht te Utrecht, NVALT
- Drs. D.M. (Danielle) Hendriks, kinderarts (MDL), Juliana Kinderziekenhuis te Den Haag, NVK
- Dr. J.J.E. Hendriks, kinderlongarts, Zuyderland Medisch Centrum te Heerlen, NVK
- Prof. dr. B. (Bart) van Hoek, MDL-arts, UMC te Leiden, NVMDL
- Drs. R.A.S. (Rogier) Hoek, longarts, Erasmus MC te Rotterdam, NVALT
- Dr. A. (Ageeth) Hofsteenge, kinderdiëtist, Amsterdam UMC, locatie VUMC en AMC, te Amsterdam, NVD
- Drs. C. (Chantal) Hoge, MDL arts, Maastricht UMC+ te Maastricht, NVMDL
- F.M. (Francis) Hollander, diëtist, UMC Utrecht, Utrecht, NVD
- Prof. dr. R.H.J. (Roderick) Houwen, kinderarts MDL, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, NVK
- Dr. J. (Jakko) van Ingen, arts microbioloog, Radboud UMC te Nijmegen, NVMM
- Dr. H.M. (Hettie) Janssens, (kinder)longarts, Erasmus MC Sophia Kinderziekenhuis te Rotterdam, NVK
- Drs. A.J. (Arjan) Jansz, arts microbioloog, Stichting PAMM te Eindhoven, NVMM
- H.J. (Hetty) van der Kamp, kinderarts-endocrinoloog, HMC Bronovo te Den Haag en Wilhelmina Kinderziekenhuis UMC Utrecht te Utrecht, NVK
- C. (Cora) de Kiviet, verpleegkundig specialist, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, V&VN
- A. (Annelies) Kok, verpleegkundig consulent, Erasmus MC te Rotterdam, CF Netwerk verpleegkundigen Nederland
- Dr. B.G.P. (Bart) Koot, kinderarts (MDL), Amsterdam UMC, locatie AMC te Amsterdam, NVK
- M.A. (Marian) Kruijswijk, verpleegkundig specialist, UMC Utrecht te Utrecht, V&VN
- Dr. C.J. (Christof) Majoor, longarts, Amsterdam UMC, locatie AMC te Amsterdam, NVALT
- R. (Renske) van der Meer, longarts, Hagaziekenhuis te Den Haag, NVALT
- Dr. P.J.F.M. (Peter) Merkus, kinderlongarts, Radboud MC te Nijmegen, NVK
- Dr. D. (Dick) Mul, kinderarts (endocrinologie), Diabeter te Rotterdam, NVK
- Drs. A.F. (Ad) Nagelkerke, kinderlongarts, Amsterdam UMC, locatie VUmc te Amsterdam, NVK
- drs. J. (Jacquelien) Noordhoek, directeur patiëntenorganisatie NCFS te Baarn, NCFS
- Marit van Oirschot-van de Ven, verpleegkundig specialist, UMC Utrecht te Utrecht, V&VN
- Dr. M (Marianne) Nuijssink, kinderlongarts, Haga ziekenhuis te Den Haag, NVK
- Dr. M.H.E. (Monique) Reijers, longarts, Radboudumc te Nijmegen, NVALT
- Dr. S. (Sietze) Reitsma, KNO-arts, Amsterdam UMC, locatie AMC te Amsterdam, NVKNO
- Prof. dr. Y.B. (Yolanda) de Rijke, afdelingshoofd Klinische Chemie, Erasmus MC te Rotterdam, NVKC
- Dr. B.L. (Bart) Rottier, kinderlongarts, UMCG te Groningen, NVK
- R.A. (Revka) Schrijver, verpleegkundig consulent, Hagaziekenhuis te Den Haag, CF Netwerk verpleegkundigen Nederland
- Drs. L. (Luciënne) Speleman, KNO arts, Wilhelmina Kinderziekenhuis en UMC Utrecht, te Utrecht, NVKNO
- Dr. S.W.J. (Suzanne) Terheggen-Lagro, kinderlongarts, Amsterdam UMC, locatie AMC te Amsterdam, NVK
- Prof. dr. H.A.W.M (Harm) Tiddens, (kinder)longarts, Erasmus MC Sophia Kinderziekenhuis te Rotterdam, NVK
- H. (Hilda) Vale-Eeman, kinderverpleegkundige, Amsterdam UMC, locatie AMC te, Amsterdam, V&VN
- Dr. H. (Hester) van der Vaart, longarts UMCG te Groningen, NVALT
- Dr. H.W. (Harold) de Valk, internist-endocrinoloog UMCU te Utrecht, NIV
- Dr. M. (Marieke) Verkleij, GZ-psycholoog/cognitief gedragstherapeut, Amsterdam UMC, locatie VUMC te Amsterdam, VGCT
- Dr. E.J.M. (Els) Weersink, longarts, Amsterdam UMC, locatie AMC te Amsterdam, NVALT
- M. (Marion) Wessels, Verpleegkundige, UMC Utrecht te Utrecht, V&VN
- Dr. B.J. (Barbara) Wijnberg-Williams, klinisch psycholoog, UMCG te Groningen en Isala Ziekenhuis te Zwolle, NIP
- Dr. K.M. (Karin) de Winter- de Groot, kinderlongarts, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, NVK
- Dr. P.J.G. (Petra) Zwijnenburg, klinisch geneticus, Amsterdam UMC, locatie VUMC te Amsterdam, VKGN
Met ondersteuning van
- Dr. F. (Floor) Willeboordse, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Ir. T. (Teus) van Barneveld, directeur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. A. (Anne) Speijer, coördinator kwaliteit van zorg, VSOP
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Drs. G.D. (George) Nossent (voorzitter) |
Longarts UMCG |
Bestuurslid NVALT |
Geen |
Geen actie |
|
O. Akkerman |
Longarts, fulltime, UMCG |
Lid nascholingscommissie VvAwT; onbetaald Lid visitatieteam TBC screening LRCB; onbetaald |
Geen |
Geen actie |
|
S. Amstelveen-Bokkerink |
Diëtist Radboudumc Dekkerswald |
Geen |
Geen |
Geen actie |
|
B. Arets |
Kinderlongarts, UMC Utrecht |
Academisch kinder(long)arts, deels Associate Professor Medisch Onderwijs Universiteit.
|
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
M. Bakker |
Longarts, Erasmus MC Rotterdam |
Geen |
Deelname aan diverse studies Vertex (chloortransportmodulatoren) |
Geen trekker van module CFTR modulatoren (wel meelezer).
Toelichting op onderzoek gesponsord door Vertex: Betrokken bij inclusie van patiënten en dataverzameling. Niet betrokken bij data-analyse, wel principal investigator, geen auteur. |
|
T. van Barneveld |
Directeur Kennisinstituut Federatie Medisch Specialisten |
|
Geen |
Geen actie |
|
A. van den Berg |
Longarts Hagaziekenhuis Den Haag |
Geen |
Geen |
Geen actie |
|
M. Berkhout |
KNO-arts in opleiding in het Academisch Medisch Centrum Amsterdam. Opleider: Prof. dr. F.G. Dikkers |
Geen |
Geen |
Geen actie |
|
F. Bodewes |
Kinderarts-MDL UMC Groningen |
Geen |
Geen |
Geen actie |
|
J. Boekhoff |
medisch maatschappelijk werker Amsterdam UMC, locatie VUmc |
Geen |
Geen |
Geen actie |
|
A. Bongen |
Medisch maatschappelijk werker UMC Utrecht |
Geen |
Geen |
Geen actie |
|
H. Bouazzaoui |
Longarts Hagaziekenhuis Den Haag |
Geen |
Geen |
Geen actie |
|
D. Brocke |
Medisch maatschappelijk werk UMC Utrecht Divisie Hart en Longen |
Geen |
Geen |
Geen actie |
|
E. Brokaar |
Poliklinisch apotheker in de Haga Apotheek, HagaZiekenhuis |
Geen |
Gedeeltelijke vergoeding voor internationaal CF congres door Novartis (2012 en 2014) |
Geen actie |
|
I. Bronsveld |
Pulmonoloog UMC Utrecht |
Geen |
Geen |
Geen actie |
|
A. Clement - Boers, de |
Kinderarts, diabetes HAGA/Julianaziekenhuis Den Haag |
Voorzitter Stichting D-Support (ondersteuning voor gezinnen met diabetes) onbetaald |
Geen |
Geen actie |
|
W. Doeleman |
Fysiotherapeut UMC-Utrecht |
Geen |
Geen |
Geen actie |
|
H. Eeman |
Kinderverpleegkundig consulent CF Werkgever: Academisch Medisch Centrum Amsterdam |
Geen |
Geen |
Geen actie |
|
M. Eerden |
Longarts Erasmus MC |
Geen |
Geen |
Geen actie |
|
K. van der Ent |
Kinderarts, hoogleraar kinderlongziekten UMC Utrecht |
|
Onderzoeksubsidies afgelopen vijf jaar:
Instituut heeft betalingen ontvangen voor klinische studies en adviesraad bijeenkomsten van Gilead, Vertex, GSK, Nutrica, TEVA, ProQR, Galapagos en Proteastasis.
|
Gemelde belangen en nevenfuncties zijn besproken met initiatief nemende verenigingen NVALT en NVK.
Deelname in werkgroep als meelezer bij alle modules op basis van expertise over CF.
Geen trekker van modules over CFTR modulatoren waarvoor er financiële belangen zijn. |
|
B. Flapper |
Kinderarts, sociale pediatrie |
Geen |
Geen |
Geen actie |
|
L. van der Giessen |
0,8 Kinderfysiotherapeut Erasmus MC Sophia 0,1 Coordinator onderwijs Erasmus MC 0,1 docentbegeleiding Erasmus MC |
B. Gastdocent Hogeschool Rotterdam Post HBO kinderfysio B. Cursusleider NPI B. Gastdocent Maas en Meer (B=betaald) |
Geen |
Geen actie |
|
V. Gulmans |
Hoofd onderzoek en kwaliteit van zorg bij Nederlandse Cystic Fibrosis Stichting |
Geen |
Geen persoonlijke vergoedingen. De NCFS heeft corporate sponsorovereenkomsten met meerdere bedrijven (farmaceuten en hulpmiddelen). De overeenkomsten zijn aangemeld bij het transparantieregister. De totale sponsorinkomsten bedragen niet meer dan 10 % van de totale NCFS-begroting. De sponsors hebben geen invloed op de inhoud van NCFS-uitingen. |
Geen actie |
|
H. Heijerman |
Longarts, hoofd afdeling longziekten UMC Utrecht. |
|
|
Gemelde belangen en nevenfuncties zijn besproken met initiatief nemende verenigingen NVALT en NVK.
Deelname in werkgroep als meelezer bij alle modules op basis van expertise over CF.
Geen trekker van modules over CFTR modulatoren waarvoor advies is gegeven. |
|
D. Hendriks |
kinderarts-maagdarmleverziekten Juliana Kinderziekenhuis/Hagaziekenhuis Den Haag |
Geen |
Geen |
Geen actie |
|
H. Hendriks |
kinderarts-longarts in Zuyderland MC en 0,1 fte gedetachteerd naar MUMC + voor CF zorg. |
Geen |
Geen |
Geen actie |
|
B. Hoek |
gastroenteroloog en hepatoloog, LUMC Hoogleraar |
Geen |
Geen gesponsord onderzoek op het gebied van CF. Bij genoemde studies mogelijk auteur en: Novartis: PI, inclusie patiënten Zambon: PI, design studies, data analyse Chiesi: design studie, patiënt inclusie, data analyse Abbvie, Norgine, Astellas: patiënt inclusie CLIF: patiënt inclusie Perspectum: patiënt inclusie, design deel van studie Organ Assist: PI, patiënt inclusie Novartis - deelname aan internationale medicijnstudie bij auto-immuun hepatitis Zambon-unrestricted grant voor onderzoek naar auto-immuun hepatitis en overlap syndromen Chiesi - investigator-initiated studie naar farmacoklnetiek van Envarsus (tacrolimus) na levertransplantatie Abbvie - studie naar langetermijn effect op leverfibrose na DAA behandeling van hepatitis C Norgine - deelname aan rifaximin bij hepatische encefalopathie studie CLIF consortium - deelname aan internationale studies naar accuut - op chronisch leverfalen Perspectum - studies naar nieuew NRI technieken bij leverziekte en na levertransplantatie Astellas - deelname aan immuunsuppressie studie na levertransplantatie OrganAssist - deelname aan studie met machineperfusie voor levertransplantatie |
Geen actie |
|
R. Hoek |
Longarts Erasmus MC Centrum voor Longtransplantatie Centrum voor Cystic Fibrosis en Recidiverende Luchtweginfecties |
Nederlands Transplantatievereniging
allen onbezoldigd |
Geen |
Geen actie |
|
A. Hofsteenge |
Dietist: CF-team (kindergeneeskunde) (Vumc en AMC) Kindergeneeskunde (polikliniek) (VUmc) |
Geen |
Geen |
Geen actie |
|
C. van Hoge |
Maag- darm- leverarts MUMC+ |
Geen |
Geen |
Geen actie |
|
F. Hollander-Kraaijeveld |
Diëtist UMC Utrecht |
Geen |
Geen |
Geen actie |
|
R. Houwen |
Hoofd afdeling kinder-MDL UMCU/WKZ |
De (poli)klinische zorg voor patienten met MDL problematiek, het geven van onderwijs alsmede het vooruitbrengen van de zorg en kennis op dit gebied, onder meer door (meewerken aan) publicaties. Tevens aansturen van de subafdeling kinder-MDL. Deze taken worden verricht in een 100% dienstverband. |
|
Geen actie |
|
J. van Ingen |
Arts-microbioloog, Radboudumc, Nijmegen |
Geen |
Mede-auteur van de internationale richtlijn voor diagnostiek en behandeling van niet-tuberculeuze mycobacterieën bij pantiënten met CF (Floto, 2016). |
Geen actie |
|
H. Janssens |
Kinderlongarts, Erasmus MC/Sophia Kinderziekenhuis |
Voorzitter CF-team Sophia |
Co-promotor bij meerdere studies gefinancierd door unrestricted grant van Chiesi en Gilead. |
Geen actie, meelezer bij module over behandeling P.Aeruginosa (Gilead, Chiesi), geen trekker.
Toelichting gesponsorde onderzoeken. -Studies van Chiesi en Gilead waren met een unrestricted grant, financieen gerund door Sophia BV. De aard van de studies kon door het onderzoeksteam vrij ingevuld worden en gepubliceerd. -Deelname centrum aan sponsor initiated studies van Vertex, en Gilead. Geen mede-auteur. Als voorzitter van CF-team verantwoordelijk voor uitvoer van de studie, en beoordeling adverse events en lab uitslagen van deelnemende patiënten. |
|
A. Jansz |
arts-microbioloog, St PAMM, streeklaboratorium voor de volksgezondheid Veldhoven |
Coördinerend arts-microbioloog, RIVM/IDS, Bilthoven, een detachering van 20% auditor voor de RvA |
Geen |
Geen actie |
|
H. van der Kamp |
kinderarts-endocrinoloog (0,7 fte) werkzaam in het WKZ Utrecht en in het Bronovo ziekenhuis in Den Haag (0,15 fte). |
Lid bestuur NVE (onbetaald) Lid adviesgroep groeihormoon (onbetaald) Lid adviesgroep neonatale screening AGS & CHT (onbetaald) |
Geen |
Geen actie |
|
C. de Kiviet |
Verpleegkundig Specialist Bij CF-centrum UMC Utrecht, locatie WKZ |
Lid van Accreditatiecommissie Van de RSV (Register Verpleegkundig Specialismen) >Vacatievergoeding per bijeenkomst -Beoordelaar scholing voor herregistratie Verpleegkundig Specialisten > Vergoeding per beoordeelde scholing |
Geen |
Geen actie |
|
A. Kok |
verpleegkundig consulent CF Erasmus MC-Sophia Rotterdam |
Geen |
Geen |
Geen actie |
|
B. Koot |
kinderarts AMC Amsterdam |
Bestuur sectie kinder MDL, NVK, onbetaald |
Geen |
Geen actie |
|
M. Kruiswijk |
verpleegkundig specialist afdeling Cystic Fibrosis |
Geen |
Geen |
Geen actie |
|
C. Majoor |
Longarts, Amsterdam UMC, locatie AMC |
|
Inclusie patiënten aan fase IIa, IIb, III en IV studies van Vertex en Galapagos |
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
R. van der Meer |
Longarts, aandachtsgebied Cystic Fibrose. Werkzaam in Hagaziekenhuis. Den Haag. |
Geen |
Geen |
Geen actie |
|
P. Merkus |
Kinderarts-pulmonoloog, Radboudumc Amalia Kinderziekenhuis |
|
Deelname Studies bij CF door farmaceutische bedrijven: Vertex, PTC (PI, betrokken bij inclusie, betrokken bij data-analyse) |
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
D. Mul |
Kinderarts-endocrinoloog bij Diabeter |
|
Geen |
Geen actie, trekker module diabetes (screening en behandeling)
Toelichting op deelname adviesraad medisch Novo Nordisk: conflicteert niet met trekkersrol van diabetes modules. |
|
A. Nagelkerke |
Kinderlongarts VU medisch centrum |
Geen |
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is.
|
|
J. Noordhoek |
Directeur Nederlandse Cystic Fibrosis Stichting |
|
|
Geen actie |
|
M. Nuijsink |
Kinderarts Juliana Kinderziekenhuis/ HAGA ziekenhuis |
Geen |
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
M. van Oirschot-van de Ven |
Kinderverpleegkundig consulent CF, Academisch Medisch Centrum Amsterdam |
Geen |
Geen |
Geen actie |
|
M. Reijers |
Longarts, Radboud UMC, Nijmegen |
|
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is.
|
|
S. Reitsma |
KNO-arts AMC Amsterdam |
Geen |
Geen |
Geen actie |
|
Y de Rijke |
Afdelingshoofd Klinische Chemie Erasmus MC te Rotterdam |
Geen |
Geen |
Geen actie |
|
B. Rottier |
UMC Groningen, kinderlongarts |
Geen |
Geen |
Geen actie |
|
R. Schrijver |
Verpleegkundig consulent CF Hagaziekenhuis |
Geen |
Geen |
Geen actie |
|
A. Speijer |
Coördinator kwaliteit van zorg |
Lid advies - en expertcommissie AQUA van Zorginstituut Nederland.
|
Geen |
Geen actie |
|
L. Speleman |
paediatrische KNO, UMC Utrecht Wilhelminakinderziekenhuis |
|
Geen |
Geen actie |
|
S. Terheggen-Lagro |
Kinderlongarts AMC |
|
Geen |
Geen actie |
|
H. Tiddens |
Kinderlongarts, Erasmus MC, Sofia kinderziekenhuis
|
|
|
Geen actie, meelezer bij module over behandeling P.Aeruginosa geen trekker.
Toelichting gesponsorde onderzoeken. iABC: Co-investigator, CT aquisitie, analyse van CTs, geen betrokkenheid bij inclusie van patiënten ALPINE II: betrokken bij inclusie van patiënten |
|
H. van der Vaart |
Longarts UMCG |
Geen |
Geen |
Geen actie |
|
H. de Valk |
Internist-endocrinoloog, UMC Utrecht |
|
Geen |
Geen actie |
|
H. Verkade |
Kinderarts MDL, UMCG Groningen |
|
Geen |
Geen actie |
|
M. Verkleij |
GZ-psycholoog/cognitief gedragstherapeut, Amsterdam UMC locatie VUmc |
Geen |
Geen |
Geen actie |
|
E. Weersink |
longarts, AMC Amsterdam |
Geen |
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
M. Wessels-Bakker |
Verpleegkundig Specialist Longtransplantatie, onderzoeker |
Geen |
Geen |
Geen actie |
|
B. Wijnberg-Williams |
Klinisch psycholoog/medisch psycholoog, richting kinderen en jeugdigen, UMCG (0,4 fte) en Isala ziekenhuis (0,7fte) |
Lid van Accreditatiecommissie Federatie van Gezondheidszorgpsychologen en Psychotherapeuten (FGzPt) (vacatiegelden) |
Geen |
Geen actie |
|
F. Willeboordse |
Adviseur Kennisinstituut Federatie Medisch Specialisten |
Geen |
Via werk partner aandelen bij moederbedrijf Johnson & Johnson. Partner is werkzaam bij Janssen Vaccines BV. |
Geen actie |
|
K. Winter-de Groot |
kinderarts-pulmonoloog WKZ/UMC Utrecht |
|
Geen |
Geen actie |
|
P. Zwijnenburg |
kinderarts-klinisch geneticus VUMC afd. klinische genetica |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door deelname aan de werkgroep van de patiëntenorganisatie NCFS en de VSOP voor zeldzame en genetische aandoeningen. De uitgangsvragen zijn getoetst via een online peiling onder patiënten en ouders. Voor sommige onderwerpen is het patiënten-panel van de NCFS geraadpleegd om input te verkrijgen over patiëntenvoorkeuren over een behandeling of screeningsmethode.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de kwaliteitsstandaarden de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de kwaliteitsstandaard in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
Deze medisch inhoudelijke modules in deze kwaliteitsstandaard is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Voor de modules over psychosociale zorg en de modules over organisatie van zorg is er volgens de AQUA methode gewerkt: GRADE. De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie https://www.gradeworkinggroup.org/docs/Criteria_for_using_GRADE_2016-04-05.pdf).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de stuurgroep en de adviseur de knelpunten. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten. Tevens zijn er knelpunten aangedragen door VSOP, NCFS, NVK, NVALT, Patiëntenfederatie, Lareb, NVMDL, ZiN, ZN, NIP, NVKNO, VKGN, Vereniging innovatieve geneesmiddelen, NVKC, V&VN, NVMM, KNGF, NIV, NVvR, NVD, NVAB, NVZA via een invitational conference.
De concept uitgangsvragen zijn door de NCFS online voorgelegd aan mensen met CF en ouders van kinderen met CF. Vrijwel alle uitgangsvragen werden door tenminste 85% van de 68 respondenten als zinvol tot zeer zinvol ervaren. Bij twee vragen was dit percentage lager (56% respectievelijk 72%), veroorzaakt door het feit dat 25% van de respondenten bij deze vragen geen mening had.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de stuurgroep en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er is voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Voor deze kwaliteitsstandaard was de Europese Best Practice richtlijn van de ECFS (Castellani, 2018) een belangrijk uitgangspunt voor bijna alle modules.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de kwaliteitsstandaard is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Indicatorontwikkeling
De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn omdat er geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Castellani C, Duff AJA, Bell SC, Heijerman HGM, Munck A, Ratjen F, Sermet-Gaudelus I, Southern KW, Barben J, Flume PA, Hodková P, Kashirskaya N, Kirszenbaum MN, Madge S, Oxley H, Plant B, Schwarzenberg SJ, Smyth AR, Taccetti G, Wagner TOF, Wolfe SP, Drevinek P. ECFS best practice guidelines: the 2018.
revision. J Cyst Fibros. 2018 Mar;17(2):153-178. doi: 10.1016/j.jcf.2018.02.006. Epub 2018 Mar 3. Review.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
PubMed
Embase
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
R117h
|
Database |
Zoektermen |
Totaal |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Pubmed
Embase
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
