CF gerelateerde leverziekte
Uitgangsvraag
Hoe moet CF gerelateerde leverziekte gediagnosticeerd en behandeld worden?
De uitgangsvraag omvat de volgende deelvragen:
- Welke controles dienen te worden uitgevoerd bij patiënten met CF zonder leverfunctiestoornissen?
- Wat is de gewenste controle frequentie bij patiënten met CF die geen leverfunctiestoornissen hebben?
- Wat is de optimale follow-up en behandeling (Ursodeoxycholic acid (UDCA)) bij patiënten met CF met leverfunctiestoornissen (inclusief cirrose) of afwijkingen op de echo?
- Is bij verdenking op portale hypertensie bij cirrose een endoscopie om eventuele oesofagusvarices op te sporen gewenst?
- Wat is de meest optimale behandeling bij CFLD varices? (Beta-blokkers versus band ligatie)
- Wanneer is levertransplantatie geïndiceerd?
Aanbeveling
Subvraag a: welke controles dienen te worden uitgevoerd bij patiënten met CF zonder leverbetrokkenheid?
Subvraag b: wat is de gewenste controle frequentie bij een patiënten met CF die geen leverbetrokkenheid heeft?
Vervolg de leverenzymen (GGT, ALAT en ASAT) bij patiënten met CF (ernstige mutatie klassen in combinatie met exocriene pancreas insufficiëntie) eens per jaar, en doe vanaf de leeftijd van 5 jaar eens per jaar, of boven de 18 jaar om het jaar, een echo van lever (ter beoordeling leverrand, mate van homogeniciteit, aanwezigheid van nodulaire transformatie) en milt (milt grootte (cm)), eventueel in combinatie met een meting van de leverstijfheid.
Subvraag c1: wat is de optimale follow-up bij patiënten met CF met echografische vastgestelde parenchym afwijkingen op de lever echo (inclusief cirrose, maar exclusief steatohepatitis)
Intensiveer de follow-up wanneer er echografisch leverafwijkingen (met uitzondering van steatohepatitis) en/of portale hypertensie is vastgesteld.
Wanneer er bij de patiënt tevens portale hypertensie is vastgesteld:
- Vervolg de patiënt (ten minste 2 keer per jaar), bij voorkeur door een kinderarts-MDL of hepatoloog.
- Meet bij lichamelijk onderzoek een liggende en staande saturatie.
- Bepaal bij laboratorium controles, naast standaard laboratorium, tenminste twee jaarlijks het bloedbeeld, albumine, bilirubine totaal, ammoniak, INR, APTT en AFP.
- Maak één keer per jaar een echo van de lever in kader van HCC screening.
Subvraag c2: wat is de optimale behandeling bij patiënten met CF met leverfunctiestoornissen (inclusief portale hypertensie) of structurele afwijkingen op de echo?
Overweeg behandeling met UDCA wanneer CF gerelateerde lever betrokkenheid is vastgesteld waarbij sprake is van structurele parenchymale afwijkingen bij lever echografie (inhomogene en/of nodulaire lever) zonder aanwijzingen voor portale hypertensie.
Dosering: zie formularium
Subvraag d: Is bij verdenking op portale hypertensie bij cirrose een endoscopie om eventuele oesofagusvarices op te sporen gewenst?
Overweeg screening op varices door middel van endoscopie bij patiënten met CF gerelateerde lever betrokkenheid en portale hypertensie.
Subvraag e: Wat is de meest optimale behandeling bij CF gerelateerde lever betrokkenheid waarbij varices zijn vastgesteld?
Overweeg als primaire profylaxe, te behandelen met rubberband ligatie bij patiënten met portale hypertensie, zonder een gedocumenteerde gastrointestinale bloeding, waar bij endoscopisch screening grote varices zijn aangetroffen.
Overweeg als alternatief om, onder strikte controle van de longfunctie, te kiezen voor medicamenteuze onderhoudsbehandeling met niet-selectieve bètablokkers.
Subvraag f: Wanneer is levertransplantatie geïndiceerd?
Indicatie verwijzing patiënten met CF naar lever transplantatie centrum
CF gerelateerde lever betrokkenheid met portale hypertensie en of meerdere van volgende condities:
- Leverfunctie stoornissen:
- Hyperbilirubinemie of icterus.
- Ernstige, vitamine K onafhankelijke, coagulopatie.
- Persisterende hypoalbuminaemie.
- Onverklaarde hypoglykemie bij vasten.
- Ascites.
- Episode van spontane bacteriële peritonitis.
- Aanwijzing voor hepato-pulmonaal syndroom.
- Aanwijzingen voor porto-pulmonale hypertensie.
- Therapie resistente complicaties van portale hypertensie.
- Hepatische encefalopathie.
- Anders onverklaarde malnutritie.
- Aanwijzingen voor hepatocellulair carcinoom bij screening.
Indicaties voor levertransplantatie bij CF
- Gedecompenseerde cirrose:
- Hyperbilirubinemie of icterus.
- Vitamine K onafhankelijke coagulopatie.
- Persisterende of progressieve lever eiwit synthese stoornissen (hypoalbuminaemie).
- Therapie resistente malnutritie.
- Therapie resistentie refractoire ascites.
- Therapie resistentie refractoire complicaties portale hypertensie.
- Hepato-pulmonaal syndroom.
- Therapie resistente encephalopathie.
- Overwegen bij bewezen porto-pulmonale hypertensie.
- Overwegen bij bewezen hepatocellulair carcinoom.
- Overwegen in kader van gecombineerd orgaan transplantatie procedure bij patiënt met indicatie voor longtransplantatie en bekend met CF gerelateerde lever betrokkenheid met portale hypertensie.
Overwegingen
Subvraag a: welke controles dienen te worden uitgevoerd bij patiënten met CF zonder leverbetrokkenheid?
Subvraag b: wat is de gewenste controle frequentie bij een patiënten met CF die geen leverbetrokkenheid heeft?
Er zijn geen studies beschikbaar over de manier waarop patiënten met CF vervolgd moeten worden om het eventuele ontstaan van leverafwijkingen te herkennen, noch over het interval waarmee dit zou moeten plaatsvinden. Toch blijken artsen een vergelijkbare frequentie te gebruiken voor opsporen van eventuele leverproblematiek en daarbij in eerste instantie ook dezelfde parameters te gebruiken: bij patiënten worden in het algemeen jaarlijks de relevante leverenzymen (GGT, ALAT en ASAT) en bloedbeeld (trombocyten) gecontroleerd, met, bij PI patiënten, vanaf de leeftijd van 5 jaar eens per jaar een echo onderzoek van lever en milt. Bij een stabiele patiënt boven de leeftijd van 18 jaar kan ook overwogen worden eens per 2 jaar in plaats van eens per jaar een echo te doen. Ook kan, indien beschikbaar, een meting van leverstijfheid wordt toegevoegd (elastografie) (van der Feen, 2016; Kitson, 2013). Deze laatste parameter lijkt een goed correlatie te vertonen met toegenomen hoeveelheid bindweefsel in de lever in het bijzonder met cirrose (van der Feen, 2016; Kitson, 2013).
Subvraag c1: wat is de optimale follow-up bij patiënten met CF met echografische vastgestelde parenchym afwijkingen op de lever echo (inclusief cirrose, maar exclusief steatohepatitis)
Wanneer echografisch structurele leverafwijkingen zijn vastgesteld moet rekening worden gehouden dat bij deze patiënten zich ook portale hypertensie kan ontwikkelen. Tijdens periodieke controle wordt daarom aangeraden patiënten met CF te screenen op de aanwezigheid of progressie van portale hypertensie. Klinische aanwijzingen voor portale hypertensie zijn een palpabele milt (splenomegalie) bij lichamelijk onderzoek, een echografisch vastgestelde splenomegalie op basis miltgrootte-meting, en/of aanwijzingen voor hypersplenisme in de vorm van persisterende thrombopenie (en eventueel persisterende leucopenie).
Het wordt aangeraden bij patiënten met CF met structurele lever parenchym afwijkingen tenminste jaarlijks een echo doppler te doen. Echografische vergroting van de milt en veranderingen in het doppler flow profiel van de vena porta zijn aanwijzingen voor de aanwezigheid van portale hypertensie.
Patiënten met portale hypertensie (cirrotisch of non-cirrotisch) hebben een hogere morbiditeit, een hoger risico op complicaties bij operatieve procedures zoals longtransplantaties en een grotere kans op overlijden (Debray, 2011; Bodewes, 2015; Woodruff, 2017; Pals, 2019; Rowland, 2015). Chronische leverfalen met leverfunctie stoornissen kan voorkomen bij patiënten met CF maar is weinig frequent.
Wanneer er eenmaal portale hypertensie is ontstaan zal er ook een oordeel gevormd moeten worden over de leversynthesefunctie, in ieder geval door middel van het bepalen van het albumine en de stollingsparameters INR en APTT (Debray, 2011; van de Peppel, 2017), detoxificatiefunctie door middel van totaal bilirubine, alsmede screening voor hepato-pulmonaal syndroom (HPS) door middel van een staand/liggende saturatiemeting en periodieke screening op hepatocellulair carcinoom (HCC) door middel van twee keer per jaar een alpha-foeto proteine (AFP) bepaling in het bloed en een jaarlijkse leverecho. In deze situatie zal de mate van portale hypertensie indirect gevolgd worden aan de hand van miltgrootte, middels echografie, en door bepaling van aantal bloedplaatjes (thrombocyten) (Debray, 2011; van de Peppel, 2017).
|
Tabel 1 Mogelijke complicatie CF gerelateerde lever betrokkenheid met portale hypertensie |
|
Complicatie van portale hypertensie |
|
|
Symptomen van functionele lever decompensatie |
|
|
Hepatocellulair carcinoom |
Subvraag c2: wat is de optimale behandeling bij patiënten met CF met leverfunctiestoornissen (inclusief portale hypertensie) of structurele afwijkingen op de echo?
Ernstige leverziekte met cirrose gaat gepaard met een verlaagde overleving en andere complicaties (Woodruff, 2017; Pals, 2019; Rowland, 2015). Het voorkomen of beperken hiervan zou bijdragen aan de verdere verbetering zorg voor de patiënten met CF. Het is nog niet bekend Oof CFTR eiwit modulatie therapieën die de laatste jaren worden ingezet bij CF een gunstig effect heeft hebben op ontwikkeling van structurele leverziekten, in het bijzonder cirrose is nog niet bekend.
Een andere interventie, Ursodeoxycholzuur (UDCA), wordt al bijna dertig jaar gebruikt bij patiënten met CFLD. Met deze medicatie verbeteren waarden van verhoogde leverenzymen (ASAT, ALAT en GGT), waarbij een dosering van 20 mg mg/kg/dag superieur bleek aan een dosering van 10 mg/kg/dag (Cotting, 1990; van de Meeberg, 1997; Kappler, 2012). Het is echter controversieel of er op lange termijn ook voordelen zijn bij gebruik van UDCA, met name of er een vermindering van de progressie van leverziekte en/of een betere overleving is. Ook hier zijn geen gerandomiseerde gecontroleerde studies beschikbaar (Cheng, 2017), zoals ook bleek uit de systematisch literatuursamenvatting (zie onderbouwing).
Indirect bewijs lijkt het gebruik van UDCA mogelijk te ondersteunen. In een retrospectieve studie uit het CF-centrum in München bleek het aantal patiënten met CF dat ernstige leverziekte ontwikkelde sinds de introductie van UDCA significant gedaald (Kappler, 2012). Verder bleek dat bij patiënten met CF met een inhomogene lever, maar zonder cirrose, de leverstijfheid met gebruik van UDCA minder snel toeneemt (van der Feen, 2016). Ondanks het ontbreken van formeel bewijs wordt UDCA door veel CF behandelaars voorgeschreven aan patiënten met CF met een inhomogene lever op de echo en/of verhoogde leverstijfheid. De huidige Europese richtlijn ondersteunt dit beleid (Debray, 2011). De bewijskracht van dit advies is echter zeer laag.
Wanneer zich eenmaal portale hypertensie heeft ontwikkeld lijkt het gebruik van UDCA geen gunstig effect meer op de leverstijfheid te hebben en kan dit worden gestaakt (van der Feen, 2016).
Subvraag d: Is bij verdenking op portale hypertensie bij cirrose een endoscopie om eventuele oesofagusvarices op te sporen gewenst?
Bij portale hypertensie is er sprake van verhoogde druk in het gehele portale vaatsysteem. Hierbij kunnen zich in gastro-intestinale varices ontwikkelen. Wanneer de varices groot zijn kunnen deze gaan bloeden, met potentieel ernstige complicaties. De meest frequente locaties met hoogste kans op varices bloeding zijn de slokdarm en de maag.
Over de noodzaak tot screening op varices bij kinderen met portale hypertensie door middel van endoscopie is geen eenstemmigheid, vooral omdat onduidelijk is of het vinden van varices behandel consequenties heeft (Ling, 2011). Bij volwassenen zal men, in navolging van standaard protocol voor follow up van portale hypertensie (Baveno VI criteria en AASLD guidelines) er in het algemeen wel toe over gaan om als screening een endoscopie te doen om na te gaan of er grote varices aanwezig zijn wanneer het aantal bloedplaatjes onder de 110.000 per µl is gedaald in combinatie met een leverstijfheid > 25kPa als gemeten met de fibroscan (Augustin, 2017).
Subvraag e: Wat is de meest optimale behandeling bij CF gerelateerde lever betrokkenheid waarbij varices zijn vastgesteld?
Indien wordt besloten om endoscopische te screenen kunnen varices in verschillende mate van ernst worden vastgesteld. Er is geen consensus over de noodzaak en vorm van primaire profylaxe (=preventieve behandeling varices bij patiënten zonder gedocumenteerde varices bloeding) van aangetoonde varices bij kinderen zonder CF (Ling, 2011). Uit een studie onder kinderartsen in Canada bleek dat een kleine meerderheid van de kinderartsen van mening is dat behandelen van grote varices aan te raden is (Ling, 2011). Bij volwassenen zal men grote varices in het algemeen wel banderen of een niet-selectieve bètablokker geven (Li, 2011; Garcia-Tsao, 2017). Echter het gebruik van niet-selectieve bètablokkers om zo de bloeddruk in het portale vaatstelsel te verlagen bij CF patiënten is mogelijk gecontra-indiceerd in verband potentieel broncho-constructieve effect op de luchtwegen (Debray, 2011). Indien niet-selectieve bètablokkers desondanks moeten worden overwogen dient dit te gebeuren met longfunctie controle voor en na met reversibiliteit onderzoek. Op basis van deze overwegingen komt de commissie tot onderstaand advies voor kinderen en volwassenen met CF en aangetoonde varices.
Subvraag f: Wanneer is levertransplantatie geïndiceerd?
Levertransplantatie kan bij CF patiënten noodzakelijk zijn bij eind stadium leverziekte of therapie resistente complicaties van cirrose (zie tabel 1). Deze situatie en indicatie doen zich alleen voor bij de patiënten met CF gerelateerde lever betrokkenheid en portale hypertensie.
Eind stadium leverziekte in het kader van CF is een internationaal erkende indicatie voor levertransplantatie. Dit ondanks het feit dat CF een multi-orgaan ziekte en als een consequentie daarvan, geïsoleerde levertransplantatie niet curatief zal zijn voor de aan CF geassocieerde morbiditeit van de donororgaan ontvanger. Daarnaast bestaat er bij solide orgaan transplantatie ook de aan procedure gekoppelde perioperatieve complicaties en complicaties van langdurige gebruik van immunosuppressiva.
In Nederland zijn centra voor levertransplantatie; voor volwassen (Erasmus MC Rotterdam LUMC Leiden en UMC Groningen) en kinderen onder de 18 jaar (UMC Groningen).
Indicatie verwijzing patiënten met CF naar lever transplantatie centrum
De resultaten voor levertransplantatie bij patiënten met CF zijn minder goed dan voor andere indicaties voor levertransplantatie (Black, 2016; Freeman, 2019). Dit lijkt met name te worden veroorzaakt door een lagere lange termijn patiënt survival en niet door verlaagde transplantaat survival. Meest waarschijnlijk is het dus gerelateerd aan de bekende morbiditeit van CF welke niet wordt verbeterd door een geïsoleerde levertransplantatie bij deze multi-orgaan ziekte. Vooral nierfunctie stoornissen en de aanwezigheid van diabetes lijken geassocieerd met een slechtere patiënt survival.
De timing van een eventuele levertransplantatie voor patiënten met CF gerelateerde lever betrokkenheid en portale hypertensie is complex en dient te worden gemaakt in een multidisciplinair team bestaande uit experts op gebied van CF, lever en longtransplantatie. Levertransplantatie vroeg in het ziektebeeld (voordat lever decompensatie evident is) kan mogelijk leiden tot verbetering van longfunctie en voedingstoestand (Dowman, 2012; Miller, 2012). Echter de patiënten zijn na levertransplantatie langer blootgesteld aan immunosuppressiva met een cumulatieve kans op bijwerkingen zoals verhoogde kans op infecties en nierfunctie stoornissen. Levertransplantatie bij eindstadium leverziekte of leverfalen brengt echter het risico met zich mee dat patiënten in veel slechtere conditie zijn om een levertransplantatie te ondergaan met een hoger morbiditeits- en mortaliteit risico.
Daarnaast moeten in de beslissing tot de indicatie voor lever transplantatie andere CF specifieke factoren zoals de longfunctie met de mogelijk separate indicatie voor longtransplantatie, (pulmonale)microbiële kolonisatie, microbiële resistentie en CF gerelateerde diabetes een rol spelen in de overwegingen.
Een aparte afweging voor lever transplantatie moet worden gemaakt bij patiënten met CF die op basis van longfalen in aanmerking komen voor longtransplantatie maar CF gerelateerde lever betrokkenheid met portale hypertensie als co-morbiditeit hebben. Hoewel succesvolle geïsoleerde long transplantatie bij deze patiëntengroep kan worden uitgevoerd bestaat er ook en risico op perioperatieve lever decompensatie en lever falen (Nash, 2012). Voor deze patiënten moet voorafgaande aan longtransplantatie een multidisciplinaire afweging worden gemaakt tussen geïsoleerde longtransplantatie of een gecombineerde long-levertransplantatie. (Mallea, 2019).
Onderbouwing
Achtergrond
Er zijn verschillende vormen van CF gerelateerde leverbetrokkenheid (Tabel 1). De pathogenese hiervan en de onderlinge samenhang en of progressie van verschillende vormen is onbekend.
Tabel 1 Presentatie Cystic fibrosis gerelateerde leverbetrokkenheid
|
1) Persisterende verhoogde leverenzymen (ASAT, ALAT, gamma GT) |
|
2) Steatohepatitis |
|
3) Echografische structurele parenchymale afwijking zonder aanwijzingen portale hypertensie |
|
4) Leverbetrokkenheid met portale hypertensie (gekenmerkt door aanwezigheid van splenomegalie en thrombopenie met of zonder gastrointestinale varices) a) cirrotische portale hypertensie b) non-cirrotische portale hypertensie |
|
5) Cholangiopathien a) galstenen b) microgalblaas c) galwegstenose |
|
6) Lever maligniteiten a) hepatocellulair carcinoom (beschreven in relatie tot CF gerelateerde cirrose) b) cholangiocarcinoom |
Stijging van gamma gamma-GT naar hoog normaal of waarden boven de ULN zijn geassocieerd met de ontwikkeling of aanwezigheid van cirrotische lever afwijkingen (Debray, 2011; Bodewes, 2015; Woodruff, 2017; Ling, 2019). Milde biochemisch stijging van leverenzymen (ALAT en ASAT) komen bij patiënten met CF regelmatig voor en hebben lage tot zeer lage sensitiviteit voor het voorspellen van het ontstaan van structurele veranderingen van het leverparenchym of de ontwikkeling van portale hypertensie (Debray, 2011). Echter persisterende verhoogde leverenzymen moeten ook bij patiënten met CF differentiaal diagnostisch beoordeeld worden (bijvoorbeeld medicamenteuze toxiciteit, coeliakie).
Bij tenminste 30% van de patiënten met CF ontstaan er in de loop van het leven structurele veranderingen in de lever (Debray, 2011; Colombo, 2002; Flass, 2013). Bij ongeveer 10% van de patiënten met CF ontstaat hierbij ook portale hypertensie met in de meeste gevallen in het kader van cirrose (Debray, 2011; Colombo, 2002; Flass, 2013). CF lever betrokkenheid met cirrose en/of portale hypertensie is klinisch de meest ernstige vorm met betrekking tot morbiditeit en heeft een significant verhoogde mortaliteit (Pals, 2019; Rowland, 2015). kunnen presenteren. Het is dan ook belangrijk echografische screening op structurele leverparenchym veranderingen te doen bij alle CF patiënten. Verder laten recente studies zien dat structurele leverafwijkingen, anders dan eerder beschreven, zich ook op latere, volwassen leeftijd kunnen presenteren (Koh, 2017; Toledano, 2019; Boëlle, 2019). Echografisch onderzoek van de lever dient dus ook op volwassen leeftijd plaats te vinden.
Conclusies / Summary of Findings
|
Laag GRADE |
Een behandeling met UDCA zou kunnen resulteren in een niet klinisch relevante verbetering in gewicht bij CF patiënten vergeleken met placebo of geen behandeling.
Bronnen: (Cheng, 2017) |
|
Zeer laag GRADE |
Het is onzeker of er een effect is van UDCA op de noodzaak voor een levertransplantatie bij CF patiënten vergeleken met placebo of geen behandeling.
Bronnen: (Cheng, 2017) |
|
Zeer laag GRADE |
Het is waarschijnlijk dat er een gunstig effect is van UDCA op de serum lever enzym levels bij CF patiënten vergeleken met placebo of geen behandeling.
Bronnen: (Cheng, 2017) |
|
Zeer laag GRADE |
Er is niet uit te sluiten dat er een gunstig effect is van UDCA op progressie van de leverziekte bij CF patiënten vergeleken met placebo of geen behandeling.
Bronnen: (Kappler, 2012; van der Feen, 2016; Cheng, 2017) |
Samenvatting literatuur
Beschrijving studies
Eén systematische literatuur review (Cochrane) werd geïncludeerd met daarin vier RCT’s met in totaal 137 deelnemers (Cheng, 2017). Deze review omvatte drie cross-over RCT’s en één parallelle RCT. Echter, van één cross-over trial kon de data niet worden meegenomen omdat de data niet juist is gerapporteerd, dus slechts van 118 deelnemers is er data. In alle trials was UDCA de behandeling om de lever functie te verbeteren vergeleken met een placebo behandeling of geen behandeling in de controlegroep.
De follow-up duur varieerde tussen de 6 en 12 maanden.
Twee observationele studies zijn toegevoegd; Kappler (2012) en van der Feen (2016). Kappler (2012) beschreef een retrospectieve case-controle studie met een follow-up duur van 17 jaar. UDCA behandeling was gestart bij 98 patiënten die voldeden aan de criteria voor een lever aandoening uit een cohort van 382 CF patiënten. De patiënten werden vergeleken met een historisch cohort van 3521 patiënten van voor 1989, toen UDCA nog niet beschikbaar was. Uit de groep met 382 CF patiënten werd 98 patiënten gematcht voor de lange-termijn vergelijking van de lever functie. (Kappler, 2012)
Van der Feen (2016) onderzocht het effect van UDCA op lever stijfheid in een observationele studie. 32 patiënten die een UDCA behandeling ontvingen werden vergeleken met 73 patiënten die geen UDCA behandeling ontvingen en allen hadden ten minste twee metingen met ten minste een jaar hier tussen van de lever stijfheid met behulp van transient elastography.
Verder zijn twee prospectieve studies toegevoegd waarbij het beloop van leverenzymen gevolgd werd na start van UDCA bij respectievelijk 8 patiënten (Cotting, 1990) en 30 patiënten met CFLD (van de Meeberg, 1997). In de studie van van de Meeberg (1997) werd verder het effect van een hoge UDCA dosering (20 mg/kg/dag) (N=13) vergeleken met een lage dosering (10 mg/kg/dag)(N=17). In de studie van Cotting (1990) werd het effect op de leverenzymen ASAT, ALAT en Alkalische fosfatase na 6 maanden vastgelegd en in de studie van van de Meeberg (1997) het effect op ASAT, ALAT, Alkalische fosfatase en GGT na 12 maanden UDCA therapie. In beide studies werden de waarden na 6 respectievelijk 12 maanden UDCA therapie vergeleken met de uitgangswaarden van deze enzymen.
1. Verandering in gewicht (kg)
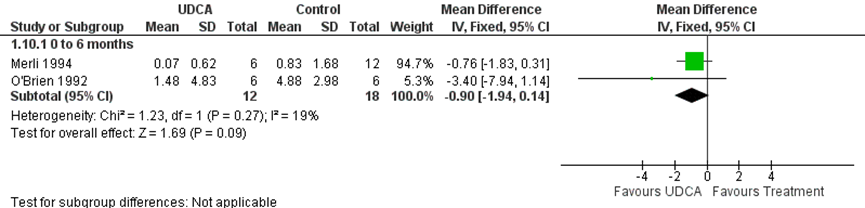
Twee RCT’s in de Cochrane review van Cheng (2017) rapporteerden data over gewichtsverandering in 30 patiënten. Het gepoolde gemiddelde verschil na 6 maanden UDCA behandeling bedroeg -0,90 kg (95% Betrouwbaarheidsinterval (BI) -1,94 tot 0,14) in het voordeel van de UDCA behandeling vergeleken met placebo of geen behandeling. Dit verschil was niet significant, p=0.09. (zie figuur 1)
Figuur 1 Forest plot: Verandering in gewicht (kg) door UDCA behandeling vergeleken met placebo of geen behandeling
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat verandering in gewicht is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; incomplete data en onduidelijkheden in cross-over designs) en het geringe aantal patiënten (imprecisie). Het niveau van de bewijskracht komt uit op GRADE ‘laag’.
2. Huidplooi dikte (mm)
Er is geen bruikbare vergelijkende data gepresenteerd. Deze uitkomstmaat kan dus niet beoordeeld worden.
3. Verbetering in gal excretie (min)
Er is geen vergelijkende data gepresenteerd. Deze uitkomstmaat kan dus niet beoordeeld worden.
4. Noodzaak voor levertransplantatie
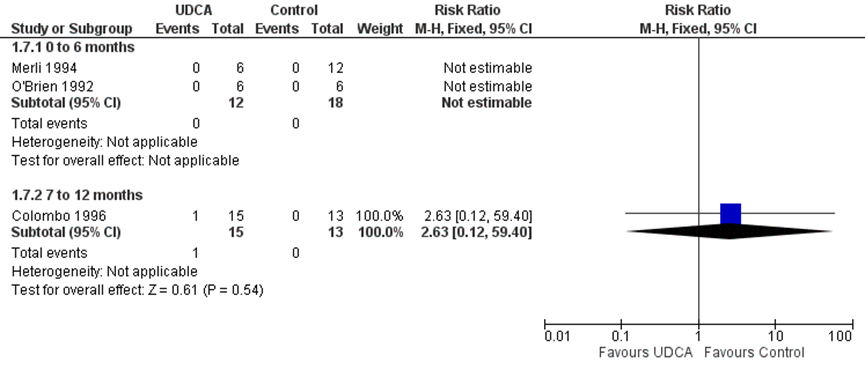
Drie RCT’s in de Cochrane review van Cheng (2017) rapporteerden data over de noodzaak tot levertransplantatie, ook al was dit niet specifiek benoemd als een uitkomstmaat in de RCT’s. In de twee studies met een zes maanden follow-up tijd had geen enkele patiënt een levertransplantatie nodig. In één studie met 12 maanden follow-up was er één patiënt in de UDCA groep die een levertransplantatie nodig had. De risk ratio van 2.63 (95% BI 0,12- 59,40) in het voordeel van de controlegroep is niet significant en heeft een zeer wijd betrouwbaarheidsinterval gebaseerd op één event. (zie figuur 2)
Figuur 2 Forest plot: Noodzaak voor lever transplantatie door UDCA behandeling vergeleken met placebo of geen behandeling
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat noodzaak voor lever transplantatie is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; incomplete data en onduidelijkheden in cross-over designs) en het zeer geringe aantal patiënten en events (imprecisie). Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
5. Mortaliteit
In geen enkele studie zijn er sterfgevallen voorgekomen. Deze uitkomstmaat kan dus niet beoordeeld worden.
6. Serum lever enzym levels
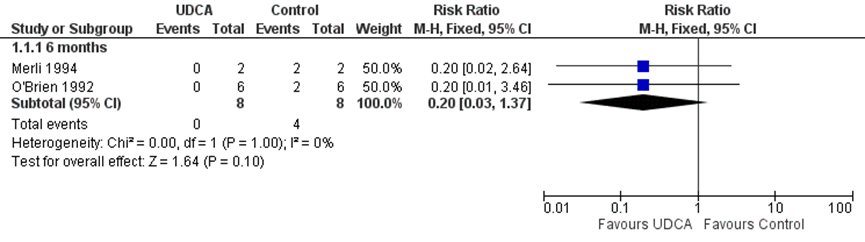
Twee RCT’s in de Cochrane review van Cheng (2017) rapporteerden data over de normalisatie van een serum lever enzym level in 16 patiënten. De gepoolde RR na 6 maanden UDCA behandeling bedroeg 0,20 (95% BI 0,03 tot 1,37) in het voordeel van de UDCA behandeling vergeleken met placebo of geen behandeling. Dit verschil was niet significant, p=0.10. Dezelfde resultaten werden gezien bij analyse van de aparte enzymen, 5’nucleotidase, aspartate transaminase, alanine transferase en gammaglutamate transferase (zie figuur 3) (Cheng, 2017).
In de studie van Cotting (1990) bij 8 patiënten met CFLD bleek de ASAT ten opzichte van de uitgangswaarde na 6 maanden gedaald te zijn met 52% (P<0.005), de ALAT met 60% (P<0.001) en de alkalische fosfatase met 46% (P<0.01). In de studie van van de Meeberg (1197) was bij de 17 patiënten met een UDCA dosis van 10 mg/kg/dag ten opzichte van de uitgangswaarde de alkalische fosfatase na 12 maanden gedaald met 37% (P<0.01), de GGT met 63% (P<0.01), de ASAT met 49% (P<0;01) en de ALAT met 51% (P<0.01). Bij de 13 patiënten met een dosis van 20 mg/kg/dag was het effect nog meer uitgesproken: de alkalische fosfatase was gedaald met 55% (P<0.01), de GGT met 73% (P<0.01), de ASAT met 45% (P<0.01) en de ALAT met 71% (P<0.01). Het verschil tussen de lage en hoge dosis UDCA was na 12 maanden significant verschillend in het voordeel van de hoge dosis voor het effect op de GGT (P<0.002) en de ALAT (P<0.02).
In de retrospectieve observationele studie van Kappler (2012) met een follow-up duur van 17 jaar verbeterden in bijna alle patiënten (87/98) de serum lever enzym levels. Deze data kon niet vergeleken worden met de gematchte controlegroep of het historische cohort. (Kappler, 2012).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Serum lever enzym levels is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; incomplete data en onduidelijkheden in cross-over designs) en het zeer geringe aantal patiënten en events (imprecisie). Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Figuur 3 Forest plot: Normalisatie van elke serum lever enzym levels door UDCA behandeling vergeleken met placebo of geen behandeling
7. Progressie van de leverziekte
7a. Stijfheid van de lever
In de observationele studie van van der Feen (2016), wordt geen significant verschil gevonden in stijfheid van de lever tussen de groep die UDCA ontvangt vergeleken met de groep die geen UDCA ontvangt. De verandering per jaar in kPA (IQR) in UDCA groep is 0,13 (-1,0 tot 1,1) vergeleken met 0,19 (-0,03 tot 0,59) in de groep zonder behandeling. Er is wel een significant verschil in de subgroepen die UDCA waren gestart op basis van de Colombo criteria (-0,70 (-1,6 tot 0,55), p<0,001) of vanwege cirrose vergeleken met geen behandeling (4,6 (0,67 tot 12,4), p=0,006). (van der Feen, 2016).
7b. Openlijke leverziekte
In de case-control studie van Kappler (2012) waren er significant minder openlijke leverziektes in de UDCA behandelgroep (1/98) na 17 jaar vergeleken met de historische controlegroep (9/352), p=0,009. (Kapler, 2012).
7c. Portale hypertensie
In geen enkele studie was portale hypertensie een uitkomstmaat. Twee trials in de Cochrane review van Cheng (2017) hebben aangegeven dat geen enkele patiënt portale hypertensie ontwikkelde binnen de studieperiode.
Bewijskracht van de literatuur
De bewijskracht voor observationale studies begint ‘laag’. De bewijskracht voor de uitkomstmaat progressie van de leverziekte is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias; geen correctie voor potentiele confounders en niet-representatieve controle groep) en het geringe aantal patiënten of events (imprecisie). Het niveau van de bewijskracht komt uit op GRADE ‘zeer laag’.
Zoeken en selecteren
Om de uitgangsvraag c2 te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn de (on)gunstige effecten van UDCA ten opzichte van geen behandeling bij CFLD patiënten?
P (Patiënten): patiënten met CF gerelateerde lever ziekte of hepatische abnormaliteiten;
I (Interventie): ursodeoxycholic acid;
C (Comparison): placebo of geen aanvullende behandeling;
O (Outcomes): verandering in gewicht, progressie van de lever aandoening.
Er is geen systematische search uitgevoerd voor subvraag a, b, d, f en het eerste deel van subvraag c (follow-up bij een CF patiënt met leverproblematiek) omdat hier geen bewijs werd verwacht; voor het tweede deel van subvraag c (behandeling bij leverfunctiestoornissen) werd een systematische literatuur search uitgevoerd; subvraag e werd beantwoord aan de hand van de richtlijnen die bestaan voor volwassenen zonder CF, maar met portale hypertensie en (het vermoeden op) varices, alsmede de mening van kinderartsen die vertrouwd zijn met deze problematiek, zowel nationaal en internationaal, hierover.
Relevante uitkomstmaten
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 14 december 2017 met relevante zoektermen gezocht naar systematische reviews, randomized controlled trials (RCT’s) en observationele studies, die de behandeling van CFRLD met UDCA bij patiënten met Cystic Fibrosis beschreven. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 136 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- systematische review of origineel onderzoek (RCT’s of observationeel onderzoek);
- waarin de behandeling van CFRLD met UDCA werd bestudeerd bij patiënten met Cystic fibrosis;
- waarbij de controlegroep een placebo / geen behandeling was.
Op basis van titel en abstract werden in eerste instantie 24 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 21 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en drie studies definitief geselecteerd.
Drie onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studie-karakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Augustin S, Pons M, Maurice JB, et al. Expanding the Baveno VI criteria for the screening of varices in patients with compensated advanced chronic liver disease. Hepatology 2017;66:1980-8.
- Black SM, Woodley FW, Tumin D, Mumtaz K, Whitson BA, Tobias JD, Hayes D Jr. Cystic Fibrosis Associated with Worse Survival After Liver Transplantation. Dig Dis Sci 2016;61:1178-85.
- Boëlle PY, Debray D, Guillot L, Clement A, Corvol H; French CF Modifier Gene Study Investigators. Cystic Fibrosis Liver Disease: Outcomes and Risk Factors in a Large Cohort of French Patients. Hepatology. 2019 Apr;69(4):1648-1656. doi:10.1002/hep.30148. Epub 2018 Dec 28.
- Bodewes FA, van der Doef HP, Houwen RH, Verkade HJ. Increase of Serum γ-Glutamyltransferase Associated With Development of Cirrhotic Cystic Fibrosis Liver Disease. J Pediatr Gastroenterol Nutr. 2015;61:113-8.
- Cheng K, Ashby D, Smyth RL. Ursodeoxycholic acid for cystic fibrosis-related liver disease. Cochrane Database Syst Rev 2017, doi: 10.1002/14651858.CD000222.
- Colombo C, Battezzati PM, Crosignani A, et al. Liver disease in cystic fibrosis: A prospective study on incidence, risk factors, and outcome. Hepatology. 2002;36:1374-1382.
- Cotting J, Lentze MJ, Reichen J. Effects of ursodeoxycholic acid treatment on nutrition and liver function in patients with cystic fibrosis and longstanding cholestasis. Gut 1990;31:918-21.
- Debray D, Kelly D, Houwen R, Strandvik B, Colombo C. Best practice guidance for the diagnosis and management of cystic fibrosis-associated liver disease. J Cyst Fibros 2011;10:S29-S36.
- Dowman JK, Watson D, Loganathan S, Gunson BK, Hodson J, Mirza DF, Clarke J, Lloyd C, Honeybourne D, Whitehouse JL, Nash EF, Kelly D, van Mourik I, Newsome PN. Long-term impact of liver transplantation on respiratory function and nutritional status in children and adults with cystic fibrosis. Am J Transplant 2012;12:954-64.
- Flass T, Narkewicz MR. Cirrhosis and other liver disease in cystic fibrosis. Journal of Cystic Fibrosis. 2013;12(2):116-124.
- Freeman AJ, Sellers ZM, Mazariegos G, Kelly A, Saiman L, Mallory G, Ling SC, Narkewicz MR, Leung DH. A Multidisciplinary Approach to Pretransplant and Posttransplant Management of Cystic Fibrosis-Associated Liver Disease. Liver Transpl. 2019 Apr;25(4):640-657. doi: 10.1002/lt.25421.
- Garcia-Tsao G, Abraldes JG, Berzigotti A, Bosch J. Portal hypertensive bleeding in cirrhosis: Risk stratification, diagnosis, and management: 2016 practice guidance by the American Association for the study of liver diseases. Hepatology 2017;65:310-335.
- Kappler M, Espach C, Schweiger-Kabesch A, et al. Ursodeoxycholic acid therapy in cystic fibrosis liver disease - a retrospective long-term follow-up case-control study. Aliment Pharmacol Ther 2012;36:266-73.
- Kitson MT, Kemp WW, Iser DM, Paul E, Wilson JW, Roberts SK. Utility of transient elastography in the non-invasive evaluation of cystic fibrosis liver disease. Liver Int 2013;33:698-705.
- Koh, Christopher, et al. "Adult‐onset cystic fibrosis liver disease: diagnosis and characterization of an underappreciated entity." Hepatology 66.2 (2017): 591-601
- Li L, Yu C, Li Y. Endoscopic band ligation versus pharmacological therapy for variceal bleeding in cirrhosis: a meta-analysis. Can J Gastroenterol 2011;25:147-55.
- Ling SC, Walters T, McKiernan PJ, Schwarz KB, Garcia-Tsao G, Shneider BL. Primary prophylaxis of variceal hemorrhage in children with portal hypertension: A framework for future research. J Pediatr Gastroenterol Nutr 2011;52:254-61.
- Ling, Simon C., et al. "Liver Ultrasound Patterns in Children with Cystic Fibrosis Correlate with Non-Invasive Tests of Liver Disease." Journal of pediatric gastroenterology and nutrition(2019).
- Mallea J, Bolan C, Cortese C, Harnois D. Cystic Fibrosis-Associated Liver Disease in Lung Transplant Recipients. Liver Transpl. 2019 Aug;25(8):1265-1275. doi: 10.1002/lt.25496. Epub 2019 Jun 25. Review.
- Miller MR, Sokol RJ, Narkewicz MR, Sontag MK. Pulmonary function in individuals who underwent liver transplantation: from the US cystic fibrosis foundation registry. Liver Transpl 2012;18:585-93.
- Nash EF, Volling C, Gutierrez CA, Tullis E, Coonar A, McRae K, Keshavjee S, Singer LG, Durie PR, Chaparro C. Outcomes of patients with cystic fibrosis undergoing lung transplantation with and without cystic fibrosis-associated liver cirrhosis. Clin Transplant 2012;26:34-41.
- Pals FH, Verkade HJ, Gulmans VAM, De Koning BAE, Koot BGP, De Meij TGJ, Hendriks DM, Gierenz N, Vreugdenhil ACE, Houwen RHJ, Bodewes FAJA. Cirrhosis associated with decreased survival and a 10-year lower median age at death of cystic fibrosis patients in the Netherlands. J Cyst Fibros, 2019; 18(3):385-389.
- Rowland M, Gallagher C, Gallagher CG, et al. Outcome in patients with cystic fibrosis liver disease. J Cyst Fibrosis 2015;14:120-6.
- Toledano, M. B., et al. "The emerging burden of liver disease in cystic fibrosis patients: A UK nationwide study." PloS one 14.4 (2019): e0212779
- Van der Feen C, van der Doef HPJ, van der Ent CK, Houwen RHJ. Ursodeoxycholic acid treatment is associated with improvement of liver stiffness in cystic fibrosis patients. J Cyst Fibros 2016;15:834-8.
- Van de Peppel IP, Bertolini A, Jonker JW, Bodewes FAJA, Verkade HJ. Diagnosis, follow-up and treatment of cystic fibrosis-related liver disease. Curr Opin Pulm Med 2017;23:562-9.
- Van de Meeberg PC, Houwen RH, Sinaasappel M, Heijerman HG, Bijleveld CM, VanBergeHenegouwen GP. Low-dose versus high dose ursodeoxycholic acid in cystic fibrosis cholestatic liver disease. Results of a randomized study with 1-year follow-up. Scand J Gastroenterol 1997;32:369-73.
- Woodruff SA, Sontag MK, Accurso FJ, Sokol RJ, Narkewicz MR. Prevalence of elevated liver enzymes in children with cystic fibrosis diagnosed by newborn screen. J Cyst Fibros 2017;16:139-145.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: Wat is de optimale follow-up en behandeling (Ursodeoxycholic acid (UDCA)) bij patiënten met CF met leverfunctiestoornissen (inclusief cirrose) of afwijkingen op de echo?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Cheng, 2017
study characteristics and results are extracted from the SR |
SR and meta-analysis of RCTs
Literature search up to April 2017
A: Colombo, 1996 B: Lepage, 1997 C: Merli, 1994 D: O’Brien, 1992
Study design: A: RCT [parallel] B: RCT (cross-over] C: RCT (cross-over] D: RCT. Method unclear
Setting and Country: A: Multicentre, Italy B: Single centre, Canada C: Single centre, Italy D: Single centre, Ireland
Source of funding: National Institute for Health Research, via Cochrane Infra-structure funding to the Cochrane Cystic Fibrosis and Genetic Disorders Group |
Inclusion criteria SR: -RCTs, -Children and adults with defined CF, diagnosed clinically and by sweat test or genetic testing, including all ages, all degrees of severity of disease and any degree of liver involvement - UDCA administered orally, at any dose, given for a period of at least three months compared to a control group receiving either placebo or no additional therapy (i.e. both groups receiving usual CF therapy).
Exclusion criteria SR: none reported
4 studies included
Important patient characteristics at baseline:
N, mean age A: n=15 (55 in total group), median 13.8 yr (range 4-22 yr) -> Age also for other arms (with taurine) B: n=19, 11.9 (sd 0.6) yr C: n=51, median 14 yr (range 8-32) D: n=12, median 19.5 yr (range 12-42)
Sex: A: 71% Male B: 68% Male C: ? D: ?
Groups comparable at baseline? A: Group characteristics not equal at baseline - all 5 participants with oesophageal varices and 7 out of 8 participants with abnormal serum bilirubin levels at entry, in UDCA group |
Describe intervention:
A: UDCA: 10-20 mg/kg/day B: UDCA 15 mg/kg/day (In the absence of a 50% decrease of ALT or AST or both within 2 months, the dose was increased to 30 mg/kg) C: UDCA 12 mg/kg/day D: UDCA 20 mg/kg/day
|
Describe control:
A: placebo B: placebo C: placebo D: no additional treatment
|
End-point of follow-up:
A: 12 months B: 6 months C: 6 months D: 6 months
For how many participants were no complete outcome data available? (intervention/control) A: none B: 6 withdrawals (1 died, 4 moved away, 1 discontinued medication) C: 42 participants completed the trial, 9 dropouts (5 in UDCA group, 4 in UDCA plus taurine group) not followed-up D: none
|
Outcome measure-1 Defined as: Change in weight (kg)
Effect measure: mean difference [95% CI]: C: -0.76 (-1.83- 0.31) D: -3.40 (-7.94 – 1.14)
Pooled effect (fixed effects model): -0.90 [95% CI -1.94 to 0.14] favoring UDCA Heterogeneity (I2): 19%
Outcome measure-2 Defined as: skinfold thickness (mm). Data for skinfold thickness was incomplete for presentation, minor improvements were mentioned but no differences across treatment groups were mentioned
Outcome measure-3 Defined as: Improvement in biliary excretion (in minutes)
D: time (in minutes) from injection of the isotope to maximal hepatic activity and the percentage clearance of isotope from the liver and biliary tree, at 45 and 60 minutes compared with maximal activity. No significant changes in biliary excretion occurred after treatment with UDCA. no differences across treatment groups were mentioned
Outcome measure-4 Defined as: Need for liver transplant Effect measure: OR [95% CI]: A: 2.79 (0.10-74.63) C: no events D: no events
Outcome measure-5 There were no deaths in either treatment group (related to liver disease or all causes) in any of the trials
Outcome measure-6 Defined as: Lack of normalisation of any hepatocellular enzyme (change from outside the normal range on at least one occasion to within the normal range of the method stated)
Effect measure: OR [95% CI]: C: 0.04 (0.00 – 2.93) D: 0.14 (0.01 – 3.63)
Pooled effect (fixed effects model): 0.09 [95% CI 0.01 to 1.24] favoring UDCA Heterogeneity (I2): 0%
Results of separate enzymes did not give different results.
Outcome measure-7 Defined as: Development of portal hypertension This was not reported as outcome measures in any of the RCTs. However, it was confirmed (personal communication) that in the two six-month follow-up RCTs (C and D) portal hypertension did not develop in any of the participants |
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading
1. LOW (Downgraded twice due to serious risk of bias: one trial was judged to be at high risk of attrition bias due to large amounts of incomplete outcome data and all included trials did not report clear details regarding trial design)
2. NO GRADE
3. LOW (Downgraded once due to risk of bias: the included trial did not report clear details regarding trial design) (Downgraded once due to imprecision: numerical results for the outcome not available)
4. VERY LOW (Downgraded twice due to serious risk of bias: one trial was judged to be at high risk of attrition bias due to large amounts of incomplete outcome data and all included trials did not report clear details regarding trial design) (Downgraded once due to imprecision: very wide CIs around some effect sizes due to low event rates)
5. LOW (Downgraded twice due to serious risk of bias: one trial was judged to be at high risk of attrition bias due to large amounts of incomplete outcome data and all included trials did not report clear details regarding trial design)
6. VERY LOW (Downgraded twice due to serious risk of bias: one trial was judged to be at high risk of attrition bias due to large amounts of incomplete outcome data and all included trials did not report clear details regarding trial design) (Downgraded once due to imprecision: very wide CIs around some ef fect sizes due to low event rates)
7. LOW (Downgraded twice due to serious risk of bias: one trial was judged to be at high risk of attrition bias due to large amounts of incomplete outcome data and all included trials did not report clear details regarding trial design)
|
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Kappler, 2012 |
Type of study: retrospective follow-up case-control study
Setting: Single centre
Country: Germany
Source of funding: 3 author received funding from Asklepion Pharmaceuticals or Novartis. Study design, collection, analysis, and interpretation of the data and the writing of the report were independent of any funding. |
Inclusion criteria: -Liver disease was defined as (i) elevation of one or more serum liver enzymes (aminotransferases (ALT, AST), c-glutamyltransferase (c-GT), glutamate dehydrogenase (GLDH)) ≥1.5 times of the upper normal limit and persisting for ≥6 months, or (ii) liver enlargement >2 cm for ≥6 months.
Exclusion criteria: potential causes of liver disease such as alpha 1 antitrypsin deficiency
N total at baseline: Intervention (early CFRLD +UDCA): 98 Matched control group (no CFRLD): 98 Historic control group (CF patients not screend for CFRLD): 352
Important prognostic factors2: age ± SD: I: 14.8 ± 8.2 M C: 13.3 ± 8.8 H C: ?
Sex: I: 57 % M M C: 57 % M
Groups comparable at baseline? Unclear for historic cohort |
Describe intervention (treatment/procedure/test): UDCA 20 mg per kg body weight
|
Describe control (treatment/procedure/test): No treatment
|
Length of follow-up: 17 years
Loss-to-follow-up: None due to retrospective design
|
Outcome measures and effect size (include 95%CI and p-value if available):
Overt liver disease 1 overt liver disease case in UDCA group 0 overt liver disease cases in the matched control group 9 overt liver cases in historic control group P=0.009, Fishers exact test
Serum liver enzyme levels Serum liver enzyme levels declined in most patients receiving UDCA treatment during the 17-year follow-up (87/98, P < 0.05). There was no comparison with the control groups. |
|
|
Van der Feen, 2016 |
Type of study: Observational cohort study
Setting: Single centre
Country: The Netherlands
Source of funding: Tramedico supported this study by an unrestricted educational grant
|
Inclusion criteria: - pediatric CF Patients who had at least two measurements of liver stiffness by transient elastography (TE) at least 1 year apart
Exclusion criteria: None reported
N total at baseline: N=105 (n=32 UDCA; n=73 no UDCA)
Important prognostic factors2: age ± SD: I: 10.3 (8.6–12.8) yr C: 9.8 (6.9–12.3) yr
Sex: I: 63% male C: 52% male
Groups comparable at baseline? No, control group has a lower liver stiffness and no indication for CFRLD |
Describe intervention (treatment/procedure/test): UDCA 15–20 mg/kg/day
|
Describe control (treatment/procedure/test): No treatment
|
Length of follow-up: median, 40 months; IQR, 17–54 months
Loss-to-follow-up: None
|
Outcome measures and effect size (include 95%CI and p-value if available):
Change in liver stiffness per year (measured with TE) in kPA (IQR)
UDCA: 0.13 (−1.0 to 1.1) No UDCA: 0.19 (−0.03 to 0.59)
For analyses the UDCA group is divided in three roups: 1. UDCA started when fulfilling Colombo criteria (n=15) -0.70 (−1.6 to 0.55), p<0.001 compared with no UDCA group
2. UDCA started for other reasons (n=11) 0.23 (−0.20 to 0.51)
3. UDCA started when cirrhotic (n=6) 4.6 (0.67 to 12.4), p=0.006 compared with no UDCA group |
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Cheng, 2017 |
Yes |
Yes |
Yes |
Yes |
NA |
Yes |
Yes |
Yes |
Unclear |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for examle funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Kappler, 2012 |
Likely |
Unlikely |
Unlikely |
Likely |
|
Van der Feen, 2016 |
Likely |
Unlikely |
Unlikely |
Likely |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Meeberg 1997 |
Vergelijking: low vs high dose UDCA |
|
Lepage 1997 |
Zit in Cochrane review |
|
Colombo 1996 |
Zit in Cochrane review |
|
Merli 1994 |
Zit in Cochrane review |
|
O'Brien 1992 |
Zit in Cochrane review |
|
Smyth 2006 |
Cochrane review is geupdate |
|
Cheng 2000 |
Cochrane review is geupdate |
|
Meeberg 1997 |
Dubbelpublicatie |
|
Colombo 1992 |
Geen vergelijkende studie |
|
Leung 2015 |
Geen vergelijkende studie: associatie |
|
CICUA 2015 |
Geen vergelijkende studie: voor-na studie |
|
Siano 2010 |
Comparison: UCDA at onset vs early UCDA |
|
Desmond 2007 |
Geen vergelijkende studie: voor-na studie |
|
Nousia 2001 |
Geen vergelijkende studie: voor-na studie |
|
Lindblad 1998 |
Geen vergelijkende studie: voor-na studie |
|
Garvia 1992 |
Poster op congres, geen vergelijkende studie |
|
O brien 1996 |
Geen relevante uitkomsten, RCT O'Brien 1992 wel geincludeerd in Cochrane |
|
Thomas 1995 |
Poster op congres, case-studie |
|
Colombo 1994 |
Beschrijvende review |
|
Parisi, 2013 |
Beschrijvende review |
|
Cotting, 1997 |
Geen vergelijkende studie |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 03-07-2020
Beoordeeld op geldigheid : 28-10-2019
Voor het beoordelen van de actualiteit van deze kwaliteitsstandaard is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepalen de besturen van de NVALT, NVK en NCFS of de modules van deze kwaliteitsstandaard nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de kwaliteitsstandaard heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de kwaliteitsstandaard komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVALT, NVK en NCFS zijn regiehouders van deze Kwaliteitsstandaard en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de modules. De andere aan deze kwaliteitsstandaard deelnemende wetenschappelijke verenigingen of gebruikers van de kwaliteitsstandaard delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
CFLD |
NVK en NVALT |
2020 |
2025 |
Eens in de vijf jaar |
NVK en MDL |
-
|
Algemene gegevens
Deze richtlijn is ontwikkeld in samenwerking met:
- Landelijke Vereniging Medische Psychologie
- Nederlands Instituut van Psychologen
- Nederlandse Vereniging van Diëtisten
De ontwikkeling van de medisch inhoudelijke modules binnen deze Kwaliteitsstandaard werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De module over psychosociale zorg en de organisatie van zorg modules werden ondersteund vanuit de Samenwerkende Ouder- en Patiëntenorganisaties (VSOP) en gefinancierd vanuit ZonMW. De financierders hebben geen enkele invloed gehad op de inhoud van de kwaliteitsstandaard.
Doel en doelgroep
Doel
Het tot stand brengen van een evidence-based kwaliteitsstandaard Cystic Fibrosis, een combinatie van een zorgstandaard en een medisch specialistische richtlijn om patiënten met Cystic Fibrosis optimale afgestemde zorg te bieden.
Doelgroep
De doelgroep zijn alle patiënten met Cystic Fibrosis. De kwaliteitsstandaard behelst de gebieden van diagnostiek, behandeling en follow-up conform de diverse stadia van de aandoening en de verschillende leeftijdscategorieën.
Samenstelling werkgroep
Voor het ontwikkelen van de kwaliteitsstandaard is in 2016 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met CF en vertegenwoordigers van de NCFS.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze kwaliteitsstandaard.
Werkgroep
- Drs. G.D. (George) Nossent, longarts, UMCG te Groningen, NVALT (voorzitter)
- Dr. O.W. (Onno) Akkerman, longarts, UMCG te Groningen, NVALT
- S. (Sigrid) Amstelveen-Bökkerink, diëtist, Radboud UMC te Nijmegen, NVD
- Dr. H.G.M. (Bert) Arets, kinderlongarts, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, NVK
- Dr. M. (Marleen) Bakker, longarts, Erasmus MC te Rotterdam, NVALT
- Drs. J.M.W. (Annemarie) van den Berg, longarts, Hagaziekenhuis te Den Haag, NVALT
- Dr. M.C. (Maaike) Berkhout, KNO arts, OLVG te Amsterdam, NVKNO
- Dr. F.A.J.A. (Frank) Bodewes, kinderarts-MDL, UMCG te Groningen, NVK
- A. (Annet) Bongen, maatschappelijk werker, UMC Utrecht te Utrecht, BPSW
- J. (Jacqueline) Boekhoff, maatschappelijk werker, Amsterdam UMC, locatie VUMC te Amsterdam, BPSW
- Drs. L.H. (Hassan) el Bouzzaoui, longarts, Hagaziekenhuis te Den Haag, NVALT
- D. (Dagmar) Brocke, maatschappelijker werker, UMC Utrecht te Utrecht, BPSW
- Drs. E.J. Brokaar, poliklinisch apotheker, Hagaziekenhuis te Den Haag, NVZA
- Dr. I. (Inez) Bronsveld, longarts, UMC Utrecht te Utrecht, NVALT
- Drs. A. (Agnes) Clement-de Boer, kinderarts (endocrinologie), Hagaziekenhuis te Den Haag, NVK
- W. (Wytze) Doeleman, fysiotherapeut, UMC Utrecht te Utrecht, KNFG
- Dr. M.M. (Menno) van der Eerden, longarts, Erasmus MC te Rotterdam, NVALT
- Prof. Dr. C.K. (Kors) van der Ent, Kinderlongarts, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, NVK
- Dr. B.C.T. (Boudien) Flapper, kinderarts-sociale pediatrie, UMCG te Groningen, NVK
- Dr. L. (Lianne) van der Giessen, kinderfysiotherapeut, Erasmus MC Sophia Kinderziekenhuis te Rotterdam, KNGF
- Drs. N. (Nanko) de Graaf, kinderradioloog, Erasmus MC te Rotterdam, NVvR
- Dr. V. (Vincent) Gulmans, Hoofd Onderzoek en Kwaliteit van zorg NCFS te Baarn, NCFS
- Prof. dr. H.G.M. (Harry) Heijerman, longarts, UMC Utrecht te Utrecht, NVALT
- Drs. D.M. (Danielle) Hendriks, kinderarts (MDL), Juliana Kinderziekenhuis te Den Haag, NVK
- Dr. J.J.E. Hendriks, kinderlongarts, Zuyderland Medisch Centrum te Heerlen, NVK
- Prof. dr. B. (Bart) van Hoek, MDL-arts, UMC te Leiden, NVMDL
- Drs. R.A.S. (Rogier) Hoek, longarts, Erasmus MC te Rotterdam, NVALT
- Dr. A. (Ageeth) Hofsteenge, kinderdiëtist, Amsterdam UMC, locatie VUMC en AMC, te Amsterdam, NVD
- Drs. C. (Chantal) Hoge, MDL arts, Maastricht UMC+ te Maastricht, NVMDL
- F.M. (Francis) Hollander, diëtist, UMC Utrecht, Utrecht, NVD
- Prof. dr. R.H.J. (Roderick) Houwen, kinderarts MDL, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, NVK
- Dr. J. (Jakko) van Ingen, arts microbioloog, Radboud UMC te Nijmegen, NVMM
- Dr. H.M. (Hettie) Janssens, (kinder)longarts, Erasmus MC Sophia Kinderziekenhuis te Rotterdam, NVK
- Drs. A.J. (Arjan) Jansz, arts microbioloog, Stichting PAMM te Eindhoven, NVMM
- H.J. (Hetty) van der Kamp, kinderarts-endocrinoloog, HMC Bronovo te Den Haag en Wilhelmina Kinderziekenhuis UMC Utrecht te Utrecht, NVK
- C. (Cora) de Kiviet, verpleegkundig specialist, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, V&VN
- A. (Annelies) Kok, verpleegkundig consulent, Erasmus MC te Rotterdam, CF Netwerk verpleegkundigen Nederland
- Dr. B.G.P. (Bart) Koot, kinderarts (MDL), Amsterdam UMC, locatie AMC te Amsterdam, NVK
- M.A. (Marian) Kruijswijk, verpleegkundig specialist, UMC Utrecht te Utrecht, V&VN
- Dr. C.J. (Christof) Majoor, longarts, Amsterdam UMC, locatie AMC te Amsterdam, NVALT
- R. (Renske) van der Meer, longarts, Hagaziekenhuis te Den Haag, NVALT
- Dr. P.J.F.M. (Peter) Merkus, kinderlongarts, Radboud MC te Nijmegen, NVK
- Dr. D. (Dick) Mul, kinderarts (endocrinologie), Diabeter te Rotterdam, NVK
- Drs. A.F. (Ad) Nagelkerke, kinderlongarts, Amsterdam UMC, locatie VUmc te Amsterdam, NVK
- drs. J. (Jacquelien) Noordhoek, directeur patiëntenorganisatie NCFS te Baarn, NCFS
- Marit van Oirschot-van de Ven, verpleegkundig specialist, UMC Utrecht te Utrecht, V&VN
- Dr. M (Marianne) Nuijssink, kinderlongarts, Haga ziekenhuis te Den Haag, NVK
- Dr. M.H.E. (Monique) Reijers, longarts, Radboudumc te Nijmegen, NVALT
- Dr. S. (Sietze) Reitsma, KNO-arts, Amsterdam UMC, locatie AMC te Amsterdam, NVKNO
- Prof. dr. Y.B. (Yolanda) de Rijke, afdelingshoofd Klinische Chemie, Erasmus MC te Rotterdam, NVKC
- Dr. B.L. (Bart) Rottier, kinderlongarts, UMCG te Groningen, NVK
- R.A. (Revka) Schrijver, verpleegkundig consulent, Hagaziekenhuis te Den Haag, CF Netwerk verpleegkundigen Nederland
- Drs. L. (Luciënne) Speleman, KNO arts, Wilhelmina Kinderziekenhuis en UMC Utrecht, te Utrecht, NVKNO
- Dr. S.W.J. (Suzanne) Terheggen-Lagro, kinderlongarts, Amsterdam UMC, locatie AMC te Amsterdam, NVK
- Prof. dr. H.A.W.M (Harm) Tiddens, (kinder)longarts, Erasmus MC Sophia Kinderziekenhuis te Rotterdam, NVK
- H. (Hilda) Vale-Eeman, kinderverpleegkundige, Amsterdam UMC, locatie AMC te, Amsterdam, V&VN
- Dr. H. (Hester) van der Vaart, longarts UMCG te Groningen, NVALT
- Dr. H.W. (Harold) de Valk, internist-endocrinoloog UMCU te Utrecht, NIV
- Dr. M. (Marieke) Verkleij, GZ-psycholoog/cognitief gedragstherapeut, Amsterdam UMC, locatie VUMC te Amsterdam, VGCT
- Dr. E.J.M. (Els) Weersink, longarts, Amsterdam UMC, locatie AMC te Amsterdam, NVALT
- M. (Marion) Wessels, Verpleegkundige, UMC Utrecht te Utrecht, V&VN
- Dr. B.J. (Barbara) Wijnberg-Williams, klinisch psycholoog, UMCG te Groningen en Isala Ziekenhuis te Zwolle, NIP
- Dr. K.M. (Karin) de Winter- de Groot, kinderlongarts, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, NVK
- Dr. P.J.G. (Petra) Zwijnenburg, klinisch geneticus, Amsterdam UMC, locatie VUMC te Amsterdam, VKGN
Met ondersteuning van
- Dr. F. (Floor) Willeboordse, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Ir. T. (Teus) van Barneveld, directeur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. A. (Anne) Speijer, coördinator kwaliteit van zorg, VSOP
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Drs. G.D. (George) Nossent (voorzitter) |
Longarts UMCG |
Bestuurslid NVALT |
Geen |
Geen actie |
|
O. Akkerman |
Longarts, fulltime, UMCG |
Lid nascholingscommissie VvAwT; onbetaald Lid visitatieteam TBC screening LRCB; onbetaald |
Geen |
Geen actie |
|
S. Amstelveen-Bokkerink |
Diëtist Radboudumc Dekkerswald |
Geen |
Geen |
Geen actie |
|
B. Arets |
Kinderlongarts, UMC Utrecht |
Academisch kinder(long)arts, deels Associate Professor Medisch Onderwijs Universiteit.
|
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
M. Bakker |
Longarts, Erasmus MC Rotterdam |
Geen |
Deelname aan diverse studies Vertex (chloortransportmodulatoren) |
Geen trekker van module CFTR modulatoren (wel meelezer).
Toelichting op onderzoek gesponsord door Vertex: Betrokken bij inclusie van patiënten en dataverzameling. Niet betrokken bij data-analyse, wel principal investigator, geen auteur. |
|
T. van Barneveld |
Directeur Kennisinstituut Federatie Medisch Specialisten |
|
Geen |
Geen actie |
|
A. van den Berg |
Longarts Hagaziekenhuis Den Haag |
Geen |
Geen |
Geen actie |
|
M. Berkhout |
KNO-arts in opleiding in het Academisch Medisch Centrum Amsterdam. Opleider: Prof. dr. F.G. Dikkers |
Geen |
Geen |
Geen actie |
|
F. Bodewes |
Kinderarts-MDL UMC Groningen |
Geen |
Geen |
Geen actie |
|
J. Boekhoff |
medisch maatschappelijk werker Amsterdam UMC, locatie VUmc |
Geen |
Geen |
Geen actie |
|
A. Bongen |
Medisch maatschappelijk werker UMC Utrecht |
Geen |
Geen |
Geen actie |
|
H. Bouazzaoui |
Longarts Hagaziekenhuis Den Haag |
Geen |
Geen |
Geen actie |
|
D. Brocke |
Medisch maatschappelijk werk UMC Utrecht Divisie Hart en Longen |
Geen |
Geen |
Geen actie |
|
E. Brokaar |
Poliklinisch apotheker in de Haga Apotheek, HagaZiekenhuis |
Geen |
Gedeeltelijke vergoeding voor internationaal CF congres door Novartis (2012 en 2014) |
Geen actie |
|
I. Bronsveld |
Pulmonoloog UMC Utrecht |
Geen |
Geen |
Geen actie |
|
A. Clement - Boers, de |
Kinderarts, diabetes HAGA/Julianaziekenhuis Den Haag |
Voorzitter Stichting D-Support (ondersteuning voor gezinnen met diabetes) onbetaald |
Geen |
Geen actie |
|
W. Doeleman |
Fysiotherapeut UMC-Utrecht |
Geen |
Geen |
Geen actie |
|
H. Eeman |
Kinderverpleegkundig consulent CF Werkgever: Academisch Medisch Centrum Amsterdam |
Geen |
Geen |
Geen actie |
|
M. Eerden |
Longarts Erasmus MC |
Geen |
Geen |
Geen actie |
|
K. van der Ent |
Kinderarts, hoogleraar kinderlongziekten UMC Utrecht |
|
Onderzoeksubsidies afgelopen vijf jaar:
Instituut heeft betalingen ontvangen voor klinische studies en adviesraad bijeenkomsten van Gilead, Vertex, GSK, Nutrica, TEVA, ProQR, Galapagos en Proteastasis.
|
Gemelde belangen en nevenfuncties zijn besproken met initiatief nemende verenigingen NVALT en NVK.
Deelname in werkgroep als meelezer bij alle modules op basis van expertise over CF.
Geen trekker van modules over CFTR modulatoren waarvoor er financiële belangen zijn. |
|
B. Flapper |
Kinderarts, sociale pediatrie |
Geen |
Geen |
Geen actie |
|
L. van der Giessen |
0,8 Kinderfysiotherapeut Erasmus MC Sophia 0,1 Coordinator onderwijs Erasmus MC 0,1 docentbegeleiding Erasmus MC |
B. Gastdocent Hogeschool Rotterdam Post HBO kinderfysio B. Cursusleider NPI B. Gastdocent Maas en Meer (B=betaald) |
Geen |
Geen actie |
|
V. Gulmans |
Hoofd onderzoek en kwaliteit van zorg bij Nederlandse Cystic Fibrosis Stichting |
Geen |
Geen persoonlijke vergoedingen. De NCFS heeft corporate sponsorovereenkomsten met meerdere bedrijven (farmaceuten en hulpmiddelen). De overeenkomsten zijn aangemeld bij het transparantieregister. De totale sponsorinkomsten bedragen niet meer dan 10 % van de totale NCFS-begroting. De sponsors hebben geen invloed op de inhoud van NCFS-uitingen. |
Geen actie |
|
H. Heijerman |
Longarts, hoofd afdeling longziekten UMC Utrecht. |
|
|
Gemelde belangen en nevenfuncties zijn besproken met initiatief nemende verenigingen NVALT en NVK.
Deelname in werkgroep als meelezer bij alle modules op basis van expertise over CF.
Geen trekker van modules over CFTR modulatoren waarvoor advies is gegeven. |
|
D. Hendriks |
kinderarts-maagdarmleverziekten Juliana Kinderziekenhuis/Hagaziekenhuis Den Haag |
Geen |
Geen |
Geen actie |
|
H. Hendriks |
kinderarts-longarts in Zuyderland MC en 0,1 fte gedetachteerd naar MUMC + voor CF zorg. |
Geen |
Geen |
Geen actie |
|
B. Hoek |
gastroenteroloog en hepatoloog, LUMC Hoogleraar |
Geen |
Geen gesponsord onderzoek op het gebied van CF. Bij genoemde studies mogelijk auteur en: Novartis: PI, inclusie patiënten Zambon: PI, design studies, data analyse Chiesi: design studie, patiënt inclusie, data analyse Abbvie, Norgine, Astellas: patiënt inclusie CLIF: patiënt inclusie Perspectum: patiënt inclusie, design deel van studie Organ Assist: PI, patiënt inclusie Novartis - deelname aan internationale medicijnstudie bij auto-immuun hepatitis Zambon-unrestricted grant voor onderzoek naar auto-immuun hepatitis en overlap syndromen Chiesi - investigator-initiated studie naar farmacoklnetiek van Envarsus (tacrolimus) na levertransplantatie Abbvie - studie naar langetermijn effect op leverfibrose na DAA behandeling van hepatitis C Norgine - deelname aan rifaximin bij hepatische encefalopathie studie CLIF consortium - deelname aan internationale studies naar accuut - op chronisch leverfalen Perspectum - studies naar nieuew NRI technieken bij leverziekte en na levertransplantatie Astellas - deelname aan immuunsuppressie studie na levertransplantatie OrganAssist - deelname aan studie met machineperfusie voor levertransplantatie |
Geen actie |
|
R. Hoek |
Longarts Erasmus MC Centrum voor Longtransplantatie Centrum voor Cystic Fibrosis en Recidiverende Luchtweginfecties |
Nederlands Transplantatievereniging
allen onbezoldigd |
Geen |
Geen actie |
|
A. Hofsteenge |
Dietist: CF-team (kindergeneeskunde) (Vumc en AMC) Kindergeneeskunde (polikliniek) (VUmc) |
Geen |
Geen |
Geen actie |
|
C. van Hoge |
Maag- darm- leverarts MUMC+ |
Geen |
Geen |
Geen actie |
|
F. Hollander-Kraaijeveld |
Diëtist UMC Utrecht |
Geen |
Geen |
Geen actie |
|
R. Houwen |
Hoofd afdeling kinder-MDL UMCU/WKZ |
De (poli)klinische zorg voor patienten met MDL problematiek, het geven van onderwijs alsmede het vooruitbrengen van de zorg en kennis op dit gebied, onder meer door (meewerken aan) publicaties. Tevens aansturen van de subafdeling kinder-MDL. Deze taken worden verricht in een 100% dienstverband. |
|
Geen actie |
|
J. van Ingen |
Arts-microbioloog, Radboudumc, Nijmegen |
Geen |
Mede-auteur van de internationale richtlijn voor diagnostiek en behandeling van niet-tuberculeuze mycobacterieën bij pantiënten met CF (Floto, 2016). |
Geen actie |
|
H. Janssens |
Kinderlongarts, Erasmus MC/Sophia Kinderziekenhuis |
Voorzitter CF-team Sophia |
Co-promotor bij meerdere studies gefinancierd door unrestricted grant van Chiesi en Gilead. |
Geen actie, meelezer bij module over behandeling P.Aeruginosa (Gilead, Chiesi), geen trekker.
Toelichting gesponsorde onderzoeken. -Studies van Chiesi en Gilead waren met een unrestricted grant, financieen gerund door Sophia BV. De aard van de studies kon door het onderzoeksteam vrij ingevuld worden en gepubliceerd. -Deelname centrum aan sponsor initiated studies van Vertex, en Gilead. Geen mede-auteur. Als voorzitter van CF-team verantwoordelijk voor uitvoer van de studie, en beoordeling adverse events en lab uitslagen van deelnemende patiënten. |
|
A. Jansz |
arts-microbioloog, St PAMM, streeklaboratorium voor de volksgezondheid Veldhoven |
Coördinerend arts-microbioloog, RIVM/IDS, Bilthoven, een detachering van 20% auditor voor de RvA |
Geen |
Geen actie |
|
H. van der Kamp |
kinderarts-endocrinoloog (0,7 fte) werkzaam in het WKZ Utrecht en in het Bronovo ziekenhuis in Den Haag (0,15 fte). |
Lid bestuur NVE (onbetaald) Lid adviesgroep groeihormoon (onbetaald) Lid adviesgroep neonatale screening AGS & CHT (onbetaald) |
Geen |
Geen actie |
|
C. de Kiviet |
Verpleegkundig Specialist Bij CF-centrum UMC Utrecht, locatie WKZ |
Lid van Accreditatiecommissie Van de RSV (Register Verpleegkundig Specialismen) >Vacatievergoeding per bijeenkomst -Beoordelaar scholing voor herregistratie Verpleegkundig Specialisten > Vergoeding per beoordeelde scholing |
Geen |
Geen actie |
|
A. Kok |
verpleegkundig consulent CF Erasmus MC-Sophia Rotterdam |
Geen |
Geen |
Geen actie |
|
B. Koot |
kinderarts AMC Amsterdam |
Bestuur sectie kinder MDL, NVK, onbetaald |
Geen |
Geen actie |
|
M. Kruiswijk |
verpleegkundig specialist afdeling Cystic Fibrosis |
Geen |
Geen |
Geen actie |
|
C. Majoor |
Longarts, Amsterdam UMC, locatie AMC |
|
Inclusie patiënten aan fase IIa, IIb, III en IV studies van Vertex en Galapagos |
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
R. van der Meer |
Longarts, aandachtsgebied Cystic Fibrose. Werkzaam in Hagaziekenhuis. Den Haag. |
Geen |
Geen |
Geen actie |
|
P. Merkus |
Kinderarts-pulmonoloog, Radboudumc Amalia Kinderziekenhuis |
|
Deelname Studies bij CF door farmaceutische bedrijven: Vertex, PTC (PI, betrokken bij inclusie, betrokken bij data-analyse) |
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
D. Mul |
Kinderarts-endocrinoloog bij Diabeter |
|
Geen |
Geen actie, trekker module diabetes (screening en behandeling)
Toelichting op deelname adviesraad medisch Novo Nordisk: conflicteert niet met trekkersrol van diabetes modules. |
|
A. Nagelkerke |
Kinderlongarts VU medisch centrum |
Geen |
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is.
|
|
J. Noordhoek |
Directeur Nederlandse Cystic Fibrosis Stichting |
|
|
Geen actie |
|
M. Nuijsink |
Kinderarts Juliana Kinderziekenhuis/ HAGA ziekenhuis |
Geen |
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
M. van Oirschot-van de Ven |
Kinderverpleegkundig consulent CF, Academisch Medisch Centrum Amsterdam |
Geen |
Geen |
Geen actie |
|
M. Reijers |
Longarts, Radboud UMC, Nijmegen |
|
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is.
|
|
S. Reitsma |
KNO-arts AMC Amsterdam |
Geen |
Geen |
Geen actie |
|
Y de Rijke |
Afdelingshoofd Klinische Chemie Erasmus MC te Rotterdam |
Geen |
Geen |
Geen actie |
|
B. Rottier |
UMC Groningen, kinderlongarts |
Geen |
Geen |
Geen actie |
|
R. Schrijver |
Verpleegkundig consulent CF Hagaziekenhuis |
Geen |
Geen |
Geen actie |
|
A. Speijer |
Coördinator kwaliteit van zorg |
Lid advies - en expertcommissie AQUA van Zorginstituut Nederland.
|
Geen |
Geen actie |
|
L. Speleman |
paediatrische KNO, UMC Utrecht Wilhelminakinderziekenhuis |
|
Geen |
Geen actie |
|
S. Terheggen-Lagro |
Kinderlongarts AMC |
|
Geen |
Geen actie |
|
H. Tiddens |
Kinderlongarts, Erasmus MC, Sofia kinderziekenhuis
|
|
|
Geen actie, meelezer bij module over behandeling P.Aeruginosa geen trekker.
Toelichting gesponsorde onderzoeken. iABC: Co-investigator, CT aquisitie, analyse van CTs, geen betrokkenheid bij inclusie van patiënten ALPINE II: betrokken bij inclusie van patiënten |
|
H. van der Vaart |
Longarts UMCG |
Geen |
Geen |
Geen actie |
|
H. de Valk |
Internist-endocrinoloog, UMC Utrecht |
|
Geen |
Geen actie |
|
H. Verkade |
Kinderarts MDL, UMCG Groningen |
|
Geen |
Geen actie |
|
M. Verkleij |
GZ-psycholoog/cognitief gedragstherapeut, Amsterdam UMC locatie VUmc |
Geen |
Geen |
Geen actie |
|
E. Weersink |
longarts, AMC Amsterdam |
Geen |
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
M. Wessels-Bakker |
Verpleegkundig Specialist Longtransplantatie, onderzoeker |
Geen |
Geen |
Geen actie |
|
B. Wijnberg-Williams |
Klinisch psycholoog/medisch psycholoog, richting kinderen en jeugdigen, UMCG (0,4 fte) en Isala ziekenhuis (0,7fte) |
Lid van Accreditatiecommissie Federatie van Gezondheidszorgpsychologen en Psychotherapeuten (FGzPt) (vacatiegelden) |
Geen |
Geen actie |
|
F. Willeboordse |
Adviseur Kennisinstituut Federatie Medisch Specialisten |
Geen |
Via werk partner aandelen bij moederbedrijf Johnson & Johnson. Partner is werkzaam bij Janssen Vaccines BV. |
Geen actie |
|
K. Winter-de Groot |
kinderarts-pulmonoloog WKZ/UMC Utrecht |
|
Geen |
Geen actie |
|
P. Zwijnenburg |
kinderarts-klinisch geneticus VUMC afd. klinische genetica |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door deelname aan de werkgroep van de patiëntenorganisatie NCFS en de VSOP voor zeldzame en genetische aandoeningen. De uitgangsvragen zijn getoetst via een online peiling onder patiënten en ouders. Voor sommige onderwerpen is het patiënten-panel van de NCFS geraadpleegd om input te verkrijgen over patiëntenvoorkeuren over een behandeling of screeningsmethode.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de kwaliteitsstandaarden de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de kwaliteitsstandaard in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
Deze medisch inhoudelijke modules in deze kwaliteitsstandaard is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Voor de modules over psychosociale zorg en de modules over organisatie van zorg is er volgens de AQUA methode gewerkt: GRADE. De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie https://www.gradeworkinggroup.org/docs/Criteria_for_using_GRADE_2016-04-05.pdf).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de stuurgroep en de adviseur de knelpunten. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten. Tevens zijn er knelpunten aangedragen door VSOP, NCFS, NVK, NVALT, Patiëntenfederatie, Lareb, NVMDL, ZiN, ZN, NIP, NVKNO, VKGN, Vereniging innovatieve geneesmiddelen, NVKC, V&VN, NVMM, KNGF, NIV, NVvR, NVD, NVAB, NVZA via een invitational conference.
De concept uitgangsvragen zijn door de NCFS online voorgelegd aan mensen met CF en ouders van kinderen met CF. Vrijwel alle uitgangsvragen werden door tenminste 85% van de 68 respondenten als zinvol tot zeer zinvol ervaren. Bij twee vragen was dit percentage lager (56% respectievelijk 72%), veroorzaakt door het feit dat 25% van de respondenten bij deze vragen geen mening had.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de stuurgroep en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er is voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Voor deze kwaliteitsstandaard was de Europese Best Practice richtlijn van de ECFS (Castellani, 2018) een belangrijk uitgangspunt voor bijna alle modules.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de kwaliteitsstandaard is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Indicatorontwikkeling
De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn omdat er geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Castellani C, Duff AJA, Bell SC, Heijerman HGM, Munck A, Ratjen F, Sermet-Gaudelus I, Southern KW, Barben J, Flume PA, Hodková P, Kashirskaya N, Kirszenbaum MN, Madge S, Oxley H, Plant B, Schwarzenberg SJ, Smyth AR, Taccetti G, Wagner TOF, Wolfe SP, Drevinek P. ECFS best practice guidelines: the 2018.
revision. J Cyst Fibros. 2018 Mar;17(2):153-178. doi: 10.1016/j.jcf.2018.02.006. Epub 2018 Mar 3. Review.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
|
Embase.com
Ovid Medline |
'cystic fibrosis'/exp OR ((cystic* NEAR/3 fibros*):ti,ab) OR mucoviscoidos*:ab,ti OR mucoviscidos*:ab,ti OR cfld:ab,ti AND 'ursodeoxycholic acid'/exp OR 'cholagogue'/exp OR ((ursodeoxycholic NEAR/3 acid*):ab,ti) OR cholagogue*:ab,ti OR choleretic*:ab,ti OR udca:ab,ti OR hydrocholeretic:ab,ti
AND [1-1-1987]/sd
NOT 'conference abstract':it
Gebruikte filters:
Systematische reviews ('meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)
|
673 513
22
26
166
8
25 |
