Behandeling van Allergische Bronchopulmonale Aspergillosis
Uitgangsvraag
Wat is de meeste effectieve therapie voor Allergische Bronchopulmonale Aspergillosis (ABPA) bij patiënten met CF?
Aanbeveling
Behandel een patiënt met CF met allergische bronchopulmonale aspergillose primair met systemische corticosteroïden, al dan niet gecombineerd met een azol.
Indien behandeling met een azol wordt overwogen, dient vooraf een resistentiebepaling met betrekking tot azolen te worden verricht om zo nodig de behandeling aan te passen.
Let op bij het gebruik van CYP3A4-beïnvloeders, zoals ivacaftor, deze kunnen interacteren met azolen.
Overwegingen
Uit bovenstaand overzicht blijkt dat er zeer weinig onderbouwing uit klinische gerandomiseerde trials is voor het te kiezen therapeutische beleid bij ABPA.
Pathofysiologische argumenten zijn mogelijk de sterkste argumenten voor behandeling met enerzijds corticosteroïden en anderzijds azolen. Een regime van 0,5 mg/kg/dag (voor volwassenen) en 1 tot 2 mg/kg/dag (voor kinderen) gedurende 1 tot 2 weken wordt aanbevolen. Vervolgens kan langzaam worden afgebouwd op geleide van klachten en kliniek (bijvoorbeeld halveren van de dosis elke 2 weken). Alhoewel er geen gerandomiseerde studie is gedaan zijn er wel case series beschreven over de effectiviteit van methylprednisolon in de behandeling van ABPA.
Indien een patiënt binnen een jaar recidiveert, kan gekozen worden voor toevoeging van azolen. Hierbij is itraconazol vooralsnog eerste keus (orale drank, start op 2 dd 200 mg) Het bijwerkingenprofiel of therapieontrouw bij de onaangename inname van itraconazol kan aanleiding zijn voor een keuze voor voriconazol of posaconazol. Twee punten van aandacht zijn hierbij van belang: allereerst alertheid op adequate spiegels van azolen bij comedicatie (onder andere Orkambi®), ten tweede alertheid op de toenemende resistentie voor azolen in Nederland. De mogelijkheid van amfoB inhalaties met amfotericine B kan dan - bij wijze van profylaxe - worden overwogen.
Studies waarbij omalizumab als eerste keus behandeling en/of als steroïdsparende ondersteuning van de behandeling zijn nog onvoldoende verricht. Een behandeling met omalizumab (750 mg) maandelijks valt desondanks te overwegen wanneer in samenspraak met de patiënt de bijwerkingen van (hoge dosis) corticosteroïden op de korte (CFRD) en lange termijn (osteoporose, Cushing, gewichtstoename) opwegen tegen de onbekende effecten van omalizumab.
De laatste jaren heeft het bewustzijn terrein gewonnen dat er overlap bestaat tussen de diagnose ABPA en chronische pulmonale aspergillose al dan niet met subacute invasieve episodes. Het actief blijven monitoren van deze patiënten op kliniek, serologische kenmerken en beeldvorming kan behulpzaam zijn hier verder inzicht in te krijgen.
Onderbouwing
Achtergrond
Allergische bronchopulmonale aspergillose is een overgevoeligheidsreactie op inhalatie van sporen van Aspergillus fumigatus, die met name bij mensen met astma en CF wordt gezien. De diagnostische criteria zijn voor astma en CF op een paar punten echter verschillend. Dit heeft ook te maken met het feit dat ongeveer 70% van alle patiënten met CF antilichamen in het bloed hebben die passen bij Allergische Bronchopulmonale Aspergillosis (ABPA). Dit betreft IgE specifiek voor Aspergillus (IgEasp) en IgG specifiek voor Aspergillus (IgGasp) (Agarwal, 2013). Slechts een klein deel van deze groep ontwikkelt klachten bij ABPA zoals hoesten en benauwdheid. Omdat deze klachten weinig specifiek zijn is het niet altijd duidelijk of zij door ABPA zelf, of door andere pathofysiologie worden veroorzaakt. Om deze redenen is de precieze indicatiestelling voor de behandeling van ABPA minder helder dan de criteria (zie schema) doet vermoeden.
Daarnaast is het ook niet duidelijk wat de beste behandelstrategie is: in sommige ziekenhuizen in Nederland wordt er gestart met corticosteroïden, terwijl andere ziekenhuizen starten met een combinatie van corticosteroïden en azolen. In een recente publicatie in Groot-Brittannië werd aan longartsen en kinderartsen gevraagd naar hun behandelstrategie bij ABPA. Ook hier bleek grote variatie (Boyle, 2018).
|
Patiënt factoren |
Astma of CF |
|
Klinische criteria |
Bronchiectasis |
|
MMB/immunologie |
Obligaat zowel aan A als aan B moet worden voldaan
Ondersteunend een van onderstaande moet geldig zijn
Kweken De meerwaarde van kweek is de eventuele resistentie bepaling indien azolen therapie overwogen wordt. |
|
Diagnose |
A en B zijn obligaat. Indien daarbij een ondersteunend criterium positief is, kan van ABPA worden gesproken. Indien A positief is maar totaal IgE niet verhoogd is, spreekt met van AS of SAFS (aspergillus sensitisation/severe astma with fungal sensitisation).* |
*Het stellen van de diagnose op deze criteria is niet per definitie een indicatie voor behandeling: immers er moeten ook klachten/symptomen zijn
Conclusies / Summary of Findings
De conclusies zijn getrokken op basis van studies van patiënten met astma, en niet CF. Om deze reden zijn alle conclusies ten minste met één niveau verlaagd wegens indirectheid.
1. Longfunctie
|
Zeer laag GRADE |
Het is onduidelijk wat het effect van antimycotica in vergelijking met placebo is op de longfunctie bij patiënten met CF.
Bronnen: (Agbetile, 2014; Wark, 2004) |
|
Zeer laag GRADE |
Het is onduidelijk wat het effect van de dosis van prednisolon is op de longfunctie bij patiënten met CF.
Bronnen: (Agarwal, 2015) |
|
Zeer laag GRADE |
Het is onduidelijk wat het effect van omalizumab in vergelijking met placebo is op de longfunctie bij patiënten met CF.
Bronnen: (Voskamp, 2015) |
2. Exacerbaties
|
Zeer laag GRADE |
Het is onduidelijk wat het effect van antimycotica in vergelijking met placebo is op exacerbaties bij patiënten met CF.
Bronnen: (Agbetile, 2014) |
|
Zeer laag GRADE |
Het is onduidelijk wat het effect van de dosis van prednisolon is op exacerbaties bij patiënten met CF.
Bronnen: (Agarwal, 2015) |
|
Zeer laag GRADE |
Het gebruik van omalizumab zou het aantal exacerbaties enigszins kunnen verminderen ten opzichte van placebo bij patiënten met CF.
Bronnen: (Voskamp, 2015) |
3. Kwaliteit van leven
|
Zeer laag GRADE |
Het gebruik van antimycotica lijkt de kwaliteit van leven niet te verbeteren ten opzichte van placebo bij patiënten met CF.
Bronnen: (Wark, 2004) |
|
Zeer laag GRADE |
Het gebruik van omalizumab lijkt de kwaliteit van leven niet te verbeteren ten opzichte van placebo bij patiënten met CF.
Bronnen: (Voskamp, 2015) |
4. Labparameters
|
Zeer laag GRADE |
Het gebruik van antimycotica zou het serum totale IgE enigszins kunnen verlagen ten opzichte van placebo bij patiënten met CF.
Bronnen: (Wark, 2004) |
|
Zeer laag GRADE |
Een hoge dosis prednisolon zou IgE enigszins kunnen verlagen ten opzichte van een gemiddelde dosering bij patiënten met CF.
Bronnen: (Agarwal, 2015) |
|
Zeer laag GRADE |
Het gebruik van ketoconazol zou specifieke IgG antilichamen enigszins kunnen verlagen ten opzichte van placebo bij patiënten met CF.
Bronnen: (Wark, 2004) |
|
Zeer laag GRADE |
Het gebruik van itraconazol lijkt de eosinofielen in het sputum enigszins te kunnen verlagen ten opzichte van placebo bij patiënten met CF.
Bronnen: (Wark, 2004) |
5. Bijwerkingen
|
Zeer laag GRADE |
Een hoge dosering prednisolon kan het risico op het optreden van het Cushing syndroom enigszins verhogen ten opzichte van een gemiddelde dosering bij patiënten met CF.
Bronnen: (Agarwal, 2015) |
Samenvatting literatuur
Beschrijving studies
Drie systematische reviews zijn geïncludeerd, waarvan twee review studies patiënten met CF includeerden (Elphick, 2016; Jat, 2015). Elphick (2016) vond geen studies die voldeden aan de inclusiecriteria. Jat (2015) vond één niet-gepubliceerde studie in een trialregister, waarbij omalizumab injecties worden vergeleken met placebo. Deze studie is stopgezet, omdat er te weinig patiënten met CF waren die deel wilden nemen aan de studie. Uiteindelijk werden 14 patiënten geïncludeerd. De review van Wark (2004) includeerde studies die antimycotica vergeleken met placebo of standaardbehandeling. Het was niet duidelijk of het een chronische of eerste behandeling van ABPA betrof. Studies met patiënten met CF werden geëxcludeerd. Wark (2004) includeerde 3 RCT’s, met totaal 94 patiënten.
Naast de systematische reviews zijn 3 RCT’s geïncludeerd. Agarwal (2015) vergelijkt een hoge dosis prednisolon gedurende 6 weken met een gemiddelde dosis prednisolon bij 92 patiënten met astma. Voskamp (2015) vergelijkt omalizumab met placebo in een cross-over trial met 13 astmapatiënten. Agbetile (2015) vergelijkt voriconazol met placebo bij 65 astmapatiënten.
Resultaten
1. Longfunctie
1.1 Antimycotica versus placebo
De review van Wark (2004) vond 3 studies die de longfunctie rapporteerde, waarvan één studie met 10 patiënten geen significante verschillen vond in spirometrie tussen patiënten met ketoconazol en placebo (waardes niet gerapporteerd). De andere twee studies vonden geen significante verschillen in longfunctie tussen patiënten met itraconazol en placebo, zie figuur 1 (RR 1,52 (95% BI 0,91 tot 2,54)). De RCT van Agbetile (2014) vond geen significante verschillen tussen patiënten met voriconazol en placebo (waardes niet gerapporteerd).
Figuur 1 Verbetering van longfunctie van 25% of meer
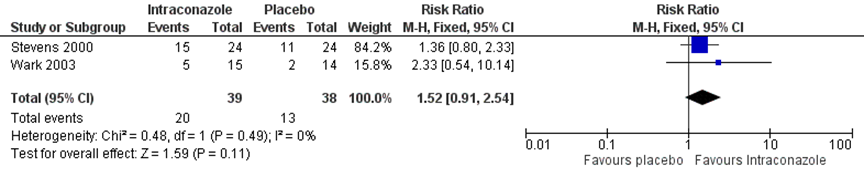
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: Wark, 2004
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat longfunctie is met drie niveaus verlaagd gezien het brede betrouwbaarheidsinterval, het geringe aantal patiënten (imprecisie) en de extrapoleerbaarheid naar patiënten met CF (indirectheid).
1.2 Hoge versus gemiddelde dosis prednisolon
Agarwal (2015) vond geen significante verschillen in longfunctie tussen 66 patiënten met een hoge of een gemiddelde dosis prednisolon in FEV1 (gemiddeld verschil ten opzichte van baseline 0,27 versus 0,34; p=0,426) en FVC (gemiddeld verschil ten opzichte van baseline in beide groepen 0,37).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat longfunctie is met drie niveaus verlaagd gezien verlaagd gezien beperkingen in de onderzoeksopzet (de missende blindering van de allocatie van de behandelingen en bias door grote uitval), het geringe aantal patiënten (imprecisie) en de extrapoleerbaarheid van astma naar patiënten met CF (indirectheid).
1.3 Omalizumab versus placebo
Voskamp (2015) vond geen significante verschillen in longfunctie bij 13 patiënten met omalizumab of placebo in FEV1 (gemiddelde 1,98 (SD 0,85) versus 1,87 (SD 0,68); p=0,16) en FeNO (gemiddelde 17,1 (SD 11,5) versus 20,5 (SD 0,65); p=0,58).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat longfunctie is met drie niveaus verlaagd gezien de grote standaarddeviatie, het geringe aantal patiënten (imprecisie) en de extrapoleerbaarheid van astma naar patiënten met CF (indirectheid).
2. Exacerbaties
2.1 Antimycotica versus placebo
Agbetile (2014) rapporteerde geen significante verschillen in exacerbaties tussen 64 patiënten met voriconazol en placebo. Het gemiddelde aantal exacerbaties per persoon was respectievelijk 1,4 versus 3,0 en het gemiddelde aantal ernstige exacerbaties per persoon was 1,2 gedurende 12 maanden versus 2,5 exacerbaties in de 12 maanden vooraf aan de behandeling (p-waardes niet gerapporteerd).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat exacerbaties is met drie niveaus verlaagd gezien het zeer geringe aantal patiënten (imprecisie) en de extrapoleerbaarheid van astma naar patiënten met CF (indirectheid).
2.2 Hoge versus gemiddelde dosis prednisolon
Agarwal (2015) rapporteerde geen significante verschillen in exacerbaties tussen 66 patiënten met een hoge of gemiddelde dosis prednisolon (40,9% versus 50%; p=0,592).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat exacerbaties is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (de missende blindering van de allocatie van de behandelingen en bias door grote uitval), het geringe aantal patiënten (imprecisie) en de extrapoleerbaarheid van astma naar patiënten met CF (indirectheid).
2.3 Omalizumab versus placebo
In de cross-over studie met 13 patiënten van Voskamp (2015) hadden patiënten in de interventiegroep minder exacerbaties dan patiënten in de controlegroep (2 versus 12; p=0,048).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat exacerbaties is met drie niveaus verlaagd gezien het zeer geringe aantal patiënten (imprecisie) en de extrapoleerbaarheid van astma naar patiënten met CF (indirectheid).
3. Kwaliteit van leven
3.1 Antimycotica versus placebo
Eén studie in het review van Wark (2004) met 55 patiënten vond geen significante verschillen in kwaliteit van leven (geen cijfers gerapporteerd) tussen patiënten met itraconazol en placebo. Ook Agbetile (2014) rapporteerde geen significante verschillen in kwaliteit van leven tussen 64 patiënten met voriconazol of placebo (geen cijfers gerapporteerd).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat kwaliteit van leven is met drie niveaus verlaagd gezien het zeer geringe aantal patiënten (imprecisie) en de extrapoleerbaarheid van astma naar patiënten met CF (indirectheid).
3.2 Omalizumab versus placebo
In de cross-over studie van Voskamp (2015) met 13 patiënten was de kwaliteit van leven niet significant verschillende tussen de omalizumab en de placebogroep (mediaan 0,88 (IQR 0,90) versus 1,21 (IQR 0,65); p=0,58).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat kwaliteit van leven is met drie niveaus verlaagd gezien het zeer geringe aantal patiënten (imprecisie) en de extrapoleerbaarheid van astma naar patiënten met CF (indirectheid).
4. Labparameters
4.1 IgE
4.1.1 Antimycotica versus placebo
De review van Wark (2004) vond 3 studies die serum totale IgE rapporteerde. Eén studie met 10 patiënten vond een significante afname na 12 maanden (p<0,05) in de groep patiënten met ketoconazol terwijl de IgE toenam in de placebogroep (waardes niet gerapporteerd). Twee studies met totaal 79 patiënten vonden dat de totale serum IgE bij patiënten met intraconazol vaker met 25% of meer afnam dan patiënten in de placebogroep, zie figuur 2 (RR 1,93 (95% BI 1,11 tot 3,3))). Er was sprake van een substantiële mate van heterogeniteit (I2 72%).
Figuur 2 Afname in totale serum IgE van 25% of meer
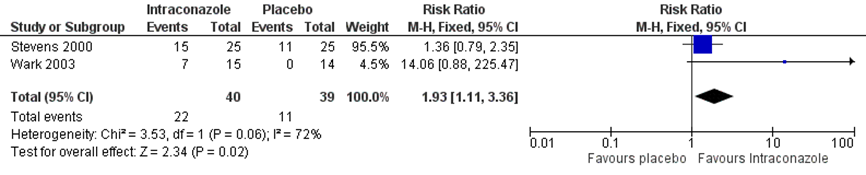
Z: p-waarde van gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval. Bron: Wark, 2004
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat IgE is met drie niveaus verlaagd gezien het grote betrouwbaarheidsinterval, het zeer geringe aantal patiënten (imprecisie, verlaging met twee niveaus) en de extrapoleerbaarheid van astma naar patiënten met CF (indirectheid, verlaging met één niveau).
4.1.2 Hoge versus gemiddelde dosis prednisolon
Agarwal (2015) toonde een significant hogere procentuele afname van IgE na behandeling met hoge dosis prednisolon (n=32) ten opzichte van een gemiddelde dosis (n=34) (43,8% versus 11,8%, p=0,025).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat IgE is met drie niveaus verlaagd gezien verlaagd gezien beperkingen in de onderzoeksopzet (bias door grote uitval), het geringe aantal patiënten (imprecisie) en de extrapoleerbaarheid van astma naar patiënten met CF (indirectheid).
4.2 IgG antilichamen
4.2.1 Antimycotica versus placebo
De review van Wark (2004) vond 1 studie die IgG antilichamen rapporteerde bij 10 patiënten. Het gebruik van ketoconazol resulteerde in een afname van specifieke IgG antilichamen van 40% versus 0% in de placebo groep (p<0,05).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat IgG is met drie niveaus verlaagd gezien verlaagd gezien het zeer geringe aantal patiënten (imprecisie, met twee niveaus verlaagd) en de extrapoleerbaarheid van astma naar patiënten met CF (indirectheid, met één niveau verlaagd).
4.3 Eosinofielen in het sputum
4.3.1 Antimycotica versus placebo
De review van Wark (2004) vond 1 studie die eosinofielen in het sputum rapporteerde bij 29 patiënten. Het gebruik van itraconazol resulteerde in een afname van eosinofielen in het sputum van 35% (95% BI 20 tot 40% afname) versus geen afname in de placebogroep (95% BI 66% afname tot 30% toename).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat eosinofielen in het sputum is met drie niveaus verlaagd gezien het grote betrouwbaarheidsinterval, het zeer geringe aantal patiënten (imprecisie) en de extrapoleerbaarheid van astma naar patiënten met CF (indirectheid).
5. Bijwerkingen
5.1 Hoge versus gemiddelde dosis prednisolon
Agarwal (2015) vond dat patiënten met een hoge dosis prednisolon vaker het Cushing syndroom hadden dan patiënten met een gemiddelde dosis (79,6% versus 29,2%; p<0,001) (totaal 66 patiënten).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat Cushing syndroom is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (de missende blindering van de allocatie van de behandelingen en bias door grote uitval), het geringe aantal patiënten (imprecisie) en de extrapoleerbaarheid van astma naar patiënten met CF (indirectheid).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn de behandelingsresultaten van Allergische Bronchopulmonale Aspergillosis bij patiënten met CF van de op dit moment gebruikte technieken?
P (Patiënten): patiënten met CF volwassenen en kinderen (apart analyseren, verschil in dosering) met allergische bronchopulmonale aspergillose, Aspergillus fumigatus;
I (Interventie): systemische steroïden (prednison, en/of antimycotica (itraconazol, voriconazol, posaconazol, amfotericine), omalizumab;
C (Comparison): placebo/ geen behandeling, of systemische steroïden of antimycotica (itraconazol, voriconazol, posaconazol), of omalizumab;
O (Outcomes): verbetering longfunctie (FEV1 en reversibiliteit), hoestklachten, benauwdheid, kwaliteit van leven, labparameters (IgE, spec IgE, spec IgG, precipitines, eosinofielen, kweekuitslagen); bijwerkingen: nefrotoxiciteit.
Relevante uitkomstmaten
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 2 december 2017 met relevante zoektermen gezocht naar Engelstalige systematische reviews, gerandomiseerde gecontroleerde studies (RCT’s), gecontroleerde klinische studie (CCT’s) en vergelijkend observationeel onderzoek studies gepubliceerd vanaf 1987 gericht op behandeling van patiënten met CF met allergische bronchopulmonale aspergillose met systemische steroïden of antimycotica. Deze search leverde bijna geen hits op, waarna besloten is om de zoekstrategie uit te breiden naar alle patiënten met allergische bronchopulmonale aspergillose. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 568 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: gerandomiseerde gecontroleerde trials die systemische steroïden of antimycotica vergelijken met een placebobehandeling, geen behandeling of andere systemische steroïden of antimycotica en ten minste één van de volgende uitkomstmaten hanteren: verbetering longfunctie (FEV1 en reversibiliteit), hoestklachten, benauwdheid, kwaliteit van leven, labparameters (IgE, spec IgE, spec IgG, precipitines, eosinofielen, kweekuitslagen); bijwerkingen: nefrotoxiciteit. Op basis van titel en abstract werden in eerste instantie 23 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 17 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 6 studies definitief geselecteerd.
Drie systematische reviews (Elphick, 2016; Jat, 2015; Wark, 2004) en 3 RCT’s (Agarwal, 2015; Agbetile, 2014; Voskamp, 2015) zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Agarwal, R., et al., Allergic bronchopulmonary aspergillosis: review of literature and proposal of new diagnostic and classification criteria. Clinical and experimental allergy: journal of the British Society for Allergy and Clinical Immunology, 2013. 43: p. 850-73.
- Agarwal R, Chakrabarti A, Shah A, et al; ABPA complicating asthma ISHAM working group. Allergic bronchopulmonary aspergillosis: review of literature and proposal of new diagnostic and classification criteria. Clin Exp Allergy 2013; 43 (8) 850-873
- Agarwal R, Aggarwal AN, Dhooria S, Singh Sehgal I, Garg M, Saikia B, Behera D, Chakrabarti A. A randomised trial of glucocorticoids in acute-stage allergic bronchopulmonary aspergillosis complicating asthma. Eur Respir J. 2016 Feb;47(2):490-8. doi: 10.1183/13993003.01475-2015.
- Agarwal, R., Allergic bronchopulmonary aspergillosis. Chest, 2009. 135: p. 805-26.
- Agbetile J, Bourne M, Fairs A, Hargadon B, Desai D, Broad C, Morley J, Bradding P, Brightling CE, Green RH, Haldar P, Pashley CH, Pavord ID, Wardlaw AJ. Effectiveness of voriconazole in the treatment of Aspergillus fumigatus-associated asthma (EVITA3 study). J Allergy Clin Immunol. 2014 Jul;134(1):33-9. doi: 10.1016/j.jaci.2013.09.050.
- Boyle m, J E Moore, J L Whitehouse, D Bilton, DG Downey. The diagnosis and management of respiratory tract fungal infection in cystic fibrosis: A UK survey of current practice. 15 March 2018. Medical Mycology, myy014, https://doi.org/10.1093/mmy/myy014
- Elphick HE, Southern KW. Antifungal therapies for allergic bronchopulmonary aspergillosis in people with cystic fibrosis. Cochrane Database Syst Rev. 2016 Nov 8;11:CD002204.
- Jat KR, Walia DK, Khairwa A. Anti-IgE therapy for allergic bronchopulmonary aspergillosis in people with cystic fibrosis. Cochrane Database Syst Rev. 2015 Nov 4;(11):CD010288. doi: 10.1002/14651858.CD010288.pub3.
- Stevens, D.A., et al., Allergic bronchopulmonary aspergillosis in cystic fibrosis--state of the art: Cystic Fibrosis Foundation Consensus Conference. Clin Infect Dis, 2003. 37 Suppl 3: p. S225-64.
- Voskamp AL, Gillman A, Symons K, Sandrini A, Rolland JM, O'Hehir RE, Douglass JA. Clinical efficacy and immunologic effects of omalizumab in allergic bronchopulmonary aspergillosis. J Allergy Clin Immunol Pract. 2015 Mar-Apr;3(2):192-9. doi: 10.1016/j.jaip.2014.12.008.
- Wark PA, Gibson PG, Wilson AJ. Azoles for allergic bronchopulmonary aspergillosis associated with asthma. Cochrane Database Syst Rev. 2004;(3):CD001108.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: Wat is de meeste effectieve therapie voor Allergische Bronchopulmonale Aspergillosis (ABPA) bij CF patiënten?
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy - otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question: Wat is de meeste effectieve therapie voor Allergische Bronchopulmonale Aspergillosis (ABPA) bij CF patiënten?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Agarwal et al, 2015 |
Type of study: RCT
Setting: Chest Clinic of the Postgraduate Institute of Medical Education and Research (PGIMER)
Country: India
Source of funding: non-commercial |
Inclusion criteria: 1. Diagnosis of ABPA 2. Presence of all the following three criteria: - asthma - immediate cutaneous hyperreactivity on Aspergillus skin test or A. fumigatus specific IgE levels >0.35 kUA·L−1 - elevated total IgE levels >1000 IU·mL−1
Presence of two of the following criteria: - presence of precipitating antibodies against A. fumigatus in serum - fixed or transient radiographic pulmonary opacities - total eosinophil count >1000·μL−1 - bronchiectasis on high-resolution computed tomography (HRCT) of the thorax.
Exclusion criteria: 1. intake of systemic glucocorticoids for >3 weeks in the preceding 6 months 2. immunosuppressive states such as uncontrolled diabetes mellitus, chronic renal failure, chronic liver failure and others 3. patient on immunosuppressive drugs 4. pregnancy 5. enrolment in another trial of ABPA 6. failure to provide informed consent
N total at baseline: Intervention: 44 Control: 48
Important prognostic factors2:
Age, median (IQR): I: 32 (23-41) C: 30 (21-45)
Sex: I: 65.9% M C: 45.8% M
FEV1 % lower limit of normal, median (IQR) I: 72.2 (48.2-87.1) C: 67.7 (56.9-96.4)
Groups are comparable at baseline
|
Describe intervention (treatment/procedure/test):
High-dose steroids: oral prednisolone 0.75 mg·kg−1 · day−1 for 6 weeks followed by 0.5 mg·kg−1 · day−1 for 6 weeks, then taper by 5 mg every 6 weeks and discontinue after 8–10 months
|
Describe control (treatment/procedure/test):
medium-dose steroids: oral prednisolone 0.5 mg·kg−1·day−1 for 2 weeks followed by 0.5 mg·kg−1 on alternate days for 8 weeks, then taper by 5 mg every 2 weeks and discontinue after 3–5 months |
Length of follow-up: 2-years
Loss-to-follow-up: Intervention: 12 (27%) Reasons unknown
Control: 14 (29%) Reasons unknown
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
Exacerbation after 1 year, % (95% CI): I: 40.9 (27.2-55.6) C: 50 (36.4-63.6), p=0.592
Percentage decline in IgE after 6 weeks of treatment, mean (95% CI) I: 43.8 (36.8–50.9) C: 11.8 (−8.1–31.7), p=0.025
Difference in FEV1 after 6 weeks of treatment, mean (95% CI) I: 0.27 (0.17–0.37) C: 0.34 (0.23–0.45), p=0.426
Difference in FVC after 6 weeks of treatment, mean (95% CI) I: 0.37 (0.19–0.54) C: 0.37 (0.26–0.49), p=0.725
Glucocorticoid-related adverse reactions, % (95% CI) Cushingoid habitus I: 79.6 (65.5–88.9) C: 29.2 (18.2–43.2), p=0.0001
Hypertension I: 2.3 (0.4–11.8) C: 0
Hyperglycaemia) I: 2.3 (0.4–11.8) C: 0
Hypertrichosis I: 11.4 (4.9–23.9) C: 0
Acne I: 36.4 (23.8–51.1) C: 20.8 (11.7–34.3), p=0.098
Striae I: 18.2 (9.5–31.9) C: 2.1 (0.4–10.9), p=0.025
Weight gain (>10% of baseline) I: 54.6 (40.1–68.3) C: 16.7 (8.7–29.6), p=0.0001
Mood changes I: 9.1 (3.6–21.2) C: 4.2 (1.2–13.9), p=0.594 |
Author’s conclusion: Medium-dose oral glucocorticoids are as effective in preventing exacerbations and progression to the glucocorticoid-dependent stage in ABPA complicating asthma and safer than high-dose in treatment of ABPA. |
|
Voskamp et al, 2015 |
Type of study: RCT (cross-over)
Setting: Immunology and Respiratory Medicine, Alfred Hospital and Monash University, Melbourne, Australia
Country: Australia
Source of funding: industrial funding |
Inclusion criteria: 1. Subjects more than 18 years of age who met the diagnostic criteria for ABPA, as defined by Rosenberg and Patterson. 2. Patients had poorly controlled symptoms of ABPA with cough, sputum production, wheeze, and dyspnea despite treatment with maximal doses of inhaled combined corticosteroid and long-acting b-agonist therapy and regular oral corticosteroid if required. 3. a previous diagnosis of asthma, an elevated serum total IgE > 400 IU/mL, the presence of proximal bronchiectasis on chest high-resolution computerized tomography scan, sensitization to A. fumigatus antigens with a positive SPT > 3mm, and the presence of Aspergillus-specific serum IgE.
Exclusion criteria: 1. Patients who had commenced antifungal therapy in the previous 8 weeks or had required an escalation of corticosteroid treatment during that time. 2. Cystic fibrosis (CF), pregnancy, and lactation
N total at baseline: 13 patients
Important prognostic factors2: Age, mean (range): 59 (26-69)
Sex: 9 females |
Describe intervention (treatment/procedure/test):
4-month treatment with omalizumab (750 mg monthly) followed by a 3-month washout period
|
Describe control (treatment/procedure/test):
4-month treatment with placebo followed by a 3-month washout period
|
Length of follow-up: All patients were reviewed monthly throughout the study up to 11 months
Loss-to-follow-up: 1 person was withdrawn during washout period after placebo phase due to exacerbation
Incomplete outcome data: 1 person
|
Outcome measures and effect size (include 95%CI and p-value if available):
Exacerbation frequency I: 2 C: 12 P=0.048
FEV1, mean (SD) I: 1.98 (0.85) C: 1.87 (0.68) P=0.16
FeNO, mean (SD) I: 17.1 (11.5) C: 20.5 (17.6) P=0.14
Quality of life, median (IQR) I: 0.88 (0.90) C: 1.21 (0.65) P=0.58
Basophil sensitivity Basophil sensitivity decreased significantly after omalizumab treatment but not placebo in both whole blood and PBMC derived basophils (p<0,001)
Basophil maximal reactivity Whole blood, median (IQR) I: 35.5 (63.1) C: 89.9 (10.7) P=0.002
PBMC, median (IQR) I: 30.3 (62.1) C: 78.8 (19.7) P=0.001
Anti-IgE, mean (SD) I: 55.6 (22.3) C: 40.2 (22.5) P= 0.40
fMLP, mean (SD) I: 48.6 (17.8) C: 41.6 (19.8) P=0.015
% basophils, mean (SD) I: 2.3 (1.3) C: 2.2 (1.1) P=0.69
Adverse outcomes C: 1 patients with exacerbation that required hospitalization I: no adverse outcomes |
Author’s conclusion: This study provides evidence that omalizumab is an effective therapy for patients with chronic ABPA, which results in a decreased number of exacerbations during the active treatment phase compared to placebo and a decline of a well accepted inflammatory marker of the lower airways (FeNO). These findings suggest that the immunologic mechanisms underlying exacerbations in ABPA can be effectively reduced with omalizumab, with the potential to prevent disease progression and/or development of bronchiectasis. |
|
Agbetile et al, 2014 |
Type of study: RCT
Setting: The Institute for Lung Health, department of Infection, immunity and Inflammation, University of Leicester, and the Department of Respiratory Medicine, University Hospitals of Leicester NHS Trust, Glenfield Hospital.
Country: United Kingdom
Source of funding: Industrial funding |
Inclusion criteria: 1. clinical diagnosis of asthma 2. at least historical evidence of variable airflow obstruction (short-term variability in FEV1 >12% or PC20 <8 mg/mL) 3. evidence of IgE sensitization to A fumigatus (increased specific IgE level >0.35 IU/L or a skin prick test response >2 mm larger than that elicited by the negative control) 4. at least 2 severe exacerbations (defined as requiring a minimum of 3 days of high-dose oral corticosteroids for asthma symptoms) in the previous 12 months
Exclusion criteria: 1. pregnancy 2. a diagnosis of chronic obstructive pulmonary disease, a medical condition that would increase the likelihood of an adverse reaction to voriconazole 3. treatment with an antifungal agent in the 12 months before entry into the study
N total at baseline: Intervention: 33 Control: 32
Important prognostic factors2: Age, mean (range) : I: 59 (27-80) C: 59 (38-78)
Sex: I: 38% M C: 63% M
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
3 months 200 mg Voriconazole twice daily
|
Describe control (treatment/procedure/test):
Placebo
|
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: 0
Control: 1 (3%) Reason: changed mind
Incomplete outcome data: Intervention: 3 (9%) Reasons: Transaminitis (n=2) Photosensitivity (n=1)
Control: 2 (6%) Reasons: Died pneumonia (n=1) Coronary spasm (n=1)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Severe exacerbations, mean per subject I: 1.16 C: 2.5
Exacerbations, mean per subject I: 1.4 C: 3.0
AQLQ score, mean at baseline, end of treatment, end of trial I: 4.55, 5.22, 4.85 C: 4.66, 5.54, 5.13 No significant difference between groups (p-value not reported)
FEV1 There were no significant differences between the groups in FEV1 (values not reported)
|
Author’s conclusion: We were unable to show a beneficial effect of 3 months of treatment with voriconazole in patients with moderate-to-severe asthma who were IgE sensitized to A fumigatus on either the rate of severe exacerbations, quality of life, or other markers of asthma control. |
Abbreviations: ABPA: Allergic bronchopulmonary aspergillosis; AQLQ: Asthma Quality of Life Questionnaire; FEV1: Forced expiratory volume in 1 second; FeNO: Fractional exhaled nitric oxide; fMLP: Formyl-methionyl-leucyl-phenylalanine; PBMC- Peripheral blood mononuclear cells
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Research question: Wat is de meeste effectieve therapie voor Allergische Bronchopulmonale Aspergillosis (ABPA) bij CF patiënten?
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Elphick,, 2016 |
Yes |
Yes |
Yes |
N/A* |
N/A |
N/A* |
N/A* |
N/A* |
Yes |
|
Jat, 2015 |
Yes |
Yes |
Yes |
Yes |
N/A |
Yes |
No** |
Yes |
Yes |
|
Wark, 2004 |
Yes |
Yes |
Yes |
No |
N/A |
Yes |
Yes |
Unclear |
No*** |
*0 studies were included
** Only 1 study included
***Reported for SR, but not for included study
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials)
Research question: Wat is de meeste effectieve therapie voor Allergische Bronchopulmonale Aspergillosis (ABPA) bij CF patiënten?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Agarwal, 2015 |
computer-generated |
unlikely (sealed envelopes) |
likely (open lable) |
likely (open lable) |
likely (open lable) |
unlikely |
likely* |
likely |
|
Voskamp, 2015 |
the sequence of treatments was randomized by the hospital pharmacy that prepared the injections |
unclear |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Agbetile, 2014 |
blocks of 3 with the minimization method using the criteria of sputum eosinophil counts, numbers of exacerbations in the previous 12 months, and sputum fungal culture results for A fumigatus |
unclear |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
* Large number of patients lost to follow-up, without reported reasons
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Godet, 2017 |
Franstalig artikel |
|
Casciaro, 2015 |
Geen systematisch review of origineel onderzoek |
|
Moreira, 2014 |
Recentere systematische reviews geïncludeerd met dezelfde PICO |
|
Mahdavinia, 2012 |
Recentere systematische reviews geïncludeerd met dezelfde PICO |
|
Argarwal, 2012 |
Geen systematisch review of origineel onderzoek |
|
Hogan, 2011 |
Geen systematisch review of origineel onderzoek |
|
Wark, 2004 |
Bevat dezelfde resultaten als geïncludeerd review Wark, 2004 |
|
Wark, 2003 |
RCT is geïncludeerd in review Wark, 2004 |
|
Skov, 2002 |
Voldoet niet aan PICO |
|
Stevens, 2000 |
RCT geïncludeerd in review Wark, 2004 |
|
Stevens, 2000 |
Geen systematisch review of origineel onderzoek |
|
Leon, 1999 |
Recentere systematische reviews geïncludeerd met dezelfde PICO |
|
Khalil, 2015 |
Voldoet niet aan PICO |
|
Kanthan, 2007 |
Retrospectief observationeel onderzoek |
|
Ritz, 2005 |
Retrospectief observationeel onderzoek |
|
Ritz, 2006 |
Erratum op Ritz 2006 |
|
Main, 2002 |
Voldoet niet aan PICO |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 03-07-2020
Beoordeeld op geldigheid : 28-10-2019
Voor het beoordelen van de actualiteit van deze kwaliteitsstandaard is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepalen de besturen van de NVALT, NVK en NCFS of de modules van deze kwaliteitsstandaard nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de kwaliteitsstandaard heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de kwaliteitsstandaard komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVALT, NVK en NCFS zijn regiehouders van deze Kwaliteitsstandaard en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de modules. De andere aan deze kwaliteitsstandaard deelnemende wetenschappelijke verenigingen of gebruikers van de kwaliteitsstandaard delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Behandeling ABPA |
NVALT, NVK |
2020 |
2025 |
Eens in de vijf jaar |
NVALT / NVK |
Nieuwe wetenschappelijke ontwikkelingen voor behandeling ABPA* |
*Op korte termijn zijn er geen studies te verwachten. Mogelijk dat uit de behandeling van chronische pulmonale aspergillose nieuwe inzichten komen.
Algemene gegevens
Deze richtlijn is ontwikkeld in samenwerking met:
- Landelijke Vereniging Medische Psychologie
- Nederlands Instituut van Psychologen
- Nederlandse Vereniging van Diëtisten
De ontwikkeling van de medisch inhoudelijke modules binnen deze Kwaliteitsstandaard werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De module over psychosociale zorg en de organisatie van zorg modules werden ondersteund vanuit de Samenwerkende Ouder- en Patiëntenorganisaties (VSOP) en gefinancierd vanuit ZonMW. De financierders hebben geen enkele invloed gehad op de inhoud van de kwaliteitsstandaard.
Doel en doelgroep
Doel
Het tot stand brengen van een evidence-based kwaliteitsstandaard Cystic Fibrosis, een combinatie van een zorgstandaard en een medisch specialistische richtlijn om patiënten met Cystic Fibrosis optimale afgestemde zorg te bieden.
Doelgroep
De doelgroep zijn alle patiënten met Cystic Fibrosis. De kwaliteitsstandaard behelst de gebieden van diagnostiek, behandeling en follow-up conform de diverse stadia van de aandoening en de verschillende leeftijdscategorieën.
Samenstelling werkgroep
Voor het ontwikkelen van de kwaliteitsstandaard is in 2016 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met CF en vertegenwoordigers van de NCFS.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze kwaliteitsstandaard.
Werkgroep
- Drs. G.D. (George) Nossent, longarts, UMCG te Groningen, NVALT (voorzitter)
- Dr. O.W. (Onno) Akkerman, longarts, UMCG te Groningen, NVALT
- S. (Sigrid) Amstelveen-Bökkerink, diëtist, Radboud UMC te Nijmegen, NVD
- Dr. H.G.M. (Bert) Arets, kinderlongarts, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, NVK
- Dr. M. (Marleen) Bakker, longarts, Erasmus MC te Rotterdam, NVALT
- Drs. J.M.W. (Annemarie) van den Berg, longarts, Hagaziekenhuis te Den Haag, NVALT
- Dr. M.C. (Maaike) Berkhout, KNO arts, OLVG te Amsterdam, NVKNO
- Dr. F.A.J.A. (Frank) Bodewes, kinderarts-MDL, UMCG te Groningen, NVK
- A. (Annet) Bongen, maatschappelijk werker, UMC Utrecht te Utrecht, BPSW
- J. (Jacqueline) Boekhoff, maatschappelijk werker, Amsterdam UMC, locatie VUMC te Amsterdam, BPSW
- Drs. L.H. (Hassan) el Bouzzaoui, longarts, Hagaziekenhuis te Den Haag, NVALT
- D. (Dagmar) Brocke, maatschappelijker werker, UMC Utrecht te Utrecht, BPSW
- Drs. E.J. Brokaar, poliklinisch apotheker, Hagaziekenhuis te Den Haag, NVZA
- Dr. I. (Inez) Bronsveld, longarts, UMC Utrecht te Utrecht, NVALT
- Drs. A. (Agnes) Clement-de Boer, kinderarts (endocrinologie), Hagaziekenhuis te Den Haag, NVK
- W. (Wytze) Doeleman, fysiotherapeut, UMC Utrecht te Utrecht, KNFG
- Dr. M.M. (Menno) van der Eerden, longarts, Erasmus MC te Rotterdam, NVALT
- Prof. Dr. C.K. (Kors) van der Ent, Kinderlongarts, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, NVK
- Dr. B.C.T. (Boudien) Flapper, kinderarts-sociale pediatrie, UMCG te Groningen, NVK
- Dr. L. (Lianne) van der Giessen, kinderfysiotherapeut, Erasmus MC Sophia Kinderziekenhuis te Rotterdam, KNGF
- Drs. N. (Nanko) de Graaf, kinderradioloog, Erasmus MC te Rotterdam, NVvR
- Dr. V. (Vincent) Gulmans, Hoofd Onderzoek en Kwaliteit van zorg NCFS te Baarn, NCFS
- Prof. dr. H.G.M. (Harry) Heijerman, longarts, UMC Utrecht te Utrecht, NVALT
- Drs. D.M. (Danielle) Hendriks, kinderarts (MDL), Juliana Kinderziekenhuis te Den Haag, NVK
- Dr. J.J.E. Hendriks, kinderlongarts, Zuyderland Medisch Centrum te Heerlen, NVK
- Prof. dr. B. (Bart) van Hoek, MDL-arts, UMC te Leiden, NVMDL
- Drs. R.A.S. (Rogier) Hoek, longarts, Erasmus MC te Rotterdam, NVALT
- Dr. A. (Ageeth) Hofsteenge, kinderdiëtist, Amsterdam UMC, locatie VUMC en AMC, te Amsterdam, NVD
- Drs. C. (Chantal) Hoge, MDL arts, Maastricht UMC+ te Maastricht, NVMDL
- F.M. (Francis) Hollander, diëtist, UMC Utrecht, Utrecht, NVD
- Prof. dr. R.H.J. (Roderick) Houwen, kinderarts MDL, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, NVK
- Dr. J. (Jakko) van Ingen, arts microbioloog, Radboud UMC te Nijmegen, NVMM
- Dr. H.M. (Hettie) Janssens, (kinder)longarts, Erasmus MC Sophia Kinderziekenhuis te Rotterdam, NVK
- Drs. A.J. (Arjan) Jansz, arts microbioloog, Stichting PAMM te Eindhoven, NVMM
- H.J. (Hetty) van der Kamp, kinderarts-endocrinoloog, HMC Bronovo te Den Haag en Wilhelmina Kinderziekenhuis UMC Utrecht te Utrecht, NVK
- C. (Cora) de Kiviet, verpleegkundig specialist, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, V&VN
- A. (Annelies) Kok, verpleegkundig consulent, Erasmus MC te Rotterdam, CF Netwerk verpleegkundigen Nederland
- Dr. B.G.P. (Bart) Koot, kinderarts (MDL), Amsterdam UMC, locatie AMC te Amsterdam, NVK
- M.A. (Marian) Kruijswijk, verpleegkundig specialist, UMC Utrecht te Utrecht, V&VN
- Dr. C.J. (Christof) Majoor, longarts, Amsterdam UMC, locatie AMC te Amsterdam, NVALT
- R. (Renske) van der Meer, longarts, Hagaziekenhuis te Den Haag, NVALT
- Dr. P.J.F.M. (Peter) Merkus, kinderlongarts, Radboud MC te Nijmegen, NVK
- Dr. D. (Dick) Mul, kinderarts (endocrinologie), Diabeter te Rotterdam, NVK
- Drs. A.F. (Ad) Nagelkerke, kinderlongarts, Amsterdam UMC, locatie VUmc te Amsterdam, NVK
- drs. J. (Jacquelien) Noordhoek, directeur patiëntenorganisatie NCFS te Baarn, NCFS
- Marit van Oirschot-van de Ven, verpleegkundig specialist, UMC Utrecht te Utrecht, V&VN
- Dr. M (Marianne) Nuijssink, kinderlongarts, Haga ziekenhuis te Den Haag, NVK
- Dr. M.H.E. (Monique) Reijers, longarts, Radboudumc te Nijmegen, NVALT
- Dr. S. (Sietze) Reitsma, KNO-arts, Amsterdam UMC, locatie AMC te Amsterdam, NVKNO
- Prof. dr. Y.B. (Yolanda) de Rijke, afdelingshoofd Klinische Chemie, Erasmus MC te Rotterdam, NVKC
- Dr. B.L. (Bart) Rottier, kinderlongarts, UMCG te Groningen, NVK
- R.A. (Revka) Schrijver, verpleegkundig consulent, Hagaziekenhuis te Den Haag, CF Netwerk verpleegkundigen Nederland
- Drs. L. (Luciënne) Speleman, KNO arts, Wilhelmina Kinderziekenhuis en UMC Utrecht, te Utrecht, NVKNO
- Dr. S.W.J. (Suzanne) Terheggen-Lagro, kinderlongarts, Amsterdam UMC, locatie AMC te Amsterdam, NVK
- Prof. dr. H.A.W.M (Harm) Tiddens, (kinder)longarts, Erasmus MC Sophia Kinderziekenhuis te Rotterdam, NVK
- H. (Hilda) Vale-Eeman, kinderverpleegkundige, Amsterdam UMC, locatie AMC te, Amsterdam, V&VN
- Dr. H. (Hester) van der Vaart, longarts UMCG te Groningen, NVALT
- Dr. H.W. (Harold) de Valk, internist-endocrinoloog UMCU te Utrecht, NIV
- Dr. M. (Marieke) Verkleij, GZ-psycholoog/cognitief gedragstherapeut, Amsterdam UMC, locatie VUMC te Amsterdam, VGCT
- Dr. E.J.M. (Els) Weersink, longarts, Amsterdam UMC, locatie AMC te Amsterdam, NVALT
- M. (Marion) Wessels, Verpleegkundige, UMC Utrecht te Utrecht, V&VN
- Dr. B.J. (Barbara) Wijnberg-Williams, klinisch psycholoog, UMCG te Groningen en Isala Ziekenhuis te Zwolle, NIP
- Dr. K.M. (Karin) de Winter- de Groot, kinderlongarts, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, NVK
- Dr. P.J.G. (Petra) Zwijnenburg, klinisch geneticus, Amsterdam UMC, locatie VUMC te Amsterdam, VKGN
Met ondersteuning van
- Dr. F. (Floor) Willeboordse, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Ir. T. (Teus) van Barneveld, directeur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. A. (Anne) Speijer, coördinator kwaliteit van zorg, VSOP
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Drs. G.D. (George) Nossent (voorzitter) |
Longarts UMCG |
Bestuurslid NVALT |
Geen |
Geen actie |
|
O. Akkerman |
Longarts, fulltime, UMCG |
Lid nascholingscommissie VvAwT; onbetaald Lid visitatieteam TBC screening LRCB; onbetaald |
Geen |
Geen actie |
|
S. Amstelveen-Bokkerink |
Diëtist Radboudumc Dekkerswald |
Geen |
Geen |
Geen actie |
|
B. Arets |
Kinderlongarts, UMC Utrecht |
Academisch kinder(long)arts, deels Associate Professor Medisch Onderwijs Universiteit.
|
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
M. Bakker |
Longarts, Erasmus MC Rotterdam |
Geen |
Deelname aan diverse studies Vertex (chloortransportmodulatoren) |
Geen trekker van module CFTR modulatoren (wel meelezer).
Toelichting op onderzoek gesponsord door Vertex: Betrokken bij inclusie van patiënten en dataverzameling. Niet betrokken bij data-analyse, wel principal investigator, geen auteur. |
|
T. van Barneveld |
Directeur Kennisinstituut Federatie Medisch Specialisten |
|
Geen |
Geen actie |
|
A. van den Berg |
Longarts Hagaziekenhuis Den Haag |
Geen |
Geen |
Geen actie |
|
M. Berkhout |
KNO-arts in opleiding in het Academisch Medisch Centrum Amsterdam. Opleider: Prof. dr. F.G. Dikkers |
Geen |
Geen |
Geen actie |
|
F. Bodewes |
Kinderarts-MDL UMC Groningen |
Geen |
Geen |
Geen actie |
|
J. Boekhoff |
medisch maatschappelijk werker Amsterdam UMC, locatie VUmc |
Geen |
Geen |
Geen actie |
|
A. Bongen |
Medisch maatschappelijk werker UMC Utrecht |
Geen |
Geen |
Geen actie |
|
H. Bouazzaoui |
Longarts Hagaziekenhuis Den Haag |
Geen |
Geen |
Geen actie |
|
D. Brocke |
Medisch maatschappelijk werk UMC Utrecht Divisie Hart en Longen |
Geen |
Geen |
Geen actie |
|
E. Brokaar |
Poliklinisch apotheker in de Haga Apotheek, HagaZiekenhuis |
Geen |
Gedeeltelijke vergoeding voor internationaal CF congres door Novartis (2012 en 2014) |
Geen actie |
|
I. Bronsveld |
Pulmonoloog UMC Utrecht |
Geen |
Geen |
Geen actie |
|
A. Clement - Boers, de |
Kinderarts, diabetes HAGA/Julianaziekenhuis Den Haag |
Voorzitter Stichting D-Support (ondersteuning voor gezinnen met diabetes) onbetaald |
Geen |
Geen actie |
|
W. Doeleman |
Fysiotherapeut UMC-Utrecht |
Geen |
Geen |
Geen actie |
|
H. Eeman |
Kinderverpleegkundig consulent CF Werkgever: Academisch Medisch Centrum Amsterdam |
Geen |
Geen |
Geen actie |
|
M. Eerden |
Longarts Erasmus MC |
Geen |
Geen |
Geen actie |
|
K. van der Ent |
Kinderarts, hoogleraar kinderlongziekten UMC Utrecht |
|
Onderzoeksubsidies afgelopen vijf jaar:
Instituut heeft betalingen ontvangen voor klinische studies en adviesraad bijeenkomsten van Gilead, Vertex, GSK, Nutrica, TEVA, ProQR, Galapagos en Proteastasis.
|
Gemelde belangen en nevenfuncties zijn besproken met initiatief nemende verenigingen NVALT en NVK.
Deelname in werkgroep als meelezer bij alle modules op basis van expertise over CF.
Geen trekker van modules over CFTR modulatoren waarvoor er financiële belangen zijn. |
|
B. Flapper |
Kinderarts, sociale pediatrie |
Geen |
Geen |
Geen actie |
|
L. van der Giessen |
0,8 Kinderfysiotherapeut Erasmus MC Sophia 0,1 Coordinator onderwijs Erasmus MC 0,1 docentbegeleiding Erasmus MC |
B. Gastdocent Hogeschool Rotterdam Post HBO kinderfysio B. Cursusleider NPI B. Gastdocent Maas en Meer (B=betaald) |
Geen |
Geen actie |
|
V. Gulmans |
Hoofd onderzoek en kwaliteit van zorg bij Nederlandse Cystic Fibrosis Stichting |
Geen |
Geen persoonlijke vergoedingen. De NCFS heeft corporate sponsorovereenkomsten met meerdere bedrijven (farmaceuten en hulpmiddelen). De overeenkomsten zijn aangemeld bij het transparantieregister. De totale sponsorinkomsten bedragen niet meer dan 10 % van de totale NCFS-begroting. De sponsors hebben geen invloed op de inhoud van NCFS-uitingen. |
Geen actie |
|
H. Heijerman |
Longarts, hoofd afdeling longziekten UMC Utrecht. |
|
|
Gemelde belangen en nevenfuncties zijn besproken met initiatief nemende verenigingen NVALT en NVK.
Deelname in werkgroep als meelezer bij alle modules op basis van expertise over CF.
Geen trekker van modules over CFTR modulatoren waarvoor advies is gegeven. |
|
D. Hendriks |
kinderarts-maagdarmleverziekten Juliana Kinderziekenhuis/Hagaziekenhuis Den Haag |
Geen |
Geen |
Geen actie |
|
H. Hendriks |
kinderarts-longarts in Zuyderland MC en 0,1 fte gedetachteerd naar MUMC + voor CF zorg. |
Geen |
Geen |
Geen actie |
|
B. Hoek |
gastroenteroloog en hepatoloog, LUMC Hoogleraar |
Geen |
Geen gesponsord onderzoek op het gebied van CF. Bij genoemde studies mogelijk auteur en: Novartis: PI, inclusie patiënten Zambon: PI, design studies, data analyse Chiesi: design studie, patiënt inclusie, data analyse Abbvie, Norgine, Astellas: patiënt inclusie CLIF: patiënt inclusie Perspectum: patiënt inclusie, design deel van studie Organ Assist: PI, patiënt inclusie Novartis - deelname aan internationale medicijnstudie bij auto-immuun hepatitis Zambon-unrestricted grant voor onderzoek naar auto-immuun hepatitis en overlap syndromen Chiesi - investigator-initiated studie naar farmacoklnetiek van Envarsus (tacrolimus) na levertransplantatie Abbvie - studie naar langetermijn effect op leverfibrose na DAA behandeling van hepatitis C Norgine - deelname aan rifaximin bij hepatische encefalopathie studie CLIF consortium - deelname aan internationale studies naar accuut - op chronisch leverfalen Perspectum - studies naar nieuew NRI technieken bij leverziekte en na levertransplantatie Astellas - deelname aan immuunsuppressie studie na levertransplantatie OrganAssist - deelname aan studie met machineperfusie voor levertransplantatie |
Geen actie |
|
R. Hoek |
Longarts Erasmus MC Centrum voor Longtransplantatie Centrum voor Cystic Fibrosis en Recidiverende Luchtweginfecties |
Nederlands Transplantatievereniging
allen onbezoldigd |
Geen |
Geen actie |
|
A. Hofsteenge |
Dietist: CF-team (kindergeneeskunde) (Vumc en AMC) Kindergeneeskunde (polikliniek) (VUmc) |
Geen |
Geen |
Geen actie |
|
C. van Hoge |
Maag- darm- leverarts MUMC+ |
Geen |
Geen |
Geen actie |
|
F. Hollander-Kraaijeveld |
Diëtist UMC Utrecht |
Geen |
Geen |
Geen actie |
|
R. Houwen |
Hoofd afdeling kinder-MDL UMCU/WKZ |
De (poli)klinische zorg voor patienten met MDL problematiek, het geven van onderwijs alsmede het vooruitbrengen van de zorg en kennis op dit gebied, onder meer door (meewerken aan) publicaties. Tevens aansturen van de subafdeling kinder-MDL. Deze taken worden verricht in een 100% dienstverband. |
|
Geen actie |
|
J. van Ingen |
Arts-microbioloog, Radboudumc, Nijmegen |
Geen |
Mede-auteur van de internationale richtlijn voor diagnostiek en behandeling van niet-tuberculeuze mycobacterieën bij pantiënten met CF (Floto, 2016). |
Geen actie |
|
H. Janssens |
Kinderlongarts, Erasmus MC/Sophia Kinderziekenhuis |
Voorzitter CF-team Sophia |
Co-promotor bij meerdere studies gefinancierd door unrestricted grant van Chiesi en Gilead. |
Geen actie, meelezer bij module over behandeling P.Aeruginosa (Gilead, Chiesi), geen trekker.
Toelichting gesponsorde onderzoeken. -Studies van Chiesi en Gilead waren met een unrestricted grant, financieen gerund door Sophia BV. De aard van de studies kon door het onderzoeksteam vrij ingevuld worden en gepubliceerd. -Deelname centrum aan sponsor initiated studies van Vertex, en Gilead. Geen mede-auteur. Als voorzitter van CF-team verantwoordelijk voor uitvoer van de studie, en beoordeling adverse events en lab uitslagen van deelnemende patiënten. |
|
A. Jansz |
arts-microbioloog, St PAMM, streeklaboratorium voor de volksgezondheid Veldhoven |
Coördinerend arts-microbioloog, RIVM/IDS, Bilthoven, een detachering van 20% auditor voor de RvA |
Geen |
Geen actie |
|
H. van der Kamp |
kinderarts-endocrinoloog (0,7 fte) werkzaam in het WKZ Utrecht en in het Bronovo ziekenhuis in Den Haag (0,15 fte). |
Lid bestuur NVE (onbetaald) Lid adviesgroep groeihormoon (onbetaald) Lid adviesgroep neonatale screening AGS & CHT (onbetaald) |
Geen |
Geen actie |
|
C. de Kiviet |
Verpleegkundig Specialist Bij CF-centrum UMC Utrecht, locatie WKZ |
Lid van Accreditatiecommissie Van de RSV (Register Verpleegkundig Specialismen) >Vacatievergoeding per bijeenkomst -Beoordelaar scholing voor herregistratie Verpleegkundig Specialisten > Vergoeding per beoordeelde scholing |
Geen |
Geen actie |
|
A. Kok |
verpleegkundig consulent CF Erasmus MC-Sophia Rotterdam |
Geen |
Geen |
Geen actie |
|
B. Koot |
kinderarts AMC Amsterdam |
Bestuur sectie kinder MDL, NVK, onbetaald |
Geen |
Geen actie |
|
M. Kruiswijk |
verpleegkundig specialist afdeling Cystic Fibrosis |
Geen |
Geen |
Geen actie |
|
C. Majoor |
Longarts, Amsterdam UMC, locatie AMC |
|
Inclusie patiënten aan fase IIa, IIb, III en IV studies van Vertex en Galapagos |
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
R. van der Meer |
Longarts, aandachtsgebied Cystic Fibrose. Werkzaam in Hagaziekenhuis. Den Haag. |
Geen |
Geen |
Geen actie |
|
P. Merkus |
Kinderarts-pulmonoloog, Radboudumc Amalia Kinderziekenhuis |
|
Deelname Studies bij CF door farmaceutische bedrijven: Vertex, PTC (PI, betrokken bij inclusie, betrokken bij data-analyse) |
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
D. Mul |
Kinderarts-endocrinoloog bij Diabeter |
|
Geen |
Geen actie, trekker module diabetes (screening en behandeling)
Toelichting op deelname adviesraad medisch Novo Nordisk: conflicteert niet met trekkersrol van diabetes modules. |
|
A. Nagelkerke |
Kinderlongarts VU medisch centrum |
Geen |
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is.
|
|
J. Noordhoek |
Directeur Nederlandse Cystic Fibrosis Stichting |
|
|
Geen actie |
|
M. Nuijsink |
Kinderarts Juliana Kinderziekenhuis/ HAGA ziekenhuis |
Geen |
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
M. van Oirschot-van de Ven |
Kinderverpleegkundig consulent CF, Academisch Medisch Centrum Amsterdam |
Geen |
Geen |
Geen actie |
|
M. Reijers |
Longarts, Radboud UMC, Nijmegen |
|
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is.
|
|
S. Reitsma |
KNO-arts AMC Amsterdam |
Geen |
Geen |
Geen actie |
|
Y de Rijke |
Afdelingshoofd Klinische Chemie Erasmus MC te Rotterdam |
Geen |
Geen |
Geen actie |
|
B. Rottier |
UMC Groningen, kinderlongarts |
Geen |
Geen |
Geen actie |
|
R. Schrijver |
Verpleegkundig consulent CF Hagaziekenhuis |
Geen |
Geen |
Geen actie |
|
A. Speijer |
Coördinator kwaliteit van zorg |
Lid advies - en expertcommissie AQUA van Zorginstituut Nederland.
|
Geen |
Geen actie |
|
L. Speleman |
paediatrische KNO, UMC Utrecht Wilhelminakinderziekenhuis |
|
Geen |
Geen actie |
|
S. Terheggen-Lagro |
Kinderlongarts AMC |
|
Geen |
Geen actie |
|
H. Tiddens |
Kinderlongarts, Erasmus MC, Sofia kinderziekenhuis
|
|
|
Geen actie, meelezer bij module over behandeling P.Aeruginosa geen trekker.
Toelichting gesponsorde onderzoeken. iABC: Co-investigator, CT aquisitie, analyse van CTs, geen betrokkenheid bij inclusie van patiënten ALPINE II: betrokken bij inclusie van patiënten |
|
H. van der Vaart |
Longarts UMCG |
Geen |
Geen |
Geen actie |
|
H. de Valk |
Internist-endocrinoloog, UMC Utrecht |
|
Geen |
Geen actie |
|
H. Verkade |
Kinderarts MDL, UMCG Groningen |
|
Geen |
Geen actie |
|
M. Verkleij |
GZ-psycholoog/cognitief gedragstherapeut, Amsterdam UMC locatie VUmc |
Geen |
Geen |
Geen actie |
|
E. Weersink |
longarts, AMC Amsterdam |
Geen |
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
M. Wessels-Bakker |
Verpleegkundig Specialist Longtransplantatie, onderzoeker |
Geen |
Geen |
Geen actie |
|
B. Wijnberg-Williams |
Klinisch psycholoog/medisch psycholoog, richting kinderen en jeugdigen, UMCG (0,4 fte) en Isala ziekenhuis (0,7fte) |
Lid van Accreditatiecommissie Federatie van Gezondheidszorgpsychologen en Psychotherapeuten (FGzPt) (vacatiegelden) |
Geen |
Geen actie |
|
F. Willeboordse |
Adviseur Kennisinstituut Federatie Medisch Specialisten |
Geen |
Via werk partner aandelen bij moederbedrijf Johnson & Johnson. Partner is werkzaam bij Janssen Vaccines BV. |
Geen actie |
|
K. Winter-de Groot |
kinderarts-pulmonoloog WKZ/UMC Utrecht |
|
Geen |
Geen actie |
|
P. Zwijnenburg |
kinderarts-klinisch geneticus VUMC afd. klinische genetica |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door deelname aan de werkgroep van de patiëntenorganisatie NCFS en de VSOP voor zeldzame en genetische aandoeningen. De uitgangsvragen zijn getoetst via een online peiling onder patiënten en ouders. Voor sommige onderwerpen is het patiënten-panel van de NCFS geraadpleegd om input te verkrijgen over patiëntenvoorkeuren over een behandeling of screeningsmethode.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de kwaliteitsstandaarden de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de kwaliteitsstandaard in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
Deze medisch inhoudelijke modules in deze kwaliteitsstandaard is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Voor de modules over psychosociale zorg en de modules over organisatie van zorg is er volgens de AQUA methode gewerkt: GRADE. De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie https://www.gradeworkinggroup.org/docs/Criteria_for_using_GRADE_2016-04-05.pdf).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de stuurgroep en de adviseur de knelpunten. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten. Tevens zijn er knelpunten aangedragen door VSOP, NCFS, NVK, NVALT, Patiëntenfederatie, Lareb, NVMDL, ZiN, ZN, NIP, NVKNO, VKGN, Vereniging innovatieve geneesmiddelen, NVKC, V&VN, NVMM, KNGF, NIV, NVvR, NVD, NVAB, NVZA via een invitational conference.
De concept uitgangsvragen zijn door de NCFS online voorgelegd aan mensen met CF en ouders van kinderen met CF. Vrijwel alle uitgangsvragen werden door tenminste 85% van de 68 respondenten als zinvol tot zeer zinvol ervaren. Bij twee vragen was dit percentage lager (56% respectievelijk 72%), veroorzaakt door het feit dat 25% van de respondenten bij deze vragen geen mening had.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de stuurgroep en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er is voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Voor deze kwaliteitsstandaard was de Europese Best Practice richtlijn van de ECFS (Castellani, 2018) een belangrijk uitgangspunt voor bijna alle modules.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de kwaliteitsstandaard is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Indicatorontwikkeling
De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn omdat er geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Castellani C, Duff AJA, Bell SC, Heijerman HGM, Munck A, Ratjen F, Sermet-Gaudelus I, Southern KW, Barben J, Flume PA, Hodková P, Kashirskaya N, Kirszenbaum MN, Madge S, Oxley H, Plant B, Schwarzenberg SJ, Smyth AR, Taccetti G, Wagner TOF, Wolfe SP, Drevinek P. ECFS best practice guidelines: the 2018.
revision. J Cyst Fibros. 2018 Mar;17(2):153-178. doi: 10.1016/j.jcf.2018.02.006. Epub 2018 Mar 3. Review.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
1987-dec. 2017
Engels |
1 Aspergillosis, Allergic Bronchopulmonary/ (1748) 2 Aspergillus fumigatus/ (7321) 3 ("Allergic bronchopulmonary aspergillosis" or "Aspergillus fumigatus" or ABPA).ti,ab,kf. (9887) 4 1 or 2 or 3 (12261) 5 Prednisone/ (40392) 6 exp Administration, Inhalation/ (29572) 7 exp Adrenal Cortex Hormones/ (398827) 8 exp antifungal agents/ or itraconazole/ or voriconazole/ (164598) 9 Omalizumab/ (1238) 10 ((systemic adj (corticosteroid* or "Adrenal Cortex Hormone*")) or prednis* or ((inhaled or inhalation or aerosolized or nebuli*) adj (corticosteroid* or "Adrenal Cortex Hormone*")) or "antifungal agent*" or intraconazol or voriconazol or posaconazol or omalizumab).ti,ab,kf. (79903) 11 6 and 7 (6780) 12 exp Azoles/ (634949) 13 azole*.ti,ab,kf. (6380) 14 5 or 8 or 9 or 10 or 11 or 12 or 13 (862889) 15 4 and 14 (3546) 16 limit 15 to (english language and yr="1987 -Current") (2974) 18 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (367140) 19 16 and 18 (53) 20 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1873901) 21 16 and 20 (158) 22 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (3147570) 23 16 and 22 (277) 24 19 or 21 or 23 (408) 31 remove duplicates from 24 (366) 32 19 or 21 (189) 33 23 not 32 (219) 34 remove duplicates from 32 (165) – 163 uniek 35 remove duplicates from 33 (201) |
568 |
|
Embase (Elsevier) |
((('allergic bronchopulmonary aspergillosis'/exp OR 'aspergillus fumigatus'/exp OR 'allergic bronchopulmonary aspergillosis':ti,ab OR 'aspergillus fumigatus':ti,ab OR abpa:ti,ab)
AND ('prednisone'/exp/mj OR ('corticosteroid'/exp/mj AND 'inhalational drug administration'/exp) OR 'antifungal agent'/exp/mj OR 'omalizumab'/exp/mj OR 'pyrrole derivative'/exp/mj OR ((systemic NEAR/1 (corticosteroid* OR 'adrenal cortex hormone*')):ti,ab) OR prednis*:ti,ab OR (((inhaled OR inhalation OR aerosolized OR nebuli*) NEAR/1 (corticosteroid* OR 'adrenal cortex hormone*')):ti,ab) OR 'antifungal agent*':ti,ab OR intraconazol:ti,ab OR voriconazol:ti,ab OR posaconazol:ti,ab OR omalizumab:ti,ab)
AND [english]/lim AND [embase]/lim AND [1987-2017]/py NOT 'conference abstract':it)
AND (('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp))) OR ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti))) (211) – 114 uniek
AND 'major clinical study'/exp (83) – 66 uniek |
|
