Behandeling met pancreasenzymen bij CF
Uitgangsvraag
Wat is de optimale behandeling met pancreasenzymen voor exocriene pancreasinsufficiënte patiënten met CF?
De uitgangsvraag omvat de volgende deelvragen:
- Hoeveel pancreasenzymen (pancreatic enzyme replacement therapy (PERT)) moeten pancreasinsufficiënte patiënten met CF gebruiken (met name maximumdosering)?
- Hoe controleert de arts of de gebruikte dosis pancreasenzymen PERT voldoende is?
- Wat is de optimale timing (voor/tijdens/na voeding) van de toediening van PERT?
- Wanneer is er een indicatie voor toevoeging van een protonpomp remmer bij PERT?
Voor deelvragen 1,3 en 4 is de evidence synthese overgenomen uit de Nutrition Guidelines for Cystic Fibrosis: in Australia and New Zealand, 2017 (Saxby, 2017).
Aanbeveling
Algemene PERT aanbevelingen
- Streef naar de laagst mogelijke dosering.
- Verdeel de enzyminname zo goed mogelijk over de maaltijden afhankelijk van de hoeveelheid vet in het geconsumeerde eten en drinken.
- Monitor gewichtsverloop, groei, buikklachten en ontlastingspatroon.
Dosering: Zie formularium
Onderzoek naar vetmalabsorptie (middels 72-uur vetbalans) is geïndiceerd indien klachten van de patiënt aanleiding geven te denken aan vetmalabsorptie en klinisch handelen door de uitslag zal worden aangepast.
Indien sprake lijkt van onvoldoende effect van PERT, dient allereerst de volgende punten te worden nagegaan:
- Is de patiënt therapietrouw met PERT?
- Is de PERT op de juiste wijze verdeeld over de maaltijd momenten?
- Is de dosis stapsgewijs verhoogd tot een maximum van 10.000 IU lipase/kg/dag?
Overweeg hierna aanpassing in timing (inname voor, tijdens of na de maaltijd) van toediening van PERT en evalueer het effect.
Overweeg het starten van protonpompremmers om de effectiviteit van PERT te verbeteren indien aanpassing in de timing van toediening van PERT onvoldoende effect heeft gehad. Evalueer het effect en staak de protonpompremmer indien dit geen duidelijk effect heeft.
Overwegingen
Kwaliteit van het bewijs en balans tussen voor- en nadelen
Er is geen bewijs dat een bepaalde dosis PERT zorgt voor optimale vetabsorptie. Door de vele en individueel verschillende factoren die werking van PERT beïnvloeden, zoals onder andere maaglediging, zuurgraad in de maag en mogelijk ook het gebruik van CFTR modulatoren, is het onwaarschijnlijk dat er één universele optimale dosering bestaat van PERT. Voor de startdosering van PERT wordt geadviseerd uit te gaan van de startdoseringen geadviseerd in de ESPEN-ESPGHAN-ECFS richtlijn uit 2012 die overeenkomt met de Noord Amerikaanse CF foundation richtlijn uit 2009. Individuele instelling en regelmatige evaluatie van de PERT dosering is noodzakelijk. Doseren van PERT op basis van gram vet in de voeding sluit het dichtst aan bij de fysiologische uitscheiding van pancreasenzymen. Er is echter geen bewijs dat deze doseringswijze in de praktijk superieur is aan een vaste dosering per maaltijd op basis van lichaamsgewicht, deze laatste methode kan eenvoudiger zijn voor sommige patiënten. Derhalve lijkt rationeel te kiezen voor doseren op basis van gram vet in de voeding, maar te kiezen voor een vaste dosering op basis van lichaamsgewicht of een combinatie van beide methoden indien dit voor de patiënt en verzorgers beter haalbaar is.
Er is geen bewijs dat monitoren met testen beter is dan monitoring op groei. De 72-uurs vetbalans is de klinisch meest toegepaste test en wordt beschouwd als meest betrouwbaar. Echter, deze is niet te beschouwen als echte gouden standaard gezien de beperkingen van een 72-uurs fecescollectie. Er is echter momenteel geen betere test beschreven dan de 72-uurs vetbalans voor het monitoren van vetabsorptie. De literatuur suggereert dat mogelijk losse monster feces op één of drie opeenvolgende dagen ook accuraat kan zijn. Studies met adequate power zijn nodig om dit vast te stellen. De 13C-MTG ademtest lijkt bij zuigelingen weinig betrouwbaar. Ook is het een beperking van de studie dat in de vergelijking de testen dichotoom beoordeeld zijn en niet als continue uitkomstmaat hetgeen in de dagelijkse praktijk van monitoren van effect van enzymen wel gebeurt. Verdere kosten (dagopname) en de tijdbelasting zijn ook barrières voor het gebruik van de 13C-MTG ademtest. Er zijn geen gegevens bekend over de accuratesse van deze test bij oudere kinderen.
Het gebruik van de zuur steatocriet als diagnose van ontlastings vetconcentratie en excretie lijkt ook geen alternatief voor de 72 uur verzameling van ontlasting in bij patiënten met CF met milde klachten.
De timing van enzymtoediening op andere momenten dan voor de maaltijd lijkt niet te leiden tot een gemiddeld mindere vetopname. Op individueel niveau kan het potentieel leiden tot betere vetopname. Derhalve is verandering in timing inclusief toediening op meerdere momenten tijdens de maaltijd te overwegen als ondanks compliant gebruik van hoge dosis PERT sprake lijkt te zijn van vetmalabsorptie.
Er is onvoldoende bewijs dat gebruik van protonpompremmers naast PERT leidt tot verbetering in de vetabsorptie. Op basis van de pathofysiologie van de spijsvertering bij CF is er reden om aan te nemen dat maagzuurremming de vetabsorptie positief kan beïnvloeden. Door geen of minder bicarbonaat uitscheiding bij EPI is de voedingsbolus in het duodenum (chymus) zuurder terwijl de werking van verteringsenzymen beter is bij neutrale pH dan een zure pH graad. Ondanks gebrek aan bewijs is derhalve gebruik van maagzuurremming te overwegen indien ondanks compliant gebruik van hoge dosis PERT en aanpassing in de timing van enzymen sprake lijkt te zijn van vetmalabsorptie. Op basis van de beperkte evidence is daarbij de voorkeur voor een proton pompremmer (PPI) boven een H2-antagonist. Evaluatie van het effect, liefst met gebruik van vetbalans, en staken van de protonpompremmers bij ontbreken van gunstig effect is noodzakelijk.
Wat vinden patiënten: patiëntenvoorkeur
Het belang aan het meer of minder gebruiken van PERT en de voorkeur voor doseren per hoeveelheid vet in de voeding of op basis van lichaamsgewicht wordt door patiënten wisselend aangegeven. De 72-uurs fecesverzameling wordt door patiënten en verzorgers in het algemeen als vervelend en belastend ervaren. Een stringente indicatiestelling voor de test en onderzoek naar alternatieve testmethoden zijn om deze reden van belang. Aanpassing in de timing van enzymen en gebruik van protonpompremmers worden in het algemeen als niet erg belastend ervaren.
Wat vinden artsen: professioneel perspectief
Gezien de belasting voor de patiënt en kosten van gebruik van PERT is het wenselijk bij iedere patiënt met CF te streven naar de laagst mogelijk effectieve dosering van PERT. De relatie tussen het gebruik van PERT in dosering boven de 10.000E/kg/dag en optreden van colonopathie is niet duidelijk en derhalve is deze overweging niet leidend voor aanhouden van deze bovengrens in de dosering. Echter bij onvoldoende effect van PERT bij een dosering van 10.000E/kg/dag is het, naast het nagaan van de therapietrouw en juiste wijze verdelen over de maaltijd, wenselijk allereerst alternatieve methoden voor het optimaliseren van de vetabsorptie te proberen zijnde timing van PERT toediening en toevoegen van protonpompremmer. Dit laatste liefst getoetst aan de hand van een vetbalans gezien ontbreken van duidelijke evidence over de effectiviteit van deze toevoeging op populatieniveau. Ook is het wenselijk jaarlijks de noodzaak voor het continueren van protonpompremmer te evalueren, mede aangezien nog niet duidelijk is wat de effecten zijn van chronisch PPI gebruik bij CF. Bij de keuze en dosering van de PPI moet daarnaast rekening gehouden worden met interactie door gelijktijdig gebruik van CFTR modulatoren.
Bij gebrek aan bewijs over beter uitkomst bij monitoring van vetopname middels laboratorium testen ten opzichte van klinisch uitkomstmaten, is er geen indicatie voor vetbalans als standaard jaarlijks onderzoek. Onder behandelaars is er consensus om een 72-uurs vetverzameling toe te passen indien op basis van klinische beoordeling (verminderde groei, ongewenst gewichtsverlies, toegenomen buikklachten en frequente ongewenste defecatie) mogelijk sprake is van niet optimale vetabsorptie, ondanks (verminderde groei, ongewenst gewichtsverlies, toegenomen buikklachten en frequente ongewenste defecatie) en wanneer het niet duidelijk is of er sprake is van niet optimale vetabsorptie, ondanks interventies voor optimaliseren van enzym toediening.
Kosten
Kosten van PERT, protonpompremmer en de genoemde testen in deze module zijn beperkt en spelen geen noemenswaardige rol in de overwegingen
Haalbaarheid
In het algemeen is aanpassing in de dosis van PERT voor patiënten goed haalbaar evenals het aanpassen van de timing van de enzymen of het toevoegen van een protonpompremmer.
Een vetbalans is ook haalbaar in de praktijk, alhoewel bij niet zindelijke kinderen verzamelen moeizaam en minder betrouwbaar kan zijn. Bij zuigelingen wordt ook wel gebruik gemaakt van een laagje plastic in de luier voor fecescollectie.
Samenvattend, de optimale dosis PERT dient individueel te worden vastgesteld en aanpassing in timing van toediening van PERT en toevoegen van PPI kunnen aanvullende strategieën zijn om de vetabsorptie te verbeteren. Evaluatie van effect van deze interventies is noodzakelijk. Er is geen evidence voor benefit van monitoring op basis van testen versus klinische beoordeling van met name groei en gewichtsverloop. Er is onvoldoende bewijs dat minder dan 72-uur fecesverzameling een betrouwbare beoordeling van vetabsorptie geeft. De 13C-MTG ademtest lijkt minder betrouwbaar, maar is alleen getest op zuigelingenleeftijd. Ook zuur steatocriet lijkt niet betrouwbaar in de CF groepen waarin dit is getest.
Onderbouwing
Achtergrond
Circa 80 tot 90% van de patiënten met CF is pancreasinsufficiënt. Dit betekent dat de spijsverteringsenzymen (pancreasenzymen) niet of onvoldoende worden geproduceerd en/of uitgescheiden door de pancreas. Normaal gesproken worden in de alvleesklier pancreasenzymen gevormd, die in de twaalfvingerige darm (duodenum) worden uitgescheiden, waar ze zich mengen met de voedselbrij. Op deze wijze worden macronutriënten (vetten, eiwitten en koolhydraten) tot kleine stukjes afgebroken om zo opgenomen te kunnen worden in het bloed. Deze sappen bestaan uit de enzymen lipase (vertering van vet), amylase (vertering van koolhydraten), protease (vertering van eiwit) en ook bicarbonaat (neutraliseren van maagzuur in duodenum).
Er bestaan kunstmatige pancreasenzymen die voor het nuttigen van voeding genomen moeten worden door patiënten met CF om zo de voedingsstoffen uit de voeding te kunnen opnemen. De dosering van de spijsverteringenzymen gaat meestal op grammen vet in de voeding in combinatie met een maximum aan capsules per kilogram lichaamsgewicht per dag. Indien patiënten het maximum aantal capsules gebruiken maar er nog steeds klachten bestaan van malabsorptie (diarree, opgezette buik, winderigheid, buikpijn, niet goed groeien/aankomen in gewicht) wordt er in de praktijk vaak een protonpompremmer toegevoegd om de pH in het duodenum te verhogen of kan timing van de enzymeninname worden aangepast naar tijdens of direct na de voeding. Deze interventies verbeteren mogelijk de werkzaamheid van de enzymen.
De kennis lacune bestaat uit het feit dat we niet goed weten hoe de individuele dosis enzymen te bepalen voor optimale vetabsorptie, hoe hoog kunnen we gaan (mogelijk ook bijwerkingen bij te hoge dosis PERT), welke test gebruikt kan worden om aan te geven dat de dosis enzymen adequaat is en of vastgesteld is of het toevoegen van een protonpompremmer of aanpassen van de timing van de toediening van enzymen daadwerkelijk kan leiden tot verbetering van vetabsorptie.
Conclusies / Summary of Findings
PICO 1 dosing from Nutrition Guidelines for Cystic Fibrosis: in Australia and New Zealand, 2017.
|
Very low GRADE |
There is insufficient evidence to recommend specific doses of PERT required to support optimal fat absorption in people with CF. A wide range of doses have been shown to be effective.
Sources: (Trapnell, 2009; Graff, 2010a; Graff 2010b; Littlewood, 2011; Konstan, 2010; Kashirskaya, 2015; Borowitz, 2006a; Borowitz, 2006b; van de Vijver, 2011; Konstan, 2004; Borowitz, 2012; Wooldridge, 2009; Wooldridge, 2014; Konstan, 2013; Brady, 2006; Baker, 2005; Haupt, 2011; Trapnell, 2011; Munck, 2009, Saxby, 2017) |
PICO 2 monitoring
|
Zeer laag GRADE |
Het is onduidelijk of het nemen van meervoudige ontlastingsmonsters (3 monsters op 3 opeenvolgende dagen) en het meten van het vetpercentage een geschikte alternatieve methode kan zijn voor een 72 uur verzameling van ontlasting met een CFA-berekening.
Bronnen: (Caras, 2011) |
|
Laag GRADE |
De 13C-MTG ademtest stelt geen nauwkeurige diagnose van pancreas insufficiëntie in CF-zuigelingen en er kan niet op worden vertrouwd om deze als alternatief te gebruiken voor de 72-uurs fecale vetbepalingen. Bewijs voor gebruik in andere leeftijdsgroepen ontbreekt.
Bronnen: (Kent, 2018) |
|
Laag GRADE |
Zuur steatocriet stelt geen nauwkeurige diagnose van ontlastings vetconcentratie en ontlastingsvet excretie bij patiënten met CF zonder steatorroe of met milde steatorroe en er kan niet op worden vertrouwd om deze als alternatief te gebruiken voor 72 uur verzameling van ontlasting in deze subgroep.
Bronnen: (Walkowiak, 2018) |
PICO 3 timing from Nutrition Guidelines for Cystic Fibrosis: in Australia and New Zealand, 2017
|
Very low GRADE |
Limited evidence suggests PERT is equally effective when taken before or after a meal in individuals with CF. It also suggests that for some individuals, changing PERT timing in relation to a meal may improve PERT efficacy.
Sources: (van der Haak, 2016) |
PICO 4 PPI from Nutrition Guidelines for Cystic Fibrosis: in Australia and New Zealand, 2017
|
Low GRADE |
There is insufficient evidence to support for or against the use of acid suppression medication to improve PERT efficacy by increasing fat absorption for people with CF.
Bronnen: (Ng, 2014) |
Samenvatting literatuur
Deelvraag 1, 3 en 4 zijn in het Engels beschreven omdat de literatuursamenvatting is overgenomen uit de Nutrition Guidelines for Cystic Fibrosis: in Australia and New Zealand, 2017.
Resultaten (deelvraag 1) as described in Nutrition Guidelines for Cystic Fibrosis: in Australia and New Zealand, 2017.
How should PERT be dosed for people with CF to optimise fat absorption?
Studies looking at optimal PERT dosing in CF differ in enzyme preparation used, dose provided, treatment duration and age of patients. A wide range of doses has been shown to be safe and effective.
Dosing of PERT
Internationally, guidelines give recommendations for both dosing PERT based on units of lipase/kg/meal and units of lipase/g of fat consumed (Turck, 2016; Borowitz, 2009; Stalling, 2008; Borowitz, 2002). Dosing per meal and snack has been used due to ease of adherence with this method compared to dosing per gram of fat intake. In clinical trials, both dosing per gram of fat (Trapnell, 2009; Graff, 2010a) and dosing per meal (Littlewood, 2011; Konstan, 2010; Kashirskaya, 2015; Borowitz, 2006a; Borowitz, 2006b; van de Vijver, 2011; Konstan, 2004; Borowitz, 2012; Wooldridge, 2009; Wooldridge, 2014; Konstan, 2013; Brady, 2006) have been shown to be effective in children and adults.
Guidelines suggest various ranges in which to dose PERT, with a maximum of 2500 IE lipase/kg/meal and 4000 IE lipase/g fat consistently suggested (Turck, 2016; Borowitz, 2009; Stalling, 2008; Borowitz, 2002). Two small prospective dose ranging studies of short duration report no improvements in coefficient of fat absorption (CFA) with doses > 500 IE lipase/kg/meal (Borowitz 2006b; van den Vijver, 2011). Larger retrospective observational studies report conflicting results of no association between PERT dose and growth outcomes (Baker, 2005), and higher BMI percentiles or weight-forage z score and weight-for-length percentiles in those with a higher mean PERT dose per kg per day (Haupt, 2011; Schechter, 2018).
Maximum daily dose
A maximum dose of 10 000 IE lipase/kg/day was recommended 516 following observations that doses above 6000 IE lipase/kg/meal (Freiman, 1996) and a mean of 50 000 IE lipase/kg/day were associated with fibrosing colonopathy (FitzSimmons, 1997). While this maximum is still generally accepted, the median dose in the control group of the US case-control study investigating fibrosing colonopathy was 13.393 IE lipase/kg/day (FitzSimmons, 1997), giving rise to the idea that this maximum may be too conservative.
This may be particularly pertinent to neonates and young infants who in the newborn phase may feed up to 12 times per day and therefore may exceed the recommended dose for a short time (Borowitz, 2013). It can also be challenging to remain below the maximum suggested dose in individuals with particularly high fat diets or who are on oral or enteral nutrition support.
While there is some suggestion that the maximum of 10 000 IE lipase/kg/day may be exceeded without harm in the short term, this should be done with caution and in consultation and regular review with an experienced gastroenterologist and dietitian. Longer term studies are required to determine whether exceeding the suggested upper limit of 10.000 IE lipase/kg/day for an extended time period is safe. Other factors contributing to poor weight gain and malabsorption related to PERT efficacy such as adherence and timing of PERT in relation to a meal should be considered before increasing PERT dose (see figure 10c). Until further evidence is available, it is recommended that health professionals follow the recommendations outlined below when dosing PERT for people with CF.
In conclusion, there is insufficient evidence to suggest specific doses of PERT to support optimal fat absorption in individuals with CF. Doses within current guidelines of < 4000 IE lipase/g of fat and < 2500 IE lipase/kg/meal have been shown to be safe and efficacious. There is insufficient evidence to suggest a maximum dose of PERT. Studies show, however, that doses ≤ 10 000 IE lipase/kg/day are safe as assessed by adverse events. In a small number of studies, this maximum dose has been exceeded in the short term with no reports of adverse events including fibrosing colonopathy. There is insufficient evidence to suggest whether dosing per gram of fat or per kg of body weight per meal is more efficacious. Both methods have been shown to be efficacious. There is insufficient evidence to suggest how PERT is best dosed to optimise efficacy in enteral feeding.
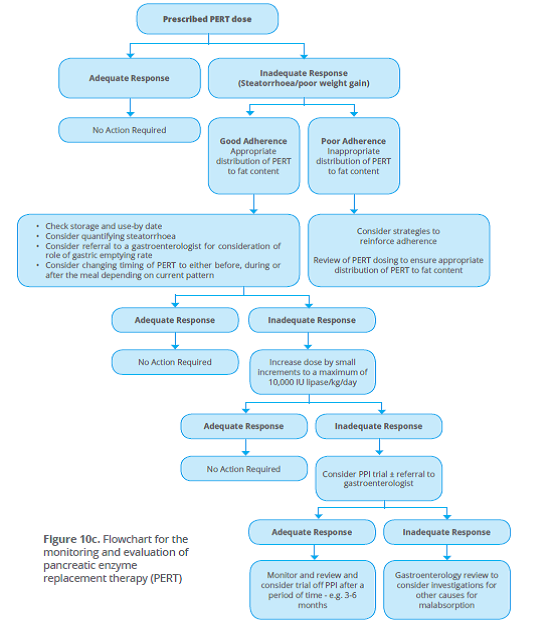
Beschrijving en resultaten studies (deelvraag 2)
Hoe controleert de arts of de gebruikte dosis pancreasenzymen (PERT) voldoende is?
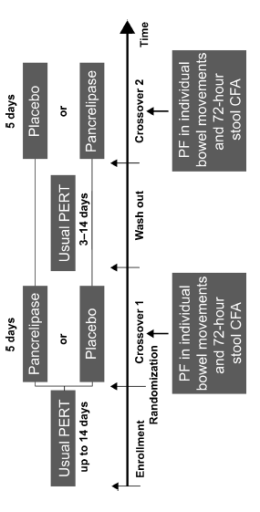
Caras (2011) heeft in een dubbelblinde, gerandomiseerde, placebo-gecontroleerde 2-periode crossover studie onderzocht wat de geschiktheid en klinische bruikbaarheid is van het verzamelen van ontlastingsmonsters voor vetbepaling als een alternatief voor het compleet verzamelen en meten van 72 uur CFA (coefficient of fat absorption) bij patiënten met EPI (exocrine pancreatic insufficiency) veroorzaakt door CF.
Het betrof 16 proefpersonen van 7 tot 11 jaar, geïncludeerd vanuit 10 verschillende centra tussen 13 juni 2008 en 1 december 2008. De mediane leeftijd was 8,0 (range 7 tot 11) jaar, waarvan 12 jongens (71%). De proefpersonen ontvingen PERT van 12.000-lipase-eenheden capsules met vertraagde afgifte.
De proefpersonen waren gerandomiseerd naar één van de twee behandelsequenties gedurende een periode van vijf dagen: PERT vervolgens placebo, of placebo en dan PERT met een uitspoelfase van drie tot 14 dagen tussen hun gebruikelijke PERT. De metingen van vetabsorptie werden verricht in periode met en zonder gebruik van PERT.
De verkregen ontlastingsmonsters werden geanalyseerd op vet als een percentage van droog gewicht (percentage vet (PF)) met behulp van vier verschillende bemonsteringsmethoden1) de eerste stoelgang op elke dag; 2) de laatste stoelgang op elke dag; 3) willekeurig gekozen stoelgangen, elk op een andere dag; 4) een enkele willekeurige steekproef die is geselecteerd ongeacht dag en werden vervolgens vergeleken met 72-uurs CFA-gegevens die ook werden verzameld.
De totale dagelijkse vetinname werd bepaald aan de hand van de voedingsinname van de proefpersoon, dat werd vastgelegd in een eetdagboek dat bijgehouden werd in de ontlasting verzamelperioden.
Individuele ontlastingsmonsters werden geanalyseerd op vetgehalte. De methoden die werd gebruikt voor de evaluatie van de associatie tussen CFA en PF zag er als volgt uit: De PF-waarden (percentage vet) werden vergeleken met CFA-waarden als continue variabelen met behulp van correlatiecoëfficiënten en checks op lineariteit en als dichotome variabelen met een CFA-cutoff-waarde van 80% omdat een CFA-waarde < 80% over het algemeen wordt beschouwd als een indicatie voor het niet goed absorberen van vet uit de darmen (vet in de ontlasting).
Diagnostische accuratesse vetpercentage methode door middel van meervoudige ontlastingsmonsters ten opzichte van 72-uurs ontlasting verzameling (Caras, 2011)
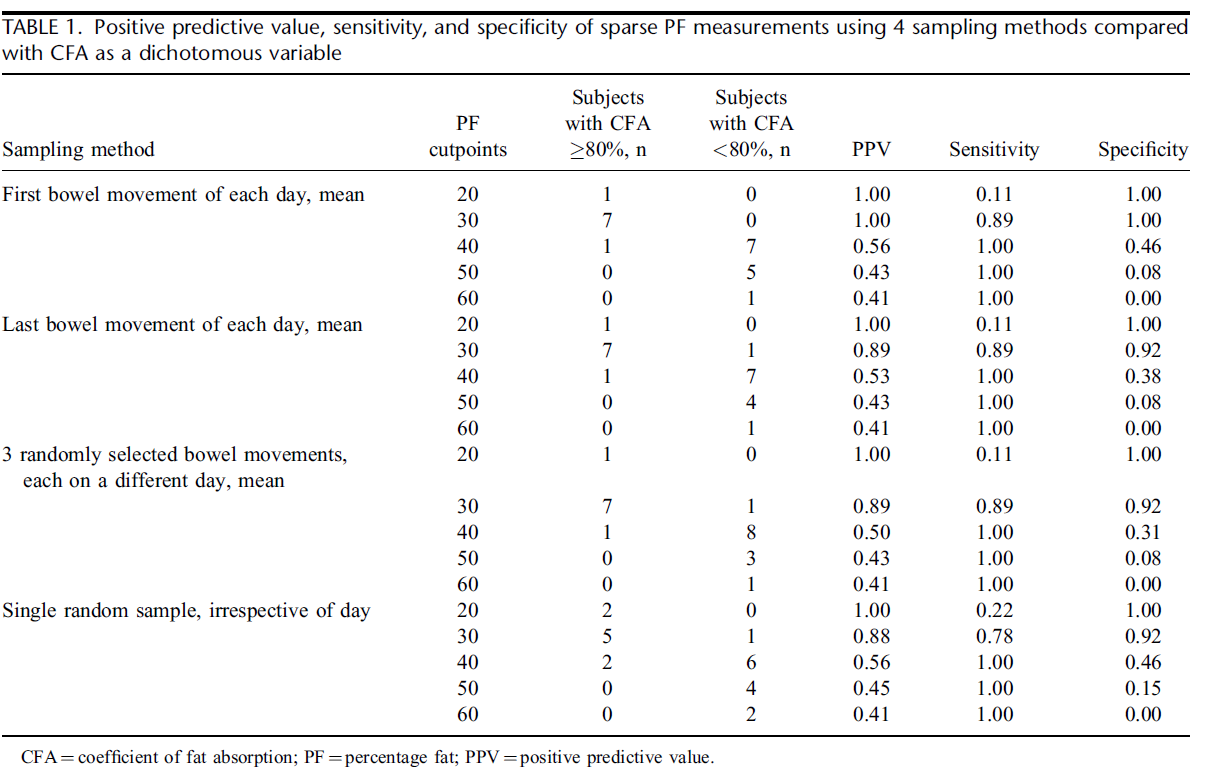
De PPV’s (positive predictive value), sensitiviteit en specificiteit voor de vergelijking van de PF-waarden (percentage vet) verkregen met behulp van elk van de vier verschillende ontlastingsmonsters methoden in vergelijking met de CFA-waarden als een dichotome variabele worden getoond in tabel in de evidencetabel.
Voor de drie meervoudige steekproefmethoden waren PF-waarden ≤ 30% voorspellend voor CFA-waarden van ≥ 80%, zoals aangetoond door de PPV, sensitiviteits- en specificiteitswaarden van ≥0,89. ROC-curven van gevoeligheid versus 1-specificiteit vertoonde hoge nauwkeurigheid (AUCs ≥ 0,93) voor de meervoudige steekproefmethoden. De PPV en sensitiviteitswaarden van 0,88 en 0,78, waren lager bij de ≤ 30% PF-drempel voor de methode met één steekproef vergeleken met de veelvoudige steekproef methoden; een AUC van 0,91 in de ROC-grafiek gaf iets aan lagere nauwkeurigheid.
De continue data zijn ook geanalyseerd, hierbij werden statistisch significante maar niet excellente associaties gevonden met de Pearson correlatiecoëfficiënt van 0,91 voor de eerste stoelgang op elke dag; 0,86 de laatste stoelgang op elke dag en 0,84 voor drie willekeurig gekozen stoelgangen, elk op een andere dag tussen PF en CFA bij de drie meervoudige steekproefmethoden. De correlaties waren lager (0,70) voor de enkelvoudige steekproefmethode. Dit is zichtbaar gemaakt in scatterplots (figure 4) met betrouwheidselipsen (Caras, 2011). Een langgerektere betrouwbaarheid elips geeft hierbij een beter correlatie aan.
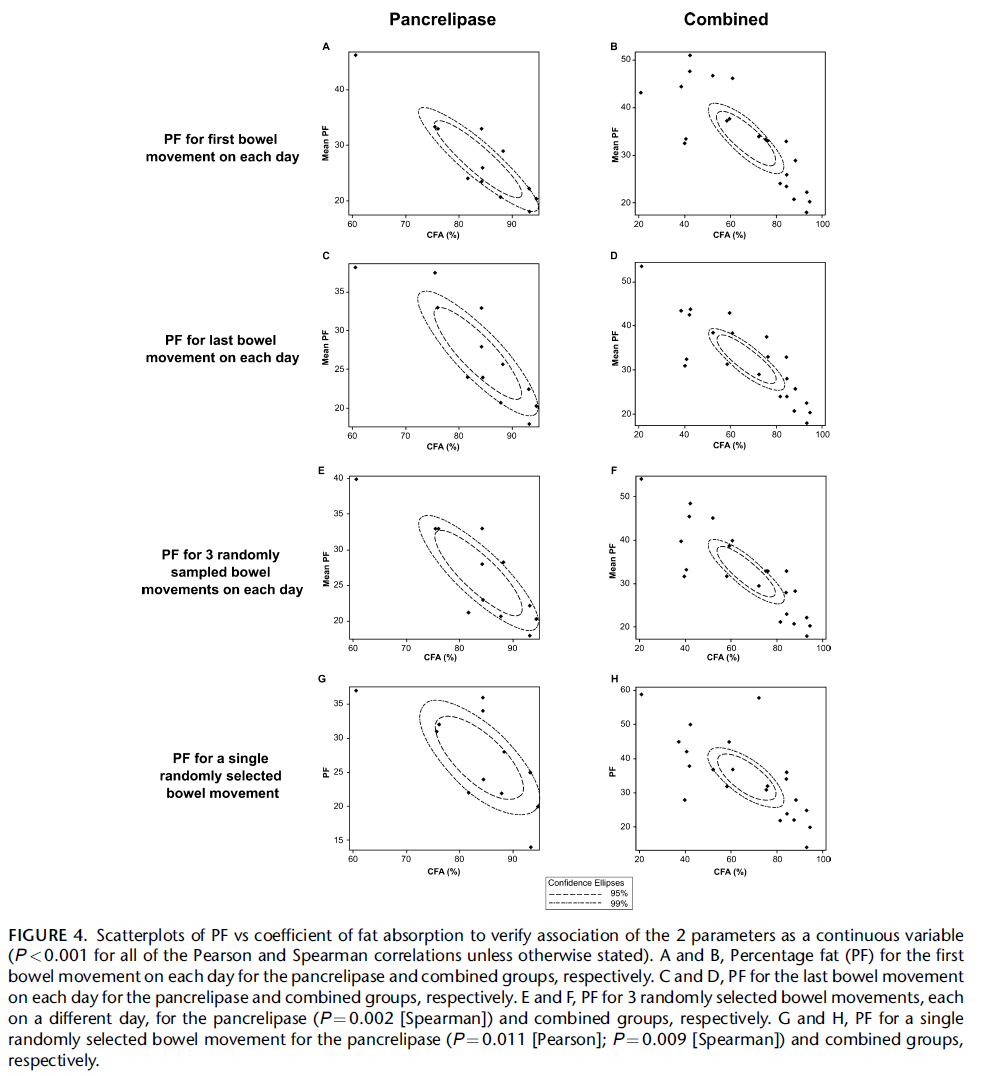
Bron: Caras, 2011
Samenvattend, suggereren de studieresultaten dat drie losse ontlastingsmonsters op drie opeenvolgende dagen en enkelvoudige ontlastingsmonsters mogelijk een alternatief kunnen zijn voor de 72-uurs vetbalans. Gezien het kleine aantal deelnemers is deze studie echter onvoldoende gepowered om hier een betrouwbare uitspraak over te doen. Daarnaast omvat de studie van Caras (2011) geen (externe) validatie van de gevonden resultaten.
De studie van Kent (2018) was gericht op het evalueren van de pancreasfunctie status door gebruik te maken van zowel de 13C Mixed Triglyceride Breath Test (13C-MTG ademtest) met niet-dispersieve infraroodspectroscopie (NDIRS) en de FE1-metingen bij 24 baby’s (variërend in leeftijd van 1 tot 13 maanden (20, < 6 maanden oud)) die borst- (n=12) en flesvoeding (n=12) kregen (10 meisjes en 14 jongens), gediagnosticeerd met CF door neonatale screening. De kwantitatieve 72-uurs fecale vet-excretie-test diende als een gouden standaard voor de vergelijking.
Alle baby’s met CF kregen een 72-uurs ontlasting vetbalansonderzoek, 13C-MTG ademtest en een FE1-metingen (zowel een monoclonal en polyclonale test). Orale inname van het pancreasenzym (PERT; indien al begonnen) werd minstens acht uur vóór het begin van de 13C-MTG-ademhaling test en één dag voor de fecale vet- en FE1-beoordeling gestopt.
FE-1 test is weggelaten uit de resultaten omdat dit niet relevant is voor monitoring.
72-uurs ontlasting vetbalansonderzoek (Kent, 2018)
Ontlastingsmonsters werden verzameld voor alle baby’s met CF gedurende een periode van 72 uur. Tevens werd, voor zuigelingen op flesvoeding, geregistreerd hoeveel en welke voeding de baby had ingenomen. De alvleesklier werd als toereikend gedefinieerd bij fles gevoede zuigelingen jonger dan 6 maanden als 72-uurs fecaal vet uitscheiding < 10% van de vetinname was en bij borst gevoede baby’s jonger dan zes maanden op basis van fecale vetafscheiding < 2 g/dag. Bij baby’s ouder dan zes maanden was dat een 72-uurs fecaal vet uitscheiding ≤ 7% van de orale vetinname.
13C Mixed Triglyceride Breath Test (Kent, 2018)
De database van het IRIS-systeem biedt in zijn software de resulterende gegevens van een groep gezonde individuen de optie om de status van de pancreasfunctie te beoordelen. De bepaling van de status van de alvleesklierfunctie is gebaseerd op de cumulatieve dosis van het % 13C herstelde (cPDR) waarde na vijf uur, met een minimumreferentie van % 13C cPDR-waarde van 13 (gekozen als afkappunt voor PS).
Vergelijking 13C Mixed Triglyceride Breath Test versus 72-uurs ontlasting vetbalansonderzoek (Kent, 2018)
Het gemiddelde gewicht voor de 72-uurs ontlastingsverzameling was 73.8 ±45.6 g. Het gemiddelde vetpercentage was 3.1±2.9 g per dag (range < 0,1 tot 9,4 g/dag).
Van de 24 baby’s met CF, waren er 13 pancreassufficiënt (PS) (ontlasting vetpercentage range < 0,1 tot 1,9 g/dag) en 11 pancreasinsufficiënt (PI) (ontlasting vetpercentage range 2,9 tot 9,4 g/dag).
Voor de MTG was het gemiddelde basale verschil in resultaten bij de 24 baby’s met CF -26.7±3.8%.
De sensitiviteit (optie 1) is 82% voor PI en 38% voor PS. De specificiteitspercentages zijn 38% voor PI en 82% voor PS. De sensitiviteit (optie 2) zijn 100% voor PI en 31% voor PS. De specificiteitsniveaus zijn 31% voor PI en 100% voor PS. Continue data voor vetpercentage van de 72 uurs verbalans versus de ademtestwaarden zijn niet weergegeven in dit artikel.
Samenvattend, de studieresultaten van de 13C-MTG adem test met behulp van NDIRS laten zien dat het geen geschikt alternatief is voor de bepaling van pancreasfenotype in CF-zuigelingen vergeleken met het 72-uurs ontlasting vetbalansonderzoek. Specifiek presteerden beide testen slecht in het herkennen van het PS-fenotype; door de 13C-MTG ademtest werden slechts 7 (optie 1) en 4 (optie 2) van de 13 PS-kinderen op vetbalanstests correct geïdentificeerd met een lage sensitiviteit van 31% tot 38%.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat diagnostische accuratesse van de vetbalans methode door middel van meervoudige ontlastingsmonsters ten opzichte van 72-uurs ontlasting verzameling (Caras, 2011) is met drie niveaus verlaagd gezien het gebrek aan een gouden standaard (één niveau) imprecisie vanwege het zeer gering aantal proefpersonen (12 kinderen) (één niveau), daarnaast betreft het hier alleen kinderen van 7 tot 11 jaar, het is onduidelijk of deze uitkomsten ook gelden voor baby’s en adolescenten met CF, hierdoor is de bewijskracht met één niveau verder verlaagd (indirectheid) naar in totaal een GRADE van zeer laag. Ook speelt publicatiebias wellicht een rol gezien de studie gesponseerd is door Abbott en de auteurs daar werkten ten tijde van de studie en het schrijven van het artikel.
Bewijskracht
De bewijskracht voor de uitkomstmaat diagnostische accuratesse van de 13C Mixed Triglyceride Breath Test in vergelijking met het 72-uurs ontlasting vetbalansonderzoek is met twee niveaus verlaagd naar een GRADE van laag door het gebrek aan een gouden standaard en imprecisie vanwege het gering aantal proefpersonen (24 baby’s).
Accuratesse van zuur steatocriet versus ontlasting vetbalansonderzoek
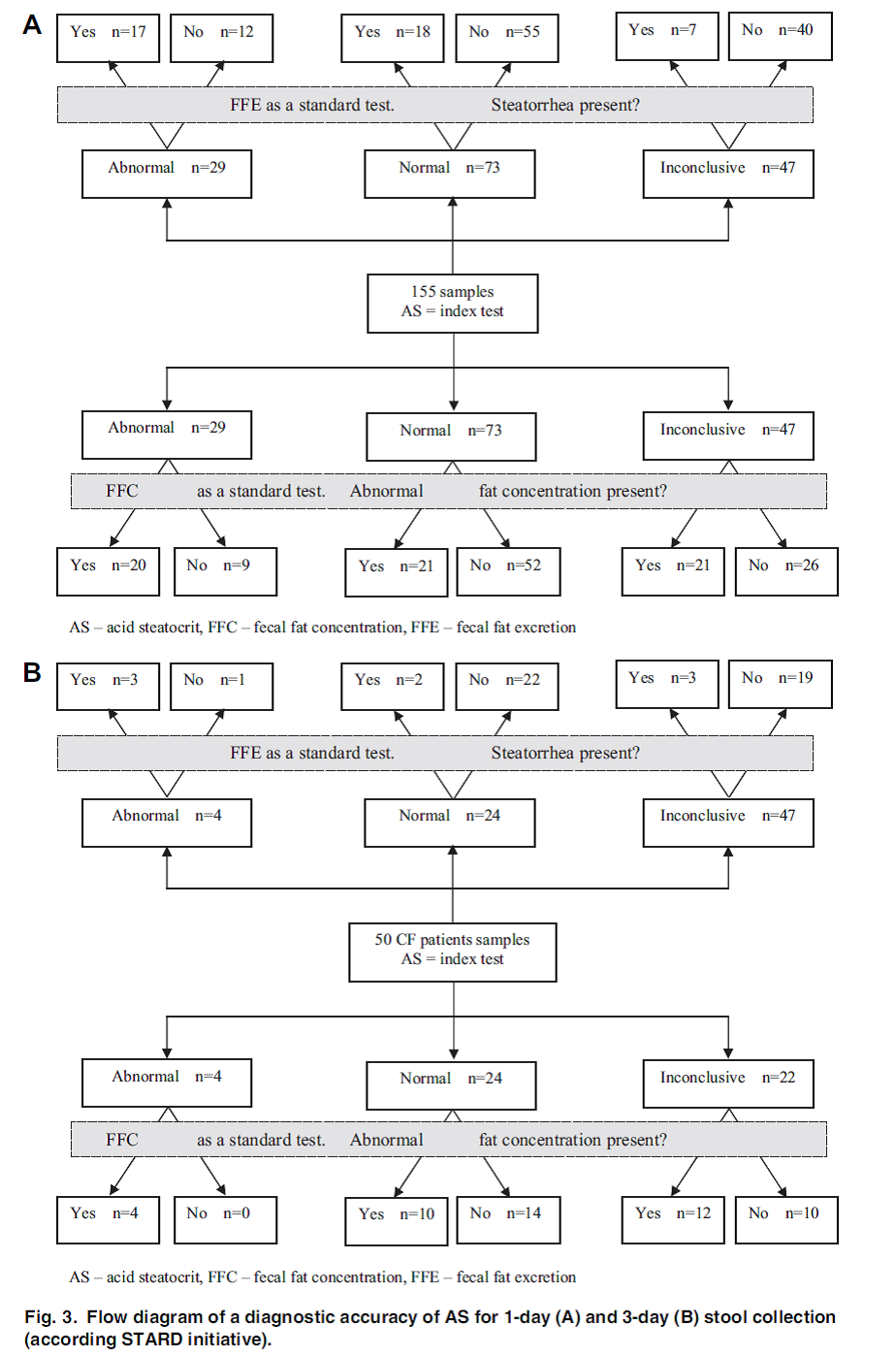
Walkowiak (2010) onderzocht 55 patiënten met CF, in de leeftijd van 7 tot 18 jaar zonder steatorroe of met milde steatoroe (< 10g/dag). Alle patiënten waren pancreasinsufficiënt en ontvingen 2.000 tot 10.000 units lipase/kg lichaamsgewicht per dag. In al deze patiënten werd zuur (acid) steatocriet (AS), ontlasting vet concentratie (FFC) en ontlastingsvet excretie (FFE) gemeten in een 24-uurs ontlasting verzameling (1 tot 3 keer), dit waren in totaal 149 samples. In 50 patiënten was de ontlasting op drie opeenvolgende dagen verzameld en was de AS, FFC en FFC berekend. De gemiddelde waardes werden gebruikt voor de analyse.
AS < 10% werd beschouwd als normaal en > 20% was abnormaal, dit werd gebruikt als afkapwaardes om de sensitiviteit, specificiteit, positief voorspellende waarde (PVW) en negatief voorspellende waarde (NVW) te berekenen. Over het algemeen waren de accuratesse uitkomsten matig (zie tabel 1 en 2).
Tabel 1 Accuratesse van zuur steatocriet voor bepaling van een abnormale ontlastings vet concentratie gebaseerd op 24-uurs en 72-uurs ontlasting verzameling
|
|
Afkapwaarde voor AS |
|||
|
|
24-uurs ontlasting verzameling |
72-uurs ontlasting verzameling |
||
|
|
10% |
20% |
10% |
20% |
|
Sensitiviteit % |
66 |
32 |
62 |
15 |
|
Specificiteit % |
60 |
90 |
58 |
100 |
|
PVW |
54 |
69 |
62 |
100 |
|
NVW |
71 |
65 |
58 |
52 |
AS=Acid steatocriet; PVW=positief voorspellende waarde; NVW=negatief voorspellende waarde
Tabel 2 Accuratesse van zuur steatocriet voor bepaling van de abnormale ontlastings vet excretie gebaseerd op 24-uurs en 72-uurs ontlasting verzameling
|
|
Afkapwaarde voor AS |
|||
|
|
24-uurs ontlasting verzameling |
72-uurs ontlasting verzameling |
||
|
|
10% |
20% |
10% |
20% |
|
Sensitiviteit % |
57 |
41 |
75 |
38 |
|
Specificiteit % |
51 |
89 |
52 |
98 |
|
PVW |
32 |
59 |
23 |
75 |
|
NVW |
74 |
79 |
92 |
89 |
AS=Acid steatocriet; PVW=positief voorspellende waarde; NVW=negatief voorspellende waarde
De correlaties tussen FFE/FFC en AS gebaseerd op de 24-uurs ontlasting verzameling waren zwak, respectievelijk r=0,208, p<0,011 en r=0,362, p<0,00006. De correlaties tussen FFE/FFC en AS gebaseerd op de 24-uurs ontlastingsverzameling waren zwak, respectievelijk r=0,208, p<0,011 en r=0,362, p<0,00006. Dezelfde correlatie voor de 72-uurs ontlasting verzameling was iets sterker, nog steeds relatief zwak, respectievelijk r=0,394, p<0,005 en r=0,454, p<0,001.
Bewijskracht
De bewijskracht voor de uitkomstmaat accuratesse uitkomsten van zuur steatocriet is met twee niveaus verlaagd naar een GRADE van laag door het gebrek aan een gouden standaard en imprecisie vanwege het gering aantal proefpersonen (55 adolescenten).
Resultaten (deelvraag 3) as described in Nutrition Guidelines for Cystic Fibrosis: in Australia and New Zealand, 2017.
Does the timing of PERT administration in relation to a meal impact PERT efficacy in people with CF?
One study found that PERT was equally effective in promoting normal lipase activity when taken before or after a meal. This study also showed that for some individuals, changing the timing of PERT from before to after a meal, or vice versa, improved or normalised lipase activity (van der Haak, 2016). A trial of changing PERT timing in relation to a meal can be considered in those with symptoms of fat malabsorption or poor growth once other treatment strategies such as adherence have been considered.
Resultaten (deelvraag 4) as described in Nutrition Guidelines for Cystic Fibrosis: in Australia and New Zealand, 2017.
Is there evidence to support the use of acid suppression medications to improve
PERT efficacy for people with CF?
A Cochrane review investigating drug therapies for reducing gastric acidity concluded that trials have shown limited evidence that agents that reduce gastric acidity improve fat absorption (Ng, 2014).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
Deelvraag 2a. Wat zijn de klinische effecten van instelling van dosis pancreasenzymen (PERT) op basis van symptomen/klinische uitkomsten vergeleken met dosis instelling van PERT op basis van laboratorium methoden in patiënten met CF?
Deelvraag 2b. Wat is de diagnostische accuratesse van de verschillende laboratorium testen om de vetabsorptie te meten ten behoeve van de monitoring van de dosis instelling van PERT.
Voor een aantal deelvragen zijn de zoekactie en evidencetabellen overgenomen van een bestaande richtlijn waarin deze vragen ook onderzocht zijn. Nutrition Guidelines for Cystic Fibrosis: in Australia and New Zealand, (Saxby, 2017). De search is daarbij geüpdatet in april 2018.
Deelvraag 1. Hoe dient PERT te worden gedoseerd voor patiënten met CF om de vetabsorptie te optimaliseren?
Deelvraag 3. Wat is het effect van timing van PERT toediening in relatie tot de maaltijd op de werking van PERT bij patiënten met CF?
Deelvraag 4. Is er bewijs dat het gebruik van zuurremmende medicatie zorgt voor betere werking van PERT bij patiënten met CF?
Relevante uitkomstmaten
De werkgroep achtte verschil in malabsorptie, groei (BMI), kwaliteit van leven en levensverwachting (zoekvraag 2a) en diagnostische accuratesse (zoekvraag 2b) voor de besluitvorming kritieke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 9 april 2018 met relevante zoektermen gezocht naar systematische reviews, RCT’s en observationeel onderzoek. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 144 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- Studiepopulatie komt overeen met patiëntengroep uit zoekvraag 2a en zoekvraag 2b.
- De test komt overeen met die genoemd in zoekvraag 2a en zoekvraag 2b.
- Betreft primair (origineel) vergelijkend onderzoek of systematische review.
Op basis van titel en abstract werden in eerste instantie 30 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 28 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en twee studies definitief geselecteerd. Deze twee studies beantwoorden echter alleen de vraag over de diagnostische accuratesse van de verschillende laboratorium testen om de vetabsorptie te meten ten behoeve van de monitoring van de dosis instelling van PERT (zoekvraag 2b).
In aan aanvullende search over zuur steatocriet met 133 treffers werden in eerste instantie drie studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens twee studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en één studie definitief geselecteerd voor zoekvraag 2b.
Zoekvraag 2a. Er zijn geen studies geselecteerd om de vraag over de klinische effecten van instelling van dosis pancreasenzymen (PERT) op basis van symptomen/klinische uitkomsten vergeleken met dosis instelling van PERT op basis van laboratorium methoden in patiënten met CF te beantwoorden.
Zoekvraag 2b. Drie accuratesse studies (Caras, 2011; Kent, 2018; Walkowiak, 2010) zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Voor de deelvragen 1, 3 en 4 is de search overgenomen uit de Nutrition Guidelines for Cystic Fibrosis: in Australia and New Zealand, 2017:
In de databases Embase, CINAHL, PubMed, AustHealth en Cochrane is gezochtvan januari 2002 tot juni 2016 tot 24 februari 2016 breed gezocht met relevante zoektermen naar studies over pancreasenzym therapie en pancreasinsufficiëntie bij patiënten met CF. De zoekverantwoording is weergegeven onder het tabblad Verantwoording.
Inclusie criteria waren studies specifiek met patiënten met CF en systematische reviews. Exclusie criteria waren studies die niet specifiek ingingen op de onderzoeksvraag, case reports, richtlijnen en consensus documenten en beschrijvende reviews.
De search is daarbij geüpdatet in april 2018.
Deelvraag 1: Er zijn 19 studies (Trapnell, 2009; Graff, 2010a; Graff, 2010b; Littlewood, 2011; Konstan, 2010; Kashirskaya, 2015; Borowitz, 2006a; Borowitz, 2006b; van de Vijver, 2011; Konstan, 2004; Borowitz, 2012; Wooldridge, 2009; Wooldridge, 2014; Konstan, 2013; Brady, 2006; Baker, 2005; Haupt, 2011; Trapnell, 2011; Munck, 2009) geselecteerd over dosering van PERT opgenomen in de literatuuranalyse van de Nutrition Guidelines for Cystic Fibrosis: in Australia and New Zealand, 2017. De update heeft hier één studie aan toegevoegd (Schechter, 2018).
Deelvraag 3: Er is één studie (van der Haak, 2016) geselecteerd over timing van PERT opgenomen in de literatuuranalyse van de Nutrition Guidelines for Cystic Fibrosis: in Australia and New Zealand, 2017. Uit de update zijn er geen nieuwe studies geselecteerd.
Deelvraag 4: Er zijn drie studies (Ng, 2014; Proesmans, 2003; Francisco, 2002) geselecteerd over de meerwaarde van het toevoegen van protonpompinhibitors aan PERT opgenomen in de literatuuranalyse van de Nutrition Guidelines for Cystic Fibrosis: in Australia and New Zealand, 2017.
De belangrijkste studiekarakteristieken en resultaten zijn overgenomen in evidencetabellen van de Nutrition Guidelines for Cystic Fibrosis: in Australia and New Zealand, 2017. Uit de update zijn er geen nieuwe studies geselecteerd.
Referenties
- Baker, SS, Borowitz, D, Duffy, L, Fitzpatrick, L, Gyamfi, J & Baker, RD. Pancreatic enzyme therapy and clinical outcomes in patients with cystic fibrosis. J Pediatr 146, 189-193 (2005).
- Brady, MS, Garson, JL, Krug, SK, Kaul, A, Rickard, KA, Caffrey, HH, et al. An enteric-coated high-buffered pancrelipase reduces steatorrhea in patients with cystic fibrosis: a prospective, randomized study. J Am Diet Assoc 106, 1181-1186 (2006).
- Borowitz, D, Baker, RD & Stallings, V. Consensus report on nutrition for pediatric patients with cystic fibrosis. J Pediatr Gastroenterol Nutr 35, 246-259 (2002).
- Borowitz, D, Goss, CH, Stevens, C, Hayes, D, Newman, L, O’Rourke, A, et al. Safety and preliminary clinical activity of a novel pancreatic enzyme preparation in pancreatic insufficient cystic fibrosis patients. Pancreas 32, 258-263 (2006a).
- Borowitz, D, Goss, CH, Limauro, S, Konstan, MW, Blake, K, Casey, S, et al. Study of a novel pancreatic enzyme replacement therapy in pancreatic enzyme replacement therapy in pancreatic insufficient subjects with cystic fibrosis. J Pediatr 149, 658-662 (2006b).
- Borowitz, D, Robinson, KA, Rosenfeld, M, Davis, SD, Sabadosa, KA, Spear, SL, et al. Cystic Fibrosis Foundation evidence-based guidelines for management of infants with cystic fibrosis. J Pediatr 155, S73-93 (2009).
- Borowitz, D, Stevens, C, Brettman, LR, Campion, M, Wilschanski, M, Thompson, H, et al. Liprotamase long-term safety and support of nutritional status in pancreatic-insufficient cystic fibrosis. J Pediatr Gastroenterol Nutr 54, 248-257 (2012).
- Borowitz, D, Gelfond, D, Maguiness, K, Heubi, JE & Ramsey, B. Maximal daily dose of pancreatic enzyme replacement therapy in infants with cystic fibrosis: a reconsideration. J Cyst Fibros 12, 784-785 (2013).
- Caras S, Boyd D, Zipfel L, Sander-Struckmeier S. Evaluation of stool collections to measure efficacy of PERT in subjects with exocrine pancreatic insufficiency. J Pediatr Gastroenterol Nutr. 2011 Dec;53(6):634-40. doi: 10.1097/MPG.0b013e3182281c38.
- Francisco, MP, Wagner, MH, Sherman, JM, Theriaque, D, Bowser, E & Novak, DA. Ranitidine and omeprazole as adjuvant therapy to pancrelipase to improve fat absorption in patients with cystic fibrosis. Journal of Pediatric Gastroenterology and Nutrition 35, 79-83 (2002).
- FitzSimmons, SC, Burkhart, GA, Borowitz, D, Grand, RJ, Hammerstrom, T, Durie, PR, et al. High-dose pancreatic-enzyme supplements and fibrosing colonopathy in children with cystic fibrosis. N Engl J Med 336, 1283-1289 (1997).
- Freiman, JP & FitzSimmons, SC. Colonic strictures in patients with cystic fibrosis: results of a survey of 114 cystic fibrosis care centers in the United States. J Pediatr Gastroenterol Nutr 22, 153-156 (1996).
- Graff, GR, Maguiness, K, McNamara, J, Morton, R, Boyd, D, Beckmann, K, et al. Efficacy and tolerability of a new formulation of pancrelipase delayed-release capsules in children aged 7 to 11 years with exocrine pancreatic insufficiency and cystic fibrosis: a ulticentre, randomized, double-blind, placebo-controlled, two-period crossover, superiority study. Clinical Therapeutics 32, 89-103 (2010a).
- Graff, GR, Maguiness, K, McNamara, J, Morton, R, Boyd, D, Beckmann, K, et al. Efficacy and tolerability of a new formulation of pancrelipase delayed-release capsules in children aged 7 to 11 years with exocrine pancreatic insufficiency and cystic fibrosis: a multicenter, randomized, double-blind, placebo-controlled, two-period crossover, superiority study. Clinical Therapeutics 32, 89-103 (2010b)
- Haupt, M, Wang, D, Kim, S, Schechter, MS & McColley, SA. Analysis of pancreatic enzyme replacement therapy dosing on nutritional outcomes in children with cystic fibrosis. Pediatric Pulmonology 46, 395 (2011).
- Kashirskaya, NY, Kapranov, NI, Sander-Struckmeier, S & Kovalev, V. Safety and efficacy of Creon Micro in children with exocrine pancreatic insufficiency due to cystic fibrosis. Journal of Cystic Fibrosis 14, 275-281 (2015).
- Kent DS, Remer T, Blumenthal C, Hunt S, Simonds S, Egert S, Gaskin KJ. 13C-Mixed Triglyceride Breath Test and Fecal Elastase as an Indirect Pancreatic Function Test in Cystic Fibrosis Infants. J Pediatr Gastroenterol Nutr. 2018 May;66(5):811-815. doi: 10.1097/MPG.0000000000001905.
- Konstan, MW, Stern, RC, Trout, JR, Sherman, JM, Eigen, H, Wagener, JS, et al. Ultrase MT12 and ultrase MT20 in the treatment of exocrine pancreatic insufficiency in cystic fibrosis: Safety and efficacy. Alimentary Pharmacology and Therapeutics 20, 1365-1371 (2004).
- Konstan, MW, Liou, TG, Strausbaugh, SD, Ahrens, R, Kanga, JF, Graff, GR, et al. Efficacy and safety of a new formulation of pancrelipase (Ultrase MT20) in the treatment of malabsorption in exocrine pancreatic insufficiency in cystic fibrosis. Gastroenterology Research and Practice (2010).
- Konstan, MW, Accurso, FJ, Nasr, SZ, Ahrens, RC & Graff, GR. Efficacy and safety of a unique enteric-coated bicarbonate-buffered pancreatic enzyme replacement therapy in children and adults with cystic fibrosis. Clinical Investigation 3, 723-729 (2013).
- Littlewood, JM, Connett, GJ, Sander-Struckmeier, S & Henniges, F. A 2-year post-authorization safety study of high-strength pancreatic enzyme replacement therapy (pancreatin 40,000) in cystic fibrosis. Expert Opinion on Drug Safety 10, 197-203 (2011).
- Munck, A, Duhamel, JF, Lamireau, T, Le Luyer, B, Le Tallec, C, Bellon, G, et al. Pancreatic enzyme replacement therapy for young cystic fibrosis patients. Journal of Cystic Fibrosis 8, 14-18 (2009).
- Ng, SM & Franchini, AJ. Drug therapies for reducing gastric acidity in people with cystic fibrosis. Cochrane Database Syst Rev 7, CD003424 (2014).
- Proesmans, M & De Boeck, K. Omeprazole, a proton pump inhibitor, improves residual steatorrhoea in cystic fibrosis patients treated with high dose pancreatic enzymes. Eur J Pediatr 162, 760-763 (2003).
- Saxby N., Painter C., Kench A., King S., Crowder T., van der Haak N. and the Australian and New Zealand Cystic Fibrosis Nutrition Guideline Authorship Group (2017). Nutrition Guidelines for Cystic Fibrosis in Australia and New Zealand, ed. Scott C. Bell, Thoracic Society of Australia and New Zealand, Sydney.
- Schechter MS, Michel S, Liu S, Seo BW, Kapoor M, Khurmi R, Haupt M. Relationship of Initial Pancreatic Enzyme Replacement Therapy Dose With Weight Gain in Infants With Cystic Fibrosis. J Pediatr Gastroenterol Nutr. 2018 Oct;67(4):520-526. doi: 10.1097/MPG.0000000000002108.
- Stallings, VA, Stark, LJ, Robinson, KA, Feranchak, AP & Quinton, H. Evidence-based practice recommendations for nutrition-related management of children and adults with cystic fibrosis and pancreatic insufficiency: results of a systematic review. J Am Diet Assoc 108, 832-839 (2008).
- Trapnell, BC, Maguiness, K, Graff, GR, Boyd, D, Beckmann, K & Caras, S. Efficacy and safety of Creon 24,000 in subjects with exocrine pancreatic insufficiency due to cystic fibrosis. Journal of Cystic Fibrosis 8, 370-377 (2009).
- Trapnell, BC, Strausbaugh, SD, Woo, MS, Tong, SY, Silber, SA, Mulberg, AE, et al. Efficacy and safety of PANCREAZE for treatment of exocrine pancreatic insufficiency due to cystic fibrosis. Journal of Cystic Fibrosis 10, 350-356 (2011).
- Turck, D, Braegger, CP, Colombo, C, Declercq, D, Morton, A, Pancheva, R, et al. ESPEN-ESPGHAN-ECFS guidelines on nutrition care for infants, children, and adults with cystic fibrosis. Clin Nutr 35, 557-577 (2016).
- Van der Haak, N, Boase, J, Davidson, G, Butler, R, Miller, M, Kaambwa, B, et al. Preliminary report of the (13)C-mixed triglyceride breath test to assess timing of pancreatic enzyme replacement therapy in children with cystic fibrosis. J Cyst Fibros 15, 669-674 (2016).
- Van De Vijver, E, Desager, K, Mulberg, AE, Staelens, S, Verkade, HJ, Bodewes, FA, et al. Treatment of infants and toddlers with cystic fibrosis-related pancreatic insufficiency and fat malabsorption with pancrelipase MT. Journal of Pediatric Gastroenterology and Nutrition 53, 61-64 (2011).
- Walkowiak J, Lisowska A, Blask-Osipa A, Drzymała-Czyz S, Sobkowiak P, Cichy W, Breborowicz A, Herzig KH, Radzikowski A. Acid steatocrit determination is not helpful in cystic fibrosis patients without or with mild steatorrhea. Pediatr Pulmonol. 2010 Mar;45(3):249-54. doi: 10.1002/ppul.21149.
- Wooldridge, JL, Heubi, JE, Amaro-Galvez, R, Boas, SR, Blake, KV, Nasr, SZ, et al. EUR-1008 pancreatic enzyme replacement is safe and effective in patients with cystic fibrosis and pancreatic insufficiency. Journal of Cystic Fibrosis 8, 405-417 (2009).
- Wooldridge, JL, Schaeffer, D, Jacobs, D & Thieroff-Ekerdt, R. Long-term experience with ZENPEP in infants with exocrine pancreatic insufficiency associated with cystic fibrosis. Journal of Pediatric Gastroenterology and Nutrition 59, 612-615 (2014).
Evidence tabellen
Evidence table for diagnostic test accuracy studies
Research question: What is the diagnostic accuracy of the different laboratory tests to measure the fat absorption for the purpose of monitoring the dose setting of PERT?
|
Study reference |
Study characteristics |
Patient characteristics |
Index test (test of interest) |
Reference test
|
Follow-up |
Outcome measures and effect size |
Comments |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Caras, 2011 |
Type of study[1]: double-blind, randomized, placebocontrolled, 2-period crossover trial
Setting and country: At 10 centers across the United States between June 13, 2008 and December 1, 2008.
Funding and conflicts of interest: funded by Abbott Products Inc, à S.C., D.B., and L.Z. were employees of Abbott, Marietta, GA, at the time of this analysis and writing of the manuscript. S.S.S. is an employee of Abbott, Hannover, Germany. |
Inclusion criteria: - Subjects ages 7 to 11 years who had a confirmed diagnosis of CF and EPI; - Patients must have been receiving treatment with a commercially available PERT product at a stable dose for >3 months. They had to be in clinically stable condition, without evidence of acute respiratory disease, for at least 1 month before enrollment. - only patients with a stable body weight (defined as a decline of no more than 5% within 3 months of enrollment) -Patients had to be able to swallow capsules and to consume a standardized diet designed to provide sufficient fat to require a minimum of 12,000 lipase units of pancreatic enzyme supplementation per meal.
Exclusion criteria: - if they had severe medical conditions that might limit participation in or completion of the study or if they had recently undergone major surgery (excluding appendectomy). - a body mass index percentile for age of <10%; ileus or acute abdomen; malignancy of the digestive tract (excluding pancreatic cancer); HIV; celiac disease; Crohn’s disease; known allergy to pancrelipase (pancreatin) or the inactive ingredients in pancrelipase delayed-release capsules; or exposure to an experimental drug within 30 days of the start of the study.
N= 17 subjects (8 received placebo then pancrelipase, 9 received pancrelipase then placebo)
median age (range): 8,0 (7–11) years
Boys: n= 12 (70,6%)
mean daily lipase dose: 4472 U/g fat consumed.
Other important characteristics: 12 subjects from 8 of the 10 centers provided samples for this analysis (10 in both treatment periods and 2 in only 1 period); the median age was 9.0 years, all subjects were of white race, and 9 (75,0%) were boys.
|
Describe index test: Sparse stool sampling for percentage fat (PF) analysis
Bowel movements were collected individually to facilitate determination of the PF in each sample.
Individual stool samples were analyzed for fat content by removing a 5-g aliquot from the remaining 50% of each homogenized bowel movement. Therefore, PF sampling did not affect the CFA determination. Stool fat was determined by nuclear magnetic resonance (NMR) methods PF was calculated based on the dry weight of each bowel movement
Comparator test[2]: PF values for each subject were derived using 4 different sparse-sample methods (3 multiple-sample methods and 1 singlesample method): - mean PF from the first bowel movement on each day; - mean PF from the last bowel movement on each day; - mean PF from 3 randomly selected bowel movements, each on a different day; - PF from a single random sample selected irrespective of day
|
Describe reference test[3]: 72-hour CFA
The CFA (coefficient of fat absorption) is calculated from fat intake and stool fat output data collected during a 72-hour period.
Subjects were administered 2 doses of blue food dye (250mg of FD and C Blue #2 indigo carmine) 72 hours apart to mark the beginning and end of the stool collections, which were performed during both crossover periods. Stool collection began after passage of the first blue-stained bowel movement and ended with passage of the second
Stool fat was determined by nuclear magnetic resonance (NMR) methods
Cut-off point: 80%
|
Time between the index test en reference test:
For how many participants were no complete outcome data available? N=1 (5,9%)
Reasons for incomplete outcome data described? Not reported |
Outcome measures The comparison of PF with CFA as a dichotomous variable (CFA <80% vs CFA ≥80%) included evaluation of sensitivity, specificity, and positive predictive value (PPV).
PF values ≤30% were greatly predictive for CFA values ≥80%, as shown by PPV, sensitivity, and specificity values ≥0,89. ROC curves of sensitivity versus 1–specificity showed high accuracy (AUCs ≥0.93) for the multiple-sample methods. PPV= 0,88 sensitivity = 0,78, à were lower at the 30% PF threshold for the single-sample method compared with the multiplesample methods; an AUC of 0,91 in the ROC plot indicated slightly lower accuracy à See table 1 below
the correlation between PF and CFA as a continuous variable based on 3 groups of samples: pancrelipase, placebo, and both combined. à See table 2 below
|
72-hour CFA à hospitalization is required to ensure complete stool collection and a complete record of dietary fat intake
The subjects received 12,000-lipase unit pancrelipase delayed-release capsules. The correct number of capsules to be consumed was calculated to provide a target dose of 4000 lipase units/gram of dietary fat intake according to the upper limit of the recommendation of CF consensus statements (30–32). Each subject received an individualized, prospectively designed diet to maintain normal nutrition, containing at least 40% of energy derived from fat. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Caras, 2011 |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Kent, 2018 |
Type of study: Accuracy study
Setting and country: The Children’s Hospital at Westmead, Sydney, Australia.
Funding and conflicts of interest: This research project was supported by grants from the James Fairfax Institute of Paediatric Nutrition and the Johno Johnston Scholarship (DSK). The authors report no conflicts of interest. |
Inclusion criteria: -identified as having CF by the New South Wales State Program.
Exclusion criteria: -
N= 24 infants (12 breast-fed and 12 formula-fed)
age: ranging in age from 1 to 13 months (20, <6 months of age)
Sex: 10/24 baby girls
Other important characteristics: Mean height: 59,9 cm (± 8.0 [48,0–76,7]) mean weight: 5,8 kg (± 2,0 [3,1–10,3]) |
Describe index test: surrogate IPF testing with 13C-mixed triglyceride breath testing (13C-MTG breath test)
Oral pancreatic enzyme substitution (PERT; if already commenced) was stopped at least 8 hours before the start of the 13C-MTG breath test.
- Infants <6 months of age received 200-mg MTG test substrate mixed in 5 ml expressed breast milk, infant formula or apple gel. - babies (>6 months of age) MTG was mixed in apple-gel or yoghurt. Duplicate breath samples (150 ml) were collected before administration of the test meal and at 30-minute intervals thereafter over the study period of 5 hours. Expired infant’s breath was collected by using an anaesthetic mask, connected via a one-way flap valve to an aluminized plastic bag. Breath samples were analyzed promptly on the same day of the test. 13C enrichment was measured using NDIRS. Breath test results were analyzed and expressed as cumulative percentage dose of 13C recovered (cPDR) over the 5-hour test period (% 13C cPDR).
Cut-off point(s): 13 Option 1 to determine pancreatic function status is based on the %13C cumulative dose recovered (cPDR) value after 5 hours, with a minimum reference %13C cPDR value of 13, therefore, chosen as cut-off point for PS.
Option 2 comparison of the individual results of the 13C cPDR values over the whole 5-hour study period à CF babies are classified to be PS if ≥80% of 13C cumulative dose results are above the minimum values provided by the group of healthy individuals.
Comparator test: fecal elastase-1 testing (FE1 measurements)
Oral pancreatic enzyme substitution (PERT; if already commenced) was stopped at least 1 day before the FE1 assessment.
Monoclonal FE1 levels were determined in all CF infants using a commercially available enzyme-linked immunosorbent assay (ELISA) kit (ScheBo, Biotech, Giessen, Germany).
Polyclonal FE1 levels were determined using a commercially available polyclonal ELISA kit (Bioserv Diagnostics, Rostock, Germany).
Cut-off point(s): Monoclonal FE1 levels FE1 According to manufacturer’s instructions à concentrations <200mg/g stool reflect pancreatic insufficiency
According to Beharry et al (2002) and Loser et al (1996) a cut-off point of 100mg/g stool
Polyclonal FE1 levels According to manufacturer’s instructions, values >200mg elastase/g faeces indicate normal exocrine pancreatic function; values between 100 and 200mg elastase/g faeces indicate moderate exocrine pancreatic insufficiency and values <100mg elastase/g faeces indicate severe exocrine pancreatic insufficiency.
|
Describe reference test: 72-h fecal fat balance test
Oral pancreatic enzyme substitution (PERT; if already commenced) was stopped at least 1 day before the fecal fat assessment.
Stool samples were collected for all CF babies over a 72-hour period. Additionally, for formula-fed infants, a record of the volume and kind of formula ingested over this period were kept. The effectiveness of fat absorption was measured by the coefficient of fat malabsorption (CFA) ([fecal fat (g)/fat intake (g)] [100]).
Cut-off point(s): infants <6 months of age à fecal fat excretion <10% of fat intake in formula-fed infants and based on fecal fat excretion < 2 g/day in breast-fed infants babies >6 months of age à fat excretion ≤7% of oral fat intake.
|
Reasons for incomplete outcome data described? Not reported
For how many participants were no complete outcome data available? Not reported
|
Outcome Mean total stool weight (72-hour stool collection): 73,8 ± 45,6 g. Mean fat excretion in faeces: 3,1±2,9 g per day (ranged from <0.1–9.4 g/day).
13/ 24 CF babies were determined PS (fecal fat excretion ranged from <0.1–1.9 g/day) 11/24 infant’s PI (fecal fat excretion ranged from 2.9 to 9.4 g/day).
Mixed Triglyceride Breath Test Mean basal delta results of the 24 CF babies were -26.7±3.8%.
Option 1 17/24 CF babies were determined as PI 7/24 CF babies as PS
Option 2 20/24 babies were determined PI 4/24 CF babies PS.
Comparison of the 13C-Mixed Triglyceride Breath Test Versus the Fecal Fat Balance Test
Option 1 Sensitivity rates PI: 82% PS: 38% specificity rates PI: 38% PS: 82%
Option 2 Sensitivity rates PI: 100% PS: 31% specificity rates PI: 31% PS: 100%
Fecal Elastase-1 Results According to Monoclonal ELISA Assessments manufacturer’s instructions: 18/ 24 CF babies PI 6/24 PS
Beharry et al (2002) and Loser et al. (1996): 17/24 PI 7/ 24 CF PS
Fecal Elastase-1 Results According to Polyclonal ELISA Assessments 16/24 CF babies PI, 3/24 CF babies PS 5/24 CF babies had FE1 concentrations between 100–200mg elastase/g stool, indicating moderate pancreatic insufficiency = PS.
Comparison of the Fecal Fat Balance Test and FE1 Analysis With Monoclonal Kit manufacturer’s cut-off values Sensitivity PI: 100%, PS: 46% Specificity PI: 46% PS: 100%
cut-off value used by Beharry et al (2002) and Loser et al (1996) sensitivity PI: 100% PS: 54% specificity PI: 54% PS: 100%
Comparison of the Fecal Fat Balance Test and FE1 Analysis With Polyclonal Kit Sensitivity PI: 92%, PS: 45% Specificity PI: 45% PS: 92% |
PI à pancreatic-insufficient require oral pancreatic enzyme replacement therapy (PERT)
PS à pancreatic- sufficient |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Walkowiak, 2010 |
Type of study: Accuracy study
Setting and country: Poland
Funding and conflicts of interest: Polish Ministry of Science and Higher Education |
Inclusion criteria: -Preselected on the basis of previously performed FFB studies -CF diagnosis -no or mild steathorrea
Exclusion criteria: -
N= 55
age: 7-18 years
Sex: 25 females
Other important characteristics: All were pancreas insufficient All had body weight >3rd percentile All received 2,000-10,000 U of lipase/kg of body weight/day |
AS values lower than 10% were considered to be normal and higher than 20% as abnormal.
|
Reasons for incomplete outcome data described? Not reported
For how many participants were no complete outcome data available? For 5 subjects 3 day stool collection was not available
|
Outcome Correlations between FFE/FFC and AS based upon 1-day stool collection FFE: r=0.208, P<0.011; FFC: r=0.362, P<0.000006,
Correlations between FFE/FFC and AS based upon 3-day stool collection FFE: r=0.394, P<0.005 FFC: r=0.454, P<0.001
Accuracy AS for determination of abnormal FFC 1 day stool collection for AS cut off levels:
Accuracy AS for determination of abnormal FFC 3 day stool collection for AS cut off levels:
Accuracy AS for determination of abnormal FFE 1 day stool collection for AS cut off levels:
Accuracy AS for determination of abnormal FFE 3 day stool collection for AS cut off levels:
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

Research question PICO 1: Does acid suppression medications improve PERT efficacy for people with CF?
Evidence synthesis from Nutrition Guidelines for Cystic Fibrosis: in Australia and New Zealand, 2017
|
Citation |
Level (NHMRC) and quality (ADA) |
Study design and sample |
Intervention and outcomes |
Results & Conclusions |
Comments |
|
Proesmans, 2003 |
NHMRC Level II
ADA Quality: Positive |
Randomised cross-over design
N=15 (CF subjects; median age 8.7 years)
Inclusion criteria: · Patients with persistent symptomatic steatorrhea despite a daily dose of at least 10,000U lipase/kg per day were candidates for the study
Persistent steatorrhea was defined as >7g faecal fat/day (when fat intake is at least 100g/day) or fat absorption <93%
Exclusion criteria: · Severe lung disease with FEV1 <30% · Pulmonary exacerbation in the previous month or liver cirrhosis with portal hypertension · Median daily lipase intake 13,500U/kg per day |
Intervention: · Patients started at random with ‘no omeprazole’ or ‘omeprazole’ for a 1 month period and then crossed over to the other group · Patients < 20kg were treated with 10mg daily, patients >20kg received 20mg · At the end of each month, a 3 day stool collection and a 3 day weighed food record were obtained allowing calculations of caloric intake, daily intake of fat, protein and carbohydrate
Outcomes: · Daily stool fat loss · Fat absorption |
Results: · Daily intake of calories, fat, carbohydrate and protein was not significantly different between the two treatment periods · Median daily faecal fat loss decreased significantly (p>0.01) during omeprazole treatment, 13g (11.5 – 16.5g/day) to 5.5g (4.9 – 8.1g/day) respectively. · The same improvement was noted when fat reabsorption was calculated, 87% (81 – 89%) versus 94% (90 – 96%) with omeprazole. · In all but one patient fat absorption improved - For this patient treated with 16,000U lipase/kg, fat loss was 10.7g/day (reabsorption 86.3%) without versus 14.3g/day (87.9%) with omeprazole – there was no obvious explanation for his lack of improvement
Conclusions: · Omeprazole can improve fat digestion in CF children with residual steatorrhea despite high – dose lipase treatment |
Author limitations: · Small sample size · Should have included all 24 patients and potentially analysed separately to give a ‘real life’ example of improvements when patients may not be compliant with enzyme supplementation
Appraiser limitations: · No blinding |
|
Francisco, 2002 |
NHMRC Level II
ADA Quality: Neutral |
Double blind randomised placebo-controlled crossover study
N = 22
CF children & adults
Inclusion criteria: · CF & PI Exclusion criteria: · Pregnancy · Cholestasis |
Intervention:
· Measure of baseline PERT · Adjuvant therapy was commenced 3 days prior to admission. - Paeds <40kg had ranitidine 5mg/kg or 10mg/kg daily divided into equal doses 30mins prior to BF & D. - Paeds >40kg & adults received 150mg or 300mg bd 30 mins before BF. · Each group was tested whilst having placebo. · The order of Rx was randomised. · Adults were also tested whilst receiving omeprazole 20mg/d 30 mins before BF. · Fat absorption was calculated & diet controlled.
Outcomes: · Effect of gastric acid suppressant therapy with either ranitidine or omeprazole on CF pts receiving ph sensitive enteric coated microtablet. |
Results:
· The linear model for all subjects showed no overall adjuvant drug effect on fat absorption p=0.32. · In adults only drug treatments showed no difference in fat absorption p=0.15 · Paired t test subgroup analysis of adults showed a 4.97% p= 0.003 in mean fat absorption all other t tests showed no significance comparing low dose ranitidine to placebo. · There was marked inter-subject & intrasubject variability in fat absorption. · No overall sig improvement in fat absorption could be demonstrated
Conclusions: · No overall sig improvement in fat absorption could be demonstrated |
Author limitations:
Adherence with therapy · Timing of PERT · Gastric emptying · Bacterial overgrowth · Bile acid abnormalities · Small bowel disease
Appraiser limitations: · Small sample size |
|
Ng, 2014 |
NHMRC Level I
ADA Quality: Positive |
Systematic Review N= 17 trials (273 participants) Inclusion criteria: · All randomised and quasi randomised trials involving agents that reduce gastric acidity compared to placebo or comparator treatment. · Children and adults with defined CF, diagnosed clinically by sweat or gene testing and including all degrees of severity. · All doses and routes of administration were considered.
Exclusion criteria: · Not RCT, examining agents which are not used to reduce gastric acidity eg prokinetic agents vs PPI, outcomes irrelevant to the study question. |
Intervention:
· Agents that reduce gastric acidity- PPI or H2 Receptor antagonists. · Other drug therapies such as prostaglandin E2 analogues & sodium bicarbonate. · Compared to placebo mostly
Primary outcome: · Measures of nutritional status as assessed by weight, height and indices of growth. · Symptoms related to increased gastric acidity such as epigastric pain or heartburn · Complications of increased gastric acidity such as gastric or duodenal ulcers.
Secondary outcome: · Faecal fat, faecal nitrogen excretion and other measures of fat malabsorption · Measures of lung function · Measures of quality or life, mortality, any adverse effects reported. |
Results:
Primary outcomes: · Drug therapies that reduce gastric acidity improve gastrointestinal symptoms such as abdominal pain · Seven trials reported significant improvement in measures of fat malabsorption · Two trials report no significant improvement in nutritional status.
Secondary outcomes: · Insufficient evidence to indicate weather there is an improvement in nutritional status, lung function, quality of life or survival.
Conclusions: · Trials have shown limited evidence that agents that reduce gastric acidity are associated with improvements in gastrointestinal symptoms and fat absorption. · Overall not able to draw firm conclusions from the evidence available.
Limitations (author noted) |
Author limitations:
· 14 trials were of a crossover design and did not have the appropriate info to conduct comprehensive meta- analysis. · The number of trials assessing each of the different agents was small. · The included trials were generally not reported adequately enough to allow judgement of risk of bias. · Unable to group outcome data in to 1, 3, 6 and 12 month time points as planned. · Due to lack of trials it was not possible to investigate heterogeneity between trials using chi2 test and I2 statistic. · Unable to identify any reporting biases. No trials described the methods of randomization · Several studies did not adequately blind or discuss blinding risk of bias from incomplete data was unclear in 4 trials.
Appraiser limitations: · 7 trials limited to children and 3 in adults only. · Large variation between the trials in terms of design, duration, treatment and outcome measures. |
Research question PICO 3: How should PERT be dosed for people with CF to support optimal fat absorption?
Evidence synthesis from Nutrition Guidelines for Cystic Fibrosis: in Australia and New Zealand, 2017
|
Citation |
Level (NHMRC) and quality (ADA) |
Study design and sample |
Intervention and outcomes |
Results & Conclusions |
Comments |
|
Littlewood, 2011 |
NHMRC Level IV ADA Quality: NEUTRAL
|
Observational, noninterventional study, single arm study
N=64 CF patients with PI (mean age 20.7)
Inclusion criteria: · PEI patients who had previously taken high doses of pancreatic enzymes (>40000IU lipase/meal). · Also, patients who require at least 40000IU lipase/meal (but were previously taking less than this)
Exclusion: · Hypersensitivity to porcine proteins
|
Intervention: · Change to pancreatin 40,000 capsules from lower dose preparation
Outcomes: · Serious suspected adverse drug reactions including fibrosing colonopathy · Maldigestion symptoms, body weight
|
Results: · No serious suspected adverse drug reactions related to pancreatin 40000 · No cases of fibrosing colonopathy. · Mean number of capsules taken per individual per day was notably reduced from 43.8 lower strength capsules to 24.6 of 40000IU capsules (as expected). · 3 subjects discontinued Pancreatin 40000 due to ‘mild stomach ache/ abdominal pain’ or ‘bowel did not settle.’ · Overall 36% patients had an increase in average daily lipase dose at last visit vs pain reduced- 24.2% at baseline to 10.7% at the end of the study. · Percentage of patients with fatty stools reduced from 30.2% at baseline to 8.9% at the end of the study · Mean body weight increased for patients <18 years of age, but remained stable in >18 years of age.
Conclusions: · No safety concerns arose during this study in which most patients received doses of >10,000 lipase units per kg/day baseline & 55% had a decrease in average daily lipase dose. · Percentage of patients with abdominal for 18 months |
Author limitations: · Due to observational study design with no control or comparison group it is not possible to determine what proportion of improvement in mal-digestion symptoms was due to pancreatin 40000 vs other factors. · Symptom improvement may be due to improved compliance due to increased monitoring during the study period. · Not possible to determine how much weight gain was due to growth in subjects <18years of age, rather than the pancreatin 40000. Conversely a portion of patients had a reduction in body weight, and the reasons for this cannot be determined as this study did not collect info such as pulmonary fx. · Limited sample size
Appraiser limitations: · Non-serious drug reactions were not recorded or reported as part of this study. · Outcome measures of malabsorption and weight are poorly described, subjective measures and prone to bias/ error etc · This study only looked at subjects who required ‘high doses’ of lipase (>40000IU/meal). |
|
Trapnell, 2009 |
NHMRC Level II ADA Quality: POSITIVE
|
Double blind randomised placebo controlled two period crossover trial
N=31 Males & females with CF
Inclusion criteria: · >12 years of age with confirmed CF & EPI · Clinically stable, including stable weight · On commercially available PERT product stable dose for last 3 months.
Exclusion criteria: · Hx of ileus/ DIOS in last 6 months · GI malignancy in last 5 years · Hx of pancreatitis · Fibrosing colonopathy or HIV. · Subjects < 18yrs also excluded if BMI centile less than 10%.
Primary objective of the study was to demonstrate superior efficacy of Creon over placebo in improving fat absorption as measured by the CFA. |
Intervention: · An individualised diet providing at least 100g/day was provided during days 1 to 5 of the crossover period. · Subjects were randomised 1:1 to one of two crossover treatment sequences: Creon then placebo or placebo then Creon. Creon 24000 capsules were administered to achieve a dose of 4000 IU lipase/ g fat. A “washout” period of 3 to 14 days separated the study periods when subjects had usual diet & enzymes. Blinding was maintained by provision of identical capsules and packaging for placebo and Creon.
Outcome: · Efficacy and safety of Creon 24000
|
Results: · Mean CFA was significantly greater with Creon 88.6% than placebo 49.6% p<0.001.
Conclusions: · The data in this study provide strong evidence for the effectiveness of Creon 24000 capsules at a dose of approx. 4000 lipase units/ fat in treatment of EPI in CF.
|
Author limitations: · The relatively high dose of 4000IU lipase/ g fat chosen together with dosing per gram of fat may not be easily compared with dosing practices commonly used in the clinical setting. · Lack of dose response data for PERT · CFA is not routinely etermined in clinical practice · Short term duration of the study does not allow conclusions regarding long term tolerability or symptomatology
Appraiser limitations: · Creon 24000 not a product available in Aust or NZ. · Placebo was not clearly defined, was difficult to tell if it was no enzyme or usual enzyme. · Funding & design of study is an obvious conflict of interest. |
|
Konstan, 2010 |
NHMRC Level II
ADA Quality: Neutral
|
Randomised, placebo controlled study with crossover design
N=31 subjects with CF >7yrs Inclusion criteria: · PI confirmed by faecal Elastase · Clinically stable at study entry · Taking optimal doses of PERT product · Adequate nutrition status per BMI cut-offs specified · Able to swallow, able to eat high fat diet · On birth control · Ok to be on PPI or H2 therapy · Informed consent.
Exclusion criteria: · Known hypersensitivity to Ultrase MT or porcine proteins. · Allergy to stool marker. · Use of narcotics · Regularly taking bowel stimulants · Hx of bowel resection or portal HT. · Acute pulmonary exacerbation, pancreatitis, GI conditions, uncontrolled DM, DIOS or any other conditions known to increase faecal fat loss. |
Intervention: · Dietitian developed, individualised high fat diet (2g fat/kg body wt) taken for entire comparison phase. · Pancrealipase (6-7days)- crossover (up to 10 days)- placebo (6-7 days) OR vice versa. · Pancrealipase dose is at a stabilised, individualised dose as Assessed by the dietitian, administered under supervision with each meal or snack and recorded.
Primary Outcomes: · Stools collected- frequency and characteristics recorded by study personnel. · 72hr faecal fat completed- The CFA%, CAN% calculated using fat and nitrogen content of stool & food. · Adverse events (AE) assessed and recorded using MedDRA codification.
Secondary outcomes: · Medical, physical, biochemical Ax- pre, during and post study.
|
Results: · Patients treated with pancrealipase had significantly higher mean CFA% than those treated with placebo. P<0.00001 · 76% of patients achieved a CFA% of >85% when treated with pancrealipase compared with 19% of placebo treated patients. · Absorption of proteins measured by CAN% showed similar results. P=<0.00001 for the pancrealipase group. · Patients treated with pancrealipase had reduced number of bowel movements per day compared with placebo- 1.7 vs 2.9 normal stool consistency movements respectively (statistical analysis not performed) · 6 patients reported at least 1 treatment related AE on pancrealipase compared to 18 patients while on placebo. Most AEs were GI and consistent with CF. No clinically significant effects of treatment were noted physically, on labs or vital signs.
Conclusions: · This pancrealipase (Ultrase MT with HP- 55 coating, rather than Eudragit) is a safe and effective treatment for malabsorption associated with PEI. |
Author limitations: · Only limitation vaguely stated was short treatment period
Appraiser limitations: · N=31 but only 24 patients provided analysable data. · The study does not describe the reason for drop-outs of poor data collection. · Small sample size · Adverse events only vaguely described as described as ‘GI’ · The study reports measuring compliance to the study drug but does not report any data around how the compliance was with the drug or the diet prescription. · Method of randomisation not described.
|
|
Kashirskaya, 2015 |
NHMRC Level IV |
Prospective open label multicentre study
N=40 children with CF Inclusion criteria: · 1 month to <4 years with EPI · Accessing eight centres in Russia between June and Dec 2012. · Exclusion criteria: Intestinal/bowel resection/solid organ transplant impacting bowel · DIOS, GI malignancy, hx of fibrosing colonopathy
|
Intervention: · Creon micro administered at a dose of 5000 lipase units per 120mL of formula or breastfeed, or 1000 lipase units/Kg body weight/meal, according to the CF Foundation Guidelines. · Creon micro given with liquid with pH <5.5 or by adding it to acidic soft food. Outcomes: · Safety- measured by AE · Efficacy Ax- height and body weight at baseline, month 1 and month 3 and compared with standard population using percentiles/z-scores. Stool frequency and consistency measures were also measures. · Acceptance of treatment and ease of use- using Likert scale for subjects and ease of use as per caregiver.
|
Results: · Adverse events occurred in 40% of subjects- none were serious or led to cessation of treatment · At 3 month mark, mean +/- SD increases from baseline z-scores were height for age 0.13 +/- 0.48, weight for age 0.2 +/- 0.39 and BMI for age 0.29 +/- 0.65. · Treatment was rated easy by 95% of caregivers and acceptance by subjects was good/very good by 90%.
Conclusions: · Creon micro was well tolerated . Growth parameters increased over the 3 month treatment period- owning to good intervention from CF Foundation guidelines.
Limitations (author noted)
|
Author limitations · Difficulties measuring height · Open –label study design · Lack of placebo/control group · Short study duration · Inability to measure clinical symptoms at baseline · Lack of direct measurement of Efficacy
Appraiser limitations: · Unclear if the time of day weight was measured and consistent scales used · Test of caregivers accuracy of dosage/food + PERT diary etc · Lung function was not acknowledged – how severe a disease did this patients have/admissions and this may effect growth · Small numbers |
|
Borowitz, 2006a |
NHMRC Level IV ADA Quality: Neutral
|
Open label multicentre dose ranging study
N=23 subjects from 11 different centres (ages 13-45 years)
Inclusion criteria: · Pancreatic insufficient based on fecal elastase <100ug/g.
Exclusion criteria: · Pregnancy · Breast feeding · DIOS in last 6 months · Taking any proton pump inhibitors, H2 receptor antagonists, or antacids. · Hx of fibrosing colonopathy, aspergilosis or liver disease
|
Intervention: · Subjects admitted to hospital discontinued usual PERT. Subjects received TCT containing lipase dose of 100, 500, 1000, 2500 or 5000 USP U/kg with each meal and snack for 3 days. 72hr 100g fat/ day diet, nil PERT, stool collected and measured. Within 14 days admitted to hospital routine. CFA was measured.
Primary outcomes: · To determine the acute safety and tolerability of 5 dose levels of TCT (TheraCLEC-Total), a proprietary formulation of microbial-derived lipase, protease and amylase.
Secondary outcomes: · To determine the effect of TCT on fat & protein absorption, GI symptoms and stool weight & frequency |
Results: · TCT increased the CFA of fat and nitrogen absorption in all groups except in the low dose group. At other dosing levels, the mean CFA and nitrogen absorption increases were 19.1% ± 24.9% and 17.8% ± 13.6% respectively whereas the mean stool weight decreased by 517 ± 362g.
Conclusions: · TCT was well tolerated in this short term exposure study. The preliminary efficacy data demonstrate lipase and protease activity with little difference seen with lipase doses greater than 500USP U/kg per meal.
Limitations (author noted)
|
Author limitations · Treatment CFA was lower than previous reports in the literature, authors cited precise methodology may have contributed to this. · Subjects were instructed to take their complete dose of TCT enzymes within 5 minutes of the start of each meal – this may have resulted in less than optimal mixing of enzymes with food.
Appraiser limitations: · Small numbers, n = 23 not powered for formal statistical testing. · No control group. · Did not describe weight (kg). · Didn’t report significance of change in CFA |
|
Graff, 2010 |
NHMRC Level IV
ADA Quality: Neutral
|
Open label multi centre single treatment arm study N = 18
Inclusion criteria: · Children with CF and EPI · 1 month - <7 years · Accessing 9 centres across the US from April 2009 – June 2009 with weight >3.75Kg · Already on a commercially available PERT with stable clinical condition
Exclusion criteria: · At risk of non-adherence by caregiver or inability to finish study. · Fibrosing colonopathy, DIOS.
|
Intervention: · Study drug given as 3000-, 6000-, and 12000- lipase unit capsules and the correct number of capsules to be consumed was calculated to provide 8000 lipase unit/Kg body weight/day without exceeding the max lipase dose of 10000 lipase units /Kg body weight/day. Patients on a higher dose before study, continued on higher dose (n?). · According to CF consensus CF Guidelines
Outcomes: · Safety and tolerability measured by AEs and weight at screening/baseline at end of treatment · Ease of accurate dosing by caregivers · Clinical symptom assessmentsstool frequency and consistency |
Results: · Patients received a mean +/- SD dose in lipase units/Kg bodyweight/day of 7542 +/- 1335 vs 6966 +/- 3392 on standard therapy. · 50% patients has AEs but were mild but did not require cessation · Clinical symptom assessment results were similar between treatments · Slight preference for study drug over standard therapy with ease of accurate dosing- 33.3% caregivers thoughts study drug was easier, 5.6% thought study drug was harder
Conclusions: · Children aged <7 years with EPI due to CF, the new formulation pancrealipase delayed-release capsules were clinically comparable with standard with standard therapy in terms of safety, tolerability, efficacy, but not clinically meaningful. |
Author limitations · Small sample size · Lack of placebo/control group
Appraiser limitations: · Bias in choosing patients who would finish study etc. · Lung function was not acknowledged – how severe a disease did this patients have/admissions and this may effect growth · Short study duration |
|
Borowitz, 2006b |
NHMRC Level II
ADA Quality: Positive |
Randomised, double blind, parallel dose-ranging study
N=117
Inclusion criteria: · CF & PI · Had baseline coefficient of fat (CFA) and coefficient of nitrogen absorption (CAN) determined in inpatient setting while not receiving PERT
Exclusion criteria: · Nil stated
|
Interventions: · Subjects had a baseline CFA and CNA while not receiving PERT. They were then randomised to treatment with ALTU-135 continuing 5000 (low), 25,000 (mid) or 100,000 (highest) units of lipase per meal or snack for 28 days. After 14 days CFA and CNA were re-measured.
Outcomes: · The primary outcomes were change from baseline in CFA and CAN treatments.
|
Results: · Treatment coefficient of fat absorption was significantly greater in the 25000 and 100000 units of lipase groups compared to 5000 group. · Findings for coefficient of nitrogen absorption were similar. · Subjects with baseline coefficient of fat absorption <40% and >40% in the 25000 and 100000 groups had a mean increase of 31 and 8 percentage points in coefficient in fat
Conclusions: · ALTU-135 was efficacious during the 1 month period at the dose of 25000 units of lipase |
Appraiser limitations: · Short duration - only for 28 Days · Unclear how adherence was measured · Timing of PERT not defined |
|
Van de Vijver, 2011 |
NHMRC Level III-3 ADA Quality: Positive
|
Phase 2 randomised, investigator – blinded, parallel group pilot study N=16 paediatric CF patients (6-30months of age) Patients were recruited from 5 university medical centres in Belgium and the Netherlands
Inclusion criteria: · CF confirmed by genetic testing or abnormal sweat test combined with clinical signs. · All subjects had a documented history of abnormal coefficient of faecal fat absorption (CFA) or lower than 15μg faecal elastase per gram, confirming a diagnosis of CF-related PI.
Exclusion criteria: · Nil stated
|
Intervention: · Use of pancrease MT (pancrelipase microtablets, 2mm, enteric coated) orally · Run in period (Day 1 – 5) where participants received 500U lipase/kg/meal at a maximum of 5 times per day · Randomisation period (days 6 – 11) where participants were randomised to receive 500, 1000, 1500, 2000U lipase/kg/meal · Study visits were conducted on day 1, day 6 and day 11. · A carton was dispensed to the parent or guardian at visits 1 and 2 and contained 6 bottles of study medication. Each bottle contained 5 capsules. Each capsule contained the meal – specific dose required for each dose group and the appropriate number of microtablets for the subjects weight in kilograms with a maximum of 10,000U lipase/kg/day. · Parents were instructed to record in a diary the date, time and amounts of all foods and formula consumed and date and time of study medications · Patients had to maintain a defined diet containing 125 – 150% of the recommended daily allowance appropriate for patients with CF.
Primary outcome: · Medication efficacy, assessed by 72 hour faecal fat exertion, expressed as a coefficient of faecal fat absorption (CFA) and 13C mixed triglyceride breath test.
Secondary outcome: · Safety and palatability
|
Results:
Primary Outcome · Compliance, defined as use of the study medication, was 89 – 99% · The changes in median weight from screening to the end of the study were 0.05kg (-1 to 0.2) in the 500U group, 0.0kg (-0.1 – 0.7) in the 1000U group, - 0.05kg (-0.2 – 0.1) in the 1500U group and 0.15kg (-0.3 – 0.5) in the 2000U group. · At the time of randomisation, the median CFA of fat was 93% (91-96) in the 500U group, 90% (85 – 95) in the 1000U group, 83% (67-93%) in the 1500U group and 92% (90 – 96) in the 2000U group. · None of the 4 doses influenced the CFA relative to the baseline period. · During the run in period the median cumulative % 13C was 11 (-8 – 59). After randomisation the median cumulative % 13C was 18 (14 – 23) in the 500U group, 14 (-1 – 17) in the 1000U group, 10 (10 – 27) in the 1500U group, and 3 (1 – 49) in the 2000U group.
Secondary outcome · The mean palatability score was 2.8 during the run in period (range 0 -3) and 2.6 (range 0.3 – 2.8) during the randomisation period. Mean scores >2 were observed in the 500U, 1000U and 1500U group. The 2000U group scored 1.8. · Gastrointestinal symptoms were reported in some patients – 3 adverse events were reported in 18 enrolled subjects (17%) during the run in period and 4 events during randomisation. During run in complaints were diarrhoea (1), vomiting (1), and rhinitis (1). In the 500U group complaints were abdominal pain 91), abnormal stools (1) and increased bowel movements (1). One patient randomised to 1000U group had constipation. In the 2000U group there was one event of vomiting and 1 of rhinitis.
Conclusions: · Pancrease MT at a dose of 500IU lipase/kg/meal resulted in a CFA of approximately 89% in the population studied · Doses were well tolerated and palatability was rated fair to good · Increasing the dose higher than 500IU lipase/kg/meal does not increase the coefficient of fat absorption · In this study, there was a large variation in cumulative % 13C with the median cumulative 13C in the 500U and 1000U groups in the low – normal range and the median cumulative 13C in the 1500U and 2000U groups below the normal range. |
Author limitations: · Large variation in results could be caused by a wide range of underlying residual endogenous lipase activity and perhaps insufficient breath sampling.
Appraiser limitations: · Small sample size · Inadequate recording of oral intake/ fat intake |
|
Konstan, 2004 |
Level II ADA Quality: Positive
|
Randomized double blind placebo controlled crossover study 12,000 N=26 (4 withdrawals)
20,000 N= 31 (6 withdrawals)
Inclusion criteria: · Subjects had CF with clinically apparent PI with two or more bowel movements per day. · >7 years of age · Clinically stable · Established on PERT · Good general CF health · Birth control (as required)
Exclusion criteria: · A known contraindication, sensitivity or hypersensitivity to porcine pancreatic enzymes · History of bowel resection · Pregnancy or lactating · Present or recent (7 days) treatment with H2- receptor antagonists, antacids, atidiarrhoeal agents, sucralfate |
Intervention: · The study compared two doses of one formulation of entericcoated pancreatic enzymes: Ultrase MT12 (12 000 lipase units per capsule) and Ultrase MT20 (20 000 lipase units per capsule), to placebo in two separate safety and efficacy studies. · The Pt took a high fat diet, the enzyme dose did not exceed 2500 IU of lipase per KG per meal. · Primary outcome - was percent absorption of dietary fat,
· Secondary outcome - absorption of protein, · Safety was assessed by laboratory values, vital signs and adverse events.
Outcome: · Safety & efficacy
|
Results: · A significant difference in both fat and protein absorption occurred with the enzyme therapy groups. · The Ultrase MT12 and Ultrase MT20 groups experienced a mean fat and protein absorption 79.4% and 83.8%, and 87.3% and 88.6%, respectively. there was a significant difference in both fat (P = 0.0001) and protein (P = 0.0001) absorption between enzyme and placebo groups, with more fat and protein being absorbed in the enzyme group · No adverse events related to study drug were reported.
Conclusion · The enzymes significantly increased fat and protein absorption. There were no major adverse events as a result of enzyme therapy.
|
Author limitations: · Short time period. A longer period of reporting could potentially provide long term evidence of safety and efficacy.
Appraiser limitations: · Nil |
|
Trapnell, 2011 |
NHMRC Level II
ADA Quality: postive
|
Randomised, placebo controlled PERT withdrawal study
n=49
Inclusion criteria: · Males & females aged 7 to 60 years with CF & PI
Exclusion criteria: · Exacerbation of CF · DIOS · Clinically significant GI symptoms
|
Intervention: · Usual PERT was discontinued, a high fat diet initiated (100g fat/day) and Pancrease administered based on patients usual lipase requirements, to a maximum of 10000 IU lipase/kg/day. The average daily dose of lipase during open label & double blind phases (6274 & 6403 iu/kg/d).
Primary outcomes: · 72hr stool collection under supervision in clinical research unit and day 3 & 6 of treatment. - Weighed and analysed for fat & nitrogen using NMR spectroscopy. CFA & CAN calculated.
Secondary outcomes: · Drug taken, stool characteristics recorded in subject diary · Adverse event information collected during each study visit. |
Results: · Pancrease improved fat absorption as shown by significantly lower mean + SD change in CFA between open label and double blind phases for Pancrease (-1.5 + 5.88%; p<0.001) compared to placebo (-34.1 + 23.03%).
Conclusions: · This study demonstrated Pancrease was effective in treating PI due to CF and was safe and well tolerated.
|
Author limitations: · The dose used in the study limits generalisation of the recommendations made with regard other lesser doses used by other CF pts
Appraiser limitations: · PANCREAZE not a product available in Aus & NZ · Funding & design of study is an obvious conflict of interest. |
|
Graff, 2010 |
NHMRC Level II ADA Quality: Positive
|
Multicentre, randomised, double-blind, placebocontrolled, 2-period crossover, superiority study of the new formulation of pancrelipase delated release 12,000-lipase unit capsuled with placebo.
Children with CF and PI aged 7- 11 years
Inclusion criteria: · On a PERT product at a stable dose for >3/12, · Clinical stable without acute respiratory disease for at least 1/12 preenrolment. · Stable body weight.
Exclusion criteria: · BMI<10% · Ileus, malignancy of the digestive tract · HIV, Coeliac disease, Chron’s disease · Known allergy to pancrelipase, or exposure to an experimental drug within 30 days of the start of the study.
|
Intervention: · Patients received pancrelipase 12,000-lipase unit capsules or identical placebo capsules. Target dose of 4000 lipase units/g dietary fat. · Each patient received an individualised prospectively designed diet containing >40% of calories from fat. · No minimum daily dietary fat requirement was implemented. · Patients remained on usual PERT day 0-14. · At visit 2 (day 1 of crossover), patients were randomised to 1 of 2 treatment sequences – pancrelipase followed by placebo or vice versa. · Each treatment was taken for 5 days. · Visit 3 took place at the end of the first crossover period (day 6 or 7). · There was a washout period of 3-14 days during which patients received their previous PERT. · Patients entered second crossover period at visit 4. · Dietary recording took place during each treatment period. GI symptoms were assessed.
Primary outcomes: · Primary – CFA – patients were administered 2 x 250mg doses blue food diet 72 hours apary marking beinning and end of each stool collection period. Stool colletions were performed during each crossover period.
Secondary outcomes · CAN · Clinical symptoms – Clinical Global Impression of disease symptoms. |
Results: · During pancrelipase treatment, the mean (SD) daily lipase dose was 4472 (743) units/g fat consumed (16,941 (3602) IU/kg body weight. Adherence was 100%. · Mean (SE) CFA values for pancrelipase and placebo were 82.8% (2.7%) and 47.4% (2.7%) respectively, for a treatment difference of 35.4% (p<0.001). · The mean (SA) CAN values for pancrelipase and placebo were 80.3% (3.2%) and 45.0% (3.2%) (p,0.001) respectively for a treatment difference of 35.3% (p<0.001). · Mean (SD) fat intake for pancrelipase and placebo was 338.3g (59.8) and 346.6 (53.1)g respectively and mean nitrogen intake was 44.6 (20.2) and 45.3 (18.6)g. · All stool characteristics were significantly improved and stool frequency was significantly reduced with pancrelipase compared wth placebo (all, p<0.001). Smyptoms of abdo pain, flatulence and stool consistency were less severe during receipt of pancrelipase compared with placebo. Symptoms remained stable on pancrelipase but worsened slightly on placebo. · TAEs were reported in 5 patients during pancrelipase treatment and 9 patients during placebo. No TEAEs were considered related to pancrelipase treatment whereas 4 patients had TEAEs considered related to placebo (GI symtpoms).
Conclusions: · Pancrelipase delayed release capsules were associated with improvements in CFA, CAN, stool properties and EPI symptoms compared with placebo. · Pancrelipase delayed release capsules appeared to be well tolerated. |
Author limitations: · Limited age range investigated. Small sample size. Appraiser limitations: · 12,000IU preparation n/a in Australia. |
|
Wooldrigde, 2009 |
NHMRC Level II
ADA Quality: Positive
|
Randomised double blind placebo controlled two treatment crossover design multicentre phase III trial
n=19
Inclusion criteria: · CF & PI · >7 years of age
Exclusion criteria: · Nil stated |
Intervention: · Patients in the randomised trial could receive an of the four dosage formulations of EUR 1008 (5000, 10000, 15000 and 20000 units of lipase/ capsule) with a starting dose of 1000 lipase /kg/meal and a targeted maximum dose of 2500 units of lipase/kg/meal and 4000 lipase / gram fat/ day. · Patients in the supplemental study were given the 5000 IU lipase/ capsule and were given 2000Iu lipase/kg/meal. Maximum daily dose was limited to 10000 lipase units/ kg.
Outcomes: · Safety & efficacy of PERT |
Results: · EUR 1008 treatment compared to placebo resulted in a significantly higher meal CFA 88.3% vs 62.8% p<0.001.
Conclusions: · EUR 1008 led to clinically and statistically significant improvements in CFA in the randomised study, and control of malabsorption and clinical symptoms in both studies.
|
Author limitations: · Nil
Appraiser limitations: · EUR 1008 not a product available in Aust & NZ. · Funding & design of study is an obvious conflict of interest. |
|
Borowtiz, 2012 |
NHMRC Level IV ADA Quality: Neutral
|
N=215 (36 withdrew)
Inclusion criteria: · PI · CF >7 yrs age · Able to take PERT capsules Exclusion criteria: · Pregnant/breastfeeding · Unwilling to use birth control · Hx fibrosing colonopathy, organ transplant, significant bowel resection, acute/chronic diarrhoeal illness unrelated to PI · Deranged LFT – liver transaminases >5 x upper limit of normal, bilirubin > 1.5 x upper limit of normal · Inability to discontinue enteral feeds · Known hypersensitivity to food additives · Pancreatic sufficiency |
Intervention: · Liprotamase 32,500 USP, 1 capsule mid meal x3 daily, 1 capsule with snacks twice daily. · The main meal dose was allowed to be increased from 1 – 2 capsules, based on strict criteria in study protocol, (steatorrhea, wt loss or lack of wt gain in paeds).
Primary Outcomes: · Evaluation of long term safety and tolerability of Liprotamase treatment in subjects with CF related EPI
Secondary Outcomes: · Nutritional status through serial measures of height, weight, BMI z scores at each time point, referenced to year 2000 CDC growth charts, as well as lung function FEV1.
|
Results: · Overall 211 (98.6%) of the 214 subjects experienced at least one treatment emergent adverse event (TEAE). · 36 (16.8%) of the subjects discontinued due to a TEAE. · There were another 33 withdrawals unrelated to study treatment. · 6 subjects (3%) had ALT values >5 times ULN, mostly transient. · Ht, wt & BMI z scores were relatively stable over the remaining treatment period. · FEV1 remained stable.
Conclusions: · Treatment with a mean 5.5 capsules daily of Liprotamase with meals &snacks for 12 months was safe & well tolerated in CF subjects with EPI. Liver enzymes were not elevated beyond
|
Author limitations: · Possible selection bias as investigators may have invited participants with GI symptoms.
Appraiser limitations: · Didn’t measure fat absorption in this study, only indirectly. · Possible Bias due to drug company involved in study design analysis and interpretation of data. · Almost 20% of participants withdrawing due to a TEAE is possibly an indication that some people don’t tolerate this enzyme · Author mentioned vitamin expected. Subjects maintained or gained weight & BMI z scores. Pulmonary function was maintained. levels mainly stable as evidence of absorption, but patients were on a ADEK vitamin supplement (supplied in the USA)
|
|
Wooldridge, 2014 |
NHMRC Level IV ADA Quality: Neutral
|
Prospective cohort study N=15 (3 withdrew) Multi-site (6) study of patients who had completed previous study and continued treatment with ZENPEP. 12 month open label follow up.
Inclusion criteria: · Between ages of 1 and 12 months diagnosed with CF · Needing PERT · Mmonoclonal fecal elastase >200 ug/g stool · Weight to length ratio >10th %ile, and clinically Stable
Exclusion criteria: · Weight to length ratio <10th %ile · Clinically unwell - Concomitant illness, acute URTI, or LRTI.
|
Intervention: · Ongoing clinical care - ZENPEP 3000 lipase (PERT)
Primary outcomes: · Safety - frequency, duration, and severity on treatment emergent adverse events (TEAE).
Secondary outcomes: · Growth parameters - weight, length, weight for age %ile, length for age %ile, weight for length %ile, & Z scores
|
Results:
Primary · 5 Patients experienced 15 TEAEs judged possibly (n = 13) or probably (n = 2) related to medication.
Secondary · Median body wt increased 7.8 kg to 11 kg. · Median body lgth was 68.5 cm increased to 81 cm. · Median wt for age %ile increased from 22nd to the 49th %ile. Median lgth for age %ile increased from the 36.5th %ile to 42nd. · Median wt for length %ile increased from the 41.5th to the 55.5th %ile. · Growth Z scores were variable. · Mean wt for lgth z scores positive at all treatment visits. · Median wt for lgth z scores positive at 6 and 12 months. · Although positive overall the improvement was not linear over time.
Conclusions: · Infants with CF safely tolerated long term Zenpep for up to 12/12. · Also wt for age %ile more than doubled |
Author limitations: · Pts with wt to length ratios >10th %ile were excluded · Small sample size
Appraiser limitations: · Nil |
|
Munck, 2009 |
NHMRC Level I ADA Quality: Positive
|
Prospective randomised study of crossover design N= 39
Inclusion criteria: · CF · PEI Exclusion criteria: · Meconium ileus · Intestinal resection · Severe concomitant diseases of other organs · Allergy to pancreatin · Auspected noncompliance of subject/family
|
Intervention: · Comparison of Creon 10,000 preparation (10000IU lipase per capsule) to Creon for Children preparation (5000IU lipase per scoop of granules)
Primary Outcome: · Parent’s treatment preference
Secondary outcomes: · Coefficient of fat absorption · Clinical symptoms and safety parameters
|
Results: · 51% of parents preferred CfC, 23% preferred C10 and 26% had no preference. · Mean CFA was similar for both 77.8% vs 78.7% · Safety and tolerability were good for both treatments · GIT symptoms- no clinically relevant differences. · Mean daily energy intake was 1100 kcal/day for a mean body weight of 10.1 kg. · Fat intake was about 40 g/day with comparable mean daily lipase intakes during the CfC and C10 phases (3969 vs. 4310 U/kg/day).
Conclusions: · Those parents who had a preference preferred CfC over C10, but both enzyme preparations improved malabsorption to a similar degree
· The mean faecal fat excretion was higher than desired (9.2 and 8.3 g per day during CfC and C10, respectively). |
Author limitations: · Applied dosages could have been too low in some children reflected in suboptimal CFA. · Parents may under report symptoms · No attempt was made to optimise creon dose before the randomisation
Appraiser limitations: · Parent preference is a very subjective primary outcome measure and the questionnaire used provided varying quality of responses. · Low clinical impact/relevance of patient preference for one preparation over the other given there were no significant differences found in actual safety, tolerability, GIT symptoms and CFA between preparations. Hence this study is just about ease of handling CfC.
|
|
Konstan, 2013 |
NHMRC Level II ADA Quality: Positive
|
Randomised, double blind, placebo controlled cross over N=21 CF children (>7years) and adults with confirmed PI Multicentre – 5 centres across USA
Inclusion criteria: · Children aged 7-18 yrs and adults with confirmed CF · PEI per faecal elastase · Currently receiving PERT. · ‘Adequate nutritional status’ per BMI
Exclusion criteria: · Major organ diseases or syndromes affecting digestion i.e. diabetes, liver, intestinal obstruction, IBD, pancreatitis. · Contraindication to porcine products, acute exac on recent Abx
|
Intervention: · Active study drug and identical placebo capsules. Treatment period (6-8days)-crossover/restabilisation (7-10 days)- placebo (6-8 days) OR vice versa. · Subjects individually stabilised to an EC- bicarb buffered PERT dose at home. · Individualised high fat diet (2g fat/kg/day) taken for entire comparison phase.
Primary outcomes: · 72hr stool collection under supervision in clinical research unit and day 3 & 6 of treatment. · Weighed and analysed for fat & nitrogen using NMR spectroscopy. CFA & CAN calculated.
Secondary outcomes: · Drug taken · Stool characteristics recorded in subject diary · Adverse event information collected during each study visit. |
Results: · Statistically significant improvement in fat & nitrogen absorption for active treatment vs placebo. · Mean co-efficient of fat absorption was 82.5% with Enteric coated bicarbonate buffered PERT, compared with 46.3% with the placebo. P=<0.001 · Overall stool frequency decreased by 40% and stool weight decreased by 50% p=<0.001. · No safety concerns were identified. · The most common adverse event was GI complaints and these were more common during placebo than active treatment and found not to be clinically meaningful.
Conclusions: · This unique enteric coated-bicarbonate buffered PERT is safe and effective in treating CF associated PEI.
|
Author limitations: · Bicarb buffered PERT product compared to placebo not a non-buffered PERT product
Appraiser limitations: · Compliance/outcome data · Intake at home, drug taken stool frequency and characteristics ‘recorded in subject diary’ by subject at home – potentially very subjective |
|
Brady, 2006 |
NHMRC Level II ADA Quality: Neutral
|
Prospective randomised controlled trial with crossover Design
N=18 CF patients with PI Aged 12.2-27.6 years
Inclusion criteria: · CF & PEI diagnosis · Consumption of large EC PERT >1000IU lipase/kg/meal · Fat excretion >15% of dietary fat intake when consuming 50% of usual enzyme dose · Adequate BMI · Mild lung disease · No Abx · No major organ disease that affects digestion or absorption.
Exclusion: Nil stated
|
Intervention: · A unique EC high-buffered pancrealipase formulation vs usual brand of EC nonbuffered PERT. · 7 days in each treatment group- 3 days at home washout followed by 4 days at GCRC of: · Controlled enzyme doses (at 50% of the subjects usual lipase dose & given immediately before meals and snacks) · Controlled food intake, weighted and recorded with even distribution of fat.
Primary Outcome: · Feacal fat excretion per and 72hrs of stool collection, which were counted weighed and analysed using a ravimetric method. Looked at faecal fat as a % of fat intake and g/kg/day
Secondary Outcome: · Coefficient of fat absorption % of intake · Nitrogen excretion |
Results: · Mean fat excretion decreased significantly in each subject during periods where EC high buffered pancrealipase compared with periods of EC non buffered enzymes. · Fat absorption 81.8% vs 75.1% respectively p=0.01 · 72% of patients (13/18 subjects) excreted less fat with EC high buffered PERT. Of these, 56% (10 subjects) decreased fat excretion by more than 5% (range 6-17%). · NB: >5% considered clinically significant (arbitrarily chosen cutoff). · However, 5 subjects (28%) did not respond to the EC high buffered PERT.
Conclusions: · EC high buffered pancrealipase decreased fat excretion, symbolising increased fat absorption, when compared to EC non buffered PERT given at equivalent, reduced lipase dose in nourished CF patients with mild lung disease.
|
Author limitations: · One patient did not adhere and their data was excluded. · Relatively small sample size · Some variability in fat intake · Open label study design= potential to bias subjective data. · Duodenal PH was not determined, thus explanation of the effect of bicarb in the gut is hypothetical and can’t explain mechanism of action. Eg: why 5 subjects did not have a response at all. · Short term study period
Appraiser limitations: · Mishandling of lab specimens requiring a 3rd study period for some subjects, which was completed as an outpatient, not in the centre. · 20 subjects was required for 90% power and only 18 analysable data sets were received. · Subjects usual enzyme brand varied between 6 different brands/capsule sizes |
|
Baker, 2005 |
NHMRC Level IV ADA Quality: Neutral
|
Retrospective cross sectional study
N= 1215
Inclusion criteria: · >4wks of age · CF diagnosis from accredited centres · Willingness to fill out questionnaire and collect small random stool specimen without stopping or changing PERT.
Exclusion criteria: · Acute diarrhoea · Surgically created enterostomy · Short bowel
|
Intervention: nil
Outcomes: · Primary- pancreatic sufficiency- faecal elastase. · Enzyme dosing, growth, abdominal pain, gassiness, constipation, number of stools.
|
Results: · <2yrs of age- 25% of PS patients had a weight and height <5th percentile compared with 8.8% of PI children. · From age 3-20 there was no difference in the distribution of BMI percentiles between PS and PI. · >20years of age- 41% of PS patients were of healthy BMI compared with 74% of the PI. · There was no relationship between PERT dosing and BMI. · There was no significant difference between patients with PS and PI in number of daily stools and dose of PERT had no effect on number of stools. · Gassiness and constipation were present significantly more in PI than PS patients. However higher PERD does did not decrease these symptoms.
Conclusions: · PERT does not correlate with growth or gastrointestinal symptoms. |
Author & appraiser limitations: · Nil |
|
Haupt, 2011 |
NHMRC Level III-2 ADA Quality: Positive
|
Retrospective study N=14482
Inclusion criteria: · 2-20 years of age · Taking PERT · CF Registry from January 1 2005 – December 31 2008 Exclusion criteria · Programs with <10 unique patients on enzyme supplementation were excluded from centre level analyses |
Intervention: · Nil Outcomes: · PERT dose - The highest reported enzyme dose on any encounter during the year. - Individual enzyme dose was compared for all patients at programs within the top and bottom BMI percentile quartiles. - Patient and centre level characteristics and median centre enzyme dose was also compared between top and bottom BMI-percentile performance quartiles. · Demographic and clinical factors that may be confounders associated with nutritional outcomes including age at diagnosis, sex, race, FEV1% predicted
|
Results: · 42561 patient visits from 14482 patients from 179 programs. · Highest quartile programs had a mean enzyme dose of 1755 lipase units/kg/meal (95% CI: 1722, 1788) compared with 1628 lipase units/kg/meal (95% CI: 1595, 1660) for lowest quartile ( P < .001). · 52% of patients in top quartile programs had enzyme doses greater than 2000 lipase units/kg/meal · The median (25th, 75th percentile) enzyme dose from the last visit of all patients was 1755 (1329, 2150) lipase units/kg/meal, and the average BMI percentile of all patients was the 45.2 percentile (SD 27.0%). · Although the top quartile programs' median enzyme dose was significantly higher than that of the bottom quartile, the median enzyme dose was lower than the maximum dose recommended by the CF foundation, ranging from 1787- 1836 lipase units/kg/meal, less than the maximum recommended dose of 2500 lipase units/kg/meal. · Note these values are less than the enzyme doses reported in the most recent CF Registry, reflecting the general trend of increased enzyme dose over time
Conclusions: · CF centres that prescribe higher average pancreatic enzyme dosing have better nutritional outcomes, as measured by average BMI percentile. · Even though the magnitude of difference in PERT dose may not appear large, only ∼150 lipase units/kg/meal, reducing minor malabsorption at each meal could enhance weight gain over time. |
Author limitations: · Adherence to PERT and other therapies, dietary recommendations, or other CF centre practices as unmeasured variables · Several statistically significant differences exist between the patient characteristics of lowest and highest quartile programs · Patients at top quartile programs were younger, despite not showing a statistically significant difference in age at diagnosis. Top quartile and bottom quartile patients also demonstrated statistically significant differences in height and weight for age percentile · Selection bias, information bias, and confounding · CF Registry is not designed to capture all adverse events of enzyme replacement therapy
Appraiser limitations: nil |

Research question PICO 4: Is there evidence to support the use of acid suppression medications to improve PERT efficacy for people with CF?
Evidence synthesis from Nutrition Guidelines for Cystic Fibrosis: in Australia and New Zealand, 2017
|
Citation |
Level (NHMRC) and quality (ADA) |
Study design and sample |
Intervention and outcomes |
Results & Conclusions |
Comments |
|
Van der Haak, 2016 |
NHMRC level: II
ADA: Positive |
Randomised, double blind crossover trial.
n=18 CF children (5-17yrs)
Inclusion criteria: · Confirmed CF · PI · Stable dose of PERT with satisfactory symptom control within current recommendations (500- 4000IU/g fat ≥ 6months) · Nil changes re dose during Study
Exclusion criteria: · Severe pulmonary disease · Previous GI surgery or meconium ileus · Enteral nutrition · Medication affect GI motility |
Aim to determine if PERT given after a meal, instead of before a meal, could result in improved lipase activity in CF children.
Primary intervention: · 13C-mixed triglyceride (13CMTG) breath test to assess pancreatic lipase activity when Creon (1333IU/g fat) given 10min prior to test meal vs. 10min after test meal. · Breath samples taken before meal & at 30min intervals for 360min
Secondary intervention: · 13C-octanoate breath test to assess gastric emptying · Breath samples taken before meal & at 15min intervals for 120mins then 30min intervals for 240mins · Light, low fat meal offered at 240min mark
Primary outcome: · Timing of PERT on lipase Activity
Secondary outcome: · Effect of gastric emptying on lipase activity |
Results:
Primary · No significant difference in PCDR with PERT before (32.5±10%) or after meal (31.2±13.7%) at 360min (p=0.68). · When PERT was taken after a meal, PCDR was higher in normal vs. fast GE (p=0.04) ** PCDR = percentage cumulative dose recovered
Secondary · 6/18 accelerated gastric emptying (37.3±5.4min) · 11/8 normal gastric emptying (55.7±15.2min) · 1/18 delayed gastric emptying (121.5min) · No significant difference in mean PCDR of 13C-MTG with PERT before or after meal in those with accelerated (p=0.06) or normal (0=0.31) gastric emptying · No correlation between gastric half emptying time and PCDR when PERT taken before (r= -0.29, p=0.24) vs. After (4=0.05, p=0.85) meal
Conclusions: · No difference in mean lipase activity when taking PERT 10 min before vs. after meal. · Changing timing of PERT can normalise lipase activity an and individual level. Gastric emptying rate may influence optimal timing of PERT. · In those with fast GE it may be beneficial to take PERT before a meal. |
Author limitations:
· Small sample size (unable to do sub-group analysis) · No concurrent control · Unable to assess intraindividual variability in results (13C-MTG only taken once at each time point) Appraiser limitations: · Patients recruited as inpatient or outpatient - No mention of if study was done in inpatient or outpatient setting - Potential impact of being unwell if done in inpatient setting · Children only (no young children/infants or adults) |

Risk of bias assessment diagnostic accuracy studies (QUADAS II, 2011)
Research question PICO 2: What is the diagnostic accuracy of the different laboratory tests to measure the fat absorption for the purpose of monitoring the dose setting of PERT.
|
Study reference |
Patient selection
|
Index test |
Reference standard |
Flow and timing |
Comments with respect to applicability |
|
Caras, 2011 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Yes
|
Is the reference standard likely to correctly classify the target condition? No
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? No
|
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: LOW |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: HIGH |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
|
Kent, 2018 |
Was a consecutive or random sample of patients enrolled? Yes
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Unclear
If a threshold was used, was it pre-specified? Yes
|
Is the reference standard likely to correctly classify the target condition? No
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: LOW |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: HIGH |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
|
Walkiowak, 2010 |
Was a consecutive or random sample of patients enrolled? unclear
Was a case-control design avoided? Yes
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes
If a threshold was used, was it pre-specified? Yes
|
Is the reference standard likely to correctly classify the target condition? No
Were the reference standard results interpreted without knowledge of the results of the index test? Yes
|
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? No |
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? No
Are there concerns that the target condition as defined by the reference standard does not match the review question? No |
|
|
CONCLUSION: Could the selection of patients have introduced bias?
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias?
RISK: LOW |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias?
RISK: HIGH |
CONCLUSION Could the patient flow have introduced bias?
RISK: LOW |
|
Exclusietabel PICO 2
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Somaraju 2016 |
Geen vergelijk klinische versus lab uitkomst waarden en geen meting accuratesse vetabsorptie testen: Er worden verschillende pancreasenzymsubstitutietherapieën met elkaar vergeleken maar niet in combinatie met wel of geen lab |
|
Lohr 2013 |
Geen vergelijk klinische versus lab uitkomst waarden en geen meting accuratesse vetabsorptie testen: We includeren alleen SR met een risk-of-biasbeoordeling, evidence-tabel(len) en zoekstrategie; dat is hier niet het geval. |
|
Drzymala 2013 |
Pools |
|
Wier 2011 |
Geen vergelijk klinische versus lab uitkomst waarden en geen meting accuratesse vetabsorptie testen |
|
van de vijver 2011 |
Vergelijking gaat over verschillende dosis PERT |
|
Trapnell 2011 |
Geen vergelijk klinische versus lab uitkomst waarden en geen meting accuratesse vetabsorptie testen |
|
Kuhn 2010 |
Geen vergelijk klinische versus lab uitkomst waarden en geen meting accuratesse vetabsorptie testen |
|
Graff 2010 |
Geen vergelijk klinische versus lab uitkomst waarden en geen meting accuratesse vetabsorptie testen |
|
Graff 2010 |
Geen vergelijk klinische versus lab uitkomst waarden en geen meting accuratesse vetabsorptie testen |
|
Trapnell 2009 |
Geen vergelijk klinische versus lab uitkomst waarden en geen meting accuratesse vetabsorptie testen |
|
Munck 2009 |
Geen vergelijk klinische versus lab uitkomst waarden en geen meting accuratesse vetabsorptie testen |
|
Colombo 2008 |
Geen vergelijk klinische versus lab uitkomst waarden en geen meting accuratesse vetabsorptie testen |
|
Kalnins 2006 |
Geen vergelijk klinische versus lab uitkomst waarden en geen meting accuratesse vetabsorptie testen: vergelijkt 2 soorten PERT |
|
Chung 2001 |
Commentaar |
|
Hunt 2000 |
Effectiviteit 1 soort PERT |
|
Durrie 1998 |
Beschrijvende review |
|
Amari 1997 |
Geen vergelijk klinische versus lab uitkomst waarden en geen meting accuratesse vetabsorptie testen |
|
Regele 1996 |
Geen vergelijk klinische versus lab uitkomst waarden en geen meting accuratesse vetabsorptie testen: vetbalans vs fecaal lipase en chymotripsine |
|
Taylor 1994 |
Beschrijvende review |
|
Beker 1994 |
Geen vergelijk klinische versus lab uitkomst waarden en geen meting accuratesse vetabsorptie testen: 2 dosis PERT vergelijken |
|
Chazalatte 1993 |
Geen vergelijk klinische versus lab uitkomst waarden en geen meting accuratesse vetabsorptie testen: Vergelijk in verschillende PERT |
|
Bowler 1993 |
Geen vergelijk klinische versus lab uitkomst waarden en geen meting accuratesse vetabsorptie testen |
|
Ansaldi 1988 |
Geen vergelijk klinische versus lab uitkomst waarden en geen meting accuratesse vetabsorptie testen: Creon vs pancreatine |
|
Petersen 1987 |
Geen vergelijk klinische versus lab uitkomst waarden en geen meting accuratesse vetabsorptie testen; vergelijkt 2 soorten PERT |
|
Calvo-Lerma 2017 |
Geen vergelijk klinische versus lab uitkomst waarden en geen meting accuratesse vetabsorptie testen |
|
Woestenenk 2015 |
Geen vergelijk klinische versus lab uitkomst waarden en geen meting accuratesse vetabsorptie testen: vetbalans uitkomsten onder PERT worden besproken |
|
Lindkvist 2015 |
Beschrijvend stuk |
|
Tardelli 2013 |
Elastase als ref standaard vs vetbalans/stetaocriet/slecte groei/ = geen goede ref standaard |
[1] In geval van een case-control design moeten de patiëntkarakteristieken per groep (cases en controls) worden uitgewerkt. NB; case control studies zullen de accuratesse overschatten (Lijmer et al., 1999)
[2] Comparator test is vergelijkbaar met de C uit de PICO van een interventievraag. Er kunnen ook meerdere tests worden vergeleken. Voeg die toe als comparator test 2 etc. Let op: de comparator test kan nooit de referentiestandaard zijn.
[3] De referentiestandaard is de test waarmee definitief wordt aangetoond of iemand al dan niet ziek is. Idealiter is de referentiestandaard de Gouden standaard (100% sensitief en 100% specifiek). Let op! dit is niet de “comparison test/index 2”.
4 Beschrijf de statistische parameters voor de vergelijking van de indextest(en) met de referentietest, en voor de vergelijking tussen de indextesten onderling (als er twee of meer indextesten worden vergeleken).
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 03-07-2020
Beoordeeld op geldigheid : 28-10-2019
Voor het beoordelen van de actualiteit van deze kwaliteitsstandaard is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepalen de besturen van de NVALT, NVK en NCFS of de modules van deze kwaliteitsstandaard nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de kwaliteitsstandaard heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de kwaliteitsstandaard komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVALT, NVK en NCFS zijn regiehouders van deze Kwaliteitsstandaard en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de modules. De andere aan deze kwaliteitsstandaard deelnemende wetenschappelijke verenigingen of gebruikers van de kwaliteitsstandaard delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
PERT |
NVK en NVALT |
2020 |
2015 |
Eens in de vijf jaar |
NVK en NVALT (in overleg met MDL werkgroep CF centra) |
- |
Algemene gegevens
Deze richtlijn is ontwikkeld in samenwerking met:
- Landelijke Vereniging Medische Psychologie
- Nederlands Instituut van Psychologen
- Nederlandse Vereniging van Diëtisten
De ontwikkeling van de medisch inhoudelijke modules binnen deze Kwaliteitsstandaard werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De module over psychosociale zorg en de organisatie van zorg modules werden ondersteund vanuit de Samenwerkende Ouder- en Patiëntenorganisaties (VSOP) en gefinancierd vanuit ZonMW. De financierders hebben geen enkele invloed gehad op de inhoud van de kwaliteitsstandaard.
Doel en doelgroep
Doel
Het tot stand brengen van een evidence-based kwaliteitsstandaard Cystic Fibrosis, een combinatie van een zorgstandaard en een medisch specialistische richtlijn om patiënten met Cystic Fibrosis optimale afgestemde zorg te bieden.
Doelgroep
De doelgroep zijn alle patiënten met Cystic Fibrosis. De kwaliteitsstandaard behelst de gebieden van diagnostiek, behandeling en follow-up conform de diverse stadia van de aandoening en de verschillende leeftijdscategorieën.
Samenstelling werkgroep
Voor het ontwikkelen van de kwaliteitsstandaard is in 2016 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met CF en vertegenwoordigers van de NCFS.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze kwaliteitsstandaard.
Werkgroep
- Drs. G.D. (George) Nossent, longarts, UMCG te Groningen, NVALT (voorzitter)
- Dr. O.W. (Onno) Akkerman, longarts, UMCG te Groningen, NVALT
- S. (Sigrid) Amstelveen-Bökkerink, diëtist, Radboud UMC te Nijmegen, NVD
- Dr. H.G.M. (Bert) Arets, kinderlongarts, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, NVK
- Dr. M. (Marleen) Bakker, longarts, Erasmus MC te Rotterdam, NVALT
- Drs. J.M.W. (Annemarie) van den Berg, longarts, Hagaziekenhuis te Den Haag, NVALT
- Dr. M.C. (Maaike) Berkhout, KNO arts, OLVG te Amsterdam, NVKNO
- Dr. F.A.J.A. (Frank) Bodewes, kinderarts-MDL, UMCG te Groningen, NVK
- A. (Annet) Bongen, maatschappelijk werker, UMC Utrecht te Utrecht, BPSW
- J. (Jacqueline) Boekhoff, maatschappelijk werker, Amsterdam UMC, locatie VUMC te Amsterdam, BPSW
- Drs. L.H. (Hassan) el Bouzzaoui, longarts, Hagaziekenhuis te Den Haag, NVALT
- D. (Dagmar) Brocke, maatschappelijker werker, UMC Utrecht te Utrecht, BPSW
- Drs. E.J. Brokaar, poliklinisch apotheker, Hagaziekenhuis te Den Haag, NVZA
- Dr. I. (Inez) Bronsveld, longarts, UMC Utrecht te Utrecht, NVALT
- Drs. A. (Agnes) Clement-de Boer, kinderarts (endocrinologie), Hagaziekenhuis te Den Haag, NVK
- W. (Wytze) Doeleman, fysiotherapeut, UMC Utrecht te Utrecht, KNFG
- Dr. M.M. (Menno) van der Eerden, longarts, Erasmus MC te Rotterdam, NVALT
- Prof. Dr. C.K. (Kors) van der Ent, Kinderlongarts, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, NVK
- Dr. B.C.T. (Boudien) Flapper, kinderarts-sociale pediatrie, UMCG te Groningen, NVK
- Dr. L. (Lianne) van der Giessen, kinderfysiotherapeut, Erasmus MC Sophia Kinderziekenhuis te Rotterdam, KNGF
- Drs. N. (Nanko) de Graaf, kinderradioloog, Erasmus MC te Rotterdam, NVvR
- Dr. V. (Vincent) Gulmans, Hoofd Onderzoek en Kwaliteit van zorg NCFS te Baarn, NCFS
- Prof. dr. H.G.M. (Harry) Heijerman, longarts, UMC Utrecht te Utrecht, NVALT
- Drs. D.M. (Danielle) Hendriks, kinderarts (MDL), Juliana Kinderziekenhuis te Den Haag, NVK
- Dr. J.J.E. Hendriks, kinderlongarts, Zuyderland Medisch Centrum te Heerlen, NVK
- Prof. dr. B. (Bart) van Hoek, MDL-arts, UMC te Leiden, NVMDL
- Drs. R.A.S. (Rogier) Hoek, longarts, Erasmus MC te Rotterdam, NVALT
- Dr. A. (Ageeth) Hofsteenge, kinderdiëtist, Amsterdam UMC, locatie VUMC en AMC, te Amsterdam, NVD
- Drs. C. (Chantal) Hoge, MDL arts, Maastricht UMC+ te Maastricht, NVMDL
- F.M. (Francis) Hollander, diëtist, UMC Utrecht, Utrecht, NVD
- Prof. dr. R.H.J. (Roderick) Houwen, kinderarts MDL, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, NVK
- Dr. J. (Jakko) van Ingen, arts microbioloog, Radboud UMC te Nijmegen, NVMM
- Dr. H.M. (Hettie) Janssens, (kinder)longarts, Erasmus MC Sophia Kinderziekenhuis te Rotterdam, NVK
- Drs. A.J. (Arjan) Jansz, arts microbioloog, Stichting PAMM te Eindhoven, NVMM
- H.J. (Hetty) van der Kamp, kinderarts-endocrinoloog, HMC Bronovo te Den Haag en Wilhelmina Kinderziekenhuis UMC Utrecht te Utrecht, NVK
- C. (Cora) de Kiviet, verpleegkundig specialist, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, V&VN
- A. (Annelies) Kok, verpleegkundig consulent, Erasmus MC te Rotterdam, CF Netwerk verpleegkundigen Nederland
- Dr. B.G.P. (Bart) Koot, kinderarts (MDL), Amsterdam UMC, locatie AMC te Amsterdam, NVK
- M.A. (Marian) Kruijswijk, verpleegkundig specialist, UMC Utrecht te Utrecht, V&VN
- Dr. C.J. (Christof) Majoor, longarts, Amsterdam UMC, locatie AMC te Amsterdam, NVALT
- R. (Renske) van der Meer, longarts, Hagaziekenhuis te Den Haag, NVALT
- Dr. P.J.F.M. (Peter) Merkus, kinderlongarts, Radboud MC te Nijmegen, NVK
- Dr. D. (Dick) Mul, kinderarts (endocrinologie), Diabeter te Rotterdam, NVK
- Drs. A.F. (Ad) Nagelkerke, kinderlongarts, Amsterdam UMC, locatie VUmc te Amsterdam, NVK
- drs. J. (Jacquelien) Noordhoek, directeur patiëntenorganisatie NCFS te Baarn, NCFS
- Marit van Oirschot-van de Ven, verpleegkundig specialist, UMC Utrecht te Utrecht, V&VN
- Dr. M (Marianne) Nuijssink, kinderlongarts, Haga ziekenhuis te Den Haag, NVK
- Dr. M.H.E. (Monique) Reijers, longarts, Radboudumc te Nijmegen, NVALT
- Dr. S. (Sietze) Reitsma, KNO-arts, Amsterdam UMC, locatie AMC te Amsterdam, NVKNO
- Prof. dr. Y.B. (Yolanda) de Rijke, afdelingshoofd Klinische Chemie, Erasmus MC te Rotterdam, NVKC
- Dr. B.L. (Bart) Rottier, kinderlongarts, UMCG te Groningen, NVK
- R.A. (Revka) Schrijver, verpleegkundig consulent, Hagaziekenhuis te Den Haag, CF Netwerk verpleegkundigen Nederland
- Drs. L. (Luciënne) Speleman, KNO arts, Wilhelmina Kinderziekenhuis en UMC Utrecht, te Utrecht, NVKNO
- Dr. S.W.J. (Suzanne) Terheggen-Lagro, kinderlongarts, Amsterdam UMC, locatie AMC te Amsterdam, NVK
- Prof. dr. H.A.W.M (Harm) Tiddens, (kinder)longarts, Erasmus MC Sophia Kinderziekenhuis te Rotterdam, NVK
- H. (Hilda) Vale-Eeman, kinderverpleegkundige, Amsterdam UMC, locatie AMC te, Amsterdam, V&VN
- Dr. H. (Hester) van der Vaart, longarts UMCG te Groningen, NVALT
- Dr. H.W. (Harold) de Valk, internist-endocrinoloog UMCU te Utrecht, NIV
- Dr. M. (Marieke) Verkleij, GZ-psycholoog/cognitief gedragstherapeut, Amsterdam UMC, locatie VUMC te Amsterdam, VGCT
- Dr. E.J.M. (Els) Weersink, longarts, Amsterdam UMC, locatie AMC te Amsterdam, NVALT
- M. (Marion) Wessels, Verpleegkundige, UMC Utrecht te Utrecht, V&VN
- Dr. B.J. (Barbara) Wijnberg-Williams, klinisch psycholoog, UMCG te Groningen en Isala Ziekenhuis te Zwolle, NIP
- Dr. K.M. (Karin) de Winter- de Groot, kinderlongarts, Wilhelmina Kinderziekenhuis en UMC Utrecht te Utrecht, NVK
- Dr. P.J.G. (Petra) Zwijnenburg, klinisch geneticus, Amsterdam UMC, locatie VUMC te Amsterdam, VKGN
Met ondersteuning van
- Dr. F. (Floor) Willeboordse, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Ir. T. (Teus) van Barneveld, directeur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. A. (Anne) Speijer, coördinator kwaliteit van zorg, VSOP
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Drs. G.D. (George) Nossent (voorzitter) |
Longarts UMCG |
Bestuurslid NVALT |
Geen |
Geen actie |
|
O. Akkerman |
Longarts, fulltime, UMCG |
Lid nascholingscommissie VvAwT; onbetaald Lid visitatieteam TBC screening LRCB; onbetaald |
Geen |
Geen actie |
|
S. Amstelveen-Bokkerink |
Diëtist Radboudumc Dekkerswald |
Geen |
Geen |
Geen actie |
|
B. Arets |
Kinderlongarts, UMC Utrecht |
Academisch kinder(long)arts, deels Associate Professor Medisch Onderwijs Universiteit.
|
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
M. Bakker |
Longarts, Erasmus MC Rotterdam |
Geen |
Deelname aan diverse studies Vertex (chloortransportmodulatoren) |
Geen trekker van module CFTR modulatoren (wel meelezer).
Toelichting op onderzoek gesponsord door Vertex: Betrokken bij inclusie van patiënten en dataverzameling. Niet betrokken bij data-analyse, wel principal investigator, geen auteur. |
|
T. van Barneveld |
Directeur Kennisinstituut Federatie Medisch Specialisten |
|
Geen |
Geen actie |
|
A. van den Berg |
Longarts Hagaziekenhuis Den Haag |
Geen |
Geen |
Geen actie |
|
M. Berkhout |
KNO-arts in opleiding in het Academisch Medisch Centrum Amsterdam. Opleider: Prof. dr. F.G. Dikkers |
Geen |
Geen |
Geen actie |
|
F. Bodewes |
Kinderarts-MDL UMC Groningen |
Geen |
Geen |
Geen actie |
|
J. Boekhoff |
medisch maatschappelijk werker Amsterdam UMC, locatie VUmc |
Geen |
Geen |
Geen actie |
|
A. Bongen |
Medisch maatschappelijk werker UMC Utrecht |
Geen |
Geen |
Geen actie |
|
H. Bouazzaoui |
Longarts Hagaziekenhuis Den Haag |
Geen |
Geen |
Geen actie |
|
D. Brocke |
Medisch maatschappelijk werk UMC Utrecht Divisie Hart en Longen |
Geen |
Geen |
Geen actie |
|
E. Brokaar |
Poliklinisch apotheker in de Haga Apotheek, HagaZiekenhuis |
Geen |
Gedeeltelijke vergoeding voor internationaal CF congres door Novartis (2012 en 2014) |
Geen actie |
|
I. Bronsveld |
Pulmonoloog UMC Utrecht |
Geen |
Geen |
Geen actie |
|
A. Clement - Boers, de |
Kinderarts, diabetes HAGA/Julianaziekenhuis Den Haag |
Voorzitter Stichting D-Support (ondersteuning voor gezinnen met diabetes) onbetaald |
Geen |
Geen actie |
|
W. Doeleman |
Fysiotherapeut UMC-Utrecht |
Geen |
Geen |
Geen actie |
|
H. Eeman |
Kinderverpleegkundig consulent CF Werkgever: Academisch Medisch Centrum Amsterdam |
Geen |
Geen |
Geen actie |
|
M. Eerden |
Longarts Erasmus MC |
Geen |
Geen |
Geen actie |
|
K. van der Ent |
Kinderarts, hoogleraar kinderlongziekten UMC Utrecht |
|
Onderzoeksubsidies afgelopen vijf jaar:
Instituut heeft betalingen ontvangen voor klinische studies en adviesraad bijeenkomsten van Gilead, Vertex, GSK, Nutrica, TEVA, ProQR, Galapagos en Proteastasis.
|
Gemelde belangen en nevenfuncties zijn besproken met initiatief nemende verenigingen NVALT en NVK.
Deelname in werkgroep als meelezer bij alle modules op basis van expertise over CF.
Geen trekker van modules over CFTR modulatoren waarvoor er financiële belangen zijn. |
|
B. Flapper |
Kinderarts, sociale pediatrie |
Geen |
Geen |
Geen actie |
|
L. van der Giessen |
0,8 Kinderfysiotherapeut Erasmus MC Sophia 0,1 Coordinator onderwijs Erasmus MC 0,1 docentbegeleiding Erasmus MC |
B. Gastdocent Hogeschool Rotterdam Post HBO kinderfysio B. Cursusleider NPI B. Gastdocent Maas en Meer (B=betaald) |
Geen |
Geen actie |
|
V. Gulmans |
Hoofd onderzoek en kwaliteit van zorg bij Nederlandse Cystic Fibrosis Stichting |
Geen |
Geen persoonlijke vergoedingen. De NCFS heeft corporate sponsorovereenkomsten met meerdere bedrijven (farmaceuten en hulpmiddelen). De overeenkomsten zijn aangemeld bij het transparantieregister. De totale sponsorinkomsten bedragen niet meer dan 10 % van de totale NCFS-begroting. De sponsors hebben geen invloed op de inhoud van NCFS-uitingen. |
Geen actie |
|
H. Heijerman |
Longarts, hoofd afdeling longziekten UMC Utrecht. |
|
|
Gemelde belangen en nevenfuncties zijn besproken met initiatief nemende verenigingen NVALT en NVK.
Deelname in werkgroep als meelezer bij alle modules op basis van expertise over CF.
Geen trekker van modules over CFTR modulatoren waarvoor advies is gegeven. |
|
D. Hendriks |
kinderarts-maagdarmleverziekten Juliana Kinderziekenhuis/Hagaziekenhuis Den Haag |
Geen |
Geen |
Geen actie |
|
H. Hendriks |
kinderarts-longarts in Zuyderland MC en 0,1 fte gedetachteerd naar MUMC + voor CF zorg. |
Geen |
Geen |
Geen actie |
|
B. Hoek |
gastroenteroloog en hepatoloog, LUMC Hoogleraar |
Geen |
Geen gesponsord onderzoek op het gebied van CF. Bij genoemde studies mogelijk auteur en: Novartis: PI, inclusie patiënten Zambon: PI, design studies, data analyse Chiesi: design studie, patiënt inclusie, data analyse Abbvie, Norgine, Astellas: patiënt inclusie CLIF: patiënt inclusie Perspectum: patiënt inclusie, design deel van studie Organ Assist: PI, patiënt inclusie Novartis - deelname aan internationale medicijnstudie bij auto-immuun hepatitis Zambon-unrestricted grant voor onderzoek naar auto-immuun hepatitis en overlap syndromen Chiesi - investigator-initiated studie naar farmacoklnetiek van Envarsus (tacrolimus) na levertransplantatie Abbvie - studie naar langetermijn effect op leverfibrose na DAA behandeling van hepatitis C Norgine - deelname aan rifaximin bij hepatische encefalopathie studie CLIF consortium - deelname aan internationale studies naar accuut - op chronisch leverfalen Perspectum - studies naar nieuew NRI technieken bij leverziekte en na levertransplantatie Astellas - deelname aan immuunsuppressie studie na levertransplantatie OrganAssist - deelname aan studie met machineperfusie voor levertransplantatie |
Geen actie |
|
R. Hoek |
Longarts Erasmus MC Centrum voor Longtransplantatie Centrum voor Cystic Fibrosis en Recidiverende Luchtweginfecties |
Nederlands Transplantatievereniging
allen onbezoldigd |
Geen |
Geen actie |
|
A. Hofsteenge |
Dietist: CF-team (kindergeneeskunde) (Vumc en AMC) Kindergeneeskunde (polikliniek) (VUmc) |
Geen |
Geen |
Geen actie |
|
C. van Hoge |
Maag- darm- leverarts MUMC+ |
Geen |
Geen |
Geen actie |
|
F. Hollander-Kraaijeveld |
Diëtist UMC Utrecht |
Geen |
Geen |
Geen actie |
|
R. Houwen |
Hoofd afdeling kinder-MDL UMCU/WKZ |
De (poli)klinische zorg voor patienten met MDL problematiek, het geven van onderwijs alsmede het vooruitbrengen van de zorg en kennis op dit gebied, onder meer door (meewerken aan) publicaties. Tevens aansturen van de subafdeling kinder-MDL. Deze taken worden verricht in een 100% dienstverband. |
|
Geen actie |
|
J. van Ingen |
Arts-microbioloog, Radboudumc, Nijmegen |
Geen |
Mede-auteur van de internationale richtlijn voor diagnostiek en behandeling van niet-tuberculeuze mycobacterieën bij pantiënten met CF (Floto, 2016). |
Geen actie |
|
H. Janssens |
Kinderlongarts, Erasmus MC/Sophia Kinderziekenhuis |
Voorzitter CF-team Sophia |
Co-promotor bij meerdere studies gefinancierd door unrestricted grant van Chiesi en Gilead. |
Geen actie, meelezer bij module over behandeling P.Aeruginosa (Gilead, Chiesi), geen trekker.
Toelichting gesponsorde onderzoeken. -Studies van Chiesi en Gilead waren met een unrestricted grant, financieen gerund door Sophia BV. De aard van de studies kon door het onderzoeksteam vrij ingevuld worden en gepubliceerd. -Deelname centrum aan sponsor initiated studies van Vertex, en Gilead. Geen mede-auteur. Als voorzitter van CF-team verantwoordelijk voor uitvoer van de studie, en beoordeling adverse events en lab uitslagen van deelnemende patiënten. |
|
A. Jansz |
arts-microbioloog, St PAMM, streeklaboratorium voor de volksgezondheid Veldhoven |
Coördinerend arts-microbioloog, RIVM/IDS, Bilthoven, een detachering van 20% auditor voor de RvA |
Geen |
Geen actie |
|
H. van der Kamp |
kinderarts-endocrinoloog (0,7 fte) werkzaam in het WKZ Utrecht en in het Bronovo ziekenhuis in Den Haag (0,15 fte). |
Lid bestuur NVE (onbetaald) Lid adviesgroep groeihormoon (onbetaald) Lid adviesgroep neonatale screening AGS & CHT (onbetaald) |
Geen |
Geen actie |
|
C. de Kiviet |
Verpleegkundig Specialist Bij CF-centrum UMC Utrecht, locatie WKZ |
Lid van Accreditatiecommissie Van de RSV (Register Verpleegkundig Specialismen) >Vacatievergoeding per bijeenkomst -Beoordelaar scholing voor herregistratie Verpleegkundig Specialisten > Vergoeding per beoordeelde scholing |
Geen |
Geen actie |
|
A. Kok |
verpleegkundig consulent CF Erasmus MC-Sophia Rotterdam |
Geen |
Geen |
Geen actie |
|
B. Koot |
kinderarts AMC Amsterdam |
Bestuur sectie kinder MDL, NVK, onbetaald |
Geen |
Geen actie |
|
M. Kruiswijk |
verpleegkundig specialist afdeling Cystic Fibrosis |
Geen |
Geen |
Geen actie |
|
C. Majoor |
Longarts, Amsterdam UMC, locatie AMC |
|
Inclusie patiënten aan fase IIa, IIb, III en IV studies van Vertex en Galapagos |
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
R. van der Meer |
Longarts, aandachtsgebied Cystic Fibrose. Werkzaam in Hagaziekenhuis. Den Haag. |
Geen |
Geen |
Geen actie |
|
P. Merkus |
Kinderarts-pulmonoloog, Radboudumc Amalia Kinderziekenhuis |
|
Deelname Studies bij CF door farmaceutische bedrijven: Vertex, PTC (PI, betrokken bij inclusie, betrokken bij data-analyse) |
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
D. Mul |
Kinderarts-endocrinoloog bij Diabeter |
|
Geen |
Geen actie, trekker module diabetes (screening en behandeling)
Toelichting op deelname adviesraad medisch Novo Nordisk: conflicteert niet met trekkersrol van diabetes modules. |
|
A. Nagelkerke |
Kinderlongarts VU medisch centrum |
Geen |
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is.
|
|
J. Noordhoek |
Directeur Nederlandse Cystic Fibrosis Stichting |
|
|
Geen actie |
|
M. Nuijsink |
Kinderarts Juliana Kinderziekenhuis/ HAGA ziekenhuis |
Geen |
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
M. van Oirschot-van de Ven |
Kinderverpleegkundig consulent CF, Academisch Medisch Centrum Amsterdam |
Geen |
Geen |
Geen actie |
|
M. Reijers |
Longarts, Radboud UMC, Nijmegen |
|
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is.
|
|
S. Reitsma |
KNO-arts AMC Amsterdam |
Geen |
Geen |
Geen actie |
|
Y de Rijke |
Afdelingshoofd Klinische Chemie Erasmus MC te Rotterdam |
Geen |
Geen |
Geen actie |
|
B. Rottier |
UMC Groningen, kinderlongarts |
Geen |
Geen |
Geen actie |
|
R. Schrijver |
Verpleegkundig consulent CF Hagaziekenhuis |
Geen |
Geen |
Geen actie |
|
A. Speijer |
Coördinator kwaliteit van zorg |
Lid advies - en expertcommissie AQUA van Zorginstituut Nederland.
|
Geen |
Geen actie |
|
L. Speleman |
paediatrische KNO, UMC Utrecht Wilhelminakinderziekenhuis |
|
Geen |
Geen actie |
|
S. Terheggen-Lagro |
Kinderlongarts AMC |
|
Geen |
Geen actie |
|
H. Tiddens |
Kinderlongarts, Erasmus MC, Sofia kinderziekenhuis
|
|
|
Geen actie, meelezer bij module over behandeling P.Aeruginosa geen trekker.
Toelichting gesponsorde onderzoeken. iABC: Co-investigator, CT aquisitie, analyse van CTs, geen betrokkenheid bij inclusie van patiënten ALPINE II: betrokken bij inclusie van patiënten |
|
H. van der Vaart |
Longarts UMCG |
Geen |
Geen |
Geen actie |
|
H. de Valk |
Internist-endocrinoloog, UMC Utrecht |
|
Geen |
Geen actie |
|
H. Verkade |
Kinderarts MDL, UMCG Groningen |
|
Geen |
Geen actie |
|
M. Verkleij |
GZ-psycholoog/cognitief gedragstherapeut, Amsterdam UMC locatie VUmc |
Geen |
Geen |
Geen actie |
|
E. Weersink |
longarts, AMC Amsterdam |
Geen |
|
Geen actie
Toelichting: Niet direct betrokken bij module waarop de potentiële belangenverstrengeling van toepassing is. |
|
M. Wessels-Bakker |
Verpleegkundig Specialist Longtransplantatie, onderzoeker |
Geen |
Geen |
Geen actie |
|
B. Wijnberg-Williams |
Klinisch psycholoog/medisch psycholoog, richting kinderen en jeugdigen, UMCG (0,4 fte) en Isala ziekenhuis (0,7fte) |
Lid van Accreditatiecommissie Federatie van Gezondheidszorgpsychologen en Psychotherapeuten (FGzPt) (vacatiegelden) |
Geen |
Geen actie |
|
F. Willeboordse |
Adviseur Kennisinstituut Federatie Medisch Specialisten |
Geen |
Via werk partner aandelen bij moederbedrijf Johnson & Johnson. Partner is werkzaam bij Janssen Vaccines BV. |
Geen actie |
|
K. Winter-de Groot |
kinderarts-pulmonoloog WKZ/UMC Utrecht |
|
Geen |
Geen actie |
|
P. Zwijnenburg |
kinderarts-klinisch geneticus VUMC afd. klinische genetica |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door deelname aan de werkgroep van de patiëntenorganisatie NCFS en de VSOP voor zeldzame en genetische aandoeningen. De uitgangsvragen zijn getoetst via een online peiling onder patiënten en ouders. Voor sommige onderwerpen is het patiënten-panel van de NCFS geraadpleegd om input te verkrijgen over patiëntenvoorkeuren over een behandeling of screeningsmethode.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de kwaliteitsstandaarden de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de kwaliteitsstandaard in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
Deze medisch inhoudelijke modules in deze kwaliteitsstandaard is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Voor de modules over psychosociale zorg en de modules over organisatie van zorg is er volgens de AQUA methode gewerkt: GRADE. De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie https://www.gradeworkinggroup.org/docs/Criteria_for_using_GRADE_2016-04-05.pdf).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de stuurgroep en de adviseur de knelpunten. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten. Tevens zijn er knelpunten aangedragen door VSOP, NCFS, NVK, NVALT, Patiëntenfederatie, Lareb, NVMDL, ZiN, ZN, NIP, NVKNO, VKGN, Vereniging innovatieve geneesmiddelen, NVKC, V&VN, NVMM, KNGF, NIV, NVvR, NVD, NVAB, NVZA via een invitational conference.
De concept uitgangsvragen zijn door de NCFS online voorgelegd aan mensen met CF en ouders van kinderen met CF. Vrijwel alle uitgangsvragen werden door tenminste 85% van de 68 respondenten als zinvol tot zeer zinvol ervaren. Bij twee vragen was dit percentage lager (56% respectievelijk 72%), veroorzaakt door het feit dat 25% van de respondenten bij deze vragen geen mening had.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de stuurgroep en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er is voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Voor deze kwaliteitsstandaard was de Europese Best Practice richtlijn van de ECFS (Castellani, 2018) een belangrijk uitgangspunt voor bijna alle modules.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de kwaliteitsstandaard is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Indicatorontwikkeling
De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn omdat er geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Castellani C, Duff AJA, Bell SC, Heijerman HGM, Munck A, Ratjen F, Sermet-Gaudelus I, Southern KW, Barben J, Flume PA, Hodková P, Kashirskaya N, Kirszenbaum MN, Madge S, Oxley H, Plant B, Schwarzenberg SJ, Smyth AR, Taccetti G, Wagner TOF, Wolfe SP, Drevinek P. ECFS best practice guidelines: the 2018.
revision. J Cyst Fibros. 2018 Mar;17(2):153-178. doi: 10.1016/j.jcf.2018.02.006. Epub 2018 Mar 3. Review.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
1987 – april 2018
|
1 Cystic Fibrosis/ or (cystic adj3 fibros*).ti,ab,kf. or (pancreatic adj3 fibros*).ti,ab,kf. or mucoviscidos*.ti,ab,kf. (46233) 2 exp Enzyme Therapy/ or exp Enzyme Replacement Therapy/ or 'pancreatic enzyme replacement therapy'.ab,ti. or pert.ab,ti. or 'pancreatic enzyme substitution '.ab,ti. (2085) 3 exp breath tests/ or exp clinical laboratory techniques/ or laborator*.ab,ti. or test*.ab,ti. or lipid*.ab,ti. or breath.ab,ti. or 'fecal elastase'.ab,ti. or 'fat balance'.ab,ti. or ((fat or lipid) adj2 (excret* or absor*)).ab,ti. or 'feces analysis'.ab,ti. (5450333) 4 1 and 2 and 3 (78) 5 limit 4 to (english language and yr="1987 -Current") (71) 6 5 not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (68)
= 68 (67 uniek) |
173 |
|
Embase (Elsevier) |
(('cystic fibrosis'/exp OR ((cystic* NEAR/3 fibros*):ti,ab) OR ((pancreatic NEAR/3 fibros*):ti,ab) OR mucoviscidos*:ti,ab)
AND ('pancreas enzyme'/exp OR 'pancreatic enzyme replacement therapy'/exp OR 'pancreatic enzyme replacement therapy':ab,ti OR pert:ab,ti OR 'pancreatic enzyme substitution':ab,ti))
AND ('laboratory test'/exp OR laborator*:ab,ti OR test*:ab,ti OR 'lipid absorption'/exp OR lipid*:ab,ti OR 'breath analysis'/exp OR breath:ab,ti OR 'feces lipid'/exp OR 'fecal elastase':ab,ti OR (((fat OR lipid) NEAR/2 (excret* OR absor* OR malabsor*)):ab,ti) OR 'feces analysis'/exp OR 'feces analysis':ab,ti)
AND [1987-2018]/py AND [english]/lim)
AND (('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)))
AND (('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it))
AND ('clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti)))
= 150 (144 uniek) |
Zoekstrategie PICO 1,3,4:
1 cystic fibrosis/ (56062)
2 limit 1 to (english language and yr="2002 - 2015") (32138)
3 (pancreatic insufficiency or pancreas insufficiency).mp. [mp=title, abstract, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] (5072)
4 exp enzyme therapy/ or enzyme therapy.mp. [mp=title, abstract, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] (8538)
5 (pancreatin or exocrine secretion or pancreas or pancreas disease or pancrelipase or cystic fibrosis or pancreas enzyme or chronic pancreatitis or pancrease exocrine insufficiency or pancreatic exocrine insufficiency or kreon).mp. [mp=title, abstract, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] (365781)
6 (patient or pancreas insufficiency or triacylglycerol lipase or cystic fibrosis or pancreas enzyme or kreon or pancreatic enzyme replacement therapy or enzyme replacement or pancrelipase).mp. [mp=title, abstract, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword] (4216183)
7 2 and 3 (1142)
8 2 and 3 and 5 (1142)
9 2 and 3 and 4 and 5 and 6 (154)