Antipyretica bij kind met koorts
Uitgangsvraag
Welke therapie met antipyretica (duur, toedieningsvorm, dosering, bijwerkingen, kosten) is het meest effectief bij kinderen met koorts om de lichaamstemperatuur te verlagen en het welzijn van het kind te verbeteren, in vergelijking met een placebo, geen behandeling of een alternatieve behandeling?
Aanbeveling
Het gebruik van antipyretica is alleen geïndiceerd bij kinderen met koorts die onwel of ongemakkelijk overkomen. Er is geen indicatie voor routinematig voorschrijven van antipyretica met als enige doel de temperatuur te verlagen bij kinderen met koorts die niet ziek overkomen.
Zowel paracetamol als ibuprofen kunnen worden gebruikt om de temperatuur te verlagen bij kinderen met koorts.
Voor de dosering van paracetamol en ibuprofen wordt verwezen naar het Kinderformularium, NKFK.
Antipyretica voorkomen koortsconvulsies niet en antipyretica horen niet gegeven te worden ter preventie van koortsconvulsies.
De wensen en overtuigingen van de ouders dienen te worden meegenomen in de overwegingen om antipyretica voor te schrijven.
Alternatieve manieren, zoals het afsponzen met lauw water, werken niet om de temperatuur te verlagen; deze maatregelen vergroten daarnaast het ongemak van de kinderen.
Advies over kleding moet gericht zijn op comfort van het kind, niet gericht op het beïnvloeden van de lichaamstemperatuur.
Er wordt bij voorkeur één antipyretisch middel tegelijk gegeven.
Er is geen indicatie voor routinematig alternerend voorschrijven van paracetamol en ibuprofen aan kinderen met koorts. Het geven van een ander antipyreticum kan worden overwogen als het antipyreticum van eerste keus geen effect heeft. Alternerend gebruik van paracetamol en ibuprofen is echter wel veilig en kan op indicatie gebruikt worden indien de klinische presentatie persisteert of recidiveert voor de volgende dosis.
Vanwege mogelijke verergering van huidcomplicaties is het advies NSAIDs en acetylsalicylzuur te vermijden bij varicella infecties (waterpokken of gordelroos). Acetylsalicylzuur dient vermeden te worden bij waterpokken of influenza vanwege de kans op optreden van het syndroom van Reye.
In het geval dat een kind antipyretica heeft gekregen:
- Dienen zorgverleners, bij het maken van onderscheid tussen ernstige en niet-ernstige aandoeningen, niet te vertrouwen op (gebrek aan) temperatuurverlaging na 1-2 uur.
- Dient het beloop van ‘oranje’ of ‘rode’ alarmsymptomen (#Tabel 1) bij kinderen te worden geëvalueerd te worden na 1-2 uur.
Overwegingen
Veel beschikbare literatuur gaat over het verlagen van koorts, wat de werkgroep geen primair doel vindt bij een kind met koorts (uitgangsvraag 13, module 'Indicatie voor empirische antibiotische behandeling bij het kind met koorts'). Verbetering van het welbevinden van het kind met koorts is volgens de werkgroep belangrijker, maar daar geeft de literatuur eigenlijk geen bewijs voor.
Er is geen bewijs voor de voorspellende waarde van reactie op antipyretica voor SBI.
Er zijn geen studies over herbeoordelingen na antipyretica, bijvoorbeeld of bepaalde alarmsymptomen binnen een bepaald tijdsbeloop verdwijnen.
Er zijn in ieder geval weinig bijwerkingen van antipyretica bekend.
De werkgroep is van mening dat de kans op intoxicatie door paracetamol laag is. Aan de andere kant is paracetamolintoxicatie wel de meest frequente oorzaak voor leverschade bij kinderen.
In tegenstelling tot de resultaten uit de besproken reviews zijn in de Lareb databank frequenter gastrointestinale bijwerkingen voor ibuprofen gerapporteerd dan voor paracetamol.
Eventuele kostenoverwegingen zoals verwoord in de NICE, nemen niet de mogelijkheid van suppositoria mee, zoals veel gebruikt in Nederland. Vanuit het perspectief van de zorgverzekeraar/gezondheidszorg zal het kostenaspect voor zelfzorgmiddelen (zoals antipyretica) niet relevant zijn.
Hoewel een combinatie van ibuprofen en paracetamol effectiever lijkt in het verlagen van lichaamstemperatuur dan paracetamol alleen lijkt dit voordeel klinisch niet relevant. Dit lijkt ook te gelden voor het afwisselend geven van ibuprofen en paracetamol. Er is nog steeds onvoldoende bewijs dat een combinatie of het alternerend geven van ibuprofen en paracetamol beter werkt dan monotherapie met alleen ibuprofen of paracetamol. In de studies worden geen ernstige bijwerkingen aangetoond; het geven van meerdere middelen kan echter leiden tot doseringsfouten door ouders.
Onderbouwing
Conclusies
|
Niveau* |
|
|
1 |
Er is een marginaal voordeel voor het gecombineerd toedienen van ibuprofen en paracetamol ten opzichte van paracetamol als monotherapie om de lichaamstemperatuur te verlagen. Er is onvoldoende bewijs voor het effect op het welzijn van het kind.
Er is ook een marginaal voordeel voor het afwisselend toedienen van ibuprofen en paracetamol ten opzichte van paracetamol of ibuprofen als monotherapie om de lichaamstemperatuur te verlagen. Er is onvoldoende bewijs voor het effect op het welzijn van het kind. A1 systematische review van Purssell et al. [105] A1 systematische review van Nabulsi et al. [109] |
|
1 |
Ibuprofen heeft in ieder geval een even goede antipyretische werking als paracetamol. A1 systematische review van Pierce et al. [111] |
|
1 |
Paracetamol en ibuprofen zijn beide veilig en worden beide goed verdragen, zowel als monotherapie als in combinatie. A1 systematische review van Purssell et al. [105] A1 systematische review van Nabulsi et al. [109] A1 systematische review van Pierce et al. [111] A1 systematische review van en Southey et al. [110] |
|
1 |
Paracetamol is even effectief in het verlagen van de lichaamstemperatuur in orale als in rectale toedieningsvorm. A1 systematische review van Goldstein et al. [112] |
* Zie Verantwoording: Werkwijze.
Samenvatting literatuur
Na de NICE-richtlijn zijn er vijf systematische reviews verschenen die relevant zijn voor deze uitgangsvraag. Ze worden hieronder beschreven en zijn samengevat in de evidencetabel.
Purssell et al. [105] voerden een systematische review uit naar het effect van het gebruik van paracetamol, ibuprofen of een combinatie van beide bij kinderen met koorts. Zij includeerden 7 gerandomiseerde gecontroleerde klinische trials van goede tot zeer goede kwaliteit, die waren uitgevoerd onder poliklinische en opgenomen kinderen en kinderen in de thuissituatie. In totaal werden 907 kinderen met koorts > 6 maanden (range 3 maanden – 14 jaar) geïncludeerd in deze studies; de grootste trial betrof een trial met 3 interventiegroepen (paracetamol vs. ibuprofen vs. paracetamol plus ibuprofen) met in totaal 464 kinderen van 6 maanden tot 3 jaar. Koorts werd in de studies verschillend gedefinieerd. In de studie met de laagste afkapwaarde voor koorts moest een axillaire temperatuur van 37,8ºC of hoger zijn gemeten. In de andere studies varieerde dit van 38,0ºC of hoger tot en met 38,5ºC of hoger. Ook verschilden de studies onderling in dosering en frequentie van de medicatie: paracetamol werd eenmalig of van 1 tot 6 keer per dag gegeven in een dosering van 10 – 15 mg/kg; ibuprofen werd eenmalig of van 1 tot 4 keer per dag gegeven in een dosering van 5 – 15 mg/kg. Zes van de zeven studies beschreven als uitkomstmaat het effect van antipyretica op de lichaamstemperatuur. De auteurs concludeerden dat geen van de studies een significant verschil aantoonde voor het verlagen van de lichaamstemperatuur in de eerste drie uur na toediening. Na vier uur was er een significant voordeel voor de combinatie van paracetamol en ibuprofen ten opzichte van monotherapie met een van beide. Ook was in één studie een groter deel van de kinderen na zes uur koortsvrij, wanneer ibuprofen en paracetamol gecombineerd waren gegeven dan met ibuprofen alleen (na zes uur was er nog geen verschil; na zeven uur was het verschil tussen beide groepen 40,9% en na acht uur was dit 45,1%). In één studie was de snelheid waarmee de lichaamstemperatuur daalde hoger; ook de maximumtemperatuur over een aantal dagen bleek in één studie lager bij de kinderen die zowel paracetamol als ibuprofen kregen (range 0,80oC – 1,11oC). Twee studies keken als uitkomstmaat naar de mate van comfort van het kind. In een van deze studies leek paracetamol het op de eerste dag beter te doen en de combinatie van paracetamol en ibuprofen op de dagen daarna. In de studies werd slechts een enkele maal melding gemaakt van bijwerkingen. Het voorkomen van bijwerkingen verschilde niet tussen de groepen. Wel moet hierbij worden opgemerkt dat de studies niet gepowered noch specifiek genoeg waren opgezet om betrouwbare uitspraken over bijwerkingen te doen. Purssell et al. [105] gaven ook een kort overzicht van vier internationale richtlijnen [19, 37, 106-108]: de NICE-richtlijn, de WHO-richtlijn, de richtlijn van de Italiaanse Vereniging voor Kindergeneeskunde en de AAP-richtlijn van Amerikaanse Vereniging van Kinderartsen. De richtlijnen benadrukken dat het belangrijkste doel voor het toedienen van antipyretica het verbeteren van het welzijn van het kind is en niet primair het verlagen van de temperatuur. De richtlijnen bevestigen de resultaten van deze review dat er weinig bewijs is voor het combineren of afwisselen van ibuprofen en paracetamol in plaats van het geven van monotherapie met paracetamol of ibuprofen. De auteurs adviseren dat of paracetamol of ibuprofen moest worden gebruikt om het welzijn van het kind met koorts te verbeteren.
In de bondige systematische review van Nabulsi et al. [109] werd de vraag behandeld of een gecombineerd of afwisselend gebruik van paracetamol en ibuprofen beter is dan monotherapie met een van de twee. Er werden vijf artikelen gevonden die voldeden aan de inclusiecriteria. Alle studies waren van matige tot goede kwaliteit en betroffen gerandomiseerde trials bij kinderen met koorts van 6 maanden tot 3 – 14 jaar. Twee van deze studies waren trials met drie interventiegroepen: ibuprofen vs. paracetamol vs. ibuprofen plus paracetamol. Beide trials vonden een vergelijkbaar effect voor het verlagen van de lichaamstemperatuur voor de groep met gecombineerde medicatie en de ibuprofengroep (RCT1: gecombineerd vs. ibuprofen: verschil in verlaging van de lichaamstemperatuur na 1 uur: 0,25ºC, 95% BI -0,01 – 0,50; RCT2: gecombineerd vs. ibuprofen: verschil in periode zonder koorts in eerste vier uur: 16 minuten, 95% BI -7 – 39 minuten). De groep met gecombineerde medicatie had een iets sterkere temperatuursdaling ten opzichte van de paracetamolgroep (RCT1: gecombineerd vs. paracetamol: verschil in verlaging van de lichaamstemperatuur na 1 uur: 0,35ºC, 95% BI 0,10 – 0,60; RCT2: gecombineerd vs. paracetamol: verschil in periode zonder koorts in eerste vier uur: 55 minuten, 95% BI 33 – 77 minuten). In beide trials werden geen ernstige bijwerkingen gevonden en leek er geen verschil in effect op het welzijn van de kinderen te zijn. Verder werden er drie studies gevonden die het afwisselend geven van paracetamol en ibuprofen vergeleken met monotherapie van alleen paracetamol of ibuprofen. In deze studies bleek het afwisselend geven van ibuprofen en paracetamol iets effectiever dan monotherapie en in één studie ook te leiden tot minder stress bij de ouders en minder werkverzuim van de ouders. Ook in deze studies werden geen ernstige bijwerkingen gevonden. De auteurs stelden dat er niet voldoende bewijs was om kinderen met koorts afwisselend of gecombineerd te behandelen met paracetamol en ibuprofen. Daarbij hebben de geïncludeerde trials alle enige tekortkomingen betreffende validiteit (i.e. problemen met blindering, randomisatie, placebocontrole) en adequate sample sizes. Er was heterogeniteit in de medicatie doseringen en de auteurs omschreven het mogelijke marginale voordeel voor het afwisselend geven van ibuprofen en paracetamol ten opzichte van monotherapie als klinisch niet relevant.
Southey et al. [110] presenteerden in hun systematische review en meta-analyse een overzicht van de literatuur die de veiligheid en tolerantie van paracetamol en ibuprofen beschrijft voor het behandelen van pijn en koorts bij kinderen tot 18 jaar. Ze zochten naar gerandomiseerde gecontroleerde trials en observationele studies die als doel hadden bijwerkingen te signaleren van medicatiegebruik, of case series van meer dan 1000 patiënten. Uiteindelijk includeerden zij 24 gerandomiseerde gecontroleerde trials van matige tot goede kwaliteit en 12 grote observationele studies. Alle studies vergeleken paracetamol en/of ibuprofen met placebo. Als uitkomstmaten keken zij naar (1) bijwerkingen, gedefinieerd als systemische reacties gerelateerd aan ibuprofen- of paracetamolgebruik, naar (2) ernstige bijwerkingen, gedefinieerd als fatale bijwerkingen, levensbedreigende bijwerkingen of bijwerkingen waarvoor ziekenhuisopname nodig was, en naar (3) ernstige bijwerkingen waarvoor geen opname nodig was. Een meta-analyse, waarvoor alleen de data afkomstig van de trials werden gebruikt, liet vergelijkbare resultaten zien voor de veiligheid en verdraagbaarheid (i.e. het voorkomen van bijwerkingen of ernstige bijwerkingen) bij kinderen die ibuprofen kregen (ibuprofen vs. placebo: RR 1,39, 95% BI 0,92 – 2,10) en paracetamol (paracetamol vs. placebo: RR 1,57, 95% BI 0,74 – 3,33) in vergelijking met kinderen die placebo kregen. Bij 2937 kinderen van de in totaal 21.305 kinderen die ibuprofen gebruikten, kwamen bijwerkingen voor; bij 1466 kinderen van de in totaal 11.164 kinderen die paracetamol gebruikten, kwamen bijwerkingen voor. De auteurs concludeerden dat ibuprofen, paracetamol en placebo vergelijkbaar waren wat betreft veiligheid en verdraagbaarheid, met name op het gebied van gastro-intestinale bijwerkingen, asthma, en renale bijwerkingen. Als beperking gaven de auteurs de heterogeniteit van de studies, en dat slechts drie studies het aantonen van bijwerkingen als primaire uitkomstmaat hadden gesteld.
Pierce et al. [111] voerden een meta-analyse uit voor de effectiviteit en veiligheid van paracetamol en ibuprofen bij zowel kinderen < 18 jaar als volwassenen. Voor de meta-analyse bij kinderen met koorts includeerden zij 30 studies. Geen enkele studie betrof kinderen < 2 maanden. De auteurs presenteerden geen verdere details over de geïncludeerde patiëntengroepen van de diverse studies; wel werd het doseringsschema in de verschillende studies vermeld, welke varieerde van 5 – 20 mg/kg voor ibuprofen, en 8 – 50 mg/kg voor paracetamol. Van deze van studies toonden 15 studies aan dat ibuprofen een betere antipyretische werking had dan paracetamol; de 15 andere studies vonden geen verschil in effect. Een gestandaardiseerd gemiddeld verschil voor het verlagen van de lichaamstemperatuur kon worden berekend op basis van 7 van de 30 studies (alle gerandomiseerde trials). Er bleek een significant, maar klinisch niet relevant verschil te zijn voor verlaging van de lichaamstemperatuur vier uur na toediening van medicatie in het voordeel van ibuprofen ten opzichte van paracetamol (0,28 ºC, 95% BI 0,10 – 0,41). 31 artikelen beschreven de veiligheid van ibuprofen en/of paracetamol bij kinderen. Dertig artikelen rapporteerden geen verschil in veiligheid tussen ibuprofen en paracetamol, 1 artikel vond dat paracetamol veiliger en beter verdragen werd dan ibuprofen. Een analyse met de gecombineerde data van 19 gerandomiseerde gecontroleerde trials liet geen verschil zien in veiligheid en verdraagbaarheid tussen paracetamol en ibuprofen (OR 0,82, 95% BI 0,60 – 1,12). De auteurs concludeerden dat ibuprofen ten minste een net zo sterke antipyretische werking had als paracetamol en net zo veilig was.
Goldstein et al. [112] vergeleken in hun systematische review en meta-analyse de effectiviteit van orale paracetamol met rectaal toegediende paracetamol in de behandeling van koorts en pijn bij zowel volwassenen als kinderen. Zij selecteerden vier (quasi) gerandomiseerde trials die als primaire uitkomstmaat verlaging van de lichaamstemperatuur beschreven. Drie van deze vier trials waren studies die alleen kinderen met koorts beschreven. Eén uur na toediening van paracetamol was er geen significant verschil in temperatuursverlaging tussen de patiënten die orale paracetamol hadden gekregen ten opzichte van de patiënten die paracetamol rectaal hadden gekregen (het gewogen gemiddelde verschil was: -0,14 ºC, 95% BI -0,36 – 0,08 ºC). Ook na drie uur was er geen verschil (-0,10, 95% BI -0,41 – 0,21). Het verschil van de maximale verlaging in lichaamstemperatuur (-0,10, 95% BI -0,.24 – 0,04) en de gemiddelde tijd die nodig was tot een temperatuursverlaging van ≥ 1 ºC bleek hetzelfde tussen oraal en rectaal gegeven paracetamol. Hieruit maakten de auteurs op dat paracetamol in rectale en orale toedieningsvorm vergelijkbaar waren voor het verlagen van de lichaamstemperatuur. Beperking van deze studie is dat ook studies naar volwassenen waren meegenomen in de analyse (hoewel drie van de vier studies kinderen betroffen) en dat er geen uitspraken werden gedaan over het effect op het welzijn van het kind. Verder werden er geen uitspraken gedaan over de veiligheid van de medicatie of het effect van herhaalde medicatiegiften.
Zoeken en selecteren
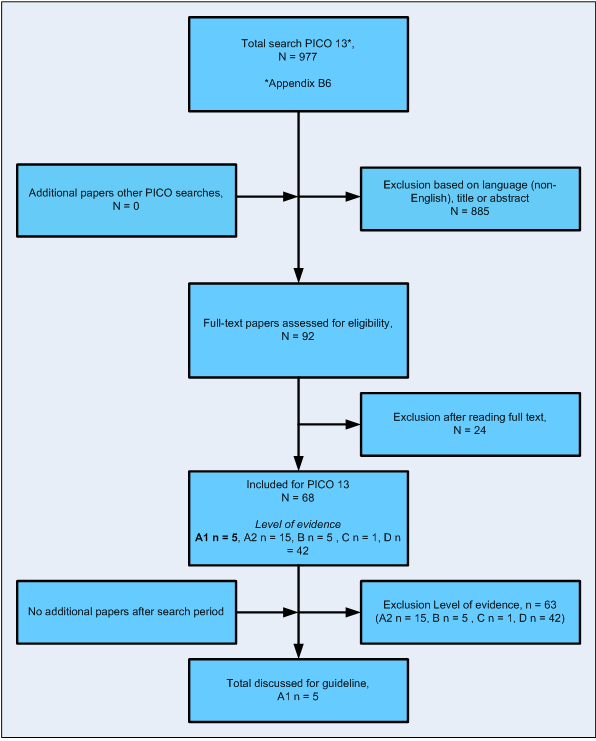
Flowdiagram bij uitgangsvraag 15
Zoekstrategie bij uitgangsvraag 15
Uitgevoerd 25 juni 2012
Medline via OvidSP
(exp Infant/ OR exp child/ OR (infan* OR newborn* OR new born* OR neonat* OR perinat* OR postnat* OR baby OR babies OR child OR schoolchild* OR school child* OR kid OR kids OR toddler* OR teen OR teenage OR boy* OR girl* OR minors OR underag* OR under ag* OR juvenil* OR youth* OR kindergar* OR pubert* OR pubescen* OR schools OR nursery school* OR preschool* OR pre school* OR primary school* OR secondary school* OR elementary school* OR high school* OR highschool* OR school age* OR schoolage*).ab,ti. OR ((adolescent/ OR adolescen*.ab,ti.) NOT exp adult/) ) AND (exp Fever/ OR (fever* OR febril* OR hypertherm* OR pyrexi* OR pyretic* OR hyperpyrex* OR hyperpyretic* OR pyrogen*).ab,ti.)
AND (exp "Anti Inflammatory Agents, Non Steroidal"/ OR ((Non adj Steroid*) OR nsaid* OR Antipyretic* OR paracetamol OR Acetaminophen).ab,ti. )
limit 2 to ed=20060901-20130101
Embase
((infan* OR newborn* OR (new NEXT/1 born*) OR baby OR babies OR neonat* OR perinat* OR postnat* OR child OR 'child s' OR childhood* OR children* OR kid OR kids OR toddler* OR teen* OR boy* OR girl* OR minors* OR underag* OR (under NEXT/2 ag*) OR juvenil* OR youth* OR kindergar* OR puber* OR pubescen* OR prepubescen* OR prepuberty* OR pediatric* OR peadiatric* OR school* OR preschool* OR highschool* OR suckling):de,ab,ti OR (adoles*:de,ab,ti NOT adult/exp) OR child/exp OR newborn/exp) AND (Fever/de OR (fever* OR febril* OR hypertherm* OR pyrexi* OR pyretic* OR hyperpyrex* OR hyperpyretic* OR pyrogen*):ab,ti)
AND ('nonsteroid antiinflammatory agent'/de OR ((Non NEXT/1 Steroid*) OR nsaid* OR Antipyretic* OR paracetamol OR Acetaminophen):ab,ti ) AND [1-9-2006 ]/sd
Referenties
- Hay, A.D., J. Heron, and A. Ness, The prevalence of symptoms and consultations in pre-school children in the Avon Longitudinal Study of Parents and Children (ALSPAC): A prospective cohort study. Family Practice, 2005. 22(4): p. 367-374.
- Bouwhuis, C.B., et al., [Few ethnic differences in acute pediatric problems: 10 years of acute care in the Sophia Children's Hospital in Rotterdam]]. Ned Tijdschr Geneeskd, 2001. 145(38): p. 1847-51.
- Roukema, J., et al., Randomized Trial of a Clinical Decision Support System: Impact on the Management of Children with Fever without Apparent Source. J Am Med Informatics Assoc, 2008. 15(1): p. 107-13.
- Gill, P.J., et al., Increase in emergency admissions to hospital for children aged under 15 in England, 1999-2010: national database analysis. Arch Dis Child, 2013.
- Elberse, K.E., et al., Changes in the composition of the pneumococcal population and in IPD incidence in The Netherlands after the implementation of the 7-valent pneumococcal conjugate vaccine. Vaccine, 2012.
- Conyn-van Spaendonck, M.A., et al., [Significant decline of the number of invasive Haemophilus influenzae infections in the first 4 years after introduction of vaccination against H. influenzae type B in children] Sterke daling van het aantal invasieve infecties door Haemophilus influenzae in de eerste 4 jaar na de introductie van de vaccinatie van kinderen tegen H. influenzae type b. Ned Tijdschr Geneeskd, 2000. 144(22): p. 1069-73.
- Baraff, L.J., Management of fever without source in infants and children. Ann Emerg Med, 2000. 36(6): p. 602-14.
- Evidence based clinical guideline: outpatient evaluation and management of fever of uncertain source in children 2 to 36 moths of age; Cincinnati children's hospital medical center. 2003.
- Baraff, L.J., et al., Practice guideline for the management of infants and children 0 to 36 months of age with fever without source. Agency for Health Care Policy and Research [published erratum appears in Ann Emerg Med 1993 Sep;22(9):1490] [see comments]. Ann Emerg Med, 1993. 22: p. 1198-1210.
- Nijman, R.G., et al., Parental fever attitude and management: influence of parental ethnicity and child's age. Pediatr Emerg Care, 2010. 26(5): p. 339-42.
- Kai, J., What worries parents when their preschool children are acutely ill, and why: a qualitative study. Bmj, 1996. 313(7063): p. 983-6.
- van Ierland, Y., et al., Self-Referral and Serious Illness in Children With Fever. Pediatrics, 2012.
- Najaf-Zadeh, A., et al., Epidemiology of malpractice lawsuits in paediatrics. Acta Paediatr, 2008. 97(11): p. 1486-91.
- (2007) Feverish illness in children: a guick reference guide, London, http://guidance.nice.org.uk/CG47/guickrefguide/pdf/english. NICE Clinical Guidelines CG47.
- Berger, M.Y., et al., NHG-Standaard Kinderen met koorts. Huisarts Wet, 2008. 51(6): p. 287-96.
- Oostenbrink, R., M. Thompson, and E.W. Steyerberg, Barriers to translating diagnostic research in febrilechildren to clinical practice: a systematic review. Arch Dis Child, 2011.
- Graneto, J.W. and D.F. Soglin, Maternal screening of childhood fever by palpation. Pediatr Emerg Care, 1996. 12(3): p. 183-4.
- AGREE Next steps consortium. AGREE II. Instrument voor de beoordeling van richtlijnen. Mei 2009.
- NHS., NICE clinical guideline 47: feverish illness in children. Assesment and initial management in children younger than 5 years. 2007: London. N1247.
- Assessment and initial management of feverish illness in children younger than 5 years: summary of NICE guidance. BMJ, 2013. 346: p. f3764.
- Craig, J.V., et al., Temperature measured at the axilla compared with rectum in children and young people: systematic review. BMJ, 2000. 320(7243): p. 1174-8.
- Morley, E.J., et al., Rates of positive blood, urine, and cerebrospinal fluid cultures in children younger than 60 days during the vaccination era. Pediatr Emerg Care, 2012. 28(2): p. 125-30.
- Schuh, S., et al., Comparison of the temporal artery and rectal thermometry in children in the emergency department. Pediatr Emerg Care, 2004. 20(11): p. 736-41.
- Van den Bruel, A., et al., Diagnostic value of clinical features at presentation to identify serious infection in children in developed countries: a systematic review. Lancet, 2010. 375(9717): p. 834-45.
- Thompson, M.J., et al., Deriving temperature and age appropriate heart rate centiles for children with acute infections. Arch Dis Child, 2008.
- Nijman, R.G., et al., Derivation and validation of age and temperature specific reference values and centile charts to predict lower respiratory tract infection in children with fever: prospective observational study. BMJ, 2012. 345: p. e4224.
- Elshout, G., et al., Duration of fever and serious bacterial infections in children: a systematic review Review. BMC Fam Pract, 2011. 12: p. 33.
- Curtis, S., et al., Clinical features suggestive of meningitis in children: a systematic review of prospective data Review. Pediatrics, 2010. 126(5): p. 952-60.
- Brent, A.J., et al., Evaluation of temperature-pulse centile charts in identifying serious bacterial illness: Observational cohort study. Arch Dis Child, 2011. 96(4): p. 368-373.
- Fleming, S., et al., Normal ranges of heart rate and respiratory rate in children from birth to 18 years of age: a systematic review of observational studies. Lancet, 2011. 377(9770): p. 1011-8.
- Thompson, M., et al., Deriving temperature and age appropriate heart rate centiles for children with acute infections. Arch Dis Child, 2009. 94(5): p. 361-5.
- Rudinsky, S.L., et al., Serious bacterial infections in febrile infants in the post-pneumococcal conjugate vaccine era. Acad Emerg Med, 2009. 16(7): p. 585-590.
- Garcia, S., et al., Is 15 days an appropriate cut-off age for considering serious bacterial infection in the management of febrile infants? Pediatr Infect Dis J, 2012. 31(5): p. 455-458.
- Hui C., N.G., Tsertsvadze A., Yazdi F., Tricco A., Tsouros S., Skidmore B., Daniel R., Diagnosis and management of febrile infants (0-3 months). Evidence repot/Technology assessment, 2012. Contract No. HHSA 290-2007-10059-I.
- Huppler, A.R., J.C. Eickhoff, and E.R. Wald, Performance of low-risk criteria in the evaluation of young infants with fever: Review of the literature. Pediatrics, 2010. 125(2): p. 228-33.
- Nijman, R.G., et al., Clinical prediction model to aid emergency doctors managing febrile children at risk of serious bacterial infections: diagnostic study. BMJ, 2013. BMJ 2013;346:f1706 doi: 10.1136/bmj.f1706.
- Nigrovic, L.E., R. Malley, and N. Kuppermann, Meta-analysis of bacterial meningitis score validation studies. Arch Dis Child, 2012. 97(9): p. 799-805.
- Craig, J.C., et al., The accuracy of clinical symptoms and signs for the diagnosis of serious bacterial infection in young febrile children: prospective cohort study of 15 781 febrile illnesses. BMJ, 2010. 340: p. c1594.
- Brent, A.J., et al., Risk score to stratify children with suspected serious bacterial infection: observational cohort study. Arch Dis Child, 2011. 96(4): p. 361-7.
- Thompson, M., et al., How well do vital signs identify children with serious infections in paediatric emergency care? Arch Dis Child, 2009. 94(11): p. 888-893.
- Van Den Bruel, A., et al., Diagnostic value of laboratory tests in identifying serious infections in febrile children: Systematic review. BMJ, 2011. 342(7810).
- Offringa, M., et al., Seizures and fever: can we rule out meningitis on clinical grounds alone? Clin Pediatr (Phila), 1992. 31(9): p. 514-22.
- Nijman, R.G., et al., Can urgency classification of the Manchester triage system predict serious bacterial infections in febrile children? Arch Dis Child, 2011. 96(8): p. 715-722.
- Thompson, M., et al., Systematic review and validation of prediction rules for identifying children with serious infections in emergency departments and urgent-access primary care. Health Technol Assess, 2012. 16(15): p. 1-100.
- Yo, C.H., et al., Comparison of the Test Characteristics of Procalcitonin to C-Reactive Protein and Leukocytosis for the Detection of Serious Bacterial Infections in Children Presenting With Fever Without Source: A Systematic Review and Meta-analysis. Ann Emerg Med, 2012.
- Sanders, S., et al., Systematic review of the diagnostic accuracy of C-reactive protein to detect bacterial infection in nonhospitalized infants and children with fever Review. J Pediatr, 2008. 153(4): p. 570-4.
- Bressan, S., et al., Predicting severe bacterial infections in well-appearing febrile neonates: Laboratory markers accuracy and duration of fever. Pediatr Infect Dis J, 2010. 29(3): p. 227-232.
- Luaces-Cubells, C., et al., Procalcitonin to detect invasive bacterial infection in non-toxic-appearing infants with fever without apparent source in the emergency department. Pediatr Infect Dis J, 2012. 31(6): p. 645-7.
- Manzano, S., et al., Markers for bacterial infection in children with fever without source. Arch Dis Child, 2011. 96(5): p. 440-446.
- Pratt, A. and M.W. Attia, Duration of fever and markers of serious bacterial infection inyoung febrile children. Pediatr Int, 2007. 49(1): p. 31-35.
- Woelker, J.U., et al., Serum procalcitonin concentration in the evaluation of febrile infants 2 to 60 days of age. Pediatr Emerg Care, 2012. 28(5): p. 410-415.
- Mills, G.D., et al., Elevated procalcitonin as a diagnostic marker in meningococcal disease. Eur J Clin Microbiol Infect Dis, 2006. 25(8): p. 501-9.
- Dauber, A., et al., Procalcitonin levels in febrile infants after recent immunization. Pediatrics, 2008. 122(5): p. e1119-e1122.
- Maniaci, V., et al., Procalcitonin in young febrile infants for the detection of Serious bacterial infections. Pediatrics, 2008. 122(4): p. 701-710.
- Gomez, B., et al., Diagnostic value of procalcitonin in well-appearing young febrile infants. Pediatrics, 2012. 130(5): p. 815-22.
- Galetto-Lacour, A., et al., Validation of a laboratory risk index score for the identification of severe bacterial infection in children with fever without source. Arch Dis Child, 2010. 95(12): p. 968-973.
- Lacour, A.G., S.A. Zamora, and A. Gervaix, A score identifying serious bacterial infections in children with fever without source. Pediatr Infect Dis J, 2008. 27(7): p. 654-656.
- Cornbleet, P.J., Clinical utility of the band count. Clin Lab Med, 2002. 22(1): p. 101-36.
- Chiesa, C., et al., Procalcitonin as a marker of nosocomial infections in the neonatal intensive care unit. Intensive Care Med, 2000. 26 Suppl 2: p. S175-7.
- Bressan, S., et al., Bacteremia in feverish children presenting to the emergency department: A retrospective study and literature review. Acta Paediatr Int J Paediatr, 2012. 101(3): p. 271-7.
- Greenhow, T.L., Y.Y. Hung, and A.M. Herz, Changing epidemiology of bacteremia in infants aged 1 week to 3 months. Pediatrics, 2012. 129(3): p. e590-e6.
- Krief, W.I., et al., Influenza virus infection and the risk of serious bacterial infections in young febrile infants. Pediatrics, 2009. 124(1): p. 30-9.
- Velasco-Zuniga, R., et al., Predictive factors of low risk for bacteremia in infants with urinary tract infection. Pediatr Infect Dis J, 2012. 31(6): p. 642-5.
- Ralston, S., V. Hill, and A. Waters, Occult serious bacterial infection in infants younger than 60 to 90 days with bronchiolitis: A systematic review. Arch Pediatr Adolesc Med, 2011. 165(10): p. 951-6.
- Hsiao, A.L., L. Chen, and M.D. Baker, Incidence and predictors of serious bacterial infections among 57- to 180-day-old infants. Pediatrics, 2006. 117(5): p. 1695-701.
- Hom, J. and K. Medwid, The low rate of bacterial meningitis in children, ages 6 to 18 months, with simple febrile seizures. Acad Emerg Med, 2011. 18(11): p. 1114-20.
- Kimia, A., et al., Yield of lumbar puncture among children who present with their first complex febrile seizure. Pediatrics, 2010. 126(1): p. 62-9.
- Tebruegge, M., et al., The age-related risk of co-existing meningitis in children with urinary tract infection. PLoS ONE, 2011. 6(11): p. e26576.
- Paquette, K., et al., Is a lumbar puncture necessary when evaluating febrile infants (30 to 90 days of age) with an abnormal urinalysis? Pediatr Emerg Care, 2011. 27(11): p. 1057-61.
- Shah, S.S., et al., Sterile Cerebrospinal Fluid Pleocytosis in Young Infants with Urinary Tract Infections. J Pediatr, 2008. 153(2): p. 290-2.
- Mintegi, S., et al., Well appearing young infants with fever without known source in the Emergency Department: Are lumbar punctures always necessary? Eur J Emerg Med, 2010. 17(3): p. 167-9.
- Meehan, W.P. and R.G. Bachur, Predictors of cerebrospinal fluid pleocytosis in febrile infants aged 0 to 90 days. Pediatr Emerg Care, 2008. 24(5): p. 287-93.
- Seltz, L.B., E. Cohen, and M. Weinstein, Risk of bacterial or herpes simplex virus meningitis/encephalitis in children with complex febrile seizures. Pediatr Emerg Care, 2009. 25(8): p. 494-7.
- Shah, S., et al., Detection of occult pneumonia in a pediatric emergency department. Pediatr Emerg Care, 2010. 26(9): p. 615-21.
- Murphy, C.G., et al., Clinical Predictors of Occult Pneumonia in the Febrile Child. Acad Emerg Med, 2007. 14(3): p. 243-9.
- Rutman, M.S., R. Bachur, and M.B. Harper, Radiographic pneumonia in young, highly febrile children with leukocytosis before and after universal conjugate pneumococcal vaccination. Pediatr Emerg Care, 2009. 25(1): p. 1-7.
- Mintegi, S., et al., Occult pneumonia in infants with high fever without source: A prospective multicenter study. Pediatr Emerg Care, 2010. 26(7): p. 470-4.
- Bourayou, R., et al., [What is the value of the chest radiography in making the diagnosis of children pneumonia in 2011?] Quel est l'interet de la radiographie du thorax dans le diagnostic d'une pneumonie de l'enfant en 2011 ? Arch Pediatr, 2011. 18(11): p. 1251-4.
- Bramson, R.T., N.T. Griscom, and R.H. Cleveland, Interpretation of chest radiographs in infants with cough and fever. Radiology, 2005. 236(1): p. 22-9.
- Wilkins, T.R. and R.L. Wilkins, Clinical and radiographic evidence of pneumonia. Radiol Technol, 2005. 77(2): p. 106-10.
- Doan, Q., et al., Rapid viral diagnosis for acute febrile respiratory illness in children in the Emergency Department. Cochrane Database Syst Rev, 2012. 5: p. CD006452.
- Iyer, S.B., et al., Effect of Point-of-care Influenza Testing on Management of Febrile Children. Acad Emerg Med, 2006. 13(12): p. 1259-68.
- Benito-Fernandez, J., et al., Impact of rapid viral testing for influenza A and B viruses on management of febrile infants without signs of focal infection. Pediatr Infect Dis J, 2006. 25(12): p. 1153-7.
- Mintegi, S., et al., Rapid influenza test in young febrile infants for the identification of low-risk patients. Pediatr Infect Dis J, 2009. 28(11): p. 1026-8.
- Dewan, M., et al., Cerebrospinal fluid enterovirus testing in infants 56 days or younger. Arch Pediatr Adolesc Med, 2010. 164(9): p. 824-30.
- Gomez, B., et al., Clinical and analytical characteristics and short-term evolution of enteroviral meningitis in young infants presenting with fever without source. Pediatr Emerg Care, 2012. 28(6): p. 518-23.
- Vanagt, W.Y., et al., Paediatric sepsis-like illness and human parechovirus. Arch Dis Child, 2012. 97(5): p. 482-3.
- Verboon-Maciolek, M.A., et al., Severe neonatal parechovirus infection and similarity with enterovirus infection. Pediatr Infect Dis J, 2008. 27(3): p. 241-5.
- King, R.L., et al., Routine cerebrospinal fluid enterovirus polymerase chain reaction testing reduces hospitalization and antibiotic use for infants 90 days of age or younger. Pediatrics, 2007. 120(3): p. 489-96.
- Lin, T.-Y., et al., Neonatal enterovirus infections: emphasis on risk factors of severe and fatal infections. Pediatr Infect Dis J, 2003. 22(10): p. 889-94.
- Rittichier, K.R., et al., Diagnosis and outcomes of enterovirus infections in young infants. Pediatric Infectious Disease Journal, 2005. 24(6): p. 546-550.
- Sharp, J., et al., Characteristics of Young Infants in Whom Human Parechovirus, Enterovirus or Neither Were Detected in Cerebrospinal Fluid during Sepsis Evaluations. Pediatr Infect Dis J, 2012.
- Caviness, A.C., et al., The Prevalence of Neonatal Herpes Simplex Virus Infection Compared with Serious Bacterial Illness in Hospitalized Neonates. J Pediatr, 2008. 153(2): p. 164-9.
- Caviness, A.C., G.J. Demmler, and B.J. Selwyn, Clinical and laboratory features of neonatal herpes simplex virus infection: a case-control study. Pediatr Infect Dis J, 2008. 27(5): p. 425-30.
- Kneen, R., et al., The management of infants and children treated with aciclovir for suspected viral encephalitis. Arch Dis Child, 2010. 95(2): p. 100-6.
- Long, S.S., et al., Herpes simplex virus infection in young infants during 2 decades of empiric acyclovir therapy. Pediatr Infect Dis J, 2011. 30(7): p. 556-61.
- Cohen, D.M., et al., Factors influencing the decision to test young infants for herpes simplex virus infection. Pediatr Infect Dis J, 2007. 26(12): p. 1156-8.
- Davis, K.L., et al., Why are young infants tested for herpes simplex virus? Pediatr Emerg Care, 2008. 24(10): p. 673-8.
- McGuire, J.L., et al., Herpes Simplex Testing in Neonates in the Emergency Department. Pediatr Emerg Care, 2012.
- Byington, C.L., et al., Serious bacterial infections in febrile infants 1 to 90 days old with and without viral infections. Pediatrics, 2004. 113(6): p. 1662-6.
- Rittichier, K.R., et al., Diagnosis and outcomes of enterovirus infections in young infants. Pediatr Infect Dis J, 2005. 24(6): p. 546-50.
- Stellrecht, K.A., et al., The impact of an enteroviral RT-PCR assay on the diagnosis of aseptic meningitis and patient management. J Clin Virol, 2002. 25 Suppl 1: p. S19-26.
- Schwartz, S., et al., A week-by-week analysis of the low-risk criteria for serious bacterial infection in febrile neonates. Arch Dis Child, 2009. 94(4): p. 287-92.
- Thompson, C., et al., Encephalitis in children. Arch Dis Child, 2012. 97(2): p. 150-61.
- Purssell, E., Systematic review of studies comparing combined treatment with paracetamol and ibuprofen, with either drug alone. Arch Dis Child, 2011. 96(12): p. 1175-9.
- Chiappini, E., et al., Management of fever in children: summary of the Italian Pediatric Society guidelines. Clin Ther, 2009. 31(8): p. 1826-43.
- Sullivan, J.E. and H.C. Farrar, Fever and antipyretic use in children. Pediatrics, 2011. 127(3): p. 580-7.
- Grol, R., et al., Attributes of clinical guidelines that influence use of guidelines in general practice: observational study. BMJ, 1998. 317(7162): p. 858-61.
- Nabulsi, M., Is combining or alternating antipyretic therapy more beneficial than monotherapy for febrile children? BMJ (Online), 2010. 340(7737): p. 92-3.
- Southey, E.R., K. Soares-Weiser, and J. Kleijnen, Systematic review and meta-analysis of the clinical safety and tolerability of ibuprofen compared with paracetamol in paediatric pain and fever. Curr Med Res Opin, 2009. 25(9): p. 2207-22.
- Pierce, C.A. and B. Voss, Efficacy and safety of ibuprofen and acetaminophen in children and adults: A meta-analysis and qualitative review. Ann Pharmacother, 2010. 44(3): p. 489-506.
- Goldstein, L.H., et al., Effectiveness of oral vs rectal acetaminophen: A meta-analysis. Arch Pediatr Adolesc Med, 2008. 162(11): p. 1042-6.
- Almond, S., D. Mant, and M. Thompson, Diagnostic safety-netting. Br J Gen Pract, 2009. 59(568): p. 872-4; discussion 874.
- Neighbour, R., The inner consultation. 2004, Oxford: Radcliffe Publishing.
- Goldman, R.D., M. Ong, and A. Macpherson, Unscheduled return visits to the pediatric emergency department-one-year experience. Pediatr Emerg Care, 2006. 22(8): p. 545-9.
- Wahl, H., et al., Health information needs of families attending the paediatric emergency department. Arch Dis Child, 2011. 96(4): p. 335-9.
- Doan, Q., et al., Rapid viral diagnosis for acute febrile respiratory illness in children in the Emergency Department. Cochrane Database Syst Rev, 2009(4): p. CD006452.
- American College of Emergency Physicians Clinical Policies, C. and F. American College of Emergency Physicians Clinical Policies Subcommittee on Pediatric, Clinical policy for children younger than three years presenting to the emergency department with fever. Ann Emerg Med, 2003. 42(4): p. 530-45.
- American College of Radiology. ACR Appropriateness Criteria. Fever without source - Child. . 1999 (last update: 2011).
Evidence tabellen
Tabel Evidence-tabellen voor systematische reviews behorende bij uitgangsvraag
|
|
Reference |
Level |
Study type |
Studies, patients and setting |
Intervention |
Controle |
Outcome measure |
Results |
Other remarks |
|
[105] |
Purssell, E., Systematic review of studies comparing combined treatment with paracetamol and ibuprofen, with either drug alone. Arch Dis Child, 2011. 96(12): p. 1175-9. |
A1 |
SR |
7 studies: All studies were RCTs, moderate to good quality, peformed in inpatient, outpatient and home care settings,
Patients: Children with fever, aged >6 months to 3-14 years
|
3 groups: G1 paracetamol G2 ibuprofen G3 paracetamol and ibuprofen
Dosing rgimens differed per study |
G1 vs G2 vs G3 |
Effect on body temperature: clinical relevance was defined by authors and varied per study
Effect on discomfort
Side effects |
Effect on temperature (6/7 studies): Limited benefit for the combine treatment until 4 hrs, thereafter a significant but clinically marginally relevant benefit. RCT 1: Mean fall over 1 h °C (tympanic): No clinically or statistically significant difference (P 0.95, I 0.92, PI 1.22) RCT 2:% Afebrile at 6–8 h (rectal): greater in mixed group 6 hrs: I 57.6, PI 83.3, p=0.018; 7 hrs: I 45.2, PI 86.1, p<0.001; 8 hrs: I 35.5, PI 80.6, p<0.001 Max temperature decline no difference RCT 3: Mean max temperature on days 1–3 °C (rectal) lowest in mixed group, highest in paracetamol 1 day: P 40.6, I 40.6, PI 39.6 p<0.001; 2 day: P 39.7, I 39.7, PI 38.8 p<0.001 ;3 day: P 39.3, I 39.6, PI 38.5 p<0.001 RCT 4: Minutes without fever fi rst 4 h (axillary): greatest in mixed group, shortest in paracetamol group (P 116.2, I 156, PI 171.1). Pairwise comparison mixed vs paracetamol p<0.001, ibuprofen vs paracetamol p=0.001 First 24 h: same pattern (P 940.3, PI 1055.2 , PI 1217.4) RCT 5: Mean temperature at 3–6 hrs °C (oral/rectal) no difference at 3 or 6 hrs, at 4 and 5 hrs lower in mixed group; 4 hrs: P 38, PI 37.4, p=0.05; 5 h: P 37.9, PI 37.1, p=0.003; RCT 6: Mean temperature at 1–6 h °C (tympanic/axillary) no difference at 1–3 hrs, at 4–6 hrs lower in mixed (PI) and alternating (IP) than ibuprofen (note order of groups) 4 hrs: IP 36.9, I 37.5, PI 36.9, p=0.002; 5 hrs: IP 36.8, I 38, PI 36.9, p<0.001; 6 hrs: IP 36.9, I 38.5, PI 37.2, p<0.001 Two studies reported on child’s comfort: marginal benefit for combined treatment without clinical relevance No evidence of greater adverse events for combined treatment compared to monotherapy |
Search period: through May 2011
Section on expert opinion, ie. International guidelines, presented in paper |
|
[112] |
Goldstein, L.H., et al., Effectiveness of oral vs rectal acetaminophen: A meta-analysis. Arch Pediatr Adolesc Med, 2008. 162(11): p. 1042-6. |
A1 |
SR, meta analysis |
4 studies: all were RCTs, or quasi-RCTs describing studies of high quality; 3 out of 4 studies included children only
Patients and setting: no restrictions mentioned |
Oral PCM (different dosing schems) |
Rectal PCM (different dosing schems) |
Temperature reduction (data on pain reduction not presented), described in weighted mean difference (WMD) |
Rectal vs oral PCM: Temperature decline after 1 hr: weighted mean difference (WMD) -0.14 oC (95% -0.36 – 0.08) After 3 hrs: WMD -0.10 (95% CI -0.41 – 0.21)
No difference in maximum decline (WMD, -0.10oC, 95% -0.24 0.04), or average time to temperature reduction of ≥1oC (WMD, -0.06, 95% CI -1.34 – 1.23) |
Search period: through October 2007
Data on pain reduction not presented in evidence table |
|
[109] |
Nabulsi, M., Is combining or alternating antipyretic therapy more beneficial than monotherapy for febrile children? BMJ (Online), 2010. 340(7737): p. 92-3. |
A1 |
SR |
Studies: 5 RCTs, of moderate/good quality; 2 studies on combined therapy vs monotherapy; 3 studies on alternating therapy vs monotherapy
Patients: febrile children (ie. Different definitions of fever fever were used for the studies), aged >6 months to 14 years
Setting: not described |
Alternating doses of PCM and ibuprofen
(dosing schemes differed for different studies) |
PCM or ibuprofen
(dosing schemes differed for different studies) |
Temperature reduction
Adverse events (liver, kidney, skin) |
No significant adverse reactions were reported
Combined treatment was no better than monotherapy with ibuprofen
Combined treatment was marginally better than monotherapy with paracetamol
Alternating treatment was marginally superior than monotherapy with paracetamol or ibuprofen
In one study alternating treatment was reported to be associated with less parental stress and absenteeism from day care or work
|
No search period described |
|
[111] |
Pierce, C.A. and B. Voss, Efficacy and safety of ibuprofen and acetaminophen in children and adults: A meta-analysis and qualitative review. Ann Pharmacother, 2010. 44(3): p. 489-506. |
A1 |
SR plus meta-analysis |
58 studies, of which 30 reported on antipyretic effects of PCM vs ibuprofen in children, and 31 reported on safety (ie. adverse events) in children.
Patients: Results reported for children 0 to 18 years, no studies included children <2 months (results from adult studies not presented)
|
Ibuprofen (dosing 5 to 20 mg/kg) |
PCM (dosing 8 to 50 mg/kg) |
1. temperature reduction
2. adverse events and serious adverse events (as defined and reported by individual studies)
(3. analgesic effects: results not presented in evidence table) |
15 studies reported that ibuprofen was superior to PCM in reducing body temperature; 15 studies found no difference
Pooled estimate: standardized mean difference 0.26 (95% CI 0.10 – 0.41) in favour of ibuprofen for temperature reduction after 4 hours
30/31 studies found no significant difference between ibuprofen and PCM in safety and tolerability; 1 paper reported PCM safer than ibuprofen. Pooled Odds Ratio for safety (ie. Incidence adverse events): 0.90 (95% CI 0.60 – 1.12) meaning no significant difference in safety/adverse events |
Search period: EMBASE through January 2008; PUBMED/MEDLINE through August 2009 |
|
[110] |
Southey, E.R., K. Soares-Weiser, and J. Kleijnen, Systematic review and meta-analysis of the clinical safety and tolerability of ibuprofen compared with paracetamol in paediatric pain and fever. Curr Med Res Opin, 2009. 25(9): p. 2207-22.
|
A1 |
SR, plus meta analysis |
36 studies, of which 24 were RCTs: 20 RCTs on ibuprofen vs PCM 5 RCTs on ibuprofen vs placebo 5 RCTs on PCM vs placebo And 12 large observational studies
Patients: children with pain and fever, data on children with pain not presented. Age: 0 -18 years.
|
Ibuprofen and/or PCM (dosing differed per study) |
placebo |
(1) Adverse events requiring discontinuation of medication, (2) systemic reactions related to ibuprofen or PCM; (3) serious AE that are fatal, life threatening, or require hospitalisation; and (4) serious AE not requiring hospitalisation
|
Systemic reactions (meta-analysis): no significant difference for PCM vs. placebo (RR 1.57, 95% CI 0.74 – 3.33), and ibuprofen vs. placebo (1.39, 95% 0.92 – 2.10)
2,937 systemic AEs occurred in 21,305 patients takng ibuprofen vs. 1,466 AEs in 11,164 patients taking PCM (RR 1.03, 95% 0.98 – 1.10) (data both for children with pain and with fever)
Similar tolerability and safety profiles were found for PCM, ibuprofen, and placebo, in terms of gastro-intestinal symptoms, asthma, and renal adverse effects.
|
Search period: through November 2008
Some remaining heterogeneity exists between studies used for meta analysis.
Observational studies were not used for meta-analysis but indicate comparable results |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-12-2013
Laatst geautoriseerd : 01-12-2013
Geplande herbeoordeling : 01-01-2018
De richtlijn dient elke vijf jaar gereviseerd te worden. De geldigheid van de richtlijn komt eerder te vervallen als nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
Algemene gegevens
Deze richtlijn is tot stand gekomen door financiering van Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften, maar ‘systematisch ontwikkelde op evidence’ gebaseerde aanbevelingen bedoeld om hulpverleners en patiënten te ondersteunen in het besluitvormingsproces voor diagnostiek en behandeling. Aangezien deze aanbevelingen hoofdzakelijk gebaseerd zijn op de ‘gemiddelde patiënt’, kunnen zorgverleners op basis van hun professionele autonomie zonodig afwijken van de richtlijn. De aanbevelingen die in de huidige richtlijn staan vermeld, zijn te vertalen naar lokale protocollen die zijn toegespitst op de plaatselijke situatie. Afwijken van richtlijnen is, als de situatie van de patiënt dat vereist, soms zelfs noodzakelijk. Wanneer van een richtlijn wordt afgeweken, dient dit beargumenteerd en gedocumenteerd te worden.
Doel en doelgroep
Aanleiding
Koorts komt frequent voor bij kinderen. Elk gezond kind maakt gemiddeld acht infecties met koorts door in de eerste achttien levensmaanden [1]. Voor 20-40% van deze kinderen wordt een arts geconsulteerd in verband met koorts, met de hoogste prevalentie in de leeftijd van 6 tot 18 maanden.
Jaarlijks worden ongeveer 300.000 kinderen gezien op de SEH van Nederlandse ziekenhuizen. Ongeveer de helft van de kinderen die de kindergeneeskundige SEH bezoekt, komt vanwege koorts [2]. Het merendeel van deze kinderen heeft een virale infectie die geen verdere behandeling behoeft. Een ernstige (bacteriële) infectie is aanwezig bij 10-15% van de kinderen met koorts en kan bij te late onderkenning een gecompliceerd of eventueel fataal beloop kennen [3]. Het grote dilemma is het vroegtijdig onderscheiden van kinderen met een ernstige infectie (meningitis, sepsis, urineweginfectie, pneumonie) van de overgrote meerderheid van kinderen met een zelflimiterende aandoening. Als onderdeel van de diagnostische aanpak vindt bij ongeveer de helft van kinderen met koorts die zich op de SEH presenteren, aanvullende diagnostiek (bloedonderzoek, thoraxfoto, urineonderzoek) plaats, bij een derde een observationele opname, die bij een groot deel (achteraf) onnodig blijkt [3]. Vooral de (kortdurende) observationele opname neemt toe [4]. Sinds de introductie van vaccinatiestrategieën (Haemophilus influenzae type b (Hib)-vaccinatie in 1993, pneumokokkenvaccinatie in 2006) is het spectrum van diagnoses veranderd [5, 6], en de kans op zeer ernstige diagnoses sterk verlaagd [7]. Bij het verschuiven van het spectrum van bacteriële verwekkers door vaccinatie is er ook een verandering in de indicatie voor diagnostiek en behandeling. Eerdere richtlijnen beoogden vooral het identificeren van het kind met koorts zonder focus [8, 9], met een risico op occulte bacteriëmie, welke diagnose vooral relevant is bij pneumokokkeninfecties. Verder zijn bepaalde typische klinische kenmerken (zoals de hoogte van de koorts bij Hib-infectie) tegenwoordig minder relevant [21].
Een complicerende factor bij de beoordeling van het kind met koorts is dat het veelal jonge kinderen betreft. Het klinische beeld bij jonge kinderen met koorts kan dramatisch verslechteren in korte tijd. Daarentegen kan een kind met een virale infectie aanvankelijk ziek lijken, maar snel herstellen. Daar ernstige ziekten met koorts bij kinderen minder frequent voorkomen bestaat enerzijds het gevaar van overdiagnostiek en -behandeling en anderzijds van het (te) laat onderkennen van het ernstig zieke kind. Per jaar overlijden 23 kinderen in Nederland aan een infectieziekte die (bij tijdige onderkenning) goed te behandelen zou zijn geweest (RIVM, 2011).
De zorg bij ouders over een ernstige oorzaak bij een kind met koorts is groot [10]. In een studie naar de reactie van ouders wanneer hun kind acuut ziek werd, bleek dat ouders hoofdzakelijk bezorgd zijn over koorts, hoesten en de kans op meningitis [11]. Een groot deel van de ouders bezoekt de SEH zonder verwijzing via de huisarts. Bij kinderen met een ernstige infectie hebben ouders vaak hun bezorgdheid terecht geuit [12]. Bij te late onderkenning van ernstige infecties blijkt vaak eerder wel adequaat hulp te zijn gezocht door ouders [13], maar is instructie voor herbeoordeling bij verslechtering onvolledig gebleken. De rol van de ouders en de aard van instructie ten aanzien van follow-up is in de huidige richtlijnen onvoldoende belicht [14, 15].
Doelstelling
Evidence-based onderbouwing van de beoordeling en de eerste behandeling van het kind met koorts in de tweedelijnszorg teneinde enerzijds ernstige infecties vroegtijdig te
herkennen en anderzijds overdiagnostiek te beperken.
Toelichting
In deze richtlijn verstaan we onder ‘ernstige infecties’ die infecties die interventie behoeven, zoals ernstige bacteriële infecties (meningitis, sepsis, pneumonie, urineweginfectie, septische arthritis, osteomyelitis) en encefalitis (HSV). Bij de samenvatting van de aanbevelingen dient te worden opgemerkt dat de brede differentiaal diagnose bij het kind met koorts raakvlakken vertoont met specifieke ziektebeelden, welke in deze algemene richtlijn voor het kind met koorts niet volledig zijn uitgediept.
Doelgroep
Deze richtlijn is bedoeld voor alle zorgverleners in de tweede lijn, betrokken bij de opvang van het kind van 0 - 16 jaar met koorts, verdacht van een infectie. Daarnaast is de richtlijn bedoeld voor ouders van kinderen met koorts. De richtlijn geldt niet voor de neonatale sepsis en de gehospitaliseerde neonaat. De richtlijn sluit aan bij de NHG-standaard [15]. Koorts is een symptoom van infectie. Het is van belang ernstige infecties vroegtijdig te herkennen, zodat adequaat gehandeld kan worden. Van belang is echter ook dat er geen overdiagnostiek plaatsvindt bij kinderen zonder ernstige infectie.
Vanuit dit perspectief is het doel van deze richtlijn:
Evidence-based onderbouwing van de beoordeling, diagnostisch beleid en eerste handelingen bij het kind met koorts in de tweedelijnszorg, teneinde ernstige infecties vroegtijdig te herkennen en overdiagnostiek te beperken.
Samenstelling werkgroep
Projectteam
Mw. dr. R. Oostenbrink (projectleider), kinderarts Erasmus MC-Sophia, Rotterdam
Dhr. drs. R. G. Nijman (arts), Erasmus MC-Sophia, Rotterdam
Mw. drs. M.K. Tuut (epidemioloog, projectadviseur)
Mw. dr. L.M.A.J. Venmans (epidemioloog)
Werkgroepleden
Dhr. dr. G.J. Driessen, SPII, kinderarts-infectioloog/immunoloog, Erasmus MC-Sophia, Rotterdam
Dhr. dr. R.H. Dijkstra, NHG
Mw. A. Horikx, KNMP (meelezer)
Mw. Dr. W.M. Klein, NVvR, radioloog UMCN St Radboud Nijmegen (meelezer)
Dhr. dr. R. Kornelisse, sectie Neonatologie NVK, neonatoloog, Erasmus MC-Sophia, Rotterdam
Mw. dr. T. Krediet, sectie Neonatologie NVK (meelezer)
Mw. drs. N. Oteman, NHG
Mw. H. Rippen, Stichting Kind en Ziekenhuis
Mw. dr. Y.B. de Rijke, NVKC, klinisch chemicus Erasmus MC-Sophia, Rotterdam
Mw. M. Steijn, V&VN, verpleegkundig specialist neonatologie IJsselland ziekenhuis, Capelle a/d IJssel (meelezer)
Drs. L.P. Tan, NVZA, Ziekenhuisapotheker Groene Hart Ziekenhuis, Gouda(meelezer)
Mw. dr. M. Verboon, sectie Neonatologie NVK, neonatoloog UMC Utrecht
Mw. dr. E. de Vries, SPII, kinderarts-infectioloog/immunoloog, Jeroen Bosch Ziekenhuis, ’s-Hertogenbosch
Mw. drs. A. van Wermeskerken, SAP, kinderarts Flevoziekenhuis, Almere
Mw. dr. M. van Westreenen, NVMM, microbioloog Erasmus MC, Rotterdam
Mw. drs. M.P.W. Zaanen-Bink, NVSHA, SEH-arts KNMG, St.Antonius Ziekenhuis, Nieuwegein
De werkgroep is multidisciplinair samengesteld: beoefenaars uit verschillende disciplines betrokken bij de diagnostiek en behandeling van het kind met koorts en verdacht van infectie in de tweede en derde lijn zijn verzocht te participeren. Als aanvulling hierop werden werkgroepleden gevraagd vanuit de wetenschappelijke vereniging van huisartsgeneeskunde en vanuit de patiëntengroep. Leden van de werkgroep werden namens de betreffende (wetenschappelijke) verenigingen verzocht zitting te nemen in de werkgroep op grond van hun persoonlijke expertise en/of affiniteit met het onderwerp. Het projectteam was verantwoordelijk voor het formuleren van de uitgangsvragen, verrichten van de literatuurzoekstrategie, het uitwerken van de uitgangsvragen en het formuleren van de richtlijntekst. De werkgroepleden beoordeelden en adviseerden in deze stappen.
Belangenverklaringen
De werkgroepleden hebben een belangenverklaring ingevuld waarin ze hun banden met de farmaceutische industrie hebben aangegeven. De verklaringen liggen ter inzage bij de NVK.
Inbreng patiëntenperspectief
Het perspectief van de ouders van patiënten en patiënten is meegenomen door vertegenwoordiging van de directrice van Stichting Kind en Ziekenhuis in de werkgroep.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de ontwikkeling van het concept van de richtlijn is zo veel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen. De definitieve richtlijn is onder de verenigingen verspreid en via de website van de NVK (www.nvk.nl) elektronisch beschikbaar gesteld. Op wetenschappelijke bijeenkomsten van de betrokken wetenschappelijke verenigingen zijn de aanbevelingen van de richtlijn gepresenteerd. Verder kan de lekensamenvatting uit deze richtlijn dienen als patiëntenvoorlichtingsmateriaal.
Om de implementatie en evaluatie van deze richtlijn te stimuleren, zijn interne indicatoren ontwikkeld aan de hand waarvan de implementatie steekproefsgewijs kan worden gemeten. Indicatoren geven in het algemeen de zorgverleners de mogelijkheid te evalueren of zij de gewenste zorg leveren. Zij kunnen daarmee ook onderwerpen voor verbeteringen van de zorgverlening identificeren. De interne indicatoren die bij de onderhavige richtlijn zijn ontwikkeld, worden behandeld in hoofdstuk 5 van deze richtlijn.
Werkwijze
De ontwikkeling van de richtlijn Koorts bij kinderen is gefinancierd door Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Van januari 2012 tot juli 2013 is aan de ontwikkeling van de richtlijn gewerkt door leden van de (kern)werkgroep.
Allereerst werd een knelpuntenanalyse onder de werkgroepleden uitgevoerd om de huidige werkwijze ten aanzien van de diagnostiek en behandeling van kinderen met koorts in Nederland in kaart te brengen. Tevens werd de leden gevraagd een prioritering aan te brengen in de gemelde knelpunten. De knelpunten werden gecategoriseerd in verschillende groepen: diagnostische waarde van symptomen, diagnostische waarde van laboratoriumparameters, indicatie voor aanvullend onderzoek, indicatie voor virale diagnostiek, indicatie voor empirische behandeling, vragen t.a.v. antipyretica en vragen t.a.v. follow-up. De knelpunten werden vertaald in uitgangsvragen. Vervolgens werd volgens de methode van Evidence-Based Richtlijn Ontwikkeling (EBRO) per vraag een uitgebreid literatuuronderzoek verricht. In eerste instantie werd gezocht naar evidence-based richtlijnen. Hierbij werd gebruik gemaakt van de volgende databases: GIN, SUMSEARCH, Clinical evidence van BMJ, SIGN en de TRIP DATABASE, en www.guidelines.gov (National Guidelines Clearinghouse, USA). De gevonden richtlijnen werden op kwaliteit beoordeeld door de kernwerkgroepleden met behulp van het AGREE II-instrument [18]. Wanneer er een valide richtlijn werd gevonden, werd de evidence uit de richtlijn gebruikt om de vragen te beantwoorden. De met AGREE II vastgestelde domeinscores werden gebruikt als houvast voor de beoordeling van de richtlijn. Wanneer er geen geschikte richtlijn werd gevonden, werd gezocht naar systematische literatuuroverzichten in Medline en Embase. Er werd gebruik gemaakt van zoektermen zoals beschreven in. Aanvullend werden originele studies gezocht vanaf het moment dat de zoekactie in de review eindigde. De geselecteerde literatuur werd beoordeeld op kwaliteit en inhoud met behulp van formulieren van het Cochrane Center (https://netherlands.cochrane.org/beoordelingsformulieren-en-andere-downloads). Aan elk geselecteerd artikel werd een mate van bewijskracht toegekend zoals vermeld in Appendix C. Indeling van onderzoeksresultaten naar mate van bewijskracht. De volledige (evidence-based) uitwerking van de uitgangsvragen met de daarbij geformuleerde conclusies werd geheel voorbereid door het projectteam. De gehele werkgroep formuleerde de definitieve aanbevelingen. Naast de evidence werden hierbij ‘overige overwegingen’ uit de praktijk, die expliciet genoemd werden, meegenomen. De werkgroep kwam in totaal vier keer bijeen: één keer om uitgangsvragen te formuleren, twee keer om de resultaten van een systematische literatuursearch en overige overwegingen te bespreken en één keer om de definitieve aanbevelingen te formuleren. Voor enkele uitgangsvragen, namelijk uitgangsvragen 1, 2, en 16 - 19, was het niet mogelijk om door middel van literatuuronderzoek volgens de EBRO-methode op systematische wijze de antwoorden te zoeken. De formulering van aanbevelingen ter beantwoording van deze vragen is tot standgekomen op basis van consensus binnen de werkgroep.
Indeling van onderzoeksresultaten naar mate van bewijskracht
|
. |
Interventie |
Diagnostisch accuratesse onderzoek |
Schade of bijwerkingen, etiologie, prognose* |
|
A1 |
Systematische review van tenminste twee onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau |
||
|
A2 |
Gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang |
Onderzoek ten opzichte van een referentietest (een ‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van de resultaten van test en gouden standaard, betreffende een voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad |
Prospectief cohortonderzoek van voldoende omvang en follow-up, waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten. |
|
B |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiënt-controleonderzoek, cohortonderzoek) |
Onderzoek ten opzichte van een referentietest, maar niet met alle kenmerken die onder A2 zijn genoemd |
Prospectief cohortonderzoek, maar niet met alle kenmerken als genoemd onder A2 of retrospectief cohortonderzoek of patiëntcontroleonderzoek |
|
C |
Niet-vergelijkend onderzoek |
||
|
D |
Mening van deskundigen |
||
* Deze classificatie is alleen van toepassing in situaties waarin om ethische of andere redenen gecontroleerde trials niet mogelijk zijn. Zijn die wel mogelijk dan geldt de classificatie voor interventies.
Niveau van bewijskracht van de conclusie op basis van het aan de conclusie ten grondslag liggende bewijs
|
|
Conclusie gebaseerd op |
|
1 |
Onderzoek van niveau A1 of tenminste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2 |
|
2 |
1 onderzoek van niveau A2 of tenminste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
3 |
1 onderzoek van niveau B of C |
|
4 |
Mening van deskundigen |
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
