Aanvullende diagnostiek bij kind met koorts
Uitgangsvraag
- Wat is de indicatie voor het afnemen van een bloedkweek bij kinderen met koorts die mogelijk een bacteriële systemische infectie (i.e. sepsis, meningitis) hebben als onderdeel van de diagnostische aanpak tijdens het bezoek aan de SEH?
- Wat is de indicatie voor het afnemen van een urinekweek bij kinderen met koorts die mogelijk een urineweginfectie hebben als onderdeel van de diagnostische aanpak tijdens het bezoek aan de SEH?
- Wat is de indicatie voor het verrichten van een liquorpunctie bij kinderen met koorts die mogelijk een bacteriële dan wel virale meningitis (of encefalitis) hebben als onderdeel van de diagnostische aanpak tijdens het bezoek aan de SEH?
- Wat is de indicatie voor het maken van een thoraxfoto bij kinderen met koorts die mogelijk een bacteriële lagereluchtweginfectie hebben als onderdeel van de diagnostische aanpak tijdens het bezoek aan de SEH?
Aanbeveling
Deze aanbevelingen voor aanvullende diagnostiek gelden voor het kind verdacht van een ernstige infectie (ernstige bacteriële infectie of virale encefalitis), d.w.z. voor het kind met koorts zonder focus, of voor het kind met koorts met een focus, bij wie de aanwezige alarmsymptomen niet passen bij het betreffende focus.
Kinderen ≤ 1 maand met koorts (T > 38,0°C) of hypothermie (T < 36,0°C)
- Bloedkweek
- Urinekweek (via catheter of via blaaspunctie)
Liquoronderzoek (celgetal, chemie, bacteriële kweek en PCR op HSV, entero- en parechovirus) moet laagdrempelig worden overwogen bij ontbreken van een focus voor de koorts en is in ieder geval geïndiceerd bij:
- Leeftijd ≤ 13 dagen
- Rode’ alarmsymptomen (#Tabel 1) of afwijkende Rochestercriteria (Tabel 2)
- Leukopenie (leukocytengetal < 5 x 109/L) of leukocytose (leukocytengetal > 15 x109/L)
- CRP > 80 mg/L of PCT > 2.0 ng/L
Overweeg de volgende onderzoeken:
- PCR entero- en parechovirus (faeces, keelwat, serum)
- PCR Influenza (keelwat, liquor) in endemisch seizoen
- Bacteriële faeceskweek indien er sprake is van bloederige diarree
Kinderen 1-3 maanden
Indien één of meer kenmerken die wijzen op een hoog risico op een ernstige aandoening (één of meer ‘rode’ alarmsymptomen’ (#Tabel 1) of afwijkende Rochestercriteria (leeftijd <2 mnd Tabel 2)):
- Urinekweek (via catheter of via blaaspunctie) indien afwijkingen bij algemeen urineonderzoek of vóór start antibiotica
- Bloedkweek vóór start antibiotica
Overweeg bovenstaande diagnostiek indien
- Twee of meer ‘oranje’ alarmsymptomen (#Tabel 1) en/of afwijkende Rochestercriteria (leeftijd < 2 mnd Tabel 2)
- Eén oranje alarmsymptoom (#Tabel 1) EN een CRP > 20 mg/L / PCT > 0,5 ng/L
Liquoronderzoek (chemie, celgetal, bacteriële kweek en PCR op HSV, entero- en parechovirus) moet laagdrempelig worden overwogen bij ontbreken van een focus voor de koorts, vooral bij:
- Eén of meer ‘rode’ alarmsymptomen (#Tabel 1)
- Focusspecifieke symptomen voor meningitis/encefalitis (#Tabel 3).
- Leukopenie (leukocytengetal < 5 x 109/L) of leukocytose (leukocytengetal > 15 x 109/L)
- CRP > 80 mg/L / PCT > 2,0 ng/L
Overweeg de volgende onderzoeken:
- Bacteriële faeceskweek indien er sprake is van bloederige diarree
- PCR op enterovirus/parechovirus (met name indien een sepsis/meningitis-achtig beeld (#Tabel 3) of ten tijde van enterovirus seizoen)
- PCR Influenza (keelwat(in endemisch seizoen)
Kinderen met koorts > 3 maanden
Indien één of meer kenmerken die wijzen op een hoog risico op een ernstige aandoening (één of meer ‘rode’ alarmsymptomen (#Tabel 1)):
- Urinekweek (via gewassen midstream, via catheter of via blaaspunctie) indien afwijkingen bij algemeen urineonderzoek of vóór start antibiotica
- Bloedkweek vóór start antibiotica
Overweeg bovenstaande diagnostiek indien
- Twee of meer ‘oranje’ alarmsymptomen (#Tabel 1)
- Eén oranje alarmsymptoom (#Tabel 1) EN een CRP > 20 mg/L / PCT > 0,5 ng/L
Liquoronderzoek (chemie, celgetal, bacteriële kweek en HSV) dient te worden overwogen bij:
- Eén of meer ‘rode’ alarmsymptomen (#Tabel 1).
- Focusspecifieke symptomen voor meningitis/encefalitis (#Tabel 3)
- CRP > 80 mg/L / PCT > 2,0 ng/L
Algemeen
Er is geen indicatie voor routinematig maken van thoraxfoto’s bij kinderen met koorts zonder focus en zonder alarmsymptomen voor ernstige infecties. Wel kan het worden overwogen als aanvullend focus onderzoek bij:
- Eén of meer ‘rode’ alarmsymptomen (#Tabel 1) OF een CRP-waarde van >80 mg/L / PCT > 2,0 ng/L
- Twee of meer ‘oranje’ alarmsymptomen EN een CRP-waarde van > 20 mg/L / PCT > 0,5 ng/L
Vanwege de kans op bijkomende infecties behoren ook kinderen met koorts met een klinische verdenking van een virale luchtweginfectie (al dan niet met diagnostiek bevestigd) een volledige klinische beoordeling van eventuele alarmsymptomen te ondergaan en dient men overeenkomstig te handelen (#Tabel 1).
Overwegingen bij liquorpuncties:
- Contraïndicatie zijn o.a. verhoogde bloedingsneiging, neurologische symptomen van verhoogde druk, gestoord bewustzijn en pustuleuze huidafwijking ter plaatse van de punctie (zie ook richtlijn Bacteriële meningitis, NVN).
- Een liquorpunctie dient zo spoedig mogelijk te worden uitgevoerd, en bij voorkeur voordat antibiotische therapie wordt gestart.
- Bij jonge kinderen kunnen infecties met enterovirus, HSV en parechovirus ook via PCR in het bloed worden aangetoond, eventueel als vervanging van liquoronderzoek.
Overwegingen
Bij kinderen met een ernstige bacteriële infectie zijn pneumonie en urineweginfectie de belangrijkste diagnoses (beide 3,4%) [38]. Sepsis en meningitis komen weinig frequent voor, maar kennen de grootste complicaties bij te late diagnose en behandeling. Ook in recente literatuur zijn deze ernstigere diagnoses ondervertegenwoordigd en dienen conclusies over het achterwege laten van o.a. bloedkweek en/of liquoronderzoek voorzichtig te worden geïnterpreteerd.
Ook bij kinderen met een bronchiolitis en koorts wordt in 3% van de gevallen een urineweginfectie vastgesteld. Derhalve is het beleid bij een kind met bronchiolitis voor aanvullende diagnostiek vergelijkbaar als dat bij het kind met koorts in het algemeen en dient ook bij hen actief gezocht te worden naar alarmsymptomen. Hoewel specifieke bewijsvoering hiervoor ontbreekt, is de werkgroep van mening dat dit advies ook geldt voor kinderen met een andere virale (luchtweg)verwekker.
De indicatie voor aanvullende diagnostiek wordt bepaald door de afweging van de kans op een bacteriële infectie versus de kans op complicaties bij te laat gestelde diagnose. Dit wordt mede beïnvloed door o.a. vaccinatiegraad en leeftijd van het kind.
De besproken studies laten zien dat de incidentie van bacteriëmie onder niet-ziek ogende kinderen met koorts laag is en is gedaald na de introductie van de PCV7-vaccinatie. Er is wederom weinig literatuur over het diagnostische beleid bij kinderen > 3 jaar.
De gevonden literatuur bespreekt niet de diagnostische accuratesse van bloedkweek, urinekweek en/of liquorkweek, en behandelt ook niet de nadelen van de verrichting (invasiviteit van de handeling) om materiaal voor een kweek te verkrijgen.
Er is onvoldoende evidence voor de diagnostische waarde van alternatieve diagnostische mogelijkheden voor verwekkers van bacteriële infecties in bloed, urine of liquor, zoals PCR of Antigeen-detectie gericht op S. pneumoniae om deze standaard op te nemen in de diagnostische aanpak.
In de gepresenteerde studies wordt gebruikt gemaakt van een verhoogd leukocytengetal als indicator voor het verrichten van een thoraxfoto om een pneumonie op te sporen. Dit borduurt verder op criteria die in eerdere literatuur zijn opgesteld. Er is geen literatuur die het leukocytengetal heeft vervangen door of heeft vergeleken met een afkapwaarde voor CRP.
Literatuur die specifiek gaat over de wijze en aard van diagnostiek voor urineweginfecties is voor deze richtlijn niet meegenomen. Graag verwijzen wij naar de NVK-richtlijn voor urineweginfecties bij kinderen: http://www.nvk.nl/Kwaliteit/Richtlijnenenindicatoren/Richtlijnen/Urineweginfectiesbijkinderen.aspx . Als gevolg daarvan bespreken we in deze richtlijn ook niet de consequenties van asymptomatische bacteriurie.
Voor het vaststellen van een pneumonie gelden een aantal specifieke overwegingen:
- Bevindingen op de thoraxfoto bij virale en bacteriële luchtweginfecties overlappen. Alleen een lobair infiltraat heeft enige onderscheidende waarde. Daarnaast is er een grote interobservervariabiliteit in de interpretatie van de thoraxfoto. Bovendien is er geen gouden standaard voor pneumonie. Dit beïnvloedt de interpretatie van studies van aanvullende voorspellers van pneumonie bij kinderen met koorts [78-80]. Het is namelijk de vraag of de afwijkingen gevonden op de thoraxfoto altijd klinische relevantie hebben, d.w.z. antibiotische behandeling behoeven.
- Als de thoraxfoto niet conclusief is voor de origine van verwekkers (viraal vs. bacterieel), is de diagnose occulte pneumonie (i.e. afwijkende thoraxfoto bij kinderen met koorts zonder respiratoire symptomen), zoals besproken in een aantal studies, volgens de werkgroep niet relevant. Derhalve gaan we niet in op de beschreven associatie tussen een verhoogd leukocytengetal en een occulte pneumonie. Er is geen literatuur die het leukocytengetal heeft vervangen door of heeft vergeleken met een afkapwaarde voor CRP.
Onderbouwing
Achtergrond
In vorige uitgangsvragen zijn de alarmsymptomen voor ernstige bacteriële infecties aan de orde gekomen. Als referentiestandaard werd daar de diagnostiek gebruikt die in deze uitgangsvraag wordt behandeld. Voor het beantwoorden van de uitgangsvragen over voorspellende waarden infectieparameters is geen literatuur gevonden die het verrichten van bepaalde diagnostiek positioneert voor een algemene populatie van kinderen met koorts. Wel is er literatuur over het al dan niet verrichten van diagnostiek bij kinderen zonder alarmsymptomen en het verrichten van aanvullende diagnostiek bij kinderen met een specifieke diagnose. Als uitgangspunt van deze uitgangsvraag hebben we derhalve literatuur over kinderen genomen die geen alarmsymptomen voor een ernstige bacteriële infectie hebben en bij wie diagnostiek wel of niet achterwege kan worden gelaten. Ook behandelen we de literatuur over kinderen die zijn gediagnosticeerd met een bepaalde infectie bij wie aanvullende diagnostiek moet worden overwogen om bijkomende infecties uit te sluiten.
Conclusies
Conclusies uitgangsvraag 1
|
Niveau* |
|
|
1 |
De incidentie van bacteriëmie bij kinderen met koorts op de SEH is gedaald na introductie van de PCV7-vaccinatie. Onder gezonde, niet-ziek ogende kinderen met koorts tussen 3 maanden en 3 jaar ligt de incidentie van bacteriëmie onder de 1% en onder de 0,5% in gebieden met een hoge vaccinatiegraad. Ook de incidentie van bacteriëmie onder kinderen van 1 tot 3 maanden met koorts is laag.
A1 systematische review van Bressan et al. [60] B observationele studie van Morley et al. [22] B observationele studie van Greenhow et al. [61] |
|
1 |
De incidentie van ernstige bacteriële infecties, en met name van bacteriëmie en meningitis, bij kinderen ≤ 60 dagen met koorts die een influenza-infectie hebben, is lager dan bij kinderen met koorts zonder influenza-infectie.
A1 HTA-studie van Hiu et al. [34] B observationele studie van Krief et al. [62] |
|
3 |
Het risico van bacteriëmie is klein bij gezonde, niet-ziek ogende kinderen tussen 1 en 3 maanden die de SEH bezoeken en bij wie een urineweginfectie werd vastgesteld. Kinderen met risicofactoren, namelijk de aanwezigheid van een van de volgende kenmerken: prematuriteit, eerdere ziekenhuisopname, comorbiditeit, antenatale urogenitale afwijkingen, eerdere antibiotische behandeling en een zieke indruk ten tijde van presentatie, hadden een grotere kans op bacteriëmie bij een urineweginfectie (RR 9,25, 95% CI 1,15 -74,4).
B observationele studie van Velasco-Zuniga et al.[63] |
Conclusies uitgangsvraag 2
|
Niveau* |
|
|
1 |
Kinderen < 90 dagen met een klinische bronchiolitis, een influenza-infectie of een RSV-infectie hebben een klein, maar niet verwaarloosbaar, risico op een bijkomende urineweginfectie (3,3%; 0-4.2%).
A1 systematische review van Ralston et al. [64] A1 HTA studie van Hiu et al. [34] B observationele studie van Krief et al. [62] |
|
1 |
De incidentie van urineweginfecties onder kinderen < 60 dagen met koorts is hoog (9 – 10%). Sommige studies tonen ditzelfde percentage aan voor oudere kinderen (tot 2 jaar).
A2 observationele studie van Craig et al. [38] A2 observationele studie van Rudinsky et al. [32] B observationele studie van Morley et al. [22] B observationele studie van Hsiao et al. [65] |
Conclusies uitgangsvraag 3
|
Niveau* |
|
|
2 |
De incidentie van bacteriële meningitis onder kinderen met een eenvoudige koortsconvulsie is zeer klein (0%, 95% BI 0 – 3%).
B systematische review van Hom et al.[66]
De incidentie van bacteriële meningitis onder kinderen met een atypische convulsie bij koorts is zeer klein.
B observationele studie van Kimia et al. [67] B observationele studie van Seltz et al. [73] |
|
2 |
De kans op celverhoging in de liquor of een bacteriële meningitis is erg klein bij jonge kinderen > 1 maand met koorts zonder focus die een afwijkende urineanalyse of een bewezen urineweginfectie, hebben, vooral wanneer zij een niet-zieke indruk maken. Bij kinderen < 1 maand was deze kans klein, maar niet verwaarloosbaar.
B observationele studie van Paquette et al. [69] B observationele studie van Shah et al. [70] B observationele studie van Tebruegge et al. [68] |
|
3 |
Een beleid om bij jonge kinderen met koorts < 3 maanden liquorpuncties op indicatie van de arts te verrichten, leidt niet tot het missen van kinderen met een bacteriële meningitis.
B observationele studie van Mintegi et al.[71] |
|
3 |
De kans op een bacteriële meningitis bij kinderen < 90 dagen met koorts en met celverhoging in de liquor was klein. De hoogste incidentie werd gezien bij kinderen < 2-3 weken. Temperatuur, leukocytengetal in het bloed en een bezoek aan de SEH gedurende de zomermaanden zijn mogelijk voorspellend voor celverhoging in de liquor.
B observationele studie van Meehan et al.[72] |
Conclusies uitgangsvraag 4
|
Niveau* |
|
|
2 |
Bij kinderen met koorts zonder focus wordt relatief vaak een pneumonie aangetoond op een thoraxfoto (5 – 9%), ook na invoering van de PCV7-vaccinatie en ook als er geen symptomen van een lagereluchtweginfectie waren.
B observationele studie van Shah et al. [74] B observationele studie van Mintegi et al. [77] B observationele studie van Rutman et al. [76] B observationele studie van Murphy et al. [75] |
|
2 |
Een pneumonie wordt relatief vaak aangetoond op een thoraxfoto, door het routinematig maken van een thoraxfoto bij kinderen met koorts zonder focus, een lichaamstemperatuur > 39,0oC en een leukocytengetal van > 20×109/L
B observationele studie van Rutman et al. [76] B observationele studie van Mintegi et al. [77] |
* Zie Verantwoording: Werkwijze.
Samenvatting literatuur
Beschrijving evidence uitgangsvraag 1
Wat is de indicatie voor het afnemen van een bloedkweek bij kinderen met koorts die mogelijk een bacteriële systemische infectie (i.e. sepsis, meningitis) hebben als onderdeel van de diagnostische aanpak tijdens het bezoek aan de SEH?
Na de NICE-richtlijn zijn er twee systematische reviews en vier cohortstudies verschenen die relevant zijn voor deze uitgangsvraag. Ze worden hieronder beschreven en zijn samengevat in de evidence-tabel 13 en tabel 15.
In het artikel van Bressan et al. [60] werd onder meer een studie beschreven naar de incidentie en kenmerken van bacteriëmie bij kinderen met koorts op de SEH aan de hand van bloedkweken. Doel was het beschrijven van de incidentie van occulte bacteriëmie onder jonge kinderen met koorts. In totaal werden tien artikelen geïncludeerd in de studie: vijf artikelen includeerden gezond uitziende kinderen van 3 maanden tot 3 jaar met koorts zonder focus, één studie ging over kinderen tot 3 maanden met koorts zonder focus en vier studies includeerden kinderen met koorts ongeacht focus en gezond/ziek eruit zien. In studies met een hoge vaccinatiegraad werd bij < 0,5% van de kinderen van 3 maanden tot 3 jaar met koorts zonder focus die een niet-zieke indruk maakten, een occulte bacteriëmie vastgesteld. Een occulte bacteriëmie werd vastgesteld met een bloedkweek en een inschatting van de ‘mate van ziek-zijn’ werd meestal gedaan aan de hand van laagrisicocriteria. In vergelijking met de periode voorafgaand aan de pneumokokkenvaccinatie was er een duidelijke afname van de incidentie van occulte bacteriëmie te zien. Studies toonden bij kinderen < 3 maanden een incidentie van 2 – 2,2% voor bacteriëmie, dit was 0,34% (95% BI 0 – 1,0%) bij kinderen van 3 maanden tot 3 jaar. Bij zuigelingen < 3 maanden met een zieke indruk of met afwijkende bevindingen bij algemeen urineonderzoek werd vaker bacteriëmie vastgesteld. Conclusie is dat bacteriëmie tegenwoordig weinig wordt gediagnosticeerd. Het routinematig afnemen van bloedkweken bij jonge kinderen in de leeftijd van 3 maanden tot 3 jaar kan daardoor wellicht worden vervangen door goede follow-up zonder verdere laboratoriumdiagnostiek. Hoewel de kenmerken van de verschillende studies die in de review waren geïncludeerd werden gepresenteerd, zijn de selectieprocedure en kwaliteitsbeoordeling van de artikelen niet helder beschreven.
Voor de beschrijving van de HTA-studie van Hiu et al. [34], zie uitgangsvraag 4 (module 'De voorspellende waarde van klinische symptomen bij het kind met koorts').
Greenhow et al. [61] beschreven in hun retrospectieve studie de incidentie van positieve bloedkweken onder voorheen gezonde jonge kindereren van 1 week tot 3 maanden bij wie een bloedkweek was afgenomen bij presentatie op polikliniek of SEH (of in de eerste 24 uur van de opname). Ze vonden positieve bloedkweken bij 93 van 4255 (2,2%) en ze berekenden dat bacteriëmie 0,57 per 1000 gezonde jonge kinderen voorkwam. Van de 93 kinderen met een positieve bloedkweek hadden 6 kinderen, inclusief 2 kinderen met ondertemperatuur, geen koorts ten tijde van de presentatie. De incidentie van positieve bloedkweken varieerde per leeftijdsgroep: 2,84% voor kinderen tussen 7 en 28 dagen, 1,92% voor kinderen tussen 29 en 60 dagen en 2,14% voor kinderen tussen 61 en 92 dagen. Van de kinderen met een positieve bloedkweek hadden 10 kinderen een bacteriële meningitis en 50 kinderen hadden zowel een positieve bloedkweek als een positieve urinekweek. Het onderzoek wordt aanzienlijk beperkt door het retrospectieve karakter en het ontbreken van gestandaardiseerde klinische gegevens van de patiënten en de populatieselectie. Over de werkelijke incidentie van bacteriëmie onder kinderen met koorts kunnen op basis van deze publicatie geen uitlatingen worden gedaan.
Krief et al. [62] keken in hun cross-sectionele prospectieve studie naar het voorkomen van concomitante ernstige bacteriële infecties bij kinderen verdacht van een influenza-infectie. Een ernstige bacteriële infectie werd gedefinieerd als bacteriëmie, meningitis, enteritis of urineweginfectie op basis van bacteriële kweken. Kinderen ≤ 60 dagen met koorts, gedefinieerd als een thuis of op de SEH gemeten rectale temperatuur van ≥ 38,0oC, die een van de vijf aan de studie deelnemende SEH’s bezochten gedurende drie influenzaseizoenen, kwamen in aanmerking voor een influenzasneltest. Antibioticagebruik voorafgaand aan het SEH-bezoek was een exclusiecriterium. Diagnostiek omvatte routinematig influenzatesten, bloedkweken, urinekweken, liquorkweken en op indicatie thoraxfoto’s en faeceskweken. Uiteindelijk werden 844 van de 1091 (77%) kinderen getest op een influenza-infectie, van wie 123 kinderen daadwerkelijk een influenza-infectie hadden (14,3%). Bij 95 van de 809 kinderen met aanvullende diagnostiek was er sprake van een concomitante bacteriële infectie (11,7%, 95% BI 6,96 – 14,2%). Onder de kinderen met een influenza-infectie was de incidentie van ernstige bacteriële infectie 2,5% (95% BI 0,5 – 7,2%); het betrof hier drie kinderen met een urineweginfectie die een niet-zieke indruk maakten. In de leeftijdscategorie van 0 tot 29 dagen waren er onder de influenzapositieve kinderen (n=36) geen kinderen met een ernstige bacteriële infectie. In totaal hadden 16 kinderen bacteriëmie (1,9%) en waren er 6 kinderen met een bewezen bacteriële meningitis. Geen van deze kinderen had een positieve test voor influenza. Een lobaire pneumonie werd gevonden bij 1 influenzapositief kind (36 beschikbare thoraxfoto’s, 2,8% (95% BI 0,5 – 14,2%)), en bij 18 influenzanegatieve kinderen (226 beschikbare thoraxfoto’s, 8,0% (95% BI 5,1 – 12,2%)). De auteurs concludeerden dat ernstige bacteriële infecties minder vaak voorkwamen bij kinderen die ook een bewezen influenza- infectie hadden dan bij kinderen die geen influenza-infectie hadden. Concomitante urineweginfectie komt weinig frequent voor bij kinderen > 1 maand met influenza. Beperking van dit onderzoek is dat niet alle kinderen werden geïncludeerd en een influenzasneltest kregen, en dat niet alle geïncludeerde kinderen bloedkweken en urinekweken ondergingen.
Velasco-Zuniga et al. [63] beschreven in hun retrospectieve studie dat de kans op het hebben van bacteriëmie naast een urineweginfectie laag was voor niet-zieke kinderen met een laag CRP. In hun studie van 140 kinderen in de leeftijd van 30 tot 90 dagen (gemiddelde leeftijd 55 dagen) die zich met een urineweginfectie op de SEH presenteerden, hadden 10 kinderen ook bacteriëmie en 1 kind had ook een bacteriële meningitis. Een urineweginfectie werd gedefinieerd op basis van een positieve urinekweek na katheterisatie of blaaspunctie. De auteurs definieerden als risicofactoren de aanwezigheid van een van de volgende kenmerken: prematuriteit, eerdere ziekenhuisopname, comorbiditeit, antenatale urogenitale afwijkingen, eerdere antibiotische behandeling en een zieke indruk ten tijde van de presentatie. Onder een zieke indruk werd onder meer een Glascow Coma Scale < 15, de aanwezigheid van petechiën, een vertraagde capillaire refill-tijd, een tachycardie of een verhoogd CRP verstaan. Het hebben van een risicofactor verhoogde het risico op een bacteriëmie of meningitis (RR 9,25, 95% BI 1,15 – 74,4). Slechts 1 kind met een urineweginfectie zonder risicofactoren ontwikkelde bacteriëmie. De resultaten van de studie moeten worden gezien in het licht van de retrospectieve studie-opzet, dataverzameling en de geselecteerde patiëntenpopulatie.
Morley et al. [22] onderzochten retrospectief de incidentie van ernstige bacteriële infecties onder voorheen gezonde kinderen < 60 dagen die zich met koorts (thuis gemeten of op de SEH een temperatuur van ≥ 38,0oC) presenteerden op de SEH. Bij de 207 geïncludeerde kinderen werd minimaal een van de volgende kweken afgenomen: een bloedkweek en/of een urinekweek en/of een liquorkweek. Onder de 77 kinderen < 28 dagen werd bij 2,7% (95% BI 0 – 6,4%, n=2/75) een positieve bloedkweek gevonden, bij 10,7% (95% BI 3,5 – 17,8%, n=8/75) werd een positieve urinekweek gevonden en bij 0% (95% BI 0 – 3,6%, n=0/71) werd een positieve liquorkweek gevonden. Onder de 130 kinderen ≥ 28 dagen tot 60 dagen hadden minder kinderen een positieve bloedkweek (1,5% (95% BI 0 – 3,6%, n=2/130)), iets minder kinderen een positieve urinekweek (8,5% (95% 32,7 – 13,3%, n=11/126)) en meer kinderen een positieve liquorkweek (1,7% (95% BI 0 – 5,0%, n=1/59)). Het ging hierbij om kleine absolute aantallen. Twee niet-ziek ogende kinderen hadden een urosepsis met een positieve bloedkweek en een urinekweek voor E.coli; 1 kind had daarbij een leukocytose, en 1 kind had een leukopenie. Eén kind met klinische alarmsymptomen en een leukocytose in het bloed had een bacteriële meningitis (Streptococcus pneumoniae). In deze studie ondergingen niet alle kinderen een liquorpunctie; er werd gekeken naar een geselecteerde patiëntenpopulatie en alle data werden retrospectief teruggezocht in de status.
Beschrijving evidence uitgangsvraag 2
Wat is de indicatie voor het afnemen van een urinekweek bij kinderen met koorts die mogelijk een urineweginfectie hebben als onderdeel van de diagnostische aanpak tijdens het bezoek aan de SEH?
Na de NICE-richtlijn zijn er twee systematische reviews en vijf cohortstudies verschenen die relevant zijn voor deze uitgangsvraag. Ze worden hieronder beschreven en zijn samengevat in de evidence-tabel 13 en tabel 14.
In de review van Ralston et al. [64] werd de incidentie van concomitante ernstige bacteriële infecties bij kinderen met een klinische bronchiolitis of kinderen met een RSV-infectie onderzocht. Er werden 11 studies geïncludeerd van matige tot goede kwaliteit over kinderen met een klinische bronchiolitis of bewezen RSV-infectie bij wie aanvullende diagnostiek was ingezet. Voor 9 studies gold koorts als criterium voor het includeren van kinderen. Koorts werd door de verschillende studies anders gedefinieerd, maar meestal als een thuis of op de SEH gemeten (meestal rectale) temperatuur ≥ 38,0oC. In de twee retrospectieve studies waar koorts geen inclusiecriterium was, werd melding gemaakt dat > 70% van de geïncludeerde kinderen een in de status gedocumenteerde melding van koorts hadden. Studies die waren verricht op een intensivecare-afdeling werden geëxcludeerd. Zes van de 11 studies betroffen retrospectieve studies. Zes studies keken naar occulte ernstige bacteriële infecties bij kinderen met een klinische bronchiolitis (vijf studies keken naar RSV-positieve kinderen). Zeven studies keken naar kinderen < 90 dagen en de overige vier studies keken naar kinderen < 60 dagen. Vijf studies waren uitgevoerd op de SEH, één studie was uitgevoerd onder poliklinische kinderen, vier studies onder opgenomen kinderen en één studie onder zowel opgenomen als poliklinische kinderen. Ralston et al. [64] vond 5 kinderen met een klinische bronchiolitis met een bijkomende bacteriëmie (geen bacteriële meningitis) (op een totaal van 1749 kinderen). Een significant deel van de kinderen met een klinische bronchilitis of RSV-infectie had een positieve urinekweek (3,3%, 95% BI 1,9 – 5,7%). Voor kinderen met een RSV-infectie was deze kans (5,1%, 95% BI% 2,6 – 9,6%) groter dan voor kinderen met een klinische bronchiolitis (2,0%, 95% BI 1,2 – 3,2%). De auteurs plaatsten de kanttekening dat een deel van de positieve kweken mogelijk werd gevonden bij kinderen met asymptomatische bacteriurie. Als beperking van de studie is beschreven dat de studies niet allemaal routinematig aanvullende diagnostiek inzetten, maar meestal op aanvraag van de behandelende arts, waardoor er sprake kan zijn van een geselecteerde populatie. Dit geldt voornamelijk voor de studies met gehospitaliseerde kinderen. Daarnaast beschreven de auteurs niet hoe de de urine werd verzameld die voor een kweek werd ingezet. Ook konden de auteurs geen uitspraak doen over concomitante bacteriële pneumonieën door het ontbreken van een goede referentiestandaard.
Voor de beschrijving van de HTA-studie van Hiu et al. [34], zie: Beschrijving evidence uitgangsvraag 4 (module 'De voorspellende waarde van klinische symtpomen bij het kind met koorts').
De studie van Krief et al. [62]en de studie van Morley et al. [22] zijn beschreven onder uitgangsvraag 7, zie: Beschrijving evidence uitgangsvraag 7.
De studies van Hsiao et al. [65], Craig et al. [38] en Rudinsky et al.[32] zijn beschreven onder uitgangsvraag 1-3, zie: Beschrijving evidence uitgangsvraag 3 en verder (module 'De voorspellende waarde van klinische symtpomen bij het kind met koorts').
Beschrijving evidence uitgangsvraag 3
Wat is de indicatie voor het verrichten van een liquorpunctie bij kinderen met koorts die mogelijk een bacteriële dan wel virale meningitis (of encefalitis) hebben als onderdeel van de diagnostische aanpak tijdens het bezoek aan de SEH?
Na de NICE-richtlijn is er één systematische review (van B-niveau kwaliteit: er werden slechts twee kleine retrospectieve studies besproken) en zijn er zeven cohortstudies verschenen die relevant zijn voor deze uitgangsvraag. Ze worden hieronder beschreven en zijn samengevat in de evidence-tabel 13 en tabel 14.
In de systematische review van Hom et al. [66] werd gekeken naar de incidentie van bacteriële meningitis onder voorheen gezonde kinderen in de leeftijd van 6 tot 18 maanden die zich presenteerden op de SEH met een eenvoudige koortsconvulsie en die een liquorpunctie hadden ondergaan. Zij includeerden twee kleine retrospectieve studies van in totaal 150 kinderen vanaf het jaar 2000 in verband met het hernieuwde vaccinatieschema voor H. influenza en S. pneumoniae, en de daarmee samenhangende verwachte lagere incidenties van bacteriële meningitis. Zij vonden in deze studies geen kinderen met een bacteriële infectie (95% BI 0 – 3%). Onder de kinderen die werden behandeld met antibiotica voordat de liquorpunctie werd verricht, werd bij 2,5% van de kinderen een celverhoging, gedefinieerd als een leukocytengetal > 5×106/L in de liquor, gevonden (95% BI 0 – 14,0%). Als beperking van de studies noemden de auteurs het gebrek aan adequate follow-up om een bacteriële meningitis die zou kunnen zijn gemist tijdens de eerste presentatie, uit te sluiten. De auteurs concludeerden dat de geïncludeerde studies van beperkte kwaliteit waren met te kleine aantallen om definitieve conclusies te trekken. Zij sloten zich aan bij richtlijnen die in het artikel werden aangehaald om alleen een liquorpunctie te verrichten bij kinderen in de leeftijd van 6 tot 12 maanden met een eenvoudige koortsconvulsie indien de vaccinatiestatus onvolledig was.
Kimia et al. [67] beschreven in hun studie een retrospectief cohort van 526 kinderen (6 maanden tot 5 jaar) die zich op de SEH presenteerden met een eerste atypische koortsconvulsie. Onder een atypische koortsconvulsie verstonden zij convulsies die langer dan 15 minuten duurden, herhaalde convulsies binnen een korte periode (< 24 uur) en focale convulsies. Van deze kinderen ondergingen 340 kinderen een liquorpunctie. Drie van deze kinderen hadden een acute bacteriële meningitis, die in alle gevallen werd veroorzaakt door S. pneumoniae. Twee van deze casus deden zich voor in de periode waarin PVC7-vaccinatie nog niet beschikbaar was. Twaalf andere kinderen met celverhoging in hun liquor, gedefinieerd als > 7×106/L leukocytenin de liquor, hadden negatieve bacteriële kweken (3 van hen waren voorbehandeld met antibiotica). Geen van de 186 kinderen met een atypische koortsconvulsie die initieel geen liquorpunctie hadden ondergaan, had later bij follow-up toch een bacteriële meningitis. Ondanks de beperkingen van het retrospectieve cohort en het ontbreken van een gouden standaard in een groot deel van de patiënten laat deze studie zien dat de kans op een bacteriële meningitis bij een atypische koortsconvulsie klein is.
Tebruegge et al. [68] beschreven in een retrospectieve studie de incidentie van concomitante bacteriële meningitis bij kinderen met een urineweginfectie. Zij includeerden kinderen < 16 jaar met een bewezen urineweginfectie die tevens een liquorpunctie hadden ondergaan tijdens de diagnostische work-up op de SEH. In totaal kwamen in een periode van 9 jaar 748 casus (van 735 kinderen) in aanmerking. Onder de kinderen < 1 maand hadden 2 kinderen (2/163, 1,2%, 95 BI 0,15 – 4,36%) een urineweginfectie met concomitante bewezen bacteriële meningitis (casus 1: E. coli in urine en liquor; casus 2: S. aureus in urine en liquor). Beide kinderen hadden koorts, en waren prikkelbaar en lethargisch. Van de 499 kinderen tussen de 1 en 12 maanden en van de 86 kinderen > 12 maanden met een urineweginfectie had geen een concomitante bacteriële meningitis. Hoewel de studie wordt beperkt door de retrospectieve dataverzameling en een geselecteerde populatie (namelijk kinderen met een urinekweek en liquorkweek), toont deze studie een zeer klein risico bij kinderen > 1 maand met een urineweginfectie van het voorkomen van een concomitante bacteriële meningitis; bij kinderen < 1 maand is dit risico klein, maar niet verwaarloosbaar. Een andere beperking van het onderzoek is dat 10% (n=72) van de kinderen antibiotica had gehad voorafgaand aan de liquorpunctie, waardoor vals-negatieven niet zijn uit te sluiten. Van deze 10% hadden 10 kinderen een celverhoging in de liquor en een negatieve bacteriële kweek: van 4 patiënten kon geen duidelijke verwekker worden gevonden.
Paquette et al. [69] onderzochten retrospectief de indicatie voor een liquorpunctie bij kinderen met koorts en een afwijkende urineanalyse. Ze includeerden voorheen gezonde kinderen van 30 tot en met 90 dagen met koorts (gedefinieerd als een rectale temperatuur van ≥ 38,0oC) zonder focus die zich op de SEH presenteerden en bij wie een bloedkweek en een urinekweek en liquorpunctie werden verricht: volgens het lokale protocol werd dit routinematig gedaan bij alle kinderen met koorts die niet aan de laagrisicocriteria van Rochester voldeden. Kinderen met een duidelijk focus voor de koorts werden geëxcludeerd. Een abnormale urine-analyse werd gedefinieerd als positief voor leukocyten en/of nitriet, of meer dan 10 leukocyten/hoogresolutieveld in het sediment. Bacteriële infecties werden gebaseerd op positieve bacteriële kweken. 57 van de 392 geïncludeerde kinderen hadden een afwijkende urineanalyse: slechts bij één van deze werd de diagnose urineweginfectie gesteld in combinatie met een bacteriële meningitis. Dit kind maakte klinisch een zieke indruk en had een verlaagd leukocytengetal. De auteurs concludeerden dat liquorpuncties wellicht niet stelselmatig hoefden te worden verricht bij kinderen tussen 1 en 3 maanden die een afwijkende urineanalyse hadden, met name wanneer zij een niet-zieke indruk maakten en voldeden aan de laagrisicocriteria van Rochester. Beperking van deze studie is de retrospectieve dataverzameling en de geselecteerde patiëntenpopulatie, waardoor onder meer niet duidelijk is hoeveel kinderen met een abnormale urineanalyse geen liquorpunctie kregen.
Uit de studie van Shah et al. [70] kwam naar voren dat steriel verhoogd leukocytengetal in de liquor weinig voorkwam onder kinderen met bewezen urineweginfecties. Zij toonden dit aan in een prospectieve cross-sectionele studie die werd uitgevoerd op 8 SEH’s bij kinderen ≤ 60 dagen met een thuis of op de SEH gemeten rectale temperatuur van ≥ 38,0oC. Antibioticagebruik in de 48 uur voorafgaand aan het bezoek aan de SEH was een exclusiecriterium. Volgens studieprotocol werd bij alle kinderen routinematig een urinekweek (blaaskatheterisatie of suprapubische urinepunctie), een bloedkweek en een liquorkweek afgenomen. Een urineweginfectie werd gedefinieerd als een algemeen urineonderzoek positief was voor leukocyten of nitriet, of afwijkend sediment met > 5 leukocyten/hoogresolutieveld en een positieve urinekweek (katheterisatie of suprapubische punctie). Celverhoging in de liquor werd met verschillende leeftijdsafhankelijke afkapwaarden voor het aantal leukocyten in de liquor gedefinieerd. 91 van de 1025 kinderen hadden een urineweginfectie en van hen ondergingen 82 kinderen een liquorpunctie. Eén kind had een urineweginfectie met een concomitante bacteriële meningitis: dit kind had 20×106/L in de liquor en voldeed daarmee niet aan de strikte criteria die in de studie waren gesteld voor celverhoging in de liquor. Zeven andere kinderen hadden een concomitante bacteriëmie. Celverhoging in de liquor kwam even vaak voor onder kinderen met urineweginfecties (18,5%) als onder kinderen zonder urineweginfecties (19,3%). Wanneer kinderen met een traumatische punctie buiten beschouwing werden gelaten (21%), had slechts een klein deel van de kinderen met een urineweginfectie celverhoging in de liquor (0% (95% BI 0 – 5,8%) tot 8% (95% CI 2,7 – 17,8%)). Als tekortkomingen van de studie noemen de auteurs het relatief kleine aantal urineweginfecties en het niet routinematig verrichten van diagnostiek naar enterovirussen in de liquor om mogelijke verwekkers van celverhoging aan te tonen.
Mintegi et al. [71] beschreven in hun prospectieve studie 685 gezonde, niet-zieke, kinderen < 3 maanden met koorts zonder focus die zich presenteerden op de SEH. In deze studie werd onderzocht welke gevolgen het niet-routinematig verrichten van liquorpuncties bij jonge kinderen met koorts zonder focus had. Kinderen die antibiotica hadden gekregen voorafgaand aan het bezoek aan de SEH, werden geëxcludeerd. Als uitkomstmaat namen de auteurs bacteriële meningitis, gedefinieerd als een positieve liquorkweek of een positief Gram-preparaat of celverhoging in de liquor met een negatieve liquorkweek, maar met een positieve bloedkweek. Aseptische meningitis was gedefinieerd als celverhoging in de liquor, maar met een negatieve liquorkweek en bloedkweek; virale meningitis gedefinieerd op basis van een aangetoonde virale verwekker (PCR, of virale kweek voor enterovirus in de liquor). Het onderzoeksprotocol betekende een urineanalyse, bloedbeeld en bloedkweek voor niet-zieke kinderen < 3 maanden en liquorpunctie op indicatie. Voor kinderen < 15 dagen met koorts werd een liquorpunctie sterk aanbevolen; het verrichten van een LP bij kinderen tussen 15 en 28 dagen moest worden overwogen op basis van het klinische beeld en leukocytose of leukopenie. Bij 198 kinderen werd een liquorpunctie verricht: 36 kinderen (18,1%) hadden celverhoging in de liquor, 2 van deze kinderen (beiden < 15 dagen) hadden een bewezen bacteriële meningitis (verwekker: Listeria monocytogenes). Bij 18 kinderen werd een enterovirus aangetoond, 9 van deze patiënten zonder celverhoging in de liquor. Van de 487 kinderen zonder liquorpunctie, kregen 418 kinderen initieel geen antibiotica en werden niet opgenomen in het ziekenhuis: 4 kinderen werden later alsnog teruggezien met een diagnose van een aseptische meningitis. Er werden geen kinderen met een bacteriële meningitis gemist. Het verrichten van een liquorpunctie was afhankelijk van de leeftijd en varieerde van 100% voor kinderen < 15 dagen tot 14% bij kinderen tussen de 60 en 90 dagen. De auteurs concludeerden dat het wellicht niet nodig was om routinematig liquorpuncties te verrichten bij niet ziek ogende, voorheen gezonde kinderen met koorts > 1 maand.
Meehan et al. [72] voerden een retrospectief onderzoek uit naar het voorkomen van celverhoging in de liquor en naar de voorspellers van celverhoging in de liquor. Ze includeerden 2003 voorheen gezonde kinderen < 90 dagen (gemiddelde leeftijd: 1,6 maanden) met koorts, gedefinieerd als een rectale temperatuur ≥ 38,0oC tijdens triage. Kinderen bij wie geen liquor-punctie was verricht of kinderen met een traumatische punctie (≥ 10×109/L rode bloedcellen) werden geëxcludeerd. Ook kinderen die antibiotica kregen voorafgaand aan het bezoek aan de SEH werden geëxcludeerd. De auteurs definieerden celverhoging in de liquor als ≥ 25×106/L leukocyten voor kinderen tussen 0 en 28 dagen en ≥ 10×106/L leukocyten voor kinderen tussen 29 en 90 dagen, met een correctiefactor 1:500 voor de aanwezigheid van rode bloedcellen in de liquor. Aseptische meningitis werd gediagnosticeerd wanneer er sprake was van een celverhoging en negatieve liquorkweek; bij een positieve liquorkweek sprak men van een bacteriële meningitis. Bij 2197/2820 kinderen (78%) werd een liquorpunctie verricht en deze was bij 182 kinderen traumatisch. 176/2003 (8,8%, 95% BI 7,6 – 10,1%) kinderen hadden celverhoging in de liquor. De kans op celverhoging nam toe gedurende de zomermaanden van 5,0% tot 17,4%. Een model (beslisboom) met seizoen, lichaamstemperatuur en leukocyten in bloed had een sensitiviteit van 89% (95% BI 83 – 92%) en NPV van 97% (95% BI 96 – 98%) en classificeerde 156 van de 176 kinderen met celverhoging als ‘hoog risico voor celverhoging’. Zeven kinderen (0,35%, 95% BI 0,17 – 0,72%) hadden een bacteriële meningitis, van wie er twee geen celverhoging in de liquor hadden. Eén kind met een bacteriële meningitis zou volgens het model niet als ‘hoog risico voor celverhoging’ zijn geclassificeerd: dit kind presenteerde zich lethargisch, met grauwe huidskleur, verminderde circulatie en een bomberende fontanel, en maakte een zieke indruk. Onder de kinderen met celverhoging in de liquor had 6,8% een concomitante urineweginfectie. De auteurs concludeerden dat bacteriële meningitis weinig voorkwam, maar dat celverhoging werd gevonden bij 1 op 11 kinderen < 90 dagen die een liquorpunctie ondergingen, en zelfs bij 1 op de 6 in de zomerperiode. Als tekortkoming van deze studie noemden de auteurs dat niet alle kinderen een liquorpunctie ondergingen (78%) en dat een deel van de kinderen een traumatische punctie had.
De studie van Seltz et al.[73] is beschreven onder uitgangsvraag 12b, zie: Beschrijving evidence uitgangsvraag 12b (module: 'Virale diagnostiek bij het kind met koorts met een verdenking op meningitis').
Beschrijving evidence uitgangsvraag 4
Wat is de indicatie voor het maken van een thoraxfoto bij kinderen met koorts die mogelijk een bacteriële lagereluchtweginfectie hebben als onderdeel van de diagnostische aanpak tijdens het bezoek aan de SEH?
Na de NICE-richtlijn zijn geen systematische reviews, maar alleen vier cohortstudies verschenen die relevant zijn voor deze uitgangsvraag. Ze worden hieronder beschreven en zijn samengevat in de evidence-tabel 13 en tabel 14.
Shah et al. [74] onderzochten prospectief observationeel de incidentie van occulte pneumonieën bij kinderen. Zij includeerden 1866 gezonde kinderen < 21 jaar (gemiddelde leeftijd: 5,2 jaar) die op de SEH een thoraxfoto kregen in verband met verdenking van een pneumonie. Kinderen die een thoraxfoto kregen in verband met een andere indicatie, werden geëxcludeerd. Een pneumonie werd gedefinieerd als infiltraten of consolidaties op de thoraxfoto en er was sprake van een ‘occulte’ pneumonie, als deze afwijkingen op de thoraxfoto werden gevonden bij kinderen zonder tekenen van een ondersteluchtweginfectie (gedefinieerd als tekenen van dyspneu of andere pulmonale afwijkingen bij het lichamelijk onderzoek). Aan de artsen op de SEH werd gevraagd geblindeerd voor de uitkomst een vragenlijst in te vullen voor alle kinderen voor wie zij een thoraxfoto aanvroegen. De compliance was 46%: de auteurs vermeldden dat zij geen significante verschillen vonden tussen de kinderen die wel en niet werden geïncludeerd, wat werd onderstreept door vergelijkbare incidenties van radiologisch bevestigde pneumonieën: 6,4% (95% BI 5,4% - 7,6%) van de geïncludeerde kinderen had een bacteriële pneumonie, vs. 5,2% (95% BI 2,9% - 9,0%) van de niet-geïncludeerde kinderen. 308 van de 1866 geïncludeerde kinderen hadden ten tijde van de presentatie geen tekenen van een ondersteluchtweginfectie, van wie bij 21 (6,8%) kinderen een pneumonie op de thoraxfoto werd gezien. Van deze 308 kinderen had 72% koorts ten tijde van de presentatie. Bij kinderen met tekenen van een onderste-luchtweginfectie was de incidentie van een pneumonie 6,3% (92/1467 kinderen). Redenen van de artsen om voor kinderen zonder tekenen van een ondersteluchtweginfectie een thoraxfoto aan te vragen waren onder meer: langdurig aanhouden van hoesten (38%), hoogte van de koorts (31%), ernst van het hoesten (15%), verhoogd leukocytengetal (11%), eerder doorgemaakte pneumonie (8%), pijn op de borst (6%) en op aanvraag van de huisarts (4%). In een model bleken kinderen zonder tekenen van een ondersteluchtweginfectie met kortdurende (< 1 dag) koorts en de afwezigheid van hoesten een klein risico van een pneumonie te hebben (0/36 kinderen, LR- 0,40 (95% BI 0,19 – 0,84). De auteurs concludeerden dat een aanzienlijk deel van de kinderen (1 op 15) zonder tekenen van een ondersteluchtweginfectie een pneumonie hadden op de thoraxfoto. Hoewel er geen duidelijke predictoren voor een ‘occulte’ pneumonie werden gevonden, was de afwezigheid van hoesten in combinatie met kortdurende koorts gerelateerd aan een laag risico op ‘occulte’ pneumonie bij kinderen zonder tekenen van een ondersteluchtweginfectie. Als beperking noemden de auteurs de geselecteerde groep kinderen die een thoraxfoto ondergingen, waardoor het risico op een bacteriële pneumonie waarschijnlijk werd overschat. Ook kan de definitie van ‘tekenen van een ondersteluchtweginfectie’ en hun klinische relevantie worden betwist.
Murphy et al. [75] beschreven in hun retrospectieve studie de incidentie van pneumonieën bij kinderen met koorts zonder focus en zonder tekenen van een lagereluchtweginfectie. Zij bekeken data van 2128 gezonde kinderen ≤ 10 jaar oud met koorts, gedefinieerd als een temperatuur van ≥ 38,0oC tijdens triage of thuis gemeten in de voorgaande 24 uur, die een thoraxfoto hadden ondergaan tijdens een bezoek aan de SEH. De diagnose pneumonie werd gebaseerd op de beoordeling van de thoraxfoto door een radioloog. 1084 kinderen, met een gemiddelde leeftijd van 1,7 jaar (interkwartielwaarden 0,8 tot 3,5 jaar), hadden geen tekenen van een lagereluchtweginfectie (i.e. dyspneu, tachypneu, afwijkingen bij auscultatie of zuurstof saturatie ≤ 95%), van wie 57 kinderen (5,3%, 95% BI 4,0 – 6,8%) een pneumonie, zoals aangetoond op de thoraxfoto, hadden. Van de kinderen met tekenen van een lagereluchtweginfectie had 12,6% (n=132/1044, 95% BI 10,7 – 14,8%) een pneumonie. Lang aanhoudende koorts (> 5 dagen, LR+ 2,24, 95% 1,35 – 3,71), langdurige klachten van hoesten (> 10 dagen, LR+ 2,25, 95% 1,21 – 4,20) en een verhoogd leukocytengetal in het bloed (leukocytengetal > 20×109/L LR+ 2,17, 95% BI 1,58 – 2,96) waren geassocieerd met een verhoogd risico van een pneumonie bij kinderen met koorts zonder tekenen van een lagere-luchtweginfectie. Afwezigheid van hoesten was een sterke negatieve predictor voor pneumonie (LR- 0,19, 95% BI 0,05 – 0,75). De auteurs toonden aan dat van de kinderen met koorts zonder focus en zonder tekenen van een luchtweginfectie een aanzienlijk deel toch een pneumonie had. De studie wordt echter beperkt door de retrospectieve dataverzameling, de geselecteerde patiëntenpopulatie, en niet-geblindeerde interpretatie van de thoraxfoto. Ook bij deze studie kan men zich afvragen of de definitie van ‘tekenen van lagereluchtweginfectie’ dekkend is en of de gevonden afwijkingen klinisch relevant zijn.
In de retrospectieve studie van Rutman et al. [76] werd gekeken naar de incidentie van radiologisch bewezen pneumonieën voor en na de invoering van de PCV7-vaccinatie. Over een periode van negen jaar bestudeerden zij de data van voorheen gezonde kinderen < 5 jaar die zich op de SEH presenteerden met een temperatuur van ≥ 39,0 oC (gemeten tijdens triage of vermeld in de status), met een leukocytengetalbepaling in het bloed en een thoraxfoto. Het aanvragen van verdere aanvullende diagnostiek was op indicatie. Kinderen met een andere bewezen bacteriële infectie (abces, appendicitis, cellulitis, meningitis, osteomyelitis, urineweginfectie) werden geëxcludeerd. Een radioloog beoordeelde de foto’s en maakte onderscheid tussen bewezen radiologische pneumonie, equivocale pneumonieën en niet-afwijkende thoraxfoto’s. ‘Occulte’ pneumonie werd gedefinieerd als een radiologisch bewezen pneumonie in de afwezigheid van klinische symptomen als hoesten of tekenen van een lagereluchtweginfectie. Een radiologisch bewezen pneumonie werd voor de invoering van de PCV7-vaccinatie bij 21% van de kinderen gevonden (190/889, 95% BI 19 – 24%), en na de invoering bij 18% (61/335, 95% BI, 14 – 23%, p=0,27). De incidentie van een radiologisch bewezen pneumonie bij kinderen zonder tekenen van een lagereluchtweginfectie verschilde niet significant tussen de twee groepen. Voor de kinderen < 2 jaar was er wel een significante daling van het aantal; radiologisch bewezen pneumonieën: 17% (95% BI 14 – 20%) vs. 10% (95% BI 7 – 15%) (p=0,01). De auteurs concludeerden dat de incidentie van radiologisch bewezen pneumonieën onder kinderen met koorts zonder focus en zonder tekenen van een lagere luchtweginfectie was afgenomen na de invoering van de PCV7-vaccinatie van 15% naar 9%. Opvallend in deze studie was dat het percentage kinderen in de post-PCV7-periode bij wie een leukocytengetal werd bepaald, afnam van 70% naar 30%. Het aantal thoraxfoto’s nam in deze periode echter niet af en ook het percentage kinderen met leukocytose bleef gelijk (12% pre- vs. 13% post-PCV7-vaccinatie). Verder kenmerkte deze studie zich door het retrospectieve karakter en de niet-gestandaardiseerde dataverzameling, waardoor het lastig is om de resultaten te extrapoleren naar de algemene populatie op een SEH.
Mintegi et al. [77] keken in hun prospectief uitgevoerde studie op vier SEH’s naar de incidentie van pneumonieën bij kinderen met hoge koorts zonder focus. Ze includeerden 188 gezonde, niet-ziek ogende kinderen < 36 maanden bij wie thuis of tijdens triage hoge koorts (> 39,0oC) werd gemeten en bij wie geen ander duidelijk focus voor de koorts, in het bijzonder geen tekenen van een lagereluchtweginfectie, werd gevonden en bij wie het leukocytengetal >20×109/L was. Een pneumonie werd gedefinieerd als een consolidatie of een infiltraat op de thoraxfoto die werd geïnterpreteerd door een kinderarts en/of een radioloog. Uiteindelijk werden 37 (20%) thoraxfoto’s door de radioloog geïnterpreteerd. Een pneumonie werd vastgesteld bij 25 kinderen met koorts zonder focus en zonder tekenen van een ondersteluchtweginfectie (13,3%, 95% BI 9,2 – 18,9%). Het voorkomen van pneumonie bij deze kinderen hing samen met leeftijd (OR voor kinderen > 12 maanden, 2,62, 95% BI 1,04 – 6,60), absoluut neutrofielengetal (OR voor ANC > 20×109/L 3,52, 95% BI 1,37 – 9,06) en CRP (OR voor CRP > 100 mg/l 3,18, 95% BI 1,19 – 8,51). Zeven kinderen (3,7%, alle veroorzaakt door een pneumokok) hadden een bacteriëmie, waarvan één ook een pneumonie had op de thoraxfoto. Als beperkingen gaven de auteurs aan dat niet alle thoraxfoto’s geblindeerd werden beoordeeld en dat er door de inclusiecriteria een geselecteerde populatie was beschreven (namelijk niet-zieke kinderen met hoge koorts bij wie een bloedbeeld en bloedkweek waren afgenomen als aanvullende diagnostiek). Bovendien was ten tijde van de studie nog niet op alle onderzoekslocaties een hoge PCV7-vaccinatiegraad. De auteurs concludeerden dat de incidentie van pneumonie bij kinderen met koorts zonder focus en een leukocytose > 20×109/L in deze studie iets lager lag dan in eerdere literatuur, maar nog steeds aanzienlijk was.
Zoeken en selecteren
Flowdiagram uitgangsvragen 1-4
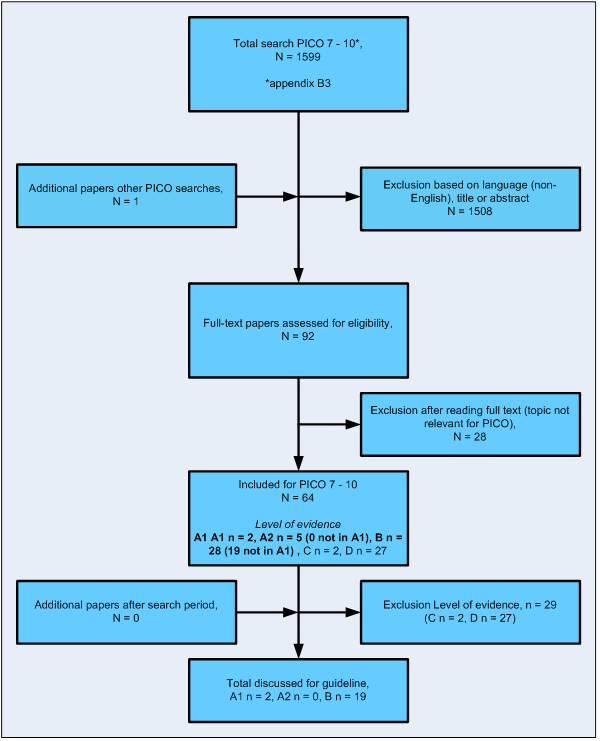
Zoektermen bij uitgangsvragen 1-4
Uitgevoerd 21 jui 2012
Medline via OvidSP
(exp Infant/ OR exp child/ OR (infan* OR newborn* OR new born* OR neonat* OR perinat* OR postnat* OR baby OR babies OR child OR schoolchild* OR school child* OR kid OR kids OR toddler* OR teen OR teenage OR boy* OR girl* OR minors OR underag* OR under ag* OR juvenil* OR youth* OR kindergar* OR pubert* OR pubescen* OR schools OR nursery school* OR preschool* OR pre school* OR primary school* OR secondary school* OR elementary school* OR high school* OR highschool* OR school age* OR schoolage*).ab,ti. OR ((adolescent/ OR adolescen*.ab,ti.) NOT exp adult/) ) AND (exp Fever/ OR (fever* OR febril* OR hypertherm* OR pyrexi* OR pyretic* OR hyperpyrex* OR hyperpyretic* OR pyrogen*).ab,ti.) AND ((exp "Arthritis, Infectious"/ OR exp "Bone Diseases, Infectious"/ OR exp "Community-Acquired Infections"/ OR exp Respiratory Tract Infections/ OR exp Sepsis/ OR exp "Skin Diseases, Infectious"/ OR exp Soft Tissue Infections/ OR exp Urinary Tract Infections/ OR exp Meningitis/ OR exp Gastroenteritis/ OR exp encephalitis/ OR exp bacteremia/ OR exp pneumonia/ ) OR (Infect* adj6 (Arthrit* OR bone* OR Communit* OR Respirator* OR skin OR Soft Tissue OR Urinar* OR serious* OR severe*)).ab,ti OR Seps?s.ab,ti. OR Septicaemi*.ab,ti. OR Septicemi*.ab,ti. OR Gastroenteritis.ab,ti. OR encephalitis.ab,ti. OR Bacteremi*.ab,ti. OR Pneumonia*.ab,ti.OR meningitis*.ab,ti. OR exp Morbidity/ OR morbid*.ab,ti. OR exp Mortality/ OR Mortality.xs. OR mortal*.ab,ti.)
AND (((blood OR hemo OR urine) ADJ culture*) OR hemoculture* OR ((liquor OR Lumbar OR CSF OR cerebral spine fluid) ADJ punct*) OR (Chest ADJ (radiograph* OR X-ray OR x-rays)) OR CXR).ab,ti.
limit 2 to ed=20060901-20130101
Basis – embase
((infan* OR newborn* OR (new NEXT/1 born*) OR baby OR babies OR neonat* OR perinat* OR postnat* OR child OR 'child s' OR childhood* OR children* OR kid OR kids OR toddler* OR teen* OR boy* OR girl* OR minors* OR underag* OR (under NEXT/2 ag*) OR juvenil* OR youth* OR kindergar* OR puber* OR pubescen* OR prepubescen* OR prepuberty* OR pediatric* OR peadiatric* OR school* OR preschool* OR highschool* OR suckling):de,ab,ti OR (adoles*:de,ab,ti NOT adult/exp) OR child/exp OR newborn/exp) AND (Fever/de OR (fever* OR febril* OR hypertherm* OR pyrexi* OR pyretic* OR hyperpyrex* OR hyperpyretic* OR pyrogen*):ab,ti) AND (('infectious arthritis'/exp OR 'Bone Infection'/exp OR 'communicable disease'/exp OR 'Respiratory Tract Infection'/exp OR Sepsis/exp OR 'Skin Infection'/exp OR 'Soft Tissue Infection'/de OR 'Urinary Tract Infection'/de OR Meningitis/exp OR Gastroenteritis/de OR encephalitis/exp OR bacteremia/exp OR pneumonia/exp ) OR (Infect* NEAR/6 (Arthrit* OR bone* OR Communit* OR Respirator* OR skin OR 'Soft Tissue' OR Urinar* OR serious* OR severe*)):ab,ti OR Seps?s:ab,ti OR Septicaemi*:ab,ti OR Septicemi*:ab,ti OR Gastroenteritis:ab,ti OR encephalitis:ab,ti OR Bacteremi*:ab,ti OR Pneumonia*:ab,ti OR meningitis*:ab,ti )
AND ('blood culture'/de OR 'urine culture'/de OR (((blood OR hemo OR urine) NEXT/1 culture*) OR hemoculture* OR ((liquor OR Lumbar OR CSF OR cerebral spine fluid) NEXT/1 punct*) OR (Chest NEXT/1 (radiograph* OR X-ray OR x-rays)) OR CXR):ab,ti) AND [01-09-2006 ]/sd
Referenties
- Hay, A.D., J. Heron, and A. Ness, The prevalence of symptoms and consultations in pre-school children in the Avon Longitudinal Study of Parents and Children (ALSPAC): A prospective cohort study. Family Practice, 2005. 22(4): p. 367-374.
- Bouwhuis, C.B., et al., [Few ethnic differences in acute pediatric problems: 10 years of acute care in the Sophia Children's Hospital in Rotterdam]]. Ned Tijdschr Geneeskd, 2001. 145(38): p. 1847-51.
- Roukema, J., et al., Randomized Trial of a Clinical Decision Support System: Impact on the Management of Children with Fever without Apparent Source. J Am Med Informatics Assoc, 2008. 15(1): p. 107-13.
- Gill, P.J., et al., Increase in emergency admissions to hospital for children aged under 15 in England, 1999-2010: national database analysis. Arch Dis Child, 2013.
- Elberse, K.E., et al., Changes in the composition of the pneumococcal population and in IPD incidence in The Netherlands after the implementation of the 7-valent pneumococcal conjugate vaccine. Vaccine, 2012.
- Conyn-van Spaendonck, M.A., et al., [Significant decline of the number of invasive Haemophilus influenzae infections in the first 4 years after introduction of vaccination against H. influenzae type B in children] Sterke daling van het aantal invasieve infecties door Haemophilus influenzae in de eerste 4 jaar na de introductie van de vaccinatie van kinderen tegen H. influenzae type b. Ned Tijdschr Geneeskd, 2000. 144(22): p. 1069-73.
- Baraff, L.J., Management of fever without source in infants and children. Ann Emerg Med, 2000. 36(6): p. 602-14.
- Evidence based clinical guideline: outpatient evaluation and management of fever of uncertain source in children 2 to 36 moths of age; Cincinnati children's hospital medical center. 2003.
- Baraff, L.J., et al., Practice guideline for the management of infants and children 0 to 36 months of age with fever without source. Agency for Health Care Policy and Research [published erratum appears in Ann Emerg Med 1993 Sep;22(9):1490] [see comments]. Ann Emerg Med, 1993. 22: p. 1198-1210.
- Nijman, R.G., et al., Parental fever attitude and management: influence of parental ethnicity and child's age. Pediatr Emerg Care, 2010. 26(5): p. 339-42.
- Kai, J., What worries parents when their preschool children are acutely ill, and why: a qualitative study. Bmj, 1996. 313(7063): p. 983-6.
- van Ierland, Y., et al., Self-Referral and Serious Illness in Children With Fever. Pediatrics, 2012.
- Najaf-Zadeh, A., et al., Epidemiology of malpractice lawsuits in paediatrics. Acta Paediatr, 2008. 97(11): p. 1486-91.
- (2007) Feverish illness in children: a guick reference guide, London, http://guidance.nice.org.uk/CG47/guickrefguide/pdf/english. NICE Clinical Guidelines CG47.
- Berger, M.Y., et al., NHG-Standaard Kinderen met koorts. Huisarts Wet, 2008. 51(6): p. 287-96.
- Oostenbrink, R., M. Thompson, and E.W. Steyerberg, Barriers to translating diagnostic research in febrilechildren to clinical practice: a systematic review. Arch Dis Child, 2011.
- Graneto, J.W. and D.F. Soglin, Maternal screening of childhood fever by palpation. Pediatr Emerg Care, 1996. 12(3): p. 183-4.
- AGREE Next steps consortium. AGREE II. Instrument voor de beoordeling van richtlijnen. Mei 2009.
- NHS., NICE clinical guideline 47: feverish illness in children. Assesment and initial management in children younger than 5 years. 2007: London. N1247.
- Assessment and initial management of feverish illness in children younger than 5 years: summary of NICE guidance. BMJ, 2013. 346: p. f3764.
- Craig, J.V., et al., Temperature measured at the axilla compared with rectum in children and young people: systematic review. BMJ, 2000. 320(7243): p. 1174-8.
- Morley, E.J., et al., Rates of positive blood, urine, and cerebrospinal fluid cultures in children younger than 60 days during the vaccination era. Pediatr Emerg Care, 2012. 28(2): p. 125-30.
- Schuh, S., et al., Comparison of the temporal artery and rectal thermometry in children in the emergency department. Pediatr Emerg Care, 2004. 20(11): p. 736-41.
- Van den Bruel, A., et al., Diagnostic value of clinical features at presentation to identify serious infection in children in developed countries: a systematic review. Lancet, 2010. 375(9717): p. 834-45.
- Thompson, M.J., et al., Deriving temperature and age appropriate heart rate centiles for children with acute infections. Arch Dis Child, 2008.
- Nijman, R.G., et al., Derivation and validation of age and temperature specific reference values and centile charts to predict lower respiratory tract infection in children with fever: prospective observational study. BMJ, 2012. 345: p. e4224.
- Elshout, G., et al., Duration of fever and serious bacterial infections in children: a systematic review Review. BMC Fam Pract, 2011. 12: p. 33.
- Curtis, S., et al., Clinical features suggestive of meningitis in children: a systematic review of prospective data Review. Pediatrics, 2010. 126(5): p. 952-60.
- Brent, A.J., et al., Evaluation of temperature-pulse centile charts in identifying serious bacterial illness: Observational cohort study. Arch Dis Child, 2011. 96(4): p. 368-373.
- Fleming, S., et al., Normal ranges of heart rate and respiratory rate in children from birth to 18 years of age: a systematic review of observational studies. Lancet, 2011. 377(9770): p. 1011-8.
- Thompson, M., et al., Deriving temperature and age appropriate heart rate centiles for children with acute infections. Arch Dis Child, 2009. 94(5): p. 361-5.
- Rudinsky, S.L., et al., Serious bacterial infections in febrile infants in the post-pneumococcal conjugate vaccine era. Acad Emerg Med, 2009. 16(7): p. 585-590.
- Garcia, S., et al., Is 15 days an appropriate cut-off age for considering serious bacterial infection in the management of febrile infants? Pediatr Infect Dis J, 2012. 31(5): p. 455-458.
- Hui C., N.G., Tsertsvadze A., Yazdi F., Tricco A., Tsouros S., Skidmore B., Daniel R., Diagnosis and management of febrile infants (0-3 months). Evidence repot/Technology assessment, 2012. Contract No. HHSA 290-2007-10059-I.
- Huppler, A.R., J.C. Eickhoff, and E.R. Wald, Performance of low-risk criteria in the evaluation of young infants with fever: Review of the literature. Pediatrics, 2010. 125(2): p. 228-33.
- Nijman, R.G., et al., Clinical prediction model to aid emergency doctors managing febrile children at risk of serious bacterial infections: diagnostic study. BMJ, 2013. BMJ 2013;346:f1706 doi: 10.1136/bmj.f1706.
- Nigrovic, L.E., R. Malley, and N. Kuppermann, Meta-analysis of bacterial meningitis score validation studies. Arch Dis Child, 2012. 97(9): p. 799-805.
- Craig, J.C., et al., The accuracy of clinical symptoms and signs for the diagnosis of serious bacterial infection in young febrile children: prospective cohort study of 15 781 febrile illnesses. BMJ, 2010. 340: p. c1594.
- Brent, A.J., et al., Risk score to stratify children with suspected serious bacterial infection: observational cohort study. Arch Dis Child, 2011. 96(4): p. 361-7.
- Thompson, M., et al., How well do vital signs identify children with serious infections in paediatric emergency care? Arch Dis Child, 2009. 94(11): p. 888-893.
- Van Den Bruel, A., et al., Diagnostic value of laboratory tests in identifying serious infections in febrile children: Systematic review. BMJ, 2011. 342(7810).
- Offringa, M., et al., Seizures and fever: can we rule out meningitis on clinical grounds alone? Clin Pediatr (Phila), 1992. 31(9): p. 514-22.
- Nijman, R.G., et al., Can urgency classification of the Manchester triage system predict serious bacterial infections in febrile children? Arch Dis Child, 2011. 96(8): p. 715-722.
- Thompson, M., et al., Systematic review and validation of prediction rules for identifying children with serious infections in emergency departments and urgent-access primary care. Health Technol Assess, 2012. 16(15): p. 1-100.
- Yo, C.H., et al., Comparison of the Test Characteristics of Procalcitonin to C-Reactive Protein and Leukocytosis for the Detection of Serious Bacterial Infections in Children Presenting With Fever Without Source: A Systematic Review and Meta-analysis. Ann Emerg Med, 2012.
- Sanders, S., et al., Systematic review of the diagnostic accuracy of C-reactive protein to detect bacterial infection in nonhospitalized infants and children with fever Review. J Pediatr, 2008. 153(4): p. 570-4.
- Bressan, S., et al., Predicting severe bacterial infections in well-appearing febrile neonates: Laboratory markers accuracy and duration of fever. Pediatr Infect Dis J, 2010. 29(3): p. 227-232.
- Luaces-Cubells, C., et al., Procalcitonin to detect invasive bacterial infection in non-toxic-appearing infants with fever without apparent source in the emergency department. Pediatr Infect Dis J, 2012. 31(6): p. 645-7.
- Manzano, S., et al., Markers for bacterial infection in children with fever without source. Arch Dis Child, 2011. 96(5): p. 440-446.
- Pratt, A. and M.W. Attia, Duration of fever and markers of serious bacterial infection inyoung febrile children. Pediatr Int, 2007. 49(1): p. 31-35.
- Woelker, J.U., et al., Serum procalcitonin concentration in the evaluation of febrile infants 2 to 60 days of age. Pediatr Emerg Care, 2012. 28(5): p. 410-415.
- Mills, G.D., et al., Elevated procalcitonin as a diagnostic marker in meningococcal disease. Eur J Clin Microbiol Infect Dis, 2006. 25(8): p. 501-9.
- Dauber, A., et al., Procalcitonin levels in febrile infants after recent immunization. Pediatrics, 2008. 122(5): p. e1119-e1122.
- Maniaci, V., et al., Procalcitonin in young febrile infants for the detection of Serious bacterial infections. Pediatrics, 2008. 122(4): p. 701-710.
- Gomez, B., et al., Diagnostic value of procalcitonin in well-appearing young febrile infants. Pediatrics, 2012. 130(5): p. 815-22.
- Galetto-Lacour, A., et al., Validation of a laboratory risk index score for the identification of severe bacterial infection in children with fever without source. Arch Dis Child, 2010. 95(12): p. 968-973.
- Lacour, A.G., S.A. Zamora, and A. Gervaix, A score identifying serious bacterial infections in children with fever without source. Pediatr Infect Dis J, 2008. 27(7): p. 654-656.
- Cornbleet, P.J., Clinical utility of the band count. Clin Lab Med, 2002. 22(1): p. 101-36.
- Chiesa, C., et al., Procalcitonin as a marker of nosocomial infections in the neonatal intensive care unit. Intensive Care Med, 2000. 26 Suppl 2: p. S175-7.
- Bressan, S., et al., Bacteremia in feverish children presenting to the emergency department: A retrospective study and literature review. Acta Paediatr Int J Paediatr, 2012. 101(3): p. 271-7.
- Greenhow, T.L., Y.Y. Hung, and A.M. Herz, Changing epidemiology of bacteremia in infants aged 1 week to 3 months. Pediatrics, 2012. 129(3): p. e590-e6.
- Krief, W.I., et al., Influenza virus infection and the risk of serious bacterial infections in young febrile infants. Pediatrics, 2009. 124(1): p. 30-9.
- Velasco-Zuniga, R., et al., Predictive factors of low risk for bacteremia in infants with urinary tract infection. Pediatr Infect Dis J, 2012. 31(6): p. 642-5.
- Ralston, S., V. Hill, and A. Waters, Occult serious bacterial infection in infants younger than 60 to 90 days with bronchiolitis: A systematic review. Arch Pediatr Adolesc Med, 2011. 165(10): p. 951-6.
- Hsiao, A.L., L. Chen, and M.D. Baker, Incidence and predictors of serious bacterial infections among 57- to 180-day-old infants. Pediatrics, 2006. 117(5): p. 1695-701.
- Hom, J. and K. Medwid, The low rate of bacterial meningitis in children, ages 6 to 18 months, with simple febrile seizures. Acad Emerg Med, 2011. 18(11): p. 1114-20.
- Kimia, A., et al., Yield of lumbar puncture among children who present with their first complex febrile seizure. Pediatrics, 2010. 126(1): p. 62-9.
- Tebruegge, M., et al., The age-related risk of co-existing meningitis in children with urinary tract infection. PLoS ONE, 2011. 6(11): p. e26576.
- Paquette, K., et al., Is a lumbar puncture necessary when evaluating febrile infants (30 to 90 days of age) with an abnormal urinalysis? Pediatr Emerg Care, 2011. 27(11): p. 1057-61.
- Shah, S.S., et al., Sterile Cerebrospinal Fluid Pleocytosis in Young Infants with Urinary Tract Infections. J Pediatr, 2008. 153(2): p. 290-2.
- Mintegi, S., et al., Well appearing young infants with fever without known source in the Emergency Department: Are lumbar punctures always necessary? Eur J Emerg Med, 2010. 17(3): p. 167-9.
- Meehan, W.P. and R.G. Bachur, Predictors of cerebrospinal fluid pleocytosis in febrile infants aged 0 to 90 days. Pediatr Emerg Care, 2008. 24(5): p. 287-93.
- Seltz, L.B., E. Cohen, and M. Weinstein, Risk of bacterial or herpes simplex virus meningitis/encephalitis in children with complex febrile seizures. Pediatr Emerg Care, 2009. 25(8): p. 494-7.
- Shah, S., et al., Detection of occult pneumonia in a pediatric emergency department. Pediatr Emerg Care, 2010. 26(9): p. 615-21.
- Murphy, C.G., et al., Clinical Predictors of Occult Pneumonia in the Febrile Child. Acad Emerg Med, 2007. 14(3): p. 243-9.
- Rutman, M.S., R. Bachur, and M.B. Harper, Radiographic pneumonia in young, highly febrile children with leukocytosis before and after universal conjugate pneumococcal vaccination. Pediatr Emerg Care, 2009. 25(1): p. 1-7.
- Mintegi, S., et al., Occult pneumonia in infants with high fever without source: A prospective multicenter study. Pediatr Emerg Care, 2010. 26(7): p. 470-4.
- Bourayou, R., et al., [What is the value of the chest radiography in making the diagnosis of children pneumonia in 2011?] Quel est l'interet de la radiographie du thorax dans le diagnostic d'une pneumonie de l'enfant en 2011 ? Arch Pediatr, 2011. 18(11): p. 1251-4.
- Bramson, R.T., N.T. Griscom, and R.H. Cleveland, Interpretation of chest radiographs in infants with cough and fever. Radiology, 2005. 236(1): p. 22-9.
- Wilkins, T.R. and R.L. Wilkins, Clinical and radiographic evidence of pneumonia. Radiol Technol, 2005. 77(2): p. 106-10.
- Doan, Q., et al., Rapid viral diagnosis for acute febrile respiratory illness in children in the Emergency Department. Cochrane Database Syst Rev, 2012. 5: p. CD006452.
- Iyer, S.B., et al., Effect of Point-of-care Influenza Testing on Management of Febrile Children. Acad Emerg Med, 2006. 13(12): p. 1259-68.
- Benito-Fernandez, J., et al., Impact of rapid viral testing for influenza A and B viruses on management of febrile infants without signs of focal infection. Pediatr Infect Dis J, 2006. 25(12): p. 1153-7.
- Mintegi, S., et al., Rapid influenza test in young febrile infants for the identification of low-risk patients. Pediatr Infect Dis J, 2009. 28(11): p. 1026-8.
- Dewan, M., et al., Cerebrospinal fluid enterovirus testing in infants 56 days or younger. Arch Pediatr Adolesc Med, 2010. 164(9): p. 824-30.
- Gomez, B., et al., Clinical and analytical characteristics and short-term evolution of enteroviral meningitis in young infants presenting with fever without source. Pediatr Emerg Care, 2012. 28(6): p. 518-23.
- Vanagt, W.Y., et al., Paediatric sepsis-like illness and human parechovirus. Arch Dis Child, 2012. 97(5): p. 482-3.
- Verboon-Maciolek, M.A., et al., Severe neonatal parechovirus infection and similarity with enterovirus infection. Pediatr Infect Dis J, 2008. 27(3): p. 241-5.
- King, R.L., et al., Routine cerebrospinal fluid enterovirus polymerase chain reaction testing reduces hospitalization and antibiotic use for infants 90 days of age or younger. Pediatrics, 2007. 120(3): p. 489-96.
- Lin, T.-Y., et al., Neonatal enterovirus infections: emphasis on risk factors of severe and fatal infections. Pediatr Infect Dis J, 2003. 22(10): p. 889-94.
- Rittichier, K.R., et al., Diagnosis and outcomes of enterovirus infections in young infants. Pediatric Infectious Disease Journal, 2005. 24(6): p. 546-550.
- Sharp, J., et al., Characteristics of Young Infants in Whom Human Parechovirus, Enterovirus or Neither Were Detected in Cerebrospinal Fluid during Sepsis Evaluations. Pediatr Infect Dis J, 2012.
- Caviness, A.C., et al., The Prevalence of Neonatal Herpes Simplex Virus Infection Compared with Serious Bacterial Illness in Hospitalized Neonates. J Pediatr, 2008. 153(2): p. 164-9.
- Caviness, A.C., G.J. Demmler, and B.J. Selwyn, Clinical and laboratory features of neonatal herpes simplex virus infection: a case-control study. Pediatr Infect Dis J, 2008. 27(5): p. 425-30.
- Kneen, R., et al., The management of infants and children treated with aciclovir for suspected viral encephalitis. Arch Dis Child, 2010. 95(2): p. 100-6.
- Long, S.S., et al., Herpes simplex virus infection in young infants during 2 decades of empiric acyclovir therapy. Pediatr Infect Dis J, 2011. 30(7): p. 556-61.
- Cohen, D.M., et al., Factors influencing the decision to test young infants for herpes simplex virus infection. Pediatr Infect Dis J, 2007. 26(12): p. 1156-8.
- Davis, K.L., et al., Why are young infants tested for herpes simplex virus? Pediatr Emerg Care, 2008. 24(10): p. 673-8.
- McGuire, J.L., et al., Herpes Simplex Testing in Neonates in the Emergency Department. Pediatr Emerg Care, 2012.
- Byington, C.L., et al., Serious bacterial infections in febrile infants 1 to 90 days old with and without viral infections. Pediatrics, 2004. 113(6): p. 1662-6.
- Rittichier, K.R., et al., Diagnosis and outcomes of enterovirus infections in young infants. Pediatr Infect Dis J, 2005. 24(6): p. 546-50.
- Stellrecht, K.A., et al., The impact of an enteroviral RT-PCR assay on the diagnosis of aseptic meningitis and patient management. J Clin Virol, 2002. 25 Suppl 1: p. S19-26.
- Schwartz, S., et al., A week-by-week analysis of the low-risk criteria for serious bacterial infection in febrile neonates. Arch Dis Child, 2009. 94(4): p. 287-92.
- Thompson, C., et al., Encephalitis in children. Arch Dis Child, 2012. 97(2): p. 150-61.
- Purssell, E., Systematic review of studies comparing combined treatment with paracetamol and ibuprofen, with either drug alone. Arch Dis Child, 2011. 96(12): p. 1175-9.
- Chiappini, E., et al., Management of fever in children: summary of the Italian Pediatric Society guidelines. Clin Ther, 2009. 31(8): p. 1826-43.
- Sullivan, J.E. and H.C. Farrar, Fever and antipyretic use in children. Pediatrics, 2011. 127(3): p. 580-7.
- Grol, R., et al., Attributes of clinical guidelines that influence use of guidelines in general practice: observational study. BMJ, 1998. 317(7162): p. 858-61.
- Nabulsi, M., Is combining or alternating antipyretic therapy more beneficial than monotherapy for febrile children? BMJ (Online), 2010. 340(7737): p. 92-3.
- Southey, E.R., K. Soares-Weiser, and J. Kleijnen, Systematic review and meta-analysis of the clinical safety and tolerability of ibuprofen compared with paracetamol in paediatric pain and fever. Curr Med Res Opin, 2009. 25(9): p. 2207-22.
- Pierce, C.A. and B. Voss, Efficacy and safety of ibuprofen and acetaminophen in children and adults: A meta-analysis and qualitative review. Ann Pharmacother, 2010. 44(3): p. 489-506.
- Goldstein, L.H., et al., Effectiveness of oral vs rectal acetaminophen: A meta-analysis. Arch Pediatr Adolesc Med, 2008. 162(11): p. 1042-6.
- Almond, S., D. Mant, and M. Thompson, Diagnostic safety-netting. Br J Gen Pract, 2009. 59(568): p. 872-4; discussion 874.
- Neighbour, R., The inner consultation. 2004, Oxford: Radcliffe Publishing.
- Goldman, R.D., M. Ong, and A. Macpherson, Unscheduled return visits to the pediatric emergency department-one-year experience. Pediatr Emerg Care, 2006. 22(8): p. 545-9.
- Wahl, H., et al., Health information needs of families attending the paediatric emergency department. Arch Dis Child, 2011. 96(4): p. 335-9.
- Doan, Q., et al., Rapid viral diagnosis for acute febrile respiratory illness in children in the Emergency Department. Cochrane Database Syst Rev, 2009(4): p. CD006452.
- American College of Emergency Physicians Clinical Policies, C. and F. American College of Emergency Physicians Clinical Policies Subcommittee on Pediatric, Clinical policy for children younger than three years presenting to the emergency department with fever. Ann Emerg Med, 2003. 42(4): p. 530-45.
- American College of Radiology. ACR Appropriateness Criteria. Fever without source - Child. . 1999 (last update: 2011).
Evidence tabellen
Evidence-tabellen voor systematische reviews behorende bij uitgangsvragen 1-4
|
|
Reference |
Level |
Study type |
Studies, patients and setting |
Prevalence |
intervention |
Comparison, control |
Outcome measures |
Results |
Other remarks |
|
[60] |
Bressan, S., et al., Bacteremia in feverish children presenting to the emergency department: A retrospective study and literature review. Acta Paediatr Int J Paediatr, 2012. 101(3): p. 271-7. |
A1 |
SR, plus retrospective observational cohort study |
Review included 10 studies
5 studies included well-apearing children, aged 3 – 36 months with FWS 1 study on children <3 months with FWS 4 studies on febrile children, irrespective of appearance and source of fever
Patients; children with fever, aged 0 – 18 years
Setting: emergency departments in USA, and Spain
Retrospective study: Patients: previously healthy and well appearing children aged 1 month – 36 month who had a blood culture performed as part of their evaluation for fever without source. Fever without source was defined as fever defined as a rectal temperature ≥38.0 oC or an axillary temperature ≥37.5oC Children with antibiotics use within 72 hr before admission to ED were excluded.
Setting: tertiary care peditric emergency department, Italy, 2006 - 2009 |
Review
Retrospective study:
|
Review Blood culture
Retrospective study: Blood culture (performed according to protocol. A blood culture was ordered for children without source with fever defined as a rectal temperature >38.0 oC or axillary temperature >37.5oC in children < 3 months, and a rectal temperature >39.5oC or an axillary temperature >39.0oC in children aged 3 – 36 months.) |
NA, descriptive studies on incidence of bacteraemia |
Bacteraemia (defined as positive blood culture) |
Review: 5 studies included well-apearing children, aged 3 – 36 months with FWS: rate of bacteraemia <0.5% with high (ie >80%) PCV7 vaccine coverage, and 0.7-0.9% in low coverage (ie. 50-70%) areas.
One study showed a decline of incidence of bacteraemia from 6.7% (pre PCV7 vaccination era) to 0.4% (post) among well-appearing children; among well appearing children 1 study showed a reduction from 1,8% to 0,76%; another study showed a decline from 1,3% to 0,43% (all children with fever); and a thord study showed a decline from 2,4% to 0,2% (all children with fever)
One Study with children <3 months: rate of bacteraemia was 2.2%, with higher rates in ‘not well appearing’ children and in children with positive urine dipstick.
Retrospective study: 3/392 children had bacteraemia (0.77%, 95% CI 0.0% – 1.64%)
3 – 36 months: 0.34% (95% CI 0-1%, n=1) 1 – 3 months: 2% (95% 0 – 4.7%, n=2) Difference in incidence not statistically significant. |
Search period: 2001 – April 2011
Data extraction methods, or quality assessment have been described in paper. |
|
[66] |
Hom, J. and K. Medwid, The low rate of bacterial meningitis in children, ages 6 to 18 months, with simple febrile seizures. Acad Emerg Med, 2011. 18(11): p. 1114-20.
|
B |
SR (including 2 B level studies) |
2 studies, both included studies were retrospective observational cohort studies
Patients: 150 children, aged 6 months to 18 months, who presented to the ED with simple febrile seizure episode, defined as a primarily generalised seizure lasting no longer than 15 minutes, occurring only once within 24 hrs, and without evidence of a CNS infection (via history and physical examination) or underlying seizure seizure disorder. Studies on complex febrile seizures, or underlying neurologic pathology/medical history were excluded. Patients with clinical signs of meningitis (ie. Bulging fontanelle, ill-appearance, lethargy, irritability, or mengingeal signs) were also excluded.
Setting: emergency departments |
Bacterial meningitis 0% (95% CI 0 – 3%) |
LP performed with the aim of ruling out bacterial meningitis |
NA |
Primary outcome: bacterial meningitis, as diagnosed by LP findings (defined as bacterial growth form CSF specimen, CSF pleiocytosis ie. ≥5 ×106/L WBC, pathogen growth in blood culture, positive GRAM stain, positive latex agglutination test)
Secondary outcome: Rate of pleiocytosis in children who were pretreated with antibiotics |
Overall rate of bacterial meningitis was 0% (95% CI 0 -3%, 0/150)
Rate of CSF pleiocytosis in chidren pretreated with antibiotics: 2.5 % (95% CI 0 – 14%, 1/40) |
|
|
[64] |
Ralston, S., V. Hill, and A. Waters, Occult serious bacterial infection in infants younger than 60 to 90 days with bronchiolitis: A systematic review. Arch Pediatr Adolesc Med, 2011. 165(10): p. 951-6.
|
A1 |
SR |
Studies: 10 studies, of which were 5 prospective and 5 were retrospective observational studies.
Patients: children <90 days with clinical bronchiolitis and/or respiratory syncytial virus infection. In 8/11 studies all included children had fever (as defined by the individual studies). In most studies children with comorbidities were excluded; some studies also excluded children with antibiotics use prior to visit.
Setting: ED, inpatient and outpatient |
Weighted rate of UTI was 3.3% (95% CI 1.9 – 5.7%).
|
Urine culture, blood culture, CSF culture |
|
Admission for bronchiolitis and the presence of cocomittant occult serious bacterial infections (defined as UTI, meningitis, and bacteraemia) |
Weighted rate of UTI was 3.3% (95% CI 1.9 – 5.7%).
No case of bacteraemia was reported in 8/11 studies.
No case of meningitis was reported in any of the studies.
No data of concomitant bacterial pneumonia are presented |
|
Tabel 14. Aanvullende observationele diagnostische studies (publicatiedatum na verschijnen van systematische reviews): uitgangsvragen 1-4
|
|
Reference |
Level |
Study type |
patients, setting |
Prevalentce |
indextest |
referencetest |
Results |
Other remarks |
|
|
[62] |
Krief, W.I., et al., Influenza virus infection and the risk of serious bacterial infections in young febrile infants. Pediatrics, 2009. 124(1): p. 30-9.
|
B |
Prospective cross-sectional observational cohort study |
Setting:5 pediatric EDs in US, 1998 – 2001
Patients: infants ≤60 days with history or presentation to the ED with a rectal temperature of ≥38.0oC and who were tested for influenza virus by nasopharyngeal swab and for whom at least 1 bacterial culture was obtained (urine, blood, CSF, stool). Patients receiving antibiotic treatment ≤48 hrs prior to ED visit were excluded.
|
Serious bacterial infections 11.7% (95/809) and influenza virus 14.3% (123/844) |
Influenza rapid antigen detection
|
Serious bacterial infections, as determined by positive blood, urine, CSF, or stool culture
Lobar pneumonia, as defined by abnormal chest Xray determined by blinded pediatric radiologist (secondary outcome), not defined as SBI |
844 out of 1091 eligible children were tested for influenza.
123/844 (14,3%) tested positive for influenza virus
In the influenza tested population: 835/844 had blood cultures; 810/844 had CSF cultures; 835/844 had urine cultures. Telephonic follow up ruled out SBI in children without reference test. CXR: 262/844, and stool culture 63/844.
Complete SBI status was determined in 809/844 children. Incidence of SBI was 11.7% (95/809).
Incidence of SBI among Influenza positive children: 2.5% (95% CI 0.5 – 7.2%, n=3/119; UTI 2.4% (95% CI 0.5 – 6.9%, n=3/123). No No SBI among influenza positive children ≤28 days
There were no children with bacterial meningitis or bacteraemia or enteritis among influenza positive children NPV of influenza pos test: 97.5% (95% CI 93.0 – 99.2%)
Among influenza negative children: SBI 13.3% (95% CI 10.9 – 16.1%, n=92/690); UTI 10.8% (95% CI 8.6 - 13.3%, n=77/712), there were 16 cases of bacteraemia (2.2%, 95% CI 1.3 - .3.6%, n=16/715); 6 cases of meningitis (0.9%, 95% CI 0.3 – 1.9%, n=6/698) and 1 case of enteritis (1.7%, 95% CI 0.3 – 8.9%, n=1/60). |
In earlier paper similar results have been presented for RSV positive children and incidence of SBI.
Rate of SBI among RSV positive children was greater than among influenza positive children, but not significantly so.
Lobar pneumonia: Among influenza positive 1/36 (2.8%, 95% CI 0.5 – 14.2%) among influenza negative children 18/226 (8%, 95% CI 5.1 – 12.2 %) |
|
|
[22] |
Morley, E.J., et al., Rates of positive blood, urine, and cerebrospinal fluid cultures in children younger than 60 days during the vaccination era. Pediatr Emerg Care, 2012. 28(2): p. 125-30.
|
B |
Retrospective cross sectional cohort study |
Patients: 207 otherwise healthy children ≤60 days presenting with fever, defined as a temperature of ≥38.0oC at ED or reported by a caregiver from home, and who had received a blood, urine, and/or CSF culture. Children who had received antibiotics t were excluded.
Setting: ED at a tertiary care center, US, 2006 - 2008 |
See results |
|
Positive blood, urine and/or CSF culture
All children ≤60 days should have at least one of these cultures according to a local protocol |
Overall rate of positive cultures was:
Children <28 days: Rate of positive blood culture 2.7% (range 0.0 – 6.4%, n=2 out ot 75/77) Rate of positive urine culture: 10.7% (range 3.5 – 17.8%, n=8 out of 75/77) Rate of positive CSF culture: 0% (range 0.0 – 3.9%, n=0 out of 71/77)
Children ≥days – 60 days: Rate of positive blood culture 1.5% (range 0.0 – 3.6%, n=2 out of 130/130) Rate of positive urine culture: 8.5% (range 3.7 – 13.3%, n=11 out of 126/130) Rate of positive CSF culture: 1.7% (range 0.0 – 5.0%, n=1 out of 59/130)
Most common pathogen for UTI was E.Coli; no H.Influenza or S.pneumonia were detected.
|
|
|
|
[61] |
Greenhow, T.L., Y.Y. Hung, and A.M. Herz, Changing epidemiology of bacteremia in infants aged 1 week to 3 months. Pediatrics, 2012. 129(3): p. e590-e6.
|
B |
Retrospective cross sectional cohort study |
Patients: previously healthy children aged 1 week – 3 months, for whom a blood culture was drawn
Setting: clinic, emergency department, or hospital (first 4 hrs of hospitalisation), US, 2005 – 2009
Data was extracted from large medical databse containing all blood culture results at KPNC (health organisation) |
|
|
Bacteraemia as determined by positive blood culture.
Concomitant serious bacterial infections, ie. UTI defined as: positive urine culture from catheterized urine, and meningitis, defined as positive CSF culture with or without CSF pleiocytosis |
4,255 unique blood cultures were peformed in 4,122 healthy infants
340/4,55 blood cultures were positive, of which 247 were deemed contaminants, and one child had 2 positive blood cultures, leaving 92 unique, positive blood cultures in 92 healthy infants (2.2%).
6 out of 868/92 children had no documented history of fever.
Rates of bacteraemia: 7 – 28 days: 2.84% 29 – 60 days: 1.92% 61 – 92 days: 2.14% Not significantly different
Between 2005 – 2009 no change in incidence of bacteraemia was observed
Causative pathogens: E.Coli (n=52), GBS (n=19), S. aureus (n=7), other (n=14)
10 cases had concomitant meningitis (GBS n=5, S. pneumonia n=1, E. coli n=4)
47/48 children with E. coli in blood culture (n=52) had positive urine culture (no urine culture was available in 4 E. coli positive children)
|
|
|
|
[63] |
Velasco-Zuniga, R., et al., Predictive factors of low risk for bacteremia in infants with urinary tract infection. Pediatr Infect Dis J, 2012. 31(6): p. 642-5.
|
B |
Retrospective cross sectional cohort study |
Patients: 140 children aged 29 – 60 days with a discharge diagnosis of UTI.
Setting: teaching hospital in Spain, 1994 – 2010 |
|
Secondary bacteraemia, defined as positive blood culture
|
UTI, defined as positive urine culture from catheterised urine or suprapubic puncture, plus a positive urinalysis (nitriuria or leukocyturia). |
10 patients had concomitant bacteraemia, of whom 3 had septic shock
1 patients had positive CSF culture (same organism as positive urine culture)
1/63 children without risk factors (ie. Prematurity, underlying chronic disease, antenatal diagnosed renal malformation, prior antibiotics prescription, signs of general malaise, elevated CRP) had bacteraemia (NPV: 98.4%, 95% CI 91.5 – 99.7%; LR – 5.28; sensitivity: 90.9%, 95% CI 62.2 – 98.3%; specificity: 48%, 95% CI 39.6 – 56.6%) |
|
|
|
[67] |
Kimia, A., et al., Yield of lumbar puncture among children who present with their first complex febrile seizure. Pediatrics, 2010. 126(1): p. 62-9.
|
B |
Retrospective, cohort study |
Patients: 526 otherwise healthy children aged 6 – 60 months who had their first complex febrile seizure (>15 minutes, focal seizures with several possible features, new events may reoccur <24 hr, may present with a series of seizures with limited time interval)
Setting: paediatric ED, US, 1995 - 2008 |
|
|
CSF pleiocytosis was defined a CSF white blood cell count >7/µl, corrected for presence of red blood cell in CSF.
Acute bacterial meningitis was defined as growth of a pathogen in CSF culture, or CSF pleiocytosis with positive blood culture. |
526 patients presented with complex febilre seizure
340/526 (64%) had a lumbar punction
No patients without LP did not return to the hospital with a diagnosis of acute bacterial meningitis
14/340 had pleiocytosis; 2 of those had acute bacterial meningitis (both S pneumoniae). One patient did not have CSF cell, but had positive CSF culture for S. pneumoniae.
No data is supplied on viral meningitis/encephalitis: 5 admitted children with pleiocytosis had presumptive viral meningoencephalitis
|
|
|
|
[71] |
Mintegi, S., et al., Well appearing young infants with fever without known source in the Emergency Department: Are lumbar punctures always necessary? Eur J Emerg Med, 2010. 17(3): p. 167-9.
|
B |
Retrospective, cohort study |
Patients: 685 previously healthy and well appearing children < 3 months old with fever without source. Children using antibiotics prior to ED visit were excluded.
Setting: ED of a tertiary hospital, Spain, 2003 – 2007 |
|
Lumbar punction: according to protocol all healthy children with FWS <15 days to have LP, for children between 15 and 28 days LP is recommended, >28 days performance of LP is based on clinical status, observational period or ancillary testing |
Bacterial meningitis, defined as a positive CSF culture or positive GRAM stain, or positive pleiocytosis with positive blood culture.
Aseptic meningitis: patients with CSF pleiocytosis plus negative CSF/blood cultures, and patients with viral meningitis (ie. Enterovirus isolate in CSF culture and/or PCR).
All discharged patients had telephonic follow-up |
In 198/685 lumbar punction was performed
In 36/198 (18.1%) pleiocytosis was found. Of these 2 had bacterial meningitis (both <15 days old), and 47 had aseptic meningitis.
Of the 487 in whom no LP was performed, 4 children had aseptic meningitis on return visit (out of 38 unscheduled return visits), but no child had bacterial meningitis. 64 were admitted to the hospital, and 46 had UTI.
Rate of SBI: Children <28 days: 20.1%; children > 28 days: 12.6% (p=0.04)
Enterovirus was isolated in 18 infants (9 without pleiocytosis) |
|
|
|
[70] |
Shah, S.S., et al., Sterile Cerebrospinal Fluid Pleocytosis in Young Infants with Urinary Tract Infections. J Pediatr, 2008. 153(2): p. 290-2.
|
B |
Prospective, cross-sectional multicenter study |
Patients: children aged ≤60 days with fever, defined as rectal temperature ≥38.0oC by history or at the ED, in whom a lumbar puncture was performed. Children were excluded if using antibiotics ≤48 hrs prior to ED visit.
Setting: 8 pediatric EDs during the bronchiolitis season, US,1999 - 2001 |
|
Lumbar puncture |
CSF pleiocytosis, defined in 3 ways based on WBC in CSF, and corrected for the presence of red blood cells
UTI, defined as growth of a single pathogen from a urine obtained by using suprapubic or catheterised urine, in combination with positive urinalysis (positive leukocyte esterase, or nitrite, or both) |
91/1025 (9%) had UTI. Bactermaeia occurred in 7 infants with UTI (8,5%).
82 of these 91 children underwent LP: 18.5% (n=15) had pleiocytosis, but not bacterial meningitis. If traumatic punctures were excluded, incidence of pleiocytosis was considerably less.
|
|
|
|
[69] |
Paquette, K., et al., Is a lumbar puncture necessary when evaluating febrile infants (30 to 90 days of age) with an abnormal urinalysis? Pediatr Emerg Care, 2011. 27(11): p. 1057-61.
|
B |
Retrospective, cohort study |
Patients: 392 otherwise healthy children aged 30 – 90 days who underwent LP for bacterial culture, in addition to urinalysis and blood and urine cultures. Children with evident focus of infection and those receiving antibiotic treatment were excluded.
Setting: predicatric ED, Canada, 2001 – 2005
|
|
|
Abnormal urinalysis, defined as positive leukocute esterase, and/or positive nitrite on dipstick, or >10WBCs/HPF on miscroscopy |
57/392 had abnormal urinalysis.
1/57 had E.coli UTI, bacteraemia and meningitis; NPV for meningitis in nchildren with abnormal urinalysis was 98.2%, pos LR 1.8 (95% CCI 0.3 – 9.6), neg LR 0.87 (95% CI 0.5 – 1.5). This child did not meet Rochester Low Risk criteria.
3/392 children with normal urinalysis had bacterial meningitis
|
|
|
|
[68] |
Tebruegge, M., et al., The age-related risk of co-existing meningitis in children with urinary tract infection. PLoS ONE, 2011. 6(11): p. e26576.
|
B |
Retrospective study |
Patients: children <16 years old with culture proven UTI and a paired CSF sample
Setting: data were extracted from hospital record, Australia, 2001 - 2010 |
|
|
UTI, defined as growth of a single bacterial pathogen from suprapubic or catheterised urine, or clean catch urine, or a bag urine sample
CSF pleiocytosis defined as CSF WBC >19/µl for children <28 days and >9/ µl for older children, corrected for the presence of red blood cells.
Definite meningitis was defined as growth of single bacterial pathogen from CSF culture |
748 episodes of 735 children were evluated: 2/163 neonates (1.2%, 95% CI 0.15 – 4.36%) with UTI had co-existing meningitis. Both neonates presented with pyrexia, irritability and lethargy. 0/499 infants (0%, 95% CI 0.0 – 0.74%) (aged 29 days – 12 months) with UTI had co-existing meningitis 0/86 (0%, 95% 0.0 – 2.4%) children aged >12 months with UTI had co-existing bacterial meningitis.
10/68 CSF samples with antimicrobial activity had pleiocytosis; 1 case had bacterial meningitis, 5 cases had other clear diagnoses, in the remaining 4 children no clear diagnoses was made but there were no further indications of bacterial meningitis |
|
|
|
[72] |
Meehan, W.P. and R.G. Bachur, Predictors of cerebrospinal fluid pleocytosis in febrile infants aged 0 to 90 days. Pediatr Emerg Care, 2008. 24(5): p. 287-93.
|
B |
Retrospective study |
Patients: previously healthy children aged ≤90 days with fever defined as a rectal temperature ≥38.0oC in whom a LP was performed and CSF sample was available. Children with a traumatic (ie. >10.000 red blood cells/µl) LP, and children using antibiotics prior to ED visit were excluded.
Setting: pediatric ED, US, 4-year study period
|
|
|
CSF pleiocytosis, defined as CSF WBC count of ≥25 cells/µl for children 0 – 28 days, and CSF WBC count of ≥10 cells/µl for children 29 – 90 days, corrected for red blood cells with 1:500 ratio.
Bacterial meningitis was defined by positive CSF culture. |
2003/2820 children had CSF obtained and were included for analysis. (excluding 182 LPs (8.3%) because of traumatic LPs) 176/2003 had pleiocytosis (8.8%, 95% CI 7.6 – 10.1%).
Children ≤30 days: 38/500 (7.6%) had pleiocytosis Children 31 – ≤60 days: 86/813 (10.4%) Children 61 – ≤90 days: 52/680 (7.7%)
Of children with pleiocytosis, 2.2% were described as ill appearing
Incidence of pleiocytosis in summer: 17.4% (95% 14.6 – 20.6%) vs non-summer 5.0% (95% CI 4.0 – 6.3%)
7 children had bacterial meningitis (0.35%, 95% CI 0.17 – 0.72%), of whom 5 also had positive blood cultures. 2/7 did not have CSF pleiocytosis.
A decision tree was presented for predicting CSF pleiocytosis, including season, temperature and WBC. Sensitivity: 89% (95% CI 83 – 92%) Specificity 38% (95% CI 36 – 40%) NPV: 97% (95% CI 96 – 98%) PPV 12% (95% CI 10 – 14%) LR+ 1.43 (95% CI 1.34 – 1.53) LR- 0.30 (95% CI 0.20 – 0.45)
among children with pleiocytosis (n=176) Incidence UTI 6.8%, Bacteraemia 4.0%, bacterial meningitis 2.8% among children without pleiocytosis: (n=1827) Incidence UTI 8.1%, Bacteraemia 1.1%, bacterial meningitis 0.1% |
|
|
|
[74] |
Shah, S., et al., Detection of occult pneumonia in a pediatric emergency department. Pediatr Emerg Care, 2010. 26(9): p. 615-21. |
B |
Prospective observational study |
Patients: Previously healthy patients <21 years who underwent chest X ray for suspicion of pneumonia
Setting: pediatric ED, US, 2006 - 2007
|
|
|
Occult pneumonia: definite pneumonia in children without lower respiratory tract findings or respiratory distress (as judged and scores in a standardized manner by the attending physician)
Definite Pneumonia, defined as infiltrate, consolidation or pneumonia on chestbradiograph
If report of CXR included ambivalent terminology diagnosis was considered ‘equivocal pneumonia’ |
308/1866 children had no evidence of respiratory distress or lower Respiratory tract findings (ie. tachypea, or adventitial breathing sounds, such as wheeze, focal decreased breathing sounds, rhonchi, rales, and/or crackles).
21/308 had radiographic occult pneumonia (6.8%, 95% CI 4.0 – 10.6%); another 13 had equivocal pneumonia (4.2%)
A decision model was constructed including cough and duration of illness to identify patients at greater risk of OP (LR pos 1.47, 95% CI 1.21 – 1.77; LR neg 0.40, 95% CI 0.19 – 0.84)
Decisions to perform CXR were: duration of cough (38.3%), height of fever (30.8%), duration of fever (27.9%), severity of cough (14.9%), elevated WBC count (11.4%), history of previous pneumonia (7,5%), chest pain (6.2%) and primary care physician’s request (4.2%) |
|
|
|
[75] |
Murphy, C.G., et al., Clinical Predictors of Occult Pneumonia in the Febrile Child. Acad Emerg Med, 2007. 14(3): p. 243-9. |
B |
Retrospective cross sectional study |
Setting: paediatric emergency department, US, 2002
Patients: 2,128 children aged ≤10 years with fever, defined as temperature ≥38.0oC at home or during triage at ED, and in whom a chest X ray was performed for suspected pneumonia. |
|
|
Pneumonia: presence of infiltrate or consolidation or multiple infiltrates or pneumonia or pneumonia with effusion on CXR, as read by radiologist.
Equivocal pneumonia: presence of focal atectase, or ‘cannot exclude pneumonia’ or ‘atelectase vs infiltrate’ as reported by radiologist.
Occult pneumonia: Proven pneumonia in children with no signs of pneumonia, defined as absence of retractions, nasal flaring, grunting, tachypnea, hypoxia, wheeze, crackles, rales, rhonchi, decreased breath sounds. |
1.084 of 2128 children had no signs of pneumonia, of whom 5.3% had occult pneumonia (95% CI 4.0 – 6.8%).
Presence of cough (LR+ 1.24, 95 % 1.15 – 1.33), longer duration (>10 days) of cough (LR+ 2.25 (95% CI 1.21 – 4.20) and longer duration (>5 days) of fever (LR+ 2.24, were associated with presence of occult pneumonia
Presence of cough: LR- 0.19 (95% CI 0.05 – 0.75)
Presence of nasal congestion, ill appearance, height of fever were not associated with occult pneumonia
Pneumonia among children with signs of pneumonia: 12.6% (n=132/1044)
Among children with signs of pneumonia: Wheeze: LR+ 0.66 (95% CI 0.51 – 0.86), LR- 13.32 (95% CI 1.15 – 1.52) Rales : LR+ 1.72 (95% CI 1.34 – 2.22), LR- 0.78 (95% CI 0.67 – 0.90) Decreased breath sounds: LR+ 2.91 (95% CI 2.08 – 4.08), LR- 0.77 (95% CI 0.68 – 0.86), rhonchi, dyspnea and tachypnea were not associated with pneumonia |
|
|
|
[76] |
Rutman, M.S., R. Bachur, and M.B. Harper, Radiographic pneumonia in young, highly febrile children with leukocytosis before and after universal conjugate pneumococcal vaccination. Pediatr Emerg Care, 2009. 25(1): p. 1-7.
|
B |
Retrospective study |
Setting: pediatric emergency department, US, 1996 – 2005
Patients: 1,224 previously healthy children < 5 years, with fever (ie. temperature at triage or documented in patient chart ≥39.0 oC) and a WBC >20×109/L and a chest X ray performed. Children with a clear source of infection were excluded.
|
|
|
Radiograpically proven pneumonia: consolidation and/or focal infiltrate(s) on CXR, interpreted by board-certified radiologists.
Equivocal pneumonia: CXR with findings reported as atelectasis, or possible pneumonia.
Occult pneumonia: pneumonia in children in the absence of cough or without symptoms and signs of lower respiratory tract infection, defined as presence of grunting, flaring, retractions, coarse breath sounds, crackles, rales, rhonchi, wheeze or decrease aeration/breath sounds, tachypnea, reduced oxygen saturation. . |
Pneumonia Pre-vaccination period (1995 – 2000): 190/889 (21%, 95% CI 19 – 24%) had radiographic pneumonia Post-vaccination period (2001 – 2005): 61/335 (18%, 95% CI 14 – 23%) had radiographic pneumonia (p=0.27)
Occult pneumonia: Pre-vaccination period (1995 – 2000): 61/404 (15%, 95% CI 12 – 19%) had radiographic pneumonia Post-vaccination period (2001 – 2005): 13/147 (9%, 95% CI 5 – 15%) had radiographic pneumonia (p=0.07)
In children <2 years: Pre-vaccination period (1995 – 2000): 121/709 (17%, 95% CI 14 – 20%) had radiographic pneumonia Post-vaccination period (2001 – 2005): 26/254 (10%, 95% CI 17 – 15%) had radiographic pneumonia (p=0.01)
Proportion of patients with bacteraemia: Pre-vaccination period (1995 – 2000): 60/873 (7%, 95% CI 19 – 24%) had bactaemia Post-vaccination period (2001 – 2005): 4/319 (1%, 95% CI 0 – 3%) had bacteraemia (p=0.001)
Among Children with CXR: Pre-vaccination period (1995 – 2000): 70% (95% CI 69 – 70) had WBC Post-vaccination period (2001 – 2005): 30% (95CI 29 – 30%() had WBC
Among Children with WBC: Pre-vaccination period (1995 – 2000): 12% had leukocytosis Post-vaccination period (2001 – 2005): 13% had leukocytosis |
|
|
|
[77] |
Mintegi, S., et al., Occult pneumonia in infants with high fever without source: A prospective multicenter study. Pediatr Emerg Care, 2010. 26(7): p. 470-4. |
B |
Muliticenter prospective study |
Setting: 4 pediatric emergency departments, Spain
Patients: 188 well appearing, previously healthy children <36 months with fever, as measured at home or at triage >39.0oC, without clear fouces (defined as being without cartarrhal or respiratory symptoms/signs or a diarrhoeal process in a patient with a normal physical examination result), and with a WBC >20 ×109/L. Not well appearing children and children who were taking antibiotics prior to ED visit were ecluded, as well children in whom a cflear focus could be established by anamnesis or physical examination.
Data collection: prospective, standardized questionnaire filled in by attending physician |
|
|
Pneumonia: report of consolidation and/or infiltrate(s) on chest X ray of attending paediatrician, and when I doubt, an emergency radiologist |
188 children were included; 37 chest X rays were interpreted by radiologist (20%).
Occult pneumonia: 25/188 (13.3%, 95% CI 9.2 – 18.9%)
Occult pneumonia was associated with age (OR 2.62 for infants >12 months, 95% CI 1.04 – 6.60) ANC (>20×109/L OR 3.52, 95% CI 1.37 – 9.06), and serum CRP level (>100 mg/l OR 3.18, 95% CI 1.19 – 8.51).
7/188 had pneumococ isolated In blood (blood culture taken in all children, 3.7%): 1 child had pneumonia on CXR, 6 children had normal CXR. |
|
|
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-12-2013
Laatst geautoriseerd : 01-12-2013
Geplande herbeoordeling : 01-01-2018
De richtlijn dient elke vijf jaar gereviseerd te worden. De geldigheid van de richtlijn komt eerder te vervallen als nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
Algemene gegevens
Deze richtlijn is tot stand gekomen door financiering van Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften, maar ‘systematisch ontwikkelde op evidence’ gebaseerde aanbevelingen bedoeld om hulpverleners en patiënten te ondersteunen in het besluitvormingsproces voor diagnostiek en behandeling. Aangezien deze aanbevelingen hoofdzakelijk gebaseerd zijn op de ‘gemiddelde patiënt’, kunnen zorgverleners op basis van hun professionele autonomie zonodig afwijken van de richtlijn. De aanbevelingen die in de huidige richtlijn staan vermeld, zijn te vertalen naar lokale protocollen die zijn toegespitst op de plaatselijke situatie. Afwijken van richtlijnen is, als de situatie van de patiënt dat vereist, soms zelfs noodzakelijk. Wanneer van een richtlijn wordt afgeweken, dient dit beargumenteerd en gedocumenteerd te worden.
Doel en doelgroep
Aanleiding
Koorts komt frequent voor bij kinderen. Elk gezond kind maakt gemiddeld acht infecties met koorts door in de eerste achttien levensmaanden [1]. Voor 20-40% van deze kinderen wordt een arts geconsulteerd in verband met koorts, met de hoogste prevalentie in de leeftijd van 6 tot 18 maanden.
Jaarlijks worden ongeveer 300.000 kinderen gezien op de SEH van Nederlandse ziekenhuizen. Ongeveer de helft van de kinderen die de kindergeneeskundige SEH bezoekt, komt vanwege koorts [2]. Het merendeel van deze kinderen heeft een virale infectie die geen verdere behandeling behoeft. Een ernstige (bacteriële) infectie is aanwezig bij 10-15% van de kinderen met koorts en kan bij te late onderkenning een gecompliceerd of eventueel fataal beloop kennen [3]. Het grote dilemma is het vroegtijdig onderscheiden van kinderen met een ernstige infectie (meningitis, sepsis, urineweginfectie, pneumonie) van de overgrote meerderheid van kinderen met een zelflimiterende aandoening. Als onderdeel van de diagnostische aanpak vindt bij ongeveer de helft van kinderen met koorts die zich op de SEH presenteren, aanvullende diagnostiek (bloedonderzoek, thoraxfoto, urineonderzoek) plaats, bij een derde een observationele opname, die bij een groot deel (achteraf) onnodig blijkt [3]. Vooral de (kortdurende) observationele opname neemt toe [4]. Sinds de introductie van vaccinatiestrategieën (Haemophilus influenzae type b (Hib)-vaccinatie in 1993, pneumokokkenvaccinatie in 2006) is het spectrum van diagnoses veranderd [5, 6], en de kans op zeer ernstige diagnoses sterk verlaagd [7]. Bij het verschuiven van het spectrum van bacteriële verwekkers door vaccinatie is er ook een verandering in de indicatie voor diagnostiek en behandeling. Eerdere richtlijnen beoogden vooral het identificeren van het kind met koorts zonder focus [8, 9], met een risico op occulte bacteriëmie, welke diagnose vooral relevant is bij pneumokokkeninfecties. Verder zijn bepaalde typische klinische kenmerken (zoals de hoogte van de koorts bij Hib-infectie) tegenwoordig minder relevant [21].
Een complicerende factor bij de beoordeling van het kind met koorts is dat het veelal jonge kinderen betreft. Het klinische beeld bij jonge kinderen met koorts kan dramatisch verslechteren in korte tijd. Daarentegen kan een kind met een virale infectie aanvankelijk ziek lijken, maar snel herstellen. Daar ernstige ziekten met koorts bij kinderen minder frequent voorkomen bestaat enerzijds het gevaar van overdiagnostiek en -behandeling en anderzijds van het (te) laat onderkennen van het ernstig zieke kind. Per jaar overlijden 23 kinderen in Nederland aan een infectieziekte die (bij tijdige onderkenning) goed te behandelen zou zijn geweest (RIVM, 2011).
De zorg bij ouders over een ernstige oorzaak bij een kind met koorts is groot [10]. In een studie naar de reactie van ouders wanneer hun kind acuut ziek werd, bleek dat ouders hoofdzakelijk bezorgd zijn over koorts, hoesten en de kans op meningitis [11]. Een groot deel van de ouders bezoekt de SEH zonder verwijzing via de huisarts. Bij kinderen met een ernstige infectie hebben ouders vaak hun bezorgdheid terecht geuit [12]. Bij te late onderkenning van ernstige infecties blijkt vaak eerder wel adequaat hulp te zijn gezocht door ouders [13], maar is instructie voor herbeoordeling bij verslechtering onvolledig gebleken. De rol van de ouders en de aard van instructie ten aanzien van follow-up is in de huidige richtlijnen onvoldoende belicht [14, 15].
Doelstelling
Evidence-based onderbouwing van de beoordeling en de eerste behandeling van het kind met koorts in de tweedelijnszorg teneinde enerzijds ernstige infecties vroegtijdig te
herkennen en anderzijds overdiagnostiek te beperken.
Toelichting
In deze richtlijn verstaan we onder ‘ernstige infecties’ die infecties die interventie behoeven, zoals ernstige bacteriële infecties (meningitis, sepsis, pneumonie, urineweginfectie, septische arthritis, osteomyelitis) en encefalitis (HSV). Bij de samenvatting van de aanbevelingen dient te worden opgemerkt dat de brede differentiaal diagnose bij het kind met koorts raakvlakken vertoont met specifieke ziektebeelden, welke in deze algemene richtlijn voor het kind met koorts niet volledig zijn uitgediept.
Doelgroep
Deze richtlijn is bedoeld voor alle zorgverleners in de tweede lijn, betrokken bij de opvang van het kind van 0 - 16 jaar met koorts, verdacht van een infectie. Daarnaast is de richtlijn bedoeld voor ouders van kinderen met koorts. De richtlijn geldt niet voor de neonatale sepsis en de gehospitaliseerde neonaat. De richtlijn sluit aan bij de NHG-standaard [15]. Koorts is een symptoom van infectie. Het is van belang ernstige infecties vroegtijdig te herkennen, zodat adequaat gehandeld kan worden. Van belang is echter ook dat er geen overdiagnostiek plaatsvindt bij kinderen zonder ernstige infectie.
Vanuit dit perspectief is het doel van deze richtlijn:
Evidence-based onderbouwing van de beoordeling, diagnostisch beleid en eerste handelingen bij het kind met koorts in de tweedelijnszorg, teneinde ernstige infecties vroegtijdig te herkennen en overdiagnostiek te beperken.
Samenstelling werkgroep
Projectteam
Mw. dr. R. Oostenbrink (projectleider), kinderarts Erasmus MC-Sophia, Rotterdam
Dhr. drs. R. G. Nijman (arts), Erasmus MC-Sophia, Rotterdam
Mw. drs. M.K. Tuut (epidemioloog, projectadviseur)
Mw. dr. L.M.A.J. Venmans (epidemioloog)
Werkgroepleden
Dhr. dr. G.J. Driessen, SPII, kinderarts-infectioloog/immunoloog, Erasmus MC-Sophia, Rotterdam
Dhr. dr. R.H. Dijkstra, NHG
Mw. A. Horikx, KNMP (meelezer)
Mw. Dr. W.M. Klein, NVvR, radioloog UMCN St Radboud Nijmegen (meelezer)
Dhr. dr. R. Kornelisse, sectie Neonatologie NVK, neonatoloog, Erasmus MC-Sophia, Rotterdam
Mw. dr. T. Krediet, sectie Neonatologie NVK (meelezer)
Mw. drs. N. Oteman, NHG
Mw. H. Rippen, Stichting Kind en Ziekenhuis
Mw. dr. Y.B. de Rijke, NVKC, klinisch chemicus Erasmus MC-Sophia, Rotterdam
Mw. M. Steijn, V&VN, verpleegkundig specialist neonatologie IJsselland ziekenhuis, Capelle a/d IJssel (meelezer)
Drs. L.P. Tan, NVZA, Ziekenhuisapotheker Groene Hart Ziekenhuis, Gouda(meelezer)
Mw. dr. M. Verboon, sectie Neonatologie NVK, neonatoloog UMC Utrecht
Mw. dr. E. de Vries, SPII, kinderarts-infectioloog/immunoloog, Jeroen Bosch Ziekenhuis, ’s-Hertogenbosch
Mw. drs. A. van Wermeskerken, SAP, kinderarts Flevoziekenhuis, Almere
Mw. dr. M. van Westreenen, NVMM, microbioloog Erasmus MC, Rotterdam
Mw. drs. M.P.W. Zaanen-Bink, NVSHA, SEH-arts KNMG, St.Antonius Ziekenhuis, Nieuwegein
De werkgroep is multidisciplinair samengesteld: beoefenaars uit verschillende disciplines betrokken bij de diagnostiek en behandeling van het kind met koorts en verdacht van infectie in de tweede en derde lijn zijn verzocht te participeren. Als aanvulling hierop werden werkgroepleden gevraagd vanuit de wetenschappelijke vereniging van huisartsgeneeskunde en vanuit de patiëntengroep. Leden van de werkgroep werden namens de betreffende (wetenschappelijke) verenigingen verzocht zitting te nemen in de werkgroep op grond van hun persoonlijke expertise en/of affiniteit met het onderwerp. Het projectteam was verantwoordelijk voor het formuleren van de uitgangsvragen, verrichten van de literatuurzoekstrategie, het uitwerken van de uitgangsvragen en het formuleren van de richtlijntekst. De werkgroepleden beoordeelden en adviseerden in deze stappen.
Belangenverklaringen
De werkgroepleden hebben een belangenverklaring ingevuld waarin ze hun banden met de farmaceutische industrie hebben aangegeven. De verklaringen liggen ter inzage bij de NVK.
Inbreng patiëntenperspectief
Het perspectief van de ouders van patiënten en patiënten is meegenomen door vertegenwoordiging van de directrice van Stichting Kind en Ziekenhuis in de werkgroep.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de ontwikkeling van het concept van de richtlijn is zo veel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen. De definitieve richtlijn is onder de verenigingen verspreid en via de website van de NVK (www.nvk.nl) elektronisch beschikbaar gesteld. Op wetenschappelijke bijeenkomsten van de betrokken wetenschappelijke verenigingen zijn de aanbevelingen van de richtlijn gepresenteerd. Verder kan de lekensamenvatting uit deze richtlijn dienen als patiëntenvoorlichtingsmateriaal.
Om de implementatie en evaluatie van deze richtlijn te stimuleren, zijn interne indicatoren ontwikkeld aan de hand waarvan de implementatie steekproefsgewijs kan worden gemeten. Indicatoren geven in het algemeen de zorgverleners de mogelijkheid te evalueren of zij de gewenste zorg leveren. Zij kunnen daarmee ook onderwerpen voor verbeteringen van de zorgverlening identificeren. De interne indicatoren die bij de onderhavige richtlijn zijn ontwikkeld, worden behandeld in hoofdstuk 5 van deze richtlijn.
Werkwijze
De ontwikkeling van de richtlijn Koorts bij kinderen is gefinancierd door Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Van januari 2012 tot juli 2013 is aan de ontwikkeling van de richtlijn gewerkt door leden van de (kern)werkgroep.
Allereerst werd een knelpuntenanalyse onder de werkgroepleden uitgevoerd om de huidige werkwijze ten aanzien van de diagnostiek en behandeling van kinderen met koorts in Nederland in kaart te brengen. Tevens werd de leden gevraagd een prioritering aan te brengen in de gemelde knelpunten. De knelpunten werden gecategoriseerd in verschillende groepen: diagnostische waarde van symptomen, diagnostische waarde van laboratoriumparameters, indicatie voor aanvullend onderzoek, indicatie voor virale diagnostiek, indicatie voor empirische behandeling, vragen t.a.v. antipyretica en vragen t.a.v. follow-up. De knelpunten werden vertaald in uitgangsvragen. Vervolgens werd volgens de methode van Evidence-Based Richtlijn Ontwikkeling (EBRO) per vraag een uitgebreid literatuuronderzoek verricht. In eerste instantie werd gezocht naar evidence-based richtlijnen. Hierbij werd gebruik gemaakt van de volgende databases: GIN, SUMSEARCH, Clinical evidence van BMJ, SIGN en de TRIP DATABASE, en www.guidelines.gov (National Guidelines Clearinghouse, USA). De gevonden richtlijnen werden op kwaliteit beoordeeld door de kernwerkgroepleden met behulp van het AGREE II-instrument [18]. Wanneer er een valide richtlijn werd gevonden, werd de evidence uit de richtlijn gebruikt om de vragen te beantwoorden. De met AGREE II vastgestelde domeinscores werden gebruikt als houvast voor de beoordeling van de richtlijn. Wanneer er geen geschikte richtlijn werd gevonden, werd gezocht naar systematische literatuuroverzichten in Medline en Embase. Er werd gebruik gemaakt van zoektermen zoals beschreven in. Aanvullend werden originele studies gezocht vanaf het moment dat de zoekactie in de review eindigde. De geselecteerde literatuur werd beoordeeld op kwaliteit en inhoud met behulp van formulieren van het Cochrane Center (https://netherlands.cochrane.org/beoordelingsformulieren-en-andere-downloads). Aan elk geselecteerd artikel werd een mate van bewijskracht toegekend zoals vermeld in Appendix C. Indeling van onderzoeksresultaten naar mate van bewijskracht. De volledige (evidence-based) uitwerking van de uitgangsvragen met de daarbij geformuleerde conclusies werd geheel voorbereid door het projectteam. De gehele werkgroep formuleerde de definitieve aanbevelingen. Naast de evidence werden hierbij ‘overige overwegingen’ uit de praktijk, die expliciet genoemd werden, meegenomen. De werkgroep kwam in totaal vier keer bijeen: één keer om uitgangsvragen te formuleren, twee keer om de resultaten van een systematische literatuursearch en overige overwegingen te bespreken en één keer om de definitieve aanbevelingen te formuleren. Voor enkele uitgangsvragen, namelijk uitgangsvragen 1, 2, en 16 - 19, was het niet mogelijk om door middel van literatuuronderzoek volgens de EBRO-methode op systematische wijze de antwoorden te zoeken. De formulering van aanbevelingen ter beantwoording van deze vragen is tot standgekomen op basis van consensus binnen de werkgroep.
Indeling van onderzoeksresultaten naar mate van bewijskracht
|
. |
Interventie |
Diagnostisch accuratesse onderzoek |
Schade of bijwerkingen, etiologie, prognose* |
|
A1 |
Systematische review van tenminste twee onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau |
||
|
A2 |
Gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang |
Onderzoek ten opzichte van een referentietest (een ‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van de resultaten van test en gouden standaard, betreffende een voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad |
Prospectief cohortonderzoek van voldoende omvang en follow-up, waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten. |
|
B |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiënt-controleonderzoek, cohortonderzoek) |
Onderzoek ten opzichte van een referentietest, maar niet met alle kenmerken die onder A2 zijn genoemd |
Prospectief cohortonderzoek, maar niet met alle kenmerken als genoemd onder A2 of retrospectief cohortonderzoek of patiëntcontroleonderzoek |
|
C |
Niet-vergelijkend onderzoek |
||
|
D |
Mening van deskundigen |
||
* Deze classificatie is alleen van toepassing in situaties waarin om ethische of andere redenen gecontroleerde trials niet mogelijk zijn. Zijn die wel mogelijk dan geldt de classificatie voor interventies.
Niveau van bewijskracht van de conclusie op basis van het aan de conclusie ten grondslag liggende bewijs
|
|
Conclusie gebaseerd op |
|
1 |
Onderzoek van niveau A1 of tenminste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2 |
|
2 |
1 onderzoek van niveau A2 of tenminste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
3 |
1 onderzoek van niveau B of C |
|
4 |
Mening van deskundigen |
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
