Kleincellig longcarcinoom - Thoracale bestraling na chemotherapie bij SCLC
Uitgangsvraag
Is thoracale bestraling na chemotherapie bij patiënten met stadium IV kleincellig longcarcinoom geïndiceerd?
Aanbeveling
Overweeg bij fitte patiënten (WHO-score 0-1) met SCLC stadium IV zonder pleurale of leptomeningeale metastasen met thoracale resttumor na chemotherapie thoracale radiotherapie (10 x 3 Gy).
Licht de (mogelijke) gevolgen van de behandeling qua impact op het dagelijks leven van de patiënt toe. Licht ook de (mogelijke) gevolgen van niet-behandelen hierop toe. Maak, nadat de patiënt voldoende tijd en voor hem of haar begrijpelijke informatie heeft gekregen en deze heeft kunnen bespreken met iemand uit zijn of haar omgeving, samen de beslissing voor al dan niet behandelen.
Overwegingen
Gelet op de CREST-studie (Slotman, 2015) en de meta-analyse (Palma, 2016), en het feit dat thoracale radiotherapie weinig of geen bijwerkingen geeft en bij patiënten met resttumor na chemotherapie ook de overall survival significant verbetert, dient thoracale radiotherapie bij patiënten met stadium IV en een respons chemotherapie overwogen te worden.
Een kosteneffectiviteitsstudie heeft aangetoond dat het toepassen van thoracale radiotherapie bij deze groep patiënten kosteneffectief is (Patrice, 2017). De toepassing van thoraxbestraling leidde tot langere overleving en lagere kosten in de rest van het leven.
Na de publicaties van de IMPOWER-133-studie (Horn, 2018) waarin atezolizumab is toegevoegd aan de behandeling voor patiënten met SCLC stadium IV ontstaat soms discussie over de toepassing thoraxbestraling na afloop van de chemotherapie. Er zijn geen redenen om aan te nemen dat thoraxbestraling in een relatief lage dosis van 30 Gy in 10 fracties niet veilig zou zijn. Om die reden kan thoraxbestraling ook bij patiënten die zijn behandeld met anti-PDL1-medicijnen worden toegepast.
De patiënten bij wie thoracale radiotherapie overwogen dient te worden zijn fitte patiënten met een WHO-performancescore vn 0-1. In de CREST-studie zijn ook patiënten met WHO-performancescore 2 geïncludeerd, echter dit betrof een kleine minderheid van de studiepopulatie (12% in de thoracale radiotherapie groep en 9% in de controlegroep).
Onderbouwing
Achtergrond
In de EORTC-studie naar de rol van PCI (Slotman, 2007) bleek niet alleen dat profylactische hersenbestraling (prophylactic cranial irradiation (PCI)) tot een significant betere overleving leidde, maar ook dat de meerderheid van de patiënten nog resttumorweefsel in de thorax had na chemotherapie, en vaak als eerste event ziekteprogressie in de thorax hadden. Er zijn aanwijzingen dat thoracale bestraling na chemotherapie de recidiefkans kan verkleinen en ook de overleving kan verbeteren.
Conclusies / Summary of Findings
Overall survival
|
Redelijk GRADE |
Bij fitte patiënten met SCLC stadium IV en een respons op chemotherapie maar met resttumor in de thorax, geeft thoracale bestraling een verbetering in overall survival.
Bronnen: (Slotman, 2015) |
Progressievrije overleving
|
Redelijk GRADE |
Bij fitte patiënten met SCLC stadium IV en een respons op chemotherapie, geeft thoracale bestraling een verbetering in progressievrije overleving.
Bronnen: (Slotman, 2015) |
Toxiciteit
|
Redelijk GRADE |
Thoracale bestraling met een dosering van 30Gy in 10 fracties leidt niet tot ernstige toxiciteit bij fitte patiënten.
Bronnen: (Slotman, 2016) |
Samenvatting literatuur
De RCTs van Slotman (2015a) en Jeremic (1999) en de systematische review van Palma (2016) worden hieronder per uitkomstmaat beschreven. In beide studies werd het effect van thoracale bestraling na chemotherapie bij patiënten met SCLC stadium IV onderzocht.
In de studie van Slotman (2015a) (CREST-studie) werden 495 patiënten met een respons na chemotherapie gerandomiseerd tussen alleen PCI en PCI met thoracale bestraling. Er werd, gelet op de slechte prognose van de patiënten met extende disease kleincellig longcarcinoom (ED-SCLC), gekozen voor een relatief lage (zogenaamde “hoog-palliatieve”) dosis bestraling (30 Gy in 10 tot 15 fracties). Patiënten met pleurale en/of leptomeningeale metastasen werden geëxcludeerd. Alle patiënten kregen PCI. De meeste patiënten (90%) hadden een goede performance score (WHO 0-1).
Palma (2016) includeerde in een meta-analyse de studies die keken naar het effect van thoracale bestraling bij patiënten met ED-SCLC die platinumhoudende chemotherapie kregen. Naast de studie van Slotman (2015a) werd hierin ook een oudere studie met andere patiëntenselectie en behandeling meegenomen (Jeremic, 1999). In deze laatste studie werden 109 patiënten met ED-SCLC met een complete remissie buiten de thorax en een complete of partiele remissie in de thorax, gerandomiseerd in een behandeling met alleen chemotherapie of chemotherapie gecombineerd met thoracale bestraling (54 Gy in 36 fracties (1,5 Gy twee dagelijks)). Aangezien deze studie een andere groep patiënten betreft en de thoraxbestraling tijdens de chemotherapie werd gegeven, betreft dit geen consolidatie radiotherapie. In totaal werden in de systematic review van Palma 604 patiënten geanalyseerd, allen ontvingen PCI naast de chemotherapie eventueel aangevuld met radiotherapie.
Resultaten
Overall survival
In de CREST-studie (Slotman, 2015a) werd vanaf 18 maanden een significante overlevingswinst voor thoracale bestraling gezien. Na twee jaar was het verschil in overleving 10% in het voordeel van de groep die thoracale bestraling had gekregen (13% versus 3%). Er was geen statistisch significant verschil in 1-jaars overleving (p=0,06), dat was gebruikt voor sample size calculation. Een aanvullende analyse op een vooraf gedefinieerde subgroep met resttumor in de thorax (n=434; 88%) van de CREST-studie toonde wel een significante verbetering van de overall survival aan (p=0,04) (Slotman, 2015b).
In de analyse van Palma (2016) gaf thoracale bestraling een significante verbetering in de overall survival (OS) bij patiënten met ED-SCLC na een respons op chemotherapie (random-effects model HR 0,81; 95%BI: 0,69-0,95; p=0,01).
Progressievrije overleving
In de CREST-studie werd een significant verschil in progressievrije overleving gezien in de groep die werd behandeld met thoracale radiotherapie (HR 0,73, 95%BI: 0,61-0,87, p=0,001) (Slotman, 2015a). De progressievrije overleving zes maanden na randomisatie tien maanden na chemotherapie was 34% (95%BI: 19-30) voor de groep die consolidatieve thoraxbestraling kreeg en 7% voor de controlegroep (95%BI: 4-11, p=0,001).
Ook in de systematische review van Palma gaf thoracale bestraling een significante verbetering in de progressievrije overleving (random-effects model HR 0,74; 95%BI: 0,64 tot 0,87; p<0,001).
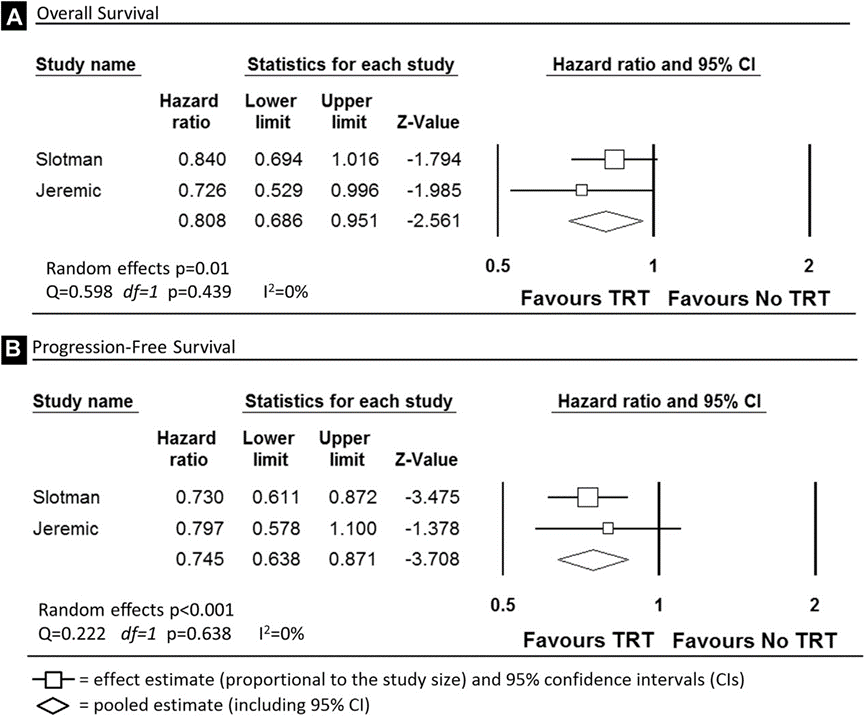
Palma (2016)
Toxiciteit
In de CREST-studie werd geen significant verschil in toxiciteit gezien tussen de groep die thoraxbestraling plus profylactische hersenbestraling kregen en de groep die alleen profylactische hersenbestraling ontving (p=0,28). Graad III en ernstiger hoestklachten, dyspneu of dysfagie trad op bij 3% van de groep die thoraxbestraling kreeg en bij 2% van de patiënten in de controlegroep. Er werd in de systematische review van Palma (2016) geen verschil gevonden in bronchopulmonale toxiciteit van graad III of hoger tussen de groep met thoracale bestraling en chemotherapie en de groep met alleen chemotherapie (2,0% versus 1,7%; p=1,00).
Kwaliteit van leven
Deze uitkomstmaat werd niet beschreven in de geïncludeerde studies.
Bewijskracht van de literatuur
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Er zijn een RCT en een systematische review geïncludeerd en gegradeerd die beide alle drie de uitkomstmaten beschreven. Voor alle drie de uitkomstmaten is de bewijskracht daarom op dezelfde manier verlaagd met 1 niveau (startpunt: hoog) gezien beperkingen in de onderzoeksopzet (risk of bias).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is het effect van thoracale bestraling na chemotherapie in vergelijking tot een afwachtend beleid bij volwassen patiënten met stadium IV kleincellig longcarcinoom?
Relevante uitkomstmaten
De werkgroep achtte overall survival, progressievrije overleving, toxiciteit en kwaliteit van leven voor de besluitvorming cruciale uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases PubMed en Embase (via Embase.com) is op 2 mei 2018 met relevante zoektermen gezocht naar literatuur die bovengenoemde zoekvraag beantwoordt. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 124 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: beantwoording van de zoekvraag, Engelstalige systematische reviews, meta-analyses of RCT’s gepubliceerd na 2009. Op basis van titel en abstract werden in eerste instantie veertien studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens twaalf studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en twee studies definitief geselecteerd.
Een systematische review en een RCT zijn opgenomen in de literatuuranalyse. De tweede RCT werd ook geïncludeerd in de systematische review en is daarom niet apart beschreven. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of biastabellen.
Referenties
- 1 - Gore EM, Hu C, Sun AY, Grimm DF, Ramalingam SS, Dunlap NE, et al. Randomized Phase II Study Comparing Prophylactic Cranial Irradiation Alone to Prophylactic Cranial Irradiation and Consolidative Extracranial Irradiation for Extensive-Disease Small Cell Lung Cancer (ED SCLC): NRG Oncology RTOG 0937 October 2017 Volume 12, Issue 10, Pages 1561-1570.
- 2 - Horn L, Mansfield AS, SZczesna A, et al., (2018). First-line atezolizumab plus chemotherapy in extensive-stage small-cell lung cancer. N Engl J Med 379, 2220-9.
- 3 - Jeremic B, Y. Shibamoto, et al. (1999). "Role of radiation therapy in the combined-modality treatment of patients with extensive disease small-cell lung cancer: A randomized study." J Clin Oncol 17(7): 2092-9
- 4 - Palma DA, Warner A, Loui AV, et al. (2016). Thoracic radiotherapy for extensive stage small-cell lung cancer: a meta-analysis. Clin Lung Cancer 17, 239-44.
- 5 - Patrice IG, Lester-Coll NH, Yu JB, Amdahl JA, Delea TE, Patrice SJ. Cost-Effectiveness of Thoracic Radiation Therapy for Extensive-Stage Small Cell Lung Cancer Using Evidence From the Chest Radiotherapy Extensive-Stage Small Cell Lung Cancer Trial (CREST). January 1, 2018, Volume 100, Issue 1, Pages 97-106.
- 6 - Slotman B, Faivre-Finn C, Kramer G, Rankin E, Snee M, Hatton M, et al. Prophylactic Cranial Irradiation in Extensive Small-Cell Lung Cancer. August 16, 2007 N Engl J Med 2007; 357:664-672.
- 7 - Slotman BJ, van Tinteren H, Praag JO, et al. (2015a) Use of thoracic radiotherapy for extensive stage small-cell lung cancer: a phase 3 randomised controlled trial. Lancet 385, 36-42.
- 8 - Slotman BJ, van Tinteren H, Praag JO, et al. (2015b) Radiotherapy for extensive stage small-cell lung cancer: Authors reply. Lancet 385, 1292-3.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Palma, 2016
|
SR and meta-analysis of 2 RCTs
Literature search up to January 2015
A: Jeremic, 1999 B: Slotman, 2015
Study design: A: Randomized trial B: Randomized trial
Setting and Country: A: NR B: NR
Source of funding: A: NR B: NR
|
Inclusion criteria SR: Randomized trials eval- uating the role of TRT in patients with ES-SCLC receiving treat- ment with platinum-based chemotherapy.
Exclusion criteria SR: Non-English, studies, andomized trials that included radiotherapy to additional sites beyond PCI and TRT (ie, abdominal radiation, half- body irradiation), noneplatinum-based chemotherapy regimens, and/or intrathecal chemotherapy were excluded.
2 studies included
Important patient characteristics at baseline:
N=604, median age: 62 years A: 109 patients, B: 495 patients
Sex: overall: 56% M
Good performance status was present in 90% of patients receiving TRT and 92% without TRT (P 1⁄4 .469), defined as Karnofsky performance status ! 70 or World Health Organization score 0 to 1.
Groups comparable at baseline? Yes |
Thoracic radiotherapy (TRT) and chemotherapy A: 54 Gy/36 (1.5 Gy twice daily) with low-dose daily carboplatin eetoposide B: 30 Gy/10
All patients received prophylactic PCI: A: 25 GY/10 B: 20 Gy/5, 25 Gy/10 or 30 Gy/10-15
|
Chemotherapy alone A: Cisplatineetoposide; PR or CR in thorax, CR at distant sites B: Etoposide-platinum
|
End-point of follow-up: A: NR B: NR
For how many participants were no complete outcome data available? (intervention/control) A: NR B: NR
|
Overall survival Pooled effect: random effects model HR, 0.81; 95% CI 0.69-0.95; P=0.01 favoring TRT. Heterogeneity (I2): 0%.
OS result remaind significant in the sensitivity analysis.
Progression-free survival Pooled effect: random effects model, HR, 0.74; 95% CI 0.64-0.87; P<0.001 favoring TRT. Heterogeneity (I2): 0%.
PFS result remaind significant in the sensitivity analysis.
Toxicity There was no difference in rates of grade 3 or higher bronchopulmonary toxicity between the TRT and non-TRT groups (2.0% vs. 1.7%; P 1⁄4 1.00). Rates of grade 3 or higher esophageal toxicity did differ by treatment arm, and were 6.6% (n 1⁄4 20) in the TRT group and 0 in the non-TRT group (P < .001). Esophageal toxicity varied based on TRT pre- scription, with 27% grade 3 or higher toxicity in the trial delivering 54 Gy with low-dose etoposideeplatinum versus 2% grade 3 or higher toxicity with 30 Gy TRT alone.
|
This systematic review identified 2 randomized studies examining the role of thoracic radiotherapy (TRT) in patients receiving platinum-based chemotherapy for extensive stage small-cell lung cancer. Meta-analysis of these 2 trials of 604 patients indicates that TRT improves overall survival and progression-free survival, with a small incremental risk of esophageal toxicity and no increased risk of bronchopulmonary toxicity. |
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?
Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported?
Yes/no/unclear |
|
Palma, 2016 |
Yes |
Yes |
Yes |
No |
NA |
No |
Yes |
Yes |
No, only for authors of the review study |
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Slotman, 2015 |
Type of study: Phase 3 randomised controlled trial (CREST-trial, NTR1527)
Setting: 42 hospitals: 16 in Netherlands, 22 in the UK, three in Norway, and one in Belgium, patient enrollement between February 2009 and December 2012.
Country: the Netherlands
Source of funding: Dutch Cancer Society (CKTO), Dutch Lung Cancer Research Group, Cancer Research UK, Manchester Academic Health Science Centre Trials Coordination Unit, and the UK National Cancer Research Network. |
Inclusion criteria: Age 18 years or older, WHO performance status 0–2, extensive stage small-cell lung cancer (defined as disease beyond the hemithorax, hilar, mediastinal, and supraclavicular nodes12), any response after four to six cycles of standard chemotherapy (platinum etoposide) assessed in accordance with standard local policy, thoracic treatment volume con- sidered treatable using acceptable radiation fields as judged by a radiation oncologist, 6 weeks or less between chemotherapy and randomisation, no clinical evidence of brain, leptomeningeal, or pleural metastases, no previous radiotherapy to brain or thorax, and ability to comply with protocol and follow-up schedules.
Exclusion criteria: NR
N total at baseline: 495 Intervention: 247 Control: 248
Important prognostic factors2: Age ± SD: I: 63 (58-69) C: 63 (57-69)
Median time to diagnosis (IQR, months): I: 3.7 (3.2-4.4) C: 3.7 (3.2-4.4)
Sex: I: 55 % M C: 55 % M
WHO performance score: I: 39%: 0; 49%: 1; 12%: 2 C: 28%: 0; 63%: 1; 9%: 2
Respons after chemotherapy: Complete respons: I: 5% C: 5%
Partial respons: I: 73% C: 69%
Good respons: I: 22% C: 26%
Groups comparable at baseline? In the thoracic radiotherapy group were more patients under 75 years of age. Also WHO performance scores were not completely comparable. |
Thoracic radiotherapy: 30 Gy in 10 fractions
|
No thoracic radiotherapy
|
Length of follow-up: Patients in both groups were followed up at 6 weeks and 12 weeks, then once every 3 months, then once every 6 months after 1 year. Median follow-up: 24 months.
Loss-to-follow-up: Intervention: 7 (2.5%) because of disease progression (n=5), deterioration of general condition (n=3), patient refusal (n=4), or treatment-related toxic effects (n=1).
Control: NR
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Overall survival at 1 year, at 2 years and the median OS: .
Progression-free survival at 6 months and median PFS: defined as time from randomisation to progression or death (whichever came first).
Toxicity:
Slotman, 2015: Overall survival at 1 year was 33% (95% CI 27–39) in the thoracic radiotherapy group versus 28% (95% CI 22–34) in the control group: the difference between groups was not significant (HR 0·84, 95% CI 0·69–1·01, p=0·066; Median overall survival was 8 months in both groups. At 18 months, survival was 16% versus 9% (p=0·03). At 2 years, survival was 13% (95% CI 9–19) in the thoracic radiotherapy group and 3% (95% CI 2–8) in the control group (p=0·004). The number of patients needed to treat to avoid one death was 10·6 (95% CI 6·1–42·5).
|
All but 9 patients underwent PCI as 20 Gy in 5 fractions/25 Gy in 10 fractions/30 Gy in 10, 12 or 15 fractions. Each centre had to preselect one prophylactic cranial irradiation scheme for all patients.
Chemotherapy: platinum etoposiede combination: n=488 (99%). 7 patients recieved other platinum-based regimens.
Study included in Palma 2016 |
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation |
Bias due to inadequate concealment of allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?
(unlikely/likely/unclear) |
Bias due to loss to follow-up?
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?
(unlikely/likely/unclear) |
|
Slotman, 2015 |
Random assignment centrally by computer 1:1 |
Unlikely |
Unclear, no blinding possible |
Unclear, no blinding possible |
|
|
|
Unlikely |
Exclusietabel
|
Nummer in search |
Auteur, jaartal |
Inclusie/ Exclusie |
Reden van exclusie |
|
Systematic reviews |
|
|
|
|
1 |
Zhang, 2017 |
Excluderen |
SR waarbij de methode niet is beschreven. Onduidelijk of het wel een SR is. Geïncludeerde studies: behalve Slotman (2015) en Gore (2017) zijn studies van voor 2009 of retrospectief. |
|
3 |
Palma, 2016 |
Includeren
|
SR van Jeremic, 1999 en Slotman, 2015. |
|
RCTs |
|
|
|
|
1 |
Slotman, 2017
|
Excluderen |
Secundaire analyse van data uit de CREST-studie (Slotman, 2015). Beantwoordt niet de PICO-vraag |
|
4 |
Corkum, 2017
|
Excluderen |
Geen SR of RCT. Indien relevant beschrijven bij overwegingen. |
|
10 |
Slotman, 2015 |
Includeren |
Geïncludeerd bij Palma, 2016. |
|
11 |
Slotman, 2015 |
Excluderen |
Erratum bovenstaande studie, includeren bij overwegingen. |
|
19 |
Yee, 2012
|
Excluderen |
Geen SR of RCT. Indien relevant beschrijven bij overwegingen. |
|
|
Gore, 2017 |
Excluderen |
Studie komt niet naar boven in de literatuurresultaten. In de studie kregen alle patiënten PCI. De reden dat het er niet in zou kunnen is dat ze naast thoracale bestraling ook bestraling van metastasen kregen, waardoor de resultaten worden vertroebeld qua survival en toxiciteit. Is echter wel als RCT bruikbaar voor verschil in thorax-progressie. |
|
Diverse designs |
|
|
|
|
3 |
Patrice, 2018 |
Excluderen |
Dit is een kosteneffectiviteitsstudie, uitkomstmaat is dus kosteneffectiviteit. Beschrijven bij overwegingen. |
|
7 |
Xu, 2017
|
Excluderen |
Geen SR of RCT, retrospectieve studie. |
|
23 |
An, 2017
|
Excluderen |
Geen SR of RCT, retrospectieve chart studie. |
|
28 |
Qin, 2016 |
Excluderen |
Beantwoordt niet de PICO, gaat over voordeel van thoracale rt bij patiënten met verhoogde lactaatdehydrogenase. |
|
34 |
Slotman, 2015 |
Includeren |
Geen SR of RCT, letter to the editor. Aanvullende resultaten van de CREST-studie (Slotman, 2015). Meenemen in de overwegingen. |
|
37 |
Luan, 2015 |
Excluderen
|
Geen SR of RCT, retrospectieve studie. |
|
65 |
Zhu, 2011 |
Excluderen |
Geen SR of RCT, retrospectieve studie, geen randomisatie. |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 07-10-2019
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
2 |
NVRO |
2019 |
2022 |
3 jaar |
NVALT/NRVO |
|
Bij het opstellen van de module heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodule komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten. De geldigheid is per module weergegeven.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit het project Modulair Onderhoud van de Federatie Medisch Specialisten. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
De richtlijn heeft als doel richting te geven aan de klinisch werkzame arts over hoe om te gaan met het kleincellig longcarcinoom met betrekking tot diagnostiek, therapie en prognose. Het gekozen aantal onderwerpen is niet volledig, maar sluit wel aan op een groot deel van de klinische vragen.
Een richtlijn is een aanbeveling ter ondersteuning van de belangrijkste knelpunten uit de dagelijkse praktijk. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijk onderzoek of consensus.
De richtlijn richt zich op de klinisch werkzame professional die zich bezig houdt met de diagnostiek, behandeling en begeleiding van het kleincellig longcarcinoom. In de praktijk wordt hiermee voornamelijk de longarts (in opleiding), radiotherapeut (in opleiding), de longoncologisch geïnteresseerd (cardiothoracaal)chirurg (in opleiding) bedoeld, maar ook longoncologie verpleegkundigen, medisch oncologen, andere hulpverleners en patiënten kunnen gebruik maken van de richtlijn.
Doelgroep
De patiëntenpopulatie betreft alle patiënten met een kleincellig longcarcinoom. Er bestaat voor dit onderwerp geen georganiseerde patiëntenvereniging. De mening van patiënten over dit onderwerp is niet specifiek gevraagd. Dit heeft onder andere te maken met de slechte prognose van deze patiëntengroep. Getracht is mede uit patiëntenperspectief te denken bij het maken van de richtlijn en aanbevelingen.
Samenstelling werkgroep
Werkgroep:
- Prof. dr. D.K.M. (Dirk) de Ruysscher, radiotherapeut-oncoloog Maastro clinic, UM, NVRO (voorzitter)
- Prof. dr. B.J. (Ben) Slotman, hoogleraar-afdelingshoofd Radiotherapie Amsterdam UMC, NVRO
- Drs. E.J.A. (Ernest) Vonk, radiotherapeut-oncoloog Radiotherapiegroep Deventer, NVRO
- Dr. N.C.M.G. (Noëlle) van der Voort van Zyp, radiotherapeut-oncoloog MC Haaglanden, NVRO
- Dr. I.J.C. (Ieneke) Hartmann, radioloog Maasstad Ziekenhuis, NVvR
- Dr. A. (Annemarie) Becker, longarts Amsterdam UMC, NVALT
- Dr. A.J. (Jeske) Staal-van den Brekel, longarts Ziekenhuisgroep Twente, NVALT
- Drs. L.A. (Lidia) Barberio, senior-beleidsmedewerker Longkanker Nederland
Met ondersteuning van:
- Drs. E.E.M. (Evie) Kolsteren, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- D.P. (Diana) Gutierrez, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Barberio |
Senior beleidsmedewerker Longkanker Nederland |
Geen |
Geen |
N.v.t. |
|
Vonk |
Radiotherapeut, werkzaam bij Radiotherapiegroep Deventer/Arnhem |
Geen |
Geen |
N.v.t. |
|
Voort, van der - van Zyp |
Radiotherapeut Haaglanden Medisch Centrum |
Wetenschapscommissie Dutch Lung Radiotherapy Audit (DLRA), onbetaald |
geen |
N.v.t. |
|
Slotman |
Hoogleraar-afdelingshoofd Radiotherapie Amsterdam UMC (1,0 fte) |
Geen |
Geen |
N.v.t. |
|
Ruysscher, de |
Radiotherapeut-Oncoloog Maastro clinic |
Geen |
Betaald wordt aan Maastro clinic (dus geen persoonlijke inkomsten) voor de advisory board van Bristol-Myers-Squibb, Roche/Genentech, Merck/Pfizer, Astra-Zeneca, Celgene. Onderzoek gefinancierd door Bristol-Myers-Squibb, AstraZeneca, Philips, Olink. |
N.v.t.; Geen raakvlak met deze richtlijn. |
|
Becker |
Longarts Amsterdam UMC |
Geen |
Geen |
N.v..t |
|
Staal-van den Brekel |
Longarts, ZGT Almelo/Hengelo, aandachtsgebied oncologie |
Opleider deelspecialisme longziekten binnen internoide opleiding van ZGT Palliatief team |
Verrichten van trials binnen NVALT verband en voor de firma Astra Zeneca, hier staan vergoedingen tegenover
|
Geen. De firma Astra Zeneca is een farmaceutisch bedrijf die de studie sponsort waarbij chemotherapie en immunotherapie wordt gegeven in combinatie bij SCLC, geen enkele relatie met RTX indicaties. De NVALT heeft meerdere studies, allen bij NSCLC dus dat raakt niet aan de richtlijn. Geen actie. " |
|
Hartmann |
Radioloog, Maasstad Ziekenhuis Rotterdam |
Geen |
Geen |
N.v.t. |
Inbreng patiëntenperspectief
Een beleidsmedewerker van Longkanker Nederland was lid van de werkgroep.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van het ontwikkelproces is rekening gehouden met de implementatie van de richtlijnmodule en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de module in de praktijk kunnen bevorderen of belemmeren. De implementatietabel is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze module is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Uit een inventarisatie door de NVALT en de NVRO bleek dat er een noodzaak was voor de revisie van drie modules van de richtlijn kleincellig longcarcinoom. Tijdens een schriftelijke knelpuntenanalyse waarbij partijen de gelegenheid kregen te reageren op het conceptraamwerk zijn er knelpunten aangedragen door de NVRO en de NVvR.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroepleden en de adviseur uitgangsvragen opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten de voor de patiënt klinisch relevant verschillen.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad Zoekverantwoording voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration:
- AMSTAR – voor systematische reviews.
- Cochrane – voor gerandomiseerd gecontroleerd onderzoek.
- ACROBAT-NRS – voor observationeel onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de module is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag, randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Kennislacunes
Tijdens de ontwikkeling van deze module is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden.
Commentaar- en autorisatiefase
De conceptmodule wordt aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve module wordt aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Hultcrantz M, Rind D, Akl EA, et al. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
