Preventie recidiverende jicht
Uitgangsvraag
Wat is de optimale urinezuurverlagende behandeling bij patiënten met recidiverende en/of tofeuze jicht? Deze uitgangsvraag omvat de volgende deelvragen:
1. Vergelijkingen met allopurinol, benzbromaron, febuxostat, uricase analoga (pegloticase, rasburicase) of placebo;
2. Allopurinol gecombineerd met Benzbromaron versus Allopurinol alleen;
3. Overige farmacologische interventies (ascorbinezuur, losartan, calciumantagonisten);
4. Wat is de plaats van nierfunctie vervangende therapie?
Aanbeveling
Geef bij voorkeur zes maanden profylaxe met colchicine bij het starten van urinezuurverlagende therapie.
Behandeling met allopurinol:
-
bepaal nierfunctie voor start van behandeling;
-
start met 100 mg per dag; start met 50 mg per dag bij een nierfunctiestoornis met eGFR <30 ml/min/1,73m2;
-
verhoog de dosering elke twee tot vijf weken geleidelijk tot het serumurinezuur onder de streefwaarden is;
-
de dosering dient hierbij zo nodig geleidelijk te worden verhoogd tot boven 300mg per dag (max. 900 mg/dag); dit kan ook bij patiënten met een nierfunctiestoornis;
- monitor op bijwerkingen en informeer de patiënt over bijwerkingen en wanneer contact moet worden opgenomen met de arts.
Behandeling met benzbromaron:
-
bepaal nierfunctie voor start van behandeling;
-
schrijf geen benzbromaron voor aan jichtpatiënten met een eGFR <20 ml/min/1,73m2;
-
wees terughoudend met benzbromaron bij jichtpatiënten met een voorgeschiedenis van uraat urolithiasis; neem dan aanvullende maatregelen (alkaliniseren van de urine, ruime vochtinname);
- monitor op bijwerkingen (serumtransaminasen).
Overwegingen
Deelvragen 1, 2, 3: Farmacologische interventies
Evaluatie van de jichtpatiënt ten behoeve van urinezuurverlagende behandeling
Er bestaat consensus over het starten van urinezuurverlagende behandeling bij patiënten met (1) een jichtaanvalsfrequentie tweemaal per jaar of hoger of (2) tofeuze jicht of (3) urolithiasis in de anamnese (Khanna et al., 2012). De voordelen en risico’s van de (levenslange) urinezuurverlagende behandeling moeten worden afgewogen en besproken worden met de patiënt. Het getal van twee of meer aanvallen is mede gebaseerd op een kosteneffectiviteitonderzoek waarbij uitval uit het arbeidproces is meegewogen.
Tabel 6.1 geeft een checklist weer voor controle op bijkomende factoren die van belang (kunnen) zijn voor het behandelplan.
Tabel 6.1 Comorbiditeit checklist voor jichtpatiënten
|
Obesitas, dieetfactoren Overmatig gebruik van alcohol Metabool syndroom, type 2 diabetes mellitus Hypertensie, hyperlipidemie, cardiovasculaire morbiditeit SU–verhogende medicatie1 Urolithiasis in de voorgeschiedenis Nefropathie, creatinineklaring Specifieke oorzaken van overproductie van urinezuur2 Lood intoxicatie
1 de SU-verhoging door diuretica wordt geschat op 0,03-0,05 mmol/l en door acetylsalicylzuur in lage dosering op 0,02-0,03 mmol/l; de klinische relevantie is onduidelijk. Andere SU-verhogende medicatie omvat ciclosporine A, ethambutol en pyrazinamide.
2 bijvoorbeeld erfelijke afwijkingen, myelo-/lymfoproliferatieve aandoeningen, tumor lysis syndroom. |
Behandeldoel en -strategie
Het behandeldoel van jicht is initieel gericht op voldoende verlaging van SU om jichtaanvallen en urinezuurdepots te laten verdwijnen. Het is aannemelijk dat de effectiviteit van de urinezuurverlagende behandeling op de incidentie van recidiverende jichtaanvallen in directe relatie staat tot een voldoende verlaging van het serumurinezuur (Shoji et al., 2004; Pérez-Ruiz, 2009). Het is daarnaast aannemelijk dat de effectiviteit van de urinezuurverlagende behandeling op de vermindering van tophi in directe relatie staat tot de daling van het serumurinezuur (Pérez-Ruiz, 2002b).
De streefwaarde dient beneden het verzadigingsniveau van 0,36 mmol/l te blijven. Initieel kan worden overwogen om een lagere streefwaarde van < 0,30 mmol/l te hanteren om tophi of andere urinezuurdepots sneller te laten verdwijnen (Khanna; Pérez-Ruiz et al., 2011).
Het is van belang dat patiënten goed worden voorgelicht over de behandeling wegens de kans op paradoxale jichtaanvallen tijdens de start van de behandeling en de chronische aard van de behandeling (patient concordance).
De dosering van de urinezuurverlager wordt voorzichtig opgebouwd om bijwerkingen (bijv. huidreacties, paradoxale jichtaanvallen) te verminderen en getitreerd op basis van SU-waarden (elke twee tot vijf weken) onder profylaxe met een anti-inflammatoir middel (Khanna et al., 2012). Na instelling van de onderhoudsdosering wordt periodieke controle van het SU elke 6 maanden aanbevolen om de therapietrouw van de patiënt te evalueren (Harrold et al., 2009).
In een publicatie Peréz-Ruiz et al., (2006) werd geconcludeerd dat patiënten die langdurig een goede controle hebben van SU <0,30 mmol/l een ‘drug holiday’ van enkele jaren kunnen krijgen op geleide van het SU. Op dit moment raadt de werkgroep een dergelijke ‘drug holiday’ niet aan omdat het mogelijk een negatieve invloed heeft op de patiënt compliance.
Bij de urinezuurverlagende behandeling van jicht heeft allopurinol de voorkeur boven febuxostat vanwege ervaring, toepasbaarheid bij nierfunctiestoornis (eGFR <30 ml/min/1,73m2) en kosteneffectiviteit (Stevenson et al., 2011). Er is nog geen advies van de Commissie Farmaceutische Hulp over de vergoeding van febuxostat gepubliceerd. Indien allopurinol niet gebruikt kan worden, kan gekozen worden tussen febuxostat en benzbromaron; keuzecriteria hierbij zijn de aanwezigheid van contra-indicaties en vergoeding door de zorgverzekeraar.
Indien allopurinol in de hoogst getolereerde dosering onvoldoende effectief is, kan worden overwogen om benzbromaron toe te voegen.
Allopurinol
Er wordt een startdosering van 100 mg per dag aanbevolen (Stamp et al., 2012; Khanna) vanwege vermindering van de kans op (1) vroegtijdige jichtaanvallen na de start van urinezuurverlagende behandeling (Becker, 2010) en (2) ernstige overgevoeligheidsreacties (Stamp, 2012). Voor patiënten met een matig-ernstige nierfunctiestoornis (eGFR <30 ml/min/1,73m2) geldt een startdosering van 50 mg per dag. Vervolgens dient de dosering geleidelijk elke twee tot vijf weken te worden verhoogd totdat het serumuraat voldoende is verlaagd tot streefwaarden beneden de 0,30 tot 0,36 mmol/l afhankelijk van de ernst van de ziekte (Khanna, 2012; Jordan; Zhang). Hierbij kunnen doseringen >300 mg/dag nodig zijn, in dat geval wordt de dosering verdeeld over twee giften [Summary of Product Characterics Zyloric®]. De maximale dosering bedraagt 900 mg/dag. Bij patiënten met een verminderde nierfunctie dient eveneens te worden gedoseerd op geleide van het effect (SU), waarbij in principe geen lagere maximum dosering wordt aanbevolen dan bij patiënten met een normale nierfunctie (Stamp et al., 2011).
Overgevoeligheidsreacties op allopurinol komen voor in ca. 2% van de gevallen. Deze kunnen zeer ernstig zijn in de vorm van het allopurinol hypersensitivity syndrome (AHS) met een mortaliteit van 20 tot 25% (Arellano et al., 1993). De incidentie van AHS wordt geschat op 1:1000 en omvat het Stevens-Johnson syndroom, toxische epidermale necrolyse en systemische ziekte met symptomen van eosinofilie, vasculitis, rash en orgaanfalen (DRESS). Het gelijktijdig gebruik van thiazide diuretica en/of aanwezigheid van een verminderde nierfunctie zijn in verband gebracht met AHS (Chao et al., 2009). AHS treedt op in de eerste maanden van allopurinol behandeling. Een recente patiënt-controle studie van AHS en allopurinol startdosering (Stamp, 2012) ondersteunt het advies om te starten met maximaal 100 mg allopurinol per dag en bij ernstige nierfunctiestoornis met eenmaal daags 50 mg. Een veelgebruikte risicomanagementstrategie, waarbij de allopurinol onderhoudsdosering wordt vastgesteld op basis van de creatinineklaring, is beoordeeld als niet evidencebased en wordt niet (meer) aanbevolen (Khanna).
Het optreden van AHS is sterk geassocieerd met aanwezigheid van het HLA–B*5801 allel (matched-control: OR=97, 95%BI=[25-381], p < 0.001; population-control: OR=79, 95%BI=[42-151], p < 0.001). Patiënten van Koreaanse afkomst (HLA–B*5801 allel frequentie 12%) en van Han-Chinese of Thaise afkomst (HLA–B*5801 allel frequentie 6 tot 8%) hebben een verhoogd risico op AHS (Somkrua et al., 2011).
Allopurinol remt het metabolisme van 6-mercaptopurine, azathioprine en didanosine (door remming van xanthine-oxidase) waardoor de toxische effecten hiervan worden versterkt. Bij gelijktijdig gebruik van allopurinol dient de dosering van deze middelen te worden verlaagd tot ¼ of 1/3 van de gebruikelijke dosering. Bij gelijktijdig gebruik van amoxicilline is er meer kans op huiduitslag. Hoge doses allopurinol (vanaf 600 mg) kunnen door remming van het levermetabolisme de plasmaspiegels van theofylline verhogen. De werking van orale anticoagulantia kan worden versterkt door remming van de omzetting in de lever. Allopurinol kan de plasmaspiegel van ciclosporine verhogen (toegenomen toxiciteit).
Febuxostat
Febuxostat is een niet-purine, selectieve xanthine-oxidaseremmer. Het remt zowel de geoxideerde als de gereduceerde vormen van het enzym xanthine–oxidase. Hierdoor wordt de afbraak van hypoxanthine en xanthine tot urinezuur geremd en daalt de urinezuurconcentratie van het bloed geleidelijk, worden tophi kleiner en wordt vorming van uraatstenen voorkomen. De urinezuurconcentratie is na twee tot vier weken verlaagd tot een normale waarde. Het kan echter maanden duren tot de frequentie van acute aanvallen afneemt.
De dosering bedraagt 80 mg eenmaal per dag. Indien de SU-waarde na twee tot vijf weken >0,36 mmol/l is, kan worden overwogen om de dosis te verhogen tot 120 mg eenmaal per dag. Bij starten wordt profylactische behandeling tegen jichtaanvallen, bij voorkeur gedurende zes maanden en met colchicine, aanbevolen.
Bij febuxostat kunnen net als bij allopurinol huiduitslag en leverfunctieafwijkingen optreden. De ernstige overgevoeligheidsreacties en huidreacties treden veelal op tijdens de eerste maand van de behandeling; in sommige gevallen waren de patiënten al overgevoelig voor allopurinol. In een klein observationeel onderzoek met 13 patiënten met een ernstige bijwerking op allopurinol kon bij 12 van de 13 patiënten veilig worden behandeld met febuxostat (Chohan, 2011). Echter, bij één patiënt trad een cutane vasculitis op die waarschijnlijk veroorzaakt werd door febuxostat. Vanwege het gebrek aan voldoende data wordt bij de omzetting van allopurinol naar febuxostat voorzichtigheid, langzame dosistitratie en adequate monitoring aanbevolen bij patiënten met een allopurinol intolerantie.
Febuxostat remt het metabolisme van azathioprine en mercaptopurine (door remming van xanthine-oxidase) waardoor de toxische effecten van deze stoffen worden versterkt; gelijktijdig gebruik wordt niet aanbevolen. Sterke remming van xanthine-oxidase kan door remming van het levermetabolisme de plasmaspiegel van theofylline verhogen; voorzichtigheid en monitoring van de theofyllinewaarden wordt geadviseerd. Sterke UGT–inductoren (bijv. rifampicine) kunnen het metabolisme van febuxostat versnellen. Daarom wordt aanbevolen om bij gelijktijdig gebruik de eerste één tot twee weken de urinezuurspiegel te monitoren.
Er zijn weinig gegevens beschikbaar over het gebruik van febuxostat bij patiënten met verminderde nierfunctie. In een onderzoek werd febuxostat 80 mg eenmaal daags toegediend gedurende zeven dagen aan personen met een normale nierfunctie (n = 11, ClCr >80 ml/min/1,73 m), milde nierfunctiestoornis (n = 6, ClCr 50-80 mL/min/1,73 m2), matige nierfunctiestoornis (n = 7, ClCr 30-49 ml/min/1,73m2) en ernstige nierfunctiestoornis (n = 7, ClCr 10-29 ml/min/1,73m2); (Mayer et al., 2005). Hieruit volgde dat er een relatie bestond tussen de blootstelling aan febuxostat en zijn actieve metabolieten en de creatinineklaring, maar dat er geen verschil werd gezien in de relatieve verlaging van SU. Geconcludeerd werd dat febuxostat 80 mg eenmaal daags in deze groepen patiënten veilig lijkt en dat er geen dosisaanpassing noodzakelijk is.
Bij milde tot matige leverfunctiestoornissen lijkt febuxostat 80 mg veilig gegeven te kunnen worden (Khosravan et al., 2006). Over gebruik van febuxostat bij patiënten met ernstige leverfunctiestoornissen is geen informatie beschikbaar.
Een leverfunctietest wordt aanbevolen voorafgaand aan het begin van de therapie met febuxostat en daarna periodiek aan de hand van het klinisch oordeel. Aangezien geen ervaring is opgedaan bij maligne aandoeningen, het syndroom van Lesch-Nyhan en ontvangers van een orgaantransplantatie wordt het gebruik van febuxostat bij deze patiënten niet aanbevolen. De veiligheid en werkzaamheid bij kinderen <18 jaar is niet vastgesteld.
Benzbromaron
De geregistreerde indicatie van benzbromaron luidt: behandeling van jicht alleen bij patiënten die allergisch zijn voor allopurinol of bij een contra-indicatie voor allopurinol.
De startdosering bedraagt 100 mg per dag; de onderhoudsdosering 50 tot 200 mg per dag, maximaal 300 mg. Tijdens een onderhoudsbehandeling van lange duur kan men de toediening gedurende twee tot drie weken onderbreken.
Benzbromaron verhoogt de uitscheiding van urinezuur via de nieren door remming van de terugresorptie van uraten in de niertubuli. Om de kans op urolithiasis (9 tot 11%) te verkleinen dient benzbromaron niet te worden voorgeschreven aan patiënten met hyperuraturie (>4,2 mmol/24uur) (Pérez-Ruiz et al., 2010). Eventueel kan de urinezuuruitscheiding eerst worden verlaagd met allopurinol, waarna benzbromaron wordt toegevoegd. Andere voorzorgsmaatregelen om urolithiasis te voorkomen zijn voldoende vochtinname en eventueel alkaliseren van de urine met bijvoorbeeld kaliumcitraat of natriumbicarbonaat.
Benzbromaron is minder effectief bij nierfunctiestoornissen, hierdoor kan een hogere dosering nodig zijn. Gebruik van benzbromaron is minder effectief bij een eGFR van kleiner dan 20 á 30 ml/min/1,73m2 omdat het minder op de plaats van werking in de niertubuli aankomt.
Benzbromaron kent enkele interacties - het remt onder andere cytochroom P450 2C9 in sterke mate - waardoor de werking van coumarines wordt versterkt. Gelijktijdig gebruik van hepatotoxische geneesmiddelen dient te worden vermeden. De uricosurische werking wordt ten dele geremd door salicylaten en thiazidediuretica. Gelijktijdige toediening van pyrazinamide vermindert het uricosurisch effect van benzbromaron en vergroot het risico op hepatotoxiciteit.
In verband met het eventueel optreden van (ernstige) leverbeschadiging dient voor begin van de behandeling en gedurende ten minste de eerste zes maanden de leverfunctie gecontroleerd te worden. De behandeling dient te worden gestaakt bij verhoogde (>ULN) leverenzymactiviteit. Bij braken, misselijkheid, abdominale pijn, asthenie en geelzucht dienen patiënten contact op te nemen met de arts. Voor het begin van de behandeling dient een urinezuur bepaling in 24-uurs urine te worden uitgevoerd waarbij de totale hoeveelheid urinezuur ≤ 4,2 mmol/24 uur moet zijn. Bij overschrijden van deze waarde bestaat er een verhoogde kans op uraat urolithiasis; aanvullende maatregelen dienen dan te worden overwogen (bijv. natriumbicarbonaat 4dd 1000 mg).
Uricase analoga
De werkzame stof pegloticase is een covalent conjugaat van het enzym uricase - geproduceerd door een genetisch gemodificeerde stam van Escherichia coli - en monomethoxypoly (ethyleenglycol). Pegloticase is geïndiceerd voor de behandeling van ernstige, invaliderende, chronische, tofeuze jicht bij volwassen patiënten die tevens erosieve gewrichtsproblemen hebben en bij wie het niet gelukt is om het SU met xanthine-oxidaseremmers in de maximale medisch aangewezen dosis te normaliseren of voor wie deze geneesmiddelen gecontra-indiceerd zijn (Epar Krystexxa®, EMA 2013). De beslissing om de patiënt met pegloticase te behandelen dient op een voortdurende beoordeling van de baten en risico’s voor de individuele patiënt te zijn gebaseerd.
Rasburicase is niet geregistreerd voor de behandeling van jicht. Er is nauwelijks ervaring met herhaalde toediening vaker dan vijf keer in vijf dagen. Er zijn enkele case reports / case series gepubliceerd waarin behandeling met rasburicase effectief is gebleken bij ernstige tofeuze jicht die niet op andere manieren kan worden behandeld (Richette et al., 2007). Op basis van bewijskracht gaat bij uricase-behandeling de voorkeur uit naar pegloticase.
Losartan en calciumanagonisten, vitamine C (ascorbinezuur)
Beperkte evidence suggereert dat losartan en calciumantagonisten de serumurinezuur concentratie en jichtaanvalfrequentie kunnen verlagen. Om die reden kan losartan of een calciumantagonist worden overwogen als middel van eerste keuze voor behandeling van hypertensie bij jichtpatiënten als de streefwaarde van serumurinezuur (<0,36 mmol/l) niet wordt bereikt met orale urinezuurverlagende therapie. Hierbij dient aandacht te zijn voor eventuele risico’s verbonden met het wisselen van antihypertensivum. Het eventueel staken van een diureticum bij hartfalers met moeilijk behandelbare jicht moet altijd in overleg met het hartfalenteam plaatsvinden. Strikte controle is dan onontbeerlijk. Betrouwbare gegevens over een eventuele verlaging van de jichtaanvalfrequentie door vitamine C ontbreken; vitamine C lijkt geen klinisch relevant effect te hebben op de urinezuurconcentratie. Om die reden kan vitamine C niet worden aanbevolen ter preventie van jichtaanvallen.
Samenvatting farmacologische behandelstrategie
|
I. Diagnose |
|
II. Algemene aanbevelingen - evaluatie ernst van de ziekte - secundaire oorzaken hyperurikemie - patiëntvoorlichting, leefstijl/dieet |
|
III. Indicatie voor urinezuurverlagende behandeling - jichtaanvalsfrequentie vanaf 2x per jaar - tofeuze jicht - uraat urolithiasis in de voorgeschiedenis |
|
IV. Behandeling op SU-waarde - in ieder geval SU <0,36 mmol/l - ernstige jicht SU <0,30 mmol/l (bijv. tofeuze jicht, immobiliserende jicht) - keuze geneesmiddel: 1. allopurinol 2a. benzbromaron (evt. in combinatie met allopurinol bij onvoldoende effectiviteit in de maximaal getolereerde dosering van allopurinol) 2b. febuxostat (indien contra-indicatie benzbromaron) 2c. probenecide 3. pegloticase Geef bij start van de behandeling anti-inflammatoire profylaxe gedurende minimaal 6 maanden. |
|
V. Treat to target <-> increase dosage |
|
VI. Langetermijn management |
Deelvraag 4: Nierfunctie vervangende therapie
Er zijn aanwijzingen dat bij patiënten met ESRD die behandeld worden met dialyse (hemodialyse of peritoneaal dialyse) de frequentie van de jichtaanvallen afneemt. Echter de bewijskracht van deze studies is zeer laag. Er zijn geen studies bekend waarin patiënten met jicht maar zonder nierfalen zijn behandeld met dialyse. Er zijn derhalve onvoldoende aanwijzingen dat het starten van dialyse (hemodialyse of peritoneaal dialyse) een effectieve en veilige behandeling is voor jicht. Dialyse kan niet als reguliere behandeloptie worden aanbevolen; het is een theoretische optie die in uitzonderlijke gevallen (bij patiënten met zeer ernstige [tofeuze] jicht die niet reageren op farmacologische interventies) kan worden toegepast, rekening houdend met het risico op complicaties.
Onderbouwing
Achtergrond
Bij jicht is er sprake van een positieve massabalans van urinezuur in het lichaam. Dit kan worden veroorzaakt door een verhoogde inname/productie (overproducers), een verminderde uitscheiding (underexcretors) of - meestal - een combinatie van beide (Choi et al., 2005; Pérez-Ruiz et al., 2002a). Het doel van de urinezuurverlagende behandeling is: voorkomen van jichtaanvallen, verminderen of doen verdwijnen van tophi, beperken van verdere gewrichtsschade en het tegengaan van nefrologische en urologische complicaties (uraatnefropathie, urolithiasis). Aangenomen wordt dat een voldoende negatieve massabalans van urinezuur bereikt moet worden om voldoende effectief te zijn op het behalen van de ultieme behandeldoelen. Dit betekent dat het serumurinezuur (SU) voldoende verlaagd dient te worden tot beneden streefwaarden van 0,30 tot 0,36 mmol/l afhankelijk van de ernst van de ziekte (Perez-Ruiz, 2009; Zhang et al., 2006; Khanna et al., 2012).
Xanthine-oxidaseremmers (allopurinol, febuxostat) en uricosurica (benzbromaron, probenecide) zijn beschikbaar voor orale urinezuurverlagende behandeling. Daarnaast bestaat de mogelijkheid om urinezuur enzymatisch om te zetten naar allantoïne met uricase analoga (pegloticase, rasburicase). Febuxostat 80 mg en 120 mg zijn in Nederland geregistreerd maar niet opgenomen in het Geneesmiddel Vergoedingssysteem (GVS) tijdens het opstellen van deze richtlijn. Benzbromaron is geregistreerd voor behandeling van jicht alleen bij patiënten die intolerant/allergisch zijn voor allopurinol of bij een contra-indicatie voor allopurinol. Probenecide is niet in Nederland in de handel maar kan eventueel vanuit het buitenland worden geïmporteerd en voorgeschreven worden op artsenverklaring. Voor pegloticase is op het moment van opstellen van dit hoofdstuk een positief advies afgegeven door de European Medicines Agency voor de indicatie: treatment of severe debilitating chronic tophaceous gout in adult patients who may also have erosive joint involvement and who have failed to normalize serum uric acid with xanthine oxidase inhibitors at the maximum medically appropriate dose or for whom these medicines are contraindicated. Rasburicase is beschikbaar in de vorm van intraveneuze toediening; het is echter alleen geregistreerd voor de indicatie tumor lysis syndrome.
Bij patiënten met nierinsufficiëntie is het urinezuur vaak verhoogd. Er zijn aanwijzingen in de literatuur dat door hemodialyse de urinezuurspiegels kunnen normaliseren, tofi afnemen in grootte en dat de frequentie van jichtaanvallen kan afnemen.
De werkgroep benoemde de volgende uitkomstmaten als kritisch: jichtaanvalfrequentie en ernstige bijwerkingen. Daarnaast werden milde bijwerkingen, aantal en grootte van tofi, en de SU-concentratie (surrogaatparameter) als belangrijke uitkomstmaten benoemd. Hierbij wordt aangetekend dat SU weliswaar een surrogaat uitkomstmaat is, maar toch belangrijk wordt geacht wegens (1) het beperkte aantal onderzoeken met resultaten op harde eindpunten; (2) internationale aanbevelingen om te doseren op geleide van het SU. De OMERACT 9 Special Interest Group heeft vergelijkbare uitkomstmaten opgesteld voor de evaluatie van chronische jicht (Schumacher et al., 2009a).
Conclusies
Vergelijkingen met allopurinol, benzbromaron, febuxostat, uricase analoga (pegloticase, rasburicase) of placebo
|
HOOG |
Allopurinol 200-300 mg/dag en febuxostat 80-120 mg/dag hebben een vergelijkbare effectiviteit in het voorkomen van jichtaanvallen op de lange termijn.
Bronnen (Tayar et al., 2012) |
|
HOOG tot MATIG |
Behandelingen met allopurinol 200-300 mg/dag en febuxostat 80-120 mg/dag gaan gepaard met een vergelijkbare frequentie van ernstige bijwerkingen.
Bronnen (Tayar et al., 2012) |
|
MATIG |
Febuxostat in hoge dosering (120 mg/dag) gaat gepaard met meer jichtaanvallen in de eerste 8 weken na starten van de behandeling in vergelijking met allopurinol 200-300 mg/dag of placebo.
Bronnen (Tayar et al., 2012) |
|
ZEER LAAG |
Allopurinol 300-600 mg/dag en benzbromaron 100-200 mg/dag lijken even effectief om tofi te laten verdwijnen als streefwaarden urinezuur worden bereikt.
Bronnen (Pérez-Ruiz et al., 2002b) |
|
MATIG |
Benzbromaron (100 tot 200 mg 1x daags) en allopurinol (300 mg 1 tot 2x daags) lijken even effectief om serumurinezuur streefwaarden te behalen.
Bronnen (Reinders et al., 2009) |
|
MATIG |
Pegloticase (8 mg elke twee of vier weken) in vergelijking met placebo behandeling verlaagt serumurinezuur bij jichtpatiënten die niet reageren op of intolerant zijn voor orale urinezuurverlagende therapie.
Bronnen (Sundy et al., 2011) |
|
MATIG |
Pegloticase (8 mg elke twee of vier weken) in vergelijking met placebo behandeling leidt tot verdwijning van tofi bij jichtpatiënten die niet reageren op of intolerant zijn voor standaard urinezuurverlagende therapie.
Bronnen (Sundy et al., 2011; Becker et al., 2012) |
|
LAAG |
Pegloticase (8 mg elke twee of vier weken) in vergelijking met placebo behandeling verlaagt de incidentie van jichtaanvallen bij jichtpatiënten die niet reageren op of intolerant zijn voor standaard urinezuurverlagende therapie.
Bronnen (Sundy et al., 2011) |
Allopurinol gecombineerd met Benzbromaron versus Allopurinol alleen
|
ZEER LAAG |
Er lijkt een lineair verband te bestaan tussen verlaging van serumurinezuur concentratie en de snelheid van afname van tophi, ongeacht behandeling met allopurinol, benzbromaron of een combinatie van beide.
Bronnen (Pérez-Ruiz et al., 2002b) |
Overige farmacologische interventies
|
LAAG |
Vitamine C suppletie leidt tot een statistisch significante maar klinisch niet relevante daling van het serumurinezuur bij personen met hyperurikemie.
Onbekend is of vitamine C suppletie de jicht aanvalsfrequentie verlaagt.
Bronnen (Juraschek et al., 2011) |
|
LAAG |
Losartan en calciumantagonisten lijken de serumurinezuur concentratie en jichtaanvalsfrequentie te verlagen bij jichtpatiënten; dit lijkt te gelden voor jichtpatiënten met en zonder hypertensie.
Bronnen (Würzner et al., 2011; Choi et al., 2012) |
Wat is de plaats van nierfunctievervangende therapie?
|
ZEER LAAG |
Bij patiënten met jicht bij wie dialyse wordt gestart in verband met eindstadium nierfalen neemt de jichtaanvalfrequentie sterk af na start van de periodieke dialyse (hemodialyse of peritoneale dialyse).
De oorzaak voor de afname in jichtaanvalfrequentie is onbekend.
Bronnen (Ohno, 2005; Ifudu, 1994) |
Samenvatting literatuur
Vergelijkingen met allopurinol, benzbromaron, febuxostat, uricase analoga (pegloticase, rasburicase) of placebo
Xanthineoxidase remmers: allopurinol en febuxostat
Er zijn geen onderzoeksgegevens beschikbaar over de effectiviteit van allopurinol versus placebo op het verminderen van jichtaanvallen of tofi (Underwood, 2011). Wel zijn er onderzoeksgegevens bekend van febuxostat in vergelijking met allopurinol, systematisch geanalyseerd in een recente Cochrane review (Tayar). De resultaten van febuxostat in de dosering van 240 mg worden hier buiten beschouwing gelaten omdat de geregistreerde dosering maximaal 120 mg per dag bedraagt. Underwood (2011) vindt één RCT (Becker et al., 2005a) van febuxostat versus allopurinol met een uitkomstmaat op harde eindpunten.
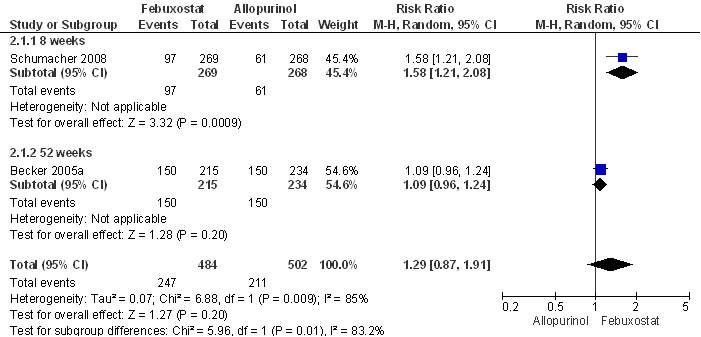
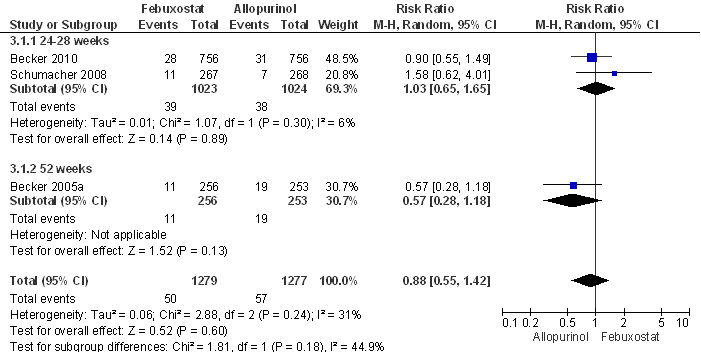
De aanvullende zoekactie leverde geen nieuwe RCT’s met jichtaanvalfrequentie als primaire uitkomstmaat op. Tayar et al. dekken de periode tot juli 2011 en includeren vier RCT’s en twee open-label trials (OLT’s) met in totaal 3978 patiënten (Becker et al., 2005a, 2005b, 2009 en 2010; Schumacher et al., 2008 en 2009b); alle studies zijn gesponsord door de producent van febuxostat. Tayar concludeert dat er geen statistisch significant verschil in jichtaanvalfrequentie is aangetoond tussen allopurinol 200-300 mg/dag en febuxostat 80-120 mg per dag na 24 tot 52 weken behandeling; het betrouwbaarheidsinterval van de overall schatting van het relatief risico bevat de waarde 1 (verticale lijn in de forest plots; Fig. 1 en 2). Een hoge (start)dosering febuxostat (120 mg) ging gepaard met meer jichtaanvallen in de eerste acht weken in vergelijking met placebo (relatief risico, RR= 1,7; 95% betrouwbaarheidsinterval 95% BI= [1,3-2,3]; event rate 407 per 1000 versus 238 per 1000); bij lagere dosering (40-80 mg) werd geen statistisch significant verschil tussen febuxostat en placebo waargenomen. Dit kan worden verklaard door (een sterkere) mobilisatie van urinezuur in het lichaam in combinatie met een kennelijk onvoldoende profylaxe in de eerste maanden van de behandeling. In het betreffende onderzoek werd ter profylaxe naproxen of colchicine gedurende week één tot acht gegeven (Becker, 2005a, 2005b). Na drie jaar follow-up werden geen statistisch significante verschillen gevonden in effectiviteit op jichtaanvalfrequentie tussen allopurinol en febuxostat (Tayar). Eveneens werden geen statistisch significante verschillen in bijwerkingen tussen allopurinol 200-300 mg en febuxostat 80 mg (Fig. 3) respectievelijk 120 mg gevonden: de adverse event rate per 100 patiëntjaren bedroeg respectievelijk 246, 227 en 216. Patiënten met febuxostat 80 en 120 mg staakten de behandeling vaker dan patiënten met allopurinol 200-300 mg: febuxostat 80 mg RR=1,5 (95% BI=[1,2-1,8]) en febuxostat 120 mg RR=2,6 [2,0-3,3] (Tayar).
Figuur 6.1 Meta-analyse van de effecten van febuxostat 80 mg/dag versus allopurinol 200 of 300 mg/dag op de incidentie van jichtaanvallen (fixed effects model; Tayar et al., 2012). Het betrouwbaarheidsinterval van de overall schatting van het relatief risico bevat de waarde 1.
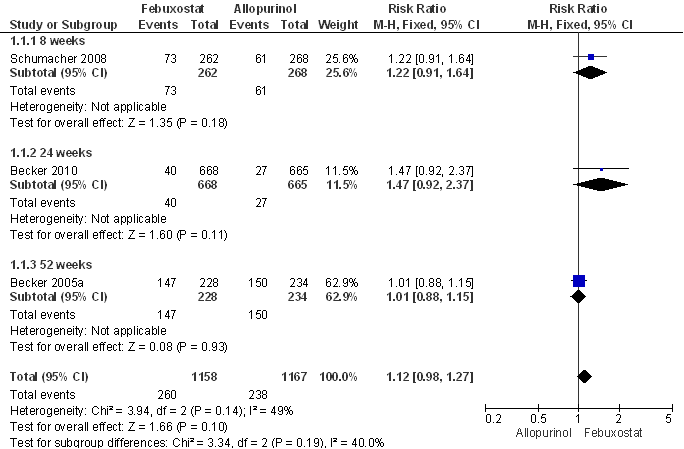
Figuur 6.2 Meta-analyse van de effecten van febuxostat 120 mg/dag versus allopurinol 200 of 300 mg/dag op de incidentie van jichtaanvallen (fixed effects model; Tayar et al., 2012). Het betrouwbaarheidsinterval van de overall schatting van het relatief risico bevat de waarde 1.
Figuur 6.3 Meta-analyse van de effecten van febuxostat 80 mg/dag versus allopurinol 200 of 300 mg/dag op de incidentie van ernstige bijwerkingen (fixed effects model; Tayar et al., 2012). Het betrouwbaarheidsinterval van de overall schatting van het relatief risico bevat de waarde 1. Een ernstige bijwerking werd gedefinieerd als “levensbedreigend, of resulterend in overlijden, hospitalisatie, verlenging van hospitalisatie, of een blijvende of significante handicap (Becker et al, 2005a).
Patiënten behandeld met febuxostat 80 mg en 120 mg behaalden vaker de SU streefwaarde dan met allopurinol 300 mg (febuxostat 80 mg RR=1,8 [1,6-2,2] en febuxostat 120 mg RR=2,2 [1,9-2,5]). Echter, belangrijke beperkingen van de beschikbare, geïncludeerde onderzoeken zijn het niet verhogen van de dosering op geleide van SU of farmacokinetische gegevens, en de maximale dosering allopurinol van 300 mg/dag (Moreland, 2005).
Becker (2009) onderzocht het effect van febuxostat 80 mg, 120 mg en allopurinol op reductie van tofi. De gemiddelde reductie van primaire tofus grootte bedroeg 48 tot 68%; het aantal tofi nam af met 50 tot 60% en bij 30 tot 45% van de patiënten was sprake van een complete resolutie van tofi. Schumacher (2009b) vond na vijf jaar verdwijning van tofi bij 69% van de patiënten.
Benzbromaron
Er zijn geen onderzoeksgegevens beschikbaar over de effectiviteit van benzbromaron in het voorkomen van jichtaanvallen (Underwood, 2011). Er zijn gegevens met een beperkte bewijskracht beschikbaar dat benzbromaron tofi kan laten verdwijnen (Pérez-Ruiz et al., 2002b) en dat de effectiviteit van behalen van serumurinezuur streefwaarden vergelijkbaar is met allopurinol (Reinders et al., 2009).
Uricase analoga (pegloticase en rasburicase)
Pegloticase
Het Cochrane review (Anderson) dekt de periode tot juli 2009 en includeert één RCT (Sundy et al., 2008). Aan het Cochrane review zijn twee recente RCT's toegevoegd (Sundy et al., 2011) en een bijbehorende open-label extensie-studie (Becker et al., 2012). Deze studies zijn allemaal gesponsord door de fabrikant.
De vroege studie van Sundy (2008) is een kleine niet-geblindeerde (open-label) RCT (n=41) waarin vier verschillende doses pegloticase worden vergeleken bij jichtpatiënten met hyperurikemie (SU >0,47 mmol/l) die niet reageren op of intolerant zijn voor standaard urinezuurverlagende therapie: 4 mg pegloticase elke twee weken (n=7); 8 mg elke twee weken (n=8); 8 mg elke vier weken (n=13) en 12 mg elke vier weken (n=13). De primaire uitkomstmaat is het bereiken van een serumurinezuur concentratie <0,36 mmol/l na 12-14 weken behandeling. Een responder is gedefinieerd als een patiënt met SU <0,36 mmol/l gedurende tenminste 80% van de studieperiode. Het percentage responders in de vier doseringsgroepen bedroeg respectievelijk, 56%, 88%, 52% en 62%. Er werden geen statistisch significante verschillen tussen de doseringsgroepen waargenomen.
De recentere studie van Sundy (2011) omvat twee grotere en geblindeerde RCT's (n=109 en n=116; totaal 225) met ieder drie behandelgroepen: 12 tweewekelijkse i.v. infusies met telkens 8 mg pegloticase; met alternerend 8 mg pegloticase en placebo, of met uitsluitend placebo. Het betreft opnieuw jichtpatiënten met hyperurikemie (SU>0,47 mmol/l) die niet reageren op of intolerant zijn voor standaard urinezuurverlagende therapie. De primaire uitkomstmaat was SUZ<0,36 mmol/l na maand drie en maand zes. Een responder is opnieuw gedefinieerd als een patiënt met SUZ<0,36 mmol/l gedurende tenminste 80% van de studieperiode. Na pooling van de data uit de twee trials werd het primaire eindpunt behaald in 36 van de 85 patiënten behandeld met pegloticase elke twee weken (42%; 95%BI=[32%-54%]); 29 van 84 patiënten behandeld met pegloticase elke vier weken (35%; 95%BI=[24%-46%]) en 0 van 43 patiënten behandeld met placebo (0%; 95%BI=[0%-8%]; p<0,001 voor elke vergelijking). De incidentie van jichtaanvallen over maand één tot drie was verhoogd in de pegloticase behandelgroepen ten opzichte van de placebogroep: jichtaanval bij 75% van de patiënten (95%BI=[65-84]; p=0,02 ten opzichte van placebo); 81% (95%BI=[71-89]; p=0,002 ten opzichte van placebo) en 53% (95%BI=[38-69]). In de maanden vier tot zes was sprake van een afname in de incidentie van jichtaanvallen in de pegloticase behandelgroepen: jichtaanval bij 41% van de patiënten (95%BI=[29-53]; p=0,007 ten opzichte van placebo); 57% (95%BI=[44-68]; statistisch niet significant verschil ten opzichte van placebo) en 67% (95%BI=[51-81]). Aan het einde van de studieperiode was sprake van resolutie van tenminste één tofus bij respectievelijk 40% van de patiënten (95%BI=[27-55]; p=0,002 ten opzichte van placebo); 21% (95%BI=[11-35]; statistisch niet significant verschil t.o.v. placebo) en 7% (95%BI=[1-24]). Ernstige bijwerkingen waren meer frequent in de pegloticase behandelgroepen dan in de placebogroep: bij 24% van de patiënten (95%BI=[15-34]); 23% (95%BI=[14-33]) en 12% (95%BI=[4-25]).
In een open-label vervolgstudie op de studie van Sundy uit 2011 (Becker, 2012) worden langetermijndata over het gebruik van pegloticase gerapporteerd (n=149). Patiënten (n=149) werden gevolgd gedurende maximaal drie jaar, de gemiddelde follow-up bedroeg 25 maanden (SD=11); alle patiënten werden behandeld met pegloticase en het gemiddeld aantal pegloticase behandelingen bedroeg 28 (SD=18). Complete verdwijning van tophi werd gezien bij 87% (32/37) van de patiënten in de responder groep (gedefinieerd als in Sundy, 2011) en in 31% (11/36) van de non-responder groep. Ernstige bijwerkingen traden op bij 34% (51/149) van de patiënten, van wie 13 patiënten (25%) de behandeling staakten.
Rasburicase
Er zijn geen systematische reviews of RCT’s gevonden naar de effectiviteit van rasburicase bij de behandeling vanrecidiverende of tofeuze jicht.
Bewijskracht van de literatuur
Bij beoordeling van de studies volgens GRADE is de bewijskracht van de conclusies hoog voor het effect van febuxostat in vergelijking met allopurinol op de jichtaanvalfrequentie op lange termijn. De bewijskracht van de conclusies voor het effect van febuxostat in vergelijking met allopurinol op de frequentie van ernstige bijwerkingen is matig tot hoog, afhankelijk van de febuxostat dosering. Bij een lage dosering (80 mg/dag) is een punt afgetrokken vanwege beperkingen in onderzoeksopzet (zie tabel quality assessment). De bewijskracht is matig voor het effect van febuxostat 120 mg/dag in vergelijking met allopurinol en placebo op de jichtaanvalfrequentie op de korte termijn (acht weken); er is een punt afgetrokken vanwege beperkingen in onderzoeksopzet. De bewijskracht van de conclusies voor de effecten van allopurinol en benzbromaron op het doen verdwijnen van tofi is gebaseerd op een enkele cohortstudie met beperkingen in onderzoeksopzet en is derhalve zeer laag. Tenslotte is de bewijskracht van de conclusies voor de effecten van allopurinol en benzbromaron op het bereiken van serumurinezuur streefwaarden matig; er is een punt afgetrokken vanwege beperkingen in de onderzoeksopzet. Bij beoordeling van de studies volgens GRADE is de bewijskracht van de conclusies matig voor het effect van pegloticase in vergelijking met placebo op het bereiken van serumurinezuur streefwaarden; er is één punt afgetrokken vanwege tekortkomingen in onderzoeksopzet. De bewijskracht van de conclusies voor de effecten van pegloticase in vergelijking met placebo op de incidentie van jichtaanvallen is laag; er zijn twee punten afgetrokken vanwege inconsistentie en tekortkomingen in onderzoeksopzet. Tot slot is de bewijskracht voor de effecten van pegloticase in vergelijking met placebo op het doen verdwijnen van tophi matig; er is een punt afgetrokken vanwege tekortkomingen in onderzoeksopzet.
Allopurinol gecombineerd met Benzbromaron versus Allopurinol alleen
Er zijn geen RCT’s gevonden die vergelijkend onderzoek hebben gedaan naar het effect van de combinatie van allopurinol en benzbromaron versus allopurinol monotherapie om jichtaanvallen te voorkomen.
Akkasilpa et al., (2004) hebben een RCT uitgevoerd naar de effectiviteit van combinatietherapie op verlaging van het serumurinezuur, echter de gebruikte doseringen in de interventiegroep waren laag (allopurinol 100 mg plus benzbromaron 20 mg, versus allopurinol 300 mg in de controlegroep); de uitkomst van dit onderzoek was dat in deze vergelijking monotherapie met allopurinol 300 mg effectiever was. De gebruikte dosering benzbromaron is echter niet conform de in Nederland geregistreerde dosering, derhalve zijn de gevonden resultaten niet klinisch relevant.
In een ander onderzoek naar afname van tophi werd combinatietherapie van allopurinol met benzbromaron voorgeschreven indien de streefwaarde serumurinezuur niet werd gehaald met monotherapie (Perez-Ruiz, 2002b). In deze cohortstudie werd een lineair verband gevonden tussen snelheid van afname van tophi en verlaging van SU ongeacht de behandeling met allopurinol, benzbromaron of de combinatie van beide. Geconcludeerd werd dat indien het serumurinezuur onvoldoende wordt verlaagd met monotherapie de combinatietherapie allopurinol + benzbromaron zinvol is.
Bewijskracht van de literatuur
De bewijskracht voor de effecten van een gecombineerde behandeling met allopurinol en benzbromaron op het doen verdwijnen van tophi is gebaseerd op een enkele cohortstudie met beperkingen in onderzoeksopzet en is derhalve zeer laag. Er zijn onvoldoende gegevens beschikbaar over de effecten op de overige kritische en belangrijke uitkomstmaten.
Overige farmacologische interventies
Losartan en calciumantagonisten
Uit een kleine RCT met cross-over design waarin dertien jichtpatiënten met hypertensie en hyperurikemie alternerend werden behandeld met losartan en irbesartan komt naar voren dat losartan in vergelijking met irbesartan een aanvullend SU-verlagend effect heeft van ca. 0,05 mmol/l (Würzner et al., 2011). In een geneste patiënt-controle studie met 24.768 patiënten en 50.000 controlepersonen werd het gebruik van losartan en calciumantagonisten geassocieerd met een lagere incidentie van jichtaanvallen (Choi et al., 2012). Daarentegen werden diuretica, bètablokkers, ACE-remmers en non-losartan angiotensine II antagonisten geassocieerd met een verhoogde incidentie van jichtaanvallen.
Vitamine C (ascorbinezuur)
Er zijn geen RCT’s bekend die onderzoek hebben gedaan naar de effectiviteit van vitamine C op jichtaanvallen. Een recente meta-analyse laat zien dat met vitamine C suppletie een significante maar beperkte verlaging van SU te bereiken is van gemiddeld 0,02 mmol/l (95% BI=[0,01-0,04]; Juraschek et al., 2011) bij patiënten met hyperurikemie. Op basis van deze waarden kan niet worden verwacht dat er een klinisch relevant effect op jichtaanvallen wordt bereikt met vitamine C.
Bewijskracht van de literatuur
De bewijskracht voor de effecten van vitamine C suppletie op de serumurinezuur concentratie (belangrijke [surrogaat] uitkomstmaat) is laag; er zijn punten afgetrokken voor beperkingen in onderzoeksopzet en grote en onverklaarde heterogeniteit tussen individuele studies. De bewijskracht voor de effecten van losartan en calciumantagonisten op de serumurinezuur concentratie zijn gebaseerd op observationele studies en is laag. Er zijn onvoldoende gegevens beschikbaar over de effecten op de kritische uitkomstmaten.
Wat is de plaats van nierfunctievervangende therapie?
De literatuurzoekactie leverde twee relevante studies op. Het betreffen retrospectieve cohortstudies van patiënten met eindstadium-nierfalen (ESRD) die periodieke dialyse ondergaan (Ohno et al., 2005; Ifudu et al., 1994).
In de Japanse retrospectieve cohortstudie van Ohno wordt bij 493 ESRD patiënten de incidentie van jicht en de jichtaanvalfrequentie vergeleken voor en na het starten van de behandeling met periodieke dialyse. Het merendeel van de patiënten (84%) wordt behandeld met hemodialyse, de overige patiënten met peritoneale dialyse (zie evidence tabel). De gemiddelde leeftijd bedroeg 60 jaar. Ten tijde van de data analyse was de gemiddelde behandelduur met dialyse 81 maanden bij de mannen (86% van de studiepopulatie) en 93 maanden bij de vrouwen (14% van de studiepopulatie) en de gemiddelde serumurinezuur concentratie respectievelijk 0,47 mmol/l en 0,45 mmol/l. Een jichtaanval werd gedefinieerd op grond van de ARA-criteria (Wallace, 1977), gebruikmakend van gegevens afkomstig uit jichtpatiënten, interviews en medische registraties. De incidentie van jicht (percentage patiënten met tenminste één jichtaanval in de studieperiode) bij mannen bedroeg 15,4% in de tijdsperiode tot twee jaar voorafgaand aan dialyse en daalde naar 7,7% in de laatste twee jaar voorafgaand aan dialyse. Na start van de periodieke dialyse nam de incidentie van jicht af naar 3,4% in de eerste twee jaar en naar 1,2% in de daaropvolgende periode. Een vergelijkbaar beeld ontstaat bij analyse van de vrouwelijke patiënten, waarbij de incidentie van jicht afneemt van 4,1% naar 0,6% in de laatste twee jaar voorafgaand aan dialyse, terwijl na het starten van de dialyse geen jichtaanvallen meer worden geconstateerd. Wanneer de analyse wordt beperkt tot patiënten met jicht (n=79; 16% van de studiepopulatie) bedraagt de jichtaanvalfrequentie per tijdsperiode (zie boven), 2.0 ± 4.2 en 1.9 ± 6.6 voorafgaand aan dialyse en daalt naar 0.2 ± 0.7 en uiteindelijk 0.1 ± 0.6 na starten van de periodieke dialyse (acute aanvallen per jaar; standaard deviatie, SD; statistisch significante daling, p<0,05). Bij de interpretatie van deze resultaten dient rekening gehouden te worden met de slecht gedefinieerde studiepopulatie (diagnose jicht zonder kristalbewijs), het feit dat niet gecorrigeerd wordt voor potentiële confounders zoals behandeling met allopurinol en dat er geen controle is voor natuurlijk beloop.
Ifudu is een Noord-Amerikaanse retrospectieve cohortstudie met 201 ESRD patiënten die behandeld worden met hemodialyse (82%) of peritoneale dialyse (18%). Een vijventwintigtal patiënten wordt al langdurig gedialyseerd (gemiddelde behandelduur: 16,3 jaar) en deze groep wordt afzonderlijk geanalyseerd. Bij de overige 176 patiënten (88% van de studiepopulatie) is de gemiddelde behandelduur 27 maanden, de gemiddelde leeftijd 52 jaar en het gemiddelde serumurinezuurgehalte, afhankelijk van de behandeling met hemodialyse of peritoneale dialyse, respectievelijk 7,6 mg/dL en 6,4 mg/dL (zie evidence tabel). Bij het merendeel van de patiënten (56%) behandeld met hemodialyse was sprake van hyperurikemie (de criteria voor hyperurikemie worden niet gespecificeerd). De auteurs rapporteren dat geen nieuwe gevallen van jichtartritis zijn geconstateerd na start van de dialyse. Dit zou gelden voor de totale studiepopulatie, inclusief de patiëntengroep met meer dan twaalf jaar dialysebehandeling, en ondanks persistente hyperurikemie en hypertensie. Echter, kwantitatieve data bijvoorbeeld over de jichtaanvalfrequentie voorafgaand aan dialysebehandeling en een statistische onderbouwing ontbreken. Bij dertien patiënten (6,5% van de studiepopulatie) werd de diagnose jicht gesteld voorafgaand aan dialyse, overwegend op grond van kristalbewijs. Het betreft mannelijke patiënten met een gemiddelde behandelduur met dialyse van 25 maanden. Al deze patiënten herinnerden zich een jichtaanvalfrequentie van tenminste twee aanvallen per jaar voorafgaand aan de start van dialyse. Na aanvang van periodieke dialyse werd bij negen patiënten (70%) geen acute jichtaanval meer geconstateerd, terwijl bij de overige vier patiënten (30%) de jichtaanvalfrequentie afnam met 50%. Geen van de patiënten werd behandeld met allopurinol. Bij de interpretatie van deze resultaten moet rekening worden gehouden met een slecht gedefinieerde studiepopulatie, een gering aantal patiënten met jicht en het ontbreken van statistische analyses en een controle voor natuurlijk beloop.
Bewijskracht van de literatuur
Bij beoordeling van de studies volgens GRADE is de bewijskracht zeer laag voor de effecten van dialyse op jichtaanvalfrequentie (kritische uitkomstmaat), de bewijskracht berust op cohortstudies en er kunnen punten worden afgetrokken vanwege indirectheid (studiepopulatie met voornamelijk patiënten zonder jicht; geen controle voor natuurlijk beloop ESRD), gebrekkige studiekwaliteit (zie tabel quality assessment) en imprecisie (klein aantal patiënten met jicht). De geïncludeerde studies bevatten geen data over de effecten van dialyse op ernstige bijwerkingen (kritische uitkomstmaat), aantal en grootte van tophi of de serumurinezuur concentratie (belangrijke uitkomstmaten).
Zoeken en selecteren
Voor de deelvragen 1 tot en met 4 is in de databases Medline (OVID) en Embase (Elsevier) met relevante zoektermen gezocht vanaf 2000 naar systematische reviews en RCT’s waarin de effectiviteit van urinezuurverlagende middelen bij de behandeling van jicht wordt vergeleken met als uitkomstmaten: jichtaanvalsfrequentie, bijwerkingen, afname tophi, en verlaging urinezuur. De zoekstrategieën zijn weergegeven onder zoekverantwoording. De literatuurzoekactie leverde 324 treffers op voor deelvragen 1 tot en met 3 en 122 treffers voor deelvraag 4. De onderzoeken zijn geselecteerd op basis van de volgende selectiecriteria: origineel vergelijkend onderzoek bij volwassenen; urinezuurverlagende therapie versus geen urinezuurverlagende therapie; jichtaanvalfrequentie, bijwerkingen, tophi (aantal, grootte), en SU concentratie als uitkomstmaten. Bij de deelvragen 1 tot en met 3 zijn een recente systematische review van zeer goede kwaliteit (Underwood, 2011; zie tabel quality assessment of systematic reviews) en de Cochrane reviews over febuxostat (Tayar et al., 2012) en pegloticase (Anderson et al., 2010) als uitgangspunt genomen, in voorkomende gevallen aangevuld met relevante recentere literatuur. Voor de overwegingen zijn de aanbevelingen van de ACR (Khanna), de EULAR (Zhang) en van de richtlijn van de BSR (Jordan et al., 2007) meegewogen, evenals de Summary of Product Characteristics (SPC) van de beschikbare farmaca.
Referenties
- Akkasilpa, S., Osiri, M., Deesomchok, U., & Avihingsanon, Y. (2004). The efficacy of combined low dose of allopurinol and benzbromarone compared to standard dose of allopurinol in hyperuricemia. J Med Assoc Thai, 87, 1087-91.
- Anderson, A., & Singh, J.A. (2010). Pegloticase for chronic gout. Cochrane Database Syst Rev., (3), CD008335.
- Arellano, F., & Sacristan, J. (1993). Allopurinol hypersensitivity syndrome: a review. Ann Pharmacother., 27, 337-43.
- Becker, M.A., Baraf, H.S., Yood, R.A., Dillon, A., Vázquez-Mellado, J., Ottery, F.D., Sundy, J.S. (2012). Long-term safety of pegloticase in chronic gout refractory to conventional treatment. Ann Rheum Dis., [Epub ahead of print]., doi:10.1136/annrheumdis-2012-201795.
- Becker, M.A., Schumacher, H.R. Jr, Wortmann, R.L., MacDonald, P.A., Eustace, D., Palo, W.A., Joseph-Ridge, N. (2005a). Febuxostat compared with allopurinol in patients with hyperuricemia and gout. New England Journal of Medicine, 353, 245061.
- Becker, M.A., Schumacher, H,R., Espinoza, L.R., Wells, A.F., Mac-Donald, P., Lloyd, E., & Lademacher, C. (2010). The urate-lowering efficacy and safety of febuxostat in the treatment of the hyperuricemia of gout: the CONFIRMS trial. Arthritis Res Ther, 12, R63.
- Becker, M.A., Schumacher, H.R., MacDonald, P.A., Lloyd, E., & Lademacher, C. (2009). Clinical efficacy and safety of successful longterm urate lowering with febuxostat or allopurinol in subjects with gout. J Rheumatol, 36, 1273-1282.
- Becker, M.A., Schumacher, H.R. Jr, Wortmann, R.L., MacDonald, P.A., Palo, W.A., Eustace D, Joseph-Ridge, N. (2005b). Febuxostat, a Novel Nonpurine Selective Inhibitor ofXanthine Oxidase:a twenty-eight-day, multicenter, phase II, randomized, double-blind, placebo-controlled, doseresponse clinical trial examining safety and efficacy in patients with gout. Arthritis and Rheumatism, 52, 916-23.
- Chao, J., & Terkeltaub, R. (2009). A critical reappraisal of allopurinol dosing, safety, and efficacy for hyperuricemia in gout. Curr Rheumatol Rep, 11, 135-40.
- Chohan, S. (2011). Safety and efficacy of febuxostat treatment in subjects with gout and severe allopurinol adverse reactions. J Rheumatol., 38, 1957-9.
- Choi, H.K., Mount, D.B., & Reginato, A.M. (2005). Pathogenesis of gout. Ann Intern Med., 143, 499-516.
- Choi, H.K., Soriano, L.C., Zhang, Y., & Rodríguez, L.A. (2012). Antihypertensive drugs and risk of incident gout among patients with hypertension: population based case-control study. BMJ, 344, d8190.
- Harrold, L.R., Andrade, S.E., Briesacher, B.A., Raebel, M.A., Fouayzi, H., Yood, R.A., & Ockene, I.S. (2009). Adherence with urate-lowering therapies for the treatment of gout. Arthritis Res Ther, 11, R46.
- Ifudu, O., Tan, C.C., Dulin, A.L., Delano, B.G., & Friedman, E.A. (1994). Gouty arthritis in end-stage renal disease: clinical course and rarity of new cases. Am J Kidney Dis., 23, 347-51.
- Jordan, K.M., Cameron, J.S., Snaith, M., Zhang, W., Doherty, M., Seckl, J., British Society for Rheumatology and British Health Professionals in Rheumatology Standards, Guidelines and Audit Working Group (SGAWG) (2007). British Society for Rheumatology and British Health Professionals in Rheumatology guideline for the management of gout. Rheumatology (Oxford), 46, 13724.
- Juraschek, S.P.,Miller. E.R. 3rd, & Gelber, A.C. (2011). Effect of oral vitamin C supplementation on serum uric acid: a meta-analysis of randomized controlled trials. Arthritis Care Res (Hoboken), 63, 1295-306.
- Khanna, D., Fitzgerald, J.D., Khanna, P.P., Bae, S., Singh, M.K., Neogi, T., ... American College of Rheumatology (2012). American College of Rheumatology guidelines for management of gout. Part 1: systematic nonpharmacologic and pharmacologic therapeutic approaches to hyperuricemia. Arthritis Care Res (Hoboken), 64, 1431-46.
- Khosravan, R., Grabowski, B.A., Mayer, M.D., Wu, J.T, Joseph-Ridge, N., & Vernillet, L. (2006). The effect of mild and moderate hepatic impairment on pharmacokinetics, pharmacodynamics, and safety of febuxostat, a novel nonpurine selective inhibitor of xanthine oxidase. J Clin Pharmacol., 46, 88-102.
- Mayer, M.D., Khosravan, R., Vernillet, L., Wu, J.T., Joseph-Ridge, N., & Mulford, D.J. (2005). Pharmacokinetics and pharmacodynamics of febuxostat, a new non-purine selective inhibitor of xanthine oxidase in subjects with renal impairment. Am J Ther., 12, 22-34.
- Moreland, L.W. (2005). Febuxostat--treatment for hyperuricemia and gout? N Engl J Med., 353, 2505-7.
- Ohno, I., Ichida, K., Okabe, H., Hikita, M., Uetake, D., Kimura, H., Hosoya, T. (2005). Frequency of gouty arthritis in patients with end-stage renal disease in Japan. Intern Med., 44, 706-9.
- Pérez-Ruiz, F. (2009). Treating to target: a strategy to cure gout. Rheumatology (Oxford), 48, Suppl 2, ii9-ii14.
- Perez-Ruiz, F., Atxotegi. J., Hernando, I., Calabozo, M., & Nolla, J.M. (2006). Using serum urate levels to determine the period free of gouty symptoms after withdrawal of long-term urate-lowering therapy: a prospective study. Arthritis Rheum., 55, 786-90.
- Pérez-Ruiz, F., Calabozo, M., Erauskin, G.G., Ruibal, A., & Herrero-Beites, A.M. (2002a). Renal underexcretion of uric acid is present in patients with apparent high urinary uric acid output. Arthritis Rheum., 47, 610-613.
- Pérez-Ruiz, F., Calabozo, M., Pijoan, J.I., Herrero-Beites, A.M., & Ruibal, A. (2002b). Effect of urate-lowering therapy on the velocity of size reduction of tophi in chronic gout. Arthritis Rheum, 47, 356-360.
- Pérez-Ruiz, F., Hernandez-Baldizon, S., Herrero-Beites, A.M., & Gonzalez-Gay, M.A. (2010). Risk factors associated with renal lithiasis during uricosuric treatment of hyperuricemia in patients with gout. Arthritis Care Res (Hoboken), 62, 1299-305.
- Pérez-Ruiz, F., Herrero-Beites, A.M., & Carmona, L. (2011). A two-stage approach to the treatment of hyperuricemia in gout: the dirty dish hypothesis. Arthritis Rheum., 63, 4002-4006.
- Reinders, M.K., Haagsma, C., Jansen, T.L., Roon, E.N. van, Delsing, J., Laar, M. A. van de, & Brouwers, J.R. (2009). A randomised controlled trial on the efficacy and tolerability with dose escalation of allopurinol 300-600 mg/day versus benzbromarone 100-200 mg/day in patients with gout. Ann Rheum Dis., 68, 892-7.
- Richette, P., Brière, C., Hoenen-Clavert, V., Loeuille, D., & Bardin, T. (2007). Rasburicase for tophaceous gout not treatable with allopurinol: an exploratory study. J Rheumatol., 34, 2093-8.
- Schumacher, H.R. Jr, Becker, M.A., Wortmann, R.L., Macdonald, P.A., Hunt, B., Streit, J., Joseph-Ridge, N. (2008). Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout: a 28-week, phase III, randomized, double-blind, parallel-group trial. Arthritis and Rheumatism, 59, 1540-8.
- Schumacher, H.R., Becker, M.A., Lloyd, E., MacDonald, P.A., & Lademacher, C. (2009b). Febuxostat in the treatment of gout: 5-yr findings of the FOCUS efficacy and safety study. Rheumatology, 48, 18894.
- Schumacher, H.R., Taylor, W., Edwards, L., Grainger, R., Schlesinger, N., Dalbeth, N., Perez-Ruiz, F. (2009a). Outcome domains for studies of acute and chronic gout. Journal of Rheumatology, 36, 2342-5.
- Shoji, A., Yamanaka, H., & Kamatani, N. (2004). A retrospective study of the relationship between serum urate level and recurrent attacks of gouty arthritis: evidence for reduction of recurrent gouty arthritis with antihyperuricemic therapy. Arthritis Rheum, 51, 321-325.
- Somkrua, R., Eickman, E.E., Saokaew, S., Lohitnavy, M., & Chaiyakunapruk, N. (2011). Association of HLA-B*5801 allele and allopurinol-induced Stevens Johnson syndrome and toxic epidermal necrolysis: a systematic review and meta-analysis. BMC Med Genet., 12, 118.
- Stamp, L.K., ODonnell, J.L., Zhang, M., James, J., Frampton, C., Barclay, M.L., & Chapman, P.T. (2011). Using allopurinol above the dose based on creatinine clearance is effective and safe in patients with chronic gout, including those with renal impairment. Arthritis Rheum., 63, 41221.
- Stamp, L.K., Taylor, W.J., Jones, P.B., Dockerty, J.L., Drake, J., Frampton, C., & Dalbeth, N. (2012). Starting dose is a risk factor for allopurinol hypersensitivity syndrome: a proposed safe starting dose of allopurinol. Arthritis Rheum., 64, 252936
- Stevenson, M., & Pandor, A. (2011). Febuxostat for the management of hyperuricaemia in patients with gout: a NICE single technology appraisal. Pharmacoeconomics, 29, 133-40.
- Sundy, J.S., Baraf, H.S., Yood, R.A., Edwards, N.L., Gutierrez-Urena, S.R., Treadwell, E.L., Becker, M. A. (2011). Efficacy and tolerability of pegloticase for the treatment of chronic gout in patients refractory to conventional treatment: two randomized controlled trials. JAMA, 306, 711-20.
- Sundy, J.S., Becker, M.A., Baraf, H.S., Barkhuizen, A., Moreland, L.W., Huang, W., Waltrip, R.W. 2nd, Maroli, A.N., & Horowitz, Z.; Pegloticase Phase 2 Study Investigators. (2008). Reduction of plasma urate levels following treatment with multiple doses of pegloticase (polyethylene glycol-conjugated uricase) in patients with treatment-failure gout: results of a phase II randomized study. Arthritis Rheum, 58, 2882-91.
- Tayar, J.H., Lopez-Olivo, M.A., & Suarez-Almazor, M.E. (2012). Febuxostat for treating chronic gout. Cochrane Database Syst Rev., 11, CD008653.Underwood, M. (2011). Gout. Clin Evid (Online), 05, 1120.
- Wallace, S.L., Robinson, H., Masi, A.T., Decker, J.L., McCarty, D.J., Yü, T.F. (1977). Preliminary criteria for the classification of the acute arthritis of primary gout. Arthritis Rheum, 20, 895-900.
- Würzner, G., Gerster, J. C., Chiolero, A., Maillard, M., Fallab-Stubi, C.L., Brunner, H.R., & Burnier, M. (2001). Comparative effects of losartan and irbesartan on serum uric acid in hypertensive patients with hyperuricaemia and gout. J Hypertens, 19, 1855-60.
- Zhang, W., Doherty, M., Bardin, T., Pascual, E., Barskova, V., Conaghan, P., ... EULAR Standing Committee for International Clinical Studies Including Therapeutics (2006). EULAR evidence based recommendations for gout. Part II: management. Report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis., 65, 131224.
Evidence tabellen
Quality assessment voor systematic reviews
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Research question: what are effective and safe treatments for recurring gout attacks?
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/ no/ unclear |
Comprehensive and systematic literature search?2
Yes/ no/ unclear |
Description of included and excluded studies?3
Yes/ no/ unclear |
Description of relevant characteristics of included studies?4
Yes/ no/ unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/ no/ unclear/ notapplicable |
Assessment of scientific quality of included studies?6
Yes/ no/ unclear |
Enough similarities between studies to make combining them reasonable?7 Yes/ no/ unclear |
Potential risk of publication bias taken into account?8
Yes/ no/ unclear |
Potential conflicts of interest reported?9
Yes/ no/ unclear |
|
Underwood 2011 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Unclear |
Unclear |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Methodology checklist – intervention studies
Research question: what are effective and safe treatments for recurring gout attacks?
|
Study reference
(first author, year of publication) |
There was adequate concealment of allocation
(yes/ no/ unclear) |
Participants receiving care were kept ‘blind’ to treatment allocation
(yes/ no/ unclear) |
Care providers were kept ‘blind’ to treatment allocation
(yes/ no/ unclear) |
Outcome assessors were kept ‘blind’ to participants’ exposure to the intervention
(yes/ no/ unclear) |
Use of unvalidated or intermediate outcomes
(yes/ no/ unclear) |
Selective outcome reporting on basis of the results
(yes/ no/ unclear) |
Loss to follow-up/incomplete outcome data described and acceptable
(yes/ no/ unclear) |
Analysis by intention to treat
(yes/ no/ unclear) |
Other limitations
(yes/ no/ unclear) |
|
Reinders 2009a (ARD 68:51) |
Yes |
No |
No |
Unclear |
No*1 |
No |
Yes*2 |
No*2 |
Yes*3 |
|
Reinders 2009b (ARD 68:892) |
Yes |
No |
No |
Unclear |
No*1 |
No |
Yes*3 |
No*4 |
Yes*5 |
|
Becker 2005a (NEJM 353:2450) |
Yes |
Unclear |
Unclear |
Unclear |
No*1 |
Unclear |
No |
No |
Yes*6 |
|
Becker 2005b (Arthr Rheum 52:916) |
Unclear
|
Unclear
|
Unclear
|
Unclear
|
No*1 |
Unclear |
No |
No |
Yes*6 |
|
Becker 2009 |
Yes |
No |
No |
No |
No*1 |
Unclear |
No |
No |
Unclear |
|
Becker 2010 |
Yes |
Yes |
Unclear |
Unclear |
No*1 |
Unclear |
Yes |
Yes |
No |
|
Schumacher 2008 |
Unclear |
Unclear |
Unclear |
Unclear |
No*1 |
Unclear |
Yes |
Yes |
No |
|
Schumacher 2009b |
Unclear |
Unclear |
No |
No |
No*1 |
Unclear |
Unclear |
No |
No |
|
Sundy 2011 |
Yes |
Unclear |
Unclear |
Unclear |
No*1 |
No |
Yes |
No |
Yes*8 |
|
Akkasilpa 2004 |
Unclear |
No |
No |
No |
No*1 |
No |
No |
No |
Yes*9 |
Footnotes:
*1 serum urate used as surrogate outcome measure
*2 2-stage trial with 14/96 excluded post-randomization at stage 1, and 3/27 and 4/35 at stage 2 (poor adherence [based on serum oxipurinol], lost to follow-up, protocol violation)
*3 relatively short follow-up (2+2 months); open label trial
*4 2-stage trial with 10/65 excluded post-randomization at stage 1, and 4/21 and 1/8 at stage 2 (poor adherence [based on serum oxipurinol], lost to follow-up, protocol violation, adverse events)
*5 relatively short follow-up (2+2 months); open label trial; low number of patients in one of the treatment groups (benzbromaron, stage-2)
*6 data collection and statistical analysis by manufacturer
*7 short follow-up (28 days); role sponsor in data collection and statistical analysis unclear
*8 definition of primary outcome was changed; data collection and statistical analysis by manufacturer
*9 short follow-up (4 weeks); age difference between groups (5years) despite randomization
Methodology checklist – intervention studies (observational)
Research question: what are effective and safe treatments for recurring gout attacks?
|
Study reference
(first author, year of publication) |
Was there a representative and well-defined sample of patients at a similar point in the course of the disease?
(yes/ no/ unclear) |
Was follow-up sufficiently long and complete, and similar for all treatments?
(yes/ no/ unclear) |
Was the outcome of interest defined and adequately measured?
(yes/ no/ unclear) |
Were the treatments of interest adequately defined?
(yes/ no/ unclear) |
Was loss to follow-up / incomplete outcome data described and acceptable?
(yes/ no/ unclear) |
Was there statistical adjustment for all important prognostic factors?
(yes/ no/ unclear) |
Other limitations?
(yes/ no/ unclear) |
|
Pharmaceutical interventions |
|||||||
|
Perez-Ruiz 2002b |
No*4 |
Yes |
Yes |
Yes |
Yes |
No |
Yes*5 |
|
Becker 2012 |
Yes |
Yes |
Yes |
Yes |
No |
No |
No |
|
Potential role of kidney function replacement therapy |
|||||||
|
Ohno 2005 |
No*1 |
Yes |
No |
Yes |
Unclear |
No |
Yes*2 |
|
Ifudu 1994 |
Yes |
Yes |
No |
Yes |
Unclear |
No |
Yes*3 |
*1 ESRD patients with or without gout or HU (only 16% gout patients, n=79; subgroup ill-defined)
*2 Patient group and methods poorly described
*3 very small subgroup with gout (n=13), data ill-described, lack of statistics
*4 very heterogeneous group of patients
*5 ULT prescribed based on clinical grounds: treatment groups are not comparable e.g. patients with ‘massive tophaceous deposits’ were all assigned to one of the treatment groups
Research question: what are effective and safe treatments for recurring gout attacks?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Level of evidence |
Comments |
|
1 Comparisons of Allopurinol, Benzbromaron, Febuxostat, Uricase analogs, and Placebo |
||||||||
|
Febuxostat, Allopurinol, Placebo |
||||||||
|
Tayar et al, 2012
Cochrane |
Systematic review |
|
|
|
|
Four randomised trials and two OLTs with 3978 patients were included. Risk of bias differed by outcome, ranging from low to high risk of bias. Included studies failed to report on five to six of the nine outcome measures recommended by OMERACT. Patients taking febuxostat 120 mg and 240 mg reported more frequent gout flares than in the placebo group at 4 to 28 weeks (RR 1.7; 95% CI 1.3 to 2.3, and RR 2.6; 95% CI 1.8 to 3.7 respectively). No statistically significant differences were observed at 40 mg and 80 mg. Compared to placebo, patients on febuxostat 40 mg were 40.1 times more likely to achieve serum uric acid levels < 6.0 mg/dL at 4 weeks (95% CI 2.5 to 639), with an absolute treatment benefit of 56% (95% CI 37% to 71%). For febuxostat 80 mg and 120 mg, patients were 68.9 and 80.7 times more likely to achieve serum uric acid levels < 6.0 mg/dL at their final visit compared to placebo (95% CI 13.8 to 343.9, 95% CI 16.0 to 405.5), respectively; with an absolute treatment benefit of 75% and 87% (95% CI 68 to 80% and 81 to 91%), respectively. Total discontinuation rates were significantly higher in the febuxostat 80 mg group compared to placebo (RR 1.4; 95% CI 1.0 to 2.0, absolute risk increase 11%; 95% CI 3 to 19%). No other differences were observed. When comparing allopurinol to febuxostat at 24 to 52 weeks, the number of gout flares was not significantly different between the two groups, except for febuxostat 240 mg (RR 2.3; 95% CI 1.7 to 3.0). Patients on febuxostat 40 mg showed no statistically significant differences in benefits or harms. Patients on febuxostat 80 mg and 120 mg were 1.8 and 2.2 times more likely to achieve serum uric acid levels < 6.0 mg/dL at their final visit (95% CI 1.6 to 2.2, 95% CI 1.9 to 2.5) with an absolute treatment benefit of 29% and 44% (95% CI 25% to 33%, 95% CI 38% to 50%), respectively, at 24 to 52 weeks. Total discontinuation rates were higher for febuxostat 80 mg and 120 mg compared to allopurinol (RR 1.5; 95% CI 1.2 to 1.8, absolute risk increase 11%; 95% CI 6% to 16%; and RR 2.6; 95% CI 2.0 to 3.3, absolute risk increase 20%; 95% CI 3% to 14%, respectively). Discontinuations due to adverse events were similar across groups. Total adverse events were lower for febuxostat 80 mg and 120 mg compared with allopurinol (RR 0.93; 95% CI 0.87 to 0.99, absolute risk increase 6%; 95% CI 0.7% to 11%; and RR 0.90; 95% CI 0.84 to 0.96, absolute risk increase 8%; 95% CI 3% to 13%, respectively). No other relevant differences were noted.After 3 years of follow-up there were no statistically significant differences regarding effectiveness and harms between febuxostat 80 mg or 120 mg and allopurinol groups (adverse event rate per 100 patient-years 227, 216, and 246, respectively). |
|
Although the incidence of gout flares requiring treatment may be increased in patients taking febuxostat compared to placebo or allopurinol during early treatment, no such increase in gout flares was observed in the long-term follow-up study when compared to allopurinol. Febuxostat at any dose was shown to be beneficial in achieving serum uric acid levels < 6.0 mg/dL and reducing serum uric acid levels in the period from baseline to final visit when compared to placebo and to allopurinol. However, the grade of evidence ranged from low to high, which indicates that further research is needed.
|
|
Becker et al, 2010
CONFIRMS trial
|
RCT (phase-3) Double-blind Non-inferiority Superiority N=2268 (mITT)
(3609 recruited; 1340 excluded; 2269 random.; mITT=2268); 52.8 y (94% male); White (82%), Black or Afric. Am. (10%)
Setting/country: Patients enrolled at 324 sites; USA
Source of funding: completely funded by TAP Pharmaceutical Products, now part of Takeda (manufacturer of febuxostat)
|
Inclusion criteria: aged 18-85 years with diagnosis of gout (ACR); sUA ≥ 8.0 mg/dL; >35% of subjects with mild or moderate renal impairment (creatinine clearance 60-89 ml/min, or 30-59 ml/minutes, respect.); subjects successfully completing previously reported long-term febuxostat studies [Schumacher ea, 2009; Becker ea, 2009] were also eligible (N=276)
Exclusion criteria: sec. hyperuricem; xanthinuria; severe renal impairment (eCLcr <30 ml/min); alanine and aspartate aminotransferase >1.5 times upper limit of normal; > 14 alc drinks/w or history alcoholism or drug abuse; medical condition interfering with treatment, safety, or adherence to protocol
Groups comparable at baseline? Yes
Diagnosis gout: ACR criteria; affected joints, not specified; gout duration 11.6 y
Renal function: mod. impared (18%); mildly impared (48%); mod+mild impared (65%); normal (35%)
Obesity (64%); hyperlipideamia (42%); hypertension (53%); CVD incl hypertension (57%); diabetes (14%); alcohol use (68%)
sUA, mean (SD) 9.6 mg/dl (1.18)
|
Febuxostat
A: 40 mg/d N= 757 (mITT)
B: 80 mg/d N=756 (mITT)
Other treatments: 30-day washout for patients receiving prior ULT; prophylaxis for gout flares: colchicine ( 0.6 mg/d), or naproxen ( 250 mg bid) plus lansoprazole (15 mg/d);
Choice prophylaxis by investigator and subject (: drug tolerance and experience); naproxen not used if eCLcr <50 ml/min
Patients (18%) allowed to continue their therapy of low dose aspirin once enrolled (≤325 mg/d) |
Allopurinol
C: 200/300 mg/d N= 755 (mITT)
Patients with moderate renal impairment received 200 mg/d (145/755; 19.2%)
Other treatments: 30-day washout for patients receiving prior ULT; prophylaxis for gout flares: colchicine ( 0.6 mg/d), or naproxen ( 250 mg bid) plus lansoprazole (15 mg/d);
Choice prophylaxis by investigator and subject (: drug tolerance and experience); naproxen not used if eCLcr <50 ml/min
Patients (18%) allowed to continue their therapy of low dose aspirin once enrolled (≤325 mg/d) |
Endpoint of follow-up: 6 months
Baseline and bimonthly visits (physical, history, lab tests, echo, compliance)
For how many participants were no complete outcome data available? 1 excl post-rand; mITT=2268 discontinued: A: 125 (16.5%) B: 158 (20.9%) C: 135 (17.9%)
Reasons for incomplete outcome data described? Yes, includes: AEs (49/61/64) Prot viol (10/2/4) Pers reas (12/24/9) Gout flare (3/7/2) Lost fup(28/33/28)
Significant differences between groups? No
mITT=2268 Safety=2269
|
Improvement in severity of symptoms (indirect); AEs
Primary outcome: sUA < 6.0 mg/dl at final visit (after 6 months)
Sec outcome: sUA < 6.0 mg/dl at final visit, among subjects with mild/moderate renal impairment
Non-inferiority if lower limit 95% CI for diff > -10%
sUA < 6.0 mg/dl (6 m) proportion, diff (%) A: 45.2 B: 67.1 C: 42.1 A/C: diff 3.1 [-1.9; 8.1] B/C: diff 24.9 (P<0.001) B/A: diff 21.9(P<0.001)
Renal impairment, and sUA < 6.0 mg/dl (6 m) A: 238/479 (49.7%) B: 360/503 (71.6) C: 212/501 (42.3) A/C: diff 7.4 (P= 0.021) B/C: diff 29.3 (P<0.001) B/A: diff 21.9(P<0.001)
Subgroup analysis(6 m) Primary endpoint Prior ULT trial subjects A1: 57.1% A1/A2 (P≤ 0.05) B1/B2 (P≤ 0.05) C1/C2 (P≤ 0.05)
Gout flares 10-15% of subjects in first 2 months; prior ULT trial subjects had lower rates (P≤ 0.001)
AEs A: 429 (57%) B: 410 (54) C: 433 (57) P=NS Mostly mild/moderate: URTI, liver function, rash, diarrhea
AEs among renal imp A: 268 (56%) B: 270 (54) C: 289 (58) P=NS
≥1 serious AE A: 19 (2.5%) B: 28 (3.7) C: 31 (4.1)
CV AEs (APTC) A: 0 (0%) B: 3 (0.4 [0.082; 1.155]) C: 3 (0.4 [0.082; 1.155]) P=NS All had underlying CVD risk factors
Deaths A: 1; B: 1; C: 3 None judged related to study drug |
GRADE-METHOD; per intervention (comparison) and outcome measure (taking all relevant studies together)
|
Authors conclude that (1) febuxostat 80 mg is more effective than febuxostat 40 mg, and allopurinol (200/300 mg); febuxostat 40 mg and allopurinol (200/300) have comparable efficacy; (2) in patients with mild to moderate renal impairment, febuxostat 80 and 40 mg are more efficacious than allopurinol, and equally safe
At any scheduled visit, more subjects receiving febuxostat 80 mg achieved target endpoint than with febuxostat 40 mg (P< 0.001); if goal sUA is not reached, dose titration to febuxostat 80 mg may be rational alternative to increasing allopurinol beyond 300 mg
Power calculation: 750/group to achieve 90% power for detecting non-inferiority, and a 10% difference in efficacy
Subgroup from prior ULT trials had significantly fewer tophi at baseline (12.5% vs 232.3%; P<0.001)
Higher sUA and tophi at baseline associated with lower rates of endpoint achievement
Mild renal impairment associated with higher rates of endpoint achievement than at normal renal function
Most common AEs leading to discontinuation were liver-function abnormalities (2/1/1%)
|
|
Becker et al. (2005) |
RCT 3-armed trial |
762 patients with gout and with serum urate concentrations of at least 8.0 mg per deciliter (480 micromol per liter) |
febuxostat (80 mg or 120 mg) or allopurinol (300 mg) once daily for 52 weeks; 760 received the study drug. Prophylaxis against gout flares with naproxen or colchicine was provided during weeks 1 through 8. |
The primary end point was a serum urate concentration of less than 6.0 mg per deciliter (360 micromol per liter) at the last three monthly measurements.
The secondary end points included reduction in the incidence of goutflares and in tophus area. |
More patients in the high-dose febuxostat group than in the allopurinol group (P=0.003) or the low-dose febuxostat group discontinued the study. Four of the 507 patients in the two febuxostat groups (0.8 percent) and none of the 253 patients in the allopurinol group died; all deaths were from causes that the investigators (while still blinded to treatment) judged to be unrelated to the study drugs (P=0.31 for the comparison between the combined febuxostat groups and the allopurinol group). |
The primary end point was reached in 53 percent of patients receiving 80 mg of febuxostat, 62 percent of those receiving 120 mg of febuxostat, and 21 percent of those receiving allopurinol (P<0.001 for the comparison of each febuxostat group with the allopurinol group).
Although the incidence of gout flares diminished with continued treatment, the overall incidence during weeks 9 through 52 was similar in all groups: 64 percent of patients receiving 80 mg of febuxostat, 70 percent of those receiving 120 mg of febuxostat, and 64 percent of those receiving allopurinol (P=0.99 for 80 mg of febuxostat vs. allopurinol; P=0.23 for 120 mg of febuxostat vs. allopurinol).
The median reduction in tophus area was 83 percent in patients receiving 80 mg of febuxostat and 66 percent in those receiving 120 mg of febuxostat, as compared with 50 percent in those receiving allopurinol (P=0.08 for 80 mg of febuxostat vs. allopurinol; P=0.16 for 120 mg of febuxostat vs. allopurinol). |
3 = Moderate (Underwood 2011)
Consistency point deducted for different results at different time points and different doses |
Authors conclude that
(1) Febuxostat, at a daily dose of 80 mg or 120 mg, was more effective than allopurinol at the commonly used fixed daily dose of 300 mg in lowering serum urate.
(2) Similar reductions in gout flares and tophus area occurred in all treatment groups. |
|
Becker et al. (2009) |
open-label extension study |
Subjects (n=1086) in this open-label extension study were assigned to |
fixed-dose daily urate-lowering treatment (ULT) with febuxostat (80 mg or 120 mg) or allopurinol (300 mg). ULT reassignment was permitted during months 1 to 6 to achieve serum urate (SUA) concentrations between 3.0 and <6.0 mg/dl. |
Flares requiring treatment, tophus size, safety, and SUA levels were monitored during up to 40 months of ULT maintenance. |
during up to 40 months of ULT maintenance. |
After 1 month initial treatment, >80% of subjects receiving either febuxostat dose, but only 46% of subjects receiving allopurinol, achieved SUA<6.0 mg/dl. After ULT reassignment, >80% of all remaining subjects maintained the primary efficacy endpoint of SUA<6.0 mg/dl at each visit. More subjects initially randomized to allopurinol required ULT reassignment to achieve SUA<6.0 mg/dl compared with subjects receiving febuxostat. Maintenance of SUA<6.0 mg/dl resulted in progressive reduction to nearly 0 in proportion of subjects requiring gout flare treatment.
Baseline tophus resolution was achieved by 46%, 36%, and 29% of subjects maintained on febuxostat 80 mg, febuxostat 120 mg, and allopurinol, respectively.
Overall adverse event rates (including cardiovascular adverse event rates), adjusted for 10-fold greater febuxostat than allopurinol exposure, did not differ significantly among treatment groups. |
|
Durable maintenance of goal range SUA level with either dose of febuxostat or in smaller numbers of subjects with allopurinol resulted in near elimination of gout flares and improved tophus status over time. |
|
Schumacher HR Jr (2009) |
This 5-yr study assessed urate-lowering and clinical efficacy and safety of long-term febuxostat therapy in subjects with gout. |
Subjects who completed a previous 28-day study were entered into an open-label extension study |
and initially received febuxostat 80 mg daily. Between Weeks 4 and 24, dosing could be adjusted to febuxostat 40 or 120 mg. All subjects received gout flare prophylaxis during the first 4 weeks. Gout flares were recorded and treated throughout the study, and sUA, baseline tophi and safety were monitored. |
The primary efficacy end-point was reduction to and maintenance of serum urate (sUA) levels < 6.0 mg/dl. |
|
Among 116 subjects initially enrolled, dose adjustments were made for 44 (38%) subjects. As a result, 8 subjects received febuxostat 40 mg, 79 received 80 mg, and 29 received 120 mg daily maintenance dose. At 5 yrs, 93% (54/58) of the remaining subjects had sUA < 6.0 mg/dl. Fifty-eight subjects (50%) discontinued prematurely; 38 did so in the first year. Thirteen subjects withdrew due to an adverse event.
Sustained reduction of sUA was associated with nearly complete elimination of gout flares.
In 26 subjects with a tophus at baseline, resolution was achieved in 69% (18/26) by last visit on study drug at any point during the study (Final Visit). There were no deaths reported during the study. |
|
Authors conclude that
(1) Long-term treatment with febuxostat resulted in durable maintenance of sUA < 6.0 mg/dl for most subjects.
(2) There was nearly complete abolition of gout flares in patients completing the study. Baseline tophi resolved in a majority of subjects. |
|
Jackson 2012,
CONFIRMS subanalyse 65+ |
post hoc analysis
of elderly subjects enrolled in the CONFIRMS trial (double-blind, randomized, comparative) |
a subset of elderly subjects enrolled in the CONFIRMS trial.
Hyperuricemic (serum urate [sUA] levels ≥ 8.0 mg/dL) gout subjects
|
febuxostat, 40 mg or 80 mg
Flare prophylaxis was provided throughout the study duration. |
allopurinol (200 mg or 300 mg based on renal function) |
6-month |
Study endpoints were the percent of elderly subjects with sUA <6.0 mg/dL at the final visit, overall and by renal function status, percent change in sUA from baseline to final visit, flare rates, and rates of adverse events (AEs).
Of 2,269 subjects enrolled, 374 were elderly. Febuxostat 80 mg was significantly more efficacious (82.0%) than febuxostat 40 mg (61.7%; p < 0.001) or allopurinol (47.3%; p < 0.001) for achieving the primary efficacy endpoint. Febuxostat 40 mg was also superior to allopurinol in this population (p = 0.029). In subjects with mild-to-moderate renal impairment, significantly greater ULT efficacy was observed with febuxostat 40 mg (61.6%; p = 0.028) and febuxostat 80 mg (82.5%; p < 0.001) compared to allopurinol 200/300 mg (46.9%). Compared to allopurinol 200/300 mg, the mean percent change in sUA from baseline was significantly greater for both febuxostat 80 mg (p < 0.001) and febuxostat 40 mg (p = 0.011) groups. Flare rates declined steadily in all treatment groups. Rates of AEs were low and comparable across treatments. |
|
Post-hoc analyse
These data suggest that either dose of febuxostat is superior to commonly prescribed fixed doses of allopurinol (200/300 mg) in subjects ≥65 years of age with high rates of renal dysfunction. In addition, in this high-risk population, ULT with either drug was well tolerated. |
|
Goldfarb 2011 |
post-hoc analysis of a
phase 2, 28-day, multicenter, randomized, double-blind, placebo-controlled trial |
gouty patients who were either overproducers or underexcretors.
Gouty subjects 18 to 85 years of age with sUA ≥ 8.0 mg/dl at baseline |
febuxostat 40 mg, 80 mg, or 120 mg daily
|
placebo |
28-day |
to determine the effectiveness of the xanthine oxidase inhibitor febuxostat in reducing serum urate (sUA) levels
The primary efficacy endpoint was the proportion of subjects with sUA < 6.0 mg/dl at Day 28.
Secondary efficacy endpoints included percentage reductions in sUA and urinary uric acid (uUA) from baseline to Day 28.
Of the 153 subjects, 118 (77%) were underexcretors (uUA ≤ 800 mg/24 h) and 32 (21%) were overproducers (uUA > 800 mg/24 h); baseline uUA data were missing for 3 subjects. Treatment with febuxostat led to the majority of subjects achieving sUA < 6.0 mg/dl at Day 28. Treatment with any dose of febuxostat led to significantly greater percentage reductions in uUA than that observed in the placebo roup, for both underexcretors and overproducers. |
Very low |
Phase 2 post-hoc
Conclusion:
Febuxostat is a highly efficacious urate-lowering therapy in patients with gout regardless of overproduction or underexcretion status. |
|
Schumacher et al,. 2008 |
randomized
|
Subjects (n = 1,072) with hyperuricemia (serum urate level > or = 8.0 mg/dl) and gout with normal or impaired (serum creatinine level >1.5 to < or = 2.0 mg/dl) renal function |
to receive once-daily febuxostat (80 mg, 120 mg, or 240 mg),
allopurinol (300 or 100 mg, based on renal function),
|
placebo |
28 weeks |
Significantly (P < or = 0.05) higher percentages of subjects treated with febuxostat 80 mg (48%), 120 mg (65%), and 240 mg (69%) attained the primary end point of last 3 monthly serum urate levels <6.0 mg/dl compared with allopurinol (22%) and placebo (0%). A significantly (P < 0.05) higher percentage of subjects with impaired renal function treated with febuxostat 80 mg (4 [44%] of 9), 120 mg (5 [45%] of 11), and 240 mg (3 [60%] of 5) achieved the primary end point compared with those treated with 100 mg of allopurinol (0 [0%] of 10). Proportions of subjects experiencing any adverse event or serious adverse event were similar across groups, although diarrhea and dizziness were more frequent in the febuxostat 240 mg group. The primary reasons for withdrawal were similar across groups except for gout flares, which were more frequent with febuxostat than with allopurinol. |
|
At all doses studied, febuxostat more effectively lowered and maintained serum urate levels <6.0 mg/dl than did allopurinol (300 or 100 mg) or placebo in subjects with hyperuricemia and gout, including those with mild to moderately impaired renal function.
|
|
Becker et al, 2005 |
phase II, randomized, double-blind, placebo-controlled trial
|
in 153 patients (ages 23-80 years). |
Subjects received febuxostat (40 mg, 80 mg, 120 mg) once daily for 28 days and colchicine prophylaxis for 14 days prior to and 14 days after randomization. |
placebo
|
28 days |
The primary end point was the proportion of subjects with sUA levels <6.0 mg/dl on day 28. Greater proportions of febuxostat-treated patients than placebo-treated patients achieved an sUA level <6.0 mg/dl at each visit (P < 0.001 for each comparison). The targeted sUA level was attained on day 28 in 0% of those taking placebo and in 56% of those taking 40 mg, 76% taking 80 mg, and 94% taking 120 mg of febuxostat. The mean sUA reduction from baseline to day 28 was 2% in the placebo group and 37% in the 40-mg, 44% in the 80-mg, and 59% in the 120-mg febuxostat groups. Gout flares occurred with similar frequency in the placebo (37%) and 40-mg febuxostat (35%) groups and with increased frequency in the higher dosage febuxostat groups (43% taking 80 mg; 55% taking 120 mg). During colchicine prophylaxis, gout flares occurred less frequently (8-13%). Incidences of treatment-related adverse events were similar in the febuxostat and placebo groups. |
|
Treatment with febuxostat resulted in a significant reduction of sUA levels at all dosages. Febuxostat therapy was safe and well tolerated. |
|
Uricase analogs (Pegloticase) |
||||||||
|
Sundy 2011 |
Two replicate, randomized, double-blind, placebo-controlled trials (C0405 and C0406)
conducted between June 2006 and October 2007 at 56 rheumatology practices in the United States, Canada, and Mexico |
in patients with severe gout, allopurinol intolerance or refractoriness, and serum uric acid concentration of 8.0 mg/dL or greater.
A total of 225 patients participated: 109 in trial C0405 and 116 in trial C0406. |
Twelve biweekly intravenous infusions containing either pegloticase 8 mg at each infusion (biweekly treatment group),
pegloticase alternating with placebo at successive infusions (monthly treatment group), |
placebo |
6 months |
Primary end point was plasma uric acid levels of less than 6.0 mg/dL in months 3 and 6.
In trial C0405 the primary end point was reached in 20 of 43 patients in the biweekly group (47%; 95% CI, 31%-62%), 8 of 41 patients in the monthly group (20%; 95% CI, 9%-35%), and in 0 patients treated with placebo (0/20; 95% CI, 0%-17%; P < .001 and <.04 for comparisons between biweekly and monthly groups vs placebo, respectively). Among patients treated with pegloticase in trial C0406, 16 of 42 in the biweekly group (38%; 95% CI, 24%-54%) and 21 of 43 in the monthly group (49%; 95% CI, 33%-65%) achieved the primary end point; no placebo-treated patients reached the primary end point (0/23; 95% CI, 0%-15%; P = .001 and < .001, respectively).
When data in the 2 trials were pooled, the primary end point was achieved in 36 of 85 patients in the biweekly group (42%; 95% CI, 32%-54%), 29 of 84 patients in the monthly group (35%; 95% CI, 24%-46%), and 0 of 43 patients in the placebo group (0%; 95% CI, 0%-8%; P < .001 for each comparison).
Seven deaths (4 in patients receiving pegloticase and 3 in the placebo group) occurred between randomization and closure of the study database (February 15, 2008). |
|
Among patients with chronic gout, elevated serum uric acid level, and allopurinol intolerance or refractoriness, the use of pegloticase 8 mg either every 2 weeks or every 4 weeks for 6 months resulted in lower uric acid levels compared with placebo. |
|
Anderson 2010
Cochrane |
Systematic review
|
|
|
|
|
Only one open-label, phase-II RCT (n=41) met the selection criteria that compared various doses of pegloticase without comparison to placebo or another treatment. |
|
After this review, Sundy 2011 was published |
|
Sundy 2008 |
Phase II |
|
Patients were randomized to one of the four doses of pegloticase for 12 to 14 weeks - 4mg every 2 weeks, 8mg every 2 weeks, 8mg every 4 weeks and 12mg every 4 weeks. |
|
|
Percent responders (uric acid below 6 mg/dl 80% or more time) in the four dose groups were 56%, 88%, 52% and 62%. Percent time without hyperuricemia (uric acid below 6 mg/dl) was 78%, 92%, 76% and 76% respectively. No between dose differences were noted. Most common adverse events (10% or more patients) included nephrolithiasis, arthralgia, anemia, dyspnea, headache, muscle spasms, nausea and pyrexia. 89% reported one or more gout flares during the study. Pain, patient/physician global, function, quality of life, tophus size/regression and radiographic progression were not reported in this study. |
|
|
|
Benzbromaron |
||||||||
|
Reinders, 2009 |
Prospective, multicentre, open-label, two-stage randomised controlled trial |
in gout patients with normal renal function.
Enrolled patients were given 300 mg allopurinol for 2 months (stage 1). Those patients who could not tolerate allopurinol or who did not attain the target serum urate concentration (sUr) < or=0.30 mmol/l (5.0 mg/dl), which was defined as successful, were randomised |
benzbromarone 200 mg/day |
probenecid 2 g/day |
2 months |
96 patients were enrolled in stage 1. 82 patients (85%) were eligible for the analysis at the end of stage 1: there was a mean (SD) decrease in sUr concentration of 35 (11)% from baseline; 20 patients (24%) attained target sUr < or=0.30 mmol/l; and 9 patients (11%) stopped allopurinol because of adverse drug reactions. 62 patients were enrolled in stage 2. 27 patients received benzbromarone (3 patients not eligible for analysis) and 35 received probenecid (4 patients not eligible for analysis). Treatment with benzbromarone was successful in 22/24 patients (92%) and with probenecid in 20/31 patients (65%) (p = 0.03 compared with benzbromarone). Compared with baseline values, there was a mean (SD) decrease of sUr concentration of 64 (9)% with benzbromarone and 50 (7)% with probenecid (p<0.001). |
|
This study showed that allopurinol 300 mg/day has a poor efficacy and tolerability profile when used to attain a biochemical predefined target level of sUr < or =0.30 mmol/l, following 2 months of treatment. In stage 2, benzbromarone 200 mg/day was more effective and better tolerated than probenecid 2 g/day.
|
|
Reinders 2009 |
A randomised, controlled, open-label, multicentre trial The primary end point was treatment success in either of the two stages, defined as clinical tolerability and attainment of biochemical target sUr.
|
in gout patients with renal function defined as a calculated creatinine clearance > or =50 ml/min. |
100 mg benzbromarone once a day (stage 1).
If sUr < or =0.30 mmol/l was not attained after 2 months, the dose was doubled to benzbromarone 200 mg once a day (stage 2). |
300 mg allopurinol once a day (stage 1).
If sUr < or =0.30 mmol/l was not attained after 2 months, the dose was doubled to allopurinol 300 mg twice a day (stage 2).
|
2 months + 2 months |
65 patients were enrolled in stage 1; 36 received allopurinol and 29 received benzbromarone. Fifty-five patients (85%) were analysed at stage 1: the success rates were 8/31 (26%) and 13/25 (52%), respectively, and the difference was -0.26 (95% CI from -0.486 to -0.005), p = 0.049. At stage 2, the success rates were 21/27 (78%) and 18/23 (78%), respectively, and the difference was -0.005 (95% CI from -0.223 to 0.220), p = 1.00. Two patients stopped receiving allopurinol and three stopped receiving benzbromarone because of adverse drug reactions. |
|
Increasing the allopurinol dose from 300 to 600 mg/day and the benzbromarone dose from 100 to 200 mg/day according to the target sUr produced significantly higher success rates (both 78% successful in attaining sUr < or =0.30 mmol/l).
No significant differences in treatment success between benzbromarone and allopurinol were found after dose escalation. |
|
2 Allopurinol combined with Benzbromarone versus Allopurinol alone |
||||||||
|
Akkasilpa 2004 |
A prospective, open study
|
of 94 hyperuricemic patients |
To compare the efficacy of combined low dose of hypouricemic drugs (Allopurinol 100 mg and benzbromarone 20 mg; Allomaron) and standard dose 300 mg of allopurinol in hyperuricemia.
|
Each group of 47 patients was given a combined low dose of hypouricemic drugs (Allopurinol 100 mg and benzbromarone 20 mg; Allomaron) |
and a standard dose 300 mg of allopurinol. |
Serum uric acid was measured before and 4 weeks after receiving the drugs. The efficacy was measured from the difference of the level of serum uric acid before and after receiving the drugs. The patients receiving the combined low dose of hypouricemic drugs and standard dose of allopurinol showed a mean reduction of serum uric acid of 2.5+/-3.4 mg/dl and 4.1+/-2.7 mg/dl consecutively. There was a statistically significant difference between the 2 groups (P = 0.010). |
Very low |
Low dose benzbromarone
Lower dose of allopurinol in intervention group than in control group |
|
Perez-Ruiz et al, 2002 |
This observational, prospective study evaluates the relationship between serum urate levels during therapy and the velocity of reduction of tophi in patients with chronic tophaceous gout.
|
Sixty-three patients with crystal-confirmed tophaceous gout
|
were treated with allopurinol, benzbromarone, or combined therapy to achieve serum uric acid levels less than the threshold for saturation of urate in tissues. |
|
|
The tophi targeted for evaluation during followup were the largest in diameter found during physical examination. Patients taking benzbromarone alone or combined allopurinol and benzbromarone therapy achieved faster velocity of reduction of tophi than patients taking allopurinol alone. The velocity of tophi reduction was linearly related to the mean serum urate level during therapy. The lower the serum urate levels, the faster the velocity of tophi reduction. |
Very low |
Serum urate levels should be lowered enough to promote dissolution of urate deposits in patients with tophaceous gout. Allopurinol and benzbromarone are equally effective when optimal serum urate levels are achieved during therapy. Combined therapy may be useful in patients who do not show enough reduction in serum urate levels with single-drug therapy.
|
|
3 Other pharmacological interventions (ascorbic acid; losartan; calcium antagonists) |
||||||||
|
4 Potential role of kidney function replacement therapy |
||||||||
|
Ohno 2005
|
Retrospective cohort study
Japan; Internal Med Dept; University
Source of funding: not mentioned |
Inclusion criteria: patients with ESRD undergoing maintenance Dialysis (HD or CAPD)
N=493 N=79 gout patients (16%; but definition is largely unclear)
324 (66%) male; Age 59.9 ± 12.7 (range, 15–93 years)
Type of dialysis HD: 413 (84%) CAPD: 80 (16%)
Renal disease Chron Glom nephr 198 (40%), diab. nephr 138 (28%), nephrosclerosis 43 (8.7%), polycystic KD 18 (3.7%), gouty kidney 3 (0.6%), unknown 98 (19%)
Laboratory data obtained at time of maintenance dialysis (before dialysis for HD and ambulant for CAPD)
UA 7.9±1.6 (m) UA 7.6±1.5 (f) BMI 22.5±3.1 (m) BMI 20.6±3.3 (f) Dial dur (months): 81.2±88.1 (m) 92.9±88.4 (f) |
Before first dialysis N=493
Time periods studied: (a) >2 y before dialysis (b) 0-2 y before
Additional (flanking) procedures or medication Allopurinol: 158 (32%)
No further details provided
|
After dialysis N=493
(c) 0-2 y after dialysis (d) >2 y after
Additional (flanking) procedures or medication Allopurinol: 158 (32%) |
Several years (retrospective) |
Incidence gouty arthritis (in all patients); number gouty attacks before and after start dialysis (in gout patients)
Gouty arthritis Based on ARA criteria (Wallace 1977) using questionnaires, patient interviews, and review of medical records
Overall incidence (%) ≥1 attack/time period N=493 ESRD patients (a) 15.4 (m); 4.1 (f) (b) 7.7 (m); 0.6 (f) (c) 3.4 (m); 0 (f) (d) 1.2 (m); 0 (f) Before(a+b): 14.0% After (c+d): 2.8%
Number attacks in patients with gouty arthritis (times/year) N=79 gout patients (a) 2.0±4.2 (b) 1.9±6.6 (c) 0.2±0.7 (d) 0.1±0.6 (c) versus (a): p=0.04 (d) versus (a): p=0.03 (d) versus (b): p=0.04
|
Retrospective cohort study; ESRD patients both with and without gout or HU; before and after study; patients and analyses poorly described; potential confounding by allopurinol use; no reasons to upgrade level of evidence
Level of evidence: GRADE
Across all studies analysed
VERY LOW* Dialysis vs no dialysis Effect on gout attacks
*Downgraded because of indirectness, serious study limitations, and imprecision (ill defined study populations; poorly described analyses; low number of gout patients)
|
Authors concluded that frequency of gouty arthritis in Japanese patients with ESRD is similar to that of patients with hyperuricemia in general population, but decreases markedly after dialysis; both overall frequency of gouty arthritis among the ESRD patients, and the annual number of attacks in ESRD patients with gout decrease significantly
Note: patient characteristics are poorly described; details on gout diagnosis and (allopurinol) treatment are lacking; analyses are unclear; possible confounding by allopurinol
32% patients use allopurinol, and gouty arthritis is more frequent in users than non-users (p=0.0002; but unclear which time period was analyzed)
|
|
Ifudu 1994
|
Retrospective cohort study
Large urban teaching hospital; USA
Source of funding: not mentioned |
Inclusion criteria: stable patients with ESRD in outpatient maintenance dialysis (HD or CAPD)
N=201
N=13 (6.5%) gout (before dialysis; all men)
N=25 had been on HD for >12 years (group analyzed separately)
Diagnosis gout questionnaires, patient interviews, reviews medical records (‘most of gout patients [pre-dialysis] had diagnosis based on crystal proof’)
Type of dialysis HD: 126 (63%) -High flux: 19% CAPD: 18%
<12 yr on dialysis CAPD/HD Age 49.4/52.8 Dur (mo)24.6/27.2 Pre-dialysis: SU 6.4/7.6 (mf) SU 6.7/7.6 (m) SU 5.9/7.5 (f) HU 24%/56% criteria for HU not stated
|
Before first dialysis
N=201
N=13 (6.5%) gout (before dialysis); all men
N=25 had been on HD for >12 years (group analyzed separately)
Additional (flanking) procedures or medication ‘none of the gout patients had been on maintenance allopurinol, colchicine, or NSAIDs)
|
After dialysis
N=201
N=13 (6.5%) gout (before dialysis); all men
N=25 had been on HD for >12 years (group analyzed separately) |
Several years (retrospective) |
Incidence gouty arthritis; number gouty attacks before and after start dialysis (in gout patients)
Gouty arthritis questionnaires, patient interviews, reviews medical records (criteria for post-dialysis diagnosis not stated)
Overall no new (new onset) cases of GA ‘even among those with HD >12 yrs, despite persistent HU and associated hypertension’ (no further details provided)
Gout patients (n=13) Dur dialysis 25 ± 3.8 mo ‘recalled GA attacks ≥2/y before dialysis’ 9/13 (70%) no attacks 4/13 (30%) ‘frequency of acute attacks declined bij 50%’ (‘despite persistent HU and associated hypertension’)
>12 yrs dialysis (n=25) Dur dialysis 16 ± 3.4 yrs Predialysis SU 6.8 ±1.5 9 (36%) persistant HU 7/9 (78%) also hypert ‘none had prior GA or developed new-onset GA after dialytic therapy’ |
Retrospective cohort study; ESRD patients both with and without gout or HU; very small number of patients (n=13) in subgroup analysis for gout patients; before and after study; patients and analyses poorly described, no statistics provided; no reasons to upgrade level of evidence
Level of evidence: GRADE
Across all studies analysed
VERY LOW* Dialysis vs no dialysis Effect on gout attacks
See above (Ohno 2005) |
Authors conclude that there is remarkable improvement in clinical activity of GA in ESRD patients on dialysis, and that new-onset GA is rare in hyperuricemic long-term ESRD patients
Authors suggest Improvement in GA may be a result of metabolic perturbations of uremia or the extraction of an unidentified factor by dialytic therapy
Note: synovial fluid of dialysis patients was not examined; urate crystals may be present without causing inflammation
Note: postdialysis levels of SU were not measured |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 03-02-2014
Laatst geautoriseerd : 03-02-2014
Geplande herbeoordeling : 01-01-2019
Uiterlijk in 2018 bepaalt het bestuur van de Nederlandse Vereniging voor Reumatologie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Reumatologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
In samenwerking met
Nederlandse Federatie voor Nefrologie
De richtlijn is tot stand gekomen met ondersteuning van het Kennisinstituut van Medisch Specialisten en met financiële steun van de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
De richtlijn is geschreven ter ondersteuning van de zorgverlening aan patiënten met jicht. Specifieke doelen van deze richtlijn zijn: het verkrijgen van uniformiteit in preventie en diagnostiek van jicht en in behandeling en begeleiding van patiënten met jicht en het bieden van een handvat voor een betere inrichting van de praktijkvoering van zorgverleners betrokken bij de zorg voor patiënten met jicht. Deze richtlijn wil tevens bijdragen aan betere communicatie tussen behandelaars onderling en tussen de patiënt, diens naasten en behandelaars.
Afbakening van de richtlijn
Deze richtlijn is een richtlijn voor de tweedelijnszorg van patiënten met jicht. Voor de eerstelijnszorg wordt verwezen naar de richtlijn ‘Artritis’ (Nederlands Huisartsen Genootschap, 2009). Er is naar gestreefd de richtlijn zoveel mogelijk te laten aansluiten bij deze NHG-standaard.
Doelgroep
De richtlijn is bedoeld voor alle zorgverleners in de tweedelijn die bij de behandeling van patiënten met jicht betrokken zijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2011 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met jicht. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Samenstelling van de werkgroep
-
Dr. M. Janssen, reumatoloog, Nederlandse Vereniging voor Reumatologie, voorzitter
-
Dr. T.L.Th.A Jansen, reumatoloog, Nederlandse Vereniging voor Reumatologie
-
Dr. C.J. Haagsma, reumatoloog, Nederlandse Vereniging voor Reumatologie
-
Dr. H. Baan, reumatoloog, Nederlandse Vereniging voor Reumatologie
-
Prof. dr. M.A.F.J. van de Laar, reumatoloog, Nederlandse Vereniging voor Reumatologie
-
Prof. dr. Sj. van der Linden, reumatoloog, Nederlandse Vereniging voor Reumatologie
-
Dr. M. Gerritsen, reumatoloog, Nederlandse Vereniging voor Reumatologie
-
Dr. J.W.G. Jacobs, reumatoloog, Nederlandse Vereniging voor Reumatologie
-
Dr. H.E.J.M. Janssens, huisarts, Nederlands Huisartsen Genootschap
-
Dr. C.E. Douma, internist-nefroloog, Nederlandse Internisten Vereniging, Nederlandse Federatie voor Nefrologie
-
Drs. P. Dubbeld, klinisch geriater, Nederlandse Vereniging voor Klinische Geriatrie
-
Dr. E.N. van Roon, ziekenhuisapotheker, Nederlandse Vereniging van Ziekenhuisapothekers
-
Dr. M.K. Reinders, ziekenhuisapotheker, Nederlandse Vereniging van Ziekenhuisapothekers
Met ondersteuning van:
-
Dr. K.N.J. Burger, medisch bioloog en epidemioloog, adviseur van het Kennisinstituut van Medisch Specialisten
-
Drs. M. Wessels, medisch informatiespecialist van het Kennisinstituut van Medisch Specialisten
-
S.K. Josso, secretaresse van het Kennisinstituut van Medisch Specialisten
Met dank aan:
-
Drs. C.M.P.G. van Durme, AIOS
-
Drs. I.A.A.M. van Echteld, reumatoloog
-
Dr. Ir. I.C.W. Arts, epidemioloog
-
Drs. L.B.E. Kienhorst, arts-onderzoeker
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen door middel van reputatiemanagement, belangen vanwege extern gefinancierd onderzoek en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten, een overzicht vindt u hieronder.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiele belangen |
Reputatie management |
Extern gefinancierd onderzoek |
Kennis valorisatie |
|
Irene van Echteld |
Meelezer |
Deelname 3e initiative sponsoring door Abbott |
nee |
nee |
ja, 3e initiative sponsoring door Abbott |
nee |
|
Dr. M.K. Reinders |
ziekenhuisapotheker |
geen |
nee |
nee |
nee |
nee |
|
Peter Dubbeld |
Klinisch geriater |
geen |
nee |
nee |
nee |
nee |
|
C.W. Arts |
Arts |
geen |
nee |
nee |
nee |
nee |
|
W.G. Jacobs |
reumatoloog |
geen |
nee |
nee |
nee |
nee |
|
H. Baan |
reumatoloog |
geen |
nee |
nee |
nee |
deelname 3e initiatief Gout (Abbott) vergoeding kosten |
|
T.L. Jansen |
reumatoloog |
lecture fee (sporadisch)/lid wetenschappelijke adviesraad voor de volgende firma's: - Abbive - BMS - Janssen - Menarini/ Ipsen - Pfizer - Savient - UCB |
nee |
lid medische adviesraad sarcoïdose belangen vereniging lid medische adviesraad Jichtpatiënten |
Projectleider van landelijke studie POEET (stappen van TNFi bij RA) met funding via ZonMW/VWS. Projectleider van POEET-substudies 1) POET-US met focus op voorspellende waarde van gewrichtsecho op succesvol stoppen TNFi, alsook 2) enotheelmetingen bij POEET, beide middels funding van Abbvie; Europacoordinator in Study of Update Gout criteria met funding acr/eulaR (SugaR) |
nee |
|
S.J. van der Linden |
Hoogleraard Reumatologie mama |
geen |
nee |
nee |
nee |
nee |
|
E.N. van Roon |
Ziekenhuisapotheker/Hoogleraar Klinische Farmacotherapie |
geen |
nee |
nee |
nee |
nee |
|
H. Janssens |
Huiarts en senior onderzoeker |
lid redatiecommissie Geneesmiddelenbulletin (onbetaald) |
nee |
nee |
nee |
nee |
|
Dr. C.E. Douma |
Internist nefroloog |
Lid Kwaliteitscommissie NfN |
nee |
nee |
nee |
nee |
|
C.J. Haagsma |
Meelezer |
geen |
nee |
nee |
nee |
nee |
|
L.B.E. Kienhorst |
arts-onderzoeker |
geen |
nee |
nee |
nee |
nee |
|
M. Gerritsen |
reumatoloog |
geen |
Eenmalige deelname adviesraad Sobi. Geen directe financiële belangen in bovengenoemd of ander bedrijf. |
nee |
Geen. Geplande studie naar effect Anakinna op therapie-resistente jicht aanval. Medicament en placebo geleverd door Sobi. Geen verdere financiële belangen firma. |
geen |
|
Matthijs Janssen |
reumatoloog |
geen |
geen |
nee |
nee |
nee |
|
Mart van de Laar |
hoogleraar Reumatologie Universiteit Twente |
vz consilium Ned. Ver. van Reumatologie (onbetaald), eigenaar Transparency-in-Health bv (betaald), vz Dream register (onbetaald) |
eigenaar Transparency-in Healthcare bv. Adviseert van Novartis terzake Canakinumab |
vz Dreamregister, vz Concilium Ned. Ver. Van Reumatologie |
nee |
nee |
|
Caroline van Durme |
|
geen |
nee |
nee |
nee |
nee |
Inbreng patiëntenperspectief
Er is aandacht besteed aan het patiëntenperspectief met patiënteninterviews (deels telefonisch). Een verslag van de patiënteninterviews is besproken in de werkgroep en de belangrijkste knelpunten zijn geadresseerd in de richtlijn. Het verslag is hieronder terug te vinden. Ook is in de oriënterende fase gezocht naar literatuur vanuit patiëntenperspectief, hierbij is gebruik gemaakt van een gestandaardiseerd zoekfilter (zie onder het verslag van de knelpunten). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de deelnemers aan de patiënteninterviews, het Reumafonds en de Nederlandse Vereniging voor Jichtpatiënten.
Verslag patiënteninterviews (plenair + telefonisch)
Datum: 12 april 2012
Tijd: 16.00-19.00 uur
Aanwezigen: twee patiënten; dr. K.N.J. Burger (OMS / OPK; adviseur); dr. M. Janssen (reumatoloog; voorzitter werkgroep richtlijn Jicht)
Afwezig maar telefonisch geraadpleegd (telefonisch interview): twee patiënten
Patiëntkarakteristieken: man (4), 65 tot 67 jaar, 7 tot 25 jaar na diagnose
Onderwerpen die tijdens de plenaire sessie en telefonische interviews als verbeterpunten in de zorg geïdentificeerd zijn en voorstellen om deze te verbeteren:
Algemeen
- ondanks het feit dat jicht relatief vaak voorkomt, met name onder ouderen, en de incidentie van jicht toeneemt door de vergrijzing, is jicht slecht bekend onder niet-patiënten. Jicht lijkt een ‘vergeten’ ziekte. Hierdoor ondervinden patiënten vaak weinig begrip van hun omgeving, en praten niet graag over hun ziekte;
- patiënten zijn gebaat bij meer openheid en een betere voorlichting over de ziekte jicht onder de algemene bevolking;
- een bredere en betere kennis van veelvoorkomende ziektes zoals jicht zou bereikt kunnen worden door het starten van een centrale website onder het motto ‘ken uw ziekte’, en meer aandacht in de media. Zo’n centrale website zou moeten worden ondersteund door de overheid en medische beroepsverenigingen.
Patiëntenvoorlichting
- er is veel onduidelijkheid bij patiënten welke factoren de kans op een jichtaanval vergroten of juist verkleinen en in welke mate:
- relatie tussen dagelijkse activiteiten (lichamelijke en psychische belasting, werk, sport, lange vliegreizen) en de kans op een jichtaanval;
- relatie tussen levensstijl en voedingfactoren (alcohol; seafood; Nieuwe Haring) en de kans op een jichtaanval;
- welke factoren belangrijk zijn, en welke (veel) minder of nauwelijks.
- er is vaak onduidelijkheid bij patiënten over de bijwerkingen van jichtmedicatie:
- bijsluiters bevatten zeer uitgebreide informatie over tal van bijwerkingen, vaak zeer ernstige. De patiënt heeft moeite om deze informatie op waarde te schatten in relatie tot de voorgeschreven dosering, en de ziekte jicht;
- één patiënt geeft aan dat de apotheker zeer goede informatie verstrekt met betrekking tot risico’s en bijwerkingen (onder andere in de vorm van print-outs).
- door de ernst en het chronisch verloop van de ziekte zijn patiënten erg gevoelig voor (goedbedoelde) adviezen uit hun omgeving;
- mede door de onduidelijkheid die bestaat bij patiënten over risicofactoren en (bijwerkingen van) medicatie, zijn patiënten snel geneigd om af te wijken van doktersvoorschriften, alternatieve middelen te testen, of hun levensstijl en voedingspatroon aan te passen:
- verhogen van de colchicine dosering op advies van de omgeving: ‘een lage dosering helpt niet’ (: is de patiënt voldoende op de hoogte van de risico’s van colchicine?);
- niet gebruiken van prednison op advies van de omgeving: ‘paardenmiddel’, ‘opgeblazen gezicht’ (: realiseert de patiënt zich voldoende dat het om een lage dosering prednison gaat en een relatief korte behandelduur?);
- gebruik van alternatieve (‘wonder’) middelen: Alkalife, glucosamine, …;
- gebruik van alternatieve pijnstillers.
- er is behoefte aan betere voorlichting:
- welke factoren verhogen of verlagen de kans op een jichtaanval, en hoe sterk? Welke algemene adviezen vloeien hier uit voort, rekening houdend met de algemene gezondheid van de patiënt?
- welke behandelopties zijn er, en wat zijn de belangrijkste bijwerkingen van de voorgeschreven medicijnen. Deze voorlichting moet worden toegespitst op de jichtpatiënt (relevante dosering);
- aandacht voor vragen van de patiënt (FAQ; vraag en antwoord, in brochure of op website);
- aandacht voor omgevingsgeluiden: hoe om te gaan met de goedbedoelde adviezen die de patiënt bereiken vanuit de omgeving?
- aandacht voor alternatieve middelen (Alkalife, glucosamine, ‘wondermiddelen’);
- aandacht voor de relatie tussen jicht en een verhoogd risico op hart- en vaatziektes;
- niet alleen gericht op de patiënt, maar ook op de betrokkenen (vergroten van begrip). Aandacht voor de grote invloed die de ziekte kan hebben op het dagelijks functioneren (werken, sport);
- niet alleen bij het stellen van de diagnose, maar gedurende het hele behandeltraject. Informatie verstrekt bij de 1e diagnose wordt vaak slecht verwerkt door de patiënt;
- niet alleen mondeling, maar ook schriftelijk (goede brochure; website).
Behandelaar (algemeen)
- patiënten zijn vaak niet voorgelicht over de relatie tussen jicht en een verhoogd risico op hart- en vaatziektes. Onduidelijk is of patiënten voldoende worden gecontroleerd op hart- en vaatziektes;
- door het chronisch verloop van de ziekte jicht en vaak terugkerende en ernstige symptomen (aanvallen), bestaat er bij patiënten vaak de behoefte aan een second opinion. Deze onafhankelijke analyse van het ziekteverloop en medicatiebeleid wordt door patiënten zeer verhelderend gevonden;
- patiënten geven aan dat aanvallen vaak optreden op bepaalde momenten, wanneer er sprake is van grote lichamelijke en psychische belasting, bijvoorbeeld bij piekbelasting op het werk. Zo’n jichtaanval komt dan op het slechts denkbare moment. Patiënten zouden graag beschikken over extra medicatie (profylaxe) om deze voor hun ‘voorspelbare’ jichtaanvallen te voorkomen;
- betere voorlichting over hart- en vaatziekterisico, en meer aandacht voor preventie van hart- en vaatziekte bij jichtpatiënten is gewenst.
Huisarts
- één patiënt met chronische jicht (25 jaar jicht) en regelmatige jichtaanvallen is nooit doorverwezen door de huisarts en min of meer door toeval (ziekenhuisopname i.v.m. ernstige infectie) recent in contact gekomen met de reumatoloog die de definitieve diagnose (kristalbewijs) heeft gesteld en de behandeling (nu ook met urinezuur-verlagende therapie) heeft overgenomen;
- de patiënt verklaard niet te zijn voorgelicht door de huisarts over (of gecontroleerd op) hart- en vaatziekterisico, en wordt pas recent behandeld voor hoge bloeddruk;
- de patiënt is ontevreden over de procedure die gevolgd wordt bij een jichtaanval. Na telefonisch contact met de huisartspraktijk volgt geen consult met de huisarts, maar wordt een herhaalrecept (pijnstiller) verstrekt door de praktijkassistent. De patiënt geeft aan behoefte te hebben aan meer contact met de huisarts;
- een tweede chronische jichtpatiënt is op eigen verzoek recent doorverwezen naar de reumatoloog vanwege pijn in het polsgewricht, met name om meer zekerheid te krijgen over de diagnose (reuma versus jicht). De reumatoloog heeft de definitieve diagnose gesteld (kristalbewijs) en behandeling met urinezuurverlagende therapie gestart;
- eerder werd de patiënt door de huisarts uitsluitend behandeld met pijnstillers, in eerste instantie naproxen, waar de patiënt ernstige bijwerkingen van ondervond. De patiënt verklaard het gevoel te hebben dat huisartsen betrekkelijk weinig kennis hebben van de ziekte jicht;
- de organisatie van zorg rond jichtpatiënten verdient extra aandacht, met name het samenspel en verwijsbeleid tussen eerstelijns en tweedelijns zorg. Dit lijkt in het bijzonder te gelden bij patiënten met langdurige chronische jicht, die gebaad zouden zijn bij een betere (persoonlijke) begeleiding, en een regelmatige herevaluatie van hun behandelplan.
Zoekfilter patiëntenperspectief
46. exp Consumer Participation/
47. ((patient or consumer*) adj3 (participat* or decisi* or decid*)).ti,ab.
48. "Patient Acceptance of Health Care"/
49. exp Attitude to Health/
50. *exp consumer satisfaction/ or patient preference/
51. "patient-focused".ti,ab.
52. "patient-centred".ti,ab.
53. (patient adj3 (attitude? or preference)).ti,ab.
54. "patient satisfaction".ti.
55. cooperative behavior/
56. exp self efficacy/ or self-efficacy.ti,ab.
57. exp Adaptation, Psychological/
58. coping.ti,ab.
59. ("self perception" or "self concept").ti,ab.
60. exp health education/ or patient education as topic/
61. exp attitude to health/ or health knowledge, attitudes, practice/
62. ("informed choice" or "shared decision making").ti,ab.
63. empowerment.tw.
64. ("focus group*" adj3 (patient* or parent* or famil* or spouse*)).ti,ab.
65. *"Quality of Life"/ or "Quality of Life"/px [Psychology]
66. (QoL or "Quality of life").ti.
67. Personal Autonomy/ or self concept/
68. consumer advocacy/ or freedom/
69. Needs Assessment/
70. Patient Advocacy/
71. Self-Help Groups/
72. Life Change Events/
73. Attitude to Death/
74. Patient-Centered Care/
75. exp Professional-Patient Relations/
76. Self Care/
77. self-management.ti.
78. ((patient* or consumer* or parent* or famil* or spouse*) adj (attitude* or involvement or desir* or
perspective* or activation or view* or preference*)).ti,ab.
79. "expert patient*".ti,ab.
80. or/45-79
81. exp Decision Making/
82. exp Communication/
83. Stress, Psychological/
84. Emotions/
85. vignette*.ti,ab.
86. or/81-85
87. exp Patients/px [Psychology]
88. (patient* or consumer*).ti.
89. 87 or 88
90. 86 and 88
91. "focus group*".ti,ab.
92. focus groups/ or narration/
93. qualitative.ti.
94. 91 or 92 or 93
95. 80 or 90 or 94
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
De richtlijn wordt digitaal verspreid onder alle relevante beroepsgroepen. Ook is de richtlijn te downloaden vanaf de website van de Richtlijnendatabase.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; AGREE Next Steps Consortium, 2009; www.agreecollaboration.org), dat een internationaal breed geaccepteerd instrument is en op ‘Richtlijn voor Richtlijnen’ van de Regieraad Kwaliteit van Zorg voor het ontwikkelen en implementeren van richtlijnen (www.cvz.nl).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse hebben de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij naar gewenste en ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als kritiek, belangrijk en onbelangrijk. Tevens definieerde de werkgroep voor zover mogelijk wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt is.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen in Medline (OVID) en in de databases van Guidelines International Network,Trip en van het National guideline clearinghouse (USA) en naar systematische reviews via Medline (OVID). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen met op voorhand opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in het hoofdstuk van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld met op voorhand opgestelde methodologische kwaliteitscriteria om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
Voor interventievragen:
de kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/) (Atkins et al., 2004).
Voor vragen over de waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose:
bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden. De bewijskracht van de conclusie is bepaald volgens de gebruikelijke EBRO-methode (Van Everdingen et al., 2004), waarbij de bewoording van de GRADE methode is gebruikt zoals hieronder weergegeven (tabellen 1 en 2).
Tabel 1. Methodologische kwaliteit van individuele studies volgens de EBRO-methode
|
Bewijs niveau |
Interventie |
Diagnostisch accuratesse onderzoek |
Schade of bijwerkingen, etiologie, prognose |
|
A1 |
Systematische review van min. 2 onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau |
||
|
A2 |
Gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang |
Onderzoek ten opzichte van een referentietest (‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van resultaten, met voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad |
Prospectief cohort onderzoek van voldoende omvang en follow-up, waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten. |
|
B |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (ook patiënt-controle onderzoek, cohort-onderzoek) |
Onderzoek ten opzichte van een referentietest, maar niet met alle kenmerken die onder A2 zijn genoemd |
Prospectief cohort onderzoek, maar niet met alle kenmerken als genoemd onder A2 of retrospectief cohort onderzoek of patiënt-controle onderzoek |
|
C |
Niet-vergelijkend onderzoek |
||
Tabel 2. Niveau van bewijskracht van de conclusie volgens de EBRO-methode
|
EBRO |
Conclusie gebaseerd op |
Bewoording |
|
Niveau 1 |
Onderzoek van niveau A1 of tenminste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2 |
Hoog |
|
Niveau 2 |
1 onderzoek van niveau A2 of tenminste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
Matig |
|
Niveau 3 |
1 onderzoek van niveau B of C |
Laag |
|
Niveau 4 |
Mening van deskundigen |
Zeer laag |
Formuleren van de conclusies
Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meer conclusies, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar een of meer artikelen, maar wordt deze getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs nog andere aspecten van belang, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische facetten. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting vermeld onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op zowel het beschikbare wetenschappelijke bewijs als op de belangrijkste overwegingen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg, zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur. Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende of bijkomende aspecten van de organisatie van zorg worden behandeld in de modules 'Randvoorwaarden (Organisatie van de zorg)'.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader of vervolg onderzoek staat in bijlage 'Kennislacunes'.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de deelnemers aan de patiënteninterviews, het Reumafonds, de Nederlandse Vereniging voor Jichtpatiënten (NVvJ) en de Nederlandse Vereniging voor Cardiologie (NVVC). De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.

