Cardiovasculair risicomanagement bij jicht
Uitgangsvraag
Wat is het optimale cardiovasculair risicomanagement bij patiënten met jicht of asymptomatische hyperurikemie? Deze uitgangsvraag omvat de volgende deelvragen:
1. Zijn jicht en hyperurikemie onafhankelijke risicofactoren voor hart- en vaatziekten? In hoeverre is de kans op een cardiovasculaire aandoening verhoogd bij patiënten met jicht of asymptomatische hyperurikemie?
2. Kan urinezuurverlagende therapie bij jicht of asymptomatische hyperurikemie het risico op hart- en vaatziekten verminderen?
Aanbeveling
Beschouw zowel hyperurikemie als jicht als risicofactor voor hart- en vaatziekten onafhankelijk van de traditionele cardiovasculaire risicofactoren.
Breng bij patiënten met jicht de traditionele cardiovasculaire risicofactoren in kaart.
Overweeg behandeling met allopurinol bij een patiënt met jicht met minder dan twee aanvallen per jaar en ontbrekende tophi en met een hoog risico op hart- en vaatziekten op basis van traditionele risicofactoren.
Overwegingen
Zijn jicht en hyperurikemie onafhankelijke risicofactoren voor hart- en vaatziekten? In hoeverre is de kans op een cardiovasculaire aandoening verhoogd bij patiënten met jicht of asymptomatische hyperurikemie?
Het is aannemelijk dat hyperurikemie en jicht risicofactoren zijn voor hart- en vaatziekten, onafhankelijk van de traditionele cardiovasculaire risicofactoren, alhoewel (residuele) confounding door metabool syndroom niet volledig kan worden uitgesloten. De geïncludeerde studies (Krishan; Kuo) suggereren dat jicht een sterkere risicofactor is dan hyperurikemie. Omdat in deze studies geen verschil in gemiddelde urinezuurconcentratie bestond tussen jichtpatiënten en patiënten met hyperurikemie is het waarschijnlijk dat ook andere factoren zoals chronische inflammatie bijdragen aan het verhoogde cardiovasculaire risico bij jicht.
Jicht is geassocieerd met een verhoging van het risico op cardiovasculaire mortaliteit bij mannen. Op grond van de sterkere associatie bij vrouwen dan bij mannen tussen hyperurikemie en het risico op mortaliteit door hartziekte (Fig. 7.2) of een beroerte (Fig. 7.4) is het aannemelijk dat jicht ook bij vrouwen de kans op een cardiale of cardiovasculaire gebeurtenis met dodelijke afloop verhoogt. Uit een recente publicatie blijkt dat jicht geassocieerd is met een toegenomen incidentie van hartfalen en een verhoogde mortaliteit ten gevolge van hartfalen ten opzichte van patiënten zonder jicht (Krishnan). Vanwege het lage aantal vrouwelijke deelnemers aan deze studie kan geen conclusie worden getrokken over een eventueel verschil in incidentie van hartfalen tussen mannelijke en vrouwelijke jichtpatiënten.
Kan urinezuurverlagende therapie bij jicht of asymptomatische hyperurikemie het risico op hart- en vaatziekten verminderen?
De literatuur zoekactie en systematische analyse bevestigen het in de inleiding genoemde gebrek aan onderzoeken, met name onderzoeken van hoge kwaliteit. Er zijn onvoldoende data om uitspraken te doen over het effect van urinezuurverlagende therapie op reductie van het risico op hart- en vaatziekten. Enkele cohortstudies suggereren dat allopurinol mogelijk het risico op hart- en vaatziekten en totale mortaliteit verlaagt bij patiënten met hyperurikemie, maar de bewijskracht is zeer laag. Ook is onduidelijk of het mogelijk beschermende effect van allopurinol het gevolg is van urinezuurverlaging per se of van andere biologische activiteiten van allopurinol. Allopurinol remt de oxidatie van low-density lipoprotein (LDL), een proces dat een belangrijke rol speelt in de ontwikkeling van atherosclerose; dit in tegenstelling tot benzbromaron (Tsutsumi et al., 2004). In een aantal kleine interventiestudies gaf remming van xanthine oxidase door allopurinol een verbetering van endotheelfunctie (Dawson et al., 2007). Bij patiënten met chronisch hartfalen en hyperurikemie resulteerde allopurinol behandeling in een verbetering van de vasodilatoire capaciteit en perifere doorbloeding, terwijl geen verbetering werd waargenomen bij patiënten met chronisch hartfalen zonder hyperurikemie (Doehner et al., 2002). Tenslotte bleek allopurinol een significante bloeddrukdaling te geven ten opzichte van placebo bij individuen met hyperurikemie (Kanbay et al., 2007; Feig et al., 2008). Mogelijk dragen bovengenoemde mechanismen bij aan een gunstig effect van allopurinol op het cardiovasculair risico. Gezien het bovenstaande acht de werkgroep het starten met allopurinol zinvol bij jichtpatiënten met een duidelijk verhoogd cardiovasculair risicoprofiel. Over andere urinezuurverlagende middelen (febuxostat of middelen met een ander werkingsmechanisme) zijn nog onvoldoende gegevens beschikbaar om een vergelijkbare aanbeveling te kunnen doen. In het algemeen is het aan te bevelen bij urinezuurverlagende behandeling te streven naar een serumurinezuur lager dan 0,36 mmol/l.
Wat is het optimale cardiovasculair risicomanagement bij patiënten met jicht of asymptomatische hyperurikemie?
Er zijn geen onderzoeken over het effect van behandeling van traditionele cardiovasculaire risicofactoren specifiek bij patiënten met hyperurikemie of jicht. Wel is onomstotelijk vastgesteld dat behandeling van deze factoren in een brede patiëntenpopulatie met verhoogd cardiovasculair risico het risico op een cardiovasculair event vermindert (NHG-standaard ‘Cardiovasculair risicomanagement’). Het is dan ook aannemelijk dat bij patiënten met hyperurikemie en jicht behandeling van onder andere hypertensie, dyslipidemie, obesitas en diabetes mellitus leidt tot een reductie van cardiovasculaire morbiditeit en mortaliteit.
Onderbouwing
Achtergrond
In de klinische praktijk wordt een duidelijke associatie gezien tussen hyperurikemie, jicht en traditionele risicofactoren voor hart- en vaatziekten zoals hypertensie, dyslipidemie, obesitas en diabetes mellitus. Daarbij lijken patiënten met jicht een verhoogd risico te hebben op hart- en vaatziekten. Hoe hoog dit risico daadwerkelijk is, is onvoldoende bekend. Onduidelijk is ook of het hebben van jicht of asymptomatische hyperurikemie een onafhankelijke risicofactor is, dat wil zeggen los van het risico veroorzaakt door associatie met traditionele risicofactoren voor hart- en vaatziekten. Tenslotte is een belangrijke vraag of urinezuurverlagende therapie het risico op hart- en vaatziekten verlaagt. Beantwoording van deze vragen kan mogelijk bijdragen aan het terugdringen van cardiovasculaire comorbiditeit bij patiënten met jicht of asymptomatische hyperurikemie. Daarnaast werd er in de patiënteninterviews (zie tabblad 'Verantwoording' onder kopje 'inbreng patientenperspectief') aangegeven dat er behoefte bestaat aan een betere voorlichting over cardiovasculaire risicofactoren bij jicht en aan meer aandacht voor primaire en secundaire preventie van hart- en vaatziekten.
De werkgroep benoemde de volgende uitkomstmaten als kritisch: dodelijke en niet-dodelijke cardiovasculaire gebeurtenissen (hartfalen [CHF], coronarialijden [CHD], cerebro-vasculair accident [CVA], transient ischemic attack [TIA], myocardinfarct [HI], nierinsufficiëntie [NI], perifeer vaatlijden). Daarnaast werd bij de tweede deelvraag totale mortaliteit als belangrijke uitkomstmaat benoemd.
Conclusies
Zijn jicht en hyperurikemie onafhankelijke risicofactoren voor hart- en vaatziekten? In hoeverre is de kans op een cardiovasculaire aandoening verhoogd bij patiënten met jicht of asymptomatische hyperurikemie?
|
Hoog |
Hyperurikemie is geassocieerd met een verhoging van het risico op cardiale mortaliteit bij vrouwen.
De kans op een cardiaal event met dodelijke afloop is bij vrouwen met hyperurikemie naar schatting 80% hoger dan bij personen met een vergelijkbaar cardiovasculair risicoprofiel maar zonder hyperurikemie.
Hyperurikemie is niet geassocieerd met een statistisch significante toename in het risico op cardiale mortaliteit bij mannen.
Hyperurikemie is niet geassocieerd met een statistisch significante toename in het risico op hartziekten (fataal plus niet-fataal) bij mannen of vrouwen.
Bronnen (A-1: Kim et al., 2010) |
|
Hoog |
Hyperurikemie is geassocieerd met een verhoging van het risico op een beroerte, bij zowel mannen als vrouwen.
De kans op een beroerte en mortaliteit als gevolg van een beroerte is bij personen met hyperurikemie naar schatting 30-50% hoger dan bij personen met een vergelijkbaar cardiovasculair risicoprofiel maar zonder hyperurikemie.
Bronnen (A-1: Kim et al., 2009) |
|
Hoog |
Jicht is geassocieerd met een verhoging van het risico op cardiovasculaire mortaliteit bij mannen.
Onduidelijk is in hoeverre jicht is geassocieerd met een verhoging van het risico op cardiovasculaire mortaliteit bij vrouwen.
De kans op een cardiaal of cardiovasculair event met dodelijke afloop is bij mannelijke patiënten met jicht naar schatting 40% hoger dan bij personen met een vergelijkbaar cardiovasculair risicoprofiel maar zonder jicht.
Bronnen (A-2: Krishnan et al., 2008; Choi et al., 2007; B: Kuo et al., 2010; Cohen et al., 2008) |
|
Matig |
Het is aannemelijk dat hyperurikemie en jicht risicofactoren zijn voor cardiovasculaire ziekten, onafhankelijk van de traditionele risicofactoren.
Bronnen (A-2: Krishnan et al., 2008; B: Kuo et al., 2010) |
|
Matig |
Het is aannemelijk dat jicht een sterkere risicofactor voor cardiovasculaire ziekten is dan hyperurikemie.
De combinatie van jicht en hyperurikemie lijkt het hoogste cardiovasculair risico met zich mee te brengen.
Bronnen (A-2: Krishnan et al., 2008) |
Kan urinezuurverlagende therapie bij jicht of asymptomatische hyperurikemie het risico op hart- en vaatziekten verminderen?
|
ZEER LAAG |
Allopurinol verlaagt mogelijk het risico op hart- en vaatziekten en totale mortaliteit bij patiënten met hyperurikemie.
Onduidelijk is of allopurinol het risico op hart- en vaatziekten en totale mortaliteit verlaagt bij patiënten met jicht.
Onduidelijk is of de effecten van allopurinol het gevolg zijn van de urinezuurverlagende werking of een andere biologische activiteit van allopurinol.
Bronnen (Wei et al., 2010; Luk et al., 2009) |
Samenvatting literatuur
Zijn jicht en hyperurikemie onafhankelijke risicofactoren voor hart- en vaatziekten? In hoeverre is de kans op een cardiovasculaire aandoening verhoogd bij patiënten met jicht of asymptomatische hyperurikemie?
De twee geïncludeerde systematische reviews analyseren uitsluitend de associaties van hyperurikemie met hart- en vaatziekten (Kim 2010 en 2009) en zijn aangevuld met één extra studie (Kuo). Een viertal van de geïncludeerde cohortstudies onderzoekt de associatie van jicht met hart- en vaatziekten (Kuo; Krishnan et al., 2012; Choi et al., 2007; Cohen et al, 2008). In twee van de laatstgenoemde studies worden de associaties van zowel hyperurikemie als jicht met hart- en vaatziekten geanalyseerd (Kuo; Krishnan).
Hyperurikemie als risicofactor
De meest recente systematische review van Kim (2010) gebruikt de incidentie van hartziekten (fataal plus niet-fataal) en cardiale mortaliteit als uitkomstmaat. De inclusiecriteria en belangrijkste karakteristieken van de zesentwintig geïncludeerde studies zijn te vinden in de evidence-tabel (zie bijlage 4). In vrijwel alle gevallen gaat het om prospectieve cohortstudies met volwassen mannen en vrouwen vrij van hartziekten op baseline. De studiegrootte varieert tussen duizend en negentigduizend en de studieduur tussen vijf en vijfentwintig jaar. De definitie van hyperurikemie varieert enigszins per studie met lagere cut-off waardes voor vrouwen dan mannen (zie evidence-tabel). Een meta-analyse werd mogelijk na exclusie van de studies waarin slechts beperkt werd gecorrigeerd voor traditionele HVZ risicofactoren. De resterende zeventien studies gebruikt in de meta-analyse hadden allen een maximale score op de Newcastle-Ottawa schaal (Wells et al., 2012) voor studiekwaliteit. De meta-analyses geven bij hyperurikemie een gering maar statistisch significant verhoogd risico te zien op hartziekten (multivariaat gecorrigeerd relatief risico, multivariaat RR; RR= 1,09; 95% BI= [1,03; 1,16]) en cardiale mortaliteit (Fig. 2; RR= 1,16 [1,01; 1,30]). Voor een onafhankelijk uitgevoerde meta-analyse, zie figuren 1 en 2. Door kleine verschillen in de gebruikte methodiek wijken de resultaten licht af van de gepubliceerde meta-analyse: risico op incidente hartziekte RR= 1,12 [1,05; 1,19] en risico op cardiale mortaliteit RR= 1,27 [1,08; 1,48]. Gemiddeld nam bij een stijging van serumurinezuur met 1mg/dl (59 µmol/l) het risico op mortaliteit door hartziekte toe met 12% (gebaseerd op vier studies; multivariaat RR=1,12 (95%BI= 1,05; 1,19]; Kim, 2010). Bij subgroepanalyses werd voor hyperurikemie bij mannen geen statistisch significant verhoogd risico op hartziekten of op cardiale mortaliteit waargenomen (respectievelijk, multivariaat RR= 1,04 [0,90; 1,17] en 1,09 [0,98; 1,19]) maar, voor cardiale mortaliteit, wel bij vrouwen (respectievelijk, multivariaat RR= 1,07 [0,82; 1,32] en 1,67 [1,30; 2,04]). In een multivariate meta-regressieanalyse was vrouwelijk geslacht geassocieerd met een verhoogd risico op cardiale mortaliteit bij hyperurikemie (p<0,001).
Figuur 7.1 Meta-analyse van de associatie tussen hyperurikemie en het risico op hartziekten (hazard ratio; random effects model). Door kleine verschillen in de methode van meta-analyse wijken de resultaten licht af van de gepubliceerde resultaten maar wordt dezelfde conclusie bereikt (vergelijk met Kim, 2010).
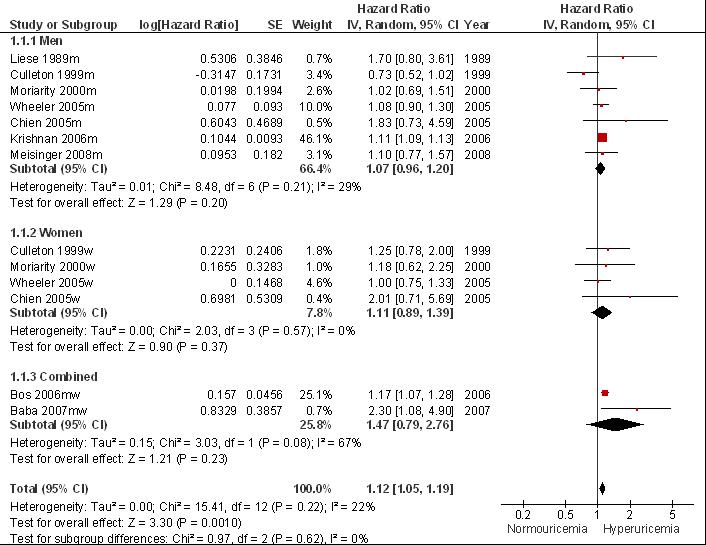
Figuur 7.2 Meta-analyse van de associatie tussen hyperurikemie en het risico op cardiale mortaliteit (hazard ratio; random effects model). Door kleine verschillen in de methode van meta-analyse wijken de resultaten licht af van de gepubliceerde resultaten maar wordt dezelfde conclusie bereikt (vergelijk met Kim, 2010).
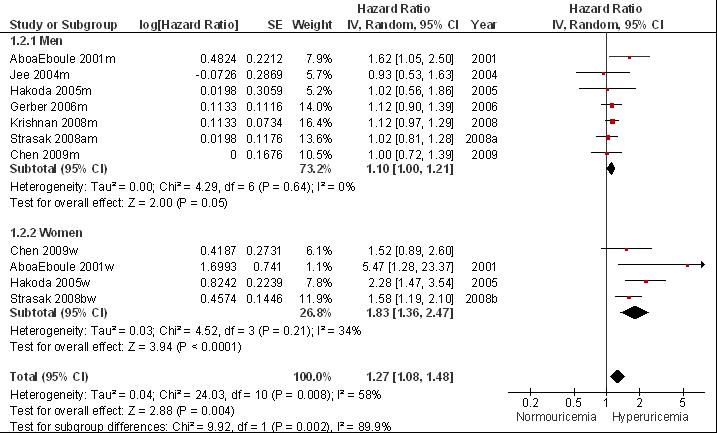
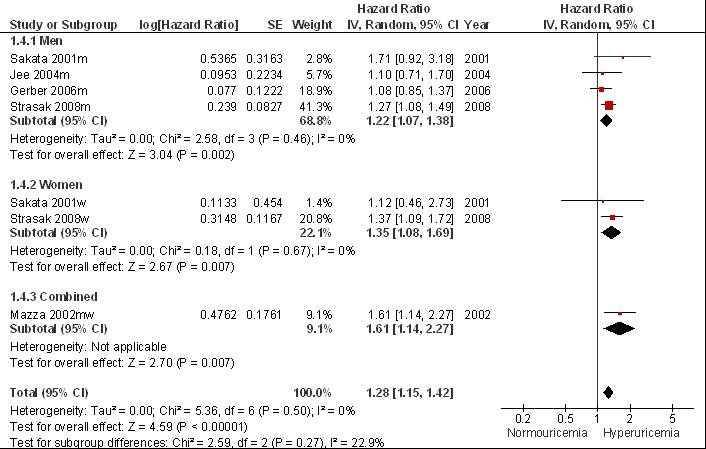
De tweede systematische review van Kim (2009) bestudeert de relatie tussen hyperurikemie en beroerte en includeert zestien prospectieve cohortstudies met volwassenen die niet eerder een beroerte hadden gehad (zie evidence-tabel). Meta-analyses van de tien studies waarin sprake was van afdoende correctie voor traditionele risicofactoren laat een aanzienlijk en statistisch significant verhoogd risico zien op (fatale plus niet-fatale) beroerte (multivariaat RR= 1,47 [1,19; 1,76]) en mortaliteit als gevolg van beroerte (multivariaat RR= 1,26 [1,12; 1,39]). Voor een onafhankelijk uitgevoerde meta-analyse, zie figuren 3 en 4. Door kleine verschillen in de gebruikte methodiek wijken de resultaten licht af van de gepubliceerde meta-analyse: risico op beroerte (fataal plus niet-fataal) RR= 1,50 [1,25; 1,81] en risico op mortaliteit als gevolg van beroerte RR= 1,28 [1,15; 1,42]. Bij subgroepanalyses worden geen grote verschillen waargenomen tussen mannen en vrouwen in het relatief risico bij hyperurikemie op beroerte (respectievelijk multivariaat RR= 1,42 [0,94; 1,90] en 1,42 [1,03; 1,80]; Kim, 2009) of mortaliteit door beroerte (respectievelijk multivariaat RR= 1,20 [1,05; 1,35] en 1,35 [1,04; 1,66]; Kim, 2009).
Bovenstaande systematische reviews dekken de periode 1980 tot juli 2008 en de literatuurselectie is uitgebreid met één studie (Kuo) gepubliceerd na juli 2008. Door het verschil in gebruikte uitkomstmaten kan deze studie niet worden toegevoegd aan de meta-analyses. De prospectieve cohortstudie uit Taiwan volgde ruim 67.000 deelnemers (mannen en vrouwen) aan een gezondheidsscreening programma gedurende 4,7 jaar en bestudeerde relaties tussen hyperurikemie en cardiovasculaire mortaliteit, kanker mortaliteit en totale mortaliteit. Na correctie voor een aantal cardiovasculaire risicofactoren was hyperurikemie niet geassocieerd met een statistisch significant verhoogd risico op cardiovasculaire mortaliteit (multivariaat RR= 1,08 [0,78; 1,51]). In een subgroepanalyse waarbij personen met verminderde nierfunctie (eGFR≤ 60ml/min/1.73m2) werden uitgesloten was er wel sprake van een significante associatie van hyperurikemie met een verhoogd risico op cardiovasculaire mortaliteit (multivariaat RR= 1.98 [1.03-3.82]). Er werden geen statistisch significante associaties waargenomen tussen hyperurikemie en totale mortaliteit of mortaliteit als gevolg van kanker. Bij de beoordeling van deze studie is van belang dat in de multivariate analyses niet is gecorrigeerd voor belangrijke cardiovasculaire risicofactoren zoals roken en alcoholconsumptie. De resultaten van Kuo (Kuo) geven dan ook geen aanleiding tot het heroverwegen van de resultaten van de eerdergenoemde systematische reviews (Kim, 2009 en 2010).
Figuur 7.3 Meta-analyse van de associatie tussen hyperurikemie en het risico op beroerte (hazard ratio; random effects model). Door kleine verschillen in de methode van meta-analyse wijken de resultaten licht af van de gepubliceerde resultaten maar wordt dezelfde conclusie bereikt (vergelijk met Kim, 2009).
Figuur 7.4 Meta-analyse van de associatie tussen hyperurikemie en het risico op mortaliteit als gevolg van een beroerte(hazard ratio; random effects model). Door kleine verschillen in de methode van meta-analyse wijken de resultaten licht af van de gepubliceerde resultaten maar wordt dezelfde conclusie bereikt (vergelijk met Kim et al, 2009).
Jicht als risicofactor
Een viertal van de geïncludeerde cohortstudies onderzoekt de associatie van jicht met hart- en vaatziekten (Kuo; Krishnan; Choi; Cohen et al., 2008).
In de eerder genoemde prospectieve cohortstudie van Kuo wordt na correctie voor een aantal cardiovasculaire risicofactoren (maar niet alle, zie opmerking eerder in de tekst) een aanzienlijk en statistisch significant verhoogd risico op cardiovasculaire mortaliteit waargenomen bij patiënten met jicht in vergelijking met personen met een normale serumurinezuur concentratie (multivariaat RR= 1.97 [1.08-3.59]). Een vergelijkbare associatie wordt gevonden tussen jicht en totale mortaliteit (multivariaat RR= 1.46 [1.12-1.91]). In deze studie werd de diagnose jicht (1311 patiënten, 2,1% van de studiepopulatie) gesteld op grond van kristalbewijs (26% jichtpatiënten), tenminste één ziekenhuisbezoek in verband met jicht (51%) of op grond van zelfrapportage (23%). Ook na exclusie van patiënten met zelfgerapporteerde jicht was jicht geassocieerd met een statistisch significant verhoogd risico op cardiovasculaire mortaliteit (multivariaat RR= 1.86 [1.01-3.44]). In een tweede subgroepanalyse waarbij personen met verminderde nierfunctie werden uitgesloten was er eveneens sprake van een statistisch significante associatie van jicht met een verhoogd risico op cardiovasculaire mortaliteit (multivariaat RR= 3.13 [2.13-61]).
In de prospectieve cohortstudie van Krishnan (uitsluitend mannen) met een aanzienlijk langere follow-up (17 jaar versus minder dan vijf jaar in Kuo) wordt na adequate correctie voor cardiovasculaire risicofactoren eveneens een statistisch significant verhoogd risico op cardiale mortaliteit waargenomen bij patiënten met jicht in vergelijking met patiënten zonder jicht (multivariaat RR= 1,35 [1,06; 1,72]). De associatie van jicht met cardiovasculaire mortaliteit is statistisch net niet significant (multivariaat RR= 1,21 [0,99; 1,49]). De diagnose jicht is hierbij gebaseerd op zelfgerapporteerde doktersdiagnose ‘jicht’ in combinatie met gedocumenteerde hyperurikemie.
In de tweede prospectieve cohortstudie (Choi et al., 2007) bij mannen en met een lange follow-up (12 jaar) wordt na adequate correctie voor cardiovasculaire risicofactoren een statistisch significante associatie van jicht waargenomen met een verhoogd risico op zowel cardiale mortaliteit (multivariaat RR= 1,55 [1,24; 1,93]), cardiovasculaire mortaliteit (multivariaat RR= 1,38 [1,15; 1,66]) als totale mortaliteit (multivariaat RR= 1,28 [1,15; 1,41]). De diagnose jicht werd hierbij gebaseerd op de zelfgerapporteerde doktersdiagnose ‘jicht’ op baseline. Bovenstaande analyse betrof personen vrij van hartziekten op baseline maar vergelijkbare resultaten werden bereikt in een aparte analyse van personen met een geschiedenis van hartziekten. Ook bleek dat een eerste diagnose jicht tijdens de studie (incidentie van jicht) was geassocieerd met een statistisch significant verhoogd risico op het krijgen van een hartinfarct (multivariaat RR= 1,59 [1,04; 2,41]).
Tot slot wordt in de retrospectieve cohortstudie van Cohen de associatie onderzocht tussen het optreden van een jichtaanval tijdens follow-up (variërend van twee tot zeven jaar) en cardiovasculaire mortaliteit bij patiënten (mannen en vrouwen) met eindstadium nierziekte (ESRD). In alle gevallen betrof het ESRD-patiënten bij de Noord-Amerikaanse zorgverzekeraar Medicare die startten met dialyse. De diagnose jicht werd gebaseerd op verzekeringsclaims geregistreerd in de database van Medicare. In deze studie is onduidelijk of er adequate correctie plaatsvindt voor traditionele hart- en vaatziekte risicofactoren. Het optreden van een jichtaanval tijdens follow-up was geassocieerd met een statistisch significant verhoogd risico op cardiovasculaire mortaliteit en totale mortaliteit (respectievelijk, RR= 1,47 [1,26; 1,59] en 1,49 [1,43; 1,55]).
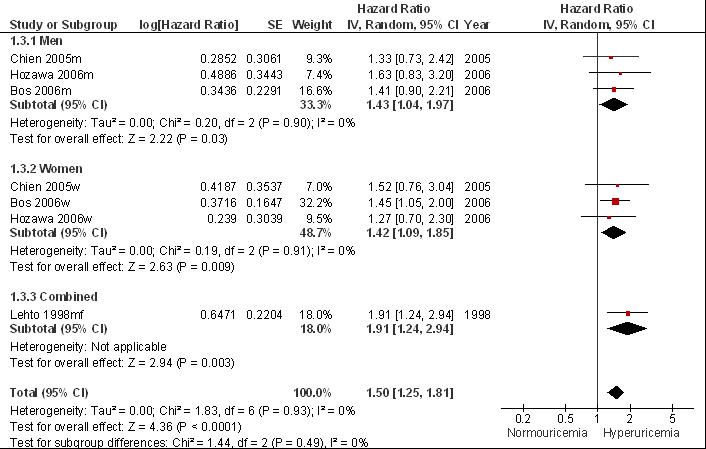
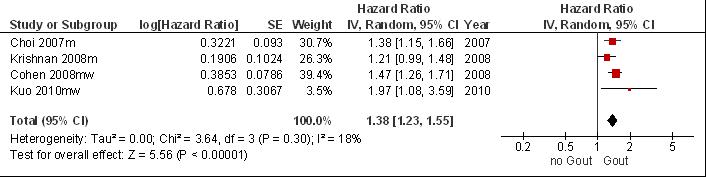
Bovenstaande studies laten grote verschillen zien in onderzoekskenmerken: verschillen tussen de studiepopulaties (cardiovasculair risico, comorbiditeiten); verschillen in lengte van de follow-up, in de definitie van hyperurikemie en in de diagnose van jicht. Als ondanks deze grote klinische heterogeniteit een meta-analyse wordt uitgevoerd (Fig. 7.5) verhoogt jicht het risico op cardiovasculaire mortaliteit met naar schatting 38% (pooled RR= 1,38 [1,23; 1,56]). Bij exclusie van de retrospectieve cohortstudie (Cohen et al., 2008) met lage studiekwaliteit is het geschatte relatief risico: pooled RR= 1.34 [1.13, 1.57]. Belangrijk om te vermelden is dat de diagnose jicht vrijwel nooit is gebaseerd op kristalbewijs en dat resultaten voor vrouwen grotendeels ontbreken. In twee studies worden ook vrouwen gevolgd maar worden alleen gecombineerde resultaten (Kuo) gerapporteerd of is onduidelijk of er voldoende is gecorrigeerd voor potentiële confounders (Cohen).
Figuur 7.5 Meta-analyse van de associatie tussen jicht en het risico op cardiovasculaire mortaliteit (hazard ratio; random effects model).
Jicht en hyperurikemie als onafhankelijke risicofactoren
In twee van de eerdergenoemde studies worden de associaties van zowel hyperurikemie als jicht met hart- en vaatziekten geanalyseerd (Kuo; Krishnan). In beide studies zijn de associaties van jicht met het risico op hart- en vaatziekten sterker dan de associaties van hyperurikemie met het risico op hart- en vaatziekten.
In de studie van Kuo is jicht geassocieerd met een aanzienlijk verhoogd risico op cardiovasculaire mortaliteit (multivariaat RR= 1.97 [1.08-3.59]) terwijl hyperurikemie niet associeert met een verhoogd risico (multivariaat RR= 1.08 [0.78-1.51]). Een vergelijkbaar beeld, met een veel sterkere associatie voor jicht dan hyperurikemie , ontstaat wanneer de analyse wordt beperkt tot personen met een normale nierfunctie (respectievelijk multivariaat RR= 3.13 [2.13-4.61] en 1.98 [1.03-3.82]). Hetzelfde geldt tenslotte voor de associaties van jicht en hyperurikemie met het risico op totale mortaliteit (respectievelijk multivariaat RR= 1,46 [1,12; 1,91] en 1,07 [0,94; 1,22]).
In de studie van Krishnan wordt in een sensitiviteitsanalyse een onderscheid gemaakt tussen personen met zelfgerapporteerde jicht maar zonder hyperurikemie en personen met zelfgerapporteerde jicht én hyperurikemie. Ten opzichte van personen zonder jicht en hyperurikemie blijkt dat het risico op cardiovasculaire mortaliteit toeneemt in de volgorde: hyperurikemie (multivariaat RR= 1.11 [0.98-1.27]), jicht (multivariaat RR= 1.19 [0.88-1.60]) en jicht én hyperurikemie (multivariaat RR= 1.30 [1.04-1.61]); alleen het laatstgenoemde relatief risico is statistisch significant. Een vergelijkbaar beeld ontstaat bij analyse van het risico op cardiale mortaliteit (respectievelijk multivariaat RR= 1.09 [0.93-1.29], 1.25 [0.88-1.78] en 1.43 [1.11-1.85]).
Bovenstaande resultaten suggereren dat hyperurikemie en jicht cardiovasculaire risicofactoren zijn, onafhankelijk van de traditionele risicofactoren, waarbij de combinatie van jicht en hyperurikemie het hoogste cardiovasculair risico met zich mee lijkt te brengen. Opnieuw geldt dat de diagnose jicht vrijwel nooit is gebaseerd op kristalbewijs en dat resultaten voor vrouwen grotendeels ontbreken. In de studie van Kuo worden weliswaar ook vrouwen gevolgd maar alleen gecombineerde resultaten gepresenteerd.
In hoeverre is de kans op een cardiovasculaire aandoening verhoogd bij patiënten met jicht?
Jicht is in twee studies (Krishnan et al., 2008; Choi et al., 2007) geassocieerd met een verhoging van cardiale mortaliteit van respectievelijk 35% (95% BI, 6-72) en 55% (95% BI, 24-93%). In een meta-analyse van vier studies blijkt jicht het risico op cardiovasculaire mortaliteit te verhogen met gemiddeld 38% (95% BI, 23-56%; zie Fig. 5). Gegevens specifiek voor vrouwen ontbreken. De kans op een cardiaal of cardiovasculair event met dodelijke afloop lijkt daarmee bij mannelijke patiënten met jicht ongeveer 40% hoger te zijn dan bij personen met een vergelijkbaar cardiovasculair risicoprofiel maar zonder jicht. Onduidelijk is of er bij vrouwen met jicht sprake is van een vergelijkbare verhoging in cardiovasculaire mortaliteit. Op grond van de sterkere associatie bij vrouwen dan bij mannen tussen hyperurikemie en het risico op mortaliteit door hartziekte (Fig. 7.2) of een beroerte (Fig. 7.4) is het aannemelijk dat jicht ook bij vrouwen de kans op een cardiaal of cardiovasculair event met dodelijke afloop met (tenminste) 40% verhoogt.
Bewijskracht
Voor de associaties tussen hyperurikemie en het risico op hart- en vaatziekten berust de bewijskracht op systematische reviews met meerdere onafhankelijke studies van hoge kwaliteit (EBRO-methode; A-1) en is derhalve de bewijskracht van de conclusies hoog (niveau-1). Voor de associaties tussen jicht en het risico op hart- en vaatziekten berust de bewijskracht op een viertal studies waaronder twee studies van hoge kwaliteit (A-2; zie tabel quality assessment) en is de bewijskracht eveneens hoog (niveau-1). Voor de vraag of de associatie van jicht met het risico op hart- en vaatziekten onafhankelijk is van hyperurikemie is de bewijskracht matig (niveau-2) omdat de bewijskracht berust op twee studies waarvan slechts één van hoge kwaliteit (A-2).
Kan urinezuurverlagende therapie bij jicht of asymptomatische hyperurikemie het risico op hart- en vaatziekten verminderen?
Bij deze interventievraag leverde de zoekactie twee relevante cohortstudies op (Wei et al., 2011; Luk et al., 2009); er werden geen geschikte RCT’s of systematische reviews gevonden.
De meest recente cohortstudie (Wei) maakt gebruik van een database waarin alle medische data worden verzameld van de volledige bevolking van Tayside, Schotland. De studie includeerde alle patiënten ouder dan 59 jaar waarbij een serumurinezuurmeting werd verricht in de periode 2000-2002 (voor meer details, zie evidence-tabel). Onder de 7.135 patiënten bevinden zich 1.093 (15%) patiënten die behandeld worden met urinezuurverlagende therapie, overwegend (95%) allopurinol. Aan het einde van de follow-up (minimum vijf jaar; mediaan 5,6 jaar) was er geen statistisch significant verschil in risico op hart- en vaatziekten (fataal plus niet-fataal) tussen allopurinol-gebruikers en patiënten die geen urinezuurverlagende therapie volgden. Na correctie voor traditionele cardiovasculaire risicofactoren en medicijngebruik (colchicine, NSAIDs, diabetes en cardiovasculaire medicatie) was het relatief risico (gebruiker versus niet-gebruiker): multivariaat RR= 1,10 [0,95; 1,26]. Hyperurikemie kwam even vaak (55%) voor onder gebruikers als niet-gebruikers. Opvallend is dat minder dan 50% van de allopurinol-gebruikers hun target serumurinezuur concentratie (6 mg/dl; 357 µmol/l) bereikten. Bij vergelijking van allopurinol-gebruikers met niet-gebruikers die tevens een normale serumurinezuur concentratie hadden werd opnieuw geen statistisch significant verschil waargenomen in hart- en vaatziekte risico (multivariaat RR= 1,07 [0,89; 1,28]). Wel werden aanmerkelijke verschillen waargenomen binnen de allopurinol-gebruikersgroep afhankelijk van de intensiteit van de medicatie. Bij vergelijking van dagelijkse allopurinol doses van 100 mg (referentie), 200 mg en >300 mg bleek het hart- en vaatziekte risico significant lager bij gebruik van de hoogste dosis (respectievelijk multivariaat RR= 1,00 [referentie], 1,01 [0,70; 1,45] en 0,69 [0,50; 0,94]). Een vergelijkbaar beeld ontstaat bij analyse van het totale mortaliteitsrisico (respectievelijk multivariaat RR= 1,00 [referentie], 0,92 [0,70; 1,21] en 0,75 [0,59; 0,94]). Bij het beoordelen van de resultaten van deze studie is het belangrijk om te constateren dat de controlegroep (niet-gebruikers) slecht is gedefinieerd, onduidelijk is waarom bij deze groep de serumurinezuur concentratie werd bepaald en waarom bij hyperurikemie geen urinezuurverlagende therapie werd ingesteld. Omdat de frequentie van jicht niet wordt gespecificeerd en jichtpatiënten niet afzonderlijk worden geanalyseerd blijft ook onduidelijk in hoeverre urinezuurverlagende therapie het cardiovasculair risico kan verlagen bij jichtpatiënten.
De Noord-Amerikaanse cohortstudie van Luk maakt gebruik van een medische database voor US veteranen en selecteert personen met een hoge serumurinezuur concentratie (≥ 7 mg/dl; ≥ 416 µmol/l) in de periode 2000 tot 2007. Binnen deze groep worden alle nieuwe allopurinol gebruikers (n= 2.483; 83% met diagnose jicht) vergeleken met willekeurig gekozen niet-gebruikers (n= 7.441; 20% met diagnose jicht). Aan het einde van de follow-up (gemiddeld 2,4 jaar) was er, na correctie voor traditionele cardiovasculaire risicofactoren en medicatie, sprake van een statistisch significant verlaagd mortaliteitsrisico in de allopurinol-gebruikersgroep (multivariaat RR= 0,77 [0,65; 0,91]. Bij het beoordelen van de resultaten van deze studie is het belangrijk te constateren dat het gaat om personen met hoog cardiovasculair risico, met name in de allopurinol-groep (Charlson index: 1,2 versus 0,7 in de controlegroep). Alleen totale mortaliteit werd geanalyseerd, oorzaakspecifieke mortaliteitsdata waren niet beschikbaar.
Bewijskracht
Bij beoordeling van de studies volgens GRADE is de bewijskracht zeer laag voor effecten van urinezuurverlagende therapie (allopurinol) op hart- en vaatziekten (morbiditeit en mortaliteit; kritische uitkomstmaten) en totale mortaliteit (belangrijke uitkomstmaat). De bewijskracht van de twee cohortstudies (Wei; Luk) is met één punt verlaagd vanwege indirectheid (slecht gedefinieerde controlegroep in één studie, indirecte uitkomstmaat in de tweede studie; voor beoordeling van de studiekwaliteit, zie tabel quality assessment).
Zoeken en selecteren
Voor deelvraag 1 (prognostische vraag) is met relevante zoektermen gezocht in de database Medline naar systematische reviews en cohortstudies vanaf 2000 waarin associaties van jicht en hyperurikemie met cardiovasculaire morbiditeit of mortaliteit zijn geanalyseerd. Zoekstrategieën zijn weergegeven in de tabel in de bijlage. De literatuurzoekactie leverden 141 treffers op. Studies zijn geselecteerd met de volgende criteria: origineel vergelijkend onderzoek bij volwassenen; associaties tussen jicht of hyperurikemie en cardiovasculaire ziekten; met cardiovasculaire events (CHF, CHD, CVA, TIA, HI, NI, perifeer vaatlijden) als uitkomstmaat. Voor de associatie tussen hyperurikemie en cardiovasculaire events zijn twee recente systematische reviews van goede kwaliteit (Kim et al., 2010 en 2009; zie tabel Quality assessment of systematic reviews) als uitgangspunt genomen. Deze systematische reviews includeerden prospectieve cohortstudies met volwassenen zonder CVD op baseline; een studieomvang van tenminste vijftig patiënten en een studieduur van tenminste één jaar. De systematische reviews dekken de periode 1980 tot juli 2008 en de literatuurselectie is uitgebreid met één studie (Kuo et al., 2010) gepubliceerd na juli 2008.
Voor deelvraag 2 (interventievraag) is gezocht, zonder beperking op studiedesign, in de databases Medline, Embase en Cochrane vanaf 2000 naar studies waarin de effecten van urinezuurverlagende therapie op cardiovasculaire morbiditeit of mortaliteit zijn onderzocht. De literatuurzoekactie leverde 110 treffers op. Studies zijn geselecteerd op basis van de volgende selectiecriteria: origineel vergelijkend onderzoek bij volwassenen; urinezuurverlagende therapie versus geen urinezuurverlagende therapie; met cardiovasculaire events (CHF, CHD, CVA, TIA, HI, NI, perifeer vaatlijden) en totale mortaliteit als uitkomstmaten.
Referenties
- Choi, H.K., & Curhan, G. (2007). Independent impact of gout on mortality and risk for coronary heart disease. Circulation, 116, 894-900.
- Cohen, S.D., Kimmel, P.L., Neff, R., Agodoa, L., & Abbott, K.C. (2008). Association of incident gout and mortality in dialysis patients. J Am Soc Nephrol., 19, 2204-10.
- Dawson, J., Quinn, T., & Walters, M. (2007). Uric acid reduction: a new paradigm in the management of cardiovascular risk? Curr Med Chem, 14, 1879-86.
- Doehner, W., Schoene, N., Rauchhaus, M., Leyva-Leon, F., Pavitt, D.V., Reaveley, D.A., ... Hambrecht, R. (2002). Effects of xanthine oxidase inhibition with allopurinol on endothelial function and peripheral blood flow in hyperuricemic patients with chronic heart failure: results from 2 placebo-controlled studies. Circulation., 105, 2619-24.
- Feig, D.I., Soletsky, B., & Johnson, R.J. (2008). Effect of allopurinol on blood pressure of adolescents with newly diagnosed essential hypertension: a randomized trial. JAMA, 300, 924-32.
- Kanbay, M., Ozkara, A., Selcoki, Y., Isik, B., Turgut, F., Bavbek, N., ... Covic, A. (2007). Effect of treatment of hyperuricemia with allopurinol on blood pressure, creatinine clearence, and proteinuria in patients with normal renal functions. Int Urol Nephrol., 39, 1227-33.
- Kim, S.Y., Guevara, J.P., Kim, K.M., Choi, H.K., Heitjan, D.F., & Albert, D.A. (2009). Hyperuricemia and risk of stroke: a systematic review and meta-analysis. Arthritis Rheum, 61, 885-92.
- Kim, S.Y., Guevara, J.P., Kim, K.M., Choi, H.K., Heitjan, D.F., & Albert, D.A. (2010). Hyperuricemia and coronary heart disease: a systematic review and meta-analysis. Arthritis Care Res (Hoboken), 62, 170-80.
- Krishnan, E. (2012). Gout and the risk for incident heart failure and systolic dysfunction. BMJ Open, 2, e000282.
- Kuo, C.F., See, L.C., Luo, S.F., Ko, Y.S., Lin, Y.S., Hwang, J.S., Lin, C.M., Chen, H.W., & Yu, K.H. (2010). Gout: an independent risk factor for all-cause and cardiovascular mortality. Rheumatology (Oxford), 49, 141-6.
- Luk, A.J., Levin, G.P., Moore, E.E., Zhou, X.H., Kestenbaum, B.R., & Choi, H.K. (2009). Allopurinol and mortality in hyperuricaemic patients. Rheumatology (Oxford), 48, 804-6.
- Tsutsumi, Z., Moriwaki, Y., Takahashi, S., Ka, T., & Yamamoto, T. (2004). Oxidized low-density lipoprotein autoantibodies in patients with primary gout: effect of urate-lowering therapy. Clin Chim Acta., 339, 117-22.
- Wei, L., Mackenzie, I.S., Chen, Y., Struthers, A.D., & MacDonald, T.M. (2011). Impact of allopurinol use on urate concentration and cardiovascular outcome. Br J Clin Pharmacol., 71, 600-607.
- Wells, G., Shea, A., OConnell, D., Peterson, J., Welch, J., Losos, M., & Tugwell, P. (2012). The Newcastle-Ottawa Scale (NOS) for Assessing the Quality of Nonrandomised Studies in Meta-analyses. Ottawa: Ottawa Hospital Research Institute. Geraadpleegd via: http://www.ohri.ca/programs/clinical_epidemiology/oxford.asp, op 20 september 2012.
Evidence tabellen
Quality assessment voor systematic reviews
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Research question: Are gout and hyperuricemia independent risk factors for cardiovascular disease?
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/ no/ unclear |
Comprehensive and systematic literature search?2
Yes/ no/ unclear |
Description of included and excluded studies?3
Yes/ no/ unclear |
Description of relevant characteristics of included studies?4
Yes/ no/ unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/ no/ unclear/ notapplicable |
Assessment of scientific quality of included studies?6
Yes/ no/ unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/ no/ unclear |
Potential risk of publication bias taken into account?8
Yes/ no/ unclear |
Potential conflicts of interest reported?9
Yes/ no/ unclear |
|
Kim et al, 2010 |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Unclear |
|
Kim et al, 2009 |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Unclear |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Methodology checklist – prognostic studies
(The criteria used in this checklist are adapted from: Altman DG (2001). Systematic reviews of evaluations of prognostic variables. In: Egger M, Smith GD, Altman DG (eds.). Systematic reviews in health care. London: BMJ Books; Laupacis A, Wells G, Richardson WS, Tugwell P (1994). Users' guides to the medical literature. How to use an article about prognosis. Evidence-Based Medicine Working Group. JAMA,272:234-7)
Research question: Are gout and hyperuricemia independent risk factors for cardiovascular disease?
|
Study reference
(first author, year of publication) |
Was there a representative and well-defined sample of patients at a similar point in the course of the disease?
(yes/ no/ unclear) |
Was follow-up sufficiently long and complete?
(yes/ no/ unclear) |
Was the outcome of interest defined and adequately measured?
(yes/ no/ unclear) |
Was the prognostic factor of interest defined and adequately measured?
(yes/ no/ unclear) |
Was loss to follow-up / incomplete outcome data described and acceptable?
(yes/ no/ unclear) |
Was there statistical adjustment for all important prognostic factors?
(yes/ no/ unclear) |
Level of evidence
|
|
Krishnan 2008 |
Yes*1 |
Yes |
Yes |
Yes*2 |
Unclear*3 |
Yes |
A2 |
|
Choi 2007 |
Yes*4 |
Yes |
Yes |
Yes*5 |
Unclear*3 |
Yes |
A2 |
|
Kuo 2010 |
Yes |
Unclear*6 |
Yes |
Yes |
Unclear*3 |
No*7 |
B |
|
Cohen 2008 |
Yes*8 |
Unclear |
Yes |
Unclear*9 |
Unclear*3 |
Unclear |
B |
Footnotes:
*1middle-aged men with high CVD risk
*2three definitions used for gout; none of them based on crystal-proof
*3not described, but likely to be low
*4men only
*5two definitions used for gout; not based on crystal-proof
*6less than 5 years follow-up
*7potentially important confounders such as smoking are not adjused for
*8patients with end-stage renal disease (ESRD) starting with long-term dialysis
*9based on Medicare claim for treatment of gout (not verified)
Methodology checklist – intervention studies (observational)
Research question: Does urate lowering therapy reduce cardiovascular risk in patients with gout?
|
Study reference
(first author, year of publication) |
Was there a representative and well-defined sample of patients at a similar point in the course of the disease?
(yes/ no/ unclear) |
Was follow-up sufficiently long and complete, and similar for all treatments?
(yes/ no/ unclear) |
Was the outcome of interest defined and adequately measured?
(yes/ no/ unclear) |
Were the treatments of interest adequately defined?
(yes/ no/ unclear) |
Was loss to follow-up / incomplete outcome data described and acceptable?
(yes/ no/ unclear) |
Was there statistical adjustment for all important prognostic factors?
(yes/ no/ unclear) |
Other limitations?
(yes/ no/ unclear) |
|
Wei et al, 2011 |
No*1 |
Yes*2 |
Yes |
Yes |
Yes |
Yes |
No |
|
Luk et al, 2009 |
No*3 |
Unclear |
Yes |
Unclear |
Unclear |
Yes |
Yes*4 |
*1 cohort of patients from a particular region (Tayside, Scotland) aged ≥60 years who had urate measurements (reasons for urate measurements unclear)
*2 <6 years but sufficient due to high event rate
*3 all patients had hyperuricemia, but not all were diagnosed with gout
*4 all cause mortality data, no data on CVD
Research question: Are gout and hyperuricemia independent risk factors for cardiovascular disease?
|
Study reference |
Study characteristics |
Patient characteristics |
Prognostic factor(s) |
Follow-up
|
Outcome measures and effect size |
Level of evidence
|
Comments |
|
Kim et al, 2010
[individual study characteristics deduced from Kim et al, 2010; with corrections if required]
|
Type of study: Systematic review; prospective cohort studies (except Wheeler, 2005, [I] which is a nested case-control study)
Literature search 1980 – Feb 2009
CHD incidence or CHD mortality in relation to serum uric acid levels: total 26 studies included
CHD-incidence 13 studies A: Cremer, 1994 B: Freedman, 1995 C: Goldberg, 1995 D: Liese, 1999 E: Culleton, 1999 F: Moriarity, 2000 G: Puddu, 2001 H: Chien, 2005 I: Wheeler, 2005 J: Bos, 2006 K: Krishnan, 2006 L: Baba, 2007 M: Meisinger, 2008
CHD-mortality 13 studies N: Persky, 1979 O: Levine, 1989 P: Fang, 2000
Country: Europe NL: J Belgium: R Germany: A,D,M Italy: G Austria: X,Y Iceland: I Greece: V Israel: U USA B,C,E,F,K,N,O,P,W Asia Japan: L,Q,T Korea: S Taiwan: H,Z |
Inclusion criteria: prospective cohort studies; CHD incidence or mortality in relation to serum uric acid levels; adult patients; > 1 year followup; >99 subjects; inception cohort free of CHD
Exclusion criteria: interventional and secondary prevention trials
N, age, (% men)
A: 5728, 40-60 (100) B: 5421, 25-74 (46) C: 2710, 55-64 (100) D: 960, 45-64 (100) E: 6763, 47±15 (45) F: 13504, 45-64 (44) G: 2469, 35-74 (45) H: 3602, ≥35 (-) I: 6042, 56±9 (70) J: 4385, ≥55 (35) K: 12866, 46±6 (100) L: 2024, 63±9 (38) M: 3424, 45-74 (100)
N: 7804, 45-64 (54) O: 4825, 45-64 (0) P: 5926, 25-74 (46)
|
Hyperuricemia; definition in mg/dl (M, men; W, women) A: 6.5 B: 7 C: 6.8 D: 6.3 E: 6.8 (M), 5.3 (W) F: 7.6 (M), 6.3 (W) G: 7.3 H: 7.7 (M), 6.6 (W) I: 5.7 (M), 4.7 (W) J: 6.4 (M), 5.4 (W) K: 7.0 L: 7.0 M: 6.6
N: 7.0 (M), 6.0 (W) O: per 1 mg/dl P: per 1 mg/dl; 7.0 (M), 5.6 (W) U: 5.6
Variables adjusted for None: A,N Only age: C,Q Multivariate: B,D-M,O,P,R-Z
Most multivariate models adjust for traditional CHD risk factors such as age, sex, hypertension, diabetes mellitus, smoking, and hypercholesterolemia (for details see evidence table in Kim et al, 2010)
|
Endpoint of follow-up: in years (no. of events, M/W) A: 5 (107) B: 13.5 (403/286) C: 23 (352) D: 8 (55) E: 17.4 (394/223) F: 8 (264/128) G: 6 (68/41) H: 8.5 (86) I: 17.5 (2080) J: 8.4 (515) K: 6.5 (1108) L: 8 (49) M: 11.7 (297)
N: 5 (48/7) O: 11.5 (23) P: 16.4 (222/172) U: 23 (830)
|
Incident coronary heart disease (CHD), and CHD mortality; RR [95%CI]
Mostly based on ICD codes on medical records and death certificates
Meta-analysis of fully adjusted RRs (random effects model); these studies had a maximum score for study quality (see comments)
CHD-incidence (A-M) 9 studies fully adjusted for traditional CHD risk factors (D,E,F,H,I,J,K,L,M)
Men (7 studies) D: 1.70 [0.80-3.30] E: 0.73 [0.52-1.02] F: 1.02 [0.69-1.51] H: 1.83 [0.73-4.56] I: 1.08 [0.90-1.31] K: 1.11 [1.09-1.15] M: 1.10 [0.77-1.57] Subtotal:1.04 [0.90-1.17] I2 = 42%; p=0.11 Women (4 studies) E: 1.25 [0.78-2.02] F: 1.18 [0.62-2.26] I: 1.00 [0.75-1.33] H:2.01 [0.71-5.70] Subtotal:1.07 [0.82-1.32] I2 = 0%; p=0.76 Combined (2 studies) J: 1.17 [1.07-1.28] L: 2.30 [1.08-4.89] Subtotal:1.32 [0.57-2.07] I2 = 26%; p=0.21
Heterogeneity groups: p=0.42 (NS) Overall: 1.09 [1.03-1.16] I2 = 18%; p=0.27
CHD-mortality (N-Z) 8 studies fully adjusted for traditional CHD risk factors (R,S,T,U,W,X,Y,Z)
Men (7 studies) R: 1.62 [1.05-2.50] S: 0.93 [0.53-1.61] U: 1.12 [0.90-1.36] T: 1.02 [0.56-1.74] X: 1.02 [0.81-1.27] W: 1.123 [0.97-1.31] Z: 1.00 [0.72-1.40] Subtotal: 1.09 [0.98-1.19] I2 = 0%; p=0.78 Women (4 studies) R: 5.47 [1.28-23.26] T: 2.28 [1.47-3.45] Y: 1.58 [1.19-2.10] Z: 1.52 [0.89-2.59] Subtotal: 1.67 [1.30-2.04] I2 = 0%; p=0.54
Heterogeneity groups: p=0.003 Overall: 1.16 [1.01-1.30] I2 = 29%; p=0.17
CHD-mortality (N-Z) – per 1mg/dl UA 4 studies fully adjusted, and data available per 1 mg/dl increase in uric acid (O,P,V,Z)
Men (2 studies) P: 1.17 [1.06-1.28] V: 1.03 [0.92-1.15] Subtotal: 1.10 [0.96-1.24] I2 = 66%; p=0.09 Women (3 studies) O: 1.18 [0.78-1.78] P: 1.30 [1.17-1.45] V: 1.05 [0.93-1.18] Subtotal: 1.17 [0.97-1.38] I2 = 71%; p=0.03 Combined (1 study) Z: 1.10 [1.06-1.14]
Heterogeneity groups: p=0.48 Overall: 1.12 [1.05-1.19] I2 = 56%; p<0.05 |
Study quality determined using Newcastle-Ottawa scale (selection study groups [0–4 points], comparability study groups [0–2 points], ascertainment outcome [0–3] ): 22 studies (85%) had maximum score (4/2/3); 2 studies scored 4/0/3 (A,N), and 2 studies scored 4/1/3 (C,Q); all studies in the meta-analysis had a maximum score for study quality; there was some evidence for publication bias for both outcome measures
Level of evidence: A1
|
26 studies included, 13 for CHD incidence, 13 for CHD mortality; 9 studies for CHD incidence, and 8 studies for CHD mortality were fully adjusted for traditional CHD risk factors
Authors conclude that hyperuricemia may marginally increase the risk of CHD events, independently of traditional CHD risk factors; a more pronounced increased risk for CHD mortality in women should be investigated in future research; the effects of urate-lowering therapy on cardiovascular disease should be studied
Hyperuricemia was associated with an increased risk of CHD incidence of 1.09 [1.03–1.16] and 1.16 [ 1.01–1.30] for CHD mortality; for each increase of 1 mg/dl in uric acid level, the pooled multivariate RR for CHD mortality was 1.12 (95% CI 1.05–1.19); subgroup analyses showed no significant association between hyperuricemia and CHD incidence/mortality in men, but an increased risk for CHD mortality in women (RR 1.67 [1.30–2.04])
Sensitivity analyses: multivariate meta–regression analysis indicated that none of the covariates, sex, year of publication, ethnicity (Asian versus non-Asian), study location, and cutoff levels defining hyperuricemia, modified the association between hyperuricemia and CHD risk; however, earlier publication year (P<0.002) and female sex (P<0.001) were significantly associated with a greater risk estimate for CHD mortality
Results are consistent with previous meta-analysis of 16 observational studies (Wheeler et al, 2005), showing pooled RR of 1.13 [1.07–1.20], RR for CHD was 1.12 [1.05–1.19] in men and 1.22 [1.05–1.40] in women |
|
Kim et al, 2009
[individual study characteristics deduced from Kim et al, 2009; with corrections if required]
|
Type of study: Systematic review; prospective cohort studies
Literature search 1980 – July 2008
Stroke incidence or stroke mortality in relation to serum uric acid levels: total 16 studies included (one study reports both incidence and mortality)
A: Tofuku, 1978 B: Takagi, 1982 C: Kagan, 1985 D: Lehto, 1998 E: Chien, 2005 F: Bos, 2006 G: Hozawa, 2006 H: Baba, 2007 I: Tomita, 2000 J: Sakata, 2001 K: Mazza, 2002 L: Jee, 2004 M: Gerber, 2006 N: Bae/Hyun, 2007 O: Strasak, 2008a P: Strasak, 2008b Country: Europe Finland: D NL: F Italy: K Israel: M USA: C,G Asia Japan: A,B,H,I,J Korea: L,N Taiwan: E, Australia: O,P |
Inclusion criteria: prospective cohort studies; CHD incidence or mortality in relation to serum uric acid levels; adult patients; > 1 year followup; >49 subjects; inception cohort free of stroke*
*except Mazza, 2002 (L) with some (<10%) having history of stroke
Exclusion criteria: interventional and secondary prevention trials
N, age, (% men)
A: 153, 16-77 (75) B: 314, 50-79 (100) C: 7895, 45-68 (100) D: 1017, 45-64 (54) E: 3602, 35+ (47) F: 4385, 63-76 (35) G: 13413, 45-64 (46) H: 2024, 63 (39) I: 49413, 25-60 (100) J: 8172, 50 (44) K: 3282, 65+ (39) L: 22698, 30-77 (100) M: 9125, 49 (100) N: 660, 59 (57) O: 83683, 41.6 (100) P: 28613, 62.3 (0) |
Hyperuricemia; definition in mg/dl (M, men; W, women) A: ≥7 B: ≥7.5 C: ≥7.2 D: ≥5 E: ≥7.7 (M), ≥6.6 (W) F: ≥6.4 (M), ≥5.4 (W) G: ≥6.9 H: ≥7 I: ≥8.5 J: ≥6.5 (M), ≥5.0 (W) K: ≥6.4 L: ≥7.01 M: ≥5.6 N: ≥6.1 (M), ≥5.1 (W) O: ≥6.7 P: ≥5.4
Variables adjusted for None: A,B,H,N Only age: C,I Multivariate: D-G,J-M,O,P
Most multivariate models adjust for known risk factors such as age, hypertension, diabetes mellitus, and cholesterol (for details see evidence table in Kim et al, 2009)
|
Endpoint of follow-up: in years (no. of events, M/W) A: 3.7 (4) B: 8 (30) C: 10 (163) D: 7.2 (114) E: 11 (155) F: 8.4 (381) G: 12.6 (381) H: 8 (84) I: 5.4 (127) J: 13.3 (174) K: 14 (170) L: 6.5 (192) M: 23 (292) N: 2.3 (12) O: 12.4 (645) P: 13.6 (776)
|
Incident stroke, and stroke mortality; RR [95%CI]
Mostly based on ICD-9 codes and hospital records, and death certificates (occasionally also on CT/MRI)
Meta-analysis of fully adjusted RRs (random effects model); these studies had a maximum score for study quality, except study-D with 1 point deducted for study group selection (see comments)
Stroke-incidence 4 studies fully adjusted for traditional CHD risk factors (D,E,F,G)
Men (3 studies) E: 1.33 [0.73-2.42] F: 1.41 [0.90-2.23] G: 1.63 [0.83-3.19] Subtotal:1.42 [0.94-1.90] I2 = 0%; p=0.92 Women (3 studies) E: 1.52 [0.76-3.06] F: 1.45 [1.05-2.01] G: 1.27 [0.70-2.30] Subtotal:1.42 [1.03-1.80] I2 = 0%; p=0.92 Combined (1 studies) D: 1.91 [1.24-2.94]
Heterogeneity groups: p=0.56 (NS) Overall: 1.47 [1.19-1.76] I2 = 0%; p=0.96
Stroke-mortality 6 studies fully adjusted for traditional CHD risk factors (J,K,L,M,O,P)
Men (4 studies) J: 1.71 [0.92-3.17] L: 1.10 [0.71-1.72] M: 1.08 [0.85-1.37] O: 1.27 [1.08-1.49] Subtotal: 1.20 [1.05-1.35] I2 = 0%; p=0.54 Women (2 studies) J: 1.12 [0.46-2.74] P: 1.37 [1.09-1.74] Subtotal: 1.35 [1.04-1.66] I2 = 0%; p=0.68 Combined (1 studies) K: 1.61 [1.14-2.10]
Heterogeneity groups: p=0.22 (NS) Overall: 1.26 [1.12-1.39] I2 = 0%; p=0.50 |
Study quality determined using Newcastle-Ottawa Scale (selection study groups [0–4 points], comparability study groups [0–2 points], ascertainment outcome [0–3] ): A: 3/0/2 B: 4/0/3 C: 4/1/3 D: 3/2/3 E: 4/2/3 F: 4/2/3 G: 4/2/3 H: 3/0/3 I: 4/1/3 J: 4/2/3 K: 4/2/3 L: 4/2/3 M: 4/2/3 N: 3/0/2 O: 4/2/3 P: 4/2/3 9 studies (56%) had maximum score (4/2/3); all but 1 study in the meta-analysis had a maximum score for study quality; there was no statistical evidence for publication bias for both outcome measures
Level of evidence: A1 |
16 studies included, 4 studies for stroke incidence, and 6 studies for stroke mortality were fully adjusted for known risk factors
Authors conclude that hyperuricemia may modestly increase the risk of stroke incidence and mortality; the role of urate-lowering therapy in stroke should be studied
Hyperuricemia was significantly associated with both stroke incidence (4 studies; RR 1.47 [1.19-1.76]) and mortality (6 studies; RR 1.26 [1.12-1.39]); the pooled estimate of multivariate RRs did not differ significantly by sex
Sensitivity analyses: multivariate meta–regression analysis indicated that none of the covariates, sex, year of publication, or race, modified the association between hyperuricemia and stroke risk
|
|
Kuo et al, 2010
[more recent than search date in Kim et al, 2010]
|
Type of study: prospective cohort study
Country and setting: Health screening programme; ChangGungMemorialHospital; Taiwan
2000-2006, 67570 subjects, 30-74 years; 6043 excluded (incomplete data or repeated visits); 61527 included: 34126 men (55.5%), 27401 women (44.5%)
Source of funding: non-commercial; authors have declared no conflicts of interest
|
Inclusion criteria: Participants of health screening programme at CGMH between 2000-2006
Exclusion criteria: Incomplete data or repeated visits (?)
67,570 subjects; 6,043 excluded; 61,527 left
N, age, (% men) 61 527, 30-74 (55)
Gout diagnosis Criteria 1, 2, or 3; (1) crystal proof; (2) ≥1 visits to CGMH outpatient department due to gout; (3) self-report
1311 with gout: 339 crystal proof 667 recorded gout 305 self-reported
Other characteristics HU: 19.8% Gout: 2.1% SU: 6.9 (M); 5.4 (W) |
Gout Hyperuricemia
Gout: criteria 1, 2, or 3; (1) crystal proof; (2) ≥1 visits to CGMH outpatient department due to gout; (3) self-report
Hyperuricemia: SU >7.7 mg/dl in males or >6.6 mg/dl in women
Variables adjusted for Multivariate; study groups, age, gender, component numbers of metabolic syndrome, and proteinuria
|
Endpoint of follow-up: 56 months (4.7 years)
National Death Registry through Dec 2007
N (%): not mentioned (probably low); 6043 of 67570 were excluded (8.9%)
Reasons for incomplete outcome data described? Not mentioned
|
CVD mortality; Cancer mortality, and death from all causes; HR [95%CI]
Definition outcome: National Death Registry; all causes (ICD-9: 001–998), cancer(140–239), CVD mortality (390–459)
Total mortality: 1383 (2.2% of participants)
CVD-mortality (198=14.3% total) No HU: 1 [ref] HU: 1.08 [0.78-1.51] Gout: 1.97 [1.08-3.59]
Subgroup with eGFR >60ml/min/1.73m2 No HU: 1 [ref] HU: 1.98 [1.03-3.82] Gout: 3.13 [2.13-4.61] Note that upper limit CI is corrected to 4.61 (stated as 61 in Kuo et al, 2010)
Total mortality (1383=100%) No HU: 1 [ref] HU: 1.07 [0.94-1.22] Gout: 1.46 [1.12-1.91]
Subgroup with eGFR >60ml/min/1.73m2 No HU: 1 [ref] HU: non-significant association Gout: 1.47 [1.09-1.97]
No statistically significant associations of gout or HU with cancer mortality
|
Study quality: see Table of quality assessment
Level of evidence: B
Relatively short follow-up; incomplete adjustment for potential confounders (e.g. smoking, alcohol); lack of details on subgroup analyses on eGFR (note broad CIs); study on both men and women |
Authors conclude that gout, but not hyperuricaemia, associates with a higher risk of death from all causes and cardiovascular diseases
Note: study on both men and (!) women
Note: relatively low % of deaths are due to CVD (low risk population)
Compared with normo-uricaemia, HRs of all-cause mortality were 1.46 [1.12- 1.91] for individuals with gout and 1.07 [ 0.94- 1.22] for those with HU; HRs of CVD mortality were 1.97 [1.08-3.59] for individuals with gout and 1.08 [ 0.78- 1.51] for those with HU
Risk of all-cause or CVD mortality for gout remained unchanged when limiting the data to those with an estimated glomerular filtration of >60 ml/min/1.73m2
Sensitivity analysis: exclusion of self-reported gout did not affect the results; HRs of gout subjects for all-cause and CVD were 1.51 [1.14-1.99], and 1.86 [1.01-3.44],respectively, when comparing with normouricaemia subjects |
|
Krishnan et al, 2008 |
Type of study: prospective cohort study
Country and setting: multi-centre; USA
12 866 men were originally randomized into MRFIT; 9105 men were alive and free of CVD at sixth annual examination = study baseline of this follow-up study
N=9105
Source of funding: non-commercial |
Participants that completed the MRFIT trial (1973-1982), which tested effectiveness of intervention programme (smoking cessation, cholesterol management through dietary control, and blood pressure control) against usual care
Inclusion criteria: MRFIT inclusion criteria: no evidence of clinical CVD, and Framingham risk scoreindicating above-average CHD risk; additional criteria: free of following events during the 6-year trial: nonfatal MI, nonfatal stroke, bypass surgery, peripheral vascular disease, intermittent claudication or angina pect., LV hypertrophy, cong. heart failure, accel. hypertension, and acute renal failure
N, age, (% men) 9105, 41-63 (100)
Gout diagnosis Def-1: 7.2% (=655) Def-2: 9.5% Def-3: 10.6%
Other characteristics Mean (SD) UA: 6.8 (1.2) mg/dl |
Gout Hyperuricemia (HU)
Definition hyperuricemia: mean serum UA ≥ 7.0 mg/dL over all 6 study visits
Definition gout: 3 definitions
Definition-1: affirmative answer to question, “Have you been told by your physician that you have gout?”, plus documentation of hyperuricemia
2 alternative definitions used in sensitivity analysis:
Definition-2: use of any gout-specific medication (allopurinol, probenecid, or colchicine) in 5 years preceding “study baseline” irrespective of gout diagnosis or uric acid level
Definition-3: self-reported physician diagnosis of gout without regard to uric acid level
Note: crystal proof was not feasible because participants seldom presented at a study visit with acute gouty arthritis
Variables adjusted for Multivariate; clinical center, age, systolic BP, diastolic BP, LDL and HDL cholesterol, TAG, creatinine, fasting glucose, cigarettes per day, family history acute MI, aspirin use, diuretic use, alcohol, and bmi
|
Endpoint of follow-up: 17 years
For how many participants were no complete outcome data available? N (%): not mentioned (likely to be low)
Reasons for incomplete outcome data described? Not mentioned
|
CVD mortality; CHD mortality, and death from acute MI; HR [95%CI]
Definition outcome: ICD-9 (ICD-10) codes on death certificates; CVD=390-459; CHD= 410 - 414 and 429.2; acute MI=410
Total mortality: 2752 (30% of participants)
CVD- mortality (1241=45% total) No HU: 1 [ref] HU: 1.13 [0.99-1.27]
No gout (def-1) : 1 [ref] Gout (def-1): 1.21 [0.99-1.49]
No gout (def-2): 1 [ref] Gout (def-2): 1.18 (p=0.08)
No HU/gout (def-3) : 1 [ref] HU alone: 1.11 [0.98-1.27] Gout alone: 1.19 [0.88-1.60] Gout + HU: 1.30 [1.04-1.61]
CHD-mortality (833=30.3%) No HU: 1 [ref] HU: 1.12 [0.97-1.31]
No gout (def-1) : 1 [ref] Gout (def-1): 1.35 [1.06-1.72]
No gout (def-2): 1 [ref] Gout (def-2): 1.26 (p=0.03)
No HU/gout (def-3) : 1 [ref] HU alone: 1.09 [0.93-1.29] Gout alone: 1.25 [0.88-1.78] Gout + HU: 1.43 [1.11-1.85]
MI-mortality (360=13.1%) No HU: 1 [ref] HU: 1.06 [0.84-1.34]
No gout (def-1) : 1 [ref] Gout (def-1): 1.35 [0.94-1.93]
No gout (def-2): 1 [ref] Gout (def-2): 1.31 (p=0.10)
No HU/gout (def-3) : 1 [ref] HU alone: 1.04 [0.81-1.33] Gout alone: 1.40 [0.83-2.35] Gout + HU: 1.40 [0.96-2.06] |
Study quality: see Table of quality assessment
Level of evidence: A2
study was performed in men who are at high risk for CHD; extrapolation to general population should be done cautiously; unknown whether results are applicable to women |
Authors conclude that among middle-aged men, a diagnosis of gout accompanied by an elevated uric acid level imparts significant Long-term CVD mortality risk independent of traditional risk factors; associations with mortality and gout (self-reported physician’s diagnosis + hyperuricemia) were stronger than for hyperuricemia alone
Note: increased mortality risk was not observed in earlier study that looked at a much shorter follow-up term (6 years) within the intervention phase of the MRFIT
Note: study on men only
Note: study population consisted of men at high risk of CHD; 30% of the study population died during follow-up (45% of CVD)
HR (gout vs no gout) for CHD mortality was 1.35 [1.06-1.72]; HR for MI mortality infarction was 1.35 [0.94-1.93]; for CVD overall mortality 1.21 [0.99-1.49]; and for total mortality 1.09 [1.00-1.19] (p=0.04); association between hyperuricemia and CVD was weak and did not persist when analysis was limited to men with hyperuricemia without a diagnosis of gout
Approximately twothirds of patients with a history of gout also had HU; of those with HU, only 16% reported gout
|
|
Choi, 2007
|
Type of study: prospective cohort study
Country and setting: multi-centre; North America
Health Professionals Follow-up Study; 51 529 male medical professionals and veterinarians
Source of funding: NIH and TAP Pharma-ceuticals; authors have received research funding and honoraria from TAP and Savient
|
Inclusion criteria: Health professionals that returned baseline questionnaire in 1986
N, age, (% men) 51 529, 40-75 (100)
Gout diagnosis Prevalent gout (Q); Incident gout (ARC-Q); no crystal proof
Other characteristics Only gout: 4.4% Only CHD: 6.9% Gout + CHD: 1%
|
Prevalent gout Incident gout
Prevalent gout: baseline Q – self-rep of physician-diagn. gout
Incident gout: biennial Q (self-rep physician-diagn) between 1988-1996 used to identify new cases of gout; incident cases of gout were confirmed using ACR survey gout criteria (suppl Q; 80% response rate)
Note: no crystal proof
Variables adjusted for Multivariate; age, hypertension, hypercholesterolemia, diabetes, aspirin, diuretic, smoking, bmi, physical activity, alcohol, family history MI, total energy intake, trans fat, dietary cholesterol, protein, linoleic fatty acid, and ratio of polyunsaturated fat to saturated fat |
Endpoint of follow-up: 12 years
N (%): not mentioned (probably low)
Reasons for incomplete outcome data described? Not mentioned
Questionnaire follow-up rates averaged 94% for each 2-year cycle |
CVD mortality; CHD mortality, and death from all causes, incident nonfatal MI; HR [95%CI]
Definition outcome: follow-up questionnaires by family members, postal service, search of National Death Index; cancer / CVD deaths confirmed using medical records; death certificates; autopsy results; ICD-9: CHD (410-414), CVD (390-459); CVD includes all CHD and other heart disease, cerebrovascular diseases, hypertension, diseases of arteries and veins, and other diseases of circulatory system; MI confirmed by review of medical records using WHO criteria
Total mortality: 5825 (11% of participants)
CVD- mortality (2132=37% total) No CHD at baseline No gout : 1 [ref] Prev Gout: 1.38 [1.15-1.66]
CHD at baseline No gout : 1 [ref] Prev Gout: 1.26 [1.07-1.50]
CHD-mortality (1576=27%) No CHD at baseline No gout : 1 [ref] Prev Gout: 1.55 [1.24-1.93]
CHD at baseline No gout : 1 [ref] Prev Gout: 1.24 [1.04-1.49]
Total mortality (5825=100%) No CHD at baseline No gout : 1 [ref] Prev Gout: 1.28 [1.15-1.41]
CHD at baseline No gout : 1 [ref] Prev Gout: 1.25 [1.09-1.45]
Nonfatal MI (1175 cases) No gout: 1 [ref] Incident gout: 1.59 [1.04-2.41] |
Study quality: see Table of quality assessment
Level of evidence: A2
Baseline cases of gout were not validated; cohort of male health professionals (may influence generalizability); unknown whether results are applicable to women |
Authors conclude that men with gout have a higher risk of death from all causes; among men without preexisting CHD, the increased mortality risk is primarily due to elevated risk of CVD death, particularly from CHD
Note: study on men only
Note: no data on hyperuricemia
Note: risk of mortality (total; CHD) did not change consistently across categories of gout duration
Compared with men without history of gout and CHD at baseline, adjusted RR among men with history of gout were 1.28[1.15 -1.41] for total mortality, 1.38[1.15-1.66] for CVD deaths, and 1.55[1.24 -1.93] for fatal CHD; among men with preexisting CHD, 1.25 [1.09-1.45], 1.26[1.07-1.50], and 1.24[1.04 -1.49], respect.; men with gout had a higher risk of nonfatal MI, adjusted RR 1.59[1.04-2.41]
|
|
Cohen, 2008
|
Type of study: retrospective cohort study; national registry
Country and setting: National registry (USRDS); USA
United States Renal Data System (USRDS)
Patients with End-stage kidney disease (ESRD) using dialysis therapy, and with Medicare as primary payer
Source of funding: non-commercial
|
Inclusion criteria: Patients presenting with ESRD and starting with long-term dialysis between Jan 1999 - Dec 2003; Medicare or Medicaid as primary payer
Exclusion criteria: ESRD coded as gouty nephropathy
450,668 patients; 259,310 patients started long-term dialysis with Medicare; 101 excluded for gouty nephropathy; leaving
259,209 patients
N, age, (% men) 259209, 64.9 ± 15.8 (48)
Gout diagnosis Incident gout based on Medicare claims data (not confirmed)
Other characteristics
Patients with incident gout(9.4%)
Male: 39.4% Age: 69.8 ± 12.6 Diabetes: 34.8% Hypertens: 82% CHF: 37.3% Ischem HD: 30.9% Cerebrv Dis: 9.7% Periph v Dis: 14.8%
Patients without incident gout (90.6%)
Male: 48.8% Age: 64.9 ± 15.8 Diabetes: 46.1% Hypertens: 78.5% CHF: 34.6% Ischem HD: 27.0% Cerebrv Dis: 10.2% Periphv Dis: 16.1% |
Incident gout
Incident gout: episode during follow up; based on Medicare claims data (not confirmed)
Variables adjusted for Multivariate
covariates not clearly described for models with mortality outcome
|
Endpoint of follow-up: 2-7 years (range)
followed through December 31, 2005
For how many participants were no complete outcome data available? N (%): not mentioned
Reasons for incomplete outcome data described? Not mentioned
|
CVD mortality; and death from all causes; HR [95%CI]
Definition outcome: based on USRDS registry; CVD defined as death due to acute MI, atherosclerotic heart disease, congestive heart failure, arrhythmia, valvular heart disease, or unspecified cardiac arrest (not including cerebrovascular disease)
Total mortality: not specified (number of total or CVD deaths are not specified)
CVD- mortality No gout : 1 [ref] Inc Gout: 1.47 [1.26-1.59]
Total-mortality No gout : 1 [ref] Inc Gout: 1.49 [1.43-1.55]
|
Study quality: see Table of quality assessment
Level of evidence: B
incident cases of gout were not validated; adjustment for confounding unclear; cohort of patients presenting with ESRD starting with long-term dialysis ( high CVD death risk; high % has CVD) |
Authors conclude that an episode of gout was independently associated with a 1.5-fold increase in mortality risk (adjusted HR 1.49 [1.43- 1.55])
Note: study on patients with ESRD starting long-term dialysis
Note: CVD is primary cause of death among ESRD patients
On the basis of Medicare claims data, the incidence of gout was 5.4% after 1 yr, 11.5% by 3 yr, and 15.4% by 5 yr (‘similar to that of general medical populations’) |
Hoofdstuk 7, deelvraag-2
Research question: Does urate lowering therapy reduce cardiovascular risk in patients with gout?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Level of evidence
GRADE (per outcome measure, across all studies analysed) |
Comments |
|
Wei et al, 2011 |
Type of study: Cohort; population-based; data collected prospectively
MEMO record-linkage database covering entire population; prescriptions, hospital discharge, mortality, biochemistry data; linked by patient identifier
Country: Scotland; Tayside population
Source of funding: none |
Inclusion criteria: all patients who had urate measurements between Jan 2000 - Dec 2002; aged ≥ 60 yrs; resident in Tayside throughout study period (Jan 2000 -Dec 2007)
Exclusion criteria: diagnosis cancer or hospitalization malignancy before study entry
N=7135 with N=1093 (15.3%) taking ULT
Groups comparable at baseline? No (but multivar adjustment)
A versus C (%) Male 62.5 vs 47.1 UA ≤6 mg/dl 44.7 vs 45.9
Previous hospitalization for: Diabetes 0.6 vs 0.3 Gout or HU 1.8 vs 0.4 Renal disease 7.4 vs 3.5 Cardiov Dis 9.7 vs 7.2 Hypertension 0.8 vs 0.6
patients in A more likely male, more co-morbidities, more concurrent drug use |
ULT N=1093 (15.3%)
(A1) 100 mg/d allopurinol (A2) 200 mg/d allopurinol (A3) > 300 mg/d allopurinol (B) other ULT (N=58)
Other ULT= colchicine, sulfinpyrazone, or probenecid
Note: only 44.7% of patients using allopurinol (A) reached target UA of ≤6 mg/ml (see below)
% with UA ≤6 mg/dl Men A1: 24.2 A2: 40.6 A3: 64.7 Total: 45.6 Women A1: 24.4 A2: 56.9 A3: 66.7 Total: 43.3
|
No ULT N=6042 (84.7%)
(C) non-ULT
Note: 45.9% of patients not using ULT had UA of ≤6 mg/ml |
Endpoint of follow-up: 5.6 yrs (median) 5 yrs (minimum)
For how many participants were no complete outcome data available? ‘none’; virtually no loss to follow-up
|
CVD (combined non-fatal + fatal); all cause mortality; rates, HRs [95%CI]
CVD combined Antiplatelet Trialists’ Collaboration (APTC) combined end-point of nonfatal MI, nonfatal stroke and CVD mortality; hospital discharge diagnosis, mortality records, death certificates (ICD-9, ICD-10)
CVD events / mortality C: 1145(19%) / 1943(32%) A: 273(26%) / 475(46%)
Multivariate adjustment age, gender, social deprivation, urate conc, gout/HU, renal disease, CVD, diabetes, use of colchicine, NSAIDs, diabetic medication and CV drugs during follow-up, and number of CV prescriptions
CVD combined CVD rates per 1000 person yrs
Allopurinol vs non-ULT
A: 61.4 [54.3-68.4] C: 38.5 [36.3-40.7] HR= 1.10 [0.95-1.26]
C (UA>6 mg/dl): 48.5 [45.1-51.9] HR= 1.07 [0.89-1.28]
Comparison of allopurinol dosages
A: 61.4 [54.3-68.4] A1: 74.0 [61.9-86.1] A2: 69.7 [49.6-89.8] A3: 47.6 [38.4-56.9] HRs A1: 1 [ref] A2: 1.01 [0.70-1.45] A3: 0.69 [0.50-0.94]
All-cause mortality Death rates per 1000 person yrs
Comparison of allopurinol dosages
A: 100.7 [92.2-109.3] A1: 120.3 [105.8-134.9] A2:108.6 [84.9-132.3] A3:73.2 [62.2-84.2] HRs A1: 1 [ref] A2: 0.92 [0.70-1.21] A3: 0.75 [0.59-0.94] |
Cohort study; cohort of patients who had urate measurement, i.e. not a random selection of the general population; non-ULT group not well-defined (: unclear why patients had urate measurement); no reasons to upgrade level of evidence
Level of evidence: GRADE
Across all studies analysed
VERY LOW* ULT vs no ULT Effect on CVD
*Downgraded 1 point because of indirectness (ill-defined control group in 1 study; indirect outcome measure [all-cause mortality] in 2nd study)
|
Authors concluded that < 50% of patients taking allopurinol reached target UA; higher doses of allopurinol were associated with better control of urate and lower risks of both cardiovascular events and mortality: higher doses of allopurinol may be of benefit by reducing cardiovascular disease or death
no significant increased CVD risk for allopurinol users compared to non-ULT users (HR 1.10 [0.95–1.26]), as well as compared to non-ULT users with urate >6 mg/dl (HR 1.07 [0.89–1.28]
Within allopurinol use cohort, CVD rates were 74.0 [61.9–86.1] per 1000 person years (100 mg group), 69.7 [49.6–89.8] for 200 mg group, and 47.6 [38.4–56.9] for the >300 mg group
Compared with low-dose (100 mg) users, high-dose (>300 mg) users had significant reductions in CVD risk (HR 0.69 [0.50–0.94]) and mortality (HR 0.75 [0.59–0.94])
Note: the control group (non-ULT group) is not well-defined; unclear why these patients had urate measurement (and no ULT treatment)
Note: no data presented on benefits of ULT for patients with gout (not clear what % of ULT users have gout)
Note: very high CVD and all cause mortality rate; 32% of non-ULT and 46% of ULT users die within median 5.6 yrs follow-up
Note: additional analyses performed using propensity score to minimize confounding by indication; adjusted HR of CVD was 0.63 [0.44–0.91] |
|
Luk et al, 2009
|
Type of study: Cohort (allopurinol vs control cohort)
CHIPS database (demographics, diagnostic codes, vital status etc) for US veterans patient encounters in Northwest US
Source of funding: Takeda Pharmaceuticals Inc |
Inclusion criteria: 1 SU level ≥ 7.0 mg/dl between 2000-2007
Exclusion criteria: GFR <30 ml/min; prior dialysis or organ transplantation; history of malignancy
2 cohorts defined: A: allopurinol C: control
Groups comparable at baseline? No (but multivar adjustment)
A versus C (%) Male (%) 99 vs 98 Age (y) 64.2 vs 62.3 UA(µmol/l) 535 vs 488 Diabetes (%) 28 vs 24 Gout (%) 83 vs 20 % GFR 69.8 vs 75.1 Cardiov Dis (%) 18 vs 15 Hypertension(%) 81 vs 70 Charlson index 1.2 vs 0.7 |
ULT N=2483
A – Allopurinol: incident allopurinol use between 2000-2007; UA >7.0 mg/dl within 1 year prior to allopurinol initiation
Note: patients in A had higher BMI, increased hypertens / CVD/ diabetes / comorb; more medicine visits / CVD medication i.e. worse prognostic factors for mortality than control
Note: 83% had a gout diagnosis, compared with 20% of control group, suggesting that allopurinol was mainly used to prevent gout attacks |
No ULT N=7441
C – Control: 3 non-allopurinol subjects per allopurinol user; alive and at-risk at time allopurinol-treated subject initiated allopurinol (index time); UA >7.0 mg/dl within 1 year prior to index time
|
Endpoint of follow-up: 23,903 person years (mean 2.4 y/person)
For how many participants were no complete outcome data available? Not stated
|
All cause mortality; HRs [95%CI]
All cause mortality C: 745/7441 (10.0%) A: 276/2483 (11.1%)
Multivariate adjustment baseline urate, Age, race, BMI, sex, Comborbidities, health care utilization, Cardiovascular and other medications, Baseline cholesterol, albumin, GFR
All-cause mortality HR adjusted for:
baseline urate 0.78 [0.67, 0.91]
complete adjustment 0.77 [0.65, 0.91]
Note: mean follow-up SUA: 428 and 446 mol/l (7.2 and 7.5 mg/dl) in allopurinol and control groups; mean change from baseline was 111mol/l (1.86 mg/dl) in allopurinol group |
Cohort study; all-cause mortality (no data on CVD deaths); high risk study population (age, male gender, metabolic syndrome); affects generalizibility; no reasons to upgrade level of evidence
Level of evidence: GRADE
Across all studies analysed
VERY LOW* ULT vs no ULT Effect on CVD
*Downgraded 1 point because of indirectness (ill-defined control group in 1 study; indirect outcome measure [all-cause mortality] in 2nd study) |
Authors conclude that allopurinol may provide a survival benefit in hyperuricaemic patients; more studies (RCTs) are required, it remains premature to advocate allopurinol for CVD prophylaxis
Unclear if survival benefit is due to urate-lowering effect, or to other beneficial effects: may improve endothelial function; allopurinol acts on both urate levels and xanthine oxidase activity
Note: at baseline (index time) allopurinol users were at higher mortality risk than non-allopurinol users (control); adjusted for in the multivariate model; residual confounding by indication expected to bias association towards the null
Note: no analysis of cause-specific deaths (data not available); high risk study population (age, male gender, metabolic syndrome, HU); affects generalizibility |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 03-02-2014
Laatst geautoriseerd : 03-02-2014
Geplande herbeoordeling : 01-01-2019
Uiterlijk in 2018 bepaalt het bestuur van de Nederlandse Vereniging voor Reumatologie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Reumatologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
In samenwerking met
Nederlandse Federatie voor Nefrologie
De richtlijn is tot stand gekomen met ondersteuning van het Kennisinstituut van Medisch Specialisten en met financiële steun van de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
De richtlijn is geschreven ter ondersteuning van de zorgverlening aan patiënten met jicht. Specifieke doelen van deze richtlijn zijn: het verkrijgen van uniformiteit in preventie en diagnostiek van jicht en in behandeling en begeleiding van patiënten met jicht en het bieden van een handvat voor een betere inrichting van de praktijkvoering van zorgverleners betrokken bij de zorg voor patiënten met jicht. Deze richtlijn wil tevens bijdragen aan betere communicatie tussen behandelaars onderling en tussen de patiënt, diens naasten en behandelaars.
Afbakening van de richtlijn
Deze richtlijn is een richtlijn voor de tweedelijnszorg van patiënten met jicht. Voor de eerstelijnszorg wordt verwezen naar de richtlijn ‘Artritis’ (Nederlands Huisartsen Genootschap, 2009). Er is naar gestreefd de richtlijn zoveel mogelijk te laten aansluiten bij deze NHG-standaard.
Doelgroep
De richtlijn is bedoeld voor alle zorgverleners in de tweedelijn die bij de behandeling van patiënten met jicht betrokken zijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2011 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met jicht. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Samenstelling van de werkgroep
-
Dr. M. Janssen, reumatoloog, Nederlandse Vereniging voor Reumatologie, voorzitter
-
Dr. T.L.Th.A Jansen, reumatoloog, Nederlandse Vereniging voor Reumatologie
-
Dr. C.J. Haagsma, reumatoloog, Nederlandse Vereniging voor Reumatologie
-
Dr. H. Baan, reumatoloog, Nederlandse Vereniging voor Reumatologie
-
Prof. dr. M.A.F.J. van de Laar, reumatoloog, Nederlandse Vereniging voor Reumatologie
-
Prof. dr. Sj. van der Linden, reumatoloog, Nederlandse Vereniging voor Reumatologie
-
Dr. M. Gerritsen, reumatoloog, Nederlandse Vereniging voor Reumatologie
-
Dr. J.W.G. Jacobs, reumatoloog, Nederlandse Vereniging voor Reumatologie
-
Dr. H.E.J.M. Janssens, huisarts, Nederlands Huisartsen Genootschap
-
Dr. C.E. Douma, internist-nefroloog, Nederlandse Internisten Vereniging, Nederlandse Federatie voor Nefrologie
-
Drs. P. Dubbeld, klinisch geriater, Nederlandse Vereniging voor Klinische Geriatrie
-
Dr. E.N. van Roon, ziekenhuisapotheker, Nederlandse Vereniging van Ziekenhuisapothekers
-
Dr. M.K. Reinders, ziekenhuisapotheker, Nederlandse Vereniging van Ziekenhuisapothekers
Met ondersteuning van:
-
Dr. K.N.J. Burger, medisch bioloog en epidemioloog, adviseur van het Kennisinstituut van Medisch Specialisten
-
Drs. M. Wessels, medisch informatiespecialist van het Kennisinstituut van Medisch Specialisten
-
S.K. Josso, secretaresse van het Kennisinstituut van Medisch Specialisten
Met dank aan:
-
Drs. C.M.P.G. van Durme, AIOS
-
Drs. I.A.A.M. van Echteld, reumatoloog
-
Dr. Ir. I.C.W. Arts, epidemioloog
-
Drs. L.B.E. Kienhorst, arts-onderzoeker
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen door middel van reputatiemanagement, belangen vanwege extern gefinancierd onderzoek en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten, een overzicht vindt u hieronder.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiele belangen |
Reputatie management |
Extern gefinancierd onderzoek |
Kennis valorisatie |
|
Irene van Echteld |
Meelezer |
Deelname 3e initiative sponsoring door Abbott |
nee |
nee |
ja, 3e initiative sponsoring door Abbott |
nee |
|
Dr. M.K. Reinders |
ziekenhuisapotheker |
geen |
nee |
nee |
nee |
nee |
|
Peter Dubbeld |
Klinisch geriater |
geen |
nee |
nee |
nee |
nee |
|
C.W. Arts |
Arts |
geen |
nee |
nee |
nee |
nee |
|
W.G. Jacobs |
reumatoloog |
geen |
nee |
nee |
nee |
nee |
|
H. Baan |
reumatoloog |
geen |
nee |
nee |
nee |
deelname 3e initiatief Gout (Abbott) vergoeding kosten |
|
T.L. Jansen |
reumatoloog |
lecture fee (sporadisch)/lid wetenschappelijke adviesraad voor de volgende firma's: - Abbive - BMS - Janssen - Menarini/ Ipsen - Pfizer - Savient - UCB |
nee |
lid medische adviesraad sarcoïdose belangen vereniging lid medische adviesraad Jichtpatiënten |
Projectleider van landelijke studie POEET (stappen van TNFi bij RA) met funding via ZonMW/VWS. Projectleider van POEET-substudies 1) POET-US met focus op voorspellende waarde van gewrichtsecho op succesvol stoppen TNFi, alsook 2) enotheelmetingen bij POEET, beide middels funding van Abbvie; Europacoordinator in Study of Update Gout criteria met funding acr/eulaR (SugaR) |
nee |
|
S.J. van der Linden |
Hoogleraard Reumatologie mama |
geen |
nee |
nee |
nee |
nee |
|
E.N. van Roon |
Ziekenhuisapotheker/Hoogleraar Klinische Farmacotherapie |
geen |
nee |
nee |
nee |
nee |
|
H. Janssens |
Huiarts en senior onderzoeker |
lid redatiecommissie Geneesmiddelenbulletin (onbetaald) |
nee |
nee |
nee |
nee |
|
Dr. C.E. Douma |
Internist nefroloog |
Lid Kwaliteitscommissie NfN |
nee |
nee |
nee |
nee |
|
C.J. Haagsma |
Meelezer |
geen |
nee |
nee |
nee |
nee |
|
L.B.E. Kienhorst |
arts-onderzoeker |
geen |
nee |
nee |
nee |
nee |
|
M. Gerritsen |
reumatoloog |
geen |
Eenmalige deelname adviesraad Sobi. Geen directe financiële belangen in bovengenoemd of ander bedrijf. |
nee |
Geen. Geplande studie naar effect Anakinna op therapie-resistente jicht aanval. Medicament en placebo geleverd door Sobi. Geen verdere financiële belangen firma. |
geen |
|
Matthijs Janssen |
reumatoloog |
geen |
geen |
nee |
nee |
nee |
|
Mart van de Laar |
hoogleraar Reumatologie Universiteit Twente |
vz consilium Ned. Ver. van Reumatologie (onbetaald), eigenaar Transparency-in-Health bv (betaald), vz Dream register (onbetaald) |
eigenaar Transparency-in Healthcare bv. Adviseert van Novartis terzake Canakinumab |
vz Dreamregister, vz Concilium Ned. Ver. Van Reumatologie |
nee |
nee |
|
Caroline van Durme |
|
geen |
nee |
nee |
nee |
nee |
Inbreng patiëntenperspectief
Er is aandacht besteed aan het patiëntenperspectief met patiënteninterviews (deels telefonisch). Een verslag van de patiënteninterviews is besproken in de werkgroep en de belangrijkste knelpunten zijn geadresseerd in de richtlijn. Het verslag is hieronder terug te vinden. Ook is in de oriënterende fase gezocht naar literatuur vanuit patiëntenperspectief, hierbij is gebruik gemaakt van een gestandaardiseerd zoekfilter (zie onder het verslag van de knelpunten). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de deelnemers aan de patiënteninterviews, het Reumafonds en de Nederlandse Vereniging voor Jichtpatiënten.
Verslag patiënteninterviews (plenair + telefonisch)
Datum: 12 april 2012
Tijd: 16.00-19.00 uur
Aanwezigen: twee patiënten; dr. K.N.J. Burger (OMS / OPK; adviseur); dr. M. Janssen (reumatoloog; voorzitter werkgroep richtlijn Jicht)
Afwezig maar telefonisch geraadpleegd (telefonisch interview): twee patiënten
Patiëntkarakteristieken: man (4), 65 tot 67 jaar, 7 tot 25 jaar na diagnose
Onderwerpen die tijdens de plenaire sessie en telefonische interviews als verbeterpunten in de zorg geïdentificeerd zijn en voorstellen om deze te verbeteren:
Algemeen
- ondanks het feit dat jicht relatief vaak voorkomt, met name onder ouderen, en de incidentie van jicht toeneemt door de vergrijzing, is jicht slecht bekend onder niet-patiënten. Jicht lijkt een ‘vergeten’ ziekte. Hierdoor ondervinden patiënten vaak weinig begrip van hun omgeving, en praten niet graag over hun ziekte;
- patiënten zijn gebaat bij meer openheid en een betere voorlichting over de ziekte jicht onder de algemene bevolking;
- een bredere en betere kennis van veelvoorkomende ziektes zoals jicht zou bereikt kunnen worden door het starten van een centrale website onder het motto ‘ken uw ziekte’, en meer aandacht in de media. Zo’n centrale website zou moeten worden ondersteund door de overheid en medische beroepsverenigingen.
Patiëntenvoorlichting
- er is veel onduidelijkheid bij patiënten welke factoren de kans op een jichtaanval vergroten of juist verkleinen en in welke mate:
- relatie tussen dagelijkse activiteiten (lichamelijke en psychische belasting, werk, sport, lange vliegreizen) en de kans op een jichtaanval;
- relatie tussen levensstijl en voedingfactoren (alcohol; seafood; Nieuwe Haring) en de kans op een jichtaanval;
- welke factoren belangrijk zijn, en welke (veel) minder of nauwelijks.
- er is vaak onduidelijkheid bij patiënten over de bijwerkingen van jichtmedicatie:
- bijsluiters bevatten zeer uitgebreide informatie over tal van bijwerkingen, vaak zeer ernstige. De patiënt heeft moeite om deze informatie op waarde te schatten in relatie tot de voorgeschreven dosering, en de ziekte jicht;
- één patiënt geeft aan dat de apotheker zeer goede informatie verstrekt met betrekking tot risico’s en bijwerkingen (onder andere in de vorm van print-outs).
- door de ernst en het chronisch verloop van de ziekte zijn patiënten erg gevoelig voor (goedbedoelde) adviezen uit hun omgeving;
- mede door de onduidelijkheid die bestaat bij patiënten over risicofactoren en (bijwerkingen van) medicatie, zijn patiënten snel geneigd om af te wijken van doktersvoorschriften, alternatieve middelen te testen, of hun levensstijl en voedingspatroon aan te passen:
- verhogen van de colchicine dosering op advies van de omgeving: ‘een lage dosering helpt niet’ (: is de patiënt voldoende op de hoogte van de risico’s van colchicine?);
- niet gebruiken van prednison op advies van de omgeving: ‘paardenmiddel’, ‘opgeblazen gezicht’ (: realiseert de patiënt zich voldoende dat het om een lage dosering prednison gaat en een relatief korte behandelduur?);
- gebruik van alternatieve (‘wonder’) middelen: Alkalife, glucosamine, …;
- gebruik van alternatieve pijnstillers.
- er is behoefte aan betere voorlichting:
- welke factoren verhogen of verlagen de kans op een jichtaanval, en hoe sterk? Welke algemene adviezen vloeien hier uit voort, rekening houdend met de algemene gezondheid van de patiënt?
- welke behandelopties zijn er, en wat zijn de belangrijkste bijwerkingen van de voorgeschreven medicijnen. Deze voorlichting moet worden toegespitst op de jichtpatiënt (relevante dosering);
- aandacht voor vragen van de patiënt (FAQ; vraag en antwoord, in brochure of op website);
- aandacht voor omgevingsgeluiden: hoe om te gaan met de goedbedoelde adviezen die de patiënt bereiken vanuit de omgeving?
- aandacht voor alternatieve middelen (Alkalife, glucosamine, ‘wondermiddelen’);
- aandacht voor de relatie tussen jicht en een verhoogd risico op hart- en vaatziektes;
- niet alleen gericht op de patiënt, maar ook op de betrokkenen (vergroten van begrip). Aandacht voor de grote invloed die de ziekte kan hebben op het dagelijks functioneren (werken, sport);
- niet alleen bij het stellen van de diagnose, maar gedurende het hele behandeltraject. Informatie verstrekt bij de 1e diagnose wordt vaak slecht verwerkt door de patiënt;
- niet alleen mondeling, maar ook schriftelijk (goede brochure; website).
Behandelaar (algemeen)
- patiënten zijn vaak niet voorgelicht over de relatie tussen jicht en een verhoogd risico op hart- en vaatziektes. Onduidelijk is of patiënten voldoende worden gecontroleerd op hart- en vaatziektes;
- door het chronisch verloop van de ziekte jicht en vaak terugkerende en ernstige symptomen (aanvallen), bestaat er bij patiënten vaak de behoefte aan een second opinion. Deze onafhankelijke analyse van het ziekteverloop en medicatiebeleid wordt door patiënten zeer verhelderend gevonden;
- patiënten geven aan dat aanvallen vaak optreden op bepaalde momenten, wanneer er sprake is van grote lichamelijke en psychische belasting, bijvoorbeeld bij piekbelasting op het werk. Zo’n jichtaanval komt dan op het slechts denkbare moment. Patiënten zouden graag beschikken over extra medicatie (profylaxe) om deze voor hun ‘voorspelbare’ jichtaanvallen te voorkomen;
- betere voorlichting over hart- en vaatziekterisico, en meer aandacht voor preventie van hart- en vaatziekte bij jichtpatiënten is gewenst.
Huisarts
- één patiënt met chronische jicht (25 jaar jicht) en regelmatige jichtaanvallen is nooit doorverwezen door de huisarts en min of meer door toeval (ziekenhuisopname i.v.m. ernstige infectie) recent in contact gekomen met de reumatoloog die de definitieve diagnose (kristalbewijs) heeft gesteld en de behandeling (nu ook met urinezuur-verlagende therapie) heeft overgenomen;
- de patiënt verklaard niet te zijn voorgelicht door de huisarts over (of gecontroleerd op) hart- en vaatziekterisico, en wordt pas recent behandeld voor hoge bloeddruk;
- de patiënt is ontevreden over de procedure die gevolgd wordt bij een jichtaanval. Na telefonisch contact met de huisartspraktijk volgt geen consult met de huisarts, maar wordt een herhaalrecept (pijnstiller) verstrekt door de praktijkassistent. De patiënt geeft aan behoefte te hebben aan meer contact met de huisarts;
- een tweede chronische jichtpatiënt is op eigen verzoek recent doorverwezen naar de reumatoloog vanwege pijn in het polsgewricht, met name om meer zekerheid te krijgen over de diagnose (reuma versus jicht). De reumatoloog heeft de definitieve diagnose gesteld (kristalbewijs) en behandeling met urinezuurverlagende therapie gestart;
- eerder werd de patiënt door de huisarts uitsluitend behandeld met pijnstillers, in eerste instantie naproxen, waar de patiënt ernstige bijwerkingen van ondervond. De patiënt verklaard het gevoel te hebben dat huisartsen betrekkelijk weinig kennis hebben van de ziekte jicht;
- de organisatie van zorg rond jichtpatiënten verdient extra aandacht, met name het samenspel en verwijsbeleid tussen eerstelijns en tweedelijns zorg. Dit lijkt in het bijzonder te gelden bij patiënten met langdurige chronische jicht, die gebaad zouden zijn bij een betere (persoonlijke) begeleiding, en een regelmatige herevaluatie van hun behandelplan.
Zoekfilter patiëntenperspectief
46. exp Consumer Participation/
47. ((patient or consumer*) adj3 (participat* or decisi* or decid*)).ti,ab.
48. "Patient Acceptance of Health Care"/
49. exp Attitude to Health/
50. *exp consumer satisfaction/ or patient preference/
51. "patient-focused".ti,ab.
52. "patient-centred".ti,ab.
53. (patient adj3 (attitude? or preference)).ti,ab.
54. "patient satisfaction".ti.
55. cooperative behavior/
56. exp self efficacy/ or self-efficacy.ti,ab.
57. exp Adaptation, Psychological/
58. coping.ti,ab.
59. ("self perception" or "self concept").ti,ab.
60. exp health education/ or patient education as topic/
61. exp attitude to health/ or health knowledge, attitudes, practice/
62. ("informed choice" or "shared decision making").ti,ab.
63. empowerment.tw.
64. ("focus group*" adj3 (patient* or parent* or famil* or spouse*)).ti,ab.
65. *"Quality of Life"/ or "Quality of Life"/px [Psychology]
66. (QoL or "Quality of life").ti.
67. Personal Autonomy/ or self concept/
68. consumer advocacy/ or freedom/
69. Needs Assessment/
70. Patient Advocacy/
71. Self-Help Groups/
72. Life Change Events/
73. Attitude to Death/
74. Patient-Centered Care/
75. exp Professional-Patient Relations/
76. Self Care/
77. self-management.ti.
78. ((patient* or consumer* or parent* or famil* or spouse*) adj (attitude* or involvement or desir* or
perspective* or activation or view* or preference*)).ti,ab.
79. "expert patient*".ti,ab.
80. or/45-79
81. exp Decision Making/
82. exp Communication/
83. Stress, Psychological/
84. Emotions/
85. vignette*.ti,ab.
86. or/81-85
87. exp Patients/px [Psychology]
88. (patient* or consumer*).ti.
89. 87 or 88
90. 86 and 88
91. "focus group*".ti,ab.
92. focus groups/ or narration/
93. qualitative.ti.
94. 91 or 92 or 93
95. 80 or 90 or 94
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
De richtlijn wordt digitaal verspreid onder alle relevante beroepsgroepen. Ook is de richtlijn te downloaden vanaf de website van de Richtlijnendatabase.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; AGREE Next Steps Consortium, 2009; www.agreecollaboration.org), dat een internationaal breed geaccepteerd instrument is en op ‘Richtlijn voor Richtlijnen’ van de Regieraad Kwaliteit van Zorg voor het ontwikkelen en implementeren van richtlijnen (www.cvz.nl).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse hebben de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij naar gewenste en ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als kritiek, belangrijk en onbelangrijk. Tevens definieerde de werkgroep voor zover mogelijk wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt is.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen in Medline (OVID) en in de databases van Guidelines International Network,Trip en van het National guideline clearinghouse (USA) en naar systematische reviews via Medline (OVID). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen met op voorhand opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in het hoofdstuk van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld met op voorhand opgestelde methodologische kwaliteitscriteria om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
Voor interventievragen:
de kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/) (Atkins et al., 2004).
Voor vragen over de waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose:
bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden. De bewijskracht van de conclusie is bepaald volgens de gebruikelijke EBRO-methode (Van Everdingen et al., 2004), waarbij de bewoording van de GRADE methode is gebruikt zoals hieronder weergegeven (tabellen 1 en 2).
Tabel 1. Methodologische kwaliteit van individuele studies volgens de EBRO-methode
|
Bewijs niveau |
Interventie |
Diagnostisch accuratesse onderzoek |
Schade of bijwerkingen, etiologie, prognose |
|
A1 |
Systematische review van min. 2 onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau |
||
|
A2 |
Gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang |
Onderzoek ten opzichte van een referentietest (‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van resultaten, met voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad |
Prospectief cohort onderzoek van voldoende omvang en follow-up, waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten. |
|
B |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (ook patiënt-controle onderzoek, cohort-onderzoek) |
Onderzoek ten opzichte van een referentietest, maar niet met alle kenmerken die onder A2 zijn genoemd |
Prospectief cohort onderzoek, maar niet met alle kenmerken als genoemd onder A2 of retrospectief cohort onderzoek of patiënt-controle onderzoek |
|
C |
Niet-vergelijkend onderzoek |
||
Tabel 2. Niveau van bewijskracht van de conclusie volgens de EBRO-methode
|
EBRO |
Conclusie gebaseerd op |
Bewoording |
|
Niveau 1 |
Onderzoek van niveau A1 of tenminste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2 |
Hoog |
|
Niveau 2 |
1 onderzoek van niveau A2 of tenminste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
Matig |
|
Niveau 3 |
1 onderzoek van niveau B of C |
Laag |
|
Niveau 4 |
Mening van deskundigen |
Zeer laag |
Formuleren van de conclusies
Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meer conclusies, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar een of meer artikelen, maar wordt deze getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs nog andere aspecten van belang, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische facetten. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting vermeld onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op zowel het beschikbare wetenschappelijke bewijs als op de belangrijkste overwegingen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg, zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur. Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende of bijkomende aspecten van de organisatie van zorg worden behandeld in de modules 'Randvoorwaarden (Organisatie van de zorg)'.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader of vervolg onderzoek staat in bijlage 'Kennislacunes'.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de deelnemers aan de patiënteninterviews, het Reumafonds, de Nederlandse Vereniging voor Jichtpatiënten (NVvJ) en de Nederlandse Vereniging voor Cardiologie (NVVC). De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
