Intracranieel Meningeoom - Beeldvorming
Uitgangsvraag
Aanbeveling
De werkgroep is van mening dat een 111indium-octreotide SPECT, al dan niet in combinatie met een FDG-PET, overwogen kan worden in geval van diagnostische twijfel over de aard van een durale laesie.
Overwegingen
Onderbouwing
Conclusies / Summary of Findings
Het is aannemelijk dat een meningeoom met behulp van CT of MRI in de meerderheid (80-90%) van de gevallen correct wordt gediagnosticeerd.
Campbell 2009 (2); Engelhard 2001 (3)
Het is aannemelijk dat hyperostosis bij 50-75% van de meningeomen en een dural tail bij 35-80% van de meningeomen wordt gezien. Beide kenmerken zijn niet pathognomonisch voor de diagnose meningeoom.
Pieper 1999 (7); Goyal 2012 (9); Campbell 2009 (2); Engelhard 2001 (3); Goldsher 1990 (15); Rhokni-Yazdi 2006 (16)
Het is aannemelijk dat meningeomen meestal de volgende MRI-karakteristieken hebben: een verlaagde signaalintensiteit op de T1, een verhoogde signaalintensiteit op de T2 en felle aankleuring op T1 na toediening van gadolinium. Hierin is veel variatie mogelijk. De aanwezigheid van calcificaties vormt een indirect teken van langzame groei.
Gasparetto 2007 (18); Saloner 2010 (13); Kasuya 2006 (14)
Er zijn aanwijzingen dat CT en MRI geen duidelijke kenmerken laten zien die een onderscheid maken tussen een WHO graad I, II en III meningeoom. Ook de aanwezigheid van peritumoraal oedeem heeft geen voorspellende waarde voor de maligniteitsgraad.
Gurkanlar 2005 (28)
Het is aannemelijk dat een MR-angiografie, MR-venografie of digitale substractie angiografie de relatie tussen een meningeoom en de naastliggende arteriën en venen preoperatief in kaart kan brengen.
Campbell 2009 (2); Engelhard 2001 (3)
Er zijn aanwijzingen dat een 111indium-octreotide SPECT (eventueel gecombineerd met een FDG-PET) van aanvullende waarde kan zijn als er radiologisch twijfel is over de aard van een durale laesie.
Nathoo 2007 (36)
Samenvatting literatuur
Voor het vaststellen van de aanwezigheid van een ruimte-innemende intracraniële afwijking, de nadere differentiatie hiervan en/of de follow-up staan meerdere beeldvormende modaliteiten ter beschikking.
Als eerste modaliteit voor patiënten met acute symptomatologie wordt vaak gebruik gemaakt van een blanco CT-scan, eventueel aangevuld met jodiumhoudend contrast (1).
Voor het vaststellen of er sprake is van een extra-axiale afwijking of een intra-axiale afwijking kan gekeken worden naar een aantal kenmerken, die met name goed te zien zijn op MRI : de aanwezigheid van een "cerebrospinal fluid (CSF) cleft", dat wil zeggen liquor tussen de hersenschors en de tumor; verplaatsing van de subarachnoïdale vaten, de aanwezigheid van cortex tussen de afwijking en de witte stof, de hoek van de afwijking met de convexiteit (stompe hoek) en de eventuele toename van de subarachnoïdale ruimte. De aanwezigheid van een liquor cleft is het beste te beoordelen op een T2-gewogen MRI. Ook kan er gekeken worden naar de aanwezigheid van een dural tail en de aanwezigheid van een ossale reactie: hyperostose. De meeste van deze kenmerken wijzen op een extra-axiale lokalisatie van de laesie, In de differentiaal diagnose van een voor meningeoom verdachte extra-axiale laesie kunnen staan een hemangiopericytoom, een durale metastase, lymfoom of een granuloom (sarcoidose of TBC) (2) (3).
Computer Tomografie (CT)
Op een CT-scan is een meningeoom een extra-axiale massa die isodens (25%) of licht hyperdens (70-75%) is ten opzichte van normaal hersenweefsel en sterk homogeen aankleurt na contrasttoediening.
Bij 15% van de patiënten wordt op CT een atypisch radiologisch beeld gezien met (centrale) necrose, cystevorming, bloeding, onscherpe begrenzing, veel oedeem, multilobulaire groei of inhomogene aankleuring. Deze kenmerken zijn niet bewijzend voor agressieve groei of een hogere maligniteitsgraad (4) (5).
In 5% van de gevallen veroorzaken meningeomen arachnoïdale cysten, vooral wanneer een meningeoom rond de basale cisternen is gelokaliseerd (6). Hyperostosis van de schedel wordt bij patiënten met een meningeoom frequent (50-75%) gezien en wordt in een groot deel van de gevallen veroorzaakt door infiltratie van het bot door het meningeoom (7) (8) (9). Hyperostosis is niet specifiek voor meningeomen, maar kan ook voorkomen bij andere (intra)craniële tumoren (bijvoorbeeld lipoom, PNET, lymfoom) (10) (11) (12).
De aanwezigheid van calcificaties kan goed worden beoordeeld op een CT-scan. De aanwezigheid van (psammomateuze) calcificaties is bij 25% van de meningeomen aanwezig en is geassocieerd met tragere groei (13) (14).
De dural tail, welke met name goed zichtbaar is op een MRI scan, kan soms ook worden waargenomen op een post-contrast CT-scan (15) (16).
Magnetic Resonance Imaging (MRI)
Een MRI-scan geeft bij een verdenking op een meningeoom een betere contrastresolutie van de tumor ten opzichte van de aangrenzende hersengebieden dan een CT-scan en is onmisbaar bij de diagnostiek van meningeomen van de schedelbasis, de achterste schedelgroeve of een meningeoom en plaque (3) (17).
Gasparetto et al. onderzochten de MRI-kenmerken van 78 patiënten met een meningeoom (18). Zestig procent van de tumoren had een verlaagde signaalintensiteit op de T1 gewogen beelden, 36% een intermediaire signaalintensiteit en 4% een verhoogde signaalintensiteit. In 60% van de tumoren was de signaalintensiteit heterogeen op T1, en in 40% homogeen. Op de FLAIR MRI sequentie had 69% een verhoogde signaalintensiteit, 22% een intermediaire signaalintensiteit en 9% verlaagde signaalintensiteit; bovendien was de signaalintensiteit op FLAIR van 64% van de tumoren heterogeen. Op de T2-gewogen beelden vertoonden 68% van de meningeomen een verhoogde signaalintensiteit, 26% een intermediaire signaalintensiteit en 4% een verlaagde signaalintensiteit. Na toediening van gadolineum kleurde 83% van de tumoren fel aan en 17% matig. In het overgrote deel (64%) was dit een heterogene aankleuring (18).
Maiuri et al. correleerden de signaalintensiteit op MRI-scan met histologie en concludeerden dat de signaalintensiteit informatie kan geven over de preoperatieve karakteristieken van de intracraniële meningeomen. T1-gewogen beelden kunnen informatie verschaffen over de aanwezigheid van cysten en intratumorale bloedvaten. T2-gewogen beelden kunnen meer informatie geven over histologisch subtype, vascularisatie en consistentie van het tumorweefsel. Meer hyperintense meningeomen op T2-gewogen beelden zijn vaker zacht, meer gevasculariseerd en vaker van het meningotheliale of angiomateuze subtype. Meer hypointense meningeomen op T2 zijn vaker van vastere consistentie en van het fibroblastaire of transitionele subtype (19).
In de studie van Gasparetto et al. was vasogeen oedeem rondom de tumor aanwezig bij 90% van de tumoren. Dit was discreet bij 50%, matig in 37% en ernstig in 17% van de gevallen. Bij 4% werden kleine bloedingscomponenten gezien, bij 4% cysteuze veranderingen en bij 4% was er calcificatie. Tekenen van botinfiltratie waren aanwezig bij 26%. Een dural tail was aanwezig bij 59% van de tumoren (18).
Oner et al. concludeerden op basis van een onderzoek van 29 patiënten met 46 meningeomen dat in tegenstelling tot andere extra-axiale ziekten er bij meningeomen geen toegevoegde waarde is van een postcontrast FLAIR boven postcontrast T1-gewogen beelden (20).
Dural tail
Op een MRI-scan is de ‘dural tail' van een meningeoom beter te zien dan op een CT-scan. Dit betreft een lokale verdikking van de dura bij de aanhechting van het meningeoom (2) (3).
Goldsher et al. beschreven drie criteria voor de definitie van een dural tail (op MRI) (15):
- aanwezigheid in ten minste twee opeenvolgende coupes en in meer dan één scanrichting
- de tail is breder nabij de tumor en wordt smaller naar distaal
- de aankleuring van de dural tail is feller dan de tumor zelf
Een dural tail doet zich vaker supratentorieel voor en minder vaak in de fossa posterior en bij cysteuze meningeomen (15). De dural tail wordt in 35-80% van de meningeomen gezien, maar is niet pathognomonisch voor de diagnose meningeoom (21). Rhokni-Yazdi et al. onderzochten de prevalentie van een dural tail in 98 patiënten met een intracraniële tumor. Zij vonden een dural tail in 44% van de patiënten: bij 18 patiënten ging het om een meningeoom, bij 2 om een hypofyse-adenoom, 1 patiënt had een lymfoom en 1 een abces. Van de patiënten met een bewezen meningeoom had 58% een dural tail. In deze studiepopulatie had de aanwezigheid van een dural tail een sensitiviteit van 59% en specificiteit van 94% voor de diagnose meningeoom (16).
Histologisch worden in een deel (ongeveer 50%) van de dural tails tumorcellen gevonden, naast gestuwde durale bloedvaten en ontsteking (22) (23) (24).
Qi et al. onderzochten in 179 patiënten die een Simpson graad 1 resectie van een meningeoom ondergingen de aanwezigheid van een dural tail op een preoperatieve MRI. De dural tail was gedefinieerd volgens de Goldsher criteria. In 86% van de patiënten betrof het een WHO graad I meningeoom en in 14% een WHO II of III meningeoom. Een nodulair type dural tail was geassocieerd met een WHO II en III meningeoom. Een smooth-type (lineair; egaal-glad begrensd) kwam daarentegen uitsluitend voor bij een WHO graad I meningeoom. Er was tumorinvasie in de dural tail in 88% van de convexiteitsmeningeomen, waarbij 82% zich binnen 2 cm en 95% zich binnen 2,5 cm bevond (25).
Peri-tumoraal oedeem (T2/FLAIR hyperintense afwijkingen)
Op FLAIR of T2 gewogen MRI-scans kunnen rondom (vermoedelijke) meningeomen hyperintense afwijkingen zichtbaar zijn. Deze kunnen veroorzaakt zijn door vasogeen oedeem, veneuze obstructie of cerebrale gliose door langdurige compressie. Deze hyperintense afwijkingen blijven soms ook postoperatief bestaan (26). In een studie bij 51 patiënten met meningeomen met peritumoraal oedeem op T2/FLAIR bleken de volgende factoren hiermee geassocieerd te zijn: de configuratie van de tumorrand, de peritumorale rand en de signaalintensiteit van de tumor op T2/FLAIR (27). Gurkanlar et al. onderzochten in een groep van 55 patiënten met meningeomen de relatie tussen locatie, leeftijd en gradering van het meningeoom enerzijds en peritumoraal oedeem op T2/FLAIR anderzijds. Zij vonden geen relatie tussen deze hyperintense afwijkingen en het geslacht van de patiënt of de locatie en histologische subtype van het meningeoom. Wel was er een positieve relatie tussen de mate van oedeem op T2/FLAIR rond het meningeoom en de leeftijd van een patiënt. Tumorgrootte en tumorranden (egaal versus gelobd) waren niet geassocieerd met peritumorale hyperintense afwijkingen op T2/FLAIR (28).
Additionele MRI-sequenties
Yin et al. vonden in een retrospectieve groep van 138 patiënten dat de ADC waarde (apparent diffusion coefficient) verlaagd was in de groep met een WHO graad II en III meningeoom in vergelijking met een WHO graad I meningeoom (29).
Om de relatie van het meningeoom met de veneuze sinussen of cerebrale arteriën in beeld te brengen, kan preoperatief een MR Venografie (MRV) of MR Arteriografie (MRA) worden verricht (zie ook angiografisch onderzoek) (3) (2).
Tot op heden is er geen bewezen toegevoegde waarde van MR Spectroscopy (MRS) en MRI perfusie in de diagnostiek en follow-up van meningeomen aangetoond (30).
Angiografie
Kennis van de bloedvoorziening of ingroei in de sinussen kan van belang zijn voor een eventuele preoperatieve embolisatie en chirurgische verwijdering (2) (3).
Voor het in kaart brengen van deze arteriële aanvoer en veneuze afvloed kan gebruikt worden gemaakt van digitale substractie angiografie (DSA). Meningeomen zijn vaatrijke tumoren en vertonen bij angiografie een karakteristieke ‘tumor blush' vanuit de capillaire fase tot aan de veneuze fase. Deze blush, ook wel "the mother in law-appearance" genoemd (‘comes early, stays late'), is karakteristiek voor meningeomen. In 85% van de gevallen gaat de vascularisatie uit van de meningeale takken van de arteria carotis externa. MRA en MRV vormen een goedalternatief voor conventionele angiografie om de verplaatsing van arteriën en venen en de ingroei in sinussen door een meningeoom zichtbaar te maken (3).
In voorkomende gevallen kan DSA worden gebruikt om te differentiëren tussen meningeomen en andere typen tumoren, wanneer er op grond van conventionele MRI en CT geen onderscheid kan worden gemaakt. Het angiografisch onderzoek heeft daarnaast als voordeel dat er aansluitend (preoperatieve) embolisatie plaats kan vinden.
Preoperatieve embolisatie kan worden ingezet om peroperatief bloedverlies te beperken. Er zijn geen grote vergelijkende studies beschikbaar met betrekking tot preoperatieve embolisatie van meningeomen. De beschikbare data zijn vooral afkomstig van case series (31) (32) (33) (34).
111Indium-octreotide SPECT scan
Bij twijfel over de aard van de tumor kan een nucleair onderzoek met een 111indium-octreotide SPECT scan meer duidelijkheid geven. Octreotide bindt aan somatostatine receptoren, die aanwezig zijn op alle meningeomen. Een vals-positieve scan is mogelijk omdat somatostatinereceptoren ook aanwezig kunnen zijn op een ganglioneuroblastoom, medulloblastoom en sommige typen hersenmetastasen (onder andere niercelcarcinoom, niet-kleincellig longcarcinoom en lymfoom) (35). Een recente studie liet een hoge sensitiviteit en specificiteit zien van een 111indium-octreotide SPECT scan voor een meningeoom in patiënten met een craniale durale massa (36). In 96% van de meningeomen was er een hoge uptake op een 111indium-octreotide SPECT en een lage uptake op FDG-PET.
In gevallen waar een definitieve diagnose beschikbaar was, had de 111indium-octreotide SPECT scan alleen een sensitiviteit van 100% en een specificiteit van 50%. Drie vals-positieve resultaten werden gevonden (metastase, chronische ontsteking, lymfoom). Het gebruik van 111indium-octreotide SPECT in combinatie met MRI om meningeomen te onderscheiden van andere laesies had daarmee een goede diagnostische waarde. Ook bij patiënten met een tumor in de orbita is de sensitiviteit en specificiteit van een 111indium-octreotide SPECT scan voor de diagnose opticusmeningeoom hoog: 100% sensitiviteit en 97,2% specificiteit (37).
Wang et al. onderzochten de relatie tussen 99mTc-octeotride SPECT/CT somatostatine receptor scintigrafie en de histologische gradering in 30 meningeomen. De ratio's van somatostatine accumulatie voor de 20 WHO graad I meningeomen was significant lager dan de ratio's van de 10 WHO graad II meningeomen (38).
Studies met andere nucleaire tracers suggereerden eveneens een positieve relatie tussen tracer opname en een hogere maligniteitsgraad van meningeomen (39) (40) (41). Validatiestudies ontbreken vooralsnog.
PET scan
Het gebruik van PET staat bij meningeomen nog in de kinderschoenen en de klinische waarde is nog niet duidelijk (42). Voor zover bekend is er geen specifieke tracer die duidelijk superieur is aan de andere (42). Het gebruik van 68Ga-DOTATOC-PET is veelbelovend. Deze tracer verbindt het radioactieve isotoop gallium-168 aan octreotide dat bindt aan de somatostatine-receptor (T1/2 = 68 min) op meningeomen. Een beperking voor het gebruik van deze tracer vormt de regio rond de sella turcica, omdat de normale hypofyse veel somatostatine receptoren bevat. Er zijn geen studies verricht naar de relatie tussen PET onderzoek en histologische verificatie van een durale laesie. In de toekomst zou PET kunnen helpen bij het bepalen van het doelgebied voor stereotactische radiotherapie van complexe schedelbasis meningeomen of van een recidief meningeoom na operatie (42). Voordat deze techniek binnen de radiotherapie (-planning) gebruikt kan worden, moeten echter nog meerdere aspecten worden onderzocht, bijvoorbeeld hoe om te gaan met PET-positieve gebieden zonder CT/MRI correlatie en vice versa (42).
Voor aanbevelingen ten aanzien van minimaal te verrichten MRI sequenties zie hieronder. De meest recente versie voor een MRI protocol kan worden gevonden op www.radiologen.nl.
Minimaal te verichten MRI sequenties
Aanbevelingen van de sectie Neuroradiologie van de Nederlandse Vereniging voor Radiologie voor MRI hersenen t.b.v. de diagnostiek en follow-up van primaire hersentumoren
De volgende sequenties zijn vereist:
- Axiale 2D T1w spin echo (SE) of gradiënt echo (GE) sequentie met maximale coupedikte 5 mm, FOV 240 mm, matrix 256 of hoger; of 3D T1w sequentie met maximale voxelgrootte ± 1 mm3.
- Axiale 2D T2w SE of turbo/fast spin echo (TSE/FSE) sequentie met maximale coupedikte 5 mm, FOV 240 mm, matrix 512 of hoger. Voor infratentoriële tumoren: sagittale in plaats van axiale acquisitie.
- Axiale en coronale/sagittale 2D (SE) T1w sequentie na toediening van Gadolineumhoudend contrast met maximale coupedikte 5 mm, FOV 240 mm, matrix 256 of hoger; of 3D T1w sequentie na toediening van Gadolineumhoudend contrast met reconstructies in 3 richtingen.
De volgende sequenties zijn optioneel:
- 2D of 3D T2-FLAIR ten behoeve van het beoordelen van de uitgebreidheid van witte stofafwijkingen; bij verdenking op leptomeningeale uitbreiding te verrichten na toediening van Gadolineumhoudend contrast.
- Diffusie gewogen opnamen (DWI) met b=0 s/mm2 en b=±1000 s/mm2 ten behoeve van de differentiële diagnostiek tussen 1. abces en necrotische tumor, en 2. tumorinfiltratie/-oedeem en verse ischemie, m.n. in het postoperatieve stadium.
- MRI perfusie ten behoeve van verbeterde diagnose, bepalen van optimale biopsie target, vervolgen van behandeling, differentiële diagnose tussen tumorprogressie en therapie-effect.
- MR spectroscopie ten behoeve van verbeterde diagnose, bepalen van optimale biopsie target, vervolgen van behandeling, differentiële diagnose tussen tumorprogressie en therapie-effect.
Functionele MRI en/of diffusie tensor MRI (DTI) ten behoeve van het pre-operatief bepalen van de lokalisatie van eloquente cortex en witte stofbanen.
Referenties
- 1 - Cha S. Neuroimaging in neuro-oncology. Neurotherapeutics 2009 Jul;6(3):465-77.
- 2 - Campbell BA, Jhamb A, Maguire JA, Toyota B, Ma R. Meningiomas in 2009: controversies and future challenges. Am J Clin Oncol 2009 Feb;32(1):73-85.
- 3 - Engelhard HH. Progress in the diagnosis and treatment of patients with meningiomas. Part I: diagnostic imaging, preoperative embolization. Surg Neurol 2001 Feb;55(2):89-101.
- 4 - Russell EJ, George AE, Kricheff II, Budzilovich G. Atypical computed tomography features of intracranial meningioma: radiological-pathological correlation in a series of 131 consecutive cases. Radiology 1980 Jun;135(3):673-682.
- 5 - de Vries J, Wakhloo AK. Cerebral oedema associated with WHO-I, WHO-II, and WHO-III-meningiomas: correlation of clinical, computed tomographic, operative and histological findings. Acta Neurochir (Wien) 1993;125(1-4):34-40.
- 6 - Awada A, Scherman B, Palkar V. Cystic meningiomas, a diagnostic and pathogenic challenge. Eur J Radiol 1997 Jul;25(1):26-9.
- 7 - Pieper DR, Al-Mefty O. Management of intracranial meningiomas secondarily involving the infratemporal fossa: radiographic characteristics, pattern of tumor invasion, and surgical implications. Neurosurgery 1999 Aug;45(2):231-7; discussion 237-8.
- 8 - Bikmaz K, Mrak R, Al-Mefty O. Management of bone-invasive, hyperostotic sphenoid wing meningiomas. J Neurosurg 2007 Nov;107(5):905-12.
- 9 - Goyal N, Kakkar A, Sarkar C, Agrawal D. Does bony hyperostosis in intracranial meningioma signify tumor invasion? A radio-pathologic study. Neurol India 2012 Jan-Feb;60(1):50-54.
- 10 - Yasuda Y, Tsukada S, Okada T, Haseda Y. Intraosseous lipoma of the skull: a report of two cases. Ann Plast Surg 1987 Jan;18(1):74-80.
- 11 - Paiva J, King J, Chandra R. Extra-axial Hodgkin's lymphoma with bony hyperostosis mimicking meningioma. J Clin Neurosci 2011 May;18(5):725-727.
- 12 - Singh AD, Husson M, Shields CL, De Potter P, Shields JA. Primitive neuroectodermal tumor of the orbit. Arch Ophthalmol 1994 Feb;112(2):217-221.
- 13 - Saloner D, Uzelac A, Hetts S, Martin A, Dillon W. Modern meningioma imaging techniques. J Neurooncol 2010 Sep;99(3):333-340.
- 14 - Kasuya H, Kubo O, Tanaka M, Amano K, Kato K, Hori T. Clinical and radiological features related to the growth potential of meningioma. Neurosurg Rev 2006 Oct;29(4):293-6; discussion 296-7.
- 15 - Goldsher D, Litt AW, Pinto RS, Bannon KR, Kricheff II. Dural "tail" associated with meningiomas on Gd-DTPA-enhanced MR images: characteristics, differential diagnostic value, and possible implications for treatment. Radiology 1990 Aug;176(2):447-450.
- 16 - Rokni-Yazdi H, Sotoudeh H. Prevalence of "dural tail sign" in patients with different intracranial pathologies. Eur J Radiol 2006 Oct;60(1):42-45.
- 17 - Croutch KL, Wong WH, Coufal F, Georgy B, Hesselink JR. En plaque meningioma of the basilar meninges and Meckel's cave: MR appearance. AJNR Am J Neuroradiol 1995 Apr;16(4 Suppl):949-51.
- 18 - Gasparetto EL, Leite Cda C, Lucato LT, Barros CV, Marie SK, Santana P, et al. Intracranial meningiomas: magnetic resonance imaging findings in 78 cases. Arq Neuropsiquiatr 2007 Sep;65(3A):610-614.
- 19 - Maiuri F, Iaconetta G, de Divitiis O, Cirillo S, Di Salle F, De Caro ML. Intracranial meningiomas: correlations between MR imaging and histology. Eur J Radiol 1999 Jul;31(1):69-75.
- 20 - Oner AY, Tokgoz N, Tali ET, Uzun M, Isik S. Imaging meningiomas: is there a need for post-contrast FLAIR? Clin Radiol 2005 Dec;60(12):1300-1305.
- 21 - Gupta S, Gupta RK, Banerjee D, Gujral RB. Problems with the "dural tail" sign. Neuroradiology 1993;35(7):541-542.
- 22 - Sotoudeh H, Yazdi HR. A review on dural tail sign. World J Radiol 2010 May 28;2(5):188-192.
- 23 - Rokni-Yazdi H, Azmoudeh Ardalan F, Asadzandi Z, Sotoudeh H, Shakiba M, Adibi A, et al. Pathologic significance of the "dural tail sign". Eur J Radiol 2009 Apr;70(1):10-16.
- 24 - Takeguchi T, Miki H, Shimizu T, Kikuchi K, Mochizuki T, Ohue S, et al. The dural tail of intracranial meningiomas on fluid-attenuated inversion-recovery images. Neuroradiology 2004 Feb;46(2):130-135.
- 25 - Qi ST, Liu Y, Pan J, Chotai S, Fang LX. A radiopathological classification of dural tail sign of meningiomas. J Neurosurg 2012 Oct;117(4):645-653.
- 26 - Whittle IR, Smith C, Navoo P, Collie D. Meningiomas. Lancet 2004 May 8;363(9420):1535-1543.
- 27 - Nakano T, Asano K, Miura H, Itoh S, Suzuki S. Meningiomas with brain edema: radiological characteristics on MRI and review of the literature. Clin Imaging 2002 Jul-Aug;26(4):243-249.
- 28 - Gurkanlar D, Er U, Sanli M, Ozkan M, Sekerci Z. Peritumoral brain edema in intracranial meningiomas. J Clin Neurosci 2005 Sep;12(7):750-753.
- 29 - Yin B, Liu L, Zhang BY, Li YX, Li Y, Geng DY. Correlating apparent diffusion coefficients with histopathologic findings on meningiomas. Eur J Radiol 2012 Dec;81(12):4050-4056.
- 30 - Chernov MF, Kasuya H, Nakaya K, et al. (1)H-MRS of intracranial meningiomas: what it can add to known clinical and MRI predictors of the histopathological and biological characteristics of the tumor? Clin Neurol Neurosurg 2011 Apr;113(3):202-12.
- 31 - Bendszus M, Rao G, Burger R, et al. Is there a benefit of preoperative meningioma embolization? Neurosurgery 2000 Dec;47(6):1306-11; discussion 1311-2.
- 32 - Nania A, Granata F, Vinci S, Pitrone A, Barresi V, Morabito R, et al. Necrosis Score, Surgical Time, and Transfused Blood Volume in Patients Treated with Preoperative Embolization of Intracranial Meningiomas. Analysis of a Single-Centre Experience and a Review of Literature. Clin Neuroradiol. 2014 Mar;24(1):29-36
- 33 - Borg A, Ekanayake J, Mair R, et al. Preoperative Particle and Glue Embolization of Meningiomas: Indications, Results and Lessons Learned from 117 Consecutive Patients. Neurosurgery 2013 Feb 25.
- 34 - Ellis JA, D'Amico R, Sisti MB, et al. Pre-operative intracranial meningioma embolization. Expert Rev Neurother 2011 Apr;11(4):545-56.
- 35 - Reubi JC, Maurer R, von Werder K, Torhorst J, Klijn JG, Lamberts SW. Somatostatin receptors in human endocrine tumors. Cancer Res 1987 Jan 15;47(2):551-558.
- 36 - Nathoo N, Ugokwe K, Chang AS, Li L, Ross J, Suh JH, et al. The role of 111indium-octreotide brain scintigraphy in the diagnosis of cranial, dural-based meningiomas. J Neurooncol 2007 Jan;81(2):167-174.
- 37 - Saeed P, Tanck MW, Freling N, Baldeschi L, Mourits MP, Bennink RJ. Somatostatin receptor scintigraphy for optic nerve sheath meningiomas. Ophthalmology 2009 Aug;116(8):1581-1586.
- 38 - Wang S, Yang W, Deng J, Zhang J, Ma F, Wang J. Correlation between (99m)Tc-HYNIC-octreotide SPECT/CT somatostatin receptor scintigraphy and pathological grading of meningioma. J Neurooncol 2013 Jul;113(3):519-526.
- 39 - Alexiou GA, Vartholomatos G, Tsiouris S, Papadopoulos A, Kyritsis AP, Polyzoidis KS, et al. Evaluation of meningioma aggressiveness by (99m)Tc-Tetrofosmin SPECT. Clin Neurol Neurosurg 2008 Jul;110(7):645-48.
- 40 - Takeda T, Nakano T, Asano K, Shimamura N, Ohkuma H. Usefulness of thallium-201 SPECT in the evaluation of tumor natures in intracranial meningiomas. Neuroradiology 2011 Nov;53(11):867-873.
- 41 - Valotassiou V, Leondi A, Angelidis G, Psimadas D, Georgoulias P. SPECT and PET imaging of meningiomas. ScientificWorldJournal 2012;2012:412580.
- 42 - Cornelius JF, Langen KJ, Stoffels G, et al. Positron emission tomography imaging of meningioma in clinical practice: review of literature and future directions. Neurosurgery 2012 Apr;70(4):1033-41; discussion 1042.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 24-11-2015
Beoordeeld op geldigheid : 04-01-2015
Voorwaarden voor revisie en beoordelingsfrequentie zijn vastgelegd in de richtlijn. De geldigheidstermijn voor de richtlijn (maximaal 5 jaar na vaststelling) wordt vanuit IKNL bewaakt.
Ook de Landelijke Werkgroep Neuro-Oncologie (LWNO) toetst jaarlijks de actualiteit van de richtlijn. Het bestuur van de landelijke werkgroep draagt de verantwoordelijkheid om de behoefte voor herziening van de huidige richtlijn bij de beroepsgroepen te peilen. Om verscheidene redenen kan actualisatie eerder dan beoogd nodig zijn. Zo nodig zal de richtlijn tussentijds op onderdelen worden bijgesteld. Als dat aan de orde is, verzoekt de LWNO de meest bij het desbetreffende onderwerp betrokken vereniging[en] de revisie te financieren, bijvoorbeeld door middel van een hierop gericht beroep op SKMS gelden. Uiterlijk in 2018 zal een nieuwe multidisciplinaire werkgroep worden geïnstalleerd om de richtlijn te reviseren.
Algemene gegevens
In 2011 heeft de Landelijke Werkgroep Neuro-Oncologie (LWNO) het Integraal Kankercentrum Nederland (IKNL) verzocht om een richtlijn Meningeoom te ontwikkelen. Naar aanleiding hiervan is een landelijke richtlijnwerkgroep Meningeoom opgericht. De multidisciplinaire werkgroep is in juli 2012 gestart met de ontwikkeling van de richtlijn Meningeoom. IKNL zorgde voor methodologische begeleiding en secretariële ondersteuning van het proces.
Naast de autoriserende verenigingen heb de volgende verenigingen ingestemd met de inhoud:
Nederlandse Vereniging van Meningeoom Patiënten (NVMP; per oktober 2013 deel van Patiëntenvereniging Cerebraal)
Patiëntenvereniging Cerebraal (via Leven met Kanker Beweging (voorheen NFK)
Doel en doelgroep
Doelstelling
De richtlijn is een document met aanbevelingen ter ondersteuning van de praktijkvoering van zorgverleners die betrokken zijn bij patiënten met een intracranieel meningeoom. De aanbevelingen zijn gebaseerd op een zo hoog mogelijke graad van wetenschappelijk bewijs en consensus binnen de werkgroepleden. De richtlijn biedt de gebruikers inzicht in het tot stand komen van de aanbevelingen. Uitgangspunt zijn de knelpunten die in de dagelijkse praktijk bij patiënten met een intracranieel meningeoom worden gesignaleerd.
Doel van de richtlijn
Het verbeteren van de kwaliteit van zorg voor volwassen patiënten met een meningeoom. De richtlijn behelst het traject van diagnostiek, behandeling, voorlichting en begeleiding van patiënten met een intracranieel meningeoom. De richtlijn beoogt hiermee de kwaliteit van de zorgverlening te verbeteren, het klinisch handelen meer te baseren op bewijs dan op ervaringen en meningen, de transparantie van keuze voor behandelingen te vergroten en de diversiteit van handelen door professionals te verminderen.
De richtlijn kan worden gebruikt bij het geven van voorlichting aan patiënten en biedt aanknopingspunten voor transmurale afspraken of lokale protocollen ter bevordering van de implementatie.
Doelgroep
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, klinische besluitvorming, behandeling en begeleiding van patiënten met een intracranieel meningeoom, zoals neurologen, neurochirurgen, radiotherapeuten, (neuro)pathologen, (neuro)radiologen, klinisch genetici, revalidatieartsen, huisartsen, psychologen, neuro-oncologieverpleegkundigen en verpleegkundig specialisten.
Deze richtlijn is primair geschreven voor bovenstaande (groepen) professionals en daardoor mogelijk minder makkelijk leesbaar voor patiënten. KWF Kankerbestrijding geeft patiëntenbrochures uit, die gebaseerd zijn op door IKNL gepubliceerde richtlijnen. Zie voor meer patiënteninformatie de folder ‘Hersentumoren’ van KWF en de website www.hersentumor.nl.
Doelpopulatie
De doelpopulatie betreft patienten van 18 jaar en ouder met een intracranieel meningeoom.
Samenstelling werkgroep
Alle werkgroepleden zijn afgevaardigd namens een wetenschappelijke, beroeps- of patiëntenvereniging en hebben daarmee het mandaat voor hun inbreng. Bij de samenstelling van de werkgroep is getracht rekening te houden met landelijke spreiding, inbreng van betrokkenen uit zowel academische als algemene ziekenhuizen/instellingen en vertegenwoordiging van de verschillende verenigingen/disciplines.
De Nederlandse Vereniging van Meningeoompatiënten (NVMP; per oktober 2013 deel van Patiëntenvereniging Cerebraal)) is eveneens vertegenwoordigd door middel van afvaardiging van de voorzitter van de patiëntenvereniging, alsmede een ervaringsdeskundige vanuit de Nederlandse Federatie van Kankerpatiëntenorganisaties (NFK) afkomstig van Vereniging Cerebraal.
De volgende (para)medische disciplines zijn in de werkgroep vertegenwoordigd:
- neurologie
- neurochirurgie
- radiotherapie
- (neuro)pathologie
- neuroradiologie
- neuropsychologie
- revalidatie
- verpleegkunde
Leden van de werkgroep
- Mw. dr. D. Brandsma, neuroloog Nederlands Kanker Instituut / Antoni van Leeuwenhoekziekenhuis en Slotervaartziekenhuis, Amsterdam, voorzitter
- Mw. drs. N.D.B. Gilhuijs, (neuro)patholoog, Westfries Gasthuis, Hoorn
- Dhr. Prof.dr. R.J.M. Groen, neurochirurg, UMCG, Groningen
- Mw. drs. E.J.J. Habets, psycholoog, MC Haaglanden, Den Haag
- Mw. drs. P. Hoenderdaal, patiëntvertegenwoordiger Vereniging Cerebraal
- Mw. dr. A.A. Jacobi - Postma, neuroradioloog MUMC+, Maastricht
- Mw. dr. A. Mendez Romero, radiotherapeut-oncoloog, Erasmus MC, Rotterdam
- Dhr. drs. C.G.J.H. Niël, radiotherapeut-oncoloog, RISO, Deventer
- Mw.dr. S.M. Peerdeman, neurochirurg, VUmc, Amsterdam
- Mw. H. Petersen - Baltussen, nurse practitioner neurochirurgie, Radboud Universitair Medisch Centrum, Nijmegen
- Mw. drs. V.P.M. Schepers, revalidatiearts, UMCU, Utrecht
- Dhr. dr. T.J. Snijders, neuroloog, UMCU, Utrecht
- Dhr. H. van Valkenburg, patiëntvertegenwoordiger
- Dhr. Prof.dr. P. Wesseling, (neuro)patholoog Radboud Universitair Medisch Centrum, Nijmegen, VUmc, Amsterdam
- Mw. J.M.C. Zwinkels, verpleegkundig specialist NO, MC Haaglanden, Den Haag
Dhr. Dr. F.J. Hes, klinisch geneticus, Leids Universitair Medisch Centrum (LUMC), Leiden, heeft een bijdrage geleverd aan de tekst over genetische syndromen.
Ondersteuning
Medewerkers van het IKNL waren verantwoordelijk voor de procesbegeleiding en secretariële ondersteuning.
- Mw. drs. E.J.A Verhoof, procesbegeleider IKNL, locatie Utrecht
- Mw. M.L. van de Kar-van der Meulen, secretariële ondersteuning werkgroep Meningeoom, IKNL, locatie Utrecht
Literatuuronderzoek
Het literatuuronderzoek en het opstellen van de concept conclusies voor het evidence based gedeelte werd uitgevoerd door dr. J. Vlayen [Medical Evaluation & Technology Assessment, ME-TA, België], en mw. dr. L. Veerbeek [IKNL].
Belangenverklaringen
Om de beïnvloeding van de richtlijnontwikkeling of formulering van de aanbevelingen door conflicterende belangen te minimaliseren zijn de leden van werkgroep gemandateerd door de wetenschappelijke verenigingen.
Alle werkgroepleden hebben bij aanvang en bij de afronding van het richtlijn traject een belangenverklaring ingevuld. Hiermee geven de werkgroepleden aan onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn. Potentiële conflicterende belangen zijn door middel van ondervraging van de werkgroepleden opgespoord en besproken. De bevindingen zijn schriftelijke vastgelegd in de belangenverklaring en opvraagbaar via oncoline@iknl.nl.
Daarnaast is conceptrichtlijn ter becommentariëring aangeboden op www.oncoline.nl en aan alle voor de knelpuntenanalyse benaderde wetenschappelijke, beroeps- en patiëntenverenigingen. De werkgroep heeft het commentaar verwerkt waarna de richtlijn door alle relevante betrokken partijen is geautoriseerd
Inbreng patiëntenperspectief
Twee patiëntvertegenwoordigers namen zitting in de richtlijnwerkgroep (één ervaringsdeskundige op het gebied van meningeoom en één deskundige op het gebied van richtlijnontwikkeling). Bij de ontwikkeling van deze richtlijn is tijdens alle fasen gebruik gemaakt van de input van deze patiëntvertegenwoordigers. Deze input is nodig voor de ontwikkeling van een kwalitatief goede richtlijnen. Een goede behandeling voldoet immers aan de wensen en eisen van zowel zorgverlener als patiënt.
Door middel van onderstaande methoden is informatie verkregen en zijn de belangen van de patiënt meegenomen:
- Bij aanvang van het richtlijntraject is een patiëntenversie van de enquête voor het inventariseren van knelpunten in de zorg voor patiënten met een meningeoom uitgezet bij leden van de NVMP.
- Tijdens het richtlijntraject heeft een gesprek plaatsgevonden waarbij de patiëntvertegenwoordigers, de verpleegkundigen, de neuropsycholoog, de procesbegeleider en de voorzitter aanwezig waren om het patiëntenperspectief te inventariseren met behulp van het ICF-model. Het gesprek vond plaats ten tijde van het literatuuronderzoek van de evidence based uitgangsvragen. Hierdoor kon het patiëntperspectief worden meegenomen in de overige overwegingen bij het bespreken van de conclusies die volgden uit het literatuuronderzoek. De gestructureerde inventarisatie maakte de bijdrage vanuit het patiëntperspectief inzichtelijk en is vooral terug te vinden in de overige overwegingen en in de aanbevelingen.
- De NVMP en Vereniging Cerebraal zijn geconsulteerd in de externe commentaarronde.
Inventarisatie patiëntenperspectief middels het ICF-model
Het patiëntenperspectief is geïnventariseerd door de invloed van het hebben/hebben gehad van een meningeoom op het gehele leven, in al de dimensies van het ICF-model, te beschrijven.
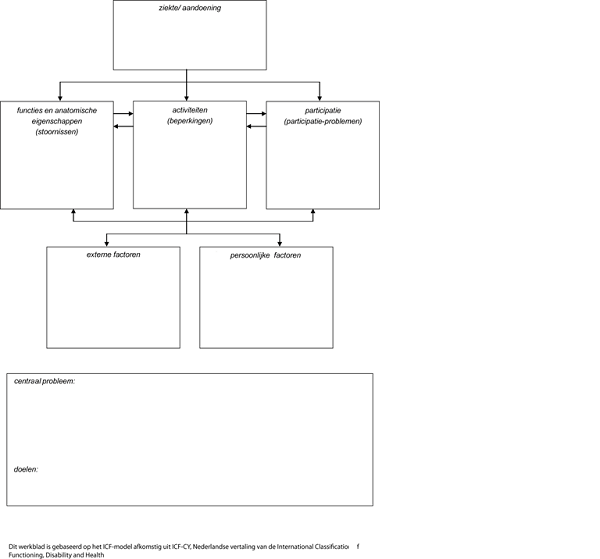
Ziekte/aandoening: mogelijkheden en beperkingen t.a.v.:
- Mentale functies
- Sensorische functies en pijn
- Stem en spraak
- Functies van hart en bloedvatenstelsel, hematologisch systeem, afweersysteem en ademhalingsstelsel
- Functies van spijsverteringsstelsel, metabool stelsel en hormoonstelsel
- Functies van urogenitaal stelsel en reproductieve functies
- Functies van bewegingssysteem en aan beweging verwante functies
- Functies van huid en verwante structuren
Mogelijkheden en beperkingen door de ziekte/aandoening voor patiënten met een meningeoom: medisch inhoudelijke zaken worden reeds in de richtlijn beschreven.
Functies en anatomische eigenschappen: mogelijkheden en beperkingen t.a.v.:
- Anatomische eigenschappen van zenuwstelsel
- Anatomische eigenschappen van oog, oor en verwante structuren
- Anatomische eigenschappen van structuren betrokken bij stem en spraak
- Anatomische eigenschappen van hart en bloedvatenstelsel, afweersysteem en ademhalingsstelsel
- Anatomische eigenschappen van spijsverteringsstelsel, metabool stelsel en hormoonstelsel
- Anatomische eigenschappen van urogenitaal stelsel
- Anatomische eigenschappen van structuren verwant aan beweging
- Anatomische eigenschappen van huid en verwante structuren
Mogelijkheden en beperkingen van functies en anatomische eigenschappen voor patiënten met een meningeoom:
- Epilepsie
- Vermoeidheid
- Cognitie
- Focale neurologische uitvalverschijnselen
- (Hoofd)Pijn
- Veranderingen van persoonlijkheid, emotie en gedrag
Activiteiten en participatie: mogelijkheden en beperkingen t.a.v.:
- Leren en toepassen van kennis
- Algemene taken en eisen
- Communicatie
- Mobiliteit
- Zelfverzorging
- Huishouden
- Tussenmenselijke interacties en relaties
- Belangrijke levensgebieden
- Maatschappelijk, sociaal en burgerlijk leven
Mogelijkheden en beperkingen van activiteiten en participatie voor patiënten met een meningeoom:
- Intermenselijke interactie en relaties
- Communicatie en mobiliteit
- Onderhouden van relaties
- Financiële afhankelijkheid
- Werkrelaties
- ADL
- Oudertaken
- Huishoudelijke taken
- Participatieproblemen
- Vrijetijdsbesteding
- Autorijden
- In een vliegtuig zitten
Externe factoren: mogelijkheden en beperkingen t.a.v.:
- Producten en technologie
- Natuurlijke omgeving en door de mens aangebrachte veranderingen daarin
- Ondersteuning en relaties
- Attitudes
- Diensten, systemen en beleid (bijv. binnen de maatschappij of gezondheidszorg)
Mogelijkheden en beperkingen van externe factoren voor patiënten met een meningeoom:
- Sociale omgeving
- Maatschappelijk functioneren
- Rol in gezin en relaties
- Beperkte toegankelijkheid van professionele hulp. Oorzaak hiervan is onvoldoende bekendheid met het aanbod en de beperkte vergoedingen van de verzekeraar
- Nazorgmogelijkheden voor partner zijn beperkt (i.v.m. vergoeding verzekeraar)
- UWV, Jobcoach
- Toegang tot nazorg/revalidatie is soms complex
De deelnemers aan de telefonische vergadering geven het volgende aan:
Wanneer er geen primaire revalidatie-indicatie is, is nazorg (te) beperkt, omdat de restverschijnselen niet gezien worden door zorgverleners. Met name de cognitieve beperkingen worden niet voldoende herkend. Screening gericht op cognitieve functies zouden hiervoor uitgevoerd moeten worden. Ook de patiënt en diens omgeving herkennen cognitieve dysfunctie pas op een later moment.
Na een half en een heel jaar postoperatief zou screening op cognitieve verschijnselen moeten plaatsvinden. Preoperatieve screening zou i.v.m. onderzoeksdoeleinden waardevol kunnen zijn. Een screeningsinstrument dat ingezet kan worden (als hulpmiddel): CLCE (niet gevalideerd). Het heeft mogelijk de voorkeur om een instrument te kiezen dat door de patiënt zelf wordt ingevuld, i.v.m. efficiëntie. Zorgverlener kan de patiënt daarnaast actief aanspreken om kritisch naar het eigen functioneren te kijken en de patiënt bewust te maken van eventuele uitvalsverschijnselen, om daar vervolgens passende ondersteuning/nazorg bij te bieden.
Persoonlijke factoren: mogelijkheden en beperkingen t.a.v.:
- factoren binnen het individu
Niet besproken
Patiëntenperspectief bij de vijf evidence based uitgangsvragen:
-
Bij het maken van een keuze voor de behandeling is rekening houden met wat de invloed is van het meningeoom op het functioneren. Ondanks dat er sprake is van een asymptomatisch meningeoom is het belangrijk te realiseren dat patiënten heel verschillend om kunnen gaan met het feit dat er een tumor in het hoofd is gediagnosticeerd. De patiënt moet een beeld geschetst worden wat de gevolgen zijn van wel/niet behandelen. De psychische gesteldheid moet worden meegewogen in de keuze voor het wel/niet behandelen.
-
De keuzes voor behandeling zijn vooral medisch ingegeven. De patiënt moet wel goed geïnformeerd worden over de gevolgen van therapie zoals chirurgie en radiotherapie. Er is weinig landelijk voorlichtingsmateriaal voor deze specifieke doelgroep beschikbaar. In de richtlijn kan opgenomen worden dat de patiënt bij het bespreken van het behandelplan een mantelzorger dient mee te nemen.
-
De keuze voor aanvullende radiotherapie is vooral medisch ingegeven. Omdat er sprake is van een lage bewijskracht, is het nut van aanvullende radiotherapie niet geheel duidelijk. Hierdoor is er mogelijk meer ruimte voor de wens van de patiënt bij het vaststellen van het behandelplan, echter zal de uiteindelijke keuze met name van de arts afhankelijk zijn en is het aan de arts de voor- en nadelen duidelijk te bespreken met de patiënt.
-
Een duidelijke uitleg moet gegeven worden over de wijze en frequentie van follow-up bij een meningeoom. De patiënt moet goed geïnstrueerd worden bij welke klachten met welke zorgverlener contact opgenomen moet worden. De zorgverlener moet in het gehele (na)zorgtraject expliciet aandacht hebben voor angst, onzekerheid en depressie en zorgdragen voor adequate doorverwijzing.
-
Herhaaldelijke screening op neuropsychologische klachten is wenselijk. Hoe en door wie deze screening plaats moet vinden kan per centrum bepaald worden. Op indicatie kan een neuropsychologisch onderzoek uitgevoerd worden. Neuropsychologisch onderzoek kan van waarde zijn bij begeleiding bij re-integratie in het arbeidsproces.
Methode ontwikkeling
Consensus based
Implementatie
Het bevorderen van het gebruik van de richtlijn begint met een brede verspreiding van de richtlijn. Er wordt een mailing verstuurd onder de professionals via de (wetenschappelijke) verenigingen en de werkgroepen van IKNL. Ook is de richtlijn gepubliceerd op www.oncoline.nl/richtlijn Intracranieel Meningeoom. Tevens zal er een artikel of manuscript ter publicatie aangeboden worden aan het Nederlands Tijdschrift voor Geneeskunde. Ook in andere tijdschriften of bij bijvoorbeeld nascholingsbijeenkomsten wordt de richtlijn onder de aandacht gebracht. Om het gebruik in de dagelijkse praktijk te bevorderen zal er een samenvattingskaart van de richtlijn gemaakt worden. Daarnaast beschikt IKNL over een toolbox ter ondersteuning van de IKNL adviseurs netwerken c.q. professionals in het veld voor de implementatie van de richtlijn. De toolbox bevat:
-
Een overzicht van de aanbevelingen.
-
De kernboodschappen (belangrijkste inhoudelijke boodschappen).
-
Een basis PowerPointpresentatie voor IKNL adviseurs netwerken en werkgroepleden van deze richtlijn.
-
Een implementatieplan voor deze richtlijn (incl. indicatoren voor evaluatie van de richtlijn). Dit plan bevat voor de belangrijkste aanbevelingen uit de richtlijn een overzicht van belemmerende en bevorderende factoren voor de implementatie. Op basis hiervan beschrijft het plan de belangrijkste doelgroepen en (adviezen voor) concrete acties om implementatie te bevorderen.
- Een training aan de IKNL adviseurs netwerken.
Werkwijze
Werkwijze
De richtlijnwerkgroep bestaat uit zorgverleners van verschillende (para)medische disciplines (bijlage 1). Ook twee patiëntvertegenwoordigers namen zitting in de richtlijnwerkgroep: één ervaringsdeskundige op het gebied van meningeoom en één deskundige op het gebied van richtlijnontwikkeling. Een overzicht van alle leden van de werkgroep is opgenomen in bijlage 2.
De werkgroep is op 11 juli 2012 voor de eerste maal bijeengekomen. Op basis van een eerste inventarisatie van de knelpunten door de werkgroepleden is, door middel van een enquête onder professionals die betrokken zijn bij patiënten met een meningeoom, een knelpunteninventarisatie gehouden. Na het versturen van de enquête hebben 168 professionals gerespondeerd en knelpunten geprioriteerd en/of ingebracht. De meest relevante knelpunten zijn uitgewerkt tot vijf uitgangsvragen (bijlage 11) die evidence based zijn uitgewerkt.
Voor iedere uitgangsvraag werd uit de richtlijnwerkgroep een subgroep geformeerd.
Bij de evidence based beantwoording van de vijf uitgangsvragen verzorgde een externe methodoloog het literatuuronderzoek, in overleg met de betreffende subgroep. Dit betrof het uitvoeren van een systematische literatuursearch, het kritisch beoordelen van de literatuur en het verwerken van de literatuur in evidence tabellen (bijlage 9). Daarnaast werd door de methodoloog een concept literatuurbespreking met bijbehorende conclusies aangeleverd voor deze uitgangsvragen. De werkgroepleden stelden overige overwegingen en aanbevelingen op volgens de checklist ‘overige overwegingen en formuleren van aanbevelingen’ (bijlage 7).
Voor de consensus-based delen in de richtlijn raadpleegden de werkgroepleden zelf de relevante bestaande literatuur. Op basis hiervan hebben de werkgroepleden de conclusies, overige overwegingen en aanbevelingen geformuleerd. Voor de consensus based beantwoording is geen systematisch literatuuronderzoek verricht en zijn de artikelen niet methodisch beoordeeld door een externe methodoloog.
De werkgroep heeft gedurende een periode van 18 maanden gewerkt aan de tekst van de conceptrichtlijn. Alle teksten zijn tijdens plenaire en telefonische vergaderingen besproken en na verwerking van de commentaren door de werkgroep geaccordeerd.
