Intracranieel Meningeoom - Symptomatisch meningeoom
Uitgangsvraag
Wat is de beste behandelingsmethode bij een patiënt met een symptomatisch intracranieel meningeoom in termen van morbiditeit en mortaliteit en progressievrije overleving / symptoomvrije overleving: chirurgie versus radiotherapie versus wait-and-scan?
Aanbeveling
Op basis van wetenschappelijk onderzoek ten aanzien van de behandeling van patiënten met een symptomatisch convexiteitsmeningeoom kan geen uitspraak kan worden gedaan over de beste behandeling, chirurgie en/of (stereotactische) radiotherapie. De keuze voor behandeling van een individuele patiënt zal op basis van het chirurgisch en radiotherapeutisch risicoprofiel moeten worden gekozen, waarbij de grootte, de locatie van het meningeoom, de leeftijd en de co-morbiditeit van een patiënt een belangrijke rol spelen.
Als primaire behandeling bij patiënten met een symptomatisch petroclivaal, schedelbasis of nervus opticus meningeoom dient stereotactische radiotherapie of radiochirurgie te worden overwogen. Bij het bestaan van bedreigende massawerking door dergelijke tumoren moet worden overwogen om de primaire behandeling te laten bestaan uit chirurgische decompressie, waarna in tweede instantie bestraling kan volgen.
Bij de keuze om patiënten met een symptomatisch meningeoom wel of niet te behandelen dienen de volgende kenmerken te worden overwogen:
- gerapporteerde groei:
- groei in het eerste jaar van >10% van de maximale diameter van het meningeoom is een risicofactor voor verdere groei en/of ontstaan van symptomen. Kanttekening is dat de percentuele lineaire groeisnelheid geen ideale maat voor groei is, met name bij meningeomen met een irregulaire vorm en bij zeer kleine laesies (waar 10% groei sneller bereikt wordt)
- tumorgrootte
- massawerking
- locatie:
- schedelbasismeningeomen lijken een lagere groeisnelheid te hebben dan convexiteitsmeningeomen. Hier staat tegenover dat beperkte groei van een schedelbasismeningeoom dat nabij belangrijke neurovasculaire structuren ligt, snel tot (irreversibele) symptomen kan leiden
- radiologische karakteristieken:
- meningeomen met calcificaties lijken trager te groeien
- T2-hyperintense meningeomen hebben een grotere kans om te groeien
- leeftijd en geslacht:
- patiënten met een leeftijd boven 70 jaar lijken een groter risico te hebben op het symptomatisch worden van een meningeoom, maar groei van een meningeoom vlakt meestal af voor of rond de leeftijd van 80 jaar
- jonge mannen (40 jaar en jonger) hebben een hogere kans op een WHO II en III meningeoom
Het is van belang de voorkeuren van de patiënt te bespreken alsmede de achtergronden daarvan. In het bijzonder moet aandacht worden besteed aan eventuele onjuiste denkbeelden van de patiënt over de prognose en risico's van behandelopties.
Overwegingen
Overige overwegingen (consensus based literatuurbespreking) zie ook uitgangsvraag 1 Asymptomatisch meningeoom en uitgangsvraag 4 Radiologische follow-up.
Ten aanzien van de keuze voor behandeling
Er is een redelijke hoeveelheid literatuur beschikbaar over het beloop van meningeomen (symptomatisch en asymptomatisch) die initieel niet behandeld zijn en klinisch-radiologisch worden vervolgd. In deze artikelen zijn patiënten met symptomatische en asymptomatische laesies vaak samengevoegd, waardoor deze studies niet konden worden opgenomen in de literatuurbeschrijving.
Conclusies hieruit zijn:
- Er is een beperkte follow-up duur van onbehandelde (asymptomatische/symptomatische) meningeomen, maar bij ongeveer de helft van deze meningeomen is er groei gedurende de eerste 4-5 jaar na diagnosestelling.
- De groei bij WHO graad I meningeomen is S-vormig met een afvlakking in de loop van het leven (voor 80ste levensjaar).
- Jonge mannen (<40 jaar) hebben een hoger risico op een WHO graad II of III meningeoom.
- Groei van onbehandelde (symptomatische of asymptomatische) meningeomen leidt in de eerste 4-5 jaar niet tot (nieuwe of toegenomen) klinische symptomen.
- Bij follow-up blijken grote (> 2.5cm) en initieel snel groeiende (>10% toename van de maximale diameter in het eerste jaar) meningeomen, en meningeomen met een T2 hyperintense tumormassa, vaker groei en/of symptomen te geven, terwijl gecalcificeerde meningeomen juist minder vaak groei vertonen. Kanttekening is dat de percentuele lineaire groeisnelheid geen ideale maat voor groei is, vooral bij meningeomen met een irregulaire vorm en bij zeer kleine laesies (waar 10% groei sneller bereikt wordt).
- Spheno-orbitale en andere schedelbasismeningeomen (symptomatisch/asymptomatisch) groeien meestal langzaam, tenzij ze initieel al groot zijn of een grote wekedelencomponent hebben.
Omdat er geen bewijs van hoge kwaliteit is over de optimale behandeling bij symptomatischemeningeomen, is er veel ruimte voor individuele voorkeuren van arts en patiënt in het maken van keuzes. Hierbij kunnen de wens tot curatie (met chirurgie), de wens tot massareductie, de wens tot een histologische diagnose, en de angst voor complicaties van een behandeling, een rol spelen.
Er kunnen ook onjuiste denkbeelden over een meningeoom bij een patiënt meespelen, zoals:
- ‘Epilepsie zal zeker genezen na meningeoom-chirurgie.'
- ‘Een meningeoom groeit altijd en zal altijd tot klachten en/of levensbedreiging leiden.'
- ‘Een meningeoom is een tijdbom die ineens tot levensbedreigende complicaties kan leiden.'
- ‘Een meningeoom moet altijd geopereerd worden, want ‘weg is zeker weg'.'
De tumorlocatie lijkt van belang te zijn in de inschatting van de risk-benefit-ratio van een behandeling, hoewel hierover zeer weinig literatuur is en deze literatuur bovendien van lage kwaliteit is. Voor het convexiteitsmeningeoom geldt in de praktijk dat indien een dergelijke tumor symptomatisch is, vrijwel altijd tot operatieve verwijdering/behandeling zal worden overgegaan. Dergelijke tumoren zijn over het algemeen meestal volledig te verwijderen met een relatief laag mortaliteitsrisico.
Ten aanzien van het risico op bijwerkingen
Aangezien in het literatuuroverzicht niet alle studies konden worden geïncludeerd over complicatie risico's van chirurgie van meningeomen enerzijds en stereotactische radiotherapie van meningeomen, anderzijds volgen hier toevoegingen betreffende dit onderwerp.
In een studie van Sanai et al. werden bij 141 patiënten die een resectie ondergingen voor een supratentorieel convexiteitsmeningeoom geen perioperatieve complicaties of overlijden gezien (11). Wel waren er neurochirurgische of algemeen medische postoperatieve complicaties bij 14 van de 141 patiënten (10%). Deze bestonden uit een postoperatief ontstaan hematoom waarvoor re-exploratie nodig was, liquorlekkage, wondinfecties, longembolie en diep veneuze trombose.
In een analyse van 834 patiënten die een meningeoom operatie ondergingen bleek bij 57 patiënten (6,8%) postoperatief een ernstige algemeen medische complicatie te zijn opgetreden, waaronder pneumonie, verminderde nierfunctie, arhythmie, diep veneuze trombose en longembolie. Vier patiënten overleden. Bij een univariate analyse bleek dat het ontwikkelen van nieuwe of toegenomen neurologische uitval, leeftijd >65 jaar, hoge bloeddruk en het gebruik van >2 cardiale medicamenten voor chirurgie significant was geassocieerd met een hoger risico op postoperatieve algemeen medische complicaties. Een multivariate analyse liet zien dat nieuwe of toegenomen neurologische uitval een significante risicofactor bleef voor het optreden van een ernstige algemeen medische complicatie (12). Tot slot bleek in een cohortstudie van Bateman et al. bij 8861 patiënten die een meningeoom operatie ondergingen dat de mortaliteit bij patiënten ouder dan 70 jaar signficant hoger was dan bij patiënten jonger dan 70 (4.0% vs. 1.1%, p<0.001) (13).
In een meta-analyse van 15 Europese gamma knife centra werden de resultaten en bijwerkingen geanalyseerd bij 4565 patiënten die radiochirurgie ondergingen voor een intracranieel meningeoom. Bij 13% van de patiënten (n=497) ontstonden er complicaties, waarvan er 6.3% van tijdelijke aard waren en 6,6% van permanente aard. De complicaties die ontstonden waren hoofdpijn (n=61, 1,6%), trigeminus symptomatologie (n=37, 1%), oculomotorius uitval (n=33, 0,8%), visusstoornissen (n=23, 0,6%), symptomatisch cerebraal oedeem (n=20, 0,5%), epileptische aanvallen (n=18, 0,5%), hemiparese (n=17, 0,5%) en ataxie/vertigo (n=14, 0,4%). In totaal waren er 4,7% graad 1 bijwerkingen, 6,8% graad 2 bijwerkingen en 1,4% graad 3 bijwerkingen (1,2% permanent). Er werd geen significant verschil gezien in bijwerkingen tussen schedelbasismeningeomen en convexiteitsmeningeomen (17 vs. 15%, permanent graad 3: 1,7% vs. 1,2%). In totaal overleden 4 patiënten aan complicaties na de stereotactische radiotherapie: 3 patiënten door cerebraal oedeem en 1 patiënt door een hydrocefalus/necrose (14).
Onderbouwing
Conclusies / Summary of Findings
De kwaliteit van de beschikbare literatuur voor deze uitgangsvraag is erg beperkt. De hoogst gevonden kwaliteit van deze studies is van zeer lage kwaliteit.
Over behandeling van patiënten met een symptomatisch convexiteitsmeningeoom is geen relevante literatuur gevonden, zodat er geen bewijs beschikbaar is over de beste behandelingsmethode voor deze categorie.
Niveau: Geen
Progressievrije overleving
Voor patiënten met een symptomatisch petroclivaal meningeoom, nervus opticusmeningeoom of een meningeoom van de schedelbasis is er bewijs van zeer lage kwaliteit dat stereotactische radiotherapie of radiochirurgie leidt tot een goede progressievrije overleving.
Niveau: Zeer laag: Pechlivanis 2011 (1); Adeberg 2011 (5); Gorman 2008 (6); Park 2006 (4)
Voor patiënten met een symptomatisch petroclivaal meningeoom is er bewijs van zeer lage kwaliteit dat de progressievrije overleving lager ligt na chirurgie dan na stereotactische radiotherapie of radiochirurgie. Echter de verschillen kunnen te wijten zijn aan patiëntenselectie, wat een definitieve conclusie onmogelijk maakt.
Niveau: Zeer laag; Pechlivanis 2011 (1); Park 2006 (4)
Effect op morbiditeit
Voor patiënten met een nervus opticus meningeoom is er bewijs van zeer lage kwaliteit dat primaire gefractioneerde stereotactische radiotherapie de visus significant verbetert ten opzichte van chirurgie gevolgd door postoperatieve gefractioneerde stereotactische radiotherapie. Echter de verschillen kunnen te wijten zijn aan patiëntenselectie, wat een definitieve conclusie onmogelijk maakt.
Niveau: Zeer laag: Adeberg 2011 (5)
Voor patiënten met een meningeoom van de schedelbasis is er bewijs van zeer lage kwaliteit dat primaire gefractioneerde stereotactische radiotherapie de symptomen significant verbetert ten opzichte van chirurgie gevolgd door postoperatieve gefractioneerde stereotactische radiotherapie.
De verschillen kunnen echter te wijten zijn aan patiëntenselectie, wat een definitieve conclusie onmogelijk maakt. Bovendien kan niet uitgesloten worden dat bij sommige patiënten ‘massareductie' en niet symptoomverbetering het doel van chirurgie was.
Niveau: Zeer laag: Gorman 2008 (6)
Voor patiënten met een symptomatisch meningeoom is er bewijs van zeer lage kwaliteit dat stereotactische radiotherapie en radiochirurgie minder gepaard gaan met bijwerkingen dan chirurgie.
Niveau: Zeer laag: Pechlivanis 2011 (1); Tanzler 2011 (8)
Algehele kwaliteit van bewijs: zeer laag
Samenvatting literatuur
Cruciale uitkomstmaten voor deze uitgangsvragen zijn: progressievrije overleving, effect op morbiditeit en effect op mortaliteit.
Eén systematische review (gerapporteerd in twee publicaties) (1) (2) en zeven cohortstudies (3) (4) (5) (6) (7) (8) (9) vergeleken verschillende behandelingsmethodes voor patiënten met een symptomatisch intracranieel meningeoom. De systematische review vergeleek de effecten van chirurgie en verschillende vormen van radiotherapie, en includeerde 31 observationele studies. Slechts twee hiervan waren vergelijkende studies: de studie van Pamir et al. (3) die ook hieronder besproken wordt, en de studie van Maruyama et al. (10) die ook patiënten met een recidief includeerde en daarom niet verder zal worden besproken.
De zeven cohortstudies includeerden in totaal 658 patiënten met een intracranieel meningeoom, waarbij aangemerkt dient te worden dat het in deze studies vrijwel uitsluitend ging om meningeomen uitgaande van de schedelbasis (sinus cavernosus, petroclivaal, of schedelbasis in algemene zin). Er zijn geen studies gevonden over convexiteitsmeningeomen.
Kwaliteit van het bewijs
Het risico op bias van deze studies is groot. De systematische review is op zich goed uitgevoerd, maar beperkt zich tot de literatuur gepubliceerd tussen 2003 en 2008. Sommige van de 31 besproken studies includeerden ook patiënten met een recidief meningeoom.
Van de zeven cohortstudies was er slechts één prospectief (5). Bij drie studies gebeurde de inclusie van patiënten consecutief (5) (8) (9). Geen enkele van deze studies corrigeerde voor risicofactoren, zoals leeftijd, geslacht, tumorlocatie, WHO graad. De mediane/gemiddelde duur van follow-up varieerde tussen 39 maanden en 7,3 jaar. Slechts drie studies rapporteerden de WHO gradering voor minstens een deel van de patiënten. De (histo)pathologische diagnose ontbrak meestal. De Simpson gradering werd in geen enkele studie vermeld.
Gewenste effecten
Progressievrije overleving (cruciale uitkomst)
Pechlivanis et al. rapporteerden de resultaten in twee reviews naargelang de lokalisatie van het meningeoom (1) (2) Eén serie van 150 patiënten behandeld met chirurgie voor een petroclivaal meningeoom had een progressievrije overleving van 96%, 87% en 80% na 3, 7 en 12 jaar, respectievelijk. Twee series van 40 patiënten in totaal, die behandeld werden met gefractioneerde stereotactische radiotherapie of radiochirurgie voor een atypisch of maligne meningeoom hadden een 3-jaars progressievrije overleving van 100% (atypische) en 57% (maligne) (1) (2).
Adeberg et al. includeerden prospectief 40 patiënten met (voornamelijk visuele) symptomen ten gevolge van een nervus opticus meningeoom (5). Hiervan ondergingen 19 patiënten primaire gefractioneerde stereotactische radiotherapie, 9 patiënten chirurgie met onmiddellijk postoperatief gefractioneerde stereotactische radiotherapie, en 12 patiënten chirurgie met gefractioneerde stereotactische radiotherapie bij progressie (mediane duur tot progressie: 56 maanden). Alle patiënten die chirurgie ondergingen hadden een meningeoom WHO graad I, maar sommige hiervan werden vóór de invoering van de WHO gradering in 2000 geïncludeerd. Nergens wordt vermeld welke criteria gehanteerd werden voor de keuze van behandeling. Na een mediane follow-up van 60 maanden was de progressievrije overleving 100% voor de totale populatie.
Gorman et al. includeerden retrospectief 38 patiënten symptomatische meningeomen van de schedelbasis (6). Veertien patiënten werden behandeld met primaire gefractioneerde stereotactische radiotherapie en 24 patiënten ondergingen chirurgie met postoperatieve gefractioneerde stereotactische radiotherapie. Van deze laatste groep waren er 14 patiënten die de gefractioneerde stereotactische radiotherapie ondergingen omwille van een recidief. Deze patiënten worden hier verder buiten beschouwing gelaten. Na een gemiddelde follow-up van 52,8 maanden toonde geen enkele patiënt lokale tumorprogressie op MRI.
Park et al. includeerden retrospectief 75 patiënten met een petroclivaal meningeoom (4). Hiervan werden er 49 behandeld met microchirurgie, 5 patiënten ondergingen radiotherapie, 12 patiënten radiochirurgie en bij 9 patiënten werd een wait-and-see beleid gevoerd. Vermoedelijk werden ook een aantal asymptomatische patiënten geïncludeerd, maar het exacte aantal is onduidelijk. Patiënten die microchirurgie ondergingen (n=39, waarvan n=11 adjuvante radiotherapie) hadden een 5-jaars progressievrije overleving van 75% en een mediane progressievrije periode van 64 maanden. Geen van de 5 patiënten die alleen radiotherapie ondergingen en geen van de 12 patiënten die alleen radiochirurgie ondergingen toonden klinische of radiologische progressie na een mediane follow-up van 56 resp. 52 maanden. Twee van de 9 patiënten die een wait-and-see beleid kregen werden uiteindelijk chirurgisch behandeld vanwege tumorprogressie. Het is onmogelijk om uit te maken of de verschillen in progressievrije overleving te wijten zijn aan patiëntenselectie.
Drie studies rapporteerden geen progressievrije overleving, maar lokale tumorcontrole. Lee et al. includeerden retrospectief 176 patiënten met een symptomatisch meningeoom van de sinus cavernosus (9). Van 17 patiënten was onvoldoende follow-up beschikbaar. Vier patiënten hadden een atypisch of maligne meningeoom, van de andere patiënten was geen WHO graad bekend. De tumorcontrole na 5 jaar bedroeg 97% voor primaire radiochirurgie (N=83) versus 80% voor chirurgie en postoperatieve radiochirurgie (N=76). Tanzler et al. includeerden 146 patiënten met een WHO graad I meningeoom op diverse locaties (8). De lokale tumorcontrole na 5 jaar bedroeg 99% voor primaire radiotherapie (n=88) versus 96% voor chirurgie en postoperatieve radiotherapie (n=58). De lokale tumorcontrole na 10 jaar bedroeg 99% en 93%, respectievelijk. Wat de interpretatie van deze cijfers bemoeilijkt is dat verschillende vormen van radiotherapie werden toegediend, namelijk conventionele radiotherapie (n=41), stereotactische radiotherapie (n=103) en intensiteit gemoduleerde radiotherapie (IMRT) (n=2). Tenslotte, Torres et al. includeerden retrospectief 161 patiënten met in totaal 194 intracraniële meningeomen (7). Van 33 patiënten (die 38 meningeomen hadden) was onvoldoende follow-up beschikbaar. Van de overige meningeomen werden er 79 behandeld met radiochirurgie en 77 met gefractioneerde stereotactische radiotherapie. Na een gemiddelde follow-up van 32,5 maanden bedroeg de tumorcontrole 92% na radiochirurgie en 97% na gefractioneerde stereotactische radiotherapie. Ongeveer twee derde van de patiënten onderging voorafgaande resectie, wat de interpretatie van deze cijfers bemoeilijkt. Opnieuw is het onmogelijk om uit te maken of de verschillen in lokale tumorcontrole, gerapporteerd in deze 3 studies, te wijten zijn aan patiëntenselectie.
Effect op morbiditeit (cruciale uitkomst)
De effecten van behandeling op morbiditeit zoals gerapporteerd in het review van Pechlivanis et al. zijn moeilijk samen te vatten gezien de zeer heterogene populaties en behandelingen, de heterogene rapportage en door het ontbreken van een controlegroep in de grote meerderheid van de studies (1) (2). Visuele symptomen verbeterden na chirurgie in 75% van de patiënten met een meningeoom ter hoogte van het tuberculum sellae, in 44% van de patiënten met een spheno-orbitaal meningeoom, in 59% van de patiënten met een meningeoom ter hoogte van het planum sphenoidale of de olfactorius groeve en in 8-14% van de patiënten met een nervus opticus meningeoom. Na chirurgie trad verslechtering van visuele symptomen op in 8% van de patiënten met een meningeoom ter hoogte van het tuberculum sellae en in 16-45% van de patiënten met een nervus opticus meningeoom. Hersenzenuwuitval verbeterde na chirurgie in 27% van de patiënten met een spheno-orbitaal meningeoom, maar verslechterde in 18% van de patiënten. In 84% van de patiënten met een meningeoom ter hoogte van het planum sfenoïdale of de olfactoriusgroeve verbeterde de cognitieve functie, en in 36% verbeterde de reukzin. In 11% verslechterden de symptomen. Bij 62% van de patiënten met een meningeoom ter hoogte van de voorste of middelste fossa verbeterden de neurologische symptomen na stereotactische radiotherapie. In 44% verbeterde de hersenzenuwuitval, terwijl deze in 5% verslechterde. In 63% van de patiënten met een parasagittaal meningeoom en durale invasie verbeterden de symptomen na radiochirurgie.
Adeberg et al. rapporteerden een significant verbeterde visus na primaire stereotactische radiotherapie versus chirurgie met postoperatieve stereotactische radiotherapie (75% vs. 20%, p<0.005) bij een nervus opticus meningeoom (5). Gorman et al. rapporteerden het herstel van neurologische symptomen in 21% van de patiënten die primaire stereotactische radiotherapie ondergingen voor een schedelbasismeningeoom (6). Een verbetering van de symptomen werd gerapporteerd in respectievelijk 29% en 50% van de patiënten die primaire stereotactische radiotherapie of chirurgie gevolgd door postoperatieve stereotactische radiotherapie ondergingen. Van de patiënten die behandeld werden met chirurgie en postoperatieve stereotactische radiotherapie kreeg 20% nieuwe symptomen. De initiële symptomen werden echter niet van alle patiënten gerapporteerd.
Van de 159 patiënten met voldoende follow-up in de studie van Lee et al. ontwikkelden 3 patiënten (2%) progressieve neurologische symptomen na stereotactische radiotherapie (9).
Park et al. rapporteerden bij patiënten met een petroclivaal meningeoom een postoperatieve verbetering van hemiparese en cerebellaire dysfunctie in 90% en 77%, respectievelijk (4). Hersenzenuwuitval verbeterde in 69% na onvolledige resectie versus 20% na volledige resectie (p=0,032), maar verslechterde in 29% van de patiënten die microchirurgie ondergingen. Eén patiënt die radiotherapie onderging toonde een cognitieve achteruitgang na 3 jaar.
Tenslotte, Torres et al. rapporteerden een verbetering van de neurologische symptomen in respectievelijk 35% en 32% van de patiënten na radiochirurgie en stereotactische radiotherapie, tegenover een verslechtering van de symptomen in 8% en 3%, respectievelijk (7).
Opnieuw dient opgemerkt te worden dat het onmogelijk is om uit te maken of deze verschillen te wijten zijn aan patiëntenselectie.
Ongewenste effecten van de behandeling
Ongewenste effecten ten gevolge van de behandeling werden zeer heterogeen gerapporteerd.
Pechlivanis et al. rapporteerden de volgende chirurgie-gerelateerde nevenwerkingen. Hersenzenuwuitval (38%), verminderde visus (14%), subduraal hygroom en hydrocefalus (9%), beroerte (4%) (1) (2). De totale morbiditeit (tijdelijk en blijvend) ten gevolge van chirurgie bedroeg 6-43%, ten gevolge van radiochirurgie 5-13% en ten gevolge van gefractioneerde stereotactische radiotherapie 3%.
Adeberg et al. rapporteerden visuele bijwerkingen na gefractioneerde stereotactische radiotherapie in 8% van de patiënten met een nervus opticus meningeoom (5). De meeste patiënten ontwikkelden lokale alopecie. Andere nevenwerkingen waren: vermoeidheid (20%), tranende ogen (8%), en xerophthalmie (5%).
Tanzler et al. rapporteerden ernstige complicaties ten gevolge van chirurgie in 17% van de patiënten (liquor lekkage, SAB met sinus trombose, visusverlies, hydrocefalus, botlapinfectie, hypothalame as dysfunctie) (8). Na radiotherapie waren deze complicaties bij 7% aanwezig en bestonden uit cerebraal oedeem (n=2, 1 patiënt overleed), opthalmologische complicaties (n=4), hydrocefalus (n=1) en osteomyelitis (n=1).
Torres et al. rapporteerden complicaties na stereotactische radiotherapie of radiochirurgie bij ongeveer 5% van de patiënten (7). Deze bestonden uit een geringe achteruitgang in visus (2,5%) en geringe toename van gevoelsstoornissen in het gezicht (2,5%).
Effect op mortaliteit (belangrijke uitkomst)
Het effect van behandeling op mortaliteit wordt slechts in geringe mate gerapporteerd.
In de studie van Adeberg et al. was geen enkel overlijden te wijten aan het meningeoom, hoewel het exacte aantal niet gerapporteerd wordt. De totale 5-jaarsoverleving bedroeg 93% (5).
In de studie van Pamir et al. was er ook geen overlijden door het meningeoom, maar stierf er 1 patiënt in de chirurgiegroep ten gevolge van een myocardinfarct 8 maanden na de ingreep (3).
Lee et al. rapporteerden 1 overlijden ten gevolge van een postoperatief hematoom (na chirurgie voor progressie na stereotactische radiochirurgie) (9).
Tenslotte, Tanzler et al. rapporteerden 1 overlijden ten gevolge van radiatienecrose en 1 overlijden ten gevolge van peritumoraal oedeem (8).
Referenties
- 1 - Pechlivanis I, Wawrzyniak S, Engelhardt M, Schmieder K. Evidence level in the treatment of meningioma with focus on the comparison between surgery versus radiotherapy. A review. J Neurosurg Sci 2011 Dec;55(4):319-328.
- 2 - Schmieder K, Engelhardt M, Wawrzyniak S, Borger S, Becker K, Zimolong A. The impact of microsurgery, stereotactic radiosurgery and radiotherapy in the treatment of meningiomas depending on different localizations. GMS Health Technol Assess 2010 Mar 16;6:Doc02.
- 3 - Pamir MN, Kilic T, Bayrakli F, Peker S. Changing treatment strategy of cavernous sinus meningiomas: experience of a single institution. Surg Neurol 2005;64 Suppl 2:S58-66.
- 4 - Park CK, Jung HW, Kim JE, Paek SH, Kim DG. The selection of the optimal therapeutic strategy for petroclival meningiomas. Surg Neurol 2006 Aug;66(2):160-5; discussion 165-6.
- 5 - Adeberg S, Welzel T, Rieken S, Debus J, Combs SE. Prior surgical intervention and tumor size impact clinical outcome after precision radiotherapy for the treatment of optic nerve sheath meningiomas (ONSM). Radiat Oncol 2011 Sep 18;6:117-717X-6-117.
- 6 - Gorman L, Ruben J, Myers R, Dally M. Role of hypofractionated stereotactic radiotherapy in treatment of skull base meningiomas. J Clin Neurosci 2008 Aug;15(8):856-862.
- 7 - Torres RC, Frighetto L, De Salles AA, Goss B, Medin P, Solberg T, et al. Radiosurgery and stereotactic radiotherapy for intracranial meningiomas. Neurosurg Focus 2003 May 15;14(5):e5.
- 8 - Tanzler E, Morris CG, Kirwan JM, Amdur RJ, Mendenhall WM. Outcomes of WHO Grade I meningiomas receiving definitive or postoperative radiotherapy. Int J Radiat Oncol Biol Phys 2011 Feb 1;79(2):508-513.
- 9 - Lee JY, Niranjan A, McInerney J, Kondziolka D, Flickinger JC, Lunsford LD. Stereotactic radiosurgery providing long-term tumor control of cavernous sinus meningiomas. J Neurosurg 2002 Jul;97(1):65-72.
- 10 - Maruyama K, Shin M, Kurita H, Kawahara N, Morita A, Kirino T. Proposed treatment strategy for cavernous sinus meningiomas: a prospective study. Neurosurgery 2004 Nov;55(5):1068-1075.
- 11 - Sanai N, Sughrue ME, Shangari G, Chung K, Berger MS, McDermott MW. Risk profile associated with convexity meningioma resection in the modern neurosurgical era. J Neurosurg 2010 May;112(5):913-919.
- 12 - Sughrue ME, Rutkowski MJ, Shangari G, Chang HQ, Parsa AT, Berger MS, et al. Risk factors for the development of serious medical complications after resection of meningiomas. Clinical article. J Neurosurg 2011 Mar;114(3):697-704.
- 13 - Bateman BT, Pile-Spellman J, Gutin PH, et al. Meningioma resection in the elderly: nationwide inpatient sample, 1998-2002. Neurosurgery 2005 Nov;57(5):866-72; discussion 866-72.
- 14 - Santacroce A, Walier M, Regis J, Liscak R, Motti E, Lindquist C, et al. Long-term tumor control of benign intracranial meningiomas after radiosurgery in a series of 4565 patients. Neurosurgery 2012 Jan;70(1):32-9; discussion 39.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 24-11-2015
Beoordeeld op geldigheid : 04-01-2015
Voorwaarden voor revisie en beoordelingsfrequentie zijn vastgelegd in de richtlijn. De geldigheidstermijn voor de richtlijn (maximaal 5 jaar na vaststelling) wordt vanuit IKNL bewaakt.
Ook de Landelijke Werkgroep Neuro-Oncologie (LWNO) toetst jaarlijks de actualiteit van de richtlijn. Het bestuur van de landelijke werkgroep draagt de verantwoordelijkheid om de behoefte voor herziening van de huidige richtlijn bij de beroepsgroepen te peilen. Om verscheidene redenen kan actualisatie eerder dan beoogd nodig zijn. Zo nodig zal de richtlijn tussentijds op onderdelen worden bijgesteld. Als dat aan de orde is, verzoekt de LWNO de meest bij het desbetreffende onderwerp betrokken vereniging[en] de revisie te financieren, bijvoorbeeld door middel van een hierop gericht beroep op SKMS gelden. Uiterlijk in 2018 zal een nieuwe multidisciplinaire werkgroep worden geïnstalleerd om de richtlijn te reviseren.
Algemene gegevens
In 2011 heeft de Landelijke Werkgroep Neuro-Oncologie (LWNO) het Integraal Kankercentrum Nederland (IKNL) verzocht om een richtlijn Meningeoom te ontwikkelen. Naar aanleiding hiervan is een landelijke richtlijnwerkgroep Meningeoom opgericht. De multidisciplinaire werkgroep is in juli 2012 gestart met de ontwikkeling van de richtlijn Meningeoom. IKNL zorgde voor methodologische begeleiding en secretariële ondersteuning van het proces.
Naast de autoriserende verenigingen heb de volgende verenigingen ingestemd met de inhoud:
Nederlandse Vereniging van Meningeoom Patiënten (NVMP; per oktober 2013 deel van Patiëntenvereniging Cerebraal)
Patiëntenvereniging Cerebraal (via Leven met Kanker Beweging (voorheen NFK)
Doel en doelgroep
Doelstelling
De richtlijn is een document met aanbevelingen ter ondersteuning van de praktijkvoering van zorgverleners die betrokken zijn bij patiënten met een intracranieel meningeoom. De aanbevelingen zijn gebaseerd op een zo hoog mogelijke graad van wetenschappelijk bewijs en consensus binnen de werkgroepleden. De richtlijn biedt de gebruikers inzicht in het tot stand komen van de aanbevelingen. Uitgangspunt zijn de knelpunten die in de dagelijkse praktijk bij patiënten met een intracranieel meningeoom worden gesignaleerd.
Doel van de richtlijn
Het verbeteren van de kwaliteit van zorg voor volwassen patiënten met een meningeoom. De richtlijn behelst het traject van diagnostiek, behandeling, voorlichting en begeleiding van patiënten met een intracranieel meningeoom. De richtlijn beoogt hiermee de kwaliteit van de zorgverlening te verbeteren, het klinisch handelen meer te baseren op bewijs dan op ervaringen en meningen, de transparantie van keuze voor behandelingen te vergroten en de diversiteit van handelen door professionals te verminderen.
De richtlijn kan worden gebruikt bij het geven van voorlichting aan patiënten en biedt aanknopingspunten voor transmurale afspraken of lokale protocollen ter bevordering van de implementatie.
Doelgroep
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, klinische besluitvorming, behandeling en begeleiding van patiënten met een intracranieel meningeoom, zoals neurologen, neurochirurgen, radiotherapeuten, (neuro)pathologen, (neuro)radiologen, klinisch genetici, revalidatieartsen, huisartsen, psychologen, neuro-oncologieverpleegkundigen en verpleegkundig specialisten.
Deze richtlijn is primair geschreven voor bovenstaande (groepen) professionals en daardoor mogelijk minder makkelijk leesbaar voor patiënten. KWF Kankerbestrijding geeft patiëntenbrochures uit, die gebaseerd zijn op door IKNL gepubliceerde richtlijnen. Zie voor meer patiënteninformatie de folder ‘Hersentumoren’ van KWF en de website www.hersentumor.nl.
Doelpopulatie
De doelpopulatie betreft patienten van 18 jaar en ouder met een intracranieel meningeoom.
Samenstelling werkgroep
Alle werkgroepleden zijn afgevaardigd namens een wetenschappelijke, beroeps- of patiëntenvereniging en hebben daarmee het mandaat voor hun inbreng. Bij de samenstelling van de werkgroep is getracht rekening te houden met landelijke spreiding, inbreng van betrokkenen uit zowel academische als algemene ziekenhuizen/instellingen en vertegenwoordiging van de verschillende verenigingen/disciplines.
De Nederlandse Vereniging van Meningeoompatiënten (NVMP; per oktober 2013 deel van Patiëntenvereniging Cerebraal)) is eveneens vertegenwoordigd door middel van afvaardiging van de voorzitter van de patiëntenvereniging, alsmede een ervaringsdeskundige vanuit de Nederlandse Federatie van Kankerpatiëntenorganisaties (NFK) afkomstig van Vereniging Cerebraal.
De volgende (para)medische disciplines zijn in de werkgroep vertegenwoordigd:
- neurologie
- neurochirurgie
- radiotherapie
- (neuro)pathologie
- neuroradiologie
- neuropsychologie
- revalidatie
- verpleegkunde
Leden van de werkgroep
- Mw. dr. D. Brandsma, neuroloog Nederlands Kanker Instituut / Antoni van Leeuwenhoekziekenhuis en Slotervaartziekenhuis, Amsterdam, voorzitter
- Mw. drs. N.D.B. Gilhuijs, (neuro)patholoog, Westfries Gasthuis, Hoorn
- Dhr. Prof.dr. R.J.M. Groen, neurochirurg, UMCG, Groningen
- Mw. drs. E.J.J. Habets, psycholoog, MC Haaglanden, Den Haag
- Mw. drs. P. Hoenderdaal, patiëntvertegenwoordiger Vereniging Cerebraal
- Mw. dr. A.A. Jacobi - Postma, neuroradioloog MUMC+, Maastricht
- Mw. dr. A. Mendez Romero, radiotherapeut-oncoloog, Erasmus MC, Rotterdam
- Dhr. drs. C.G.J.H. Niël, radiotherapeut-oncoloog, RISO, Deventer
- Mw.dr. S.M. Peerdeman, neurochirurg, VUmc, Amsterdam
- Mw. H. Petersen - Baltussen, nurse practitioner neurochirurgie, Radboud Universitair Medisch Centrum, Nijmegen
- Mw. drs. V.P.M. Schepers, revalidatiearts, UMCU, Utrecht
- Dhr. dr. T.J. Snijders, neuroloog, UMCU, Utrecht
- Dhr. H. van Valkenburg, patiëntvertegenwoordiger
- Dhr. Prof.dr. P. Wesseling, (neuro)patholoog Radboud Universitair Medisch Centrum, Nijmegen, VUmc, Amsterdam
- Mw. J.M.C. Zwinkels, verpleegkundig specialist NO, MC Haaglanden, Den Haag
Dhr. Dr. F.J. Hes, klinisch geneticus, Leids Universitair Medisch Centrum (LUMC), Leiden, heeft een bijdrage geleverd aan de tekst over genetische syndromen.
Ondersteuning
Medewerkers van het IKNL waren verantwoordelijk voor de procesbegeleiding en secretariële ondersteuning.
- Mw. drs. E.J.A Verhoof, procesbegeleider IKNL, locatie Utrecht
- Mw. M.L. van de Kar-van der Meulen, secretariële ondersteuning werkgroep Meningeoom, IKNL, locatie Utrecht
Literatuuronderzoek
Het literatuuronderzoek en het opstellen van de concept conclusies voor het evidence based gedeelte werd uitgevoerd door dr. J. Vlayen [Medical Evaluation & Technology Assessment, ME-TA, België], en mw. dr. L. Veerbeek [IKNL].
Belangenverklaringen
Om de beïnvloeding van de richtlijnontwikkeling of formulering van de aanbevelingen door conflicterende belangen te minimaliseren zijn de leden van werkgroep gemandateerd door de wetenschappelijke verenigingen.
Alle werkgroepleden hebben bij aanvang en bij de afronding van het richtlijn traject een belangenverklaring ingevuld. Hiermee geven de werkgroepleden aan onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn. Potentiële conflicterende belangen zijn door middel van ondervraging van de werkgroepleden opgespoord en besproken. De bevindingen zijn schriftelijke vastgelegd in de belangenverklaring en opvraagbaar via oncoline@iknl.nl.
Daarnaast is conceptrichtlijn ter becommentariëring aangeboden op www.oncoline.nl en aan alle voor de knelpuntenanalyse benaderde wetenschappelijke, beroeps- en patiëntenverenigingen. De werkgroep heeft het commentaar verwerkt waarna de richtlijn door alle relevante betrokken partijen is geautoriseerd
Inbreng patiëntenperspectief
Twee patiëntvertegenwoordigers namen zitting in de richtlijnwerkgroep (één ervaringsdeskundige op het gebied van meningeoom en één deskundige op het gebied van richtlijnontwikkeling). Bij de ontwikkeling van deze richtlijn is tijdens alle fasen gebruik gemaakt van de input van deze patiëntvertegenwoordigers. Deze input is nodig voor de ontwikkeling van een kwalitatief goede richtlijnen. Een goede behandeling voldoet immers aan de wensen en eisen van zowel zorgverlener als patiënt.
Door middel van onderstaande methoden is informatie verkregen en zijn de belangen van de patiënt meegenomen:
- Bij aanvang van het richtlijntraject is een patiëntenversie van de enquête voor het inventariseren van knelpunten in de zorg voor patiënten met een meningeoom uitgezet bij leden van de NVMP.
- Tijdens het richtlijntraject heeft een gesprek plaatsgevonden waarbij de patiëntvertegenwoordigers, de verpleegkundigen, de neuropsycholoog, de procesbegeleider en de voorzitter aanwezig waren om het patiëntenperspectief te inventariseren met behulp van het ICF-model. Het gesprek vond plaats ten tijde van het literatuuronderzoek van de evidence based uitgangsvragen. Hierdoor kon het patiëntperspectief worden meegenomen in de overige overwegingen bij het bespreken van de conclusies die volgden uit het literatuuronderzoek. De gestructureerde inventarisatie maakte de bijdrage vanuit het patiëntperspectief inzichtelijk en is vooral terug te vinden in de overige overwegingen en in de aanbevelingen.
- De NVMP en Vereniging Cerebraal zijn geconsulteerd in de externe commentaarronde.
Inventarisatie patiëntenperspectief middels het ICF-model
Het patiëntenperspectief is geïnventariseerd door de invloed van het hebben/hebben gehad van een meningeoom op het gehele leven, in al de dimensies van het ICF-model, te beschrijven.
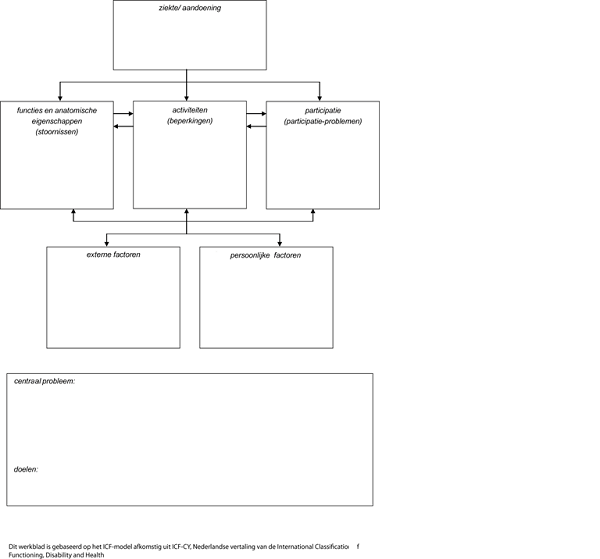
Ziekte/aandoening: mogelijkheden en beperkingen t.a.v.:
- Mentale functies
- Sensorische functies en pijn
- Stem en spraak
- Functies van hart en bloedvatenstelsel, hematologisch systeem, afweersysteem en ademhalingsstelsel
- Functies van spijsverteringsstelsel, metabool stelsel en hormoonstelsel
- Functies van urogenitaal stelsel en reproductieve functies
- Functies van bewegingssysteem en aan beweging verwante functies
- Functies van huid en verwante structuren
Mogelijkheden en beperkingen door de ziekte/aandoening voor patiënten met een meningeoom: medisch inhoudelijke zaken worden reeds in de richtlijn beschreven.
Functies en anatomische eigenschappen: mogelijkheden en beperkingen t.a.v.:
- Anatomische eigenschappen van zenuwstelsel
- Anatomische eigenschappen van oog, oor en verwante structuren
- Anatomische eigenschappen van structuren betrokken bij stem en spraak
- Anatomische eigenschappen van hart en bloedvatenstelsel, afweersysteem en ademhalingsstelsel
- Anatomische eigenschappen van spijsverteringsstelsel, metabool stelsel en hormoonstelsel
- Anatomische eigenschappen van urogenitaal stelsel
- Anatomische eigenschappen van structuren verwant aan beweging
- Anatomische eigenschappen van huid en verwante structuren
Mogelijkheden en beperkingen van functies en anatomische eigenschappen voor patiënten met een meningeoom:
- Epilepsie
- Vermoeidheid
- Cognitie
- Focale neurologische uitvalverschijnselen
- (Hoofd)Pijn
- Veranderingen van persoonlijkheid, emotie en gedrag
Activiteiten en participatie: mogelijkheden en beperkingen t.a.v.:
- Leren en toepassen van kennis
- Algemene taken en eisen
- Communicatie
- Mobiliteit
- Zelfverzorging
- Huishouden
- Tussenmenselijke interacties en relaties
- Belangrijke levensgebieden
- Maatschappelijk, sociaal en burgerlijk leven
Mogelijkheden en beperkingen van activiteiten en participatie voor patiënten met een meningeoom:
- Intermenselijke interactie en relaties
- Communicatie en mobiliteit
- Onderhouden van relaties
- Financiële afhankelijkheid
- Werkrelaties
- ADL
- Oudertaken
- Huishoudelijke taken
- Participatieproblemen
- Vrijetijdsbesteding
- Autorijden
- In een vliegtuig zitten
Externe factoren: mogelijkheden en beperkingen t.a.v.:
- Producten en technologie
- Natuurlijke omgeving en door de mens aangebrachte veranderingen daarin
- Ondersteuning en relaties
- Attitudes
- Diensten, systemen en beleid (bijv. binnen de maatschappij of gezondheidszorg)
Mogelijkheden en beperkingen van externe factoren voor patiënten met een meningeoom:
- Sociale omgeving
- Maatschappelijk functioneren
- Rol in gezin en relaties
- Beperkte toegankelijkheid van professionele hulp. Oorzaak hiervan is onvoldoende bekendheid met het aanbod en de beperkte vergoedingen van de verzekeraar
- Nazorgmogelijkheden voor partner zijn beperkt (i.v.m. vergoeding verzekeraar)
- UWV, Jobcoach
- Toegang tot nazorg/revalidatie is soms complex
De deelnemers aan de telefonische vergadering geven het volgende aan:
Wanneer er geen primaire revalidatie-indicatie is, is nazorg (te) beperkt, omdat de restverschijnselen niet gezien worden door zorgverleners. Met name de cognitieve beperkingen worden niet voldoende herkend. Screening gericht op cognitieve functies zouden hiervoor uitgevoerd moeten worden. Ook de patiënt en diens omgeving herkennen cognitieve dysfunctie pas op een later moment.
Na een half en een heel jaar postoperatief zou screening op cognitieve verschijnselen moeten plaatsvinden. Preoperatieve screening zou i.v.m. onderzoeksdoeleinden waardevol kunnen zijn. Een screeningsinstrument dat ingezet kan worden (als hulpmiddel): CLCE (niet gevalideerd). Het heeft mogelijk de voorkeur om een instrument te kiezen dat door de patiënt zelf wordt ingevuld, i.v.m. efficiëntie. Zorgverlener kan de patiënt daarnaast actief aanspreken om kritisch naar het eigen functioneren te kijken en de patiënt bewust te maken van eventuele uitvalsverschijnselen, om daar vervolgens passende ondersteuning/nazorg bij te bieden.
Persoonlijke factoren: mogelijkheden en beperkingen t.a.v.:
- factoren binnen het individu
Niet besproken
Patiëntenperspectief bij de vijf evidence based uitgangsvragen:
-
Bij het maken van een keuze voor de behandeling is rekening houden met wat de invloed is van het meningeoom op het functioneren. Ondanks dat er sprake is van een asymptomatisch meningeoom is het belangrijk te realiseren dat patiënten heel verschillend om kunnen gaan met het feit dat er een tumor in het hoofd is gediagnosticeerd. De patiënt moet een beeld geschetst worden wat de gevolgen zijn van wel/niet behandelen. De psychische gesteldheid moet worden meegewogen in de keuze voor het wel/niet behandelen.
-
De keuzes voor behandeling zijn vooral medisch ingegeven. De patiënt moet wel goed geïnformeerd worden over de gevolgen van therapie zoals chirurgie en radiotherapie. Er is weinig landelijk voorlichtingsmateriaal voor deze specifieke doelgroep beschikbaar. In de richtlijn kan opgenomen worden dat de patiënt bij het bespreken van het behandelplan een mantelzorger dient mee te nemen.
-
De keuze voor aanvullende radiotherapie is vooral medisch ingegeven. Omdat er sprake is van een lage bewijskracht, is het nut van aanvullende radiotherapie niet geheel duidelijk. Hierdoor is er mogelijk meer ruimte voor de wens van de patiënt bij het vaststellen van het behandelplan, echter zal de uiteindelijke keuze met name van de arts afhankelijk zijn en is het aan de arts de voor- en nadelen duidelijk te bespreken met de patiënt.
-
Een duidelijke uitleg moet gegeven worden over de wijze en frequentie van follow-up bij een meningeoom. De patiënt moet goed geïnstrueerd worden bij welke klachten met welke zorgverlener contact opgenomen moet worden. De zorgverlener moet in het gehele (na)zorgtraject expliciet aandacht hebben voor angst, onzekerheid en depressie en zorgdragen voor adequate doorverwijzing.
-
Herhaaldelijke screening op neuropsychologische klachten is wenselijk. Hoe en door wie deze screening plaats moet vinden kan per centrum bepaald worden. Op indicatie kan een neuropsychologisch onderzoek uitgevoerd worden. Neuropsychologisch onderzoek kan van waarde zijn bij begeleiding bij re-integratie in het arbeidsproces.
Methode ontwikkeling
Evidence based
Implementatie
Het bevorderen van het gebruik van de richtlijn begint met een brede verspreiding van de richtlijn. Er wordt een mailing verstuurd onder de professionals via de (wetenschappelijke) verenigingen en de werkgroepen van IKNL. Ook is de richtlijn gepubliceerd op www.oncoline.nl/richtlijn Intracranieel Meningeoom. Tevens zal er een artikel of manuscript ter publicatie aangeboden worden aan het Nederlands Tijdschrift voor Geneeskunde. Ook in andere tijdschriften of bij bijvoorbeeld nascholingsbijeenkomsten wordt de richtlijn onder de aandacht gebracht. Om het gebruik in de dagelijkse praktijk te bevorderen zal er een samenvattingskaart van de richtlijn gemaakt worden. Daarnaast beschikt IKNL over een toolbox ter ondersteuning van de IKNL adviseurs netwerken c.q. professionals in het veld voor de implementatie van de richtlijn. De toolbox bevat:
-
Een overzicht van de aanbevelingen.
-
De kernboodschappen (belangrijkste inhoudelijke boodschappen).
-
Een basis PowerPointpresentatie voor IKNL adviseurs netwerken en werkgroepleden van deze richtlijn.
-
Een implementatieplan voor deze richtlijn (incl. indicatoren voor evaluatie van de richtlijn). Dit plan bevat voor de belangrijkste aanbevelingen uit de richtlijn een overzicht van belemmerende en bevorderende factoren voor de implementatie. Op basis hiervan beschrijft het plan de belangrijkste doelgroepen en (adviezen voor) concrete acties om implementatie te bevorderen.
- Een training aan de IKNL adviseurs netwerken.
Werkwijze
Werkwijze
De richtlijnwerkgroep bestaat uit zorgverleners van verschillende (para)medische disciplines (bijlage 1). Ook twee patiëntvertegenwoordigers namen zitting in de richtlijnwerkgroep: één ervaringsdeskundige op het gebied van meningeoom en één deskundige op het gebied van richtlijnontwikkeling. Een overzicht van alle leden van de werkgroep is opgenomen in bijlage 2.
De werkgroep is op 11 juli 2012 voor de eerste maal bijeengekomen. Op basis van een eerste inventarisatie van de knelpunten door de werkgroepleden is, door middel van een enquête onder professionals die betrokken zijn bij patiënten met een meningeoom, een knelpunteninventarisatie gehouden. Na het versturen van de enquête hebben 168 professionals gerespondeerd en knelpunten geprioriteerd en/of ingebracht. De meest relevante knelpunten zijn uitgewerkt tot vijf uitgangsvragen (bijlage 11) die evidence based zijn uitgewerkt.
Voor iedere uitgangsvraag werd uit de richtlijnwerkgroep een subgroep geformeerd.
Bij de evidence based beantwoording van de vijf uitgangsvragen verzorgde een externe methodoloog het literatuuronderzoek, in overleg met de betreffende subgroep. Dit betrof het uitvoeren van een systematische literatuursearch, het kritisch beoordelen van de literatuur en het verwerken van de literatuur in evidence tabellen (bijlage 9). Daarnaast werd door de methodoloog een concept literatuurbespreking met bijbehorende conclusies aangeleverd voor deze uitgangsvragen. De werkgroepleden stelden overige overwegingen en aanbevelingen op volgens de checklist ‘overige overwegingen en formuleren van aanbevelingen’ (bijlage 7).
Voor de consensus-based delen in de richtlijn raadpleegden de werkgroepleden zelf de relevante bestaande literatuur. Op basis hiervan hebben de werkgroepleden de conclusies, overige overwegingen en aanbevelingen geformuleerd. Voor de consensus based beantwoording is geen systematisch literatuuronderzoek verricht en zijn de artikelen niet methodisch beoordeeld door een externe methodoloog.
De werkgroep heeft gedurende een periode van 18 maanden gewerkt aan de tekst van de conceptrichtlijn. Alle teksten zijn tijdens plenaire en telefonische vergaderingen besproken en na verwerking van de commentaren door de werkgroep geaccordeerd.
Zoekverantwoording
Behandeling symptomatisch intracranieel meningeoom
Assessment table relative importance patient-important outcomes
|
Patient-important outcomes |
Mean rating |
Relative importance |
|
Progression-free survival / symptom-free survival |
7.8 |
Critical |
|
Morbidity |
7.5 |
Critical |
|
Mortality |
6.8 |
Important |
Evidence tables
Systematic reviews
|
Study ID |
Method |
Patient characteristics |
Intervention(s) |
Results primary outcome |
Critical appraisal of review quality |
|
Pechlivanis I 2011 Schmieder K 2010 |
|
Radiotherapy
vs..
Surgery |
Progression-free survival:
Morbidity:
Mortality:
|
Risk of bias: high
|
Cohortstudies
|
Study ID |
Method |
Patient characteristics |
Intervention(s) |
Results |
Critical appraisal of study quality |
|
Adeberg S 2011 |
|
Primary fractionated stereotactic radiotherapy (N=19)
vs..
Surgery + immediate fractionated stereotactic radiotherapy (after a median of 3 months) (N=9)
vs..
Surgery + fractionated stereotactic radiotherapy for progression after surgery (after a median of 56 months) (N=12) |
Progression-free survival:
Morbidity:
Mortality:
|
Risk of bias: high
|
|
|
Gorman L 2008 |
|
Subtotal surgery + fractionated stereotactic radiotherapy (N=24): 14 treated at recurrence
vs..
Primary fractionated stereotactic radiotherapy (N=14) |
Progression-free survival:
Morbidity:
Mortality:
|
Risk of bias: high
|
|
|
Lee J 2002 |
|
Surgery + stereotactic radiosurgery (N=76)
vs..
Primary stereotactic radiosurgery (N=83) |
Progression-free survival:
Morbidity:
Mortality:
|
Risk of bias: high
|
|
|
Pamir M 2005 |
|
Radical surgery (N=10)
vs..
Extracavernous surgical removal + intracavernous GKS (N=12)
vs..
Primary GKS (N=26) |
Progression-free survival:
Morbidity:
Mortality:
|
Risk of bias: high
|
|
|
Park C-K 2006 |
|
Microsurgery (N=49)
vs..
Radiotherapy (N=5)
vs..
Radiosurgery (N=12)
vs..
Observation (N=9) |
Progression-free survival:
Morbidity:
Mortality:
|
Risk of bias: high
|
|
|
Tanzler E 2011 |
|
Surgery + postoperative radiotherapy (N=58)
vs..
Primary radiotherapy (N=88)
Patients were treated with conventional (N=41), stereotactic (N=103), or intensity-modulated radiotherapy (N=2) |
Progression-free survival:
Morbidity:
Mortality:
|
Risk of bias: high
|
|
|
Torres R 2003 |
|
Stereotactic radiosurgery (N=79 lesions)
vs..
Stereotactic radiotherapy (77 lesions) |
Progression-free survival:
Morbidity:
Mortality:
|
Risk of bias: high
|
Abbreviations: CoI: conflict of interest; GKS: gamma-knife surgery; HTA: health technology assessment; MRI: magnetic resonance imaging; SR: systematic review; SRS: stereotactic surgery; SRT: stereotactic radiotherapy; US: United States; WHO: World Health Organisation.
GRADE table
|
Quality assessment |
No of patients |
Effect (95%CI) |
|
|
||||||||
|
No. of studies |
Design |
Risk of bias |
Inconsistency |
Indirectness |
Imprecision |
Other considerations |
Intervention |
Control |
Relative |
Absolute |
Quality |
Importance |
|
PROGRESSSION-FREE SURVIVAL |
||||||||||||
|
Primary stereotactic radiotherapy vs.. surgery + postoperative stereotactic radiotherapy: optic nerve sheet meningioma |
||||||||||||
|
1 |
Cohort study |
-1 1 |
- |
- |
-2 2 |
- |
19 |
9 |
100% in both groups |
Very low |
Critical |
|
|
Primary stereotactic radiotherapy vs.. surgery + postoperative stereotactic radiotherapy: skull base meningioma |
||||||||||||
|
1 |
Cohort study |
-1 3 |
- |
- |
-2 2 |
- |
14 |
10 |
100% in both groups |
Very low |
Critical |
|
|
Microsurgery |
||||||||||||
|
1 |
Cohort study |
-2 4 |
- |
- |
-2 2 |
- |
49 |
- |
75% at 5 years |
Very low |
Critical |
|
|
MORBIDITY: improved vision |
||||||||||||
|
Primary stereotactic radiotherapy vs.. surgery + postoperative stereotactic radiotherapy: optic nerve sheet meningioma |
||||||||||||
|
1 |
Cohort study |
-1 1 |
- |
-1 5 |
-1 6 |
- |
12 |
15 |
3.75 (1.29, 10.86) |
550 more per 1000 |
Very low |
Critical |
|
MORBIDITY: improved symptoms in general (partial + complete response) |
||||||||||||
|
Primary stereotactic radiotherapy vs.. surgery + postoperative stereotactic radiotherapy: skull base meningioma |
||||||||||||
|
1 |
Cohort study |
-1 3 |
- |
- |
-2 2 |
- |
14 |
10 |
1.00 (0.44, 2.25) |
0 fewer per 1000 |
Very low |
Critical |
|
Overall quality of evidence: very low |
||||||||||||
1 High risk of bias: no blinding or risk adjustment.
2 Very small sample size.
3 High risk of bias: selection bias, no blinding or risk adjustment.
4 High risk of bias: outcome not compared with other intervention, selection bias, no blinding.
5 Also patients that received postoperative radiosurgery for progression after a median of 56 months.
6 Significant effect, but very small sample size
References
Adeberg S, Welzel T, Rieken S, Debus J, Combs SE. Prior surgical intervention and tumor size impact clinical outcome after precision radiotherapy for the treatment of optic nerve sheath meningiomas (ONSM). Radiation Oncology. 2011;6(117).
Gorman L, Ruben J, Myers R, Dally M. Role of hypofractionated stereotactic radiotherapy in treatment of skull base meningiomas. J Clin Neurosci. 2008;15(8):856-62.
Lee JYK, Niranjan A, McInerney J, Kondziolka D, Flickinger JC, Lunsford LD. Stereotactic radiosurgery providing long-term tumor control of cavernous sinus meningiomas. J Neurosurg. 2002;97(1):65-72.
Pamir MN, Kilic T, Bayrakli F, Peker S. Changing treatment strategy of cavernous sinus meningiomas: experience of a single institution. Surgical Neurology. 2005;64(2).
Park C-K, Jung H-W, Kim JE, Paek SH, Kim DG. The selection of the optimal therapeutic strategy for petroclival meningiomas. Surg Neurol. 2006;66(2):160-5; discussion 5-6.
Pechlivanis I, Wawrzyniak S, Engelhardt M, Schmieder K. Evidence level in the treatment of meningioma with focus on the comparison between surgery versus radiotherapy. A review. J Neurosurg Sci. 2011;55(4):319-28.
Schmieder K, Engelhardt M, Wawrzyniak S, Borger S, Becker K, Zimolong A. The impact of microsurgery, stereotactic radiosurgery and radiotherapy in the treatment of meningiomas depending on different localizations. GMS Health Technology Assessment. 2010;6.
Tanzler E, Morris CG, Kirwan JM, Amdur RJ, Mendenhall WM. Outcomes of WHO Grade I meningiomas receiving definitive or postoperative radiotherapy. Int J Radiat Oncol Biol Phys. 2011;79(2):508-13.
Torres RC, Frighetto L, De Salles AAF, Goss B, Medin P, Solberg T, et al. Radiosurgery and stereotactic radiotherapy for intracranial meningiomas. Neurosurg. 2003;14(5):e5.
