Intracranieel Meningeoom - Asymptomatisch meningeoom
Uitgangsvraag
Aanbeveling
Bij patiënten met een asymptomatisch meningeoom zonder aangetoonde groei, of met een lage groeisnelheid (toename van de maximale diameter van de tumor van minder dan 10% in een jaar), dient een wait-and-scan-beleid overwogen te worden.
Bij de keuze om een asymptomatisch meningeoom wel of niet te behandelen dienen de volgende kenmerken te worden overwogen:
- gerapporteerde groei:
- groei in het eerste jaar van >10% van de maximale diameter van een meningeoom is een risicofactor voor verdere groei en/of ontstaan van symptomen
- tumorgrootte:
- asymptomatische meningeomen kunnen symptomatisch worden zowel bij groei als zonder groei.
- massawerking
- locatie:
- schedelbasismeningeomen lijken een lagere groeisnelheid te hebben dan convexiteitsmeningeomen; hier staat tegenover dat beperkte groei van een schedelbasismeningeoom dat nabij belangrijke neurovasculaire structuren ligt, snel tot (irreversibele) symptomen kan leiden
- radiologische karakteristieken:
- meningeomen met calcificaties lijken trager te groeien
- meningeomen met een T2 hyperintense tumormassa lijken met een grotere kans op groei gepaard te gaan
- leeftijd en geslacht:
- patiënten ouder dan 70 jaar lijken een groter risico te hebben op het symptomatisch worden van een meningeoom, maar groei van een meningeoom vlakt meestal af voor of rond de leeftijd van 80 jaar
- jonge mannen (40 jaar en jonger) hebben een hogere kans op een WHO II en III meningeoom
Bij patiënten met een meningeoom bij wie enige mate van groeiversnelling van het meningeoom optreedt, er massawerking van het meningeoom ontstaat of er neurologische uitvalsverschijnselen optreden dient behandeling overwogen te worden. Welke behandeling gekozen wordt hangt af van het risicoprofiel van de behandeling bij een individuele patiënt.
Het is van belang de voorkeuren van de patiënt te bespreken alsmede de achtergronden daarvan. In het bijzonder moet aandacht worden besteed aan eventuele onjuiste denkbeelden over de prognose en risico's van behandelopties.
Overwegingen
Naast bovenstaande literatuur over asymptomatische meningeomen is er een redelijke hoeveelheid literatuur beschikbaar over het beloop van meningeomen (zowel symptomatisch als asymptomatisch) die initieel niet behandeld zijn en klinisch-radiologisch vervolgd worden. Zie ook module Radiologische follow-up bij een primair wait-and-scan beleid.
In deze artikelen zijn patiënten met symptomatische en asymptomatische meningeomen vaak samengevoegd, waardoor deze onderzoeken niet konden worden opgenomen in bovenstaande literatuurbeschrijving.
Conclusies hieruit zijn:
- Er is een beperkte follow-up duur van onbehandelde (asymptomatische/symptomatische) meningeomen, maar bij ongeveer de helft van deze meningeomen is er groei gedurende de eerste 4-5 jaar na diagnosestelling.
- De groeicurve bij graad I meningeoom is S-vormig met een afvlakking in de loop van het leven (voor het 80ste levensjaar).
- Jonge mannen (<40 jaar) hebben een hoger risico op een WHO graad II of III meningeoom.
- Groei van onbehandelde (symptomatische of asymptomatische) meningeomen leidt in de eerste 4-5 jaar niet tot (nieuwe of toegenomen) klinische symptomen.
- Bij follow-up blijken grote (> 2.5cm) en initieel snel groeiende (>10% toename van de maximale diameter in het eerste jaar) meningeomen, en meningeomen met een T2 hyperintense tumormassa, vaker groei en/of symptomen te geven, terwijl gecalcificeerde meningeomen juist minder vaak groei vertonen. Kanttekening is dat de percentuele lineaire groeisnelheid geen ideale maat voor groei is, vooral bij meningeomen met een irregulaire vorm en bij zeer kleine laesies (waar 10% groei sneller bereikt wordt).
- Spheno-orbitale en andere schedelbasismeningeomen (symptomatisch/asymptomatisch) groeien meestal langzaam, tenzij ze initieel al groot zijn of een grote wekedelencomponent hebben.
Asymptomatische meningeomen hebben per definitie nog niet tot klinische klachten geleid. De prevalentie is hoog, circa 0,9% van de algemene populatie van 45 jaar en ouder (13). Een groot deel van deze asymptomatische laesies zal ook op termijn geen klinische verschijnselen veroorzaken (14). Omdat er een maatschappelijke en medische tendens is om vaker en sneller radiologisch onderzoek te doen, ook bij gezonde mensen, zullen in de nabije toekomst steeds meer asymptomatische meningeomen ontdekt worden. Hierdoor is het gevaar van medicalisering van deze grote groep (klinisch gezonde) mensen reëel. Dergelijke medicalisering kan voor individuele patiënten leiden tot een toename van gevoelens van angst, onzekerheid, iatrogene schade en voor de maatschappij leiden tot oplopende zorgkosten.
Locatie lijkt van belang te zijn bij de inschatting van de risk-benefit-ratio van een behandeling, hoewel hierover zeer weinig literatuur is en geen literatuur van hoge kwaliteit. Convexiteitsmeningeomen zijn in het algemeen relatief goed chirurgisch te bereiken en groeien sneller dan schedelbasismeningeomen, wat een argument kan zijn om bij convexiteitsmeningeomen relatief sneller tot behandeling over te gaan. Daar staat tegenover dat de nabijheid van belangrijke neurovasculaire structuren bij orbita-sphenoïd-/petroclivale/schedelbasismeningeomen een reden kan zijn tot vroege behandeling, om zo irreversibele schade aan deze structuren te voorkómen.
Omdat er geen bewijs van hoge kwaliteit is over de behandelbeslissing bij asymptomatischemeningeomen, is er veel ruimte voor individuele voorkeuren van arts en patiënt in het maken van keuzes. Hierbij kunnen de wens tot curatie (met chirurgie), de wens tot een zekere (histologische) diagnose (met chirurgie) en de angst voor complicaties van een behandeling een rol spelen.
Er kunnen ook onjuiste denkbeelden bij een patiënt meespelen, zoals:
- Epilepsie zal zeker genezen na meningeoom-chirurgie.
- Een meningeoom groeit altijd en zal altijd tot klachten en/of levensbedreiging leiden.
- Een meningeoom is een tijdbom die ineens tot levensbedreigende complicaties kan leiden.
- Een meningeoom moet altijd geopereerd worden, want ‘weg is zeker weg'.
Het is waarschijnlijk dat de overwegingen betreffende asymptomatische meningeomen ook gelden voor meningeomen die zich klinisch alleen uiten door (medicamenteus goed behandelbare) epilepsie, aangezien er geen bewijs is voor een verschil in groeisnelheid tussen volledig asymptomatische meningeomen en meningeomen die alleen epilepsie geven.
Onderbouwing
Conclusies / Summary of Findings
Op basis van de beschikbare literatuur kan geen uitspraak gedaan worden over de beste behandeling voor patiënten met een asymptomatisch meningeoom.
Niveau: Geen
Progressievrije overleving
Voor patiënten met een asymptomatisch meningeoom met een initieel wait-and-scan-beleid is er bewijs van zeer lage kwaliteit dat 18-63% tumorgroei vertoont in een tijdspanne van 1-5 jaar.
Niveau: Zeer laag: Sonoda 2005 (5); Yano 2006 (4); Hashiba 2009 (6); Niiro 2000 (10); Rubin 2011 (9); Yoneoka 2000 (11)
Bij patiënten met een meningeoom is er geen bewijs dat er een verband bestaat tussen groei van een asymptomatisch meningeoom en tumorlocatie. Over het verband tussen groei van een asymptomatisch meningeoom met leeftijd of initieel tumorvolume is de literatuur verdeeld.
Niveau: Zeer laag: Hashiba 2009 (6); Rubin 2011 (9)
Voor patiënten met een asymptomatisch meningeoom met een initieel wait-and-scan-beleid is er bewijs van zeer lage kwaliteit dat meningeomen met calcificaties op CT trager groeien.
Niveau: Zeer laag: Kuratsu 2000 (2); Yano 2006 (4); Hashiba 2009 (6); Nakamura 2003 (7); Rubin 2011 (9); Niiro 2000 (10)
Voor patiënten met een asymptomatisch meningeoom is de literatuur verdeeld over het verband tussen tumorgroei enerzijds en hyperintensiteit op T2-gewogen MRI beelden anderzijds.
Niveau: Zeer laag: Kuratsu 2000 (2); Yano 2006 (4); Nakamura 2003 (7); Hashiba 2009 (6); Niiro 2000 (10)
Effect op morbiditeit
Voor patiënten met een asymptomatisch meningeoom met een initieel wait-and-scan-beleid is er bewijs van zeer lage kwaliteit dat 0-13% symptomen ontwikkelt ten gevolge van tumorgroei op een tijdspanne van 1-5 jaar.
Niveau: Zeer laag: Sonoda 2005 (5); Yano 2006 (4); Niiro 2000 (10); Rubin 2011 (9); Yoneoka 2000 (11)
Voor patiënten met een asymptomatisch meningeoom die chirurgisch behandeld werden is er bewijs van zeer lage kwaliteit dat perioperatieve en blijvende morbiditeit zich hoofdzakelijk voordoet bij patiënten ouder dan 70 jaar.
Niveau: Zeer laag: Nishizaki 1999 (3); Kuratsu 2000 (2); Yano 2006 (4)
Effect op mortaliteit
Voor patiënten met een asymptomatisch meningeoom die chirurgisch behandeld werden is er bewijs van zeer lage kwaliteit dat de postoperatieve mortaliteit 0-2.6% bedraagt.
Niveau: Zeer laag: Sonoda 2005 (5); Kuratsu 2000 (2); Yano 2006 (4); Nishizaki 1999 (3)
Voor patiënten met een asymptomatisch meningeoom met een initieel wait-and-scan-beleid is er bewijs van zeer lage kwaliteit dat de tumorgerelateerde mortaliteit 0-2.5% is binnen 5 jaar.
Niveau: Zeer laag; Rubin 2011 (9); Niiro 2000 (10)
Algehele kwaliteit van bewijs zeer laag
Samenvatting literatuur
Inleiding
Cruciale uitkomstmaten voor deze uitgangsvragen zijn: effect op morbiditeit, progressievrije overleving en mortaliteit.
In de richtlijn is gekozen om de term ‘radiotherapie' te gebruiken zonder alle specifieke radiotherapeutisch technieken apart te noemen, tenzij dat uitdrukkelijk in een gerefereerd artikel vermeld wordt.
Bij radiochirurgie wordt tumornecrose bereikt door een éénmalige hoge bestralingsdosis. Bij meningeomen wordt deze behandeling toegepast bij een kleine afwijkingen (tot 3cm): primair dan wel bij een restmeningeoom van beperkte omvang na eerdere operatie. Daarnaast kunnen een aantal bestralingen van beperkte dosis (fracties) meteen bepaalde totaaldosis in staat zijn de groei van een meningeoom tot staan te brengen. Dit heet: gefractioneerde (al dan niet stereotactische) bestraling. Bij gefractioneerde bestraling is bestralingsvolume minder snel een beperkende factor. Deze type bestraling wordt daarom meestal gebruikt bij grotere (rest-)meningeomen.
Beschrijving studies
Geen enkele gerandomiseerde studie evalueerde het effect van het al dan niet behandelen van patiënten met een asymptomatisch intracranieel meningeoom. Vijf retrospectieve cohortstudies vergeleken een wait-and-scan beleid met chirurgie en/of radiochirurgie (1) (2) (3) (4) (5). In totaal werden 1077 patiënten geïncludeerd. Aanvullend rapporteerden zes retrospectieve studies over een serie van asymptomatische patiënten met een meningeoom die geen behandeling ondergingen (6) (7) (8) (9) (10) (11). Het betreft allemaal kleine series met 31 tot 70 patiënten.
Kwaliteit van het bewijs
Het risico op bias van deze 11 studies is groot. Het betreft allemaal retrospectieve studies met een groot risico op selectiebias, aangezien geen enkele studie rapporteerde of de inclusie van patiënten consecutief gebeurde. Geen enkele van deze studies corrigeerde voor risicofactoren, hoewel sommige studies minstens een deel van de resultaten gestratificeerd rapporteren (2) (3) (4). In vier cohortstudies wordt de duur van follow-up niet gerapporteerd voor de volledige populatie (2) (3) (4) (5). Enkel Jo et al. rapporteerden een gemiddelde follow-up van langer dan vijf jaar (61,2 maanden) (12). Van de zes case series hadden slechts twee studies een gemiddelde follow-up van langer dan vijf jaar (8) (9).
Gewenste effecten interventies
Effect op morbiditeit (cruciale uitkomst)
Sonoda et al. includeerden retrospectief 16 asymptomatische patiënten met een meningeoom (5). Elf patiënten werden conservatief behandeld. Van de twee patiënten die groei vertoonden werd één patiënt (9%) symptomatisch en alsnog chirurgisch behandeld.
Yano et al. includeerden retrospectief 603 asymptomatische patiënten met een meningeoom (4). Hiervan werden 351 patiënten conservatief behandeld. Van de 171 patiënten die minstens één jaar gevolgd werden kregen 11 patiënten (6,4%) symptomen. Tien van deze patiënten vertoonden tumorgroei, vier patiënten werden alsnog chirurgisch behandeld. De initiële tumorgrootte van deze 10 patiënten bedroeg gemiddeld 3,7 cm (range 2,4-6 cm).
Ook enkele case series rapporteerden over het optreden van neurologische symptomen tijdens follow-up. Hashiba et al. volgden 70 patiënten met een asymptomatisch meningeoom gedurende gemiddeld 39,3 maanden (6). Twee patiënten ondergingen chirurgie en één patiënt stereotactische radiochirurgie vanwege uitgesproken tumorgroei. Het is onduidelijk of ze symptomen kregen. De andere 67 patiënten bleven asymptomatisch. Niiro et al. volgden 40 patiënten ouder dan 70 jaar met een asymptomatisch meningeoom gedurende gemiddeld 38,4 maanden (10). Van de 14 patiënten die tumorgroei vertoonden werden er vijf symptomatisch (12,5% van de totale populatie). Drie hiervan ondergingen chirurgie. Rubin et al. volgden 56 patiënten met een (vermoedelijk) asymptomatisch meningeoom gedurende gemiddeld 65.0 maanden (9). Vijfendertig patiënten vertoonden tumorgroei, maar klinische veranderingen ten gevolge van tumorgroei werden niet vastgesteld. Yoneoka et al. volgden 37 patiënten met een incidenteel meningeoom gedurende gemiddeld 4,2 jaar (11). Negen patiënten vertoonden tumorgroei, één patiënt vertoonde symptomen. Een tweede patiënt zonder tumorgroei ontwikkelde eveneens symptomen (5,4% van de totale populatie).
Progressievrije overleving (cruciale uitkomst)
Enkel Jo et al. rapporteerden het effect van behandeling op progressievrije overleving (12). De 69 patiënten die behandeld werden met radiochirurgie (gamma-knife) hadden een 5-jaars progressievrije overleving van 100%. Na microchirurgie (aanbevolen voor meningeomen van minstens 2,5 cm bij patiënten jonger dan 65 jaar) werden geen recidieven vastgesteld na een gemiddelde follow-up van 59,6 maanden. De 77 patiënten bij wie een wait-and-scan beleid werd gevoerd observatie ondergingen hadden een 5-jaars progressievrije overleving van 62%. Het is onmogelijk om uit te maken of deze verschillen in progressievrije overleving te wijten zijn aan patiëntenselectie. De patiënten bij wie een wait-and-see beleid werd gevoerd waren ouder (gemiddeld 63,1 jaar) en hadden kleinere tumoren (gemiddeld 15,8 mm) dan patiënten die microchirurgie (58,9 jaar en 25,6 mm) of radiochirurgie (54,9 jaar en 17,3 mm) ondergingen. Statistiek werd hier echter niet op toegepast. Radiochirugie werd hoofdzakelijk uitgevoerd bij meningeomen van de schedelbasis.
In sommige andere cohortstudies werd enkel het aantal groeiende meningeomen gerapporteerd. Kuratsu et al. rapporteerden de gegevens van 63 asymptomatische patiënten die langer dan één jaar werden gevolgd (2). Twintig patiënten (32%) vertoonden groei tijdens een gemiddelde follow-up van 27,8 maanden. Deze patiënten verschilden niet wat betreft initiële tumorgrootte (gemiddeld 9,75 versus 9,49 cm³, p=0.95) of leeftijd (gemiddeld 67,5 versus 66 jaar, p=0,3) met de 43 patiënten die geen groei vertoonden. Sonoda et al. rapporteerden na een gemiddelde follow-up van 13 maanden groei bij 2 van de 11 patiënten (18%) die conservatief behandeld werden (5). Yano et al. rapporteerden de gegevens van 67 asymptomatische patiënten die langer dan 5 jaar gevolgd werden (4). Vijfentwintig patiënten (37%) vertoonden groei. Deze patiënten verschilden niet wat betreft maximale tumorgrootte (gemiddelde diameter 2,4 versus 2,3 cm, p=0,74) of leeftijd (gemiddeld 63,0 versus 65,8 jaar, p=0,48) met de 42 patiënten die geen groei vertoonden.
Ook in enkele case series werd het aantal groeiende meningeomen gerapporteerd. Hashiba et al. rapporteerden tumorgroei in 44 van de 70 patiënten (63%) na een gemiddelde follow-up van 39,3 maanden (6). Er werden geen significante verschillen tussen groeiende en niet-groeiende meningeomen vastgesteld wat betreft tumorlocatie, initieel tumorvolume en leeftijd. Niiro et al. rapporteerden tumorgroei in 14 van de 40 patiënten (35%) na een gemiddelde follow-up van 38,4 maanden (10). Rubin et al. vonden tumorgroei in 21 van de 56 patiënten (38%) (9). Er werd geen significant verband gevonden tussen tumorgroei enerzijds en tumorgrootte of -locatie anderzijds. Patiënten met groeiende tumoren waren wel significant jonger (60 versus 67 jaar, p=0,007). Yoneoka et al. rapporteerden tumorgroei in 9 van de 37 patiënten (24%) na een gemiddelde follow-up van 4,2 jaar (11). Multivariabele analyse toonde dat initieel tumorvolume en leeftijd onafhankelijke determinanten waren van tumorgroei.
Verschillende studies evalueerden het verband tussen specifieke kenmerken op beeldvorming en het optreden van tumorgroei. Zes studies rapporteerden eensgezind dat tumoren met calcificaties op CT een significant tragere (of afwezige) groei vertoonden (2) (4) (6) (7) (9) (10). Over verband tussen hyperintensiteit op T2-gewogen MRI beelden en tumorgroei is de literatuur minder eensgezind. Drie studies rapporteerden een significant snellere groei in aanwezigheid van hyperintensiteit (2) (4) (7). Twee studies daarentegen vonden geen significant verschil (6) (10).
Effect op mortaliteit
Vier cohortstudies rapporteerden over de postoperatieve mortaliteit. Sonoda et al. en Kuratsu et al. rapporteerden een postoperatieve 30-dagen mortaliteit van 0% (5) (2). In de studie van Yano et al. stierf geen enkele patiënt binnen de 3 maanden na chirurgie (4). Nishizaki et al. rapporteerden postoperatief overlijden in twee van de 75 asymptomatische patiënten die geopereerd werden (2.6%) (3).
Enkele case series rapporteerden cijfers over lange termijn mortaliteit. Niiro et al. rapporteerden 7 overlijdens in een groep van 40 patiënten boven de 70 jaar met een initieel wait-and-scan beleid. Een van de zeven overlijdens (2.5%) was het gevolg van de tumor 88 maanden na de initiële diagnose (10). Rubin et al. rapporteerden drie overlijdens (5.4%), maar geen enkel overlijden ten gevolge van de tumor (9).
Ongewenste effecten
Jo et al. rapporteerden geen permanente neurologische gevolgen na microchirurgie of radiochirurgie (gamma-knife) (12). Tijdelijke gevolgen van radiochirurgie waren: hoofdpijn (16%), paresthesieën van de hoofdhuid (9%), duizeligheid (7%), lokale kaalheid (7%), tinnitus (6%) en oogpijn (6%).
Nishizaki et al. registreerden de Glasgow Outcome Scale bij ontslag uit het ziekenhuis bij 74 asymptomatische patiënten die chirurgisch behandeld werden (3). Patiënten met een slechte score (3-5) waren significant ouder (72,0 versus 61,7 jaar, p=0,04) en hadden frequenter een meningeoom ter hoogte van de midline.
Vergelijkbare resultaten werden gerapporteerd door Kuratsu et al. Van de 196 asymptomatische patiënten in dit cohort werden 87 patiënten chirurgisch behandeld (2). Perioperatieve morbiditeit trad op bij 11% van de patiënten. Bij patiënten ouder dan 70 jaar was er een trend naar meer perioperatieve morbiditeit in vergelijking met patiënten jonger dan 70 jaar (23% versus 4%, p=0,07).
Yano et al. rapporteerden 9% chirurgie-gerelateerde morbiditeit en 16% neurologische morbiditeit (4). Medische morbiditeit werd gevonden bij 4,2% en blijvende morbiditeit (langer dan 3 maanden na chirurgie) bij 6%. Er was een trend naar meer blijvende morbiditeit bij patiënten ouder dan 70 jaar (9% versus 4%; RR = 2,1; 95% BI: 0.70-6.35; p=0,19).
Sonoda et al. rapporteerden geen operatieve morbiditeit of postoperatieve neurologische achteruitgang bij de 5 asymptomatische patiënten die chirurgisch behandeld werden (5).
Referenties
- 1 - Jo K, Park HJ, Nam DH, Lee JI, Kong DS, Park K, et al. Treatment of atypical meningioma. J Clin Neurosci 2010 Nov;17(11):1362-1366.
- 2 - Kuratsu J, Kochi M, Ushio Y. Incidence and clinical features of asymptomatic meningiomas. J Neurosurg 2000 May;92(5):766-770.
- 3 - Nishizaki T, Ozaki S, Kwak T, Ito H. Clinical features and surgical outcome in patients with asymptomatic meningiomas. Br J Neurosurg 1999 Feb;13(1):52-55.
- 4 - Yano S, Kuratsu J, Kumamoto Brain Tumor Research Group. Indications for surgery in patients with asymptomatic meningiomas based on an extensive experience. J Neurosurg 2006 Oct;105(4):538-543.
- 5 - Sonoda Y, Sakurada K, Saino M, Kondo R, Sato S, Kayama T. Multimodal strategy for managing meningiomas in the elderly. Acta Neurochir (Wien) 2005 Feb;147(2):131-6; discussion 136.
- 6 - Hashiba T, Hashimoto N, Izumoto S, Suzuki T, Kagawa N, Maruno M, et al. Serial volumetric assessment of the natural history and growth pattern of incidentally discovered meningiomas. J Neurosurg 2009 Apr;110(4):675-684.
- 7 - Nakamura M, Roser F, Michel J, Jacobs C, Samii M. The natural history of incidental meningiomas. Neurosurgery 2003 Jul;53(1):62-70; discussion 70-1.
- 8 - Nakasu S, Nakasu Y, Fukami T, Jito J, Nozaki K. Growth curve analysis of asymptomatic and symptomatic meningiomas. J Neurooncol 2011 Apr;102(2):303-310.
- 9 - Rubin G, Herscovici Z, Laviv Y, Jackson S, Rappaport ZH. Outcome of untreated meningiomas. Isr Med Assoc J 2011 Mar;13(3):157-160.
- 10 - Niiro M, Yatsushiro K, Nakamura K, Kawahara Y, Kuratsu J. Natural history of elderly patients with asymptomatic meningiomas. J Neurol Neurosurg Psychiatry 2000 Jan;68(1):25-28.
- 11 - Yoneoka Y, Fujii Y, Tanaka R. Growth of incidental meningiomas. Acta Neurochir (Wien) 2000;142(5):507-511.
- 12 - Jo KW, Kim CH, Kong DS, Seol HJ, Nam DH, Park K, et al. Treatment modalities and outcomes for asymptomatic meningiomas. Acta Neurochir (Wien) 2011 Jan;153(1):62-7; discussion 67.
- 13 - Vernooij MW, Ikram MA, Tanghe HL, Vincent AJ, Hofman A, Krestin GP, et al. Incidental findings on brain MRI in the general population. N Engl J Med 2007 Nov 1;357(18):1821-1828.
- 14 - Sughrue ME, Rutkowski MJ, Aranda D, Barani IJ, McDermott MW, Parsa AT. Factors affecting outcome following treatment of patients with cavernous sinus meningiomas. J Neurosurg 2010 Nov;113(5):1087-1092.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 24-11-2015
Beoordeeld op geldigheid : 04-01-2015
Voorwaarden voor revisie en beoordelingsfrequentie zijn vastgelegd in de richtlijn. De geldigheidstermijn voor de richtlijn (maximaal 5 jaar na vaststelling) wordt vanuit IKNL bewaakt.
Ook de Landelijke Werkgroep Neuro-Oncologie (LWNO) toetst jaarlijks de actualiteit van de richtlijn. Het bestuur van de landelijke werkgroep draagt de verantwoordelijkheid om de behoefte voor herziening van de huidige richtlijn bij de beroepsgroepen te peilen. Om verscheidene redenen kan actualisatie eerder dan beoogd nodig zijn. Zo nodig zal de richtlijn tussentijds op onderdelen worden bijgesteld. Als dat aan de orde is, verzoekt de LWNO de meest bij het desbetreffende onderwerp betrokken vereniging[en] de revisie te financieren, bijvoorbeeld door middel van een hierop gericht beroep op SKMS gelden. Uiterlijk in 2018 zal een nieuwe multidisciplinaire werkgroep worden geïnstalleerd om de richtlijn te reviseren.
Algemene gegevens
In 2011 heeft de Landelijke Werkgroep Neuro-Oncologie (LWNO) het Integraal Kankercentrum Nederland (IKNL) verzocht om een richtlijn Meningeoom te ontwikkelen. Naar aanleiding hiervan is een landelijke richtlijnwerkgroep Meningeoom opgericht. De multidisciplinaire werkgroep is in juli 2012 gestart met de ontwikkeling van de richtlijn Meningeoom. IKNL zorgde voor methodologische begeleiding en secretariële ondersteuning van het proces.
Naast de autoriserende verenigingen heb de volgende verenigingen ingestemd met de inhoud:
Nederlandse Vereniging van Meningeoom Patiënten (NVMP; per oktober 2013 deel van Patiëntenvereniging Cerebraal)
Patiëntenvereniging Cerebraal (via Leven met Kanker Beweging (voorheen NFK)
Doel en doelgroep
Doelstelling
De richtlijn is een document met aanbevelingen ter ondersteuning van de praktijkvoering van zorgverleners die betrokken zijn bij patiënten met een intracranieel meningeoom. De aanbevelingen zijn gebaseerd op een zo hoog mogelijke graad van wetenschappelijk bewijs en consensus binnen de werkgroepleden. De richtlijn biedt de gebruikers inzicht in het tot stand komen van de aanbevelingen. Uitgangspunt zijn de knelpunten die in de dagelijkse praktijk bij patiënten met een intracranieel meningeoom worden gesignaleerd.
Doel van de richtlijn
Het verbeteren van de kwaliteit van zorg voor volwassen patiënten met een meningeoom. De richtlijn behelst het traject van diagnostiek, behandeling, voorlichting en begeleiding van patiënten met een intracranieel meningeoom. De richtlijn beoogt hiermee de kwaliteit van de zorgverlening te verbeteren, het klinisch handelen meer te baseren op bewijs dan op ervaringen en meningen, de transparantie van keuze voor behandelingen te vergroten en de diversiteit van handelen door professionals te verminderen.
De richtlijn kan worden gebruikt bij het geven van voorlichting aan patiënten en biedt aanknopingspunten voor transmurale afspraken of lokale protocollen ter bevordering van de implementatie.
Doelgroep
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, klinische besluitvorming, behandeling en begeleiding van patiënten met een intracranieel meningeoom, zoals neurologen, neurochirurgen, radiotherapeuten, (neuro)pathologen, (neuro)radiologen, klinisch genetici, revalidatieartsen, huisartsen, psychologen, neuro-oncologieverpleegkundigen en verpleegkundig specialisten.
Deze richtlijn is primair geschreven voor bovenstaande (groepen) professionals en daardoor mogelijk minder makkelijk leesbaar voor patiënten. KWF Kankerbestrijding geeft patiëntenbrochures uit, die gebaseerd zijn op door IKNL gepubliceerde richtlijnen. Zie voor meer patiënteninformatie de folder ‘Hersentumoren’ van KWF en de website www.hersentumor.nl.
Doelpopulatie
De doelpopulatie betreft patienten van 18 jaar en ouder met een intracranieel meningeoom.
Samenstelling werkgroep
Alle werkgroepleden zijn afgevaardigd namens een wetenschappelijke, beroeps- of patiëntenvereniging en hebben daarmee het mandaat voor hun inbreng. Bij de samenstelling van de werkgroep is getracht rekening te houden met landelijke spreiding, inbreng van betrokkenen uit zowel academische als algemene ziekenhuizen/instellingen en vertegenwoordiging van de verschillende verenigingen/disciplines.
De Nederlandse Vereniging van Meningeoompatiënten (NVMP; per oktober 2013 deel van Patiëntenvereniging Cerebraal)) is eveneens vertegenwoordigd door middel van afvaardiging van de voorzitter van de patiëntenvereniging, alsmede een ervaringsdeskundige vanuit de Nederlandse Federatie van Kankerpatiëntenorganisaties (NFK) afkomstig van Vereniging Cerebraal.
De volgende (para)medische disciplines zijn in de werkgroep vertegenwoordigd:
- neurologie
- neurochirurgie
- radiotherapie
- (neuro)pathologie
- neuroradiologie
- neuropsychologie
- revalidatie
- verpleegkunde
Leden van de werkgroep
- Mw. dr. D. Brandsma, neuroloog Nederlands Kanker Instituut / Antoni van Leeuwenhoekziekenhuis en Slotervaartziekenhuis, Amsterdam, voorzitter
- Mw. drs. N.D.B. Gilhuijs, (neuro)patholoog, Westfries Gasthuis, Hoorn
- Dhr. Prof.dr. R.J.M. Groen, neurochirurg, UMCG, Groningen
- Mw. drs. E.J.J. Habets, psycholoog, MC Haaglanden, Den Haag
- Mw. drs. P. Hoenderdaal, patiëntvertegenwoordiger Vereniging Cerebraal
- Mw. dr. A.A. Jacobi - Postma, neuroradioloog MUMC+, Maastricht
- Mw. dr. A. Mendez Romero, radiotherapeut-oncoloog, Erasmus MC, Rotterdam
- Dhr. drs. C.G.J.H. Niël, radiotherapeut-oncoloog, RISO, Deventer
- Mw.dr. S.M. Peerdeman, neurochirurg, VUmc, Amsterdam
- Mw. H. Petersen - Baltussen, nurse practitioner neurochirurgie, Radboud Universitair Medisch Centrum, Nijmegen
- Mw. drs. V.P.M. Schepers, revalidatiearts, UMCU, Utrecht
- Dhr. dr. T.J. Snijders, neuroloog, UMCU, Utrecht
- Dhr. H. van Valkenburg, patiëntvertegenwoordiger
- Dhr. Prof.dr. P. Wesseling, (neuro)patholoog Radboud Universitair Medisch Centrum, Nijmegen, VUmc, Amsterdam
- Mw. J.M.C. Zwinkels, verpleegkundig specialist NO, MC Haaglanden, Den Haag
Dhr. Dr. F.J. Hes, klinisch geneticus, Leids Universitair Medisch Centrum (LUMC), Leiden, heeft een bijdrage geleverd aan de tekst over genetische syndromen.
Ondersteuning
Medewerkers van het IKNL waren verantwoordelijk voor de procesbegeleiding en secretariële ondersteuning.
- Mw. drs. E.J.A Verhoof, procesbegeleider IKNL, locatie Utrecht
- Mw. M.L. van de Kar-van der Meulen, secretariële ondersteuning werkgroep Meningeoom, IKNL, locatie Utrecht
Literatuuronderzoek
Het literatuuronderzoek en het opstellen van de concept conclusies voor het evidence based gedeelte werd uitgevoerd door dr. J. Vlayen [Medical Evaluation & Technology Assessment, ME-TA, België], en mw. dr. L. Veerbeek [IKNL].
Belangenverklaringen
Om de beïnvloeding van de richtlijnontwikkeling of formulering van de aanbevelingen door conflicterende belangen te minimaliseren zijn de leden van werkgroep gemandateerd door de wetenschappelijke verenigingen.
Alle werkgroepleden hebben bij aanvang en bij de afronding van het richtlijn traject een belangenverklaring ingevuld. Hiermee geven de werkgroepleden aan onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn. Potentiële conflicterende belangen zijn door middel van ondervraging van de werkgroepleden opgespoord en besproken. De bevindingen zijn schriftelijke vastgelegd in de belangenverklaring en opvraagbaar via oncoline@iknl.nl.
Daarnaast is conceptrichtlijn ter becommentariëring aangeboden op www.oncoline.nl en aan alle voor de knelpuntenanalyse benaderde wetenschappelijke, beroeps- en patiëntenverenigingen. De werkgroep heeft het commentaar verwerkt waarna de richtlijn door alle relevante betrokken partijen is geautoriseerd
Inbreng patiëntenperspectief
Twee patiëntvertegenwoordigers namen zitting in de richtlijnwerkgroep (één ervaringsdeskundige op het gebied van meningeoom en één deskundige op het gebied van richtlijnontwikkeling). Bij de ontwikkeling van deze richtlijn is tijdens alle fasen gebruik gemaakt van de input van deze patiëntvertegenwoordigers. Deze input is nodig voor de ontwikkeling van een kwalitatief goede richtlijnen. Een goede behandeling voldoet immers aan de wensen en eisen van zowel zorgverlener als patiënt.
Door middel van onderstaande methoden is informatie verkregen en zijn de belangen van de patiënt meegenomen:
- Bij aanvang van het richtlijntraject is een patiëntenversie van de enquête voor het inventariseren van knelpunten in de zorg voor patiënten met een meningeoom uitgezet bij leden van de NVMP.
- Tijdens het richtlijntraject heeft een gesprek plaatsgevonden waarbij de patiëntvertegenwoordigers, de verpleegkundigen, de neuropsycholoog, de procesbegeleider en de voorzitter aanwezig waren om het patiëntenperspectief te inventariseren met behulp van het ICF-model. Het gesprek vond plaats ten tijde van het literatuuronderzoek van de evidence based uitgangsvragen. Hierdoor kon het patiëntperspectief worden meegenomen in de overige overwegingen bij het bespreken van de conclusies die volgden uit het literatuuronderzoek. De gestructureerde inventarisatie maakte de bijdrage vanuit het patiëntperspectief inzichtelijk en is vooral terug te vinden in de overige overwegingen en in de aanbevelingen.
- De NVMP en Vereniging Cerebraal zijn geconsulteerd in de externe commentaarronde.
Inventarisatie patiëntenperspectief middels het ICF-model
Het patiëntenperspectief is geïnventariseerd door de invloed van het hebben/hebben gehad van een meningeoom op het gehele leven, in al de dimensies van het ICF-model, te beschrijven.
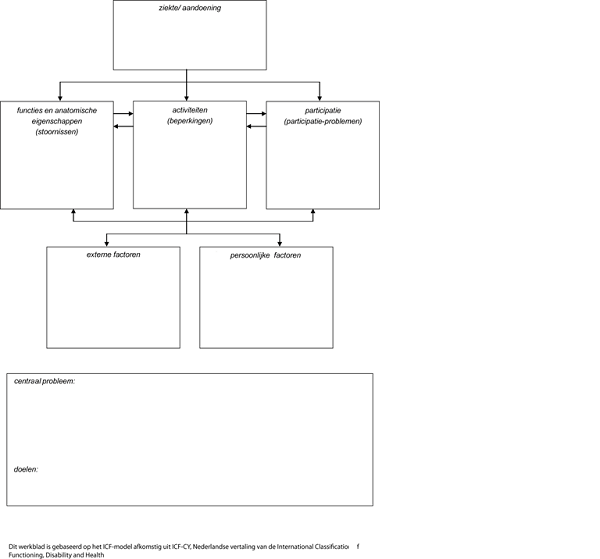
Ziekte/aandoening: mogelijkheden en beperkingen t.a.v.:
- Mentale functies
- Sensorische functies en pijn
- Stem en spraak
- Functies van hart en bloedvatenstelsel, hematologisch systeem, afweersysteem en ademhalingsstelsel
- Functies van spijsverteringsstelsel, metabool stelsel en hormoonstelsel
- Functies van urogenitaal stelsel en reproductieve functies
- Functies van bewegingssysteem en aan beweging verwante functies
- Functies van huid en verwante structuren
Mogelijkheden en beperkingen door de ziekte/aandoening voor patiënten met een meningeoom: medisch inhoudelijke zaken worden reeds in de richtlijn beschreven.
Functies en anatomische eigenschappen: mogelijkheden en beperkingen t.a.v.:
- Anatomische eigenschappen van zenuwstelsel
- Anatomische eigenschappen van oog, oor en verwante structuren
- Anatomische eigenschappen van structuren betrokken bij stem en spraak
- Anatomische eigenschappen van hart en bloedvatenstelsel, afweersysteem en ademhalingsstelsel
- Anatomische eigenschappen van spijsverteringsstelsel, metabool stelsel en hormoonstelsel
- Anatomische eigenschappen van urogenitaal stelsel
- Anatomische eigenschappen van structuren verwant aan beweging
- Anatomische eigenschappen van huid en verwante structuren
Mogelijkheden en beperkingen van functies en anatomische eigenschappen voor patiënten met een meningeoom:
- Epilepsie
- Vermoeidheid
- Cognitie
- Focale neurologische uitvalverschijnselen
- (Hoofd)Pijn
- Veranderingen van persoonlijkheid, emotie en gedrag
Activiteiten en participatie: mogelijkheden en beperkingen t.a.v.:
- Leren en toepassen van kennis
- Algemene taken en eisen
- Communicatie
- Mobiliteit
- Zelfverzorging
- Huishouden
- Tussenmenselijke interacties en relaties
- Belangrijke levensgebieden
- Maatschappelijk, sociaal en burgerlijk leven
Mogelijkheden en beperkingen van activiteiten en participatie voor patiënten met een meningeoom:
- Intermenselijke interactie en relaties
- Communicatie en mobiliteit
- Onderhouden van relaties
- Financiële afhankelijkheid
- Werkrelaties
- ADL
- Oudertaken
- Huishoudelijke taken
- Participatieproblemen
- Vrijetijdsbesteding
- Autorijden
- In een vliegtuig zitten
Externe factoren: mogelijkheden en beperkingen t.a.v.:
- Producten en technologie
- Natuurlijke omgeving en door de mens aangebrachte veranderingen daarin
- Ondersteuning en relaties
- Attitudes
- Diensten, systemen en beleid (bijv. binnen de maatschappij of gezondheidszorg)
Mogelijkheden en beperkingen van externe factoren voor patiënten met een meningeoom:
- Sociale omgeving
- Maatschappelijk functioneren
- Rol in gezin en relaties
- Beperkte toegankelijkheid van professionele hulp. Oorzaak hiervan is onvoldoende bekendheid met het aanbod en de beperkte vergoedingen van de verzekeraar
- Nazorgmogelijkheden voor partner zijn beperkt (i.v.m. vergoeding verzekeraar)
- UWV, Jobcoach
- Toegang tot nazorg/revalidatie is soms complex
De deelnemers aan de telefonische vergadering geven het volgende aan:
Wanneer er geen primaire revalidatie-indicatie is, is nazorg (te) beperkt, omdat de restverschijnselen niet gezien worden door zorgverleners. Met name de cognitieve beperkingen worden niet voldoende herkend. Screening gericht op cognitieve functies zouden hiervoor uitgevoerd moeten worden. Ook de patiënt en diens omgeving herkennen cognitieve dysfunctie pas op een later moment.
Na een half en een heel jaar postoperatief zou screening op cognitieve verschijnselen moeten plaatsvinden. Preoperatieve screening zou i.v.m. onderzoeksdoeleinden waardevol kunnen zijn. Een screeningsinstrument dat ingezet kan worden (als hulpmiddel): CLCE (niet gevalideerd). Het heeft mogelijk de voorkeur om een instrument te kiezen dat door de patiënt zelf wordt ingevuld, i.v.m. efficiëntie. Zorgverlener kan de patiënt daarnaast actief aanspreken om kritisch naar het eigen functioneren te kijken en de patiënt bewust te maken van eventuele uitvalsverschijnselen, om daar vervolgens passende ondersteuning/nazorg bij te bieden.
Persoonlijke factoren: mogelijkheden en beperkingen t.a.v.:
- factoren binnen het individu
Niet besproken
Patiëntenperspectief bij de vijf evidence based uitgangsvragen:
-
Bij het maken van een keuze voor de behandeling is rekening houden met wat de invloed is van het meningeoom op het functioneren. Ondanks dat er sprake is van een asymptomatisch meningeoom is het belangrijk te realiseren dat patiënten heel verschillend om kunnen gaan met het feit dat er een tumor in het hoofd is gediagnosticeerd. De patiënt moet een beeld geschetst worden wat de gevolgen zijn van wel/niet behandelen. De psychische gesteldheid moet worden meegewogen in de keuze voor het wel/niet behandelen.
-
De keuzes voor behandeling zijn vooral medisch ingegeven. De patiënt moet wel goed geïnformeerd worden over de gevolgen van therapie zoals chirurgie en radiotherapie. Er is weinig landelijk voorlichtingsmateriaal voor deze specifieke doelgroep beschikbaar. In de richtlijn kan opgenomen worden dat de patiënt bij het bespreken van het behandelplan een mantelzorger dient mee te nemen.
-
De keuze voor aanvullende radiotherapie is vooral medisch ingegeven. Omdat er sprake is van een lage bewijskracht, is het nut van aanvullende radiotherapie niet geheel duidelijk. Hierdoor is er mogelijk meer ruimte voor de wens van de patiënt bij het vaststellen van het behandelplan, echter zal de uiteindelijke keuze met name van de arts afhankelijk zijn en is het aan de arts de voor- en nadelen duidelijk te bespreken met de patiënt.
-
Een duidelijke uitleg moet gegeven worden over de wijze en frequentie van follow-up bij een meningeoom. De patiënt moet goed geïnstrueerd worden bij welke klachten met welke zorgverlener contact opgenomen moet worden. De zorgverlener moet in het gehele (na)zorgtraject expliciet aandacht hebben voor angst, onzekerheid en depressie en zorgdragen voor adequate doorverwijzing.
-
Herhaaldelijke screening op neuropsychologische klachten is wenselijk. Hoe en door wie deze screening plaats moet vinden kan per centrum bepaald worden. Op indicatie kan een neuropsychologisch onderzoek uitgevoerd worden. Neuropsychologisch onderzoek kan van waarde zijn bij begeleiding bij re-integratie in het arbeidsproces.
Methode ontwikkeling
Evidence based
Implementatie
Het bevorderen van het gebruik van de richtlijn begint met een brede verspreiding van de richtlijn. Er wordt een mailing verstuurd onder de professionals via de (wetenschappelijke) verenigingen en de werkgroepen van IKNL. Ook is de richtlijn gepubliceerd op www.oncoline.nl/richtlijn Intracranieel Meningeoom. Tevens zal er een artikel of manuscript ter publicatie aangeboden worden aan het Nederlands Tijdschrift voor Geneeskunde. Ook in andere tijdschriften of bij bijvoorbeeld nascholingsbijeenkomsten wordt de richtlijn onder de aandacht gebracht. Om het gebruik in de dagelijkse praktijk te bevorderen zal er een samenvattingskaart van de richtlijn gemaakt worden. Daarnaast beschikt IKNL over een toolbox ter ondersteuning van de IKNL adviseurs netwerken c.q. professionals in het veld voor de implementatie van de richtlijn. De toolbox bevat:
-
Een overzicht van de aanbevelingen.
-
De kernboodschappen (belangrijkste inhoudelijke boodschappen).
-
Een basis PowerPointpresentatie voor IKNL adviseurs netwerken en werkgroepleden van deze richtlijn.
-
Een implementatieplan voor deze richtlijn (incl. indicatoren voor evaluatie van de richtlijn). Dit plan bevat voor de belangrijkste aanbevelingen uit de richtlijn een overzicht van belemmerende en bevorderende factoren voor de implementatie. Op basis hiervan beschrijft het plan de belangrijkste doelgroepen en (adviezen voor) concrete acties om implementatie te bevorderen.
- Een training aan de IKNL adviseurs netwerken.
Werkwijze
Werkwijze
De richtlijnwerkgroep bestaat uit zorgverleners van verschillende (para)medische disciplines (bijlage 1). Ook twee patiëntvertegenwoordigers namen zitting in de richtlijnwerkgroep: één ervaringsdeskundige op het gebied van meningeoom en één deskundige op het gebied van richtlijnontwikkeling. Een overzicht van alle leden van de werkgroep is opgenomen in bijlage 2.
De werkgroep is op 11 juli 2012 voor de eerste maal bijeengekomen. Op basis van een eerste inventarisatie van de knelpunten door de werkgroepleden is, door middel van een enquête onder professionals die betrokken zijn bij patiënten met een meningeoom, een knelpunteninventarisatie gehouden. Na het versturen van de enquête hebben 168 professionals gerespondeerd en knelpunten geprioriteerd en/of ingebracht. De meest relevante knelpunten zijn uitgewerkt tot vijf uitgangsvragen (bijlage 11) die evidence based zijn uitgewerkt.
Voor iedere uitgangsvraag werd uit de richtlijnwerkgroep een subgroep geformeerd.
Bij de evidence based beantwoording van de vijf uitgangsvragen verzorgde een externe methodoloog het literatuuronderzoek, in overleg met de betreffende subgroep. Dit betrof het uitvoeren van een systematische literatuursearch, het kritisch beoordelen van de literatuur en het verwerken van de literatuur in evidence tabellen (bijlage 9). Daarnaast werd door de methodoloog een concept literatuurbespreking met bijbehorende conclusies aangeleverd voor deze uitgangsvragen. De werkgroepleden stelden overige overwegingen en aanbevelingen op volgens de checklist ‘overige overwegingen en formuleren van aanbevelingen’ (bijlage 7).
Voor de consensus-based delen in de richtlijn raadpleegden de werkgroepleden zelf de relevante bestaande literatuur. Op basis hiervan hebben de werkgroepleden de conclusies, overige overwegingen en aanbevelingen geformuleerd. Voor de consensus based beantwoording is geen systematisch literatuuronderzoek verricht en zijn de artikelen niet methodisch beoordeeld door een externe methodoloog.
De werkgroep heeft gedurende een periode van 18 maanden gewerkt aan de tekst van de conceptrichtlijn. Alle teksten zijn tijdens plenaire en telefonische vergaderingen besproken en na verwerking van de commentaren door de werkgroep geaccordeerd.
Zoekverantwoording
Assessment table relative importance patient-important outcomes
|
Patient-important outcomes |
Mean rating |
Relative importance |
|
Morbidity |
7.3 |
Critical |
|
Progression-free survival |
7.0 |
Critical |
|
Mortality |
6.8 |
Important |
Evidence tables
Cohortstudies
|
Study ID |
Method |
Patient characteristics |
Intervention(s) |
Results |
Critical appraisal of study quality |
|
Jo K-W 2011 |
|
Wait-and-scan: N=77
Microsurgery: N=8
Gamma-knife radiosurgery (GKRS): N=69 |
Morbidity:
Progression-free survival:
Mortality:
|
Risk of bias: high
|
|
|
Kuratsu J 2000 |
|
Wait-and-scan: N=109
Surgery: N=87 |
Morbidity:
Progression-free survival:
Mortality:
|
Risk of bias: high
|
|
|
Nishizaki T 1999 |
|
Wait-and-scan: N=33
Surgery: N=75 |
Morbidity:
Progression-free survival:
Mortality:
|
Risk of bias: high
|
|
|
Sonoda Y 2005 |
|
Wait-and-scan: N=11
Surgery: N=5
|
Morbidity:
Progression-free survival:
Mortality:
|
Risk of bias: high
|
|
|
Yano S 2006 |
|
Wait-and-scan: N=351
Surgery: N=191 (during follow-up, an additional 22 patients of the wait-and-scan group underwent surgery)
Stereotactic radiosurgery: N=61 |
Morbidity:
Progression-free survival:
Mortality:
|
Risk of bias: high
|
Case series
|
Study ID |
Method |
Patient characteristics |
Intervention(s) |
Results |
Critical appraisal of study quality |
|
Hashiba T 2009 |
|
Wait-and-scan (MRI or CT, volumetric assessment)
Volume changes <15% were considered no change |
Morbidity:
Progression-free survival:
Mortality:
|
Risk of bias: high
|
|
|
Nakamura M 2003 |
|
Wait-and-scan (MRI or CT)
|
Morbidity:
Progression-free survival:
Mortality:
|
Risk of bias: high
|
|
|
Nakasu S 2011 |
|
Wait-and-scan (MRI or CT, volumetric assessment)
Volume changes <8.2% were considered no change |
Morbidity:
Progression-free survival:
Mortality:
|
Risk of bias: high
|
|
|
Niiro M 2000 |
|
Wait-and-scan (MRI or CT) |
Morbidity:
Progression-free survival:
Mortality:
|
Risk of bias: high
|
|
|
Rubin G 2011 |
|
Wait-and-scan (MRI or CT)
|
Morbidity:
Progression-free survival:
Mortality:
|
Risk of bias: high
|
|
|
Yoneoka Y 2000 |
|
Wait-and-scan (MRI or CT)
Tumour growth: > 1 cu cm/year
|
Morbidity:
Progression-free survival:
Mortality:
|
Risk of bias: high
|
Abbreviations: CoI: conflict of interest; CT: computed tomography; GKRS: gamma-knife surgery; GOS: Glasgow outcome scale; MRI: magnetic resonance imaging; NS: not significant; SRS: stereotactic surgery; SRT: stereotactic radiotherapy; US: United States.
GRADE table
|
Quality assessment |
No of patients |
Effect |
|
|
||||||||
|
No. of studies |
Design |
Risk of bias 1 |
Inconsistency |
Indirectness |
Imprecision 2 |
Other considerations |
Intervention |
Control |
Intervention |
Control |
Quality |
Importance |
|
MORBIDITY |
||||||||||||
|
Symptom development during conservative treatment |
||||||||||||
|
6 |
Cohort study / case series |
-2 1 |
- |
- |
- |
-1 2 |
385 |
- |
0-12.5% |
- |
Very low |
Critical |
|
5-YEAR PROGRESSION-FREE SURVIVAL |
||||||||||||
|
Gamma-knife surgery versus conservative treatment |
||||||||||||
|
1 |
Cohort study |
-2 1 |
- |
- |
- |
-1 2 |
69 |
77 |
100% |
62% |
Very low |
Critical |
|
MORTALITY |
||||||||||||
|
Surgery: postoperative mortality |
||||||||||||
|
4 |
Cohort study |
-2 1 |
- |
- |
- |
-1 2 |
358 |
- |
0-1.3% |
- |
Very low |
Critical |
|
Conservative treatment: tumour-related mortality |
||||||||||||
|
2 |
Case series |
-2 1 |
- |
- |
- |
-1 2 |
96 |
- |
0-1.0% |
- |
Very low |
Critical |
|
Overall quality of evidence: very low |
||||||||||||
1 High risk of bias: potential selection bias, no blinding or risk adjustment. Therefore, impossible to upgrade.
2 Small sample sizes
References
Hashiba T, Moto NH, Izumoto S, Suzuki T, Kagawa N, Maruno M, et al. Serial volumetric assessment of the natural history and growth pattern of incidentally discovered meningiomas: Clinical article. J. Neurosurg. 2009;110(4):675-84.
Jo K-W, Kim C-H, Kong D-S, Seol H-J, Nam D-H, Park K, et al. Treatment modalities and outcomes for asymptomatic meningiomas. Acta Neurochir (Wien). 2011;153(1):62-7; discussion 7.
Kuratsu J, Kochi M, Ushio Y. Incidence and clinical features of asymptomatic meningiomas. J Neurosurg. 2000;92(5):766-70.
Nakamura M, Roser F, Michel J, Jacobs C, Samii M. The natural history of incidental meningiomas. Neurosurgery. 2003;53(1):62-70; discussion -1.
Nakasu S, Nakasu Y, Fukami T, Jito J, Nozaki K. Growth curve analysis of asymptomatic and symptomatic meningiomas. J Neurooncol. 2011;102(2):303-10.
Niiro M, Yatsushiro K, Nakamura K, Kawahara Y, Kuratsu J. Natural history of elderly patients with asymptomatic meningiomas. J Neurol Neurosurg Psychiatry. 2000;68(1):25-8.
Nishizaki T, Ozaki S, Kwak T, Ito H. Clinical features and surgical outcome in patients with asymptomatic meningiomas. Br J Neurosurg. 1999;13(1):52-5.
Rubin G, Herscovici Z, Laviv Y, Jackson S, Rappaport ZH. Outcome of untreated meningiomas. Isr Med Assoc J. 2011;13(3):157-60.
Sonoda Y, Sakurada K, Saino M, Kondo R, Sato S, Kayama T. Multimodal strategy for managing meningiomas in the elderly. Acta Neurochir (Wien). 2005;147(2):131-6; discussion 6.
Yano S, Kuratsu J-i, Kumamoto Brain Tumor Research G. Indications for surgery in patients with asymptomatic meningiomas based on an extensive experience. J Neurosurg. 2006;105(4):538-43.
Yoneoka Y, Fujii Y, Tanaka R. Growth of incidental meningiomas. ACTA NEUROCHIR. 2000;142(5):507-11.
