Total body CT
Uitgangsvraag
Moet elke patiënt met een potentieel meervoudig letsel routinematig een total body CT (TBCT) krijgen, of volstaat een work-up met conventioneel radiologisch onderzoek en aanvullende CT van een specifiek deelgebied op indicatie indien lichamelijk onderzoek en/of conventioneel onderzoek hiertoe aanleiding geven?
Aanbeveling
Maak niet standaard bij elke traumapatiënt met potentieel meervoudig en/of levensbedreigend letsel een total body CT.
Overweeg een total body CT in plaats van een work-up met standaard radiologisch onderzoek bij patiënten met potentieel meervoudig letsel indien:
- de patiënt na een ernstig trauma klinisch evident meervoudig gewond is en hemodynamisch, respiratoir en neurologisch voldoende stabiel wordt geacht om een CT scan te ondergaan, en
- er reeds een indicatie is voor een CT van het deelgebied zoals thorax, abdomen of bekken en de patiënt een traumamechanisme heeft gehad dat niet beperkt is tot één lichaamsgebied. (voor CT indicaties specifieke deelgebieden, zie andere modules).
Overwegingen
Balans tussen voor- en nadelen
Routinematig een TBCT maken bij elke traumapatiënt met een potentieel meervoudig en/of levensbedreigend letsel lijkt geen effect te hebben op de mortaliteit ten opzichte van een work-up met conventioneel röntgenonderzoek met CT van een deelgebied op indicatie. Het effect van de TBCT loopt in de literatuur erg uiteen, waarbij dient te worden vermeld dat de ernst van de verwondingen (ISS score) per studie erg wisselden. Alhoewel dit met de huidige literatuur niet goed te onderbouwen is, is het aannemelijk dat hoe erger de verwondingen, hoe groter het positieve effect van TBCT zal zijn.
TBCT leidt in enkele studies wel tot verkorting van de tijd van verblijf op de SEH of tijd tot diagnose, maar de resultaten in de literatuur zijn variabel. De tijdswinst van TBCT voor de verblijfsduur op de SEH zal mede afhankelijk zijn van de logistieke mogelijkheden in het betreffende ziekenhuis en de beschikbaarheid en locatie van de CT-scanner (al dan niet op SEH). Aan de andere kant kan een TBCT leiden tot vertraging in de behandeling bij hemodynamisch, respiratoir en/of neurologisch instabiele patiënten, indien de CT-scanner niet direct op de SEH beschikbaar is.
Naar de kosteneffectiviteit van TBCT is nog te weinig onderzoek gedaan en over de morbiditeit en kwaliteit van leven is op dit moment nog niets bekend. TBCT lijkt bij veel patiënten wel een hogere stralingsbelasting te geven dan standaard röntgenonderzoek met CT op indicatie.
Uit de weging van de argumenten voor en tegen TBCT in plaats van standaard conventionele diagnostiek met CT op indicatie, zijn behalve de snellere evaluatietijd (tijd tot diagnose en verblijfsduur op de SEH) geen duidelijke argumenten voor of tegen routinematige TBCT.
Kwaliteit van het bewijs
De mate van (on)zekerheid over effecten en veiligheid is groot. De GRADE-beoordeling is zeer laag tot laag. Er is lage zekerheid dat het ware effect van TBCT dichtbij het geschatte effect ligt zoals vermeld in de literatuurconclusies. Er is een reële kans dat de conclusie verandert wanneer er resultaten van nieuw grootschalig onderzoek aan de literatuuranalyse worden toegevoegd.
Kosten
In de literatuur is er weinig onderzoek gedaan naar de kosteneffectiviteit van TBCT. Er is geen duidelijk positief of negatief effect van TBCT op de totale ziekenhuiskosten gevonden.
Haalbaarheid
Alle ziekenhuizen hebben de beschikking over een CT-scanner, maar niet elk ziekenhuis heeft een CT scanner op of in de nabijheid van de SEH. Daarnaast is niet in elk ziekenhuis buiten kantooruren direct een (assistent)radioloog beschikbaar om de CT-beelden te beoordelen. Zie hiervoor ook de module “Organisatie van zorg”.
Aanbeveling:
De werkgroep is van mening dat er op dit moment te weinig bewijslast is om standaard bij iedere traumapatiënt met potentieel ernstig letsel een TBCT te adviseren. Er lijkt voor standaard TBCT onvoldoende meerwaarde te zijn ten opzichte van een work-up met standaard radiologische onderzoek met conventionele onderzoek (X-thorax, echo/FAST, X-bekken) met aanvullend CT op indicatie. Er kunnen echter wel patiënt specifieke of logistieke redenen zijn om bij een individuele patiënt wel een TBCT te maken. Verdere analyses van de REACT2 trial kunnen wellicht in de toekomst voor meer kennis hieromtrent zorgen.
In 2017 hebben Treskens et al een review verricht naar veel gebruikte indicaties voor TBCT. Uit de review bleek dat in verschillende studies uit verschillende centra zeer uiteenlopende indicaties werden gebruikt voor het verrichten van een TBCT. Indicaties bestonden vaak uit ‘afwijkende vitale parameters’, ‘ernstig traumamechanisme’ en ‘klinische verdenking op ernstige letsels’. De definities en afkapwaarden van deze indicaties liepen echter erg uiteen en wisselden sterk per studie, waardoor vergelijking tussen de studies en indicaties niet mogelijk was. Ook was het niet mogelijk om te bepalen of de indicaties voor TBCT terechte indicaties waren of niet. Daarnaast zijn al deze criteria niet prospectief of extern gevalideerd. De werkgroep kan derhalve op basis van deze review geen sterke aanbeveling geven over de indicaties voor een TBCT.
Onderbouwing
Achtergrond
Traumapatiënten die worden verdacht van ernstig en/of meervoudig letsel ondergaan vaak achtereenvolgens meerdere beeldvormende onderzoeken, om ze zo snel en adequaat mogelijk te kunnen behandelen. Volgens de ATLS-principes gebeurt dit eerst met conventionele radiologische onderzoeken (X-thorax, X-bekken en (e)FAST) en zo nodig aanvullende CT van een lichaamsdeel of orgaan op indicatie. De aanvullende CT op indicatie wordt dan van een deelgebied van het lichaam gemaakt als het lichamelijk onderzoek of voorafgaande conventionele onderzoek specifieke afwijkingen toont, die nadere diagnostiek middels CT behoeven. Het kan echter zijn dat door de relatief lage sensitiviteit van het lichamelijke en conventioneel radiologische onderzoek afwijkingen hierbij worden gemist en daardoor de noodzakelijke aanvullende CT op indicatie niet wordt gemaakt, waardoor letsels gemist kunnen worden. In tegenstelling tot een CT op indicatie, kan een CT ook routinematig worden gemaakt, waarbij de TBCT (CT Cerebrum, CWK, thorax, abdomen en bekken, inclusief thoracolumbale wervelkolom) standaard bij bepaalde potentieel ernstige traumapatiënten wordt gemaakt, ongeacht bevindingen in het lichamelijk onderzoek of voorafgaande conventionele onderzoek. Afhankelijk van lokale afspraken, kan dit bijvoorbeeld al het geval zijn op grond van prehospitale informatie.
De laatste jaren wordt steeds vaker een routinematige TBCT verricht, al dan niet direct na binnenkomst. Door van elke patiënt na een potentieel ernstig trauma routinematig een TBCT te maken, zal de diagnostiek voor de individuele patiënt mogelijk beter en sneller zijn en overlappende onderzoeken met dito stralingsbelasting kunnen worden voorkomen, maar het zal ook kunnen leiden tot meer overbodige diagnostiek met onnodige stralingsbelasting en kosten. Het is onduidelijk of en wanneer het beter is om na binnenkomst een TBCT te maken, met betrekking tot de overleving, snelheid van de diagnostiek, stralingsbelasting en kosten. Wanneer het initiële radiodiagnostisch onderzoek sneller en efficiënter verloopt, zal de overleving mogelijk verbeteren.
Conclusies / Summary of Findings
|
Laag GRADE |
Een routinematige total-body CT (TBCT) lijkt de sterfte onder patiënten met potentieel meervoudig en/of levensbedreigend letsel door stomp trauma niet te verlagen in vergelijking met een work-up van conventioneel radiodiagnostisch onderzoek met CT op indicatie (CR).
Bronnen: (Hsiao, 2013; Sierink, 2016; Sierink, 2014; Wurmb, 2010; Yeguiyan, 2012) |
|
Zeer laag GRADE |
Er zijn enige aanwijzingen dat TBCT, in vergelijking met CR, de tijd op de SEH van patiënten met potentieel meervoudig en/of levensbedreigend letsel door stomp trauma kan verkorten.
Bronnen: (Huber-Wagner, 2009; Hutter, 2011; Sierink, 2016; Weninger, 2007) |
|
Zeer laag GRADE |
Er zijn enige aanwijzingen dat TBCT, in vergelijking met CR, de tijd tot diagnose op de SEH van patiënten met potentieel meervoudig en/of levensbedreigend letsel door stomp trauma kan verkorten.
Bronnen: (Sierink, 2016; Weninger, 2007) |
|
Zeer laag GRADE |
Er zijn enige aanwijzingen dat TBCT, in vergelijking met CR, de IC opname duur van patiënten met potentieel meervoudig en/of levensbedreigend letsel door stomp trauma niet verkort.
Bronnen: (Huber-Wagner, 2009; Hutter, 2011; Sierink, 2016; Weninger, 2007) |
|
Zeer laag GRADE |
Er is onzekerheid over het effect van TBCT, in vergelijking met CR, op de ziekenhuisverblijfsduur van patiënten met potentieel meervoudig en/of levensbedreigend letsel door stomp trauma.
Bronnen: (Huber-Wagner, 2009; Huber-Wagner, 2013 en Weninger, 2007) |
|
Zeer laag GRADE |
Er zijn aanwijzingen dat TBCT, in vergelijking met CR, de stralingsbelasting van patiënten met potentieel meervoudig en/of levensbedreigend letsel door stomp trauma verhoogt.
Bronnen: (Sierink, 2016; Asha, 2012) |
|
Zeer laag GRADE |
Er is onzekerheid over het effect van TBCT, in vergelijking met CR, op de ziekenhuiskosten voor patiënten met potentieel meervoudig en/of levensbedreigend letsel door stomp trauma.
Bronnen: (Sierink, 2016) |
|
Zeer laag GRADE |
Er is onzekerheid over het effect van TBCT, in vergelijking met CR, op het aantal gemiste letsels bij patiënten met potentieel meervoudig en/of levensbedreigend letsel door stomp trauma.
Bronnen: (Asha, 2012) |
|
Zeer laag GRADE |
Er zijn enige aanwijzingen dat TBCT, in vergelijking met CR, het aantal incidentele bevindingen bij patiënten met potentieel meervoudig en/of levensbedreigend letsel door stomp trauma verhoogt.
Bronnen: (Treskes, 2017) |
Samenvatting literatuur
Beschrijving studies
De elf studies (32.207 patiënten) die Chidambaram (2017) includeerde vergeleken allen primair het effect van TBCT versus conventionele beeldvorming (CR) op mortaliteit. In alle studies gebruikte men dezelfde TBCT-definitie, maar de protocollen en indicatiestelling verschilden wel onderling, onder andere met betrekking tot de locatie van de CT-scanner en de parameters met betrekking tot de beeldvorming (zie Chidambaram (2017) voor meer details over de protocollen en indicatiestelling). In alle studies bestond de patiëntenpopulatie hoofdzakelijk uit patiënten na stomp trauma.
Eén studie (Wada, 2013) vergeleek TBCT met een work-up van louter conventionele radiodiagnostiek zonder enige orgaanspecifieke CT-beeldvorming op indicatie. Omdat de werkgroep van mening is dat het gebruik van CT-diagnostiek op indicatie algemeen geaccepteerd is en een work-up van louter conventionele diagnostiek (zonder enige CT op indicatie) niet meer conform de huidige werkwijze is, werd deze aanpak door de werkgroep beschouwd als achterhaald en werd de studie van Wada (2013) daarom verder buiten beschouwing gelaten in de literatuuranalyse. De studie van Wada 2013 benadrukt overigens wel dat louter conventioneel onderzoek een lage sensitiviteit heeft en derhalve laagdrempelig voor aanvullende CT-diagnostiek dient te worden gekozen.
De overgebleven studies uit de review van Chidambaram (2017) en de studie van Treskes (2017) werden gebruikt voor het beantwoorden van het vraagstuk.
Factoren die mogelijk het effect op mortaliteit zouden kunnen verstoren, zoals leeftijd, geslacht en traumamechanisme, waren niet verschillend tussen beide groepen in de studies. Wel bleek in drie studies (Huber-Wagner, 2009; Huber-Wagner, 2013; Hutter, 2011) de Injuriy Severity Score (ISS) in de TBCT-groep statistisch significant hoger (variërend van 26,0 tot 32,4) dan in de CR-groep (23,0 tot 28,4) (p<0.001).
Tabel 1. Overzicht van gerandomiseerde studies en prospectieve cohort studies waarin TBCT werd vergeleken met standaard initiële radiodiagnostiek inclusief CT op indicatie. Om misverstanden te voorkomen is de letterlijke beschrijving uit de studies, in het Engels, overgenomen.
|
Studie (Auteur, jaar) |
Design |
Interventie |
Controle |
|
Sierink, 2016 |
RCT |
Immediate TB scanning |
Standard work-up with conventional imaging supplemented by selective CT scanning |
|
Sierink, 2014 |
Prospectieve case-control |
Immediate TBCT scanning, consecutive patients |
Chest X-ray, pelvic X-ray, and FAST, followed by selective CT scanning based on local imaging guidelines |
|
Hsiao, 2013 |
Prospectief cohort |
Decision for TBCT at the clinical discretion of the attending trauma teamleader |
Selective CT scanning |
|
Yeguiayan, 2012 |
Prospectief cohort |
TBCT (systematically recommended unless severe trauma patients present an unstable hemodynamic status or severe isolated head injury or both) according to the diagnosis strategy defined by each trauma team. |
Selective CT scanning |
|
Wurmb, 2011 |
Prospectief cohort |
Initial TBCT, patients from 2001 to 2003 |
Conventional radiography, combined with abdominal ultrasound and organ-focused CT (conventional trauma protocol), patients from 2004 to 2006 |
Tabel 2. Overzicht van retrospectieve studies waarin TBCT werd vergeleken met standaard initiële radiodiagnostiek.
|
Studie (Auteur, jaar) |
Design |
Interventie |
Controle |
|
Huber-Wagner, 2013 |
Retrospective cohort |
Unenhanced CT of the head followed by contrast-enhanced CT of the chest, abdomen, and pelvis, including the complete spine |
No CT or only dedicated CT of one or combined body regions |
|
Huber-Wagner, 2009 |
Retrospective cohort |
Unenhanced CT of the head followed by contrast-enhanced CT of the chest, abdomen, and pelvis, including the complete spine. |
No CT or only dedicated CT of one or combined body regions |
|
Kimura, 2013 |
Retrospective cohort |
CT including all of the head, neck, chest, abdomen, and pelvis during initial trauma management |
No CT of one or more of the body regions |
|
Hutter, 2011 |
Retrospective cohort |
CT as the primary imaging tool after resuscitation, a brief physical check-up and FAST examination |
Structured physical examination, a FAST scan, plain X-rays of the chest and pelvis in the anterior-posterior view, and anterior-posterior and lateral radiographs of the entire vertebral column, always followed by cranial CT. Additional x-ray or CT scans of selected body regions were available if requested at the discretion of the trauma leader. |
|
Weninger, 2007 |
Retrospective cohort |
Patients were transported directly to the MSCT |
Routinely, CR of head, cervical spine, chest, and pelvis was performed. CR was also done on all regions where long bone or spinal fractures were suspected. The abdomen was checked by FAST. After stabilization of the patients and completion of CR and FAST, the patients were transferred to the CT that was located next to the ER. A CT scan of the brain was routinely done for all patients who were unconscious or neurologically not assessable from other reasons. CT scans of other body regions (en dergelijke chest, abdomen) were done if lesions were suspected after clinical examination, CR, or FAST. |
Resultaten
Mortaliteit
Alleen Sierink (2016) onderzocht in een gerandomiseerde studie het verschil in mortaliteit tussen een TBCT-groep en CR-groep (totaal 984 patiënten). In deze studie werd geen verschil gevonden in sterfte tussen beide groepen: 86 (16%) patiënten in de TBCT-groep overleden tegenover 85 (16%) in de CR-groep (RR 1,01; 95%BI 0,77 tot 1,33) (Figuur 1a) (NNT = 467.659). Hierbij dient te worden vermeld dat uiteindelijk in de CR groep 250 patiënten (46%) aanvullende CT-scans kregen van alle lichaamsregio’s, die uiteindelijk dezelfde beeldvorming opleveren als TBCT. De indicaties voor aanvullende CT in deze studie waren duidelijke geprotocolleerd en geformuleerd.
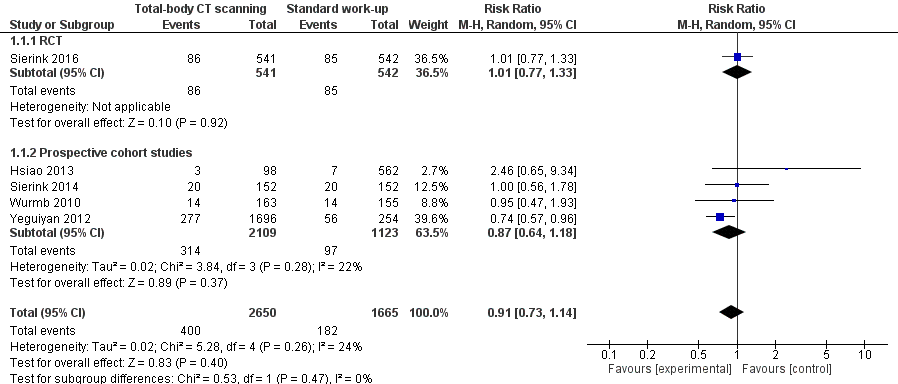
Figuur 1a. Meta-analyse voor de uitkomstmaat overleving (RCT en prospectieve cohort studies), TBCT scanning versus standaard initiële radiodiagnostiek.
Vier prospectieve cohortstudies (totaal 3232 patiënten) lieten wisselende effectschattingen zien ten aanzien van mortaliteit: variërend van geen verschil in mortaliteit tussen beide groepen (Sierink, 2014; Wurmb, 2010), een mogelijk nadelig effect van TBCT (Hsiao, 2013) en een positief effect van TBCT (Yeguiyan, 2012). De gepoolde risicomaat bedroeg 0,91 ten gunste van TBCT, maar het betrouwbaarheidsinterval omsluit 1 ruim (0,73 tot 1,14). Er lijkt dus geen effect te zijn van TBCT op mortaliteit.
Vijf retrospectieve cohortstudies (totaal 13378 patiënten) vonden een odds van 0.73 (95% CI 0.59 tot 0.90) in het voordeel van TBCT ten aanzien van mortaliteit (Huber-Wagner 2009; Huber-Wagner 2013; Hutter 2011; Kimura 2013; Weninger, 2007) (Figuur 1b).
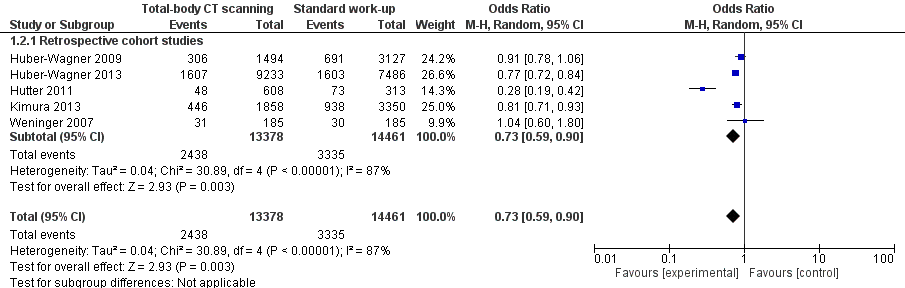
Figuur 1b. Resultaten voor de uitkomstmaat overleving (retrospectieve cohort studies), TBCT scanning versus standaard initiële radiodiagnostiek.
Evaluatietijd (tijd op de spoedeisende hulp)
Sierink (2016) rapporteerde op basis van hun RCT dat de meeste patiënten in de TBCT-groep na 63 minuten (interkwartielafstand (IQR 47 tot 102) de spoedeisende hulp verlieten, tegenover 72 minuten in de CR-groep (IQR 50 tot 109). Dit verschil was niet statistisch significant (p=0.067).
Drie studies (Huber-Wagner, 2009; Weninger, 2007; Hutter, 2011) vonden een statistisch significante reductie van tijd op de spoedeisende hulp ten gunste van TBCT. Weninger (2007) en Hutter (2011) vonden gemiddelden van 34 minuten korter tot ruim een uur korter, respectievelijk. Één studie (Huber-Wagner, 2009) vond geen verschil in de evaluatietijd (Figuur 2).
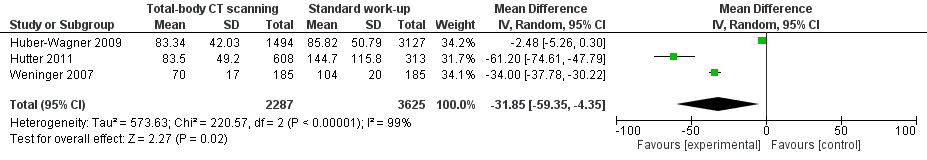
Figuur 2. Meta-analyse voor de uitkomstmaat evaluatietijd (minuten op de spoedeisende hulp), TBCT versus standaard initiële radiodiagnostiek.
Evaluatietijd (tijd tot diagnose)
Twee studies rapporteerden de tijd tot diagnose. Sierink (2016) (totaal 1083 patiënten) vond een statistisch significante kortere tijd tot diagnose in de TBCT-groep vergeleken met de CR-groep (mediaan 50 minuten (IQR 38 tot 68) versus 58 minuten (IQR 42-78), p=0,001). Weninger (2007) (totaal 370 patiënten) vond dat in 92,2% van alle patiënten in de TBCT-groep de definitieve diagnose van alle verwondingen gesteld werd na 12 minuten (SD 9), terwijl in de CR-groep 76,2% van de patiënten na 41 minuten (SD 27) de definitieve diagnose van alle verwondingen hadden. In de overige 23,8% werden letsels gemist en later gevonden door specifieke diagnostische procedures of tijdens de operatie.
IC opnameduur
Vier studies vergeleken de IC opnameduur tussen beide groepen (Figuur 3). Drie studies (Hutter, 2011; Huber-Wagner, 2009; Huber-Wagner, 2013) vonden een statistisch significante kortere opnameduur in de CR-groep vergeleken met de TBCT-groep (variërend van 1,7 dag tot 6,3 dagen korter). Weninger (2007) vond daarentegen dat de gemiddelde IC opnameduur in de TBCT-groep ruim 3 dagen korter was dan in de CR-groep, maar dit verschil was niet statistisch significant. De gepoolde resultaten wijzen erop dat de IC opnameduur ruim 2 dagen korter (95%BI 0,3 tot 4,2) was in CR-groep dan in de TBCT-groep (SMD 0,15; 95%BI 0,03 tot 0,27). De effectschatting overschrijdt de grens voor klinische relevante (SMD=0,2) niet, maar het betrouwbaarheidsinterval omsluit deze grens (klein klinisch relevant verschil) wel. Het is onduidelijk in hoeverre een eventueel lagere ISS score in de CR-groep daar invloed op heeft gehad. In elk geval lijkt TBCT geen gunstig effect te hebben op de IC opnameduur.
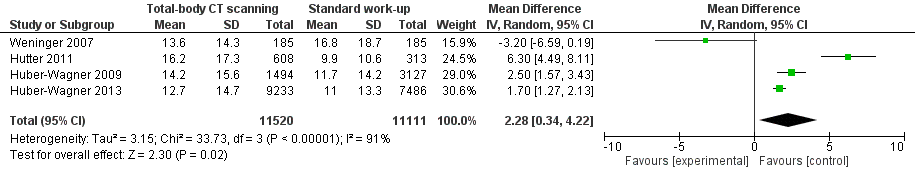
Figuur 3. Meta-analyse voor de uitkomstmaat IC opnameduur (dagen), TBCT versus standaard initiële radiodiagnostiek.
Ziekenhuisverblijfsduur
Drie studies (Huber-Wagner, 2009; Huber-Wagner, 2013 en Weninger, 2007) rapporteerden de ziekenhuisverblijfsduur van de traumapatiënten (Figuur 4). Gemiddeld verbleven de patiënten in de CR-groep 1,2 dag korter in het ziekenhuis dan de TBCT-groep, maar dit verschil was niet statistisch significant (95% BI -1,2 tot 3,6) (SMD 0.04; 95%BI -0.04 tot 0.12).
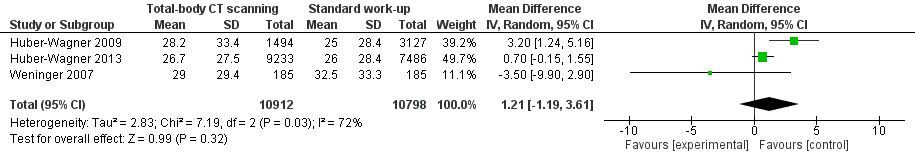
Figuur 4. Meta-analyse voor de uitkomstmaat ziekenhuisverblijfsduur (dagen), TBCT versus standaard initiële radiodiagnostiek.
Stralingsbelasting
Twee studies (Sierink, 2016; Asha, 2012) rapporteerden de stralingsbelasting van TBCT vergeleken met CR en kozen ervoor om de uitkomstmaat ‘stralingsbelasting’ te definiëren als het aantal patiënten dat werd blootgesteld aan meer dan 20 mSv. Asha (2012) (N=1280) vond dat in de TBCT-groep 20% van de patiënten werd blootgesteld aan meer dan 20 mSv, tegenover 11% in de CR-groep. In de studie van Sierink (2016) werden alle patiënten in de TBCT-groep blootgesteld aan 20mSv of meer, tegenover 55% van de patiënten in de CR-groep. De mediane stralingsbelasting was voor de complete ziekenhuisopname 21.0 resp 20.6 mSv (p< 0.0001).
Kosten
Alleen Sierink (2016) (N=1083) berekende de totale ziekenhuiskosten op basis van hun multicenter trial in Nederland. Zij vonden geen statistisch significant verschil in deze kosten. In de TBCT-groep bedroegen de kosten €24.967 (95% BI 21.880 tot 28.752) en in de CR-groep bedroegen de kosten €26.995 (95% BI 23.326 tot 30.908).
Morbiditeit
Geen van de studies rapporteerde gegevens over morbiditeit.
Kwaliteit van leven
Geen van de studies rapporteerde gegevens over kwaliteit van leven.
Gemiste letsels
Eén studie (Asha, 2012) rapporteerde gemiste letsels. Asha (2012) (N=1280) vond geen statistisch significant verschil in het aantal patiënten met gemiste letsels. In de TBCT-groep was er bij 0,6% van de patiënten sprake van letsels die niet waren opgemerkt (95%BI 0,0 tot 1,2) tegenover 0,9% (95%BI 0,2 tot 1,5) in de CR-groep.
Incidentele bevindingen
Treskes (2017) ging na hoeveel incidentele bevindingen (ook wel nevenbevindingen of incidentalomen genoemd) werden opgespoord. In de TBCT-groep ging het om 441 incidentele bevindingen in 233 patiënten, tegenover 290 in 167 patiënten in de CR groep (adjusted RR 1,53; 95%BI 1,3 tot 1,8; p <0,001). Klinisch belangrijke bevindingen vond Treskes (2017) overigens bij 23 patiënten (4,3%) in de TBCT-groep en bij 9 patiënten (1,7%) in de CR-groep. In beide groepen waren nier- en levercysten de meest voorkomende bevinding. Pulmonale noduli waren de meest voorkomende bevindingen met potentieel dodelijke afloop.
Bewijskracht van de literatuur
De hoogste bewijskracht voor de uitkomstmaten mortaliteit, tijd tot diagnose, evaluatietijd, stralingsbelasting, kosten en incidentalomen is afkomstig uit een RCT en startte derhalve op ‘Hoog’.
De bewijskracht voor de uitkomstmaat mortaliteit is echter met twee niveaus verlaagd tot ‘Laag’ gezien beperkingen in de onderzoeksopzet (risico op bias door het ontbreken van blindering van zowel artsen als patiënten), een relatief gering aantal patiënten (<400 events) en het 95% BI omsluit de grens voor klinische relevantie (imprecisie). Tevens is de extrapoleerbaarheid van resultaten naar andere typen trauma laag (bias ten gevolge van indirectheid), maar deze komen weinig voor en hiervoor is de bewijskracht niet verlaagd. In de conclusies is de specifieke patiëntengroep benoemd.
De bewijskracht voor de kritieke uitkomstmaat mortaliteit op basis van de prospectieve cohortstudies start op ‘Laag’. Er waren geen (methodologische) redenen om de bewijskracht van deze studies te verhogen.
De bewijskracht voor de uitkomstmaten tijd op de SEH, tijd tot diagnose op de SEH, stralingsbelasting, kosten en incidentalomen is met 3 niveaus verlaagd tot ‘zeer laag’ gezien de methodologische beperkingen van de observationele studies en de resultaten met het minste risico op bias zijn afkomstig uit slechts één RCT en zijn mogelijk vertekend door zeer ernstige imprecisie.
De bewijskracht voor de uitkomstmaten ziekenhuisverblijfsduur, IC opnameduur en onopgemerkte letsels berust op cohortstudies en start derhalve op ‘Laag’. De bewijskracht is verder verlaagd tot ‘zeer laag’ vanwege methodologische beperkingen, (klinische) heterogeniteit en imprecisie (zowel positieve als negatieve effectschattingen en een zeer gering aantal events (voor de uitkomstmaat onopgemerkte trauma’s).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is de effectiviteit van een routinematige total-body CT scan (TBCT) bij volwassen patiënten met potentieel meervoudig letsel vergeleken met een work-up van standaard conventioneel radiologisch onderzoek bestaande uit X-thorax, X-bekken en e-FAST met eventueel aanvullende CT van een deelgebied op indicatie (CR)?
Bij het beantwoorden van deze vraag wordt er niet gekeken naar het moment van de TBCT en wordt er geen onderscheid gemaakt of de TBCT direct bij binnenkomst (zogenaamde ‘entry through the gantry’), of later gedurende de opvang op de SEH wordt gemaakt.
PICO 1:
P (Patiënten): volwassen patiënten (≥18 jaar) met potentieel meervoudig letsel of levensbedreigend letsel;
I (Interventie): routinematige TBCT;
C (Comparison):standaard initieel conventioneel radiologisch onderzoek bestaande uit X-thorax, X-bekken en e-FAST met eventueel aanvullende CT van een deelgebied op indicatie;
R (Reference): klinische follow-up;
O (Outcomes): mortaliteit, evaluatietijd (tijd op de spoedeisende hulp, tijd tot diagnose), ziekenhuis verblijfsduur, IC opname duur, stralingsbelasting, kosten, morbiditeit, kwaliteit van leven, gemiste letsels, incidentele bevindingen.
Relevante uitkomstmaten
De werkgroep achtte mortaliteit een voor de besluitvorming cruciale uitkomstmaat; en evaluatietijd (tijd op de spoedeisende hulp, tijd tot diagnose), ziekenhuis verblijfsduur, IC opname duur, stralingsbelasting, kosten, morbiditeit, kwaliteit van leven, en gemiste letsels, incidentele bevindingen voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren
In de database Medline (via OVID) is op 17 augustus 2017 met relevante zoektermen gezocht naar systematische reviews en RCT’s. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 74 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- De studiepopulatie bestaat (hoofdzakelijk) uit volwassen patiënten met potentieel meervoudig letsel of levensbedreigend letsel.
- Het gaat over initiële radiodiagnostiek bij de opvang.
- Betreft richtlijn, systematische review of primair (origineel) onderzoek.
- Er is sprake van een vergelijking tussen TBCT versus standaard initieel radiologisch onderzoek en/of CT op indicatie.
- Uitkomstmaten komen overeen met gekozen uitkomstmaten.
Op basis van titel en abstract werden in eerste instantie 17 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 13 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 4 studies definitief geselecteerd. Deze vier publicaties bestonden uit drie systematische reviews (Chidambaram, 2017; Hajibandeh, 2016; Surendran, 2014) en één originele studie die werd gepubliceerd na de zoekactie van Chidambaram (2017) (Treskes, 2017). In totaal werden twaalf orginele studies geselecteerd voor het beantwoorden van de zoekvraag (Weninger, 2007; Huber-Wagner, 2009; Wurmb, 2010; Hutter 2011; Yeguiyan, 2012; Hsiao, 2013; Huber-Wagner 2013; Kimura, 2013; Wada, 2013; Sierink, 2014; Sierink, 2016, Treskes, 2017).
Data-extractie en -analyse
De belangrijkste studiekarakteristieken en resultaten werden geëxtraheerd uit de studies in de systematische review van Chidambaram (2017) of de originele studies (bijvoorbeeld bij ontbrekende informatie in de review of het ontbreken van de studie in de review). De informatie werd verwerkt in de evidencetabellen. De beoordeling van de individuele studieopzet (risk-of-bias) is opgenomen in de risk-of bias-tabellen.
Relevante gepoolde en eventueel gestandaardiseerde effectmaten werden berekend met Review Manager 5.3 (Cochrane Collaboration, Oxford, United Kingdom) indien zinvol. Wanneer samenvatten niet mogelijk bleek, werden de uitkomsten en resultaten van de statistische toetsing gerapporteerd zoals beschreven door de auteurs van de betreffende publicatie.
De werkgroep definieerde voor geen van de uitkomstmaten klinische (patiënt) relevante verschillen. We hanteerden daarom, indien van toepassing, de onderstaande grenzen voor klinische relevantie voor continue uitkomstmaten en vergeleken de resultaten met deze grenzen: RR <0,75 of >1,25) (GRADE recommendation) of Standardized mean difference (SMD=0,2 (klein); SMD=0,5 (matig); SMD=0,8 (groot). De interpretatie van dichotome uitkomstmaten is sterk context gebonden en hiervoor werden a priori geen grenzen voor klinische relevante benoemd. Voor dichotome uitkomstmaten werd het absolute effect berekend (Number Needed to Treat; NNT).
Referenties
- Asha S, Curtis KA, Grant N, Taylor C, Lo S, Smart R, Compagnoni K. Comparison of radiation exposure of trauma patients from diagnostic radiology procedures before and after the introduction of a panscan protocol. Emerg Med Australas. 2012;24(1):43Y51.
- Chidambaram S, Goh EL, Khan MA. A meta-analysis of the efficacy of whole-body computed tomography imaging in the management of trauma and injury. Injury. 2017;48(8):1784-93.
- Sierink JC, Treskes K, Edwards MJ, Beuker BJ, et al. Immediate total-body CT scanning versus conventional imaging and selective CT scanning in patients with severe trauma (REACT-2): a randomised controlled trial. Lancet. 2016 Aug 13;388(10045):673-83. doi: 10.1016/S0140-6736(16)30932-1. Epub 2016 Jun 28.
- Surendran A, Mori A, Varma DK, Gruen RL. Systematic review of the benefits and harms of whole-body computed tomography in the early management of multitrauma patients: are we getting the whole picture? The Journal of Trauma and Acute Care Surgery. 2014;76(4):1122-30.
- Treskes K, Bos SA, Beenen LFM, Sierink JC, et al. High rates of clinically relevant incidental findings by total-body CT scanning in trauma patients; results of the REACT-2 trial. Eur Radiol. 2017 Jun;27(6):2451-2462. doi: 10.1007/s00330-016-4598-6. Epub 2016 Oct 5. Erratum in: Eur Radiol. 2017 Jun;27(6):2463.
- Treskes K, Saltzherr TP, Luitse JS, Beenen LF, Goslings JC. Indications for total-body computed tomography in blunt trauma patients: a systematic review. Eur J Trauma Emerg Surg. 2017;43(1):35-42.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: Wat is de effectiviteit van een initiële Total Body CT scan bij volwassen patiënten met potentieel meervoudig letsel vergeleken met ander initieel radiologisch onderzoek bestaande uit X-thorax, X-bekken en e-FAST of CT op indicatie?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Chidamba-ram, 2017
Study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of comparative cohort studies (5), non-randomized prospective studies (5) and RCTs (1).
Literature search up to September 15, 2016.
Study design: Comparative studies
Setting and Country: Hospital, UK
Source of funding: None
|
Inclusion criteria SR: - reporting of mortality rate, for any trauma (blunt, penetrating, or blast)
Exclusion criteria SR: - case series, case reports, narrative reviews, editorials, and conference abstracts; studies without comparison groups; studies with pediatric patients or less than five patients; and publications in a non-English language
11 studies included
Important patient characteristics at baseline: Predominantly blunt trauma patients.
N = 32,207 Newcastle- Ottawa Scale: 7/8
SI cohort had lower baseline Injury Severity Score (ISS) (better) in 10 of the studies. |
Describe intervention:
Whole body CT scanning for any trauma (blunt, penetrating, or blast) |
Describe control:
Selective imaging for any trauma (blunt, penetrating, or blast)
|
End-point of follow-up: Not reported
For how many participants were no complete outcome data available? (intervention/control) Not reported
|
Outcome measure-1 Overall mortality rate 11 studies, N=32,207 Pooled effect (random effects model): OR = 0.74 [95% CI 0.61 to 0.91] favoring WBCT Heterogeneity (I2): 83%
Outcome measure-2 24 h mortality rate 5 studies, N=20,206 OR = 0.72 [95% CI 0.66 to 0.79] favoring WBCT Heterogeneity (I2): 85%
Outcome measure-3 Time spent in the emergency room (ER) 3 studies, N=5,912 Mean diff = -14.81 [95% CI -17.02 to -12.60] favoring WBCT Heterogeneity (I2): 99%
Outcome measure-4 Time spent in the intensive care unit (ICU) 4 studies, N=22,631 Mean diff = 1,97 [95% CI -1,59 to -2,34] favoring Selective imaging Heterogeneity (I2): 91%
Outcome measure-5 Time spent in the hospital (3 studies, N=21,710) Mean diff = 1,03 [95% CI 0.25 to 1.81] favoring Selective imaging Heterogeneity (I2): 72%
|
This analysis concludes a statistically significant reduction in the overall and 24-h mortality rate with routine use of WBCT compared to SI.
Patients receiving WBTC spent shorter time in the ER by approx. 15 minutes. Patients receiving SI had a shorter duration of stay in the ICU (approx. 2 days) and correspondingly, the hospital (approx. 1 day).
The proportion of patients with AIS>3 was greater in the WBCT arm, suggesting an increased risk of mortality in this group of patients.
The use of SI was preferred to WBCT in patients with head injuries, which may reflect the tailored use of the different imaging protocols.
In patients with injuries of the thorax, abdomen and extremities, the use of WBCT allowed for a more thorough evaluation of the injuries and hence resulted in a lower overall and 24 h mortality.
Only one RCT has been conducted in this field of trauma to date, which was included in the analysis. The remaining studies display considerable heterogeneity, with numerous bias and confounding factors.
|
|
Surendran, 2014
One relevant study: Asha et al., 2012 |
SR and meta-analysis of randomized and nonrandomized comparative studies.
Literature search up to October 31, 2013
Study design: Comparative studies
Setting and Country: Research insitute, Australia
Source of funding: None stated
|
Inclusion criteria SR: - English-language studies - comparing WBCT imaging of blunt trauma patients with a control group - Control group: conventional radiography, FAST, and selective CT.
Exclusion criteria SR: Studies without comparison groups, case series, case reports, narrative reviews, editorials, conference abstracts, and publications in a language other than English.
8 studies included
Important patient characteristics at baseline: Predominantly blunt trauma patients.
N = 32,207 Newcastle- Ottawa Scale: 7/8
Injury Severity Score (ISS) was higher in the WBCT group in four studies. |
Describe intervention:
Whole body CT scanning for blunt trauma patients |
Describe control:
Conventional radiography, FAST, and selective CT for blunt trauma patients
|
End-point of follow-up: Not reported
For how many participants were no complete outcome data available? (intervention/control) Not reported
|
Outcome measure-1 Radiation exposure > 20 mSv, % patients 1 studies, N=1,280 I: 19.6 (95% CI, 16.6 to 22.7) C: 11.6 (95% CI, 9.1 to 14.1)
Outcome measure-2 Missed injuries 1 study, N=1,280 I: 0.6% (95% CI, 0.0 to 1.2) C: 0.9% (95% CI, 0.2 to1.5), n.s.
|
At an institutional level, the more advanced and more recently built trauma centers are more likely to have a CT scanner located very close to the trauma bays, and a lower threshold may exist for scanning unstable patients. If these centers also provide higher quality of trauma care, lower mortality in these centers, compared with other centers, may be caused by better care overall than as a consequence of WBCT scanning specifically. |
Research question: Wat is de effectiviteit van een initiële Total Body CT scan bij volwassen patiënten met potentieel meervoudig letsel vergeleken met ander initieel radiologisch onderzoek bestaande uit X-thorax, X-bekken en e-FAST of CT op indicatie?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Treskes, 2017 (REACT-2) |
Type of study: RCT
Setting: Multicentre
Country: Netherlands
Source of funding: ZonMw, the Netherlands Organisation for Health Research and Development (grant number: 171102023) |
Inclusion criteria:
Patients with a clinical suspicion of
Patients with one of the following injury mechanisms:
Exclusion criteria:
N total at baseline: 1,083 Intervention: 541 Control: 542
Important prognostic factors2: Age: I: 42 years (IQR27–59) C: 45 years (IQR 26–59)
ISS: I: 20 (IQR 10–29) C: 19 (IQR 9–29), p = 0.405
Blunt trauma: I: 98% C: 98.5%
Groups comparable at baseline. |
Describe intervention (treatment/procedure/test):
Total-body CT scanning
|
Describe control (treatment/procedure/test):
Standard work-up (x-rays of the chest and pelvis, a focused assessment with sonography for trauma (FAST), and CT scans from specific body regions if indicated. Indications for selective CT scanning were predefined according to local protocols) |
Length of follow-up: Between 6 months and 2 years after the first trauma presentation, and only within the in-hospital documentation of the trauma centres.
Loss-to-follow-up: Intervention: n.a. N (%) Reasons (describe)
Control: n.a. N (%) Reasons (describe)
Incomplete outcome data: Intervention: n.a. N (%) Reasons (describe)
Control: n.a. N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Number of incidental findings: I: 441 in 233 patients C: 290 in 167 patients Adjusted rate ratio 1.53; 95%CI 1.27 to 1.84; p < 0.001.
|
TBCT imaging is more likely to detect an incidental finding than the standard work-up with selective CT scanning.
Incidental findings occurred in 43% of patients undergoing TBCT scanning, of which 42 % could cause serious morbidity.
|
|
Sierink, 2016 (REACT-2) |
Type of study: RCT
Setting: Multicentre
Country: Netherlands
Source of funding: ZonMw, the Netherlands Organisation for Health Research and Development (grant number: 171102023) |
Inclusion criteria: See Treskes, 2017
Exclusion criteria: See Treskes, 2017
N total at baseline: 1,083 Intervention: 541 Control: 542
Important prognostic factors2: Age: I: 42 years (IQR27–59) C: 45 years (IQR 26–59)
ISS: I: 20 (IQR 10–29) C: 19 (IQR 9–29), p = 0.405
Blunt trauma: I: 98% C: 98.5%
Groups comparable at baseline.
|
Describe intervention (treatment/procedure/test):
Total-body CT scanning
|
Describe control (treatment/procedure/test):
Standard work-up (x-rays of the chest and pelvis, a focused assessment with sonography for trauma (FAST), and CT scans from specific body regions if indicated. Indications for selective CT scanning were predefined according to local protocols) |
Length of follow-up: Between 6 months and 2 years after the first trauma presentation, and only within the in-hospital documentation of the trauma centres.
Loss-to-follow-up: Intervention: n.a. N (%) Reasons (describe)
Control: n.a. N (%) Reasons (describe)
Incomplete outcome data: Intervention: n.a. N (%) Reasons (describe)
Control: n.a. N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Radiation exposure (sum of all effective doses from all radiological imaging strategies) I: 20.9 mSv (IQR 20.6-20.9) C: 20.6 mSv (IQR 9.9-22.1), p< 0·0001
Hospital costs I: €24 967 (95% CI 21 880–28 752) C: €26 995 (95% CI 23 326–30 908), p=0.44
Time to diagnosis I: median 50 min (IQR 38-68) C: median 58 min (IQR 42-78), p=0.001 |
The radiation dose was increased in patients in the total-body CT group, and substantially more patients in the standard work-up group received a lower radiation dose.
Although severely injured patients can be expected to benefi t most from the rapid and detailed overview provided by a total-body CT scan, the differences between the two randomised groups might be reduced because of the high number of patients with less severe injuries.
|
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Chidambaram, 2017 |
Yes |
Yes |
Yes |
Yes |
Unclear |
Yes |
Yes |
Yes |
Yes |
Notes:
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (en dergelijke Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (en dergelijke, funnel plot, other available tests) and/or statistical tests (en dergelijke, Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk-of-bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Treskes, 2017 |
The randomization process was performed by the trauma team immediately after the primary assessment of the patient. |
Unlikely |
Likely Neither doctors nor patients were masked to treatment allocation. |
Likely Neither doctors nor patients were masked to treatment allocation. |
Likely |
Unlikely |
Unclear |
Unlikely |
|
Sierink, 2016 |
Patients were randomly assigned (1:1) by trained trauma leaders, stratified by centre, to either immediate total-body CT scanning without previous conventional imaging or to the standard workup, with ALEA randomisation software available at an iPad or desktop PC in the trauma room.
|
Unlikely |
Likely nor patients were masked to treatment allocation. |
Likely Neither doctors nor patients were masked to treatment allocation. |
Likely |
Unlikely |
Unclear |
Unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Exclusietabel
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Treskes, 2017 |
Geen vergelijking TBCT, maar een overview van 'indications for WBTC |
|
Hajibandeh, 2016 |
Chidambaram 2017 is recenter |
|
Gunn, 2015 |
Chidambaram 2017 is recenter |
|
Surendran, 2014 |
Chidambaram 2017 is recenter |
|
Jiang, 2014 |
Chidambaram 2017 is recenter |
|
Healy, 2014 |
Chidambaram 2017 is recenter |
|
Caputo, 2014 |
Chidambaram 2017 is recenter |
|
Sierink, 2012 |
Chidambaram 2017 is recenter |
|
Long, 2017 |
Geen originele studie of SR |
|
Topp, 2015 |
Controle komt niet overeen ('conventional radiographs') |
|
Sierink, 2014 |
Included in Chidambaram, 2017 (case-control study) |
|
Huber-Wagner, 2013 |
Included in Chidambaram, 2017 |
|
Hutter, 2011 |
Included in Chidambaram, 2017 |
|
Huber-Wagner, 2009 |
Included in Chidambaram, 2017 |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 28-10-2019
Beoordeeld op geldigheid : 10-07-2019
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Total-body CT |
NVvR |
2019 |
2024 |
eens per 5 jaar |
NVvR |
- |
Voor het beoordelen van de actualiteit van deze richtlijn wordt de werkgroep niet in stand gehouden. Uiterlijk in 2024 (publicatiedatum plus vijf jaar) bepaalt het bestuur van de Nederlandse Vereniging voor Radiologie (NVvR) of de modules van deze richtlijn nog actueel zijn en of er eventueel nieuwe modules toegevoegd moeten worden. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding geven een herzieningstraject te starten.
De NVvR is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Deze richtlijn beoogt het beleid ten aanzien van initiële radiologische diagnostiek bij de opvang van traumapatiënten te optimaliseren en te uniformeren. Het is van essentieel belang dat er duidelijkheid ontstaat over de indicatie voor en wijze van beeldvorming bij de opvang van traumapatiënten.
Doelgroep
De richtlijn beperkt zich tot de initiële radiologische diagnostiek bij volwassen patiënten met potentieel meervoudig letsel. Met initieel wordt bedoeld de diagnostiek die verricht wordt na triage en tijdens de opvang van patiënten op de spoedeisende hulp.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met potentieel meervoudig letsel te maken hebben (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep:
- drs. M.J. (Maeke) Scheerder, radioloog, Amsterdam UMC Locatie AMC, Amsterdam, NVvR (voorzitter)
- drs. L.F.M. (Ludo) Beenen, radioloog, Amsterdam UMC Locatie AMC, Amsterdam, NVvR (vice-voorzitter)
- dr. E.F.W. (Ewout) Courrech Staal, radioloog, Maasstad Ziekenhuis, Rotterdam, NVvR
- dr. J. (Jaap) Deunk, traumachirurg, Amsterdam UMC Locatie VUmc, NVvH
- drs. P.J.A.C. (Perjan) Dirven, anesthesioloog, Erasmus MC, Rotterdam, NVA
- drs. H.H. (Erik) Dol, SEH-arts KNMG, Jeroen Bosch Ziekenhuis, ’s-Hertogenbosch, NVSHA
- dr. I. (Iain) Haitsma, neurochirurg, Erasmus MC Rotterdam / Albert Schweitzer ziekenhuis, NVvN
- dr. C. (Christiaan) van der Leij, interventieradioloog, Maastricht UMC+, Maastricht, NVvR/NVIR
- prof. dr. J. (Joukje) van der Naalt, neuroloog, UMCG, Groningen, NVN
- drs. ing. D.P.H. (Dirk) van Oostveen, orthopedisch chirurg, Jeroen Bosch Ziekenhuis, ’s-Hertogenbosch, NOV
Met ondersteuning van:
- dr. J.S. (Julitta) Boschman, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- dr. W.J. (Wouter) Harmsen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- dr. N.H.J. (Natasja) van Veen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- D.P. Gutierrez, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Scheerder |
Radioloog |
Geen |
Geen (1/5/2017) Update 14/11/2018 |
niet van toepassing |
|
Beenen |
Radioloog |
Geen |
Geen (15/5/2017) Update 14/11/2018 |
niet van toepassing |
|
Courrech Staal |
Radioloog |
Geen |
Geen (15/3/2017) Update 14/11/2018 |
niet van toepassing |
|
Deunk |
Traumachirurg |
- Tafel- instructeur/ Faculty AO basiscursus, AO Nederland (vergoeding) -Instructeur ATLS (vergoeding) |
Geen (23/2/2017) Update 14/11/2018 |
niet van toepassing |
|
Dirven |
- Anesthesioloog - H-MMT arts - Vliegerarts |
Instructeur ATLS (vergoeding) - Instructeur e-FAST (vergoeding) - Instructeur ALS (vergoeding) - Instructeur BATLS (geen vergoeding) - AE consulent CLSk (geen vergoeding) |
Geen (26/4/2017) Update 14/11/2018 |
Geen |
|
Dol |
SEH arts KNMG |
-Instructeur ATLS (vergoeding) |
Geen (26/4/2017) Update 14/11/2018 |
Geen |
|
Haitsma |
Neurochirurg |
Geen |
Geen 11-4-2019 |
niet van toepassing |
|
van der Leij |
Interventieradioloog |
Secretaris NVIR |
Geen (12/7/2017) Update 14/11/2018 |
niet van toepassing |
|
van der Naalt |
Neuroloog |
Geen |
Geen (25/4/2017) Update 14/11/2018 |
niet van toepassing |
|
van Oostveen |
Orthopedisch chirurg |
Geen |
Geen (27/9/2017) Update 14/11/2018 |
niet van toepassing |
Inbreng patiëntenperspectief
Patiëntenfederatie Nederland zag geen rol voor hen of andere patiëntverenigingen weggelegd bij de ontwikkeling van deze richtlijn. Tijdens de oriënterende zoekactie werd gezocht op literatuur naar patiëntenperspectief (‘patient journeys’), maar er werd geen relevante literatuur gevonden.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft geen interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. De werkgroep identificeerde geen substantiële barrières die implementatie van de aanbevelingen zouden kunnen bemoeilijken.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door partijen via een invitational conference. Een verslag hiervan en de reacties op dit verslag zijn opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen (NICE), systematische reviews (Medline), en literatuur over patiëntenvoorkeuren en patiëntrelevante uitkomstmaten (patiëntenperspectief; Medline). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’.
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die een randvoorwaarde zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. PubMed PMID: 20603348.
Hultcrantz M, Rind D, Akl EA, et al. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017;87:4-13. PubMed PMID: 28529184.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. Erratum in: BMJ. 2008;336(7654). PubMed PMID: 18483053.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
|
] |
Zoektermen |
Totaal |
|
Medline (OVID) 1946 – augustus 2017
|
1 exp Whole Body Imaging/ or ((((whole or full or total) adj2 body) and (CT or tomograph*)) or (fbct or tbct)).ti,ab. (11432) 2 exp Multiple Trauma/ or exp "wounds and injuries"/ or exp amputation, traumatic/ or ((critical or sever* or multiple or multi* or poly*) adj3 (trauma* or fracture* or injur* or wound*)).ti,ab,kf. or polytrauma*.ti,ab,kf. or Intra-thoracic Injur*.ti,ab,kf. (872211) 3 intensive care units/ or Critical Care/ or exp Emergency Medical Services/ (199253) 4 ("intensive care" or "Critical Care" or Emergenc* or "trauma cent*").ti,ab,kf. (442399) 5 2 or 3 or 4 (1330571) 6 1 and 5 (743) 7 limit 6 to english language (652) 8 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (339397) 9 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1766661) 10 7 and 8 (24) 11 7 and 9 (64) 12 10 or 11 (84)
= 84 (74 uniek) |
74 |
