Dieet
Uitgangsvraag
Welk dieet is effectief voor inductie en behoud van remissie bij inflammatoire darmziekten?
Aanbeveling
Er is vooralsnog geen bewijs om een specifiek dieet aan te bevelen.
Verwijs een patiënt die aanpassingen in de voeding overweegt naar een diëtist, om een volwaardige voeding te waarborgen en deficiënties te voorkomen
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De studies die hebben gekeken naar de verschillende dieetbehandelingen hebben een relatief kleine studiepopulatie en vergelijken verschillende soorten diëten. Voornamelijk klinische uitkomstmaten zijn gebruikt als uitkomstmaat. De bewijskracht van de literatuur is beoordeeld als laag tot zeer laag.
Daarnaast spelen er ook nog mogelijke risico’s bij deze specifieke diëten. Zo is er bij stenoserende ziekte voorzichtigheid geboden bij het adviseren van een vezelrijk dieet. Een potentieel risico bij een symptoom-gestuurd dieet is dat patiënten onnodig (lang) voedingsmiddelen gaan mijden waardoor een onvolwaardig dieet ontstaat. Dit dieet zal dan ook onder begeleiding van een diëtist moeten geschieden. Een dieet met laag calciumgehalte draagt bij aan het verhoogde risico op osteoporose (ADH ± 1000 mg/dag). Vermijden van rood vlees kan resulteren tot een lagere ijzer en vitamine B12 consumptie doordat rood vlees relatief veel ijzer en vitamine B12 bevat. Tenslotte bevat een glutenvrij dieet vaak minder vezels en hogere hoeveelheden arseen en zout. Het is dus van belang dat patiënten met IBD door een diëtist begeleid worden, om eventuele voor- en nadelen samen af te wegen.
De systematische review die is opgenomen in de literatuursamenvatting heeft niet gezocht op Crohn’s exclusie dieet en exclusieve enterale voeding, terwijl dit mogelijk wel relevante diëten zijn. De informatie over exclusieve enterale voeding is afkomstig uit de Nederlandse dieetbehandelingsrichtlijn.
Crohn’s exclusie dieet
Studies waarbij (deels) enterale voeding werd onderzocht, werden niet meegenomen in de Cochrane studie van Limketkai (2019). Toch is er de laatste jaren meer aandacht voor het Crohn’s exclusie dieet (CDED). Het CDED laat mogelijk verbetering zien in het bereiken van klinische remissie. Deze studies zijn met name gericht op kinderen. In 2017 heeft Sigall Boneh (2017) het CDED dieet, in combinatie met gedeeltelijke enterale voeding, bestudeerd bij kinderen (n=10) en volwassenen (n=11) die niet meer reageerden op biologicals. De helft van de volwassen patiënten kwamen in remissie door deze behandeling na een interventieperiode van 12 weken. Diverse studies lopen nog, waarvan de resultaten de komende jaren verwacht worden.
Exclusieve enterale voeding
Invloed op induceren van remissie bij IBD
Daarnaast wordt ook exclusieve enterale voeding (exclusive enteral nutrition (EEN)) gehanteerd als inductietherapie. Bij kinderen met actieve ziekte van Crohn wordt EEN, in de vorm van volledige drinkvoeding of sondevoeding (zonder vezels), toegepast als inductietherapie voor het verkrijgen van remissie (Narula, 2018). EEN wordt als eerste keus behandeling gebruikt voor het induceren van remissie, onafhankelijk van de ernst van ziekte. De behandeling middels EEN is even effectief als de behandeling met behulp van corticosteroïden (Narula, 2018). Bij volwassenen is er minder bewijs dan bij kinderen. In de Cochrane review van 2018 (Narula, 2018) is gekeken naar de effectiviteit van sondevoeding versus corticosteroïden op het verkrijgen van remissie bij actieve ziekte van Crohn. Ook is gekeken naar verschillen in remissie ratio bij het gebruik van verschillende soorten sondevoeding.
Er werden zes onderzoeken geïncludeerd in de meta-analyse naar de effectiviteit van
sondevoeding versus corticosteroïden naar het verkrijgen van remissie bij actieve ziekte
van Crohn. In zowel de voedingstherapie (45%) als in de corticosteroïden (73%) groep
werd remissie bereikt. Echter bereikte significant meer patiënten met corticosteroïden
remissie (RR 0,65; 95%BI 0,52 tot 0,82). De soort voeding (elementair, semi-elementair, polymeer, energie- en eiwitverrijkte voedingen, hoog versus laag energiepercentage vet etc.) heeft geen invloed op de effectiviteit van EEN op het bereiken van remissie (Narula, 2018). (Exclusief gebruik van) drinkvoeding en/of sondevoeding (conform EEN therapie bij kinderen) kan als alternatief overwogen worden wanneer andere behandelingen een contra-indicatie zijn of wanneer er resistentie tegen andere therapieën optreedt bij de ziekte van Crohn.
Er is onvoldoende bewijs dat rust van de darm middels volledige drinkvoeding of sondevoeding een effectieve therapie is bij patiënten met colitis ulcerosa voor het
induceren van remissie (Mowat, 2011; Nguyen, 2016).
Invloed op behoud van remissie bij de ziekte van Crohn
De review van Akobeng vergelijkt 4 studies met elkaar (Akobeng, 2018). In een studie van 33 personen werd een elementair dieet vergeleken met een polymere voeding. Na 12 maanden follow-up was er geen significant verschil in relapse tussen beide groepen. In een andere studie van 51 personen werd een gewone voeding vergeleken met een semi-elementaire voeding in combinatie met vrij dieet. Daarbij was de relapse ratio hoger in het vrije dieet. In een studie met 95 personen vergeleek men een elementaire voeding met een controle groep en een groep die mercaptopurine kreeg. Na 12 maanden follow-up was de relapse ratio hoger onder de patiënten met een elementair dieet. In de vierde studie werd een polymeer dieet vergeleken met het gebruik van mesalazine. Waarbij de relapse ratio hoger was na 12 maanden bij de patiënten die mesalazine ontvingen.
Conclusie is dat de uitkomsten die getoetst werden in deze review onzeker zijn en dat er geen harde conclusies getrokken kunnen worden over de effectiviteit van enterale voeding voor het behouden van remissie bij patiënten met de ziekte van Crohn. Dit wordt voornamelijk veroorzaakt door het verschil in interventies en ook de follow-up van de studies waren verschillend, waardoor resultaten niet goed vergeleken kunnen worden met elkaar.
De review van Nakahigashi (2016) vergelijkt zeven studies die het effect onderzochten van drink- of sondevoeding op het behoud van remissie. Een studie vergeleek het verschil tussen een elementaire voeding en een polymere voeding. Deze bleken even effectief in het behouden van remissie terwijl het gebruik van steroïden afgebouwd kon worden. De andere zes studies vergeleken een gewone voeding met enterale voeding. Uit vier van de zes studies bleek na een jaar dat het behoud van remissie in de groep met enterale voeding significant hoger was. Doordat de onderzochte groepen echter klein waren is het niet mogelijk om hieruit conclusies te trekken (Nakahigashi, 2016).
De conclusie luidt dat er op dit moment onvoldoende bewijs is om bij de ziekte van Crohn drink- of sondevoeding in remissie fase voor te schrijven met als doel behouden van remissie.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Ongeveer 40% van de patiënten denkt dat voeding een rol speelt bij het ontstaan van IBD en een groot deel van de patiënten denkt dat voeding een rol speelt in het ziektebeloop (Dijkhuizen, 2015; Limdi, 2016; Tomar, 2017 en de Vries, 2019). Ruim 60% van de patiënten krijgt meer klachten bij specifieke voedingsmiddelen en ruim 65% van de patiënten mijdt daarom voedingsmiddelen ter preventie van een opvlamming en/of om klachten te verminderen (Dijkhuizen, 2015; Limdi, 2016; Tomar, 2017; de Vries, 2019). Het aanpassen van het dieet gebeurt vaak op basis van eigen ervaring, ervaring van anderen, volgen van specifieke diëten met/zonder begeleiding van diëtist.
Patiënten met IBD hebben grote behoefte aan erkenning aan de behoefte om hun voeding aan te passen en willen hier graag in begeleid worden. Men zoekt naar succesvolle interventies. Evenals bij het gebruik van supplementen wordt het volgen van een dieet niet altijd met de zorgverlener besproken. Het is van belang in een gesprek aan te kaarten of de patiënt een specifiek dieet volgt, met het oog op een volwaardigheid van de voeding. Een diëtist kan hier zo nodig de patiënt handvatten voor geven.
Kosten (middelenbeslag)
Het onnodig en zonder begeleiding van een diëtist volgen van een dieet zou extra kosten met zich mee kunnen brengen doordat onnodig specifieke producten worden gebruikt. Begeleiding van de diëtist maakt onderdeel uit van de behandeling in de tweede en derde lijn en is in de eerste lijn opgenomen in de basisverzekering.
Aanvaardbaarheid, haalbaarheid en implementatie
Er worden geen problemen verwacht met de aanvaardbaarheid, haalbaarheid en implementatie van verschillende diëten.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Patiënten hebben behoefte om met dieet interventie klachten en/of ziekte beter onder controle te krijgen. Er is vooralsnog onvoldoende bewijs dat diverse diëten bijdragen aan klinisch behoud en inductie van remissie bij inflammatoire darmziekten. Begeleid patiënten bij hun zoektocht en bij het maken van overwegingen, zodat de volwaardigheid van de voeding niet in het geding komt. Verwijs hierbij laagdrempelig naar de diëtist.
Onderbouwing
Achtergrond
Darminhoud en de immunologische reactie daarop spelen een belangrijke rol in de hypotheses betreffende ontstaan en beloop van inflammatoire darmziekten (IBD), waardoor voeding in directe belangstelling staat, niet in de laatste plaats bij de patiënt. Spiermassa- en gewichtsverlies - als klinische manifestatie van eiwit- en energieondervoeding- komen frequent voor bij patiënten met IBD. Oorzaken liggen in verminderde voedselinname, verhoogde energiebehoefte ten gevolge van chronische ziekte en een soms incomplete vertering met klinisch relevante malabsorptie. Bij ernstige en uitgebreide slijmvliesulceraties in het kader van IBD kan ook eiwit- of calorieverlies optreden dat kan bijdragen aan een negatieve eiwit- dan wel energiebalans. In de klinische praktijk worden frequent adviezen gegeven aan patiënten met IBD over voeding(elementen), additieven of electieve diëten. Het is niet bekend welke dieet effectief is voor inductie en behoud van remissie bij IBD.
Conclusies / Summary of Findings
Inductie van remissie bij actieve ziekte van Crohn
|
Zeer laag GRADE |
De evidence is zeer onzeker over het effect van een vezelrijk en koolhydraatarm dieet op inductie van remissie, vergeleken met een controledieet bestaande uit specifieke en algemene instructies bij patienten met een actieve ziekte van Crohn.
De evidence is zeer onzeker over het effect van een microdeeltjes-arm dieet op inductie van remissie, vergeleken met een controledieet waarin microdeeltjes niet werden vermeden bij patiënten met een actieve ziekte van Crohn.
De evidence is zeer onzeker over het effect van een symptoom-gestuurd dieet op inductie van remissie, vergeleken met een controledieet bestaande uit conventioneel voedingsadvies bij patiënten met een actieve ziekte van Crohn.
De evidence is zeer onzeker over het effect van een zeer beperkt organisch dieet op inductie van remissie, vergeleken met een controledieet bestaande uit een vetarm, koolhydraatrijk dieet bij patiënten met een actieve ziekte van Crohn.
De evidence is zeer onzeker over het effect van een calciumarm dieet (400 mg/dag) op inductie van remissie, vergeleken met een controledieet bestaande uit een dieet met een laag calciumgehalte en een laag gehalte aan microdeeltjes bij patiënten met een actieve ziekte van Crohn.
Bronnen: Bartel, 2008; Brotherton, 2014; Dariel, 2007; Lomer, 2001; Lomer, 2005. |
Inductie van remissie bij actieve colitis ulcerosa
|
Zeer laag GRADE |
De evidence is zeer onzeker over het effect van een symptoom-gestuurd dieet op inductie van remissie, vergeleken met een controledieet waarin geen wijziging van het gebruikelijke dieet plaatsvond bij patiënten met actieve colitis ulcerosa.
Bronnen: Candy, 1995 |
Behoud van remissie bij inactieve ziekte van Crohn (klinische terugval)
|
Zeer laag GRADE |
De evidence is zeer onzeker over het effect van een koolhydraatarm dieet op behoud van remissie, vergeleken met een controledieet bestaande uit een koolhydraatrijk dieet of een dieet met koolhydraten in geraffineerde vorm bij patiënten met een inactieve ziekte van Crohn.
De evidence is zeer onzeker over het effect van een dieet met weinig rood vlees op behoud van remissie, vergeleken met een controledieet met minimaal twee porties rood of verwerkt vlees per week bij patiënten met een inactieve ziekte van Crohn.
De evidence is zeer onzeker over het effect van een dieet met disachariden, granen, verzadigde vetten, rode en verwerkte vleeswaren of een FOS-supplement in combinatie met een placebo dieet op behoud van remissie, vergeleken met een controledieet bestaande uit een placebodieet en een placebosupplement bij patiënten met een inactieve ziekte van Crohn.
Bronnen: Albenberg 2018; Brandes 1981; Jones 1985; Lorenz-Meyer 1996; Mutlu 2016; Riordan 1993; Ritchie 1987. |
|
Laag GRADE |
Een symptoom-gestuurd dieet lijkt nauwelijks te resulteren in een verschil in behoud van remissie, vergeleken met een controledieet bestaande uit een ongezuiverd koolhydraatvezelrijk dieet en algemeen voedingsadvies van een diëtist bij patiënten met een inactieve ziekte van Crohn.
Bronnen: Jones 1985; Riordan 1993. |
Behoud van remissie bij inactieve colitis ulcerosa (klinische terugval)
|
Zeer laag GRADE |
De evidence is zeer onzeker over het effect van een anti-inflammatoir dieet op behoud van remissie, vergeleken met een controledieet gebaseerd op de Canadese Voedselgids bij patiënten met inactieve colitis ulcerosa.
De evidence is zeer onzeker over het effect van een carrageenvrij dieet op behoud van remissie, vergeleken met een controledieet bestaande uit een carrageenvrij dieet in combinatie met één carrageenrijke capsule van 100 milligram per dag bij patiënten met inactieve colitis ulcerosa.
Bronnen: Bhattacharyya, 2017; Keshteli, 2016 |
|
Laag GRADE |
Een melkvrij dieet of glutenvrij plus melkvrij dieet lijkt nauwelijks te resulteren in een verschil in behoud van remissie, vergeleken met een controledieet bestaande uit gebruikelijke voeding of een dieet waarin verscheidene producten werden uitgesloten bij patiënten met inactieve colitis ulcerosa.
Bronnen: Strisciuglio, 2013; Wright, 1965 |
Samenvatting literatuur
De Cochrane review van Limketkai (2019) is gebruikt voor de synthese van de literatuur. Limketkai (2019) evalueerde het effect en de veiligheid van verschillende dieetinterventies op inductie en behoud van remissie bij inflammatoire darmziekten (IBD). Limketkai (2019) zocht in de elektronische Embase (Ovid), MEDLINE (Ovid) en Web of Science databases, de CENTRAL database, de Cochrane IBD Group Specialized Trials Register (31 Januari 2019), referentielijsten van geïncludeerde artikelen en bestaande relevante reviews. Limketkai (2019) zocht daarnaast naar ontwikkelingen in de Digestive Disease Week, de Inflammatory Bowel Disease, Clinical Nutrition Week, European Crohn’s and Colitis Organisation, en de United European Gastroenterology Week (allen van 2005 tot 31 januari 2019). Daarnaast werd ook gezocht naar geregistreerde, lopende onderzoeken in de ClinicalTrials.gov en WHO International Clinical Trials Registry Platform Portal bekeken. Limketkai (2019) includeerde gerandomiseerde gecontroleerde onderzoeken (RCT’s). In totaal werden 18 RCT’s bestaand uit 1878 patiënten geïncludeerd (Albenberg, 2018; Bartel, 2008; Bhattacharyya, 2017; Brandes, 1981; Brotherton, 2014; Candy, 1995; Dariel, 2007; Jones, 1985; Keshteli, 2016; Levenstein, 1985; Lomer, 2001; Lomer, 2005; Lorenz-Meyer, 1996; Mutlu, 2016; Riordan, 1993; Ritchie, 1987; Strisciuglio, 2013; Wright, 1965). De studiegrootte van deze 18 studies varieerde van zeven tot 659 patiënten per studie. Op twee studies na (Aldenberg, 2018) Wright, 1965) werd in alle studies de gemiddelde leeftijd gerapporteerd. De gemiddelde leeftijd varieerde in 12 studies tussen een gemiddelde van 11,2 jaar tot 48 jaar. De overige studies rapporteerden de mediaan (Candy, 1995) of een range (Bhattacharyya, 2017; Jones 1985; Ritchie 1987). In twee studies (Bartel, 2008; Dariel, 2007) werd de ernst van de ziekte gerapporteerd als mild of mild tot matig. Geen van de andere studies rapporteerde de ernst van de ziekte. Zes studies vergeleken verschillende interventiediëten met een controledieet bij patiënten met actieve ziekte van Crohn (Bartel, 2008; Brotherton, 2014; Dariel, 2007; Levenstein, 1985; Lomer 2001; Lomer 2005). Zeven studies vergeleken verschillende interventiediëten met een controledieet bij patiënten met een inactieve ziekte van Crohn (Aldenberg, 2018; Brandes, 1981; Jones, 1985; Lorenz-Meyer, 1996; Mutlu, 2016; Riordan, 1993; Ritchie, 1987). Één studie vergeleek een interventiedieet met een controledieet bij patiënten met actieve colitis ulcerosa (Candy, 1995) en vier studies vergeleken verschillende interventiediëten met en controledieet bij patiënten met inactieve colitis ulcerosa. De interventiediëten bestonden uit een vezelrijk en koolhydraatarm dieet, microdeeltjes-arm dieet, symptoom-gestuurd dieet, zeer beperkt organisch dieet, calciumarm dieet, koolhydraatarm dieet, een dieet met weinig rood vlees, een dieet met lage disachariden, granen, verzadigde vetten, rode en verwerkte vleeswaren, een anti-inflammatoir dieet, een carrageenvrij dieet of een melkvrij dieet. De follow-up periode van de geïncludeerde studies varieerde van twee weken tot 24 maanden. Studies met een ander design dan beschreven, gemixte populatie, andere interventies dan beschreven of vanwege gebrek aan respons van de auteurs werden geëxcludeerd. Limketkai (2019) zocht naar evidentie tot 31 januari 2019. De volgende uitkomstmaten werden beschreven: inductie van remissie en behoud van remissie.
Resultaten
Inductie van remissie bij actieve ziekte van Crohn
Limketkai (2019) includeerde vijf studies waarin inductie van remissie werd onderzocht bij een actieve ziekte van Crohn (Bartel, 2008; Brotherton, 2014; Dariel, 2007; Lomer, 2001; Lomer, 2005) (zie figuur 1).
Eén studie (Brotherton, 2014) rapporteerde de risk ratio tussen een vezelrijk en koolhydraatarm dieet versus een controledieet bestaande uit specifieke en algemene instructies die provocatie van klachten van de ziekte van Crohn kunnen controleren. Bij 4/4 patiënten (100%) met een vezelrijk en koolhydraatarm dieet werd inductie van remissie behaald na vier weken. Bij 0/3 patiënten (0%) in de controledieet groep werd inductie van remissie behaald na vier weken, RR 7,20 (95% BI 0,53 tot 97,83). Er werd een klinisch relevant verschil in inductie van remissie behaald bij een vezelrijk en koolhydraatarm dieet bij patiënten met actieve ziekte van Crohn na vier weken. Al werd na vier weken geen significant verschil in c-reactief proteïne (CRP) gevonden
Twee studies (Lomer, 2001; Lomer 2005) rapporteerden de risicoverhouding tussen een dieet beperkt in titanium dioxide en silicaten (microdeeltjes-arm dieet) versus een controledieet. Het controledieet in de studie van Lomer (2001) was gelijk aan het interventiedieet, behalve dat voedingsmiddelen met microdeeltjes niet werden vermeden. Het controledieet in de studie van Lomer (2005) bestond uit een dieet met een laag gehalte aan microdeeltjes. De gepoolde risk ratio (95%BI) voor inductie van remissie tussen een microdeeltjes-arm dieet en een controledieet is 3,13 (0,22 tot 43,84). Er werd een klinisch relevant verschil in inductie van remissie behaald bij een microdeeltjes-arm dieet bij patiënten met actieve ziekte van Crohn na 16 weken. Al werd geen significant verschil gevonden in CRP, bezinkingssnelheid (BSE) en fecaal calprotectine (FCP).
Eén studie (Dariel, 2007) rapporteerde de risk ratio tussen een symptoom-gestuurd dieet versus een controledieet. Het controledieet bestond uit een conventioneel voedingsadvies. Bij 16/32 patiënten (50%) met een symptoom-gestuurd dieet werd inductie van remissie behaald. Bij 0/19 patiënten (0%) in de controledieet groep werd inductie van remissie behaald (RR 20,00; 95%BI 1,27 tot 315,40). Er werd een klinisch relevant verschil in inductie van remissie behaald bij een symptoom-gestuurd dieet bij patiënten met actieve ziekte van Crohn (NB: in de studie wordt niet beschreven wanneer remissie werd gemeten).
Eén studie (Bartel, 2008) rapporteerde de risk ratio tussen een zeer beperkt organisch dieet versus een controledieet. Het controledieet bestond uit een vetarm, koolhydraatrijk dieet dat compleet was met betrekking tot de benodigde voedingsstoffen. Bij 4/8 patiënten (50%) met een zeer beperkt organisch dieet werd inductie van remissie behaald na zes weken. Bij 5/10 patiënten (50%) in de controledieet groep werd inductie van remissie behaald na zes weken (RR 1,00; 95%BI 0,39 tot 2,53). Er werd geen klinisch relevant verschil in inductie van remissie behaald bij een zeer beperkt organisch dieet bij patiënten met actieve ziekte van Crohn na zes weken. Tevens werd na 24 weken geen significant verschil gevonden in BSE, FCP en endoscopische verbetering na het volgen van het dieet.
Eén studie (Lomer, 2005) rapporteerde de risk ratio tussen een calciumarm dieet (400 mg/d + 400 mg suppletie) versus een controledieet . Het controledieet bestond uit een dieet met een laag calciumgehalte (400 mg/d + placebo suppletie). Bij 16/43 patiënten (37,2%) met een calciumarm dieet werd inductie van remissie behaald na 16 weken. Bij 12/40 patiënten (30%) in de controledieet groep werd inductie van remissie behaald na 16 weken (RR 1,24; 95%BI 0,67 tot 2,29). Er werd geen klinisch relevant verschil in inductie van remissie behaald bij een calciumarm dieet bij patiënten met actieve ziekte van Crohn na 16 weken. Tevens werd na 52 weken geen verschil gevonden in CRP, ESR en FCP.
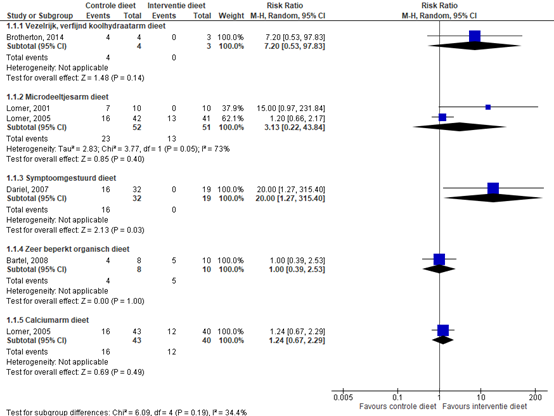
Figuur 1: forest plot met meta-analyse voor het verschil in inductie van remissie tussen interventiediëten en een controledieet bij actieve ziekte van Crohn.
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval.
Inductie van remissie bij actieve colitis ulcerosa
Limketkai (2019) includeerde één studie waarin inductie van remissie bij actieve colitis ulcerosa werd onderzocht (Candy, 1995).
Eén studie (Candy, 1995) rapporteerde de risk ratio tussen een symptoom-gestuurd dieet versus een controledieet. In het controledieet vond geen wijziging van het gebruikelijke dieet plaats. Alle geconsumeerde voedingsmiddelen en dranken werden geregistreerd. Bij 4/11 patiënten (36,6%) met een symptoom-gestuurd dieet werd inductie van remissie behaald. Bij 0/10 patiënten (0%) in de controledieet groep werd inductie van remissie behaald (RR 8,25; 95%BI 0,50 tot 136,33). Er werd een klinisch relevant verschil in inductie van remissie behaald bij een symptoom-gestuurd dieet bij patiënten met actieve colitis ulcerosa na zes weken. Er werd geen verschil gevonden in endoscopische en histologische verbetering.
Behoud van remissie bij inactieve ziekte van Crohn
Limketkai (2019) includeerde zeven studies waarin behoud van remissie bij inactieve ziekte van Crohn werd onderzocht (Albenberg 2018; Brandes 1981; Jones 1985; Lorenz-Meyer 1996; Mutlu 2016; Riordan 1993; Ritchie 1987) (zie figuur 2). Niet behouden van remissie werd onderverdeeld in klinische terugval, noodzaak tot opereren, escalatie van de therapie, opname als gevolg van ongunstige gebeurtenissen, surrogaat markers van de ontsteking en ziekteontwikkeling. Voor deze module is behoud van remissie gedefinieerd als geen klinische terugval.
Drie studies (Brandes, 1981; Lorenz-Meyer, 1996; Ritchie, 1987) rapporteerden de risicoverhouding tussen een koolhydraatarm dieet (al dan niet in combinatie met verum gelatinecapsules) versus een controledieet. De controlediëten bestonden uit een koolhydraatrijk dieet met relatieve vermindering van de eiwit- en vetopname (Brandes, 1981), placebo-capsules (Lorenz-Meyer, 1996) en een dieet met koolhydraten in geraffineerde vorm (bijv. wit meel en rijst) en het vermijden van ongeraffineerde koolhydraten (Ritchie, 1987). De gepoolde risk ratio (95%BI) voor een klinische terugval tussen een koolhydraatarm dieet en een controledieet is 1,04 (0,87 tot 1,25). Er werd geen klinisch relevant verschil in behoud van remissie behaald bij een koolhydraatarm dieet bij patiënten met inactieve ziekte van Crohn na 12 tot 24 maanden.
Twee studies (Jones, 1985; Riordan, 1993) rapporteerden de risicoverhouding tussen een symptoom-gestuurd dieet versus een controledieet. In de trial van Riordan (1993) werden patiënten met actieve ziekte van Crohn geïncludeerd. Zij ontvingen allen een elementair dieet. Alleen de patiënten die dit dieet voor 14 dagen wilden volgen én waarbij de ziekte in remissie was, werden vervolgens gerandomiseerd voor een symptoom-gestuurd dieet of een controledieet. De controlediëten bestonden uit een ongeraffineerd koolhydraatvezelrijk dieet (Jones, 1985) of 40 milligram Prednisolon per dag voor 12 weken en algemeen voedingsadvies van een diëtist (Riordan, 1993). De gepoolde RR (95%BI) voor een klinische terugval tussen een symptoom-gestuurd dieet en een controledieet is 0,53 (0,28 tot 1,01). Er werd geen klinisch relevant verschil in behoud van remissie behaald bij een symptoom-gestuurd dieet bij patiënten met inactieve ziekte van Crohn na zes tot 24 maanden. Tevens werd er geen significant verschil gevonden in CRP na 24 maanden (Riordan 1993) en BSE na 6-24 maanden (Riordan 1993; Jones 1985).
Eén studie (Aldenberg, 2018) rapporteerde de risk ratio tussen een dieet met weinig rood vlees versus een controledieet. Het controledieet bestond uit minimaal twee porties rood of verwerkt vlees per week gedurende 48 weken. Bij 63/96 patiënten (65,6%) met een dieet met weinig rood vlees vond een klinische terugval plaats. Bij 75/118 patiënten (63,6%) in de controledieet groep vond een klinische terugval plaats. De RR (95%BI) op een klinische terugval is 1,03 (0,85 tot 1,26). Er werd geen klinisch relevant verschil in behoud van remissie behaald bij een dieet met weinig rood vlees bij patiënten met inactieve ziekte van Crohn na 48 weken.
Een abstract van een studie (Mutlu, 2016) rapporteerde de risk ratio tussen een dieet met lage disachariden, granen, verzadigde vetten, rode en verwerkte vleeswaren of een fructo-oligosacchariden (FOS) supplement in combinatie met een placebo dieet versus een controledieet. Het controledieet bestond uit een placebodieet en een placebosupplement (niet verder gespecificeerd). Bij 0/16 patiënten (0%) met een dieet met lage disachariden, granen, verzadigde vetten, rode en verwerkte vleeswaren vond een klinische terugval plaats. Bij 10/38 patiënten (26,3%) met een controledieet vond een klinische terugval plaats. De RR (95%BI) op een klinische terugval is 0,11 (0,01 tot 1,76). Er werd een klinisch relevant verschil in behoud van remissie behaald bij een dieet met lage disachariden, granen, verzadigde vetten, rode en verwerkte vleeswaren of een FOS-supplement in combinatie met een placebo dieet bij patiënten met inactieve ziekte van Crohn na 12 maanden.
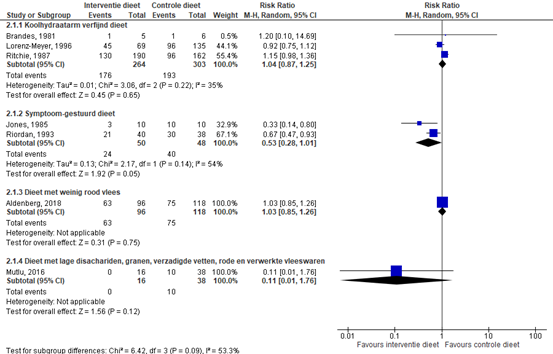
Figuur 2: forest plot met meta-analyse voor het verschil in behoud van remissie (alleen gebaseerd op klinische terugval) tussen interventiediëten en een controledieet bij inactieve ziekte van Crohn
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval.
Behoud van remissie bij inactieve colitis ulcerosa
Limketkai (2019) includeerde vier studies waarin behoud van remissie bij inactieve colitis ulcerosa werd onderzocht (Bhattacharyya, 2017; Keshteli, 2016; Strisciuglio, 2013; Wright, 1965). Voor de uitkomstmaat behoud van remissie werd gekeken naar klinische terugval en ontstekingsmarkers (FCP/BSE/CRP). Behoud van remissie is gedefinieerd als geen klinische terugval. Geen van de studies beschreef endoscopische remissie als uitkomstmaat.
Eén studie (Keshteli, 2016) rapporteerde de risk ratio tussen een anti-inflammatoir dieet versus een controledieet. Het controledieet bestond uit een dieet gebaseerd op de Canadese Voedselgids. Bij 5/14 patiënten (35,7%) met een anti-inflammatoir dieet vond een klinische terugval plaats. Bij 4/14 patiënten (28,6%) met een controledieet vond een klinische terugval plaats. De RR (95%BI) op een klinische terugval is 1,25 (0,42 tot 3,70). Er werd geen klinisch relevant verschil in behoud van remissie behaald bij een anti-inflammatoir dieet bij patiënten met inactieve colitis ulcerosa na zes maanden.
Eén studie (Bhattacharyya, 2017) rapporteerde de risk ratio tussen een carrageenvrij dieet versus een controledieet. Het controledieet bestond uit een carrageenvrij dieet in combinatie met één carrageenrijke capsules van 100 milligram per dag en een verhoogde inname tot twee capsules van 200 milligram per dag indien geconstateerd werd dat één capsule per dag verdragen werd. Bij 3/10 patiënten (30%) met een carrageenvrij dieet vond een klinische terugval plaats. Bij 3/5 patiënten (60%) met een controledieet vond een klinische terugval plaats. De RR (95%BI) op een klinische terugval is 0,50 (0,15 tot 1,64).
Er werd geen klinisch relevant verschil in behoud van remissie behaald bij een carrageenvrij dieet bij patiënten met inactieve colitis ulcerosa na 12 maanden. Tevens werd geen verschil in FCP gevonden na 12 maanden (Bhattacharyya 2017).
Twee studies (Strisciuglio, 2013; Wright, 1965) rapporteerden de risicoverhouding tussen een melkvrij dieet of een glutenvrij plus melkvrij dieet versus een controledieet. De controlediëten bestond uit gebruikelijke voeding (Strisciuglio, 2013) en een dieet waarin verscheidene producten werden uitgesloten, zoals gebakken voedsel, kruiden en ijs (Wright, 1965). De bestanddelen van deze levensmiddelen zijn opgenomen in de lijst van andere levensmiddelen die wel werden toegestaan. In het bijzonder werd de patiënten geadviseerd om melk en melkproducten vrij te consumeren (Wright, 1965). De gepoolde risk ratio (95%BI) voor een klinische terugval tussen een melkvrij dieet en een controledieet is 0,83 (0,60 tot 1,15). Er werd geen klinisch relevant verschil in behoud van remissie behaald bij een melkvrij dieet of een glutenvrij plus melkvrij dieet bij patiënten met inactieve colitis ulcerosa na 12 maanden. Tevens werd geen significant verschil gevonden in endoscopische en histologische verbetering na 12 maanden (Strisciuglio 2013).
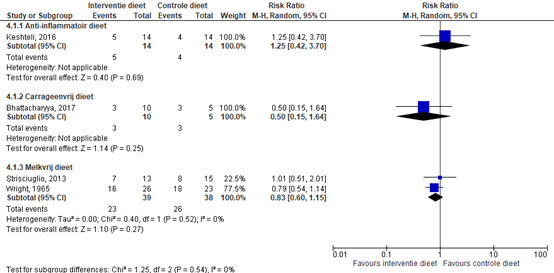
Figuur 3: forest plot met meta-analyse voor het verschil in behoud van remissie (alleen gebaseerd op klinische terugval) tussen interventiediëten en een controledieet bij inactieve colitis ulcerosa
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval.
Bewijskracht van de literatuur
Inductie van remissie bij actieve ziekte van Crohn
Vezelrijk en koolhydraatarm dieet – De bewijskracht voor de uitkomstmaat inductie van remissie is afkomstig uit gerandomiseerd gecontroleerd onderzoek. De bewijskracht van de literatuur start daarom op hoog. De bewijskracht is met drie niveaus verlaagd tot zeer laag vanwege onduidelijke randomisatie van patiënten (risk of bias); het kleine aantal patiënten (imprecisie); en het baseren van de conclusie op één enkele studie (imprecisie).
Microdeeltjes-arm dieet – De bewijskracht voor de uitkomstmaat inductie van remissie bij actieve ziekte van Crohn is afkomstig uit gerandomiseerd gecontroleerd onderzoek. De bewijskracht van de literatuur start daarom op hoog. De bewijskracht is met twee niveaus verlaagd tot zeer laag vanwege gebrek aan informatie over randomisatie van patiënten (risk of bias); en het kleine aantal patiënten (imprecisie); en overschrijding van beide grenzen van klinische relevantie door het betrouwbaarheidsinterval (imprecisie).
Symptoom-gestuurd dieet – De bewijskracht voor de uitkomstmaat inductie van remissie bij actieve ziekte van Crohn is afkomstig uit gerandomiseerd gecontroleerd onderzoek. De bewijskracht van de literatuur start daarom op hoog. De bewijskracht is met drie niveaus verlaagd tot zeer laag vanwege onduidelijke randomisatie van patiënten (risk of bias); het kleine aantal patiënten (imprecisie); en het baseren van de conclusie op één enkele studie (imprecisie).
Zeer beperkt organisch dieet – De bewijskracht voor de uitkomstmaat inductie van remissie bij actieve ziekte van Crohn is afkomstig uit gerandomiseerd gecontroleerd onderzoek. De bewijskracht van de literatuur start daarom op hoog. De bewijskracht is met drie niveaus verlaagd tot zeer laag vanwege onduidelijke randomisatie van patiënten (selectiebias); het kleine aantal patiënten (risk of bias); en het baseren van de conclusie op één enkele studie (imprecisie).
Calciumarm dieet – De bewijskracht voor de uitkomstmaat inductie van remissie bij actieve ziekte van Crohn is afkomstig uit gerandomiseerd gecontroleerd onderzoek. De bewijskracht van de literatuur start daarom op hoog. De bewijskracht is met drie niveaus verlaagd tot zeer laag vanwege onduidelijke randomisatie van patiënten (risk of bias); het kleine aantal patiënten (imprecisie); en het baseren van de conclusie op één enkele studie (imprecisie).
Inductie van remissie bij actieve colitis ulcerosa
Een symptoom-gestuurd dieet – De bewijskracht voor de uitkomstmaat inductie van remissie bij actieve colitis ulcerosa is afkomstig uit gerandomiseerd gecontroleerd onderzoek. De bewijskracht van de literatuur start daarom op hoog. De bewijskracht is met drie niveaus verlaagd tot zeer laag vanwege risico op inadequate randomisatie van patiënten (selectiebias); het kleine aantal patiënten (imprecisie); en het baseren van de conclusie op één enkele studie (imprecisie).
Behoud van remissie bij inactieve ziekte van Crohn (klinische terugval)
Koolhydraatarm dieet – De bewijskracht voor de uitkomstmaat behoud van remissie bij inactieve ziekte van Crohn is afkomstig uit gerandomiseerd gecontroleerd onderzoek. De bewijskracht van de literatuur start daarom op hoog. De bewijskracht is met drie niveaus verlaagd tot zeer laag vanwege verschillen in uitval van patiënten tussen de groepen (attrition bias); heterogeniteit in de studieresultaten (inconsistentie); en het kleine aantal patiënten (imprecisie).
Symptoom-gestuurd dieet – De bewijskracht voor de uitkomstmaat behoud van remissie bij inactieve ziekte van Crohn is afkomstig uit gerandomiseerd gecontroleerd onderzoek. De bewijskracht van de literatuur start daarom op hoog. De bewijskracht is met twee niveaus verlaagd tot laag vanwege verschillen in uitval van patiënten tussen de groepen (attrition bias); en het kleine aantal patiënten (imprecisie).
Dieet met weinig rood vlees – De bewijskracht voor de uitkomstmaat behoud van remissie bij inactieve ziekte van Crohn is afkomstig uit gerandomiseerd gecontroleerd onderzoek. De bewijskracht van de literatuur start daarom op hoog. De bewijskracht is met drie niveaus verlaagd tot zeer laag vanwege onduidelijkheid over de randomisatie van patiënten (selectiebias); het kleine aantal patiënten (imprecisie); en het baseren van de conclusie op één enkele studie (imprecisie).
Dieet met disachariden, granen, verzadigde vetten, rode en verwerkte vleeswaren of een FOS-supplement in combinatie met een placebo dieet – De bewijskracht voor de uitkomstmaat behoud van remissie bij inactieve ziekte van Crohn is afkomstig uit gerandomiseerd gecontroleerd onderzoek. De bewijskracht van de literatuur start daarom op hoog. De bewijskracht is met drie niveaus verlaagd tot zeer laag vanwege onduidelijkheid over de randomisatie van patiënten (selectiebias); het kleine aantal patiënten (imprecisie); en het baseren van de conclusie op één enkele studie (imprecisie).
Behoud van remissie bij inactieve colitis ulcerosa (klinische terugval)
Een anti-inflammatoir dieet – De bewijskracht voor de uitkomstmaat behoud van remissie bij actieve colitis ulcerosa is afkomstig uit gerandomiseerd gecontroleerd onderzoek. De bewijskracht van de literatuur start daarom op hoog. De bewijskracht is met drie niveaus verlaagd tot zeer laag vanwege inadequate rapportage van de resultaten (reporting bias); het kleine aantal patiënten (imprecisie); en het baseren van de conclusie op één enkele studie (imprecisie).
Een carrageenvrij dieet – De bewijskracht voor de uitkomstmaat behoud van remissie bij actieve colitis ulcerosa is afkomstig uit gerandomiseerd gecontroleerd onderzoek. De bewijskracht van de literatuur start daarom op hoog. De bewijskracht is met drie niveaus verlaagd tot zeer laag vanwege inadequate randomisatie van patiënten (selection bias); het kleine aantal patiënten (imprecisie); en het baseren van de conclusie op één enkele studie (imprecisie).
Een melkvrij dieet of een glutenvrij plus melkvrij dieet – De bewijskracht voor de uitkomstmaat behoud van remissie bij actieve colitis ulcerosa is afkomstig uit gerandomiseerd gecontroleerd onderzoek. De bewijskracht van de literatuur start daarom op hoog. De bewijskracht is met twee niveaus verlaagd tot laag vanwege onduidelijke randomisatie van patiënten (selectiebias); en het kleine aantal patiënten (imprecisie).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag: Wat zijn de (on)gunstige effecten van verschillende dieetbehandelingen voor inductie en behoud van remissie bij inflammatoire darmziekten?
P (patiënten) Patiënten met inflammatoire darmziekten
I (interventie) Interventiediëten
C (controle) Controledieet
O (uitkomsten) inductie van remissie, behoud van remissie
Relevante uitkomstmaten
De werkgroep achtte inductie van remissie en behoud van remissie voor de besluitvorming cruciale uitkomstmaten. De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Het induceren van remissie is gedefinieerd als het reduceren van symptomen op basis van verschillende scores de Crohn’s Disease Activity Index (CDAI), de Harvey-Bradshaw Index (HBI), de Mayo score of Colitis Activity Index (CAI).
Behouden van remissie is gedefinieerd als een aanhoudende afwezigheid van symptomen, wat gedurende een vast interval werd gemeten (zoals 6 maanden of 1 jaar), gebaseerd op klinische, biochemische of endoscopische gegevens.
Voor alle uitkomstmaten gebruikte de werkgroep de standaardgrenzen voor klinische besluitvorming, zoals deze zijn gedefinieerd door de GRADE werkgroep. Een verschil van 25% in relatief risico werd gedefinieerd als een klinisch relevant verschil (RR<0,8 of >1,25).
Zoeken en selecteren (Methode)
Voor deze uitgangsvraag is er niet systematisch gezocht omdat er ten tijde van de zoekstrategie net een Cochrane review (Limketkai, 2019) was verschenen die voldoet aan de uitgangsvraag.
Resultaten
Één systematische review is opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Albenberg L, Brensinger C, Wu Q, Gilroy E, Kappelman M, Sandler R, et al. A diet low in red and processed meats does not reduce the rate of Crohn’s disease flares in a randomized controlled trial: results of the food and Crohn’s disease exacerbation study (FACES). Gastroenterology 2018; 154(1):S3.
- Akobeng, A. K., Zhang, D., Gordon, M., & MacDonald, J. K. (2018). Enteral nutrition for maintenance of remission in Crohn's disease. Cochrane Database of Systematic Reviews, (8).
- Bartel, G., Weiss, I., Turetschek, K., Schima, W., Püspök, A., Waldhoer, T., & Gasche, C. (2008). Ingested matter affects intestinal lesions in Crohn's disease. Inflammatory bowel diseases, 14(3), 374-382.
- Bhattacharyya, S., Shumard, T., Xie, H., Dodda, A., Varady, K. A., Feferman, L., ... & Tobacman, J. K. (2017). A randomized trial of the effects of the no-carrageenan diet on ulcerative colitis disease activity. Nutrition and healthy aging, 4(2), 181-192.
- Brandes, J. W., & Lorenz-Meyer, H. (1981). Sugar free diet: a new perspective in the treatment of Crohn disease? Randomized, control study. Zeitschrift fur Gastroenterologie, 19(1), 1-12.
- Brotherton, C. S., Taylor, A. G., Bourguignon, C., & Anderson, J. G. (2014). A high fiber diet may improve bowel function and health-related quality of life in patients with Crohn’s disease. Gastroenterology nursing: the official journal of the Society of Gastroenterology Nurses and Associates, 37(3), 206.
- Campmans-Kuijpers, M.J.E., Dijkstra, D. (2021). Food and Food Groups in Inflammatory Bowel Disease (IBD): The design of the Groningen Anti-inflammatory diet (GrAID). Nutrients 13(4): 1067.
- Candy, S., Borok, G., Wright, J. P., Boniface, V., & Goodman, R. (1995). The value of an elimination diet in the management of patients with ulcerative colitis. South African Medical Journal, 85(11).
- <p align="left">Dariel I, Levi Z, Fraser A, Hadad B, Niv Y, Fraser G. Elimination diets in the treatment of mildly active Crohn’s disease - results of a randomized controlled trial. Gastroenterology 2207;132(4):A506–7.
- Dijkhuizen (2015). Kennis en attitude diëtist belangrijk bij dieetbehandeling van mensen met IBD. Voeding en visie 28: 20-23.
- <p align="left">Jones, V. A., Workman, E., Freeman, A. H., Dickinson, R. J., Wilson, A. J., & Hunter, J. O. (1985). Crohn's disease: maintenance of remission by diet. The Lancet, 326(8448), 177-180.
- Keshteli, A. H., Valcheva, R., Nickurak, C., Halloran, B. P., van Zanten, S. V., Kroeker, K., ... & Dieleman, L. A. (2016). Mo1889 Adherence to an “Anti-Inflammatory Diet” for 6 Months Can Decrease Fecal Calprotectin in Ulcerative Colitis Patients: Preliminary Findings of a Randomized Controlled Trial. Gastroenterology, 150(4), S807-S808.
- <p align="left">Levenstein, S., Prantera, C., Luzi, C., & D'ubaldi, A. (1985). Low residue or normal diet in Crohn's disease: a prospective controlled study in Italian patients. Gut, 26(10), 989-993.
- Limdi, J.K., Aggarwal, D., McLaughlin, J.T (2016). Dietary practices and beliefs in patients with inflammatory bowel disease. Inflamm Bowel Dis 22: 164-170.
- Limketkai, B. N., Iheozor‐Ejiofor, Z., Gjuladin‐Hellon, T., Parian, A., Matarese, L. E., Bracewell, K., ... & Mullin, G. E. (2019). Dietary interventions for induction and maintenance of remission in inflammatory bowel disease. Cochrane Database of Systematic Reviews, (2).
- <p align="left">Lomer, M. C., Harvey, R. S., Evans, S. M., Thompson, R. P., & Powell, J. J. (2001). Efficacy and tolerability of a low microparticle diet in a double blind, randomized, pilot study in Crohn's disease. European journal of gastroenterology & hepatology, 13(2), 101-106.
- Lomer, M. C., Grainger, S. L., Ede, R., Catterall, A. P., Greenfield, S. M., Cowan, R. E., ... & Powell, J. J. (2005). Lack of efficacy of a reduced microparticle diet in a multi-centred trial of patients with active Crohn's disease. European journal of gastroenterology & hepatology, 17(3), 377-384.
- Lorenz-Meyer, H., Bauer, P., Nicolay, C., Schulz, B., Purrmann, J., Fleig, W. E., ... & Carr, L. (1996). Omega-3 fatty acids and low carbohydrate diet for maintenance of remission in Crohn's disease: a randomized controlled multicenter trial. Scandinavian journal of gastroenterology, 31(8), 778-785.
- <p align="left">Mowat, C., Cole, A., Windsor, A. L., Ahmad, T., Arnott, I., Driscoll, R., ... & IBD Section of the British Society of Gastroenterology. (2011). Guidelines for the management of inflammatory bowel disease in adults. Gut, 60(5), 571-607.
- Mutlu E, Mikolaitis S, Sedghi S, Chakradeo PS, Engen P, Chlipala G, et al. Dietary treatment of Crohn’s disease: a randomized, placebo-controlled, double-blinded clinical trial. Gastroenterology 2016;150(4):S778.
- Nakahigashi, M., Yamamoto, T., Sacco, R., Hanai, H., & Kobayashi, F. (2016). Enteral nutrition for maintaining remission in patients with quiescent Crohn’s disease: current status and future perspectives. International journal of colorectal disease, 31(1), 1-7.
- Narula, N., Dhillon, A., Zhang, D., Sherlock, M. E., Tondeur, M., & Zachos, M. (2018).
Enteral nutritional therapy for induction of remission in Crohn's disease. Cochrane
Database of Systematic Reviews, (4). - Nguyen, D. L., Limketkai, B., Medici, V., Mendoza, M. S., Palmer, L., & Bechtold, M. (2016). Nutritional strategies in the management of adult patients with inflammatory bowel disease: dietary considerations from active disease to disease remission. Current gastroenterology reports, 18(10), 1-7.
- <p align="left">Riordan, A. M., Hunter, J. O., Crampton, J. R., Neale, G., Cowan, R. E., Davidson, A. R., ... & Saunders, J. H. B. (1993). Treatment of active Crohn's disease by exclusion diet: East Anglian multicentre controlled trial. The Lancet, 342(8880), 1131-1134. , Hunter, J. O., Crampton, J. R., Neale, G., Cowan, R. E., Davidson, A. R., ... & Saunders, J. H. B. (1993). Treatment of active Crohn's disease by exclusion diet: East Anglian multicentre controlled trial. The Lancet, 342(8880), 1131-1134.
- Ritchie, J. K., Wadsworth, J., Lennard-Jones, J. E., & Rogers, E. (1987). Controlled multicentre therapeutic trial of an unrefined carbohydrate, fibre rich diet in Crohn's disease. Br Med J (Clin Res Ed), 295(6597), 517-520.
- Strisciuglio, C., Giannetti, E., Martinelli, M., Sciorio, E., Staiano, A., & Miele, E. (2013). Does cow's milk protein elimination diet have a role on induction and maintenance of remission in children with ulcerative colitis?. Acta Paediatrica, 102(6), e273-e278.
- <p align="left">Sigall Boneh, R., Sarbagili Shabat, C., Yanai, H., Chermesh, I., Ben Avraham, S., Boaz, M., & Levine, A. (2017). Dietary therapy with the Crohn’s disease exclusion diet is a successful strategy for induction of remission in children and adults failing biological therapy. Journal of Crohn's and Colitis, 11(10), 1205-1212.
- Tomar, S.K., Kedia, S., Upadhyay, A.D. (2017). Impact of dietary beliefs and practices on patients with inflammatory bowel disease: an observational study from India. Journal of gasteroenterology and hepatology 1:15-21.
- de Vries, J.H.M., Dijkhuizen, M., Tap, P., Witteman, B.J.M. (2019). Patient’s Dietary Beliefs and Behaviours in Inflammatory Bowel Disease. Digestive diseases 237: 131-139.
- Wright, R., & Truelove, S. C. (1965). A controlled therapeutic trial of various diets in ulcerative colitis. British medical journal, 2(5454), 138.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series)) Research question: Which diet is effective in inducing and maintaining remission in patients with IBD?
|
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
|
|
Limketkai (2019) |
Design SR and meta-analysis of RCT’s
Literature search up to 31 January 2019
Active Crohn’s Disease: A: Bartel, 2008 B: Brotherton, 2014 C: Dariel, 2007 D: Levenstein, 1985 E: Lomer, 2001 F: Lomer, 2005
Inactive Crohn’s Disease: G: Aldenberg, 2018 H: Brandes, 1981 I: Jones, 1985 J: Lorenz-Meyer, 1996 K: Mutlu, 2016 L: Riordan, 1993 M: Ritchie, 1987
Active ulcerative colitis N: Candy, 1995
Inactive ulcerative colitis O: Bhattacharyya, 2017 P: Keshteli, 2016 Q: Strisciuglio, 2013 R: Wright, 1965
Study design: RCT
Setting and Country: The included studies were conducted in single or multi centers across eight different countries and were published between 1965 and 2018. Thirty-five per cent of the studies were conducted in the UK(Jones 1985; Lomer 2001; Lomer 2005; Riordan 1993; Ritchie 1987; Wright 1965), 23% in the USA (Albenberg 2018; Bhattacharyya 2017; Brotherton 2014; Mutlu 2016), 11% in Germany (Brandes 1981; Lorenz-Meyer 1996), 11% in Italy (Levenstein 1985; Strisciuglio 2013) and the rest were conducted in Austria (Bartel 2008), Canada (Keshteli 2016), Israel (Dariel 2007), and South Africa (Candy 1995).
Source of funding and conflicts of interest: Seventy-two per cent of the included studies reported no information on both funding sources and declarations of interest (Albenberg 2018; Brandes 1981; Candy 1995; Dariel 2007; Jones 1985; Keshteli 2016; Levenstein 1985; Lorenz-Meyer 1996; Mutlu 2016; Riordan 1993; Ritchie 1987; Strisciuglio 2013; Wright 1965). In two studies, authors had no conflicts of interest, however, funding was not reported (Bhattacharyya 2017; Lomer 2005). Three studies were funded by a stipend from a University (Bartel 2008), or grants from government organizations (Brotherton 2014; Lomer 2001), however, the authors of these studies did not declare any financial interests. |
Inclusion criteria SR: randomized controlled trials (RCTs) that compared the effects of dietary manipulations to other diets in participants with IBD.
Exclusion criteria SR: Studies that exclusively focused on enteral nutrition, oral nutrient supplementation, medical foods, probiotics, and parenteral nutrition were excluded.
18 studies included
Important patient characteristics at baseline: Number of patients analysed; age
N, mean age A: N=14, 48 ± 14.7 yrs B: N=7, 29.5 ± 13.6 yrs C: N=51, 36.1 ± 15 yrs D: N=60, 38.2 & 42 yrs E: N=20, 36.2 ± 11.8 yrs F: N=83, 36 ± 13 yrs G: N=214, age not stated H: N=20, 32 & 35 yrs I: N=20, N=3 age <19 & N=17 age 19-49 J: N=202, 30.7 ± 10.3 yrs K: N=54, 45 ± 14.5 yrs L: N=78, 33.7 ± 12.2 yrs M: N=352, age 14.4 – 77.7 N: N=18, Med 37 & 41 yrs O: N=12, age 34-65 yrs P: N=28, 37.7 ± 15.0 yrs Q: N=29, mean 11.2 (range 4.6 – 17) yrs R: N=50, age not stated
Sex (N male/female): A: M/F: 9/5 B: M/F: 1/6 C: M/F: 24/27 D: M/F: 36/24 E: M/F: 3/17 F: M/F: 40/43 G: Not stated H: M/F: 13/7 I: M/F: 2/18 J: M/F: 67/135 K: M/F: 21/33 L: M/F: 26/52 M: M/F: 130/222 N: M/F: 9/9 O: M/F: 8/4 P: M/F: 12/16 Q: M/F: 14/15 R: not stated
|
Describe intervention:
A: Restricted organic diet.
B: Specific instructions and general tips to increase whole wheat bran and reduced refined carbohydrate intake
C: Sequential elimination diets. Elimination diets for 30 food components were prepared using a specially designed computer program.
D: a low residue diet specifically forbidding legumes, whole grains, nuts, ordinary juices (containing some pulp) and all fruits and vegetables with the exception of ripe bananas and skinned potatoes.
E: Diet low in microparticle.
F: Low calcium (400 mg/day) and low microparticle diet.
G: Not more than 1 serving per month of red or processed meat for 48 weeks.
H: Low carbohydrate diet with a relative increase in protein and fat intake.
I: Investigated for specific food intolerances. Patients introduced a single food each day, starting with those such as chicken and fish, leaving until later those such as cereals and dairy products. A food that provoked symptoms was subsequently avoided. During the first fortnight of food testing, an elemental diet was taken to maintain a nutritionally adequate diet.
J: Patients in the diet group were instructed to adhere to a low- carbohydrate diet of less than 84 g/day.
K: 1: Anti-IBD diet and placebo supplement
2: Fructooligosaccharide supplement and ’placebo diet’.
L: Elemental diet with instruction to reintroduce a single food each day and to exclude any food that provoked symptoms such as diarrhoea and pain. They were also given placebo tablets.
M: Advised to eat carbohydrate in its natural unrefined state only, avoiding all products containing sugar or white flour.
N: Diets which were systematically manipulated to exclude foods that appeared to provoke symptoms.
O: Carrageenan-free diet + placebo (dextrose).
P: Alberta-based Anti-inflammatory Diet (anti-inflammatory diet designed to increase patients’ intakes of probiotics, prebiotics, soluble fibers, and omega-3 polyunsaturated fatty acids and decrease red meat intake).
Q: Cow’s milk protein elimination diet
R: 1:Milk-free, low-roughage diet excluded all milk/products (fresh milk, cheese, or powdered milk). Butter was permitted.
2: Gluten-free plus milk-free diet. Butter was not permitted and patients were told to use margarine instead. |
Describe control:
A: Low-fat, high-carbohydrate diet that is complete in nutrients.
B: Specific instructions and general tips suggested by experiences of individuals who have used trigger identification for CD symptom control and who have avoided consumption of dietary fiber.
C: Conventional nutritional advice.
D: gradually normalising Italian diet with a graded plan of gradual fiber reintroduction for patients previously following a low residue diet.
E: Designed to match the trial diet, except that foods containing dietary microparticle were not especially discouraged. Fibrous fruit and vegetables, which are known to cause symptoms in stricturing Crohn’s disease, were excluded.
F: Low calcium (400 mg/day) and normal microparticle diet.
G: Minimum of 2 servings per week of red or processed meat for 48 weeks
H: Carbohydrate-rich diet with relative reduction in protein and fat intake.
I: Unrefined carbohydrate fiber-rich diet.
J: Placebo capsules
K: Placebo diet’ and placebo supplement.
L: Prednisolone 40 mg/day. If they remained in remission, the prednisolone dose was reduced to 30mg after 1 week, to 20mg after 1month, and to 10mg after 2months, and withdrawn after 3 months. They received general dietary advice from a dietitian.
M: Diet with carbohydrate in its refined form (e.g. white flour and rice) and avoiding unrefined carbohydrate foods. Sugar intake was unrestricted.
N: No alteration to usual diet. All foods and drinks consumed were recorded.
O: Carrageenan-free diet + carrageenan-containing capsules - initially one capsule daily (100 mg), and increased intake to two capsules (200 mg) daily after finding that one capsule daily was well-tolerated.
P: Diet based on Canada’s Food Guide.
Q: Usual diet
R: Exclude a variety of items of diet, such as fried foods, condiments, and ice cream, but constituents of these foods which might be antigenic were included in the list of other foods which were permitted. In particular, they were advised to consume milk and milk products liberally
|
End-point of follow-up:
A: 24 weeks B: 4 weeks C: 2 weeks D: approx.. 24 months (23-34) E: 4 months F: 16 weeks G: 48 weeks H: 24 months I: 6 months J: 12 months K: 12 months L: 24 months M: 24 months N: 6 weeks O: 12 months P: 6 months Q: 12 months R: 12 months
|
Active Crohn’s disease Induction of remission Defined as the therapeutic reduction of intestinal symptoms below a clinical threshold as measured by CD and UC symptom scores.
Effect measure: RR (95%CI) A: 1.00 (0.39-2.53) B: 7.20 (0.53-97.83) C: 20.00 (1.27-315.40) D: NR E: 15.00 (0.97-231.84) F: 1.20 (0.66-2.17) and 1.24 (0.67-2.29)
CRP Effect measure: MD (95%CI) A: 0.40 (-0.51-1.31)
ESR Effect measure: MD (95%CI) A: -5.00 (-15.15-5.15)
Endoscopic improvement Effect measure RR (95%CI) A: 5.40 (0.74, 39.17)
Nonactive Crohn’s disease Clinical relapse Defined as the transition from a state of clinical remission to active disease, based on symptom scores.
Effect measure: RR [95% CI]: G: 1.03 (0.85-1.26] H: 1.20 (0.10-14.69] I: 0.33 (0.14-0.80) J: 0.92 (0.75-1.12) K: 0.11 (0.01-1.76) L: 0.67 [0.47-0.93] M: 1.15 [0.98-1.36]
CRP Effect measure: MD (95%CI) L: 0.29 (-1.95-2.53)
ESR Effect measure: MD (95%CI) I: -14.60 (-33.02-3.82) L: -4.30 )-16.09-7.49)
Active ulcerative colitis Induction of remission Defined as the therapeutic reduction of intestinal symptoms below a clinical threshold as measured by CD and UC symptom scores.
Effect measure: RR (95%CI) N: 8.25 (0.50-136.33)
Clinical improvement Effect measure RR (95%CI) N: 4.55 (0.63-32.56)
Endoscopic improvement Effect measure RR (95%CI) N: 3.64 (1.00-13.23)
Histologic improvement Effect measure RR (95%CI) N: 0.91 (0.24-3.51)
Nonactive ulcerative colitis Clinical relapse Defined as the transition from a state of clinical remission to active disease, based on symptom scores Effect measure: RR [95% CI]: O: 0.50 (0.15-1.64) P:1.25 (0.42-3.70) Q: 1.01 (0.51-2.01) R: 0.79 (0.54-1.14)
FCP Effect measure: MD [95% CI]: O: 60.00 (-59.24-179.24)
|
Risk-of-biastabel
Table of quality assessment for systematic reviews of RCTs and observational studies
Research question: Which diet is effective in inducing and maintaining remission in patients with IBD?
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
|
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
LimKetka, 2019 |
Yes
Focused on efficacy and safety of dietary interventions in IBD. |
Yes
CENTRAL; Cochrane IBD Group Specialized Trials Register; Embase (Ovid); MEDLINE (Ovid); and Web of Science were searched. |
Yes |
Yes |
Not applicable |
Yes
Cochrane risk-of-bias tool |
|
No
Studies were different with regard tot he dietary interventions. However, subgroup analyses were performed. |
Yes
They used GRADE. |
Yes
COI of both individual studies (if available) and SR were reported. |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 23-12-2022
Beoordeeld op geldigheid : 23-12-2022
De NVMDL is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied. De werkgroep heeft per module een inschatting gemaakt van de periode waarbinnen de modules beoordeeld zouden moeten worden voor eventuele herziening.
|
Module |
Uiterlijk jaar voor beoordeling |
|
Module Dieet |
2026 |
|
Module Voedingssupplementen |
2026 |
|
Module perianale fistels |
2023 |
|
Module maligniteit |
2026 |
|
Module vermoeidheid |
2026 |
|
Module zwangerschap |
2024 |
|
Module patiënten >60 jaar |
2026 |
|
Module preoperatief beleid |
2026 |
|
Module psychosociale zorg |
2026 |
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met inflammatoire darmziekten.
Werkgroep
- Dr. K.H.N. de Boer, MDL-arts, NVMDL
- Dr. B. Jharap, MDL-arts, NVMDL
- Dr. I.M. Minderhoud, MDL-arts, NVMDL
- Dr. A.G.L. Bodelier, MDL-arts, NVMDL
- Dr. G.J. Tack, MDL-arts, NVMDL
- Dr. F. Hoentjen, MDL-arts, NVMDL (tot december 2020)
- Dr. O. van Ruler, chirurg, NVvH
- Dr. M.A. de Boer, gynaecoloog, NVOG
- Dr. A.G.M.G.J. Mulders, gynaecoloog, NVOG
- Dr. A.H.W. Bruns, internist-infectioloog, NIV
- C. Bijl, diëtist, NVD
- A.M. van Dijk, diëtist, NVD
- Drs. M.P. Scherpenzeel MPM, Patiëntvertegenwoordiger, Crohn & Colitis NL
- Dr. R.J. Hoefman, Patiëntvertegenwoordiger, Crohn & Colitis NL
- R. Theeuwen, Verpleegkundig specialist IBD, V&VN
Klankbordgroep
- Prof. dr. J. Stoker, radioloog, NVvR
- Dr. J.A.W. Tielbeek, radioloog, NVvR
Met ondersteuning van:
- Dr. N. van der Zwaluw, Senior adviseur, Kennisinstituut van Medisch Specialisten
- Dr. S. Zwakenberg, Adviseur, Kennisinstituut van Medisch Specialisten
- H. Olthuis, Adviseur, Kennisinstituut van Medisch Specialisten
- S. Wouters, secretaresse, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. Er is tijdens de commentaarfase extra kritisch commentaar gevraagd van vier onafhankelijke beoordelaars vanuit de NVMDL, in verband met de gemelde belangen van de werkgroepleden. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werk-groeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
De Boer, voorzitter |
MDL-arts, Amsterdam UMC |
Actief lid en secretaris van de ICC; vanuit Amsterdam UMC actief betrokken bij het IBD trialbureau, meerdere IBD-studies lopen in wisselende samenstelling (contract research) |
PI onderzoek mercaptopurine bij CU, TEVA, ZonMW; PI onderzoek naar thioguanine bij IBD, registratiestudies, TAKEDA; PI onderzoek eNose bij IBD, Vaillant Fonds; onderzoek eNose colon kanker en poliepen; participatie aan diverse (nationale) IBD studies (geen PI), waarbij financiering vanuit industrie/overheid/fondsen kan komen; |
Tack aangesteld als vice-voorzitter |
|
Jharap |
MDL-arts, Meander Medisch Centrum te Amersfoort |
Geen |
Deelname congressen deels betaald door farmaceutische bedrijven, bijdrage symposia gesponsord door farmaceutische bedrijven |
Geen (gedurende richtlijn geen deelname adviesraden, of bijdrage symposia gesponsord door farmaceutische bedrijven) |
|
Scherpenzeel |
Directeur Crohn & Colitis NL |
Partner Blauwe Noordzee (betaald), voorzitter adviescommissie Fonds Gehandicapten sport (onbetaald), lid bestuur EFCCA (onbetaald), lid beoordelingscommissie KIDZ (betaald) |
Vader van een dochter met de ziekte van Crohn. Echter, breng ik patiënten perspectief in op basis van ervaringen van patiënten die wij als organisatie ophalen. De activiteiten van Crohn & Colitis NL worden mede ondersteund door sponsoring van farmaceutische bedrijven, waarbij altijd sprake is van multi-sponsoring. Bedrijven hebben geen invloed op de inhoud van de activiteiten. Financiering vanuit ZonMw voor twee onderzoeksprojecten. |
Geen |
|
Bruns |
Internist-infectioloog |
Geen |
Geen |
Geen |
|
De Boer |
Gynaecoloog |
Geen |
Geen |
Geen |
|
Minderhoud |
MDL-arts, Tergooi Ziekenhuis (MSB Gooi en Eemland) |
Geen |
Adviesraad/expert panel Ferring BV (2017/2018), betaling congreskosten door Ferring BV (2018) |
Geen |
|
Bijl |
Diëtist, Amsterdam UMC |
Lid netwerk diëtisten MDL (onbetaald) |
Geen |
Geen |
|
Van Dijk |
Diëtist, UMC Utrecht |
MDL-netwerk diëtisten (onbetaald, o.a. dieetbehande-lingsrichtlijn up to date houden), NVO (Nederlands voedingsteam overleg, onbetaald), lid maatschappelijke adviesraad MLDS (onbetaald). |
Geen |
Geen |
|
Hoentjen (tot december 2020) |
MDL-arts, Radboud UMC Nijmegen |
Voorzitter ICC - onbetaald |
Eenmalige advisering/presentatie voor diverse bedrijven, unrestricted grants van ZonMw, Janssen-Cilag en Abbvie. |
Geen (onderwerpen van extern gefinancieerd onderzoek komen niet terug in de richtlijn) |
|
Tack |
MDL-arts, Medisch Centrum Leeuwarden |
Geen |
Bijdrage aan symposia, georganiseerd door bedrijven. Adviesraad Janssen, Lamepro. |
Extra beoordelaars gevraagd.
|
|
Bodelier |
MDL-arts, Amphia Ziekenhuis Breda |
Geen |
Adviseursschappen/presentaties voor diverse bedrijven |
Geen (adviesraden neergelegd tijdens richtlijnontwikkeling). |
|
Van Ruler |
Colorectaal chirurg, IJsselland Ziekenhuis, i.s.m. het Erasmus MC |
Geen |
Betrokken bij onderzoek naar autoloog platelet-rich-stroma als add-on bij de chirurgische behandeling van perianale fistels. |
Geen |
|
Hoefman |
Wetenschappelijk medewerker bij het Sociaal en Cultureel Planbureau (SCP). |
Jeugdouderling Hervormde Wijkgemeente Zwijndrecht (onbetaald). |
Renske Hoefman heeft de ziekte van Crohn. |
Geen |
|
Theeuwen |
Verpleegkundig specialist Maag darm Leverziekten, Leids Universitair Medisch Centrum |
Voorzitter regioavonden regio Zuid -West vanuit V&VN (onbetaald), |
Subsidie firma Dr Falk voor materialen die nodig zijn voor het opzetten van een pre-operatief spreekuur. |
Geen (niet betrokken bij modules over medicamenteuze behandeling) |
|
Mulders |
Gynaecoloog Erasmus MC |
Geen |
Geen |
Geen |
|
Stoker (klankbordgroep) |
Divisievoorzitter Radiologie & Nucleaire Genees-kunde, Radiothera-pie, Biome-dical Engineering & Physics en Apotheek en plaatsver-vangen afdelingshoof Radiologie & Nucleaire Geneeskun-de bij het Amsterdam UMC |
Geen |
Geen |
Geen |
|
Tielbeek (klankbordgroep) |
Abdominaal radioloog in Spaarne Gasthuis |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afvaardiging van Crohn & Colitis NL in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie kopje waarden en voorkeuren van patiënten). De conceptrichtlijn is tevens voor commentaar voorgelegd aan Crohn & Colitis NL en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module Dieet |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Voedingssupplementen |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module perianale fistels |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module maligniteit |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module vermoeidheid |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module zwangerschap |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module patiënten >60 jaar |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module preoperatief beleid |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet . Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module psychosociale zorg |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Methode ontwikkeling
Evidence based
Implementatie
Inleiding
Dit implementatieplan is opgesteld ter bevordering van de implementatie van de update van de richtlijn inflammatoire darmziekten. Voor het opstellen van dit plan is een inventarisatie gedaan van de mogelijk bevorderende en belemmerende factoren voor het naleven van de aanbevelingen. Daarbij heeft de richtlijnwerkgroep een advies uitgebracht over het tijdspad voor implementatie, de daarvoor benodigde randvoorwaarden en de acties die door verschillende partijen ondernomen dienen te worden.
In deze update zijn de volgende modules nieuw ontwikkeld:
- Dieet
- Voedingssupplementen
- Behandeling van perianale fistels
- Behandeling van patiënten met een maligniteit in het verleden
- Behandeling van vermoeidheid
- IBD-medicatie tijdens zwangerschap
- Behandeling van patiënten >65 jaar
- Preoperatief beleid
- Psychosociale zorg
Werkwijze
Om tot dit plan te komen heeft de werkgroep per aanbeveling in de richtlijn nagedacht over:
- per wanneer de aanbeveling overal geïmplementeerd moet kunnen zijn;
- de verwachtte impact van implementatie van de aanbeveling op de zorgkosten;
- randvoorwaarden om de aanbeveling te kunnen implementeren;
- mogelijk barrières om de aanbeveling te kunnen implementeren;
- mogelijke acties om de implementatie van de aanbeveling te bevorderen;
- verantwoordelijke partij voor de te ondernemen acties.
Lezers van dit implementatieplan dienen rekening te houden met verschillen tussen “sterk geformuleerde aanbevelingen” en “zwak geformuleerde aanbevelingen”. In het eerste geval doet de werkgroep een duidelijke uitspraak over iets dat wel of niet gedaan moet worden. In het tweede geval wordt de aanbeveling minder zeker gesteld en spreekt de werkgroep haar voorkeur of advies uit, maar laat zij meer ruimte voor alternatieven. Een reden hiervoor is bijvoorbeeld dat er onvoldoende wetenschappelijk bewijs is om de aanbeveling te onderbouwen. Een zwakke aanbeveling is te herkennen aan de formulering en begint bijvoorbeeld met “Overweeg om …”. Zowel voor de sterke als voor de zwakke aanbevelingen heeft de werkgroep nagedacht over de implementatie. De resultaten zijn weergegevenin Tabel 1.
Tabel 1: Overzicht inventerisatie ten behoeve van de implementatie van de aanbevelingen in de richtlijn Inflammatoire darmziekten.
|
Aanbeveling |
Tijdspad voor implementatie: 1-3 jaar of >3 jaar |
Verwacht effect op kosten |
Randvoorwaarden voor implementatie (binnen aangegeven tijdspad) |
Mogelijke barrières voor implementatie |
Te ondernemen acties voor implementatie |
Verantwoordelijken voor acties |
Overige opmerkingen |
|
Dietiaire begeleiding, indien dieet overwogen wordt. |
1-3 jaar |
Neutraal |
Beschikbaarheid diëtist, inhoud richtlijn bekend bij zorgverleners. |
Formatie afspraken dietetiek |
Verspreiden richtlijn onder betrokken zorgverleners. |
WV/vereniging betrokken zorgverleners |
Geen |
|
Voedingssupplementen |
< 1 jaar |
Neutraal |
Inhoud richtlijn bekend bij zorgverleners. |
Geen |
Verspreiden richtlijn onder betrokken zorgverleners. |
WV/vereniging betrokken zorgverleners |
Geen |
|
Perianale fistels – medicamenteus |
< 1 jaar |
Neutraal |
Inhoud richtlijn bekend bij zorgverleners. |
Geen |
Verspreiden richtlijn onder betrokken zorgverleners. |
WV betrokken zorgverleners. |
Geen |
|
Perianale fistels – chirurgisch |
1-3 jaar |
Mogelijke kosten a.g.v. celtherapie |
Inhoud richtlijn bekend bij zorgverleners. |
Celtherapie is niet in elk centrum beschikbaar, onvoldoende mogelijkheden voor MDO vanwege tijd en middelen, ontbreken overlegstructuren met expertise centra. |
Verspreiden richtlijn onder betrokken zorgverleners, belang MDO onder de aandacht brengen en implementatie hiervan faciliteren, overlegstructuren met expertisecentra opzetten en/of bevorderen. |
WV betrokken zorgverleners. |
Geen |
|
Maligniteit – MDO |
< 1 jaar |
Neutraal |
Mogelijkheid tot MDO Inhoud richtlijn bekend bij zorgverleners |
Onvoldoende mogelijkheden voor MDO vanwege tijd en middelen Onvoldoende kennis bij betrokken zorgverleners |
Verspreiden richtlijn onder betrokken zorgverleners, belang MDO onder de aandacht brengen en implementatie hiervan faciliteren. |
WV betrokken zorgverleners. |
Geen |
|
Maligniteit – medicatie adviezen |
<1-3 jr |
Neutraal |
Inhoud richtlijn bekend bij zorgverleners |
Onvoldoende kennis en ervaring bij betrokken zorgverleners Verzekering/vergoeding: medicatievoorschriften volgens strikte criteria |
Verspreiden richtlijn onder betrokken zorgverleners |
WV van betrokken zorgverleners. |
Geen |
|
Vermoeidheid |
< 1 jaar |
Neutraal |
Inhoud richtlijn bekend bij zorgverleners. |
Geen |
Verspreiden richtlijn onder betrokken zorgverleners. |
WV/vereniging betrokken zorgverleners. |
Geen |
|
Zwangerschap - medicatie |
< 1 jaar |
Neutraal |
Inhoud richtlijn bekend bij zorgverleners. |
Geen |
Verspreiden richtlijn onder betrokken zorgverleners. |
WV betrokken zorgverleners. |
Geen |
|
Zwangerschap – consult |
< 1 jaar |
Neutraal |
Inhoud richtlijn bekend bij zorgverleners |
Onvoldoende motivatie om patiente te verwijzen naar andere discipline of ander ziekenhuis |
Verspreiden richtlijn onder betrokken zorgverleners en daarin ook belang van multidisciplinaire samenwerking benadrukken. |
WV van betrokken zorgverleners. |
Geen |
|
Patiënten >60 jaar |
<1 jaar |
Neutraal |
Inhoud richtlijn bekend bij zorgverleners |
Geen |
Verspreiden richtlijn onder betrokken zorgverleners. |
WV van betrokken zorgverleners. |
Geen |
|
Preoperatief beleid |
< 1 jaar |
Neutraal |
Inhoud richtlijn bekend bij zorgverleners |
Geen |
Verspreiden richtlijn onder betrokken zorgverleners. |
WV van betrokken zorgverleners. |
Geen |
|
Psychosociale zorg - organisatie |
Zie implementatieplan bij de kwaliteitsstandaard ‘Psychosociale zorg bij somatische aandoeningen’ |
||||||
Impact op zorgkosten
Geen van de aanbevelingen brengt grote gevolgen met zich mee voor de zorgkosten.
Te ondernemen acties per partij
Hieronder wordt per partij toegelicht welke acties zij kunnen ondernemen om de implementatie van de richtlijn te bevorderen.
Alle direct betrokken wetenschappelijk verenigingen/beroepsorganisaties
- Bekend maken van de richtlijn onder de leden, via het notificatiebericht dat meegeleverd wordt bij het publiceren van de richtlijn.
- Publiciteit voor de richtlijn maken door over de richtlijn te publiceren in tijdschriften en te vertellen op congressen.
- Ontwikkelen van gerichte bijscholing/trainingen, onder andere voor de module over perianale fistels.
- Ontwikkelen en/of aanpassen van patienteninformatie.
- Controleren van de toepassing van de aanbevelingen middels audits en de kwaliteitsvisitatie.
- Gezamenlijk afspraken maken over - en opstarten van continu modulair onderhoud van de richtlijn.
Als onderdeel van het richtlijnproject is patiënteninformatie op Thuisarts.nl ontwikkeld of aangepast. Ook zijn er stroomschema’s ontwikkeld bij de modules over de behandeling van perianale fistels en de behandeling van patiënten met een maligniteit in het verleden.
De lokale vakgroepen/individuele medisch professionals
- Bespreken van de aanbevelingen tijdens de vakgroepsvergadering, referaat, richtlijnoverleg en/of lokale werkgroepen, zodat er kennis genomen wordt van de inhoud en bepaald kan worden of en hoe het handelen in de dagelijkse praktijk aanpassingen behoeft.
- Het volgen van bijscholing die bij deze richtlijn ontwikkeld gaat worden.
- Aanpassen lokale patiënteninformatie op grond van de materialen die door de verenigingen beschikbaar gesteld zullen worden.
- Afstemmen en afspraken maken met andere betrokken disciplines om de toepassing van de aanbevelingen in de praktijk te borgen.
De systeemstakeholders (onder andere zorgverzekeraars, (koepelorganisaties van) ziekenhuisbestuurders, IGZ)
Ten aanzien van de financiering van de zorg voor patiënten met inflammatoire darmziekten wordt van het bestuur van de ziekenhuizen verwacht dat zij bereid zijn om de nodige investeringen te doen (zie hierboven bij impact op zorgkosten) om de aanbevelingen in deze richtlijn te kunnen implementeren. Daarnaast wordt van de bestuurders verwacht dat zij bij de betrokken medisch professionals nagaan op welke wijze zij kennis hebben genomen van de nieuwe richtlijn en deze toepassen in de praktijk.
Van zorgverzekeraars wordt verwacht dat zij de zorg die in deze richtlijn wordt voorgeschreven zullen vergoeden. De “sterk geformuleerde aanbevelingen” in deze richtlijn kunnen, na verloop van de aangegeven implementatietermijnen door zorgverzekeraars worden gebruikt voor de inkoop van zorg.
Het Kennisinstituut van Medisch Specialisten
De richtlijn wordt gepubliceerd in de Richtlijnendatabase van de Federatie Medisch Specialisten. Dit implementatieplan maakt onderdeel uit van de richtlijn (bijlage) en staat op een voor alle partijen goed te vinden plaats. Ook wordt er bij publicatie van de richtlijn een notificatiebericht verstuurd.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met inflammatoire darmziekten. Tevens zijn er knelpunten aangedragen door de Nederlands Instituut van Psychologen (NIP), Nederlandse Vereniging van Ziekenhuisapothekers (NVZA), Vereniging Innovatieve Geneesmiddelen (VIG), Nederlandse Vereniging van Podotherapeuten (NVVP) en Nederlandse Vereniging voor Kindergeneeskunde (NVK) via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk of bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID).
Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
