Coloscopie surveillance
Uitgangsvraag
Wat is het risico op colorectaal carcinoom (voor het 18e levensjaar) bij kinderen met inflammatoire darmziekten (ziekte van Crohn en colitis ulcerosa), en welke van deze patiënten komt in aanmerking voor surveillance coloscopie om (voorstadia van) maligniteiten vroegtijdig op te sporen?
Clinical question
What is the risk of colorectal cancer (before the age of 18) in children with inflammatory bowel disease (Crohn’s disease and ulcerative colitis), and which of these patients would benefit from surveillance colonoscopy to early detect (precursors of) malignancy?
Aanbeveling
Geadviseerd wordt om surveillance coloscopie uit te stellen tot na het 18e levensjaar, tenzij:
- Er sprake geweest is van zeer ernstige en langdurige ziekteactiviteit in het colon of een positieve familieanamnese voor CRC bij een eerstegraads familielid < 50 jaar.
Ook in geval van bijkomende primaire scleroserende cholangitis (PSC) geldt het advies om surveillance scopie uit te stellen tot na het 18e levensjaar, tenzij er sprake is van:
- Zeer ernstige en langdurige ziekteactiviteit in het colon;
- Ziekteduur van > 8 jaar;
- Of een positieve familieanamnese voor CRC bij een eerstegraads familielid < 50 jaar.
Indien op de kinderleeftijd een surveillance coloscopie wordt uitgevoerd, dient deze uitgevoerd te worden door een ervaren endoscopist die specifieke training voor darmkankerscreening heeft gehad. Surveillance bij actieve ziekte en onvoldoende gereinigd colon is onbetrouwbaar.
Overleg met de patiënt of diepe sedatie (propofol) gewenst is.
Recommendations
It is advised to postpone surveillance colonoscopy until after the age of 18, unless:
- There has been very severe and prolonged disease activity of the colon or a positive family history of CRC in a first-degree relative < 50 years.
In the case of concomitant primary sclerosing cholangitis (PSC), the advice is also to postpone surveillance colonoscopy until after the age of 18, unless there is:
- Very severe and prolonged disease activity of the colon;
- Disease duration of > 8 years;
- Or a positive family history of CRC in a first-degree relative < 50 years.
If surveillance colonoscopy is performed during childhood, it should be conducted by an experienced endoscopist who has received specific training in colorectal cancer screening. Surveillance during active disease and with an inadequately cleansed colon is unreliable.
Discuss with the patient whether deep sedation (propofol) is desired.
Overwegingen
Advantages and disadvantages of the intervention and quality of the evidence
From the systematic literature search, no validated prediction models were available for predicting colorectal carcinoma or dysplasia in children with inflammatory bowel disease (IBD). Some systematic reviews of large registry-based studies were available, showing an increased risk of more than 2 times for cancer overall, and >5 times for colorectal cancer. However, two important aspects should be noted: (1) cancer incidence was in most studies assessed after a long duration of follow-up, and therefore occurred at adult age in patients who had IBD-onset as a child; and (2) that despite an increased relative risk, the absolute incidence remains low, varying from 0.6 to 10 cases per 1000 person years (Elmadhi, 2022; Komaki, 2020). No definitive conclusions can be drawn from the literature search alone.
Risk factors
The summary based on the selected papers about children suggests that male patients and patients with ulcerative colitis have a higher risk of (colorectal) cancer, although also female patients and patients with Crohn’s Disease have an increased risk compared to reference populations. One study (Aardoom, 2018) suggests also that primary sclerosing cholangitis (PSC) might be associated with colorectal carcinoma. From literature in adults, known risk factors for colorectal cancer are: duration and severity of IBD, male sex, family history with a fist-degree relative having colorectal carcinoma before the age of 50 (Gausman, 2022). Obesity, physical inactivity and red meat intake are also often considered modifyable risk factors (Sninsky, 2022).
Method of screening
In recent years, the optimal method for colonoscopy surveillance has been a topic of discussion. Early literature has suggested that chromoendoscopy would be superior to conventional colonoscopy in detecting dysplasia or malignancy. However, subsequent studies have shown that chromoendoscopy requires an extremely clean bowel and takes more time per patient. When these factors are considered, chromoendoscopy does not show a significant difference compared to conventional colonoscopy (Te Groen, 2024). Endoscopist expertise and sufficient bowel preparation seem more important factors influencing colonoscopy outcomes.
Patient values and preferences
Several patient perspectives are important when considering colonoscopy surveillance for dysplasia or CRC:
- Risk: First and foremost should patients (and their caregivers) be informed that the chance of developing carcinoma during childhood is extremely small.
- Benefit: Early detection and treatment of dysplasia or carcinoma can prevent the need for more extensive and intensive treatment.
- Disadvantage: Colonoscopy is unpleasant because it requires bowel preparation with laxatives, and the sensation of the scope is often uncomfortable. Additionally, patients may experience anxiety about the procedure and its outcomes.
Specific considerations for pediatric patients:
- General anesthesia or deep sedation (with propofol) is used for children undergoing colonoscopy, making it more comfortable compared to adults who usually receive light sedation (with midazolam). Therefore, the patient might prefer to have the procedure done before turning 18.
Crohn & Colitis NL evaluated patient preferences (bijlage Resultaten vragenlijst Crohn Colitis), including those concerning surveillance colonoscopy. A total of 86 questionnaires were completed, of which 31 (36%) were filled out by the child with IBD alone, in 14 cases (16%), the child answered the questions together with one of the parents, and 41 times (48%) the questionnaire was completed solely by the parent. The question whether to undergo a surveillance colonoscopy before the age of 18 was answered by 77 respondents. A total of 38 respondents (49%) wished to undergo the surveillance colonoscopy before the age of 18. Respondents seem to consider undergoing a colonoscopy under anesthesia or deep sedation an important reason for having a screening before the age of 18: after being informed that a colonoscopy performed by a pediatrician is under sedation, 63 out of 76 respondents (83%) chose to have a first surveillance colonoscopy before the age of 18. Providing information about the risk of developing colorectal cancer helps alleviate the concerns of both parents and children, enabling them to collaboratively choose the best approach.
Costs
No cost-effectiveness analyses were available for colonoscopy screening of dysplasia or CRC in children with IBD. Screening is costly, because it must be performed on many patients, with few actually benefiting from it. Data from the national Dutch database (PALGA) over more than 30 years has not identified any CRC cases through screening.
Acceptability, feasibility and implementation
The absolute risk of developing dysplasia or CRC for children with IBD is extremely small. However, early detection of dysplasia or CRC is important, because missing such a serious diagnosis has significant consequences. Therefore, current international and European guidelines for pediatric gastroenterology suggest to screen children every one to two years (Bowlus, 2023: surveillance colonoscopy every 1-2 years from age of 15 onwards; Turner, 2018: every 1-2 years from 8-10 years after diagnosis ulcerative colitis; Oliva, 2018: every 1-2 years from age of 12 onwards). These defensive recommendations lead to overdiagnosis, despite the very low risk of CRC.
A prerequisite for performing surveillance colonoscopies is that the endoscopist is aware of the "best practice recommendations”. Therefore, involvement of colleagues from the adult gastroenterology department is essential.
Rationale of the recommendations
Despite the limited evidence from the literature, the absolute risk of developing CRC or its precursor before 18 years of age in children with IBD is extremely low. According to the national Dutch database (PALGA), no CRC cases have been detected in children with IBD over the past 30 years (publication expected in 2025). Additionally, no peaks in incidence were observed in young adults between 18 and 25 years of age, suggesting that the reported low risk of cancer in children is real and does not result from missed cases. In a recent publication regarding safety registration, including > 30.000 pediatric IBD patients, 4 CRC cases were reported, including 1 IBD patient with concomitant PSC, illustrating that the absolute risk of CRC in childhood is very low (Klomberg, 2024).
When considering the pros and cons of colonoscopy screening in children and adolescents, the working group concludes that colonoscopy surveillance is – in most cases – unnecessary in children with IBD below 18 years of age. At age 18, care is transferred to the adult gastroenterologist who is much more proficient in performing surveillance colonoscopy.
Exceptions can be made for children with IBD who may have an increased risk of CRC (beyond IBD itself), such as those with concomitant PSC, Lynch syndrome, or severe and prolonged disease activity of the colon.
Colonoscopy screening should be performed in adolescents with IBD from the age of 18, by an experienced gastroenterologist. The option of sedation should be discussed with the patient, and a propofol or similar program should be facilitated.
Onderbouwing
Achtergrond
Patients with Inflammatory Bowel Disease (IBD, including ulcerative colitis (UC), Crohn's disease (CD) and IBD-unclassified) have an increased risk of developing colorectal cancer (CRC). Age, duration of illness, disease activity, medication use, pseudopolyps, male gender, family history, and the presence of concomitant primary sclerosing cholangitis (PSC) appear to increase the likelihood. Improved treatment through the availability of biologicals, has likely reduced the incidence of CRC. It is unclear how high the risk of (mucosal) dysplasia or CRC is in childhood (from 12 years of age onwards). A risk-benefit analysis would be informative to decide upon performing (timing of) endoscopic surveillance in children with IBD. Surveillance via colonoscopy is invasive, burdensome because of bowel preparation and must be performed under general anesthesia, and therefore unpleasant for the patient. These disadvantages and the potential procedure-related risks must be weighed against the benefits of early detection and treatment in an extremely low percentage of patients, as the incidence of dysplasia and CRC is extremely low in children with IBD. Key outcome measures include preventing metastasis, more intensive treatments, and, in the worst case, mortality. Tools are needed to determine which pediatric IBD-patients benefit from surveillance and which patients derive no benefit from surveillance at all.
Conclusies / Summary of Findings
|
No GRADE |
No validated prediction models were found to determine which children with inflammatory bowel disease would benefit from colonoscopy surveillance during childhood. |
Samenvatting literatuur
Description of studies
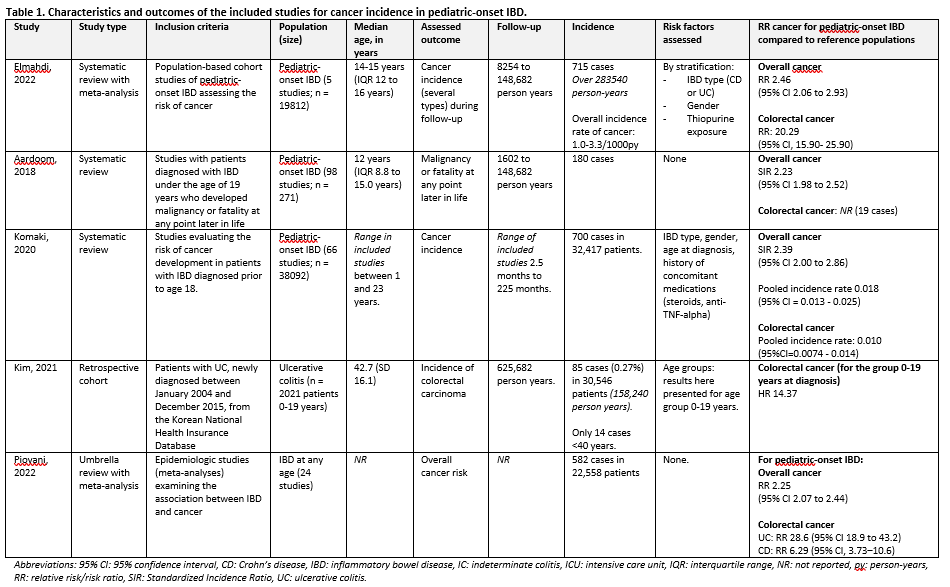
Three systematic reviews with meta-analysis were included (Elmahdi, 2022; Aardoom, 2018; Komaki, 2020), one umbrella review (Piovani, 2022), and one retrospective cohort study (Kim, 2021). All studies investigated the relative risk for cancer for pediatric-onset IBD, and two looked further into risk factors (Elmahdi, 2002; Komaki, 2020).
Three studies only included patients with pediatric-onset IBD (Elmahdi, 2022; Aardoom, 2018; Komaki, 2020), and two studies included also adults, but made a separate analysis for pediatric-onset IBD (Piovani, 2022; Kim, 2021). A summary of the included studies can be found in table 1.
Results
1. Overall cancer
All included studies show an approximate increased relative estimate of 2 to 2.5 times for the development of (overall) cancer (in most studies discovered during adulthood; see last column in table 1).
Elmahdi (2022) investigated some further risk factors for the development of cancer (compared to the reference population):
|
Study |
IBD subtype |
Sex |
|
Elmahdi (2022) |
CD: RR 2.03 (95% CI 1.67 to 2.46) UC: RR 2.61 (95% CI 2.00 to 3.41) |
Male: RR 3.23 (95% CI 2.35 to 4.45) Female: RR 2.45 (95% CI 0.93 to 6.46) |
With regard to exposure to concomitant medication, Elmahdi (2022) concludes no marked difference between thiopurine exposure or no thiopurine exposure, and Komaki (2020) that “the risk of overall cancer development was not particularly affected by the history of concomitant medications such as steroid, immunomodulator and anti-TNF agents”.
2. Colorectal cancer
Included studies show a marked increase in colorectal cancer in patients with pediatric-onset IBD. Elmahdi (2022) notes a 20-fold increase and Kim (2021) presents an HR of 14.37.
However, Elmahdi (2022) notes that “The mean incidence rates of cancer […] indicate that, despite markedly increased relative rate estimates for gastrointestinal cancers among patients with pediatric-onset IBD compared with general pediatric populations, this risk corresponds to a mean incidence rate […] of 0.6 cases of colorectal cancer per 1000 person-years in this population”. That the rate is low, is subscribed by Komaki (2020), who finds a (although markedly higher) pooled incidence rate of 0.010 (95% CI 0.0074 to 0.014).
2a. Colorectal cancer – IBD subtype
Two studies (Piovani, 2022: relative risk; and Komaki, 2020: incidence) reported the difference for colorectal cancer incidence for IBD subtype, both find a higher risk for colorectal cancer in patients with UC than in CD:
|
Study |
Crohn’s Disease (CD) |
Ulcerative colitis (UC) |
|
Piovani (2022) |
RR 6.29 (95% CI 3.73‒10.6) |
RR 28.6 (95% CI 18.9 to 43.2) |
|
Komaki (2020) |
Incidence 0.0075 (95% CI 0.0049 to 0.011) |
0.020 (95% CI 0.012 to 0.034) |
Piovani (2022) also reported that the risk of CRC was higher in patients with severe, extensive disease and pertained to the most-affected bowel segments.
2b. Colorectal cancer – Sex
The study by Komaki (2020) showed in a meta-regression that there was a positive correlation between the proportion of males and the risk of colorectal cancer (regression coefficient 0.072, 95% CI 0.046 to 0.097; suggestive of higher risk in males).
2c. Colorectal cancer – Age at diagnosis
The study by Komaki (2020) also found a negative correlation between the age at diagnosis or onset, and the risk of colorectal cancer (regression coefficient -0.36, 95% CI -0.45 to -0.28; suggestive of higher risk in patients with early onset disease).
2d. Colorectal cancer – Concomitant medications
According to meta-regression analyses by Komaki (2020), the risk of colorectal cancer development was not particularly affected by the history of concomitant medications such as steroids, immunomodulators, and anti-TNF agents.
Level of evidence of the literature
No level of evidence could be determined as no studies were included in this literature analysis that reported models predicting the development of colorectal carcinoma and/or dysplasia in pediatric patients with inflammatory bowel disease.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
Which children with IBD would benefit from colonoscopy surveillance (to detect malignancy at an early stage)?
| P: | Children with IBD |
| I: | Prediction model with presumed risk factors for malignancy, e.g.: age at diagnosis, disease duration, phenotype and localization of IBD, drug use, primary sclerosing cholangitis (PSC), sex, family with colorectal cancer <50 years of age, disease activity (clinical activity scores or biochemical parameters since diagnosis, number of hospitalizations, number of exacerbations, operations) |
| C: | Other model/no model |
| O: |
Model performance with outcome development of colorectal carcinoma or dysplasia (discrimination through area under the curve and/or calibration) Timing: Initiation of surveillance 8-10 years after diagnosis Setting: During follow-up visits |
Relevant outcome measures
The guideline development group considered area under the curve as a critical outcome measure for decision making.
The working group defined the performance of the included models as follows:
- 0.7≤AUC<0.8: acceptable,
- 0.8≤AUC<0.9: excellent,
- AUC≥0.9: outstanding.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms form 2000 until January 25th, 2023. The detailed search strategy is available upon request. The systematic literature search resulted in 211 hits. Studies were selected based on the following criteria:
- Reporting clinical prediction rules, prospective multivariable model or prediction model with dysplasia or colorectal carcinoma as dependent variable and IBD-specific risk factors as independent variables;
- The described models were at least internally validated (and preferably externally validated);
- The researched population were children with IBD;
- Studies were in English
No studies were initially selected based on the assessment of full text (n = 12), because of the lack of prediction rules and models. Therefore, a pragmatic selection was performed of studies focusing on the prevalence of pediatric colorectal cancer and associated risk factors.
After reassessing the full text of the twelve selected studies, seven studies were excluded (see the table with reasons for exclusion under the heading Evidence tables).
Results
Five studies were included in the analysis of the literature. Important study characteristics and results are shown in Table 1 Characteristics included studies for cancer incidence in pediatric onset. The assessment of the quality of the systematic reviews is summarized in the quality assessment table.
Referenties
- Aardoom MA, Joosse ME, de Vries ACH, Levine A, de Ridder L. Malignancy and Mortality in Pediatric-onset Inflammatory Bowel Disease: A Systematic Review. Inflamm Bowel Dis. 2018 Mar 19;24(4):732-741. doi: 10.1093/ibd/izx104. Erratum in: Inflamm Bowel Dis. 2019 Sep 18;25(10):e136. PMID: 29522170.
- Bowlus CL, Arrivé L, Bergquist A, Deneau M, Forman L, Ilyas SI, Lunsford KE, Martinez M, Sapisochin G, Shroff R, Tabibian JH, Assis DN. AASLD practice guidance on primary sclerosing cholangitis and cholangiocarcinoma. Hepatology. 2023 Feb 1;77(2):659-702. doi: 10.1002/hep.32771. Epub 2022 Oct 20. PMID: 36083140.
- Elmahdi R, Lemser CE, Thomsen SB, Allin KH, Agrawal M, Jess T. Development of Cancer Among Patients With Pediatric-Onset Inflammatory Bowel Disease: A Meta-analysis of Population-Based Studies. JAMA Netw Open. 2022 Mar 1;5(3):e220595. doi: 10.1001/jamanetworkopen.2022.0595. PMID: 35230438; PMCID: PMC8889462.
- Gausman V, Dornblaser D, Anand S, Hayes RB, O'Connell K, Du M, Liang PS. Risk Factors Associated With Early-Onset Colorectal Cancer. Clin Gastroenterol Hepatol. 2020 Nov;18(12):2752-2759.e2. doi: 10.1016/j.cgh.2019.10.009. Epub 2019 Oct 14. PMID: 31622737; PMCID: PMC7153971.
- Kim HM, Kim JH, Lee JK, Kang DR, Kim H, Kim SY, Kim HS. Age- and sex-specific risk of colorectal cancer in incident ulcerative colitis during the first 10 years after diagnosis: a nationwide population-based study. Scand J Gastroenterol. 2021 Nov;56(11):1279-1285. doi: 10.1080/00365521.2021.1958370. Epub 2021 Aug 10. PMID: 34376117.
- Klomberg RCW, Hellendoorn AE, Kemos P, Rizopoulos D, Ruemmele FM, Croft NM, de Ridder L; PIBD-SETQuality Safety Registry collaborators. Rare and severe adverse events in children with inflammatory bowel disease: analysis of data from the PIBD-SETQuality Safety Registry. Lancet Child Adolesc Health. 2024 Jun;8(6):422-432. doi: 10.1016/S2352-4642(24)00078-6. Epub 2024 Apr 30. PMID: 38697175.
- Komaki Y, Komaki F, Yamada A, Micic D, Ido A, Sakuraba A. Risk of Cancers in Patients with Pediatric Inflammatory Bowel Diseases: A Systematic Review and Meta-Analysis. J Pediatr. 2021 Feb;229:102-117.e36. doi: 10.1016/j.jpeds.2020.08.087. Epub 2020 Sep 6. PMID: 32898579.
- Oliva S, Thomson M, de Ridder L, Martín-de-Carpi J, Van Biervliet S, Braegger C, Dias JA, Kolacek S, Miele E, Buderus S, Bronsky J, Winter H, Navas-López VM, Assa A, Chong SKF, Afzal NA, Smets F, Shaoul R, Hussey S, Turner D, Cucchiara S. Endoscopy in Pediatric Inflammatory Bowel Disease: A Position Paper on Behalf of the Porto IBD Group of the European Society for Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr. 2018 Sep;67(3):414-430. doi: 10.1097/MPG.0000000000002092. PMID: 30130311.
- Piovani D, Hassan C, Repici A, Rimassa L, Carlo-Stella C, Nikolopoulos GK, Riboli E, Bonovas S. Risk of Cancer in Inflammatory Bowel Diseases: Umbrella Review and Reanalysis of Meta-analyses. Gastroenterology. 2022 Sep;163(3):671-684. doi: 10.1053/j.gastro.2022.05.038. Epub 2022 May 26. PMID: 35643170.
- Sninsky JA, Shore BM, Lupu GV, Crockett SD. Risk Factors for Colorectal Polyps and Cancer. Gastrointest Endosc Clin N Am. 2022 Apr;32(2):195-213. doi: 10.1016/j.giec.2021.12.008. Epub 2022 Feb 22. PMID: 35361331.
- Te Groen M, Derks M, den Broeder N, Peters C, Dijkstra G, de Vries A, Romkens T, Horjus C, de Boer N, de Jong M, Nagtegaal I, Derikx L, Hoentjen F. Quality of Surveillance Impacts the Colitis-Associated Advanced Neoplasia Risk: A Multicenter Case-Control Study. Clin Gastroenterol Hepatol. 2024 Feb;22(2):357-367.e5. doi: 10.1016/j.cgh.2022.12.010. Epub 2022 Dec 23. PMID: 36572110.
- Turner D, Ruemmele FM, Orlanski-Meyer E, Griffiths AM, de Carpi JM, Bronsky J, Veres G, Aloi M, Strisciuglio C, Braegger CP, Assa A, Romano C, Hussey S, Stanton M, Pakarinen M, de Ridder L, Katsanos K, Croft N, Navas-López V, Wilson DC, Lawrence S, Russell RK. Management of Paediatric Ulcerative Colitis, Part 1: Ambulatory Care-An Evidence-based Guideline From European Crohn's and Colitis Organization and European Society of Paediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr. 2018 Aug;67(2):257-291. doi: 10.1097/MPG.0000000000002035. Erratum in: J Pediatr Gastroenterol Nutr. 2020 Dec;71(6):794. doi: 10.1097/MPG.0000000000002967. PMID: 30044357.
Evidence tabellen
Table quality assessment of included systematic reviews
|
Study |
Comprehensive and systematic literature search? |
Description of included and excluded studies? |
Description of relevant characteristics of included studies? |
Assessment of scientific quality of included studies? |
|
Elmahdi, 2022 |
Yes; Supplement 1 available for search strategy Ovid and Medline. Searched until October 31, 2021. |
No; No reference to excluded studies available. |
Yes; Table 1 in article. |
Yes; Newcastle-Ottawa scale used and reported in Table 1. |
|
Aardoom, 2018 |
Yes; Supplement available for search strategy in multiple databases. Searched until June 1, 2017. |
No; No reference to excluded studies available. |
Partially; Description of characteristics only available for those used for pooled analysis. |
Partially; Newcastle-Ottawa scale used, but only reported for the studies included in the pooled analysis. |
|
Komaki, 2020 |
Yes; Supplement available for search strategy in multiple databases. Searched until June 30, 2018. |
No; No reference to excluded studies available. |
Yes; Table 3 in article. |
Yes; Cochrane RoB tool, Jadad score and Newcastle-Ottawa scale used, reported in Table 2 and 3. |
|
Piovani, 2022 |
Yes; Supplement available for search strategy in multiple databases. Searched until May 10, 2021. |
No; No reference to excluded studies available |
No; No table with overview of included systematic reviews. |
Yes; AMSTAR2 rating for all studies, available in supplement. |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
AlZaabi A, AlHarrasi A, AlMusalami A, AlMahyijari N, Al Hinai K, ALAdawi H, Al-Shamsi HO. Early onset colorectal cancer: Challenges across the cancer care continuum. Ann Med Surg (Lond). 2022 Aug 22;82:104453. doi: 10.1016/j.amsu.2022.104453. PMID: 36268309; PMCID: PMC9577444. |
Wrong publication type |
|
Duricova D, Fumery M, Annese V, Lakatos PL, Peyrin-Biroulet L, Gower-Rousseau C. The natural history of Crohn's disease in children: a review of population-based studies. Eur J Gastroenterol Hepatol. 2017 Feb;29(2):125-134. doi: 10.1097/MEG.0000000000000761. PMID: 27748673. |
Systematic review of insufficient quality |
|
Fumery M, Duricova D, Gower-Rousseau C, Annese V, Peyrin-Biroulet L, Lakatos PL. Review article: the natural history of paediatric-onset ulcerative colitis in population-based studies. Aliment Pharmacol Ther. 2016 Feb;43(3):346-55. doi: 10.1111/apt.13478. Epub 2015 Nov 18. PMID: 26582737. |
Systematic review of insufficient quality |
|
Siegel CA, Sands BE. Risk factors for colorectal cancer in Crohn's colitis: a case-control study. Inflamm Bowel Dis. 2006 Jun;12(6):491-6. doi: 10.1097/00054725-200606000-00008. PMID: 16775493. |
Includes adults |
|
van Rheenen PF, Aloi M, Assa A, Bronsky J, Escher JC, Fagerberg UL, Gasparetto M, Gerasimidis K, Griffiths A, Henderson P, Koletzko S, Kolho KL, Levine A, van Limbergen J, Martin de Carpi FJ, Navas-López VM, Oliva S, de Ridder L, Russell RK, Shouval D, Spinelli A, Turner D, Wilson D, Wine E, Ruemmele FM. The Medical Management of Paediatric Crohn's Disease: an ECCO-ESPGHAN Guideline Update. J Crohns Colitis. 2020 Oct 7:jjaa161. doi: 10.1093/ecco-jcc/jjaa161. Epub ahead of print. PMID: 33026087. |
Does not include surveillance topic |
|
Arai N, Kudo T, Tokita K, Kyodo R, Sato M, Miyata E, Hosoi K, Ikuse T, Jimbo K, Ohtsuka Y, Shimizu T. Expression of Oncogenic Molecules in Pediatric Ulcerative Colitis. Digestion. 2022;103(2):150-158. doi: 10.1159/000519559. Epub 2021 Oct 29. PMID: 34718239; PMCID: PMC8985031. |
No prognostic model |
|
Eaden JA, Abrams KR, Mayberry JF. The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut. 2001 Apr;48(4):526-35. doi: 10.1136/gut.48.4.526. PMID: 11247898; PMCID: PMC1728259. |
Systematic review of insufficient quality |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 10-02-2025
Beoordeeld op geldigheid : 07-02-2025
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodules werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). Patiëntenparticipatie (in de vorm van een achterbanuitvraag) bij deze richtlijn werd medegefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor kinderen met inflammatoire darmziekten.
Werkgroep
- prof. dr. J.C. (Hankje) Escher, kinderarts-MDL, Erasmus MC, Rotterdam, namens de NVK
- dr. J.E. (Johan) van Limbergen, kinderarts-MDL, Amsterdam UMC, namens de NVK
- dr. L. (Lissy) de Ridder, kinderarts-MDL, Erasmus MC, Rotterdam, namens de NVK
- dr. L.J.J. (Luc) Derijks, ziekenhuisapotheker - klinisch farmacoloog, Máxima MC en Maastricht UMC, namens de NVZA
- drs. M.P. (Menne) Scherpenzeel, patiëntvertegenwoordiger, namens Crohn & Colitis Nederland
- dr. P.F. (Patrick) van Rheenen (voorzitter), kinderarts-MDL, UMC Groningen, namens de NVK
- S. (Suzanne) van Zundert, diëtist kindergeneeskunde, Amsterdam UMC, namens de NVD
- dr. T.G.J. (Tim) de Meij, kinderarts-MDL, Amsterdam UMC, namens de NVK
Klankbordgroep
De klankbordgroepleden hebben gedurende de ontwikkeling van de richtlijn meegelezen met de conceptteksten en deze becommentarieerd.
- drs. C. (Carmen) Willemsen-Vermeer, diëtist, Radboud UMC, Nijmegen, namens de NVD
- dr. D.R. (Dennis) Wong, ziekenhuisapotheker - klinisch farmacoloog, Zuyderland Medisch Centrum, locatie Sittard-Geleen, namens de NVZA
- drs. F.D.M. (Fiona) van Schaik, arts-MDL, UMC Utrecht, namens de NVMDL
- drs. I.A. (Imke) Bertrams-Maartens, kinderarts-MDL, Máxima MC, namens de NVK
- drs. M. (Marieke) Zijlstra, kinderarts-MDL, Maasstad ziekenhuis, Rotterdam, namens de NVK
- drs. M.A.C. (Martha) van Gaalen, verpleegkundig specialist kinder-MDL, Erasmus MC, Rotterdam, namens de V&VN
Met ondersteuning van
- dr. M.M.J. (Machteld) van Rooijen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- drs. L.C. (Laura) van Wijngaarden, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
J.C. (Hankje) Escher |
Kinderarts-MDL, Erasmus MC Sophia |
E-dokter bij Cyberpoli van Stichting Artsen voor Kinderen (onbetaald) Scientific Advisory Committee Develop Registry - Jansen (betaling via ziekenhuis, ter ondersteuning van research) Scientific Advisory Committee van Cape Registry - Abbvie (betaling via ziekenhuis, ter ondersteuning van research) Programma commissie Jeugdartsen congres - Nutricia (betaling via ziekenhuis, ter ondersteuning van research) |
Abbvie, project Trasnitie coordinator Erasmus MC, projectleider MSD, project Biomarkers voor anti-TNF respons bij kinder-IBD, projectleider Stichting Theia, project HAPPY-IBD screen, angst en depressie bij kinder-IBD |
Restricties t.a.v. besluitvorming rondom Biomarkers voor anti-TNF respons. |
|
J.E. (Johan) van Limbergen |
Kinderarts-MDL, Amsterdam UMC |
Nestle Health Science: seminarie 4x/jaar |
Janssen, Nestle Health Science, Novalac Klinisch, translationeel en fundamenteel onderzoek naar voedingstherapie bij kinderen en volwassenen: genetica, microbioom, metaboloom, biomarkers. |
Restricties t.a.v. besluitvorming rondom voedingsinterventies. |
|
L. (Lissy) de Ridder |
Kinderarts-MDL, Erasmus MC |
Bestuurslid NVK (onbezoldigd) Scientific secretary ESPGHAN (onbezoldigd) Voorzitter P-ECCO (onbezoldigd) |
PIBD congres met symposium over integratie wetenschappelijk onderzoek binnen de kinder IBD patiëntenzorg (Janssen); webinars over biosimilarts (speaker's fee Pfizer).
Projectleider (PI) van investigator-initiated TISKids trial (ZonMW, Pfizer levert medicatie en restricted grant voor follow-up studie; heeft geen inbreng op protocol, data-analyse). Verdere medewerking (local investigator) aan klinische trials (Takeda, Abbvie, Ei Lilly). |
Restricties t.a.v. besluitvorming rondom TNF-alpha medicatie/ TDM |
|
L. (Luc) Derijks |
Ziekenhuisapotheker - klinisch farmacoloog, Máxima MC en Maastricht UMC |
Onderwijs (webinar, e-learning, college): webinar in opdracht van Takeda (betaald), e-learning in opdracht van Ferring (betaald), hoorcolleges UU (onbetaald). |
Geen. |
Geen. |
|
M.P. (Menne) Scherpenzeel |
Directeur, Crohn & Colitis Nederland |
Partner adviesbureau Blauwe Noordzee Diverse onbezoldigde bestuursfuncties |
Wij worden betrokken bij extern gefinancierd onderzoek van derden voor het patiëntenperspectief. Het werk van Crohn & Colitis NL wordt mede mogelijk gemaakt door pharma. |
Input patiëntenorganisatie voor alle te ontwikkelen modules middels uitvraag via achterban. |
|
P.F. (Patrick) van Rheenen |
Kinderarts-MDL, UMC Groningen |
Kinderarts lid van Medisch-Ethische Toetsingscomissie van UMCG (vacatiegelden) |
PI van een investigator-initiated onderzoeksproject mede gefinacierd door Europese Crohn en Colitis Organisatie (ECCO). Materiaal voor calprotectine sneltests zijn gedoneerd door BÜHLMANN Laboratories (beide geen invloed op opzet, uitvoering, analyse en rapportage van onderzoek). |
Geen. |
|
S. (Suzanne) van Zundert |
Diëtist kindergeneeskunde, Amsterdam UMC |
Bestuursfunctie Nederlandse KinderDiëtisten (NKD, onder de NVD) |
PECDED, Nestle Health Science: Patiëntervaring van ouders/kinderen bij voedingstherapie CDED. Participatie in wetenschappelijke onderzoeken die binnen de kinder-MDL afdeling van het Amsterdam UMC worden gedaan. |
Geen. |
|
T.G.J. (Tim) de Meij |
Kinderarts-MDL, Amsterdam UMC |
Lid advisory board Nutricia (vergoeding voor onderzoek) |
Principal investigator (PI) van industry-initiated study fase 3 naar tofacitinib (Pfizer). co-PI van investigator-initiated RCT naar probiotica bij antibiotica-geassocieerde diarree gedeeltelijk gesponsord door Winclove (restricted grant, toegekend bij minimum aantal inclusies). Unrestricted grant van Nutricia voor microbioomanalyse op fecessample van kinderen bij wie moeder antibiotica heeft gehad tijdens sectio caesaria. |
Restricties t.a.v. besluitvorming rondom voedingsinterventies. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de patiëntenvereniging Crohn&Colitis NL in de werkgroep en een enquête onder alle leden van Crohn&Colitis NL. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie kop ‘Waarden en voorkeuren van patiënten’). De conceptrichtlijn is tevens ter commentaar voorgelegd aan Crohn&Colitis NL en Patiëntenfederatie Nederland, en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Binnen het SKMS project “Inventarisatie en optimalisatie modulair onderhoud richtlijn kindergeneeskunde” is breed geïnventariseerd welke kindergeneeskundige modules toe waren aan herziening, en er is een onderhoudsplan opgeleverd. De vijf modules van deze richtlijn, herzien in 2022-2024, kwamen uit dit project naar voren. De modules zijn kritisch beoordeeld en de uitgangsvraag en zoekvraag werden aangepast of aangescherpt.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit.
http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Algemene informatie
|
Cluster/richtlijn: NVK Inflammatoire darmziekten bij kinderen |
|
|
Uitgangsvraag/modules: UV3 Wat is het risico op colorectaal carcinoom (vóór het 18e levensjaar) en is het van belang om surveillance colposcopie uit te voeren op de kinderleeftijd bij IBD (zowel CU als ZvC)? |
|
|
Database(s): Embase.com, Ovid/Medline |
Datum: 25 januari 2023 |
|
Periode: vanaf 2000 |
Talen: geen restrictie |
|
Literatuurspecialist: Alies van der Wal |
|
|
BMI-zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: Voor deze vraag is gezocht op de elementen: IBD Kinderen Colorectaal carcinoom/ dysplasie/ risico op kanker De sleutelartikelen worden gevonden met deze search |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
120 |
41 |
137 |
|
RCT |
64 |
19 |
74 |
|
Observationele studies |
1015 |
253 |
1178 |
|
Totaal |
184 |
60 |
211* |
*in Rayyan
Zoekstrategie
Embase.com
|
No. |
Query |
Results |
|
#11 |
#5 AND #8 NOT (#9 OR #10) = observationeel |
1015 |
|
#10 |
#5 AND #7 NOT #9 = RCT |
64 |
|
#9 |
#5 AND #6 = SR |
120 |
|
#8 |
'major clinical study'/de OR 'clinical study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) OR 'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) OR 'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
16324270 |
|
#7 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
2008761 |
|
#6 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
895716 |
|
#5 |
#4 AND [2000-2023]/py NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
1716 |
|
#4 |
#1 AND #2 AND #3 |
3059 |
|
#3 |
'cancer incidence'/exp OR 'cancer risk'/exp OR 'cancer mortality'/exp OR 'childhood mortality'/exp OR 'colitis-associated cancer'/exp OR 'colon tumor'/exp OR 'rectum tumor'/exp OR 'colorectal tumor'/exp OR 'metastatic colorectal cancer'/exp OR 'gastrointestinal dysplasia'/exp OR 'precancer'/exp OR crc:ti,ab,kw OR 'gastrointestinal cancer*':ti,ab,kw OR (('neoplasm'/exp OR carcino*:ti,ab,kw OR adenocarcino*:ti,ab,kw OR neoplas*:ti,ab,kw OR sarcoma*:ti,ab,kw OR adenoma*:ti,ab,kw OR cancer*:ti,ab,kw OR oncolog*:ti,ab,kw OR melanom*:ti,ab,kw OR lymphom*:ti,ab,kw OR leukemi*:ti,ab,kw OR malignan*:ti,ab,kw OR carcinogen*:ti,ab,kw OR oncogen*:ti,ab,kw OR anticarcinogen*:ti,ab,kw OR precancer*:ti,ab,kw OR praecancer*:ti,ab,kw OR premalignan*:ti,ab,kw OR preneoplas*:ti,ab,kw OR paraneoplastic:ti,ab,kw OR neuroma*:ti,ab,kw OR blastoma*:ti,ab,kw OR meningioma*:ti,ab,kw OR lymphangioma*:ti,ab,kw OR lymphangiomyoma*:ti,ab,kw OR lymphangiosarcoma*:ti,ab,kw OR 'hodgkin disease':ti,ab,kw OR plasmacytoma*:ti,ab,kw OR carcinosarcoma*:ti,ab,kw OR hepatoblastoma*:ti,ab,kw OR mesenchymoma*:ti,ab,kw OR 'dysplasia':ti,ab,kw) AND (colorectal*:ti,ab,kw OR colon:ti,ab,kw OR rectal*:ti,ab,kw)) |
951124 |
|
#2 |
'adolescent'/exp OR 'baby'/exp OR 'boy'/exp OR 'child'/exp OR 'minors'/exp/mj OR 'pediatric patient'/exp OR 'pediatrics'/exp OR 'schoolchild'/exp OR infan*:ti,ab OR newborn*:ti,ab OR 'new born*':ti,ab OR perinat*:ti,ab OR neonat*:ti,ab OR baby*:ti,ab OR babies:ti,ab OR toddler*:ti,ab OR minors*:ti,ab OR boy:ti,ab OR boys:ti,ab OR boyfriend:ti,ab OR boyhood:ti,ab OR girl*:ti,ab OR kid:ti,ab OR kids:ti,ab OR child*:ti,ab OR children*:ti,ab OR schoolchild*:ti,ab OR adolescen*:ti,ab OR juvenil*:ti,ab OR youth*:ti,ab OR teen*:ti,ab OR pubescen*:ti,ab OR pediatric*:ti,ab OR paediatric*:ti,ab OR peadiatric*:ti,ab OR school*:ti,ab OR prematur*:ti,ab OR preterm*:ti,ab |
5604009 |
|
#1 |
'inflammatory bowel disease'/exp OR 'pancolitis'/exp OR 'enterocolitis'/exp OR ((inflammatory NEAR/3 bowel NEAR/3 dis*):ti,ab,kw) OR ibd:ti,ab,kw OR pibd:ti,ab,kw OR crohn*:ti,ab,kw OR 'cleron dis*':ti,ab,kw OR 'colitis ulcer*':ti,ab,kw OR 'ulcerative col*':ti,ab,kw OR 'idiopathic proctocol*':ti,ab,kw OR 'colitis gravis':ti,ab,kw OR 'regional enteritis':ti,ab,kw OR 'ulcerative proctocol*':ti,ab,kw OR 'ulcerative procto col*':ti,ab,kw OR 'ulcerative proctitis*':ti,ab,kw OR 'mucosal colitis':ti,ab,kw OR 'ulcerous colit*':ti,ab,kw OR ((granulomatous NEAR/3 (ileit* OR enteriti*)):ti,ab,kw) OR ileocolit*:ti,ab,kw OR pancolit*:ti,ab,kw OR enterocolit*:ti,ab,kw |
264847 |
Ovid/Medline
|
# |
Searches |
Results |
|
12 |
(6 and 9) not (10 or 11) = observationeel |
253 |
|
11 |
(6 and 7) not 10 = RCT |
19 |
|
10 |
6 and 8 = SR |
41 |
|
9 |
Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) or Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ or exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. |
8110620 |
|
8 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
646941 |
|
7 |
exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf. |
1583830 |
|
6 |
limit 5 to yr="2000 -Current" |
524 |
|
5 |
4 not (comment/ or editorial/ or letter/) not ((exp animals/ or exp models, animal/) not humans/) |
671 |
|
4 |
1 and 2 and 3 |
687 |
|
3 |
Colorectal Neoplasms/ or Precancerous Conditions/ or exp *Mortality/ or crc.ti,ab,kf. or 'gastrointestinal cancer*'.ti,ab,kf. or ((exp Neoplasms/ or carcino*.ti,ab,kf. or adenocarcino*.ti,ab,kf. or neoplas*.ti,ab,kf. or sarcoma*.ti,ab,kf. or adenoma*.ti,ab,kf. or cancer*.ti,ab,kf. or oncolog*.ti,ab,kf. or melanom*.ti,ab,kf. or lymphom*.ti,ab,kf. or leukemi*.ti,ab,kf. or malignan*.ti,ab,kf. or carcinogen*.ti,ab,kf. or oncogen*.ti,ab,kf. or anticarcinogen*.ti,ab,kf. or precancer*.ti,ab,kf. or praecancer*.ti,ab,kf. or premalignan*.ti,ab,kf. or preneoplas*.ti,ab,kf. or paraneoplastic.ti,ab,kf. or neuroma*.ti,ab,kf. or blastoma*.ti,ab,kf. or meningioma*.ti,ab,kf. or lymphangioma*.ti,ab,kf. or lymphangiomyoma*.ti,ab,kf. or lymphangiosarcoma*.ti,ab,kf. or 'hodgkin disease'.ti,ab,kf. or plasmacytoma*.ti,ab,kf. or carcinosarcoma*.ti,ab,kf. or hepatoblastoma*.ti,ab,kf. or mesenchymoma*.ti,ab,kf. or 'dysplasia'.ti,ab,kf.) and (colorectal* or colon or rectal*).ti,ab,kf.) |
415162 |
|
2 |
(child* or schoolchild* or infan* or adolescen* or pediatri* or paediatr* or neonat* or boy or boys or boyhood or girl or girls or girlhood or youth or youths or baby or babies or toddler* or childhood or teen or teens or teenager* or newborn* or postneonat* or postnat* or puberty or preschool* or suckling* or picu or nicu or juvenile?).tw. |
2850512 |
|
1 |
exp Inflammatory Bowel Diseases/ or exp Enterocolitis/ or (inflammatory adj3 bowel adj3 dis*).ti,ab,kf. or ibd.ti,ab,kf. or pibd.ti,ab,kf. or crohn*.ti,ab,kf. or 'cleron disease*'.ti,ab,kf. or 'idiopathic proctocol*'.ti,ab,kf. or 'colitis gravis'.ti,ab,kf. or 'colitis ulcer*'.ti,ab,kf. or 'ulcerative col*'.ti,ab,kf. or 'regional enteritis'.ti,ab,kf. or 'ulcerative proctocol*'.ti,ab,kf. or 'ulcerative procto col*'.ti,ab,kf. or 'ulcerative proctitis*'.ti,ab,kf. or 'mucosal colitis'.ti,ab,kf. or 'ulcerous colit*'.ti,ab,kf. or (granulomatous adj3 (ileit* or enteriti*)).ti,ab,kf. or ileocolit*.ti,ab,kf. or pancolit*.ti,ab,kf. or enterocolit*.ti,ab,kf. |
161895 |