Corticosteroïden bij bacteriële keratitis
Uitgangsvraag
Wat is de plaats van corticosteroïden bij de behandeling van infectieuze bacteriële keratitis?
Aanbeveling
Voeg geen lokale corticosteroïden toe tijdens de startfase van behandeling van een bacteriële keratitis
Overweeg starten van een lokaal corticosteroïd bij een bacteriële keratitis:
- Niet eerder dan 2 weken na starten van effectieve antibiotische therapie (o.b.v. gevoeligheid)
- Alleen wanneer menginfecties zijn uitgesloten (Acanthamoeba, schimmel) en een kweekuitslag voorhanden is
- Alleen bij een verbetering of stabiel beeld van de keratitis
Bespreek met patiënt het beperkte effect van de behandeling met corticosteroïden (klinisch geen effectieve verbetering, een transplantatie is niet zeker te voorkomen) en het nadeel van het maskerend effect van corticosteroïden.
Continueer antibiotische dekking tijdens corticosteroïdgebruik en niet gesloten epitheel.
Documenteer de argumentatie betreffende het starten met corticosteroïden
Let op oogdruk(verhoging) bij inflammatie én corticosteroïd gebruik.
Wees alert op klinische verslechtering van een Pseudomonas aeruginosa keratitis na aanvankelijke verbetering op behandeling, als corticosteroïden gestart worden (na 2 weken).
Vermijd corticosteroïd gebruik bij Nocardia spp. keratitis.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek gedaan naar de effectiviteit en veiligheid van het toevoegen van corticosteroïden aan lokale antibiotische therapie voor de behandeling van bacteriële keratitis.
Er zijn vier gerandomiseerde trials gevonden die behandeling van bacteriële keratitis met corticosteroïden en antibiotica vergeleken hebben met behandeling met enkel antibiotica. Deze studies laten geen klinisch relevante verschillen zien op de cruciale uitkomstmaten grootte van infiltraat en visus, tussen behandeling met- of zonder topicale corticosteroïden. Op basis van deze gevonden resultaten lijkt het toevoegen van topicale corticosteroïden aan behandeling met antibiotica dus geen voordelige effecten te hebben op visus of infiltraat grootte bij patiënten met een bewezen bacteriële keratitis. De à priori bewijskracht voor deze effecten was in 3 van de 4 studies laag door de kleine groepsgrootte van de te vergelijken behandelingen. De SCUT-trial onderzocht wel grotere groepen (250 ogen in elke studie arm), echter kunnen factoren zoals de wijze van visus meting (alleen brilcorrectie en geen harde contactlens trial) en een uitval van 12% in de 3 maanden follow-up van invloed zijn geweest op de uitkomst. Ook op de belangrijke uitkomstmaten tijd tot epitheelgenezing en bijwerkingen werden geen klinisch relevante verschillen gevonden tussen behandeling met topicale corticosteroïden en behandeling zonder topicale corticosteroïden. De à priori bewijskracht voor deze effecten van deze belangrijke uitkomstmaten is laag.
In de trial van Srinivasan (2012) zijn meerdere subgroep analyses gedaan (13 in totaal). Deze analyses lieten zien dat er bij ogen met een visus £ 1/60 (n = 117) of een keratitis die het gehele centrum bedekte (“4 mm pupil”; n = 104) statistisch significante verschillen zijn in visus tussen behandeling met topicale corticosteroïden en behandeling zonder corticosteroïden. In patiënten met een baseline visus van £ 1/60 was dit verschil -0.17 logMAR (95% BI –0,31 tot -0,02) en voor patiënten met een centrale keratitis was dit verschil -0.20 logMAR (95% BI −0.37 tot −0.04), beide in het voordeel van behandeling met corticosteroïden. Hoewel er dus net een statistisch significant verschil tussen de 2 behandelgroepen werd gevonden, zijn deze resultaten klinisch niet significant gezien de vooraf afgesproken (en internationaal geaccepteerde) grenswaarde van 2 regels visus verschil op de ETDRS (0,2 LogMAR). Het risico bestaat dat de onderzoekers gezocht hebben naar statistisch significante verschillen door verschillende subgroep analyses te verrichten.
Een Cochrane analyse van precies de 4 studies welke in deze module werden beoordeeld kwam ook tot de conclusie dat er geen adequaat bewijs is dat corticosteroïden bij patiënten met een bacteriële keratitis een gunstig effect hebben en veilig zijn (Herretes, 2014). In de Cochrane analyse werden als oorzaken hiervoor de hoge uitval bij follow-up en een te lage power aangewezen. Mogelijk zouden de uitkomsten anders zijn geweest al er in plaats van een brillenglas gecorrigeerde visus op 3 maanden, de visus was gemeten met een harde contactlens om het effect van irregulair astigmatisme te elimineren. Ook kan beargumenteerd worden dat de resultaten van de SCUT-trial mogelijk niet te extrapoleren zijn naar de Europese situatie met een milder klimaat, veel meer contactlensdragers (en dus meer Pseudomonas aeruginosa keratitis) en aanzienlijk minder Nocardia spp. infecties. De subgroep analyse bij patiënten met Nocardia spp. ulcus laat zien dat toepassing van corticosteroïden juist in een groter litteken resulteerde (0.47mm, 95% BI, 0.06 tot 0.88, p=0.02). Uit case reports en op basis van eigen ervaringen concludeert de werkgroep tevens dat bij casus van Pseudomonas aeruginosa keratitis extra voorzichtigheid is geboden, echter de literatuur is hier niet eenduidig (Cohen, 2009). In de SCUT-trial waren contactlensdragers ondervertegenwoordigd waardoor de vraag is in hoeverre de resultaten van de SCUT-trial (volledig) op de Nederlandse populatie toepasbaar zijn.
In de geïncludeerde studies werd het lokale corticosteroïd 4dd toegepast vanaf 24-48 uur na de start van de antibiotische therapie. In de grootste studie (SCUT-trial; Srinivasan 2012) werd prednisolon fosfaat 1% gebruikt in een schema van 1week 4dd, 1 week 2dd en 1 week 1dd, waarna werd gestopt. Antibiotische dekking moet altijd voortgezet worden zolang corticosteroïden toegepast worden en er nog een epitheeldefect is. Tevens is een corticosteroïd (1% Prednisolon fosfaat) gebruikt dat in Nederland niet op de markt is.
In de geïncludeerde studies zijn schimmels en Acanthamoeba infecties geëxcludeerd. Dit is cruciaal gezien de absolute contra-indicatie voor corticosteroïden bij deze verwekkers. Reden hiervoor is dat er maskering kan optreden en een aantoonbaar slechtere uitkomst door niet juiste therapeutische keuze. Het is dan ook noodzakelijk dat deze verwekkers uitgesloten zijn. Het risico op menginfecties is in onderzochte populaties in het Verenigd Koninkrijk en Australië gemiddeld 1 op 25 (Khoo, 2020; Tan, 2017; Ting, 2018; Ting, 2021).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Voor de patiënt staat voorop dat de infectie onderdrukt wordt. Het ontwikkelen van een litteken is een onvermijdelijk gevolg van een ernstige bacteriële keratitis. Bij een centraal gelegen ulcus zal de dichtheid van het ulcus de visus bepalen, evenals de irregulariteit van het cornea oppervlak. Bij een irregulaire cornea met ijl litteken kan een contactlens de visus verbeteren. Bij de geïncludeerde studies is brilcorrectie gemeten (na 3 maanden), echter niet de visus met contactlens. Er kan dus geen genuanceerde uitspraak gedaan worden over de noodzaak op termijn van een cornea transplantatie en derhalve van het nut van toepassen van de corticosteroïden.
De toepassing van de corticosteroïden zal de inflammatie verminderen en daarmee in voorkomende gevallen de heftige pijn passend bij een bacteriële keratitis helpen verminderen. Hierbij dient te worden aangetekend dat de pijn bij een bacteriële keratitis voornamelijk veroorzaakt wordt door ontsteking van het voorsegment en het epitheeldefect, waarvan de genezing voornamelijk afhangt van de initiële grootte van het epitheeldefect en de bestrijding van de infectie door antibiotica. Antibiotische behandeling van de keratitis speelt een cruciale rol in de pijnbestrijding.
Betreffende de belangrijkste uitkomstmaat (eindvisus) is er geen beslissende rol voor de patiënt weggelegd, aangezien het effect van corticosteroïden op deze uitkomst klein is en effect verschillen alleen bij vergelijking van grote cohorten gemeten kunnen worden. Indien een keratitis al enkele weken succesvol met antibiotica behandeld wordt en de pijnklachten nog intens zijn terwijl niet-bacteriële oorzaken van een pijnlijke keratitis (zoals Acanthamoeba keratitis) uitgesloten zijn, kan toevoeging van een corticosteroïd overwogen worden. In deze besluitvorming kan de patiënt een rol spelen. Toename van de belasting door toevoeging van een lokaal corticosteroïd is laag, er zou slechts 3-6 keer per dag extra gedruppeld moeten worden. Wel dient rekening gehouden te worden met een eventueel effect op de oogdruk, met name bij patiënten die in de voorgeschiedenis al een zogenoemde ‘corticosteroïd respons’ op de oogdruk doormaakten.
In de SCUT-trial (Srinivasan, 2012) werd prednisolon fosfaat 1% gebruikt. Het is de vraag of voor pijnbestrijding een minder sterkwerkend corticosteroïd (met minder kans op een effect op de oogdruk) niet even effectief is. Wellicht is het aan te bevelen om een dergelijk middel (bijvoorbeeld fluorometholon) eerst te proberen, zeker bij ogen die eerder een corticosteroïd respons op de oogdruk lieten zien.
Kosten (middelenbeslag)
Kosten van toevoeging van een lokaal corticosteroïd zijn laag, er zou slechts 3-6 keer per dag extra gedruppeld moeten worden met goedkope oogdruppels.
Aanvaardbaarheid, haalbaarheid en implementatie
Zowel antibiotica als corticosteroïden zijn gemakkelijk ter verkrijgen in Nederland. De werkgroep verwacht weinig barrières bij de implementatie van de aanbeveling.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies.
Uit de geïncludeerde studies concludeert de werkgroep dat het toepassen van corticosteroïden geen overtuigend bewezen positief effect heeft op de visus met brilcorrectie (BSCVA), de epitheelgenezing, de grootte van het infiltraat of litteken en de aard en omvang van de bijwerkingen. Deze conclusie is volledig in lijn met een eerder uitgevoerde Cochrane analyse (Herretes, 2014). In een subgroep waarbij keratitis werd door Nocardia spp., was het effect van corticosteroïden zelfs nadelig. Alleen wanneer de initiële visus lager is dan 1/60 of het infiltraat voor de pupil is gelegen kan enige winst met betrekking op de visus bereikt worden. Dit gaat dan om een visuswinst van minder dan 2 Snellen regels (0,17 LogMAR, gecorrigeerd voor de visus bij aanvang van de behandeling). Hoewel dit effect statistisch significant was (n = 117; 95% BI: -0,31 tot -0,02; p = -0,3) wordt een verschil in visus van 0,2 LogMAR in het algemeen als grens gehanteerd voor klinische significantie. Dat laatste verschil werd alleen precies behaald bij patiënten met een groot pre-pupillair infiltraat (n = 97; 95% BI -0,31 tot -0,04, p = 0,02), de andere 12 sub-analyses kwamen niet tot statistische significantie. De vraag of dit een visus verbeterende corneatransplantatie op termijn zal voorkomen is in de studie niet beantwoord en mogelijk waren de uitkomsten anders geweest indien de visus ook met harde contactlens was gemeten en geanalyseerd. Er was een forse uitval van patiënten tijdens de follow-up in de SCUT-trial (en ook in de 3 andere geïncludeerde studies). Aangezien een overgrote meerderheid van de patiënten tijdens de SCUT-trial in India geïncludeerd werd en slechts 8 van de 500 patiënten contactlensdrager was (en mede daardoor minder
Pseudomonas aeruginosa ) is het zeer de vraag of de uitkomsten van de SCUT-trial naar onze populatie vertaald mogen worden.
Gezien het feit dat er weinig verbetering door lokaal corticosteroïd gebruik verwacht kan worden concludeert de werkgroep dat het toedienen ervan geen algemene toepassing verdient, en wegens het risico van een niet gedetecteerde niet-bacteriële dan wel menginfectie (4%) risico’s induceert die niet tegen het (klinisch niet significante) effect op de visus (bij de groep met een zeer lage visus of groot centraal infiltraat) opwegen.
Omdat Acanthamoeba dan wel schimmel als verwekker een absolute contra-indicatie voor corticosteroïden zijn (maskering en een aantoonbaar slechtere uitkomst door niet juiste therapeutische keuze) is het noodzakelijk dat deze verwekkers uitgesloten zijn. Het risico op menginfecties is in onderzochte populaties in het Verenigd Koninkrijk en Australië gemiddeld 1 op 25 (Khoo, 2020; Tan, 2017; Ting, 2018; Ting, 2021).
Voor pijnbestrijding kan een corticosteroïd effectief zijn, echter bij dubbelinfecties maskerend met het risico dat de bijkomende infectie te laat wordt onderkend. Daarom is de aanbeveling om dit slechts te overwegen bij een bewezen bacteriële keratitis die al enkele weken effectief met antibiotica behandeld wordt (klinische verbetering en een bacteriestam die gevoelig is voor het toegepaste antibioticum). In de geïncludeerde studies werd prednisolon fosfaat gebruikt. Mogelijk kan voor pijnbestrijding ook een minder sterkwerkend corticosteroïd (met minder kans op een effect op de oogdruk) effectief zijn (bijv. fluorometholon). Antibiotische dekking moet altijd voortgezet worden zolang corticosteroïden toegepast worden en er nog een epitheeldefect is.
Rationale van de aanbeveling: weging van de argumenten voor en tegen de interventie voor de subgroepen: Nocardia spp. en Pseudomonas aeruginosa
Bij een bacteriële keratitis veroorzaakt door Nocardia spp. leidt toevoeging van een lokaal corticosteroïd tot een slechtere uitkomst in termen van visus en litteken grootte (SCUT trial; Srinivasan 2014) .
Wees voorzichtig bij het voorschrijven van lokale corticosteroïden tijdens de behandeling van keratitis veroorzaakt door Pseudomonas aeruginosa (Cohen 2009). Hoewel hiernaar nooit prospectief onderzoek is verricht, wijzen verschillende auteurs op casus waar het klinisch beeld van de keratitis bij deze patiënten verslechterde na toevoeging van een lokaal corticosteroïd. Echter in een sub-analyse van de SCUT-trial kon geen nadelig effect van corticosteroïden op het beloop van Pseudomonas aeruginosa keratitis gedetecteerd worden (Sy, 2012).
Onderbouwing
Achtergrond
De behandeling van infectieuze keratitis veroorzaakt door een bacteriële verwekker is primair met lokale antibiotica. Met de juiste antibiotica zal de bacteriële groei gestopt worden, waarna de infiltratieve reactie zal afnemen en een litteken in de cornea achterblijft. Toevoeging van lokale corticosteroïden zou mogelijk een versnelde afname van de infiltratieve reactie geven en daardoor de vorming van een stromaal litteken kunnen afremmen. Mogelijk kan hierdoor een beter resultaat met betrekking tot de uiteindelijke visus verkregen worden. Bijwerkingen van de corticosteroïden zoals een vertraagde epithelialisatie dan wel weefselverlies (z.g. melting) zouden juist een negatief effect kunnen hebben. Indien de keratitis niet bacterieel van origine blijkt te zijn, dan wel een menginfectie is, kan toevoeging van een corticosteroïd de uitkomst van het ziektebeeld negatief beïnvloeden, met name bij Acanthamoeba - en schimmel keratitis. Er zijn echter ook casus van Pseudomonas aeruginosa keratitis beschreven waarbij toevoeging van corticosteroïden een negatief effect had (Cohen, 2009). Daarom is het al dan niet toevoegen van lokale corticosteroïden al sinds lange tijd controversieel, evenals het moment waarop dit wordt voorgeschreven (Cohen, 2009; Hindman, 2009; Wilhelmus, 2002). Op dit moment is er geen eenduidig advies, en worden verschillende regimes gehanteerd, variërend van start drie dagen na start van de antibiotische behandeling tot starten na klinisch merkbaar aanslaan van de antibiotische behandeling, dan wel géén toepassing van corticosteroïden. De vraag is: heeft de toevoeging van corticosteroïden een positieve uitwerking op de uitkomst van bacteriële keratitis? En zo ja: wanneer en in welke dosering kan een lokaal corticosteroïd worden toegevoegd aan de lokale antibiotische therapie?
Conclusies / Summary of Findings
|
Low GRADE |
Treatment success: Infiltrate/scar size
Treatment with corticosteroids and antibiotics may not reduce or increase treatment success (infiltrate/scarsize) when compared with treatment with antibiotics only in patients with bacterial keratitis.
Source: Srinivasan (2009), Srinivasan (2012) |
|
Low GRADE
|
Visual Acuity
Treatment with corticosteroids and antibiotics may not reduce or increase visual acuity when compared with treatment with antibiotics only in patients with bacterial keratitis.
Source: Blair (2011); Srinivasan (2009); Srinivasan (2012) |
|
Low GRADE |
Time to re-epithelialization
Treatment with corticosteroids and antibiotics may not reduce or increase time to re-epithelialization when compared with treatment with antibiotics only in patients with bacterial keratitis.
Source: Srinivasan (2009); Srinivasan (2012) |
|
Very low GRADE |
Adverse events
The evidence is very uncertain about the effects of treatment with corticosteroids and antibiotics on serious and non-serious adverse events when compared with treatment with antibiotics only in patients with bacterial keratitis.
Source: Blair (2011); Carmichael (1990); Srinivasan (2009); Srinivasan (2012) |
Samenvatting literatuur
Description of studies:
Blair (2011) performed a RCT to determine the benefit of early addition of corticosteroids to antibiotics in the treatment of corneal ulcers. The trial was executed in two hospital sites in Canada. In total, 30 patients with bacterial corneal ulcers, confirmed by culture, were included in the trial. Patients with fungal, viral, or amoebic keratitis and patients < 12 years were excluded. All patients were instructed to take gatifloxacin every hour while awake for the first 48 hours, then on day three, one drop every two hours. On day three steroid or placebo drops, four times per day, were added to the treatment. On day seven, antibiotics were given four times per day after which both antibiotics and corticosteroids/placebo were further reduced until zero drops on day 35. The intervention group received dexamethasone 0.1% (n = 15) and the control group received placebo drops (n = 15), which were packed identically. Most baseline characteristics were equally distributed across both groups. However, the mean ulcer size in mm2 at baseline was 8.802 mm2 in the intervention group, compared to 5.483 mm2 in the control group (measured by photo). Outcomes included residual ulcer size at 10 weeks compared with the baseline size using photographic measurement, visual acuity, time to healing and adverse events. Visual acuity was assessed with a standard protocol illuminated ETDRS chart. After 10 weeks follow-up, three patients in the intervention group and one patient in the control group were lost to follow-up.
Carmichael (1990) performed a RCT to examine the effect of corticosteroids in the treatment of bacterial corneal ulcers. In total, 40 patients with central or paracentral bacterial corneal ulcers presenting at a South-African hospital were enrolled in the study. Patients with fungal isolates, perforated ulcers or descemetoceles, underlying viral corneal condition, atopic ulcers, no light perception on admission and patients aged < 13 years were excluded. Standard treatment consisted of a combination of cefazolin and gentamycin eye drops daily, atropine eye drops and multivitamin tablets twice daily, and chloromycetin eye ointment at night. Additionally, patients received subconjunctival cefazolin and gentamycin injections at admission and the first hours after admission if necessary. Patients in the intervention group received dexamethasone 0.1% eye drops (Maxidex) four times a daily after 24h of antibiotic treatment (n = 21 eyes). Steroid treatment was only started if the ulcer had not worsened the first 24 hours after admission. If during the steroid treatment worsening of the ulcer occurred, corticosteroids were withheld for 24 hour and the case reassessed. The control group received usual treatment, without corticosteroids (n = 19). Both groups had a high percentage of men included (90% and 76% respectively). Outcomes included adverse effects within 21 days and healing rate (in mm2/day). In the analysis of healing rate, patients were excluded if they showed persistent epithelial defects or recovery took longer than 2 or 3 months. The analysis was performed in 15 cases of the intervention group and 11 in the control group, there was considerable loss to follow-up. Randomization was not guaranteed since only cases without serious worsening of the ulcer were included in the intervention group and because of the inclusion of bilateral cases.
Srinivasan (2009) performed a RCT to assess whether adjunctive topical corticosteroids improve outcomes in bacterial keratitis. This study was set up as a preliminary study for a larger trial (SCUT; Srinivasan 2012). The study was executed in an eye hospital in India. All bacterial corneal ulcer culture positive cases were considered for enrollment. Participants should have received at least 48 hours of topical antibiotics (moxifloxacin) to be included. Exclusion criteria included corneal perforation or impending perforation, overlying epithelial defect <0.75 mm at its greatest width, evidence of fungal, acanthamoeba or herpetic keratitis, use of a topical corticosteroid or systemic prednisolone during the present ulcer, and patients aged < 16 years. All patients received moxifloxacin eye drops, applied every hour while awake for the first 48 hours, then one drop every two hours until re-epithelialization and then four times per day until three weeks from enrollment. Patients randomized to the intervention group additionally received prednisolone sodium phosphate 1.0% 1 drop 4 times per day for 1 week, then twice per day for 1 week and then once per day for 1 week (n = 20). Patients in the control group received placebo eye drops (n = 22). Treatment allocation was double blind. Mean diameter infiltrate/scar size was at enrollment 2.0 ± 1.2 mm in the intervention group, and 1.8 ± 1.6 in the placebo group. Outcomes were assessed at 3 weeks and 3 months follow-up. In both groups there was some loss to follow-up (n =4 and n = 5) Outcomes included infiltrate/scar size, assessed with photographs, best-spectacle corrected visual acuity (BSCVA), time to re-epithelialization and adverse events. Visual acuity was assessed using a tumbling “E” chart. Multiple linear regression models were used to determine the relationship between treatment group and infiltrate scar size, while adjusting for enrollment infiltrate/scar size. Time to re-epithelialization was compared between the two treatment groups with Cox’s proportional hazard models, adjusting for baseline epithelial defect size. Endpoints were analyzed on an intention-to-treat basis.
The Steroids for Corneal Ulcers Trial (SCUT; Srinivasan 2012) was a multicenter RCT on the effects on of the use of topical corticosteroids as adjunctive therapy in the treatment of bacterial corneal ulcers on different clinical outcomes. In total, 500 patients with a culture-positive bacterial ulcer were enrolled in the study, the vast majority of the patients was from India n= 485/500 (97%). Study characteristics, interventions and outcomes that were studied were similar to a pilot study (Srinivasan 2009) and the same study protocol was followed. The sample size of 500 was determined on a power calculation of 80% to detect a difference in BCVA of 0,2 LogMAR after 3 months. It was planned to perform multiple subgroup analyses to determine whether an effect of corticosteroids existed in subgroups of baseline characteristics. In total, 250 patients were randomized to the intervention group (topical prednisolone and moxifloxacin drops) and 250 patients in the placebo arm of the trial (placebo eye drops and moxifloxacin). At enrollment, the median (25th-75th percentile) infiltrate/scar size was 2.8 (2.1-4.2) mm in the corticosteroid group and 2.6 (1.8-3.8) mm in the placebo group. Patients were evaluated at baseline, every 3 days until re-epithelialization, at 3 weeks and at 3 months. Loss to follow-up at three months was similar across both groups (n = 29 in intervention group, n = 28 in placebo group). It was stated that at baseline there were significant differences in ulcer location between the intervention and placebo condition. More patients in the intervention group had an ulcer that completely filled the central 4-mm pupil. However, the authors argue that it is unlikely that the differences in the location of the ulcer at baseline biased the results, since in the analysis there was controlled for baseline infiltrate/scar size.
Results
Treatment success: infiltrate/scar size
Two studies reported treatment effect, measured as infiltrate/scar size diameter mm, at 3 months follow-up (Srinivasan, 2009 and Srinivasan, 2012). In Srinivasan (2009; n = 42) it was reported that at 3 months follow-up the difference in infiltrate/scar size diameter between the intervention and control group was -0.33 mm (95% CI -1.4 to 0.75). In Srinivasan (2012; n = 500) it was reported that at 3 months follow-up the difference in infiltrate/scar size diameter between the intervention and control group was 0.06 mm (95% CI -0.07 to 0.17). This was not considered clinically relevant.
Visual acuity
Three studies reported the outcome visual acuity in logMAR (Blair, 2011; Srinivasan, 2009; Srinivasan, 2012). Due to heterogeneity in reporting, it was not possible to pool the results. Blair (2011, n = 30) reported mean change in visual acuity from baseline to 2-month follow-up, measured with the EDTRS chart. In the intervention group, VA improvement from baseline was -0.31 logMAR. In the control group VA improvement from baseline was -0.18 logMAR. The Mean Difference between the intervention and control group could not be obtained since SD’s were not reported, however the difference seems to be within the range of 0.2 logMAR.
In the trials by Srinivasan (2009 and 2012) visual acuity was assessed at 3-month follow-up, with Tumbling “E” chart. In Srinivasan (2009) was reported that in the intervention group visual acuity was 0.09 logMAR lower than in the control group (95% CI -0.41 to 0.24). Srinivasan (2012; n = 500) reported that in the intervention group, visual acuity was 0.009 logMAR lower than in the control group (95% CI -0.085 to 0.068). This was not considered clinically relevant.
In Srinivasan (2012) the following results were found by performing subgroup analyses:
- In eyes starting with a BSVA of counting fingers or worse: corticosteroid-treated patients had 0.17 better logMAR acuity (approximately 1.7 lines; 95% CI, −0.31 to −0.02;) than patients with higher BSVA
- in ulcers completely covering the central 4-mm pupil, corticosteroid treated patients had 0.20 better logMAR acuity (approximately 2 lines; 95% CI, −0.37 to −0.04;) than patients without ulcers covering the 4-mm pupil
- in ulcers with the deepest infiltrates at baseline, corticosteroid-treated patients had 0.15 better logMAR acuity (approximately 1.5 lines; 95% CI, −0.31 to 0.01) with more superficial infiltrates
These differences were not considered clinically relevant.
Time to re-epithelialization
All four studies reported the outcome measure time to re-epithelialization (Blair, 2011; Carmichael, 1990; Srinivasan, 2009; Srinivasan, 2012;). Due to heterogeneity in reporting it was not possible to pool the results.
Srinivasan (2009; n = 42) reported mean time to re-epithelialization was on average (± SD) 8.6 ± 4.7 days in the intervention group and 6.3 ± 3.1 days in the placebo group. Mean difference was: 2.30 days (95% CI: -0.13 to 4.73), this was not considered clinically relevant (Table 1).
Srinivasan (2012; n = 500), reported median time to re-epithelialization was 7.5 days (95% CI: 5.5 to 8.5) in the intervention group and 7.0 days (95% CI: 5.5 to 8.5) in the placebo group. A Hazard Ratio of 0.92 (95% CI: 0.76 to 1.12) was reported. This was not considered clinically relevant (Table 1).
Carmichael (1990) reported healing rate, which was only calculated for the patients with full recovery in two to three months (no epithelial defects (n = 26). It was reported that mean healing rate was 0.36 mm2/day for the intervention group, compared to 0.30 mm2/day for the control group.
Table 1. Overview of the studies reporting the outcome time to re-epithelialization. SD: standard deviation; MD: mean difference; 95% CI: 95% confidence interval
|
|
Steroids + antibiotics |
Antibiotics |
Difference |
|
Srinivasan 2009 (n = 42) |
Mean ± SD: 8.6 ± 4.7 days |
Mean ± SD: 6.3 ± 3.1 days |
MD (95% CI) 2.30 (-0.13 to 4.73) |
|
Srinivasan 2012 (n = 500) |
Median (95% CI) 7.5 (5.5 to 8.5) |
Median (95% CI) 7.0 (5.5 to 8.5) |
HR (95% CI) 0.92 (0.76 to 1.12) |
|
Carmichael 1990 (n = 26) |
Healing rate: 0.36 mm2/day |
Healing rate: 0.30 mm2/day |
|
Blair (2011; n = 30) did not report the mean time towards re-epithelialization in days but did report the residual ulcer size at 10 weeks. The mean ulcer size in mm2 at baseline was 8.802 mm2 in the intervention group, compared to 5.483 mm2 in the control group (measured by photo). At 10 weeks follow-up, mean residual ulcer size was 4.412 mm2 in the intervention group, compared to 3.090 mm2 in the control group. The mean difference can’t be assessed because SD’s were not reported.
Adverse events
The included studies reported various adverse events, these were subdivided in perforations, keratoplasty and non-serious adverse events. Results are presented per type of adverse event.
Adverse events: perforations
Three studies reported perforations as adverse events (Carmichael, 1990; Srinivasan, 2009; Srinivasan, 2012) The studies of Carmichael (1990) and Srinivasan (2012) were pooled. The pooled Risk Ratio (RR) was 0.88 (95% CI: 0.34 to 2.24). This was not considered clinically relevant. The study of Srinivasan 2009 reported a RR of 0.20 (95% CI: 0.01 to 4.30). This result was not pooled with the other studies, due to the lack of cases in the intervention group (Figure 1).
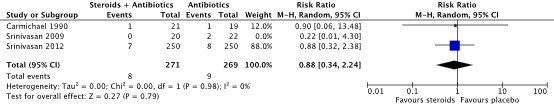
Figure 1. Forest plot showing the outcome perforations (adverse events) for treatment with corticosteroids + antibiotics compared to antibiotics alone. Pooled relative risk ratio, random effects model. Z: p-value of overall effect; df: degrees of freedom; SD: standard deviation; I2; statistical heterogeneity; CI: confidence interval.
Adverse events: keratoplasty
Two studies reported keratoplasty as adverse event (Carmichael, 1990; Srinivasan, 2012). The study of Srinivasan (2012; n = 500) reported 8/250 (3.2%) cases of keratoplasty in the intervention group, compared to 9/250 (3.6%) cases in the control group, RR: 0.89 (95% CI 0.35 to 2.27). This was not considered clinically relevant. The study of Carmichael (1990, n = 40) reported 1/21 (4.8%) cases of keratoplasty in the intervention group, compared to 0/19 (0%) cases in the control group. These results were not pooled due to the lack of cases in the placebo group in the study of Carmichael (1990).
Non-serious adverse events
Four studies reported non-serious adverse events (Blair, 2011; Carmichael, 1990; Srinivasan, 2009; Srinivasan, 2012). The studies from Blair (2011), Carmichael (1990) and Srinivasan (2012) were pooled. The pooled RR was 1.03 (95% CI: 0.72 to 1.47). This was not considered clinically relevant. The study of Srinivasan 2009 reported a RR of 0.22 (95% CI: 0.01 to 4.30). This result was not pooled with the other studies, due to the lack of cases in the intervention group (Figure 2).
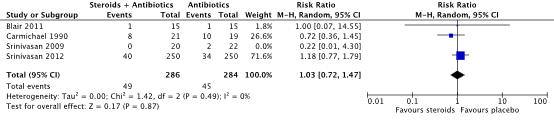
Figure 2. Forest plot showing the outcome non-serious adverse events for treatment with corticosteroids + antibiotics compared to antibiotics alone. Pooled relative risk ratio, random effects model. Z: p-value of overall effect; df: degrees of freedom; SD: standard deviation; I2; statistical heterogeneity; CI: confidence interval.
Level of evidence of the literature
The level of evidence regarding the outcome measure treatment success (infiltrate/scar size was retrieved from RCTs and therefore started high. The level of evidence was downgraded by two levels because of study limitations including high loss to follow-up rates and poor generalizability of the study population (-1 risk of bias) and the wide 95% confidence intervals including zero (-1 imprecision). The final level of evidence was graded ‘low’.
The level of evidence regarding the outcome measure visual acuity was retrieved from RCTs and therefore started high. The level of evidence was downgraded by two levels because of study limitations including high loss to follow-up rates and poor generalizability of the measurement protocol for visual acuity (-1 risk of bias) and the wide confidence intervals (-1 imprecision). The final level of evidence was graded ‘low’
The level of evidence regarding the outcome measure time to re-epithelialisation was retrieved from RCTs and therefore started high. The level of evidence was downgraded by two levels because of study limitations including high loss to follow-up rates and poor generalizability of the study population (-1 risk of bias) and the 95% confidence intervals including zero and crossing the boundaries of clinical decision making (-1 imprecision). The final level of evidence was graded ‘low’
The level of evidence regarding the outcome measure adverse events was retrieved from RCTs and therefore started high. The level of evidence was downgraded by three levels because of study limitations including high loss to follow-up rates and poor generalizability of the study population (-1 risk of bias) and the wide confidence interval crossing the boundaries of clinical decision making (-2 imprecision). The final level of evidence was graded ‘very low’.
Zoeken en selecteren
What is the effectiveness and safety of the use of corticosteroids additional to antibiotics for the treatment of bacterial keratitis?
P: Patients with bacterial keratitis
I: A combination of corticosteroids and antibiotics
C: Antibiotics
O: Treatment success, visual acuity (in logMAR), time to re-epithelialization,
adverse events (perforation, enucleation, evisceration)
Relevant outcome measures
The guideline development group considered treatment success and visual acuity as a critical outcome measure for decision making; and time to re-epithelialization and adverse events as an important outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined the following thresholds as a minimal clinically (patient) important difference (between the intervention and control group):
- Treatment success: 10% reduction in infiltrate/scar size
- Visual acuity: a difference of >2 lines (±0.2 logMAR)
- Time to re-epithelialisation: a difference of 5 days
- Adverse events; 0.80 < RR > 1.25
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until the 8th of June 2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 280 hits. Studies were selected based on the following criteria: systematic reviews and RCTs on the treatment of bacterial keratitis with corticosteroids. Fifteen studies were initially selected based on title and abstract screening. After reading the full text, ten studies were excluded (see the table with reasons for exclusion under the tab Methods). One systematic review; including four relevant trials was included. It was decided to use the data presented in the original papers, as the systematic review did not report all the outcomes of interest.
Results
Four studies were included in the analysis of the literature. The studies were also included in the review from Herretes (2014). Descriptions of the individual studies included in this review (Herretes, 2014) are presented, as data was derived from the original papers. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Blair J, Hodge W, Al-Ghamdi S, Balabanian R, Lowcock B, Pan YI, Sherif H, AlMahmoud T, Fergusson D, Slomovic A. Comparison of antibiotic-only and antibiotic-steroid combination treatment in corneal ulcer patients: double-blinded randomized clinical trial. Can J Ophthalmol. 2011 Feb;46(1):40-5. doi: 10.3129/i10-054. PMID: 21283156.
- Cohen EJ. The case against the use of steroids in the treatment of bacterial keratitis. Arch Ophthalmol. 2009 Jan;127(1):103-4. doi: 10.1001/archophthalmol.2008.503. PMID: 19139349.
- Cohen EJ. The case against the use of steroids in the treatment of bacterial keratitis. Arch Ophthalmol. 2009 Jan;127(1):103-4. doi: 10.1001/archophthalmol.2008.503. PMID: 19139349
- Herretes S, Wang X, Reyes JM. Topical corticosteroids as adjunctive therapy for bacterial keratitis. Cochrane Database Syst Rev. 2014 Oct 16;10(10):CD005430. doi: 10.1002/14651858.CD005430.pub3. PMID: 25321340; PMCID: PMC4269217.
- Hindman HB, Patel SB, Jun AS. Rationale for adjunctive topical corticosteroids in bacterial keratitis. Arch Ophthalmol. 2009 Jan;127(1):97-102. doi: 10.1001/archophthalmol.2008.504. PMID: 19139348.
- Khoo P, Cabrera-Aguas MP, Nguyen V, Lahra MM, Watson SL. Microbial keratitis in Sydney, Australia: risk factors, patient outcomes, and seasonal variation. Graefes Arch Clin Exp Ophthalmol. 2020 Aug;258(8):1745-1755. doi: 10.1007/s00417-020-04681-0. Epub 2020 May 2. PMID: 32358645.
- Srinivasan M, Lalitha P, Mahalakshmi R, Prajna NV, Mascarenhas J, Chidambaram JD, Lee S, Hong KC, Zegans M, Glidden DV, McLeod S, Whitcher JP, Lietman TM, Acharya NR. Corticosteroids for bacterial corneal ulcers. Br J Ophthalmol. 2009 Feb;93(2):198-202. doi: 10.1136/bjo.2008.147298. Epub 2008 Oct 1. PMID: 18829631; PMCID: PMC2632719.
- Srinivasan M, Mascarenhas J, Rajaraman R, Ravindran M, Lalitha P, Glidden DV, Ray KJ, Hong KC, Oldenburg CE, Lee SM, Zegans ME, McLeod SD, Lietman TM, Acharya NR; Steroids for Corneal Ulcers Trial Group. Corticosteroids for bacterial keratitis: the Steroids for Corneal Ulcers Trial (SCUT). Arch Ophthalmol. 2012 Feb;130(2):143-50. doi: 10.1001/archophthalmol.2011.315. Epub 2011 Oct 10. PMID: 21987582; PMCID: PMC3830549.
- Tan SZ, Walkden A, Au L, Fullwood C, Hamilton A, Qamruddin A, Armstrong M, Brahma AK, Carley F. Twelve-year analysis of microbial keratitis trends at a UK tertiary hospital. Eye (Lond). 2017 Aug;31(8):1229-1236. doi: 10.1038/eye.2017.55. Epub 2017 Apr 28. PMID: 28452995; PMCID: PMC5584503.
- Ting DSJ, Settle C, Morgan SJ, Baylis O, Ghosh S. A 10-year analysis of microbiological profiles of microbial keratitis: the North East England Study. Eye (Lond). 2018 Aug;32(8):1416-1417. doi: 10.1038/s41433-018-0085-4. Epub 2018 Apr 3. PMID: 29610521; PMCID: PMC6085375.
- Ting DSJ, Ho CS, Cairns J, Elsahn A, Al-Aqaba M, Boswell T, Said DG, Dua HS. 12-year analysis of incidence, microbiological profiles and in vitro antimicrobial susceptibility of infectious keratitis: the Nottingham Infectious Keratitis Study. Br J Ophthalmol. 2021 Mar;105(3):328-333. doi: 10.1136/bjophthalmol-2020-316128. Epub 2020 Jun 24. PMID: 32580955; PMCID: PMC7907586.
- Wilhelmus KR. Indecision about corticosteroids for bacterial keratitis: an evidence-based update. Ophthalmology. 2002 May;109(5):835-42; quiz 843. doi: 10.1016/s0161-6420(02)00963-6. PMID: 11986084.
Evidence tabellen
Evidence table for intervention studies studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Blair 2011 |
Type of study: RCT, double blinded
Setting and country: Two hospitals in Canada
Funding and conflicts of interest: Not reported |
Inclusion criteria: - bacterial corneal ulcer that was confirmed by culture or by bacteria seen on gram stain, - involvement of only one eye - > 12 years old
Exclusion criteria: - fungal, viral or amoebic keratits - perforated ulcer - involvement of the only functional eye, with BCVA < 20/200 in the uninfected eye, - use of topical or systemic steroids concurrently or within the past 2 month
N (no. of eyes) total at baseline: n = 30 I: 15 C: 15
Important prognostic factors2:
Groups comparable at baseline? Probably yes
|
Antibiotic + steroid Dexamethasone 0.1% + gatifloxacin
On day 3 of the antibiotics schedule, dexamethasone was added to the dosing schedule. Dosage: 4 times daily |
Antibiotic-only Placebo eye drops + gatifloxacin
On day 3 of the antibiotics schedule, placebo drops were started on the same schedule as the dexamethasone drops
Gatifloxacin 1 drop every hour while awake for the first 48 hours. On day 3, 1 drop every 2 hours. On day 7, 4 times daily until re-epithelialization.
|
Length of follow-up: 10 weeks
Loss-to-follow-up: I: n = 3 C: n = 1
|
Healing (ulcer size – Mean Difference from baseline, assessed with photographic measurement) I: -4.388 mm2 C: -1.919 mm2
Improvement in Visual acuity from baseline: I: -0.31 C: -0.18
Time to healing (median) I: 6 weeks C: 8 weeks
Adverse events I: 1/15 patient (recurrence of ulcer) C: 1/15 patients (second corneal ulcer) |
The authors’ concluded that: “the early addition of steroids to the antibiotic treatment of corneal ulcers does not seem to be harmful when employed in a closely monitored clinical setting”
Comments on RoB:
|
|
Carmichael 1990 |
Type of study: RCT
Setting and country: Department of Ophtalmology, University South Africa
Funding and conflicts of interest: Not reported |
Inclusion criteria: - central or paracentral bacterial ulcers severe enough to warrant hospital admission
Exclusion criteria: Patients with: - Fungal isolates - perforated ulcers - descementocoe-les - underlying viral corneal conditions - no light perception on admission - < 13 years
N (no. of eyes) total at baseline: Intervention: 21 Control: 19
Important prognostic factors2: Age ± SD ; % males I: 51 ± 6 ; 90% C: 51 ± 4 ; 76%
Groups comparable at baseline? Probably yes
|
Steroid Dexamethasone 0.1% (Maxidex) eye drops 4 times/day (minimum 2 weeks)
- Hourly: Kefzol eyedrops (cefazolin fortified 32 g/l) + gentamicin eye drops (fortified, 14 g/l) - Twice/day: Atropine eye drops 1%, multivitamin tablets - chloromycetin eye ointment at night (2200) - On admission + morning after admission + 1or 2 injections more when necessary: subconjunctival cefazolin (125 mg) and gentamicin (20 mg)
|
Non-steroid - Hourly: Kefzol eyedrops (cefazolin fortified 32 g/l) + gentamicin eye drops (fortified, 14 g/l) - Twice/day: Atropine eye drops 1%, multivitamin tablets - chloromycetin eye ointment at night (2200) - On admission + morning after admission + 1or 2 injections more when necessary: subconjunctival cefazolin (125 mg) and gentamicin (20 mg)
|
Length of follow-up: Adverse events: 21 days
Loss-to-follow-up: Patients with persistent epithelial defects (e.g. no healed ulcer) were not included in the analysis of healing rate Population for healing rate I: n = 15 C: n = 11
|
Complications I: 8 / 21 C: 10 / 19
Healing rate: Healing rate: I: 0.36 mm2/day C: 0.30 mm2/day |
The authors’ concluded that: “No adverse effects were encountered with topical steroids in the dosage shown above”
Comments on RoB: All patients received usual care. The patients randomised to the steroid intervention group started using steroids but only if the condition was considered the same or improved. If during the treatment there was serious worsening of the ulcer, steroid was withheld for 24 hours and the case reassessed and so on.
Bilateral cases were randomised separately
Patients were excluded from the healing rate analysis if they showed persistent epithelial defects |
|
SCUT (2012)
= Srinivasan (2012)
|
Type of study: RCT, double blinded
Setting and country: Multicenter India and US
Funding and conflicts of interest: None, grant from National Eye Institute |
Inclusion criteria: - Culture-positive bacterial corneal ulcer - antibiotic given for > 48 hours
Exclusion criteria: - fungal, acanthamoebal or herpetic keratitis - Corneal perforation or impeding perforation - Age < 16 years - Bilateral ulcers - No light perception in the affected eye - vision < 6/60 in the fellow eye - use of topical corticosteroids or systemic prednisolone during the course of present ulcer
N total at baseline; % male I: 250; 50,0% C: 250; 58,8%
Important prognostic factors2: Age median, IQR ; I: 52.0, 40.0 to 62.0 C: 54.5, 40.0 to 61.0
Groups comparable at baseline? Probably yes |
Topical prednisolone sodium phosphate 1.0% eye drops + topical moxifloxacin 0.5%
Prednisolone sodium 1 drop applied 4 times/day for 1 week, then twice/day for 1 week, then once a week
Moxifloxacin 1 drop every hour while away for the first 48 hours, then 1 drop every hour until re-epithelialization, then 4 times/day until week 3 from enrollment |
Placebo eye drops + topical moxifloxacin (0.5%)
Placebo 1 drop applied 4 times/day for 1 week, then twice/day for 1 week, then once a week |
Length of follow-up Patients were evaluated every 3 days ± 1 day until re-epithelialization, At 3 weeks At 3 months
Loss to follow-up (3 month) I: n = 29 patients C: n = 28 patients
Incomplete outcome data: The primary analysis considered only visits completed within the window period (missings not imputed) I: 6 excluded from analysis C: 9 excluded from analysis
12 months follow-up reported in Srinivasan 2014
Loss to follow-up Total: n = 202 I: n = 197 C: n = 399 (79.8%) |
Healing: Difference in Infiltrate/scar size: At 3 weeks I: 0.05 mm; 95% CI -0.09 to 0.15
At 3 months I: 0.06 mm; 95% CI: -0.07 to 0.17)
At 12 months (Srinivasan 2014) - Patients with Nocardia Ulcers I: 0.47mm, 95% CI, 0.06 to 0.88 - patients without Nocardia Ulcers I: −0.06mm, 95% CI, −0.21 to 0.10,
Visual acuity at follow-up (intervention vs. control) -0.009 (95% CI: -0.085 to 0.068)
Adverse events Serious adverse events I: 15/250 C: 13/250
Non-serious adverse events I: 40/250 C: 34/250
At 12 months (Srinivasan 2014) “no corneal perforations between 3 months and 12 months from enrolment” I: 1/250 C: 0/250 à keratoplasties
Time to reepithelialization Median (95% CI) days I: 7,5 (95% CI: 5.5 to 8.5) C: 7.0 (95% CI: 5.5 to 8.5) HR: 0.92 (95% CI: 0.76 to 1.12) Model adjusted for baseline epithelial defect size.
|
The authors’ concluded that: “there was no overall difference in 3-month BSCVA and no safety concerns with adjunctive corticosteroid therapy for bacterial corneal ulcers”
The majority of patients is from India; n= 485/500 (97%)
Enrollment period: september 2006 to February 2010 |
|
Srinivasan 2009 (SCUT pilot) |
Type of study: RCT, double blinded
Setting and country: Single center, India.
Funding and conflicts of interest: None, supported by research grants. |
Inclusion criteria: - Culture-positive bacterial corneal ulcer at presentation - antibiotics given for > 48 hours
Exclusion criteria: - fungal, acanthamoebal or herpetic keratitis - Corneal perforation or impeding perforation - Age < 16 years - Bilateral ulcers - No light perception in the affected eye - vision < 6/60 in the fellow eye - use of topical corticosteroids or systemic prednisolone during the course of present ulcer
N total at baseline; % male I: 20, 55% C: 22, 50%
Important prognostic factors2: Age Mean ± SD I: 49.9 ± 13.0 C: 44.1 ± 17.0
Mean infiltrate/ scar size (mm ± SD) I: 2.0 ± 1.2 C: 1.8 ± 1.6
Groups comparable at baseline? Probably yes
|
Topical prednisolone sodium phosphate 1.0% eye drops + topical moxifloxacin 0.5%
Prednisolone sodium 1 drop applied 4 times/day for 1 week, then twice/day for 1 week, then once a week
Moxifloxacin 1 drop every hour while awake for the first 48 hours, then 1 drop every 2 hours until re-epithelialization, then 4 times/day until week 3 from enrollment |
Placebo eye drops + topical moxifloxacin (0.5%)
Placebo 1 drop applied 4 times/day for 1 week, then twice/day for 1 week, then once a week |
Follow-up At 3 weeks At 3 months
Loss to follow-up (3 month) I: n = 16 analyzed C: n = 17analyzed
|
Healing: At 3 weeks: I (steroid): 0.57 mm smaller infiltrate/scare size in diameter, mm (95% CI: 1.5 smaller to 0.37 larger), compared to placebo.
At 3 months I (steroid): 0.33 smaller infiltrate/scar size in diameter, mm (95% CI 1.4 smaller to 0.75 larger) compared to placebo group.
Visual acuity at follow-up (intervention vs. control) -0.09 (95% CI –0.41 to 0.24)
Time to re-epithelialisation I: 8.6 ± 4.7 days C: 6.3 ± 3.1 days
Adverse events: I: 0/20 C: 4 /22 (2 corneal perforations requiring corneal glue, 1 uncontrolled intraocular pressure and 1 worsening infiltrate) |
The author’s concluded that: “Although corticosteroid treatment resulted in a statistically significant delay in reepithelialisation, this did not translate to a significant difference in visual acuity, infiltrate/scar size, or adverse events”
Enrollment period: January 2005 to August 2005
Multiple linear regression models were used to determine the relationship between treatment group and infiltrate scar size, while adjusting for enrollment infiltrate/scar size. Time to re-epithelialisaiton was compared between the two treatment groups with a Cox’s proportional hazard models, adjusting for baseline epithelial defect size |
Risk of bias table for interventions studies (cohort studies based on risk of bias tool by the CLARITY Group at McMaster University)
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no
|
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Blair 2011 |
Probably yes;
Reason: Computer-generated, stratified block randomization was used, stratified by ulcer size since this was seen as an important confounding factor
|
Unclear
Reason: allocation procedure not described |
Probably yes;
Reason: Investigators and patients were blinded, treatments were prepared by hospital pharmacy and packed identically |
Probably yes;
Reason: loss to follow-up was infrequent and equally distributed across the treatment arms |
Probably yes;
Reason: the outcomes reported in the method section are reported |
Probably yes;
Reason: no other sources of bias could be identified |
Low
For all outcomes |
|
Carmichael 1990 |
Probably no;
Reason: complete randomisation not guaranteed because worsening cases were excluded from intervention group, inclusion of bilateral cases |
Unclear
Reason: allocation procedure not described |
Unclear
Reason: information on blinding procedures not provided |
Probably yes;
Reason: high proportion of the included patients was excluded for analysis, but this was equally distributed across treatment arms |
Probably yes;
Reason: the outcomes reported in the method section are reported |
Probably no;
Reason: If worsening of the ulcer happened in steroid group, treatment was not started.
In the analysis of healing rate patients were excluded if they showed persistent epithelial defects or recovery took longer than 2 or 3 months.
|
Some concerns
True effect of steroids might be biased since steroids were paused when worsening of the ulcer occured
(both outcomes)
|
|
Srinivasan 2009 |
Definitely yes;
Reason: computer generated randomisation (with excel) |
Unclear:
Reason: allocation procedure not described |
Probably yes;
Reason: it was stated that only the biostatisticians responsible for the randomisation the study pharmacist were unmasked
|
Probably yes;
Reason: loss to follow-up was infrequent and equally distributed across treatment arms |
Probably yes;
Reason: the outcomes reported in the method section are reported |
Probably yes;
Reason: no other sources of Bias could be identified |
Low risk of bias for all outcomes. |
|
SCUT 2012 |
Probably yes;
Reason: block randomisation with varying block sizes |
Unclear
Reason: allocation procedure not described
|
Probably yes
Reason: patients and examiners were blinded, statistician not |
Probably yes
Reason: loss to follow-up was infrequent and equally distributed across groups à LTFU door adverse events? |
Definitely yes
Reason: outcomes stated in the protocol are presented (in different articles) |
Probably yes
Reason: no other sources of Bias could be identified |
Low risk of bias for all outcomes |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 02-09-2024
Beoordeeld op geldigheid : 27-08-2024
Algemene gegevens
De ontwikkeling van deze richtlijnmodules werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in nov 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor infectieuze keratitis.
Werkgroep
- Mevr. Dr. C.A. (Cathrien) Eggink, Oogarts, Nederlands Oogheelkundig Gezelschap (NOG), voorzitter werkgroep
- Mevr. dr. M.C. (Marjolijn) Bartels, Oogarts, Nederlands Oogheelkundig Gezelschap (NOG)
- Dhr. drs. J. (Jeroen) van Rooij, Oogarts, Nederlands Oogheelkundig Gezelschap (NOG)
- Mevr. dr. L. (Lies) Remeijer, Oogarts, Nederlands Oogheelkundig Gezelschap (NOG)
- Mevr. dr. N. (Nienke) Visser, Oogarts, Nederlands Oogheelkundig Gezelschap (NOG)
- Dhr. dr. E. (Erik) Schaftenaar, Arts-microbioloog, Nederlandse Vereniging voor Medische Microbiologie (NVMM)
- Mevr. drs. C. (Claudy) Oliveira dos Santos, Arts-microbioloog, tot 11 april 2023, Nederlandse Vereniging voor Medische Microbiologie (NVMM)
- Dhr. prof. dr. P.E. (Paul) Verweij, Arts-microbioloog, vanaf 11 april 2023, Nederlandse Vereniging voor Medische Microbiologie (NVMM)
- Dhr. dr. W. (Wouter) Bult, Ziekenhuisapotheker, Nederlandse Vereniging van Ziekenhuisapothekers (NVZA)
- Dhr. M. (Michel) Versteeg MCM, Patiëntvertegenwoordiger, Hoornvlies patiënten vereniging (HPV)
Klankbord
- Mevr. drs. C.M. (Chantal) van Luijk, Oogarts, Nederlands Oogheelkundig Gezelschap (NOG)
- Mevr. I. (Inger) Larsen, huisarts, Nederlands Huisartsen Genootschap (NHG)
- Mevr. dr. N. (Nienke) Miltenburg-Soeters, optometrist, Optometristen Vereniging Nederland (OVN)
Met ondersteuning van
- Mw. MSc. D.G. (Dian) Ossendrijver, junior adviseur, Kennisinstituut van Medisch Specialisten.
- Mw. dr. A.C.J. (Astrid) Balemans, senior adviseur, Kennisinstituut van Medisch Specialisten.
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Mevr. Dr. C.A. (Cathrien) Eggink |
Oogarts in Radboudumc
|
Geen
|
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen. |
Geen. |
|
Mevr. dr. M.C. (Marjolijn) Bartels |
Oogarts Deventer Ziekenhuis
|
Refractie chirurg (Iris Eye Clinics) detachering via Deventer Ziekenhuis.
|
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek ZonMW gefinancierd onderzoek: 1. BICAT studie afgerond. 2. Net opgestart EPICAT studie. 3. DSAEK versus DMEK studie afgerond Intellectuele belangen en reputatie Geen.
Overige belangen Geen. |
Geen, onderzoeken gaan niet over keratitis. |
|
Dhr. drs. J. (Jeroen) Rooij |
Oogarts |
Geen. |
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Gefinancierd, belangenloos en zonder restricties, door Stichtingen Stichting Blindenbelangen Rotterdam Stichting Wetenschappelijk Onderzoek Oozgiekenhuis (SWOO; Rotterdam) Stichting Ophthalmic Researsch Rotterdam Hoornvliesstichting Nederland tbv promotietraject ‘Epidemiology and Improved diagnosis of Acanthamoeba keratitis’.
Intellectuele belangen en reputatie Publicaties mbt Acanthamoeba zouden mogelijk positief beïnvloed worden Overige belangen Geen. |
Geen. |
|
Mevr. dr. L. (Lies) Remeijer |
Oogarts met aandachtsgebied HSV keratitis |
Geen.
|
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Clinical implications of asymptomatic corneal shedding of herpesviruses start 2019 (restricted grant, financiering door Stichting Ooglijders)
Intellectuele belangen en reputatie Geen.
Overige belangen Geen. |
Geen |
|
Mevr. dr. N. (Nienke) Visser |
Oogarts (MUMC)
|
- Lid cornea werkgroep European Society of Cataract and Refractive Surgeons (onbetaald)
|
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek European Society of Cataract and Refractive Surgeons: EPICAT study: Effectiveness of Periocular drug Injection in CATaract surgery (gefinancierd door ESCRS, het gaat hierbij om een restricted grant, de ESCRS heeft op voorhand akkoord gegeven voor de specifieke opzet, uitvoering, en terugkoppeling van de EPICAT studie)
Intellectuele belangen en reputatie Geen.
Overige belangen Geen. |
Geen, onderzoeken gaan niet over keratitis. |
|
Dhr. dr. E. (Erik) Schaftenaar |
Arts-microbioloog, vrijgevestigd medisch specialist
|
Geen. |
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen. |
Geen.
|
|
Mevr. drs. C. (Claudy) Oliveira dos Santos (tot 11 april 2023) |
Arts-microbioloog
|
Promovendus Radboudumc - Medische mycologie (onbetaald)
|
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen. |
Geen. |
|
Dhr. prof. dr. P.E. (Paul) Verweij |
Arts-microbioloog
|
SWAB - adhoc voorzitter richtlijn commissie CAPA en IAPA
|
Persoonlijke financiële belangen Geen persoonlijke financiële belangen. Eventuele vergoedingen en honoraria komen ten goede van de werkgever.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek JPIAMR, surveillance van resistentie bij schimmels, Projectleider ja
Intellectuele belangen en reputatie Geen.
Overige belangen Geen. |
Producten van Mundipharma, Gilead Sciences en F2G komen in de RL niet aan bod. Is geen trekker van een van de modules. |
|
Dhr. dr. W. (Wouter) Bult |
Ziekenhuisapotheker
|
Geen. |
Persoonlijke financiële belangen Niet van toepassing.
Persoonlijke relaties Niet van toepassing.
Extern gefinancierd onderzoek Niet van toepassing.
Intellectuele belangen en reputatie Niet van toepassing.
Overige belangen Niet van toepassing. |
Geen. |
|
Dhr. M. (Michel) Versteeg |
Verengingsmanager van de Hoornvlies Patiënten Vereniging. Honorering is op basis van 'kostenneutraal'.
|
|
Persoonlijke financiële belangen Niet van toepassing.
Persoonlijke relaties Niet van toepassing.
Extern gefinancierd onderzoek Niet van toepassing.
Intellectuele belangen en reputatie Niet van toepassing.
Overige belangen Patiëntenperspectief |
Geen. |
|
Mevr. drs. C.M. (Chantal) van Luijk - Klankbord |
Oogarts, corneaspecialist, UMC Utrecht
|
deelname adviesraad eczeem medicatie
|
Persoonlijke financiële belangen 2019: deelname adviesraad eczeemmedicatie waarvoor financiële vergoeding, Sanofi/Regeneron
Persoonlijke relaties Niet van toepassing.
Extern gefinancierd onderzoek 2022: retrospectief wetenschappelijk onderzoek waarvoor sponsoring door Santen Europe.
Intellectuele belangen en reputatie niet van toepassing. enigszins bijzondere expertise omtrent oogheelkundige eczeemzorg, welke niet direct gelinkt is aan infectieuze keratitis
Overige belangen Patiëntenperspectief |
Geen. |
|
Mevr. I. (Inger) Larsen – klankbord |
Huisarts
|
NHG richtlijn rood oog en oogtrauma
|
Persoonlijke financiële belangen Niet van toepassing.
Persoonlijke relaties Niet van toepassing.
Extern gefinancierd onderzoek Niet van toepassing.
Intellectuele belangen en reputatie Niet van toepassing.
Overige belangen Niet van toepassing. |
Geen. |
|
Mevr. dr. N. (Nienke) Miltenburg-Soeters - klankbord |
Optometrist bij Visser Contactlenzen, 0.2 fte
|
Column en redactiewerk voor ContactlensInside.nl, betaald
|
Persoonlijke financiële belangen Niet van toepassing.
Persoonlijke relaties Niet van toepassing.
Extern gefinancierd onderzoek Niet van toepassing.
Intellectuele belangen en reputatie Niet van toepassing.
Overige belangen Niet van toepassing. |
Geen. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Patiëntenfederatie Nederland en de Hoornvlies Patienten Vereniging voor de invitational conference en door een patiëntenvertegenwoordiger van de Hoornvlies Patienten Vereniging in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptmodules zijn tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en de Hoornvlies Patienten Vereniging en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module Steroïden bij bacteriële keratitis |
Uitkomst 1: Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met een (verdenking op) infectieuze keratitis. Tevens zijn er knelpunten aangedragen door middel van een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de invitational conference zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie www.gradeworkinggroup.org. De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Table of excluded studies
Literature search strategy
Algemene informatie
|
Richtlijn: Infectieuze keratitis |
|
|
Uitgangsvraag/modules: Wat is de plaats van corticosteroïden bij de behandeling van infectieuze (bacteriële) keratitis? |
|
|
Database(s): Ovid/Medline, Embase.com |
Datum: 08-06-2022 |
|
Periode: 1990 - heden |
Talen: Engels, Nederlands |
|
Literatuurspecialist: Miriam van der Maten |
|
|
BMI-zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: Er is gezocht op de elementen:
De opgegeven sleutelartikelen worden gevonden met de zoekopdracht |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
109 |
48 |
110 |
|
RCT |
149 |
94 |
170 |
|
Observationele studies |
|
|
|
|
Totaal |
258 |
142 |
280 |
Zoekstrategie
Embase.com
|
No. |
Query |
Results |
|
#8 |
#6 OR #7 |
258 |
|
#7 |
#3 AND #5 NOT #6 |
149 |
|
#6 |
#3 AND #4 |
109 |
|
#5 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
1918353 |
|
#4 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
733409 |
|
#3 |
#1 AND #2 AND ([english]/lim OR [dutch]/lim) AND [1990-2022]/py NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
3525 |
|
#2 |
'corticosteroid'/exp OR corticosteroid*:ti,ab,kw OR glucocorticoid*:ti,ab,kw OR 'adrenal cortex hormone*':ti,ab,kw OR corticoid*:ti,ab,kw OR 'steroid'/exp OR steroid*:ti,ab,kw |
1934495 |
|
#1 |
'keratitis'/exp/mj OR keratitis:ti,ab,kw OR ((cornea* NEAR/3 (ulcer* OR ulcus)):ti,ab,kw) |
32122 |
Ovid/Medline
|
# |
Searches |
Results |
|
9 |
7 or 8 |
142 |
|
8 |
(4 and 6) not 7 |
94 |
|
7 |
4 and 5 |
48 |
|
6 |
(exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf.) not (animals/ not humans/) |
1381879 |
|
5 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
569795 |
|
4 |
limit 3 to ((english language or dutch) and yr="1990 -Current") |
1838 |
|
3 |
1 and 2 |
3021 |
|
2 |
Adrenal Cortex Hormones/ or corticosteroid*.ti,ab,kf. or glucocorticoid*.ti,ab,kf. or 'adrenal cortex hormone*'.ti,ab,kf. or corticoid*.ti,ab,kf. or exp Steroids/ or steroid*.ti,ab,kf. |
1174870 |
|
1 |
exp keratitis/ or keratitis.ti,ab,kf. or (cornea* adj3 (ulcer* or ulcus)).ti,ab,kf. |
28859 |
