Behandeling schimmel keratitis
Uitgangsvraag
Wat is de optimale primaire behandeling van schimmel keratitis?
Deelvraag: Wat is de plaats van natamycine bij de behandeling van schimmel keratitis?
Aanbeveling
Denk aan een schimmel keratitis bij
- Een infiltraat met “veervormige” randen
- Multipele infiltraatjes of satellieten
- (Fors) celbeslag tegen endotheel, zelfs al bij een rustige voorste oogkamer of bij weinig hypopyon
- Wanneer een ulcus corneae niet reageert op antibiotische behandeling
Risicofactoren voor het ontstaan van een schimmel keratitis zijn
- Trauma met contact met organisch materiaal
- Het dragen van contactlenzen
- Gebruik van lokaal corticosteroïden (bijvoorbeeld als bij HSV-1 of atopie)
- Ocular surface disease
- Een immuungecompromitterde patient
Diagnostiek bij verdenking schimmel keratitis:
Neem materiaal voor kweek en indien mogelijk een direct preparaat *
- Bepaal de diepte en grootte van het infiltraat, evenals mate van eventueel weefselverlies
*zie bijlage: Hoe materiaal af te nemen
Behandeling
Voor een goede penetratie van de medicatie is het noodzakelijk dat in ieder geval gedurende de eerste drie dagen het epitheel dagelijks wordt verwijderd.
Bij oppervlakkig infiltraat (in voorste 2/3 van het stroma en kleiner dan 1,5 mm)
- Start amfotericine B 0,15% en chloorhexidine 0,02%
Bij diep infiltraat (dieper dan 2/3 van het stroma en/of groter dan 1,5 mm) en/of weefselverlies
- Verwijs naar tertiair centrum
- Start chloorhexidine 0,2%, amfotericine B 0,15% én voriconazol 1%
Dosering (voor alle middelen):
Eerste 48 uur elk uur (24/24), daarna elk uur overdag gedurende 5 dagen. Vervolgens minstens 3 weken per 2 uur of totdat het infiltraat een litteken geworden is en de inflammatoire reactie is opgeheven.
Geef géén corticosteroïden.
Wanneer er zonder (juiste) indicatie/onterecht gestart is met corticosteroïden, stop hier dan zo snel mogelijk mee. Overweeg eerst enkele dagen de dosering te halveren om een rebound effect te voorkomen.
Bij bekend worden verwekker/bij bevestiging schimmel keratitis:
- Pas eventueel medicatie aan na bekend worden van verwekker in overleg met de arts-microbioloog
Overweeg bij onvoldoende respons op de behandeling:
- Opnieuw materiaal te nemen voor direct preparaat / kweek (zowel op schimmels / gisten als bacteriën én Acanthamoeba)
- Verwijzing naar tertiair centrum
- Een diagnostisch biopt
- Bij toename van infiltratie relatief snel een therapeutische cornea transplantatie
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar de optimale behandeling van schimmel keratitis, waarbij natamycine werd vergeleken met voriconazol, amfotericine B en chloorhexidine.
Gebruikte uitkomstmaten
Genezing werd gedefinieerd als cruciale uitkomstmaat. In studies werd dit gemeten als klinische genezing of als microbiologische genezing. Als belangrijke uitkomstmaten werd gekeken naar tijd tot genezing, ernstige complicaties en kwaliteit van leven. Voor de vergelijking van de verschillende middelen op de uitkomstmaat genezing werd slechts bewijs met een zeer lage bewijskracht gevonden waardoor er veel onzekerheid bestaat over het daadwerkelijke effect. Redenen voor deze zeer lage bewijskracht zijn risico op bias in de studies (bijv. geen blindering of de inclusie van zowel schimmel- als bacteriële keratitis), conflicterende resultaten en brede 95% betrouwbaarheidsintervallen die zowel de grenzen voor ‘geen effect’ als de grenzen voor ‘verhoogd risico’ omvatten. De literatuur laat dus geen (sterk) bewijs zien voor een verhoogde kans op genezing bij behandeling met natamycine, wanneer vergeleken met een van de andere middelen (voriconazol, chloorhexidine of amfotericine B). Het is daardoor onduidelijk of natamycine leidt tot een betere genezing dan de andere typen antimycotica.
Ook voor de belangrijke uitkomstmaat tijd tot genezing werd slechts bewijs met een (zeer) lage bewijskracht gevonden. De studie van Hoffman (2022) suggereert dat behandeling met natamycine mogelijk leidt tot een 39% snellere genezing, wanneer vergeleken met chloorhexidine (HR 0.61, 95% BI: 0.47 tot 0.79). Er bestaat echter nog onzekerheid rond dit gevonden resultaat aangezien in de studiepopulatie ook bacteriële infecties werden geïncludeerd waardoor er een vertekening van de resultaten kan ontstaan.
Het gevonden bewijs over de belangrijke uitkomstmaat ernstige bijwerkingen zijn niet eenduidig. De studies van Hoffman (2022) en Rahman (1998) laten tegenstrijdige resultaten zien (RR: 0.41, 95% BI 0.2 – 0.76 en RR: 2.27, 95% BI 0.64 – 8.08 respectievelijk). De studie van Rahman (1998) heeft een zeer breed 95% BI, mede veroorzaakt door een klein aantal geïncludeerde patiënten en een beperkt aantal cases. Er bestaat veel onzekerheid over het daadwerkelijke effect. Wanneer natamycine vergeleken met voriconazol of amfotericine B, lijkt er bewijs te zijn in het voordeel van natamycine (RR: 0.61 – 95% BI: 0.40 tot 0.95 en RR: 0.81 95% BI: 0.36 tot 1.82 respectievelijk). Door beperkingen in de studieopzet, waaronder gebrek aan blindering, onduidelijke protocollen en de inclusie van bacteriële infecties, en de brede 95% betrouwbaarheidsintervallen is het vertrouwen in de gevonden effecten of ernstige complicaties (zeer) laag.
Er werden geen studies gevonden die de uitkomstmaat ‘kwaliteit van leven’ vergeleken voor de verschillende typen antimycoticum. Een verklaring hiervoor kan zijn dat de primaire focus bij de behandeling van schimmel keratitis vooral ligt op genezing en dat genezing daarom voornamelijk gebruikt is als uitkomstmaat, echter kan dit voor een patiënt een belangrijke uitkomstmaat zijn.
Bij de interpretatie van het gevonden bewijs moeten in acht worden genomen dat alle studies vooral zijn uitgevoerd in Aziatische landen, waarvan het grootste deel in India. Dit kan tot gevolg hebben dat de onderzoeken en uitkomsten hiervan niet representatief zijn voor Nederland, met betrekking tot het type verwekkers van een schimmel keratitis. Daarbij kan de gevoeligheid van de verwekkers mogelijk verschillend zijn: dezelfde soorten verwekkers kunnen in verschillende regio’s een verschillende gevoeligheid voor medicatie hebben. De geïncludeerde studies werden uitgevoerd op keratitiden die vooral veroorzaakt werden door plantaardig materiaal of trauma. De aard van de verwekkers werden niet in de analyse meegenomen. Vrijwel nooit was er sprake van een contactlens gerelateerde keratitis, terwijl dit in Nederland de meest frequent gevonden oorzaak is (vooral Fusarium spp). Hoewel er gezocht is naar zowel schimmel als gisten als verwekker, is het in de geïncludeerde studies onduidelijk of beiden werden geïncludeerd in de studie populatie, of slechts de schimmels. Gezien het feit dat deze module zich richt op de behandeling van een door schimmels of gist verdachte infectie, is dit niet van belang voor de uiteindelijke aanbeveling.
Conclusies van de auteurs van de klinische studies:
Alle geraadpleegde artikelen nemen in hun conclusie op dat natamycine de voorkeur geniet boven de andere bestudeerde middelen:
- Flor Cruz (2015 – Cochrane review): “There is evidence that natamycine is more effective than Voriconazole” (op basis van BCVA; best corrected visual acuity en minder ernstige bijwerkingen)
- Sharma (2015) “Natamycin is more effective than Voriconazole” (op basis van genezing en BCVA)
- Prajna (2020) “natamycin is comparable to Amphotericin B” (op basis van epitheliale- en microbiologische genezing)
- Hoffman (2022): “No evidence that Chlorhexidine is noninferior to Natamycin” en “strong evidence that Natamycin is better than Chlorhexidin” (op basis van BCVA)
Echter laten al deze studies beperkingen zien waardoor er onvoldoende sterk bewijs lijkt te zijn om dergelijke conclusies te kunnen trekken. Alleen het aantal gerapporteerde ernstig beloop (perforaties, transplantaties, evisceraties, enucleaties) zijn bij de andere middelen frequenter gerapporteerd.
Conclusies van reviews
Zo is de conclusie die in het review van Flor Cruz (2015) wordt getrokken, gebaseerd op een studie met 30 patiënten. De resultaten uit het review van Sharma (2015) zijn te betwisten aangezien een groot deel van de patiënten dat in eerste instantie werd behandeld met voriconazol, na 7 dagen overstapte naar behandeling met natamycine, bij onvoldoende genezing. Tevens heeft de werkgroep besloten dat visus niet beschouwd kan worden als cruciale uitkomstmaat, omdat het primaire doel van de behandeling genezing is.
Conclusies van (inter)nationale richtlijn
In internationale richtlijnen wordt de voorkeur gegeven aan natamycine als primaire monotherapie (Moorfields Eye Hospita, Microguide app; American Academy of Opthalmology guideline) gezien de effectiviteit van het middel bij de behandeling van een schimmel keratitis. Natamycine is in de landen met grote incidentie schimmel keratitiden goedkoop en beschikbaar. Natamycine is echter in Nederland niet geregistreerd. De vraag is of er zwaarwegende argumenten zijn om ook in Nederland schimmel keratitiden te gaan behandelen met natamycine.
Advies van de werkgroep
Om een advies te geven over het te starten middel bij een verdenking op een schimmel (of gist) keratitis moeten 2 vragen worden beantwoord:
- Met welk middel moet een keratitis waarbij een schimmel of gist de mogelijke verwekker is initieel worden behandeld?
- Als natamycine het middel van voorkeur is, is er dan een gelijkwaardig middel dat als alternatief kan worden ingezet?
Omdat er een advies wordt geformuleerd voor het moment dat er een verdenking is op een schimmel of gist als verwekker zal altijd materiaal voor nadere diagnostiek moeten worden afgenomen voordat met antifungale therapie wordt gestart (zie Tabel Gerichte diagnostiek bij keratitis aan de hand van risicofactoren en bijlage Hoe materiaal af te nemen)
Penetratie van een middel in het oog is cruciaal voor de effectiviteit van een middel in de behandeling van schimmel keratitis. In alle studies zijn de keratitiden waarbij het infiltraat diep gelegen is of er al verdunning van de cornea was geëxcludeerd. Derhalve moet er rekening gehouden worden met de grootte en diepte van het infiltraat. Microbiologische resultaten, zoals beschreven in MUTT (2010) en Prajna (2020) geven echter alleen informatie over een oppervlakkig gelegen micro-organisme en er zijn geen gegevens over effectiviteit bij diep gelegen infecties. Bovendien is het onduidelijk in hoeveel gevallen microbiologisch genezing ook direct leidt tot klinische genezing.
Natamycine behoort, net als amfotericine B tot de polyenen en deze middelen hebben daarmee eenzelfde werkingsmechanisme. De fysische chemische eigenschappen (moleculaire grootte) van beide middelen zijn verschillend: echter het belang daarvan is niet bestudeerd. Uit de studie van Prajna wordt echter geconcludeerd dat beide middelen (microbiologische) even effectief zijn. Natamycine wordt toegepast in een hogere concentratie dan amfotericine B (5% en 0.15% respectievelijk). Door de zeer hoge toepassingsfrequentie leidt dit verschil echter niet tot een verschil in klinisch effect; bovendien is de concentratie amfotericine B in de oogdruppel sowieso zeer ruim boven de MIC van de schimmels die de keratitis veroorzaken. Aangezien amfotericine B een gelijkwaardig werkingsmechanisme heeft aan natamycine en omdat amfotericine B in Nederland geregistreerd is als poeder voor injectie besluit de werkgroep dat beide middelen als gelijkwaardig kunnen worden beschouwd en er geen aanleiding is om natamycine te importeren.
Van natamycine, amfotericine B (Qu 2010) en chloorhexidine (Vontobel 2015) is bekend dat deze middelen niet diep in de cornea doordringen en gehinderd worden door intact epitheel. Voriconazol heeft een diepere penetratie, daarvan is bekend dat het na druppelen in de voorste oogkamer wordt aangetroffen (Thiel 2007, Lau 2008). Voor betere penetratie van de polyenen en chloorhexidine zal initieel regelmatig het epitheel verwijderd moeten worden, aangezien dit van invloed is op de penetratie van het geneesmiddel (O’Day 1984).
Chloorhexidine is fungicide met een zeer breed werkingsspectrum. Er is in vitro aangetoond dat chloorhexidine al bij een lage concentratie (0,02%) zeer effectief is op een breed scala aan schimmels (Oliviera Dos Santos, 2019). Antifungale middelen hebben een specifiek werkingsspectrum: monotherapie zal voor resistente schimmels niet effectief zijn, chloorhexidine heeft als desinfectant een zeer breed werkingsspectrum.
Gezien de ernst van een mogelijk beloop bij een resistente verwekker adviseert de werkgroep om chloorhexidine aan de primaire therapie (amfotericine B 0,15%) toe te voegen: dit kan resistente verwekkers aanvullend behandelen. Een concentratie van 0,02% wordt geadviseerd op basis van (1) de microbiologische activiteit (Oliviera dos Santos, 2019), de klinische ervaring bij werkgroep leden, en de kleinere kans op bijwerkingen (die wel gemeld worden bij gebruik van 0,2% (Hoffman 2022). Dit laatste zal bijdragen aan een betere compliance bij patiënten omdat de 0,2% minder goed verdragen wordt.
Wanneer amfotericine B niet beschikbaar is, kan gestart worden met alleen chloorhexidine oogdruppels 0,02% totdat amfotericine B voorhanden is. Wordt langdurig afwezige beschikbaarheid verwacht kan amfotericine B vervangen worden door voriconazol 1%
Op basis van de geïncludeerde studies kan er alleen een advies gegeven worden over de oppervlakkig gelegen infiltraten (< 2/3 van het stroma) en op corneae waar niet al verdunning is opgetreden. Bij een infiltraat dat dieper dan 2/3 van de dikte van de cornea is er sprake van een ernstige situatie en adviseert de werkgroep voriconazol toe te voegen aan amfotericine B en chloorhexidine. Reden hiervoor is de betere penetratie van voriconazol vergeleken met amfotericine B en chloorhexidine. In deze situatie wordt tevens geadviseerd om chloorhexidine in een dosering van 0,2% toe te dienen.
Hoewel literatuur hierover ontbreekt, is er algehele consensus dat er geen plaats is voor corticosteroïden bij de behandeling van een schimmel keratitis.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Voor de patiënt is het middel dat de beste kans op genezing geeft begrijpelijkerwijs doorslaggevend. Daarom zal in principe de keuze voor een middel bij de arts en arts-microbioloog liggen. Door de verschillende samenstelling van de middelen kunnen verschil in penetratie in het corneaweefsel optreden. Bij de wens tot maximale penetratie kan het geïndiceerd zijn om het epitheel met enige regelmaat te verwijderen, in principe de eerste 3 dagen. Dit geldt vooral voor de middelen die slecht door het epitheel diffunderen: amfotericine B, natamycine en chloorhexidine. Soms wordt dit als ongemakkelijk ervaren door de patiënt, maar met een verdovende druppel en goede uitleg is dit goed uit te voeren. Soms kunnen middelen kunnen enige milde bijwerkingen geven in de vorm van prikkend gevoel. Dit zal geen invloed hebben op de keuze van het middel.
Kosten (middelenbeslag)
De prijs voor de verschillende middelen varieert, maar de verwachting is dat de kosten geen grote rol spelen bij de keuze voor een middel. Reden hiervoor is dat schimmel keratitis een zeer zeldzame aandoening is.
Aanvaardbaarheid, haalbaarheid en implementatie
Beschikbaarheid van de middelen is een punt van zorg. Natamycine is niet beschikbaar in Nederland en moet geïmporteerd worden. Amfotericine B en Voriconazol zijn beschikbaar als grondstof voor bereiding. Chloorhexidine is beschikbaar als standaardbehandeling voor Acanthamoeba keratitis, in een concentratie van 0,02%. Echter in de studies wordt een concentratie van 0,2% gebruikt, dit is niet standaard beschikbaar in Nederland en moet worden bereid. Een zo snel mogelijke start van behandeling is altijd mogelijk. De keuze van het middel is aanvankelijk empirisch. Wanneer een middel niet beschikbaar is zal een alternatief middel gestart moeten worden. Hoge frequentie van toepassing is dan geïndiceerd om een hoge en relatief constante lokale concentratie te bereiken.
Schimmels of gisten als oorzaak voor een infectieuze keratitis is zeer zeldzaam voorkomend. Gezien de ernst van de aandoening en het zeldzame voorkomen verwachten we geen problemen bij de vergoeding van de middelen door de zorgverzekeraar.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Bij verdenking op een schimmel keratitis zal altijd materiaal voor schimmel en gist determinatie genomen moeten worden, indien mogelijk gecombineerd met een direct preparaat, om de klinische diagnose te bevestigen (zie bijlage Hoe materiaal af te nemen). Indien beschikbaar kan confocale microscopie de diagnostiek ondersteunen. Therapie wordt meteen gestart na afnemen van materiaal voor de microbiologische diagnostiek.
Er moet gedifferentieerd worden tussen een oppervlakkige aandoening (infiltraat gelegen in voorste 2/3 van het stroma, afwezig weefsel verlies, klein infiltraat (<1.5 mm)) en een diep gelegen of groter infiltraat. De grotere infiltraten vormen een bedreiging voor de effectiviteit van de medicamenteuze behandeling. Op basis van bovenstaande bevindingen en gezien het vaak ernstige beloop van de schimmel keratitis adviseert de werkgroep met dubbel therapie te starten om zo breed mogelijk werkingsspectrum te halen: naast de polyeen (als resultaat van de studie) tevens chloorhexidine te starten. Als polyeen zal in Nederland de keuze vallen op amfotericine B 0,15%. Wanneer de infectie gevorderd is (groter infiltraat dan 1,5 mm of dieper gelegen dan 2/3 van het stroma, maar ook bij al opgetreden weefselverlies) moet een tertiair centrum of een gespecialiseerde corneaspecialist de behandeling op zich nemen. Een gestarte behandeling kan, in overleg met de arts-microbioloog, aangepast worden bij bekend worden van verwekker of gevoeligheidspatroon. Wanneer de kweek niet conclusief is of de behandeling onvoldoende aanslaat kan een biopt overwogen worden (voor pathologisch en/of microbiologisch onderzoek). Bij progressie van het beeld zal bij een schimmelinfectie in een relatief vroeg stadium besloten moeten worden tot een therapeutische corneatransplantatie om uitbreiding naar het inwendige oog te voorkomen.
Onderbouwing
Achtergrond
Keratitis ten gevolge van een schimmel is erg bedreigend voor het zicht. Herkenning is moeilijker dan bij de bacteriële variant en daardoor wordt vaak pas laat de diagnose gesteld. Een schimmel wordt ofwel als co-infectie aangetroffen, bijvoorbeeld bij een niet genezend bacterieel ulcus, ofwel primair, na een organisch trauma, bij een contactlensdrager of bij ocular surface disease. Karakteristiek is een infiltraat met veervormige randen, eventueel geflankeerd door satellietjes of multipele kleine infiltraten. Er kan zich vrij vroeg al een flink beslag tegen het endotheel ontwikkelen.
Medicamenteuze therapie is minder effectief, zeker in een gevorderd stadium. Op dit moment bestaat er een grote praktijkvariatie met betrekking tot de medicamenteuze therapie van een schimmel keratitis. Het ontbreekt aan een (inter)nationale consensus. Verder zijn de medicamenteuze mogelijkheden beperkt en niet allemaal makkelijk verkrijgbaar. Internationaal wordt veel gebruik gemaakt van natamycine als primaire lokale therapie. Dit middel is in Nederland niet beschikbaar. In deze module wordt bestudeerd wat de optimale primaire behandeling is van een schimmel keratitis, en of natamycine een plaats moet krijgen in de mogelijkheden voor behandeling in Nederland.
Conclusies / Summary of Findings
Comparison 1: Topical natamycin (5%) versus topical voriconazole (1%)
|
Very low GRADE
|
Cure – natamycin (5%) vs. voriconazole (1%)
The evidence is very uncertain about the effect of treatment with natamycin (5%) on cure (6 days to 8 weeks) when compared with treatment with voriconazole (1%) in patients with fungal keratitis.
Source: Arora 2011, Mutt 2010 (from Flor Cruz 2015) and Sharma 2015 |
|
Very Low GRADE
|
Time to Cure – natamycin (5%) vs. voriconazole (1%)
The evidence is very uncertain about the effect of treatment with natamycin (5%) on time to cure when compared with treatment with voriconazole (1%) in patients with fungal keratitis.
Source: Arora 2011, Mutt 2010, Prajna 2010 (from Flor Cruz 2015) |
|
Low GRADE
|
Adverse events – natamycin (5%) vs. voriconazole (1%)
The evidence suggests that treatment with natamycin (5%) reduces the risk on serious adverse effects when compared with treatment with voriconazole (1%) in patients with fungal keratitis.
Source: Arora 2011, Mutt 2010, Prajna 2010 (from Flor Cruz 2015) |
Comparison 2 : natamycin (5%) versus chlorhexidine gluconate (0.05%, 0.1% and 0.2%)
|
Very low GRADE
|
Cure – natamycin (5%) vs. chlorhexidine gluconate (0.05%, 0.1% and 0.2%)
The evidence is very uncertain about the effect of treatment with natamycin (5%) on cure when compared with treatment with chlorhexidine gluconate (0.05%, 0.1% and 0.2%) in patients with fungal keratitis.
Source: Rahman 1997, Rahman 1998 (from Flor Cruz 2015) and Hoffman 2022 |
|
Low GRADE
|
Time to clinical cure– natamycin (5%) vs. chlorhexidine gluconate (0.2%)
The evidence suggests that treatment with natamycin (5%) reduces the time to cure when compared with treatment with chlorhexidine gluconate (0.2%) in patients with fungal keratitis.
Source: Hoffman 2022 |
|
Very Low GRADE
|
Adverse events – natamycin (5%) vs. voriconazole (1%)
The evidence is very uncertain about the effect of treatment with natamycin (5%) on adverse events when compared with treatment with chlorhexidine gluconate (0.05%, 0.1% and 0.2%) in patients with fungal keratitis.
Source: Rahman 1998 (from Flor Cruz 2015), Hoffman 2022 |
Comparison 3: Topical natamycin (5%) versus topical amphotericin B (0.15%)
|
Very low GRADE
|
Cure – natamycin (5%) vs. amphotericin B (0.15%)
The evidence is very uncertain about the effect of treatment with natamycin (5%) on cure when compared with treatment with amphotericin B (0.15%) in patients with fungal keratitis
Source: Prajna 2020 |
|
No GRADE
|
Time to Cure – natamycin (5%) vs. amphotericin B (0.15%)
No evidence was found regarding the effect of natamycin (5%) on time to clinical cure when compared with amphotericin B (0.15%) in patients with fungal keratitis.
Source: - |
|
Very low GRADE
|
Adverse events – natamycin (5%) vs. amphotericin B
The evidence is very uncertain about the effect of treatment with natamycin (5%) on adverse events, when compared with treatment with amphotericin B (0.15%) in patients with fungal keratitis.
Source: Prajna 2020 |
|
No GRADE
|
Quality of life – comparison 1, comparison 2, comparison 3.
No evidence was found regarding the effect of natamycin (5%) on quality of life when compared with amphotericin B (0.15%) in patients with fungal keratitis.
Source: - |
Samenvatting literatuur
Description of studies
Systematic review
Flor Cruz (2015) performed a Cochrane systematic review with meta-analysis on medical interventions for fungal keratitis. The databases CENTRAL (which contains the Cochrane Eyes and Vision Group Trials Register), Ovid MEDLINE, Ovid MEDLINE In-Process and Other Non-Indexed Citations, Ovid MEDLINE Daily, Ovid OLDMEDLINE, EMBASE Latin American and Caribbean Health Sciences Literature Database (LILACS), the ISRCTN registry, ClinicalTrials.gov, and the World Health Organization (WHO) International Clinical Trials Registry Platform (ICTRP) for RCTs studying medical interventions for fungal keratitis were searched. The search was executed in March 2015. Inclusion criteria for the systematic review were participants diagnosed with fungal keratitis (diagnosed either microbiologically or clinically). Studies with participants suffering from mixed bacterial and fungal infections were excluded. Studies should have at least a two-month follow-up (however, there were also studies included with a shorter follow-up period, if applicable, this was explicitly reported). Studies describing any antifungal drug, compared against each other, or compared to a placebo treatment were included. The treatments that were compared in the studies included in the systematic review were: topical natamycin, topical voriconazole and topical chlorhexidine gluconate. Outcomes in this systematic review included clinical cure (at two to three months), time to clinical cure, compliance with treatments, adverse effects (corneal thinning, descemetocele formation, corneal perforation, endophthalmitis, chemosis, punctate keratopathy, recurrent epithelial erosions, conjunctival injections, ulceration and necrosis of conjunctiva, hepatotoxicity and renal toxicity) and quality of life. In total twelve studies were included in the systematic review, which were mainly conducted in India. Of these twelve studies included in the review, five studies matched the PICO and were therefore relevant for the purpose of this guideline (Arora, 2011; MUTT trial, 2010; Prajna, 2010; Rahman 1997; Rahman 1998;). Main reason for excluding RCT’s from this systematic was the comparison of oral treatments for fungal keratitis. The studies of Arora (2011), MUTT (2010) and Prajna (2010) compared natamycin (5%) with voriconazole (1%). The studies of Rahman (1997) and Rahman (1998) compared natamycin (5%) with chlorhexidine (0.05%, 0.1% and 0.2%). Results for the different concentrations were combined, however chlorhexidine 0.2% was mostly used; in 52 patients in total (Rahman 1997; Rahman 1998). Chlorhexidine 0.05% and chlorhexidine 0.1% were used in 8 and 17 patients respectively (Rahman 1997). The study of Rahman (1998) used natamycin 2.5%, however, in this review (Flor Cruz, 2015) results of this concentration were combined with results of natamycin 5%.
Randomized controlled trials
The RCT performed by Hoffman (2022) compared treatment of filamentous fungal keratitis with topical chlorhexidine 0.2% with treatment with topical natamycin 5%. The study was executed in a tertiary care hospital in Nepal. Adults suffering from acute microbial keratitis, with evidence of filamentous fungal infection were eligible to participate. People with mixed bacterial-fungal infection were also eligible to participate. Exclusion criteria included prior topical antifungal use, no perception of light visual acuity in the affected eye, and very severe ulcers warranting immediate surgical intervention (e.g., impending perforations and perforated corneal ulcers). In total, 178 patients were randomly assigned to treatment with 0.2% chlorhexidine, and 176 were assigned to treatment with 5% natamycin. For the first 48 hours, one drop was given hourly. Then, hourly while awake for the next 5 days, and every 2 hours while awake until week 3 a drop was given. Outcomes included microbiological cure at 7 days, time to full epithelial healing and serious adverse effects, like perforation or therapeutic penetrating keratoplasty at 3 months. Data on microbiological cure was only available for 148 patients, as a repeated culture was not performed in 208 patients.
In the RCT of Prajna (2020) treatment of filamentous fungal keratitis with natamycin was compared to treatment with amphotericin B. The study was executed in an eye hospital in India. Patients aged 18 – 70 years, with a corneal ulcer, positive smear for filamentous fungus and visual acuity of 20/70 (logMAR 0.54) or worse were eligible to participate. Participants with concomitant infection with herpes or bacteria were excluded, as well as patients with involvement of posterior stroma of the cornea and thin cornea’s of less than 350 micron. In total, 26 patients were assigned to topical natamycin 5% eyedrops, and 30 patients were assigned to topical amphotericin B 0.15% eyedrops. The eyedrops were administered every hour while awake, the duration of treatment was not reported. The participants received additional therapy of homatropine 2% for 3 times daily. Follow-up was at three days, three weeks, and three months. Outcomes that were assessed at follow-up included microbiological cure at 3 days, percentage of participants with epithelial healing and serious adverse effects.
In the double blind RCT of Sharma (2015) treatment of fungal keratitis with topical voriconazole was compared to treatment with topical natamycin. The study was executed in three tertiary centres in India. Patients with a diagnosis of fungal keratitis (positive corneal scraping and ulcer 2 – 6 mm), aged 18 years and older were eligible to participate. Patients with bacterial growth were excluded, as well as patients with a deeply located infiltrate (>2/3 stromal depth) or an impending or actual perforation. In total, 58 patients were randomly assigned to topical 1% voriconazole eye drops and 60 patients were assigned to topical 5% natamycin eye drops. The dosage schedule was as follows: day 1-3 one drop every hour 24 hours, day 4 one drop every hour while wake and one drop per 3 hours while sleeping, day 5 and further one drop every two hours while awake. Seven participants were lost to follow-up and in the control group four. Additionally, in both groups six people had missing outcome data. Outcomes included healing (resolving of the ulcer) at 7 days. Patients in the voriconazole group who not experienced healing at 7 days, switched over to treatment with natamycin. Therefore, outcomes assessed after 7 days could not be used.
Results
The results were presented for the 3 separate comparisons:
- Comparison 1: Topical natamycin (5%) versus topical voriconazole (1%)
- Comparison 2: Topical natamycin (5%) versus topical chlorhexidine gluconate (0.05%, 0.1% and 0.2%)
- Comparison 3: Topical natamycin (5%) versus topical amphotericin B (0.15%)
Comparison 1: Topical natamycin (5%) versus topical voriconazole (1%)
Cure
Microbiological cure (negative culture)
One study reported the outcome microbiological cure, at 6 days, for the comparison natamycin (5%) with voriconazole (1%) (MUTT, 2010). Of the patients receiving natamycin 132/155 (85.2%) had a negative culture, compared to 75/144 (52.1%) of the patients receiving voriconazole. The Risk Ratio (RR) was 1.64 (95% CI: 1.38 to 1.94), favoring treatment with natamycin (Table 1). This was considered clinically relevant.
Clinical cure
Two studies reported clinical cure for the comparison natamycin (5%) with voriconazole (1%) (Arora 2011; Sharma 2015). Arora (2011) reported clinical cure (resolution of ulcer) at eight weeks. In the natamycin group, all patients were cured at eight weeks (15/15; 100%), in the voriconazole group 14 patients were cured at eight weeks (14/15; 93.3%). The Risk Ratio (RR) was 1.07 (95% CI: 0.89 to 1.28). Sharma (2015) reported clinical cure (complete absence of stromal infiltrate, plaque and satellite lesions) at seven days. In the natamycin group, 35/54 (65%) patients experienced clinical cure compared to 34/50 (68%) in the voriconazole group. The RR was 0.95 (95% CI: 0.73 to 1.25; Table 1)
Table 1: studies on clinical cure for the comparison natamycin (5%) versus voriconazole (1%)
RR > 1.00 favouring treatment with natamycin; RR < 1.00 favouring treatment with voriconazole.
|
Study |
|
Follow-up duration |
Risk Ratio (95% CI) |
N (natamycin/voriconazole) |
|
MUTT 2010 (Flor Cruz, 2015) |
Microbiological |
6 days |
1.64 (1.38 to 1.94) |
155 / 144 |
|
Arora, 2011 (Flor Cruz, 2015) |
Clinical |
8 weeks |
1.07 (0.89 to 1.28) |
15 / 15 |
|
Sharma, 2015 |
Clinical |
7 days |
0.95 (0.73 to 1.25) |
54 / 50 |
Time to clinical cure
Three studies reported time to clinical cure for the comparison natamycin (5%) with voriconazole (1%) (Arora 2011, MUTT, 2010, Prajna 2010). Arora (2011) reported a mean time to clinical cure of 24.3 days for the patients treated with natamycin (n = 15), and 27.4 days for the patients treated with voriconazole (n = 14, with healed ulcer). MUTT (2010) reported a median time to re-epithelialization of 31 days (IQR: 21-50 days) for the natamycin group and 39 days (IQR: 28-53 days) in the voriconazole group. A Hazard Ratio (HR) of 1.25 (95% CI 0.95 to 1.65), favoring natamycin was reported. Prajna (2010) reported a HR 0.95 (95% CI 0.88 to 1.15; Table 2)
Table 2: studies on time to clinical cure for the comparison natamycin (5%) versus voriconazole (1%)
|
Study |
Natamycin |
Voriconazole |
Effect measure |
N (natamycin/voriconazole) |
|
Arora, 2011 (Flor Cruz, 2015) |
Mean: 24.3 days |
Mean: 27.4 days |
Not reported |
15 / 14 |
|
Mutt 2010 (Flor Cruz 2015) |
Median: 31 days |
Median: 39 days |
HR: 1.25 (95% CI: 0.95 – 1.65) |
155 / 144 |
|
Prajna 2010 (from Flor Cruz 2015) |
Not reported |
Not reported |
HR: 0.95 (95% CI 0.88 – 1.15) |
60 / 60 |
Adverse effects
Three studies reported adverse effects for the comparison natamycin (5%) with voriconazole (1%) (Arora 2011; MUTT 2010; Prajna 2010). Adverse effects that were reported included corneal perforations and therapeutic penetrating keratoplasty. The pooled effect shows adverse effects in 27/216 patients (12.5%) in the natamycin group compared to 45/218 patients (20.6%) in the voriconazole group. The pooled RR was 0.61 (95% CI: 0.40 to 0.95), favoring natamycin (Figure 1). This was considered clinically relevant.

Figure 1. Forest plot showing the comparison between 5% natamycin and 1% voriconazole on the outcome adverse effects. Risk Ratio, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity; SD: standard deviation; CI: confidence interval.
Quality of life
None of the included studies reported on the outcome quality of life for the comparison natamycin (5%) to voriconazole (1%).
Comparison 2: Topical natamycin (5%) versus topical chlorhexidine gluconate (0.05%, 0.1% and 0.2%).
Cure
Microbiological cure (negative culture)
One study reported microbiological cure, at 7 days, for the comparison natamycin (5%) with chlorhexidine gluconate (0.2%) (Hoffman, 2022). For 148 patients of the total study population, a repeated culture was performed. Of the patients treated with natamycin, 54/65 (83.1%) were culture negative, compared to 61/83 (73.5%) of the patients treated with chlorhexidine. The RR was 1.13 (95% CI: 0.95 to 1.34).
Clinical cure
Two studies reported clinical cure for the comparison natamycin (5%) with chlorhexidine gluconate (0.05%, 0.1% and 0.2%), at 21 days follow-up (Rahman 1997; Rahman 1998). The pooled number of patients with clinical cure was 16/46 (34.8%) in the natamycin group, compared to 35/64 (54.7%) in the chlorhexidine group. The RR was 0.71 (95% CI: 0.46 – 1.10), favoring chlorhexidine. This was considered clinically relevant.
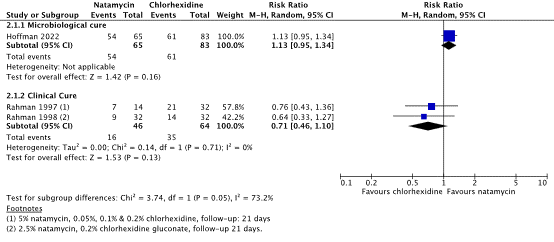
Figure 2. Forest plot showing the comparison between 5% natamycin and chlorhexidine gluconate on the outcome clinical cure. Risk Ratio, random effects model. Z: p-value of overall effect; df: degrees of freedom; I2; statistical heterogeneity; SD: standard deviation; CI: confidence interval.
*Hoffman (2022) Chlorhexidine 0.2%; Rahman (1997) chlorhexidine 0.05%, 0.1% en 0.2%; Rahman 1998 chlorhexidine gluconate (0.2%)
Time to clinical cure
One study reported time to re-epithelialization for the comparison natamycin (5%) with chlorhexidine gluconate (0.2%) (Hoffman 2022) A HR of 0.61 (95% CI: 0.47 to 0.79) was reported, favoring natamycin. This was considered clinically relevant. The HR indicates patients treated with chlorhexidine, on average healed 39% more slowly than those treated with natamycin.
Adverse effects
Two studies reported adverse effects for the comparison natamycin (2.5%) with chlorhexidine gluconate (0.05%, 0.1% and 0.2%) (Hoffman 2022; Rahman 1998).
Rahman (1998) reported 7/36 (19.4%) serious adverse events in the natamycin group, compared to 3/35 (8.6%) adverse events in the chlorhexidine group (enucleation, perforations or therapeutic penetrating keratoplasty). The RR was: 2.27 (95% CI: 0.64 to 8.08).
Hoffman (2022) reported 13/173 (7.5%) serious adverse events in the natamycin group, compared to 32/175 (18.3%) adverse events in the chlorhexidine group (corneal perforation or therapeutic penetrating keratoplasty or evisceration). The RR was: 0.41 (95% CI: 0.2 to 0.76), favoring treatment with natamycin. This was considered clinically relevant.
Quality of life
None of the included studies reported on the outcome quality of life for the comparison natamycin (5%) to chlorhexidine gluconate (0.05%, 0.1% and 0.2%).
Comparison 3: Topical natamycin (5%) versus topical amphotericin B (0.15%)
Cure
Microbiological cure (negative culture)
One study reported microbiological cure, at 3 days, for the comparison natamycin (5%) with amphotericin B (0.15%) (Prajna 2020). Of the patients treated with natamycin, 21/26 (81%) were culture negative, compared to 20/28 (71.4%) of the patients treated with chlorhexidine. The RR was 1.13 (95% CI: 0.84 to 1.53).
Clinical cure
None of the included studies reported clinical cure for the comparison topical natamycin (5%) with topical amphotericin B (0.15%).
Time to clinical cure
None of the included studies reported time to clinical cure for the comparison topical natamycin (5%) with topical amphotericin B (0.15%).
Adverse effects
One study reported adverse effects for the comparison natamycin (5%) with amphotericin B (0.15%) (Prajna, 2020). Adverse effects that were reported included perforations, therapeutic penetrating keratoplasty and endophthalmitis. Adverse effects were observed in 7/26 (27%) patients treated with natamycin compared to 10/30 (30%) patients treated with amphotericin B. This resulted in a RR of 0.81 (95% CI: 0.36 to 1.82).
Quality of life
None of the included studies reported on the outcome quality of life for the comparison topical natamycin (5%) with topical amphotericin B (0.15%).
Level of evidence of the literature
Comparison 1: Topical natamycin (5%) versus topical voriconazole (1%)
The level of evidence regarding the outcome measure cure (clinical and microbiological) for the comparison natamycin (5%) with voriconazole (1%) was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by 3 levels because of study limitations including unclear randomization and allocation procedure and limited generalizability of the study population (-1 risk of bias), conflicting outcomes (-1 inconsistency) and the 95% confidence intervals crossing the boundaries of clinical decision making (-1 imprecision). The final level of evidence was graded ‘very low’.
The level of evidence regarding the outcome measure time to cure for the comparison natamycin (5%) with voriconazole (1%) was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by 3 levels because of study limitations including unclear randomization and allocation procedure and of limited generalizability of the study population (-1 risk of bias), conflicting outcomes (-1 inconsistency) and the 95% confidence intervals crossing the boundaries of clinical decision making. The final level of evidence was graded ‘very low’.
The level of evidence regarding the outcome measure adverse events for the comparison natamycin (5%) with voriconazole (1%) was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by 2 levels because of study limitations including unclear randomization and allocation procedure of limited generalizability of the study population (-1 risk of bias) and the 95% confidence intervals crossing the boundaries of clinical decision making. The final level of evidence was graded ‘low’.
Comparison 2: Topical natamycin (5%) versus topical chlorhexidine gluconate (0.05%, 0.1% and 0.2%).
The level of evidence regarding the outcome measure cure (clinical and microbiological) for the comparison natamycin (5%) with chlorhexidine gluconate (0.05%, 0.1% and 0.2%) was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by 3 levels because of study limitations including lack of blinding and limited generalizability of the study population (-1 risk of bias), conflicting outcomes (-1 inconsistency) and the 95% confidence intervals crossing the boundaries of clinical decision making (-1 imprecision). The final level of evidence was graded ‘very low’.
The level of evidence regarding the outcome measure time to cure for the comparison natamycin (5%) with chlorhexidine gluconate (0.2%) was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by 2 levels because of study limitations including the inclusion of mixed infections and limited generalizability of the study population (-1 risk of bias), and the small study population (-1 imprecision). The final level of evidence was graded ‘low’.
The level of evidence regarding the outcome measure adverse events for the comparison natamycin (5%) with chlorhexidine gluconate (0.05%, 0.1% and 0.2%) was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by 3 levels because of study limitations including the inclusion of mixed infections and limited generalizability of the study population (-1 risk of bias), conflicting results (-1 inconsistency) and the 95% confidence intervals crossing the boundaries of clinical decision making (-1 imprecision). The final level of evidence was graded ‘very low’.
Comparison 3: Topical natamycin (5%) versus topical amphotericin B (0.15%)
The level of evidence regarding the outcome measure cure (microbiological) for the comparison natamycin (5%) with amphotericin B (0.15%) was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by 3 levels because of limited generalizability of the study population (-1 risk of bias) and the 95% confidence intervals crossing the boundaries of clinical decision making (-2 imprecision). The final level of evidence was graded ‘very low’.
The evidence for the outcome measure time to clinical cure was not graded as it was not reported in the included studies.
The level of evidence regarding the outcome measure adverse events for the comparison natamycin (5%) with amphotericin B was derived from randomized controlled trials and therefore started high. The level of evidence was downgraded by 3 levels because of limited generalizability of the study population (-1 risk of bias) and the 95% confidence intervals crossing the boundaries of clinical decision making (-2 imprecision). The final level of evidence was graded ‘very low’.
The level of evidence for the outcome quality of life was not graded as it was not reported in the included studies (comparison 1, comparison 2, comparison 3).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effectiveness and safety of natamycin compared to voriconazole, chlorhexidine and amphotericin B in the treatment of patients with fungal keratitis?
P: Patients with fungal keratitis
I: natamycin
C: voriconazole, chlorhexidine, amphotericin B
O: Cure (clinical and microbiological), time to clinical cure, serious adverse effects,
and quality of life.
Relevant outcome measures
The guideline development group considered cure (clinical and microbiological) as a critical outcome measure for decision making; time to clinical cure, adverse effects and quality of life were considered as important outcome measures for decision making.
The working group defined the outcome ‘cure’ as follows:
- Microbiological cure was defined as a negative culture
- Clinical cure was defined a resolution of the ulcer. In case of fungal keratitis, there is the possibility of a closed epithelium, while the infiltrate is still present. As a consequence, a closed epithelium does not necessarily indicate a healed infiltrate. Therefore, the working group decided not to use epithelial healing as a measure for clinical cure.
For the outcomes ‘time to clinical cure’, ‘serious adverse events’ and ‘quality of life’, the working group did not define the outcome measures but used the definitions used the included studies.
The working group defined a relative risk (RR) for dichotomous outcomes of <0.80 and >1.25 as a minimal clinically (patient) important difference. This applies to the outcome treatment success and adverse effects. For the outcome time to clinical cure, a threshold of 21 days was set as a minimal clinically important difference. For the outcome quality of life, a 10% difference, assessed with a validated scale was set as a minimal clinically important difference.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 21st of March 2022. The systematic review of Flor Cruz (2015) was identified and used a search strategy identical to the search criteria for this guideline chapter concerning natamycin, voriconazole and chlorhexidine. Therefore, for the interventions natamycin, voriconazole and chlorhexidine, additional studies published between 2015 to 21st of March 2022 were searched. For studies on the intervention amphotericin B no data restriction was applied. Search terms for both filamentous and yeasts infections were included. A separate search term for candida was not used. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 65 hits. Studies were selected based on the following criteria: systematic reviews and randomized controlled trials comparing local interventions natamycin, voriconazole, chlorhexidine B and amphotericin B (not intravenous or oral) for the treatment of fungal keratitis (filamentous and yeast infections). Eight studies were initially selected based on title and abstract screening. After reading the full text, four studies were excluded (see the table with reasons for exclusion under the tab Methods), and four studies were included.
Results
One systematic review and three RCTs were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- <strong>FlorCruz NV, Evans JR. Medical interventions for fungal keratitis. Cochrane Database Syst Rev. 2015 Apr 9;(4):CD004241. doi: 10.1002/14651858.CD004241.pub4. PMID: 25855311.
- Hoffman JJ, Yadav R, Sanyam SD, Chaudhary P, Roshan A, Singh SK, Singh SK, Mishra SK, Arunga S, Hu VH, Macleod D, Leck A, Burton MJ. Topical Chlorhexidine 0.2% versus Topical Natamycin 5% for the Treatment of Fungal Keratitis in Nepal: A Randomized Controlled Noninferiority Trial. Ophthalmology. 2022 May;129(5):530-541. doi: 10.1016/j.ophtha.2021.12.004. Epub 2021 Dec 9. PMID: 34896126; PMCID: PMC9037000.
- Oliveira Dos Santos C, Kolwijck E, van der Lee HA, Tehupeiory-Kooreman MC, Al-Hatmi AMS, Matayan E, Burton MJ, Eggink CA, Verweij PE. In Vitro Activity of Chlorhexidine Compared with Seven Antifungal Agents against 98 Fusarium Isolates Recovered from Fungal Keratitis Patients. Antimicrob Agents Chemother. 2019 Jul 25;63(8):e02669-18. doi: 10.1128/AAC.02669-18. PMID: 31182529; PMCID: PMC6658757.
- O'Day DM, Ray WA, Head WS, Robinson RD. Influence of the corneal epithelium on the efficacy of topical antifungal agents. Invest Ophthalmol Vis Sci. 1984 Jul;25(7):855-9. PMID: 6329991.
- Prajna, Radhakrishnan N, Lalitha P, Austin A, Ray KJ, Keenan JD, Porco TC, Lietman TM, 2019 Sep 4. PMID: 31619359; PMCID: PMC6982573.
- Qu L, Li L, Xie H. Corneal and aqueous humor concentrations of amphotericin B using three different routes of administration in a rabbit model. Ophthalmic Res. 2010;43(3):153-8. doi: 10.1159/000254566. Epub 2009 Nov 4. PMID: 19887881.
- Sharma S, Das S, Virdi A, Fernandes M, Sahu SK, Kumar Koday N, Ali MH, Garg P, Motukupally SR. Re-appraisal of topical 1% voriconazole and 5% natamycin in the treatment of fungal keratitis in a randomised trial. Br J Ophthalmol. 2015 Sep;99(9):1190-5. doi: 10.1136/bjophthalmol-2014-306485. Epub 2015 Mar 4. PMID: 25740805.
- Vontobel, S. F., Abad-Villar, E. M., Kaufmann, C., Zinkernagel, A. S., Hauser, P. C., & Thiel, M. A. (2015). Corneal penetration of polyhexamethylene biguanide and chlorhexidine digluconate. J Clin Exp Ophthalmol, 6(430), 2.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Flor Cruz, 2015
Study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to 16 march 2015
A: Arora, 2011 B: MUTT, 2010 C: Prajna, 2010 D: Rahman, 1997 E: Rahman, 1998
Study design: RCT Parallel group RCT: A, B, C, D, E,
Setting and Country: A: Tertiary care centre, India B: Multicentre, India C: Multicentre, India D: Eye hospital, India E: Bangladesh
Source of funding and conflicts of interest: A: not reported B: funded by non-commercial grants; received treatments from pharmaceutical company, no conflicts of interest C: funded by non-commercial grants, received treatments from pharmaceutical company, no conflicts of interest D: funding by non-commercial grant, conflicts of interest not reported E funding by non-commercial grant, no conflicts of interest
|
Inclusion criteria SR: -patients with fungal keratitis (diagnosed clinically or microbiologically) -studies using any antifungal drugs (including placebo controlled trials)
Exclusion criteria SR: -patients with mixed bacterial and fungal infections
12 studies included, of which 7 were relevant
Important patient characteristics at baseline: Total; I/C A: n = 30; 15/15 B: n = 323; 162/161 C n = 120; 60/60 D n = 60; 42/18 (n = 8; n = 17; n = 17 resp. for each dose) E n = 70; 35/35
Mean age (years) A: 43 years B 47 years C: 47 years D: not reported, patients aged > 50 years included E 43 years
Sex: Males (%) A: 70% B: 57% C: 66% D: 76% E: 74%
Groups comparable at baseline?
|
A: Topical natamycin 5%, (+ additional standard treatment protocol) B Topical natamycin 5%, C: Topical natamycin 5%, 1 D: Chlorhexidine gluconate (0.05%, 0.1%, 0.2%) E: Chlorhexidine gluconate 0.2%
|
A: topical voriconazole 1%, (+additional standard treatment protocol) B: Topical voriconazole 1%, C: Topical voriconazole 1%, D: Natamycin 5% E: Natamycin 2.5%
|
End-point of follow-up:
A: 10 weeks or until complete resolution B: 3 months C: 3 months D: 3 weeks E: 6 months to 1 year
For how many participants were no complete outcome data available? (intervention/control) A: “no reported drop outs” B: I: 21/162 (13%) / C: 18/161 (11%) C: There was lost to follow-up but exact rates are not clear D: “two patients were lost to follow-up” E: I: 3/36 (8.3%) / C: 13/35 (37/1%)
|
Outcome measure 1: clinical cure RR (95% CI) A: 1.07 (0.89 – 1.28) B: microbiological cure at 6 days: 1.64 (1.38 – 1.94) C: not reported D: 0.76 (0.43 – 1.36) E: 0.64 (0.33 – 1.27)
Outcome measure-2: time to clinical cure (days) or HR (95% CI) A: I: 24.3 days / C: 27.4 days B: HR: 1.25 (0.95 – 1.65) C: HR: 0.95 (0.88 – 1.15) D: not reported E: not reported
Outcome measure-3: Best-corrected visual acuity; logMAR ± SD A: I: 1.37 ± 0.88 / C: 1.78 ± 1.04 B: I: 0.39 ± 0.53 / C: 0.57 ± 0.66 C: I: 0.69 ± 0.80 / C: 0.63 ± 0.76 D: not reported E: not reported
Outcome measure 4: adverse outcomes: RR (95% CI) A: I: 0/15 – C: 1/15 B: 0.54 (0.32 – 0.90) C: 0.90 (0.39 – 2.06) D: not reported E: I: 7/36 – C: 3/35
Outcome measure 5: Quality of Life A: Not reported B: Not reported C: Not reported D: Not reported E: Not reported
|
Facultative:
The authors concluded that: “The trials included in this review were of variable quality and were generally underpowered. There is evidence that natamycin is more effective than voriconazole in the treatment of fungal ulcer”
Risk of Bias assessment: RS: random sequence generation; AC: allocation concealment; BL: blinding; IO: incomplete outcome data; SR: selective reporting
A: RS: unclear, AC: unclear, BL: low, IO: low, SR: unclear B: RS: low, AC: low, BL; low, IO: low, SR; unclear C: RS: low, AC: low, BL: low/unclear, IO: low, SR: unclear D:RS: low, AC; low, BL; low, IO: low, SR: low E: RS: low, AC: low, BL: high, IO: high, SR: unclear
|
Evidence table for intervention studies studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Prajna 2020 |
Type of study: Single blinded RCT
Setting and country: Eye hospital, India, between January 2016 and March 2018
Funding and conflicts of interest: Non-commercially grants, no conflicts of interest |
Inclusion criteria: -presence of corneal ulcer - smear positive for filamentous fungus -presenting visual acuity of 20/70 (logMAR 0.54) or worse - between 18 and 70 years old
Exclusion criteria: -involvement of the posterior 1/3 of the stroma - central pachymetry less than 350 mm - evidence of concomitant infection with herpes or bacteria - impeding or frank perforation or limbal involvement - no light perception vision in the affected eye - visual acuity worse than 20/200 in unaffected eye N total at baseline: Intervention: 26 Control: 30
Important prognostic factors2: age median (IQR) yr I: 50 (36, 55) C: 45 (40, 58)
Sex: n/total male (%) I: 17/26 (65%) C: 14/30(46%)
Groups comparable at baseline? Yes
|
Topical natamycin 5% eye drops, every hour while awake
(+ additional therapy of homatropine 2%, 3 times daily, duration of treatment not reported)
|
Topical amphotericin B 0.15% every hour while awake
(+ additional therapy of homatropine 2%, 3 times daily, duration of treatment not reported)
|
Length of follow-up: Follow-up at 3 days, 3 weeks and 3 months
Loss-to-follow-up: Intervention: n = 5 (19%) Reasons not reported
Control: n = 4 (13%) Reasons not reported
No incomplete outcome data
|
BSCVA at 3 months, median (IQR) logMAR At baseline I: 1.05 (0.62 – 1.12) C: 1.05 (0.62 – 1.70)
At follow-up I: 0.42 (0.10 – 0.72) C: 0.48 (0.20 – 1.70)
Adverse effects (including corneal perforation or the need for keratoplasty) I: n = 7 (27%) C: n = 11 (30%) RR: 0.73 (95% CI 0.33 – 1.62) |
The authors concluded that: “patients with mild to moderate filamentous fungal infections appear to have similar outcomes when treated with amphotericin compared with natamycin”
Overall risk of bias for this study is low. |
|
Sharma 2015 |
Type of study: Double blinded RCT
Setting and country: Multicentre; at three tertiary centres in India between November 2010 and December 2012
Funding and conflicts of interest: Funded by non-commercial grant, treatments provided by pharmaceutical company, no conflicts of interest |
Inclusion criteria -aged > 18years - presence of a corneal epithelial defect with stromal infiltrate or exudate, clinically suggestive of fungal ulcer with or without hypopyon - diameter of ulcer between 2 and 6 mm - corneal scraping positive for fungal filaments
Exclusion criteria -Duration of complaints, more than 14 days - current treatment with antifungal eye drops (> 6 times/day) - presence of serious conditions on the eye (including penetration, blind– see full text) - allergy to one of the treatments - HIV-positive or diabetic - presence of bacterial growth
N total at baseline Intervention: 58 Control: 60
Important prognostic factors2: age mean ± SD yr I: 42 C: 40
Sex: n/total male (%) I: 43/58 (74%) C: 42/60 (70%)
Groups comparable at baseline? Yes
|
Topical 1% voriconazole
Day 1-3: one drop every hour, day 4: one drop hourly while awake, every 3 hours when asleep, day 5 and after: one drop every two hours while awake until cured |
Topical 5% natamycin
Day 1-3: one drop every hour, day 4: one drop hourly while awake, every 3 hours when asleep, day 5 and after: one drop every two hours while awake until cured |
Length of follow-up At week 1, and last follow-up visit -natamycin: mean final follow-up at 26 (15 to 38.5) days -voriconazole: mean follow-up at 21 (10.33) days
Loss-to-follow-up: Intervention: n = 7 (12,1%) Reasons: not reported
Control: n = 4 (6,7%) Reasons: not reported
Missing outcome data: Intervention: n = 6 (10,3%) Reasons: not reported
Control: n = 6 (10%) Reasons: not reported
|
Ulcer healing at 7 days I: 34/50 (68%) C: 35/54 (65%) RR: 0.95 (0.73 – 1.25)
Ulcer healing at final follow-up I: 34/51 (66.6%) C: 50/56 (89.2%) RR: 1.34 (1.08 – 1.66)
Visual acuity (logMAR) Data only presented graphically
Adverse events (patients requiring surgical interventions/treatment failure) Could not be used since participants with worsening switched over from voriconazole to natamycin |
The authors concluded that: “Natamycin was more effective in the treatment of fungal keratitis, when compared with voriconazole” |
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear
|
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Flor Cruz 2015 |
Yes;
Reason: research question was “what is the best treatment for fungal infection of the cornea (fungal keratitis)?
|
Yes;
Reason: search period is described and Medline + EMBASE were searched |
Yes;
Reason: study includes a list of excluded studies with reason for exclusion
|
Yes;
Reason: baseline characteristics of the included studies are presented in a table
|
Not applicable;
Reason: only RCTs were included |
Yes;
Reason: risk of bias table is available in the systematic review |
Yes;
Reason I2 was used to assess heterogeneity |
Yes;
Reason: it is mentioned that there were fewer than 10 studies in the meta analysis |
Yes;
Reason: reported for the systematic review and included studies |
Risk of bias table for interventions studies (cohort studies based on risk of bias tool by the CLARITY Group at McMaster University)
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no
|
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Prajna, 2020 |
Definitely yes;
Reason: block randomization created with statistical software
|
Definitely yes;
Reason: randomization sequence generated at coordinating site |
Probably yes;
Reason: “all participants, physicians, refractionists and the microbiologists were masked to medication assignment”, not clear data analysts were blinded
|
Probably yes;
Reason: follow-up was infrequent and there was no evidence that loss to follow-up as associated with baseline |
Probably yes;
Reason: all outcomes reported in the methods section are reported, |
Probably yes;
Reason: no other sources of bias could be identified |
Low
|
|
Sharma, 2015 |
Definitely yes;
Reason: “patients were randomised using computer-generated randomisation blocks” |
No information
|
Probably yes;
Reason: the treating ophthalmologist, microbiologist and patients were masked to the drugs, no information on data analysts but it is reported that the trial is double-blinded
|
Probably yes;
Reason: loss to follow-up was infrequent and does not seem to be associated to baseline or treatment, but not clear how follow-up period was assessed |
Probably no;
Reason; no transparent way of presenting the data, some outcomes only presented in a graph, or in words (no numbers) |
Probably no;
Reason: patients not treated by intention to treat principle, if worsening occurred, participants were switched over to the other treatment |
Some concerns |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 02-09-2024
Beoordeeld op geldigheid : 27-08-2024
Algemene gegevens
De ontwikkeling van deze richtlijnmodules werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in nov 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor infectieuze keratitis.
Werkgroep
- Mevr. Dr. C.A. (Cathrien) Eggink, Oogarts, Nederlands Oogheelkundig Gezelschap (NOG), voorzitter werkgroep
- Mevr. dr. M.C. (Marjolijn) Bartels, Oogarts, Nederlands Oogheelkundig Gezelschap (NOG)
- Dhr. drs. J. (Jeroen) van Rooij, Oogarts, Nederlands Oogheelkundig Gezelschap (NOG)
- Mevr. dr. L. (Lies) Remeijer, Oogarts, Nederlands Oogheelkundig Gezelschap (NOG)
- Mevr. dr. N. (Nienke) Visser, Oogarts, Nederlands Oogheelkundig Gezelschap (NOG)
- Dhr. dr. E. (Erik) Schaftenaar, Arts-microbioloog, Nederlandse Vereniging voor Medische Microbiologie (NVMM)
- Mevr. drs. C. (Claudy) Oliveira dos Santos, Arts-microbioloog, tot 11 april 2023, Nederlandse Vereniging voor Medische Microbiologie (NVMM)
- Dhr. prof. dr. P.E. (Paul) Verweij, Arts-microbioloog, vanaf 11 april 2023, Nederlandse Vereniging voor Medische Microbiologie (NVMM)
- Dhr. dr. W. (Wouter) Bult, Ziekenhuisapotheker, Nederlandse Vereniging van Ziekenhuisapothekers (NVZA)
- Dhr. M. (Michel) Versteeg MCM, Patiëntvertegenwoordiger, Hoornvlies patiënten vereniging (HPV)
Klankbord
- Mevr. drs. C.M. (Chantal) van Luijk, Oogarts, Nederlands Oogheelkundig Gezelschap (NOG)
- Mevr. I. (Inger) Larsen, huisarts, Nederlands Huisartsen Genootschap (NHG)
- Mevr. dr. N. (Nienke) Miltenburg-Soeters, optometrist, Optometristen Vereniging Nederland (OVN)
Met ondersteuning van
- Mw. MSc. D.G. (Dian) Ossendrijver, junior adviseur, Kennisinstituut van Medisch Specialisten.
- Mw. dr. A.C.J. (Astrid) Balemans, senior adviseur, Kennisinstituut van Medisch Specialisten.
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Mevr. Dr. C.A. (Cathrien) Eggink |
Oogarts in Radboudumc
|
Geen
|
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen. |
Geen. |
|
Mevr. dr. M.C. (Marjolijn) Bartels |
Oogarts Deventer Ziekenhuis
|
Refractie chirurg (Iris Eye Clinics) detachering via Deventer Ziekenhuis.
|
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek ZonMW gefinancierd onderzoek: 1. BICAT studie afgerond. 2. Net opgestart EPICAT studie. 3. DSAEK versus DMEK studie afgerond Intellectuele belangen en reputatie Geen.
Overige belangen Geen. |
Geen, onderzoeken gaan niet over keratitis. |
|
Dhr. drs. J. (Jeroen) Rooij |
Oogarts |
Geen. |
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Gefinancierd, belangenloos en zonder restricties, door Stichtingen Stichting Blindenbelangen Rotterdam Stichting Wetenschappelijk Onderzoek Oozgiekenhuis (SWOO; Rotterdam) Stichting Ophthalmic Researsch Rotterdam Hoornvliesstichting Nederland tbv promotietraject ‘Epidemiology and Improved diagnosis of Acanthamoeba keratitis’.
Intellectuele belangen en reputatie Publicaties mbt Acanthamoeba zouden mogelijk positief beïnvloed worden Overige belangen Geen. |
Geen. |
|
Mevr. dr. L. (Lies) Remeijer |
Oogarts met aandachtsgebied HSV keratitis |
Geen.
|
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Clinical implications of asymptomatic corneal shedding of herpesviruses start 2019 (restricted grant, financiering door Stichting Ooglijders)
Intellectuele belangen en reputatie Geen.
Overige belangen Geen. |
Geen |
|
Mevr. dr. N. (Nienke) Visser |
Oogarts (MUMC)
|
- Lid cornea werkgroep European Society of Cataract and Refractive Surgeons (onbetaald)
|
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek European Society of Cataract and Refractive Surgeons: EPICAT study: Effectiveness of Periocular drug Injection in CATaract surgery (gefinancierd door ESCRS, het gaat hierbij om een restricted grant, de ESCRS heeft op voorhand akkoord gegeven voor de specifieke opzet, uitvoering, en terugkoppeling van de EPICAT studie)
Intellectuele belangen en reputatie Geen.
Overige belangen Geen. |
Geen, onderzoeken gaan niet over keratitis. |
|
Dhr. dr. E. (Erik) Schaftenaar |
Arts-microbioloog, vrijgevestigd medisch specialist
|
Geen. |
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen. |
Geen.
|
|
Mevr. drs. C. (Claudy) Oliveira dos Santos (tot 11 april 2023) |
Arts-microbioloog
|
Promovendus Radboudumc - Medische mycologie (onbetaald)
|
Persoonlijke financiële belangen Geen.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek Geen.
Intellectuele belangen en reputatie Geen.
Overige belangen Geen. |
Geen. |
|
Dhr. prof. dr. P.E. (Paul) Verweij |
Arts-microbioloog
|
SWAB - adhoc voorzitter richtlijn commissie CAPA en IAPA
|
Persoonlijke financiële belangen Geen persoonlijke financiële belangen. Eventuele vergoedingen en honoraria komen ten goede van de werkgever.
Persoonlijke relaties Geen.
Extern gefinancierd onderzoek JPIAMR, surveillance van resistentie bij schimmels, Projectleider ja
Intellectuele belangen en reputatie Geen.
Overige belangen Geen. |
Producten van Mundipharma, Gilead Sciences en F2G komen in de RL niet aan bod. Is geen trekker van een van de modules. |
|
Dhr. dr. W. (Wouter) Bult |
Ziekenhuisapotheker
|
Geen. |
Persoonlijke financiële belangen Niet van toepassing.
Persoonlijke relaties Niet van toepassing.
Extern gefinancierd onderzoek Niet van toepassing.
Intellectuele belangen en reputatie Niet van toepassing.
Overige belangen Niet van toepassing. |
Geen. |
|
Dhr. M. (Michel) Versteeg |
Verengingsmanager van de Hoornvlies Patiënten Vereniging. Honorering is op basis van 'kostenneutraal'.
|
|
Persoonlijke financiële belangen Niet van toepassing.
Persoonlijke relaties Niet van toepassing.
Extern gefinancierd onderzoek Niet van toepassing.
Intellectuele belangen en reputatie Niet van toepassing.
Overige belangen Patiëntenperspectief |
Geen. |
|
Mevr. drs. C.M. (Chantal) van Luijk - Klankbord |
Oogarts, corneaspecialist, UMC Utrecht
|
deelname adviesraad eczeem medicatie
|
Persoonlijke financiële belangen 2019: deelname adviesraad eczeemmedicatie waarvoor financiële vergoeding, Sanofi/Regeneron
Persoonlijke relaties Niet van toepassing.
Extern gefinancierd onderzoek 2022: retrospectief wetenschappelijk onderzoek waarvoor sponsoring door Santen Europe.
Intellectuele belangen en reputatie niet van toepassing. enigszins bijzondere expertise omtrent oogheelkundige eczeemzorg, welke niet direct gelinkt is aan infectieuze keratitis
Overige belangen Patiëntenperspectief |
Geen. |
|
Mevr. I. (Inger) Larsen – klankbord |
Huisarts
|
NHG richtlijn rood oog en oogtrauma
|
Persoonlijke financiële belangen Niet van toepassing.
Persoonlijke relaties Niet van toepassing.
Extern gefinancierd onderzoek Niet van toepassing.
Intellectuele belangen en reputatie Niet van toepassing.
Overige belangen Niet van toepassing. |
Geen. |
|
Mevr. dr. N. (Nienke) Miltenburg-Soeters - klankbord |
Optometrist bij Visser Contactlenzen, 0.2 fte
|
Column en redactiewerk voor ContactlensInside.nl, betaald
|
Persoonlijke financiële belangen Niet van toepassing.
Persoonlijke relaties Niet van toepassing.
Extern gefinancierd onderzoek Niet van toepassing.
Intellectuele belangen en reputatie Niet van toepassing.
Overige belangen Niet van toepassing. |
Geen. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Patiëntenfederatie Nederland en de Hoornvlies Patienten Vereniging voor de invitational conference en door een patiëntenvertegenwoordiger van de Hoornvlies Patienten Vereniging in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptmodules zijn tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en de Hoornvlies Patienten Vereniging en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module Behandeling schimmel keratitis |
Uitkomst 1: Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met een (verdenking op) infectieuze keratitis. Tevens zijn er knelpunten aangedragen door middel van een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de invitational conference zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie www.gradeworkinggroup.org. De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Qiu S, Zhao GQ, Lin J, Wang X, Hu LT, Du ZD, Wang Q, Zhu CC. Natamycin in the treatment of fungal keratitis: a systematic review and Meta-analysis. Int J Ophthalmol. 2015 Jun 18;8(3):597-602. doi: 10.3980/j.issn.2222-3959.2015.03.29. PMID: 26086015; PMCID: PMC4458670.
|
Same studies included as review of Flor Cruz |
|
Retamal J, Ordenes-Cavieres G, Grau-Diez A. Natamycin versus voriconazole for fungal keratitis. Medwave. 2018 Dec 18;18(8):e7388. Spanish, English. doi: 10.5867/medwave.2018.08.7387. PMID: 30562337.
|
Same studies included as review of Flor Cruz |
|
Prajna NV, Krishnan T, Rajaraman R, Patel S, Shah R, Srinivasan M, Devi L, Das M, Ray KJ, O'Brien KS, Oldenburg CE, McLeod SD, Zegans ME, Acharya NR, Lietman TM, Rose-Nussbaumer J; Mycotic Ulcer Treatment Trial Group. Adjunctive Oral Voriconazole Treatment of Fusarium Keratitis: A Secondary Analysis From the Mycotic Ulcer Treatment Trial II. JAMA Ophthalmol. 2017 Jun 1;135(6):520-525. doi: 10.1001/jamaophthalmol.2017.0616. PMID: 28426856; PMCID: PMC5847083. |
Wrong intervention; oral administration of voriconazole |
|
Rose-Nussbaumer J, Prajna NV, Krishnan KT, Mascarenhas J, Rajaraman R, Srinivasan M, Raghavan A, Oldenburg CE, O'Brien KS, Ray KJ, McLeod SD, Porco TC, Lietman TM, Acharya NR, Keenan JD; Mycotic Ulcer Treatment Trial I Group. Vision-Related Quality-of-Life Outcomes in the Mycotic Ulcer Treatment Trial I: A Randomized Clinical Trial. JAMA Ophthalmol. 2015 Jun;133(6):642-6. doi: 10.1001/jamaophthalmol.2015.0319. PMID: 25764482; PMCID: PMC4962866. |
Wrong outcome; subscales of a vision-related Indian vision-related QoL questionnaire |
Literature search strategy
Algemene informatie
|
Richtlijn: Infectieuze keratitis |
|
|
Uitgangsvraag: Wat is de optimale behandeling van schimmel keratitis? / Wat is de plaats van natamycine bij de behandeling van schimmel keratitis |
|
|
Database(s): Ovid/Medline, Embase.com |
Datum: 21-03-2022 |
|
Periode: 2015 – heden (natamycin, chlorhexidine, voriconazole) Geen restrcitie (amphotericin b) |
Talen: Engels, Nederlands |
|
Literatuurspecialist: Miriam van der Maten |
|
|
BMI-zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: De Cochrane review Medical interventions for fungal keratitis (FlorCruz, 2015) is als basis voor deze vraag genomen. De zoekstrategie van se review diende ook als basis voor de search, maar is voor deze vraag specifiek aangepast op te genoemde middelen.
Voor deze vraag is gezocht op de elementen:
|
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
16 |
6 |
19 |
|
RCT |
40 |
36 |
46 |
|
Totaal |
56 |
42 |
65 |
Zoekstrategie
Embase.com
|
No. |
Query |
Results |
|
#13 |
#11 OR #12 |
56 |
|
#12 |
#8 AND #10 NOT #11 = RCT |
40 |
|
#11 |
#8 AND #9 = SR |
16 |
|
#10 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
1888108 |
|
#9 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
733409 |
|
#8 |
#6 OR #7 |
674 |
|
#7 |
#1 AND #5 AND ([english]/lim OR [dutch]/lim) NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
542 |
|
#6 |
#1 AND (#2 OR #3 OR #4) AND ([english]/lim OR [dutch]/lim) AND [2015-2022]/py NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
384 |
|
#5 |
'amphotericin b'/exp OR 'amphotericin*':ti,ab,kw OR 'ambiosome':ti,ab,kw OR 'amfostat':ti,ab,kw OR 'amfotericin b':ti,ab,kw OR 'ampho moronal':ti,ab,kw OR 'ampho-moronal':ti,ab,kw OR 'amphocin':ti,ab,kw OR 'amphomoronal':ti,ab,kw OR 'amphotericin b':ti,ab,kw OR 'amphozone':ti,ab,kw OR 'b amphotericin':ti,ab,kw OR 'fungilin':ti,ab,kw OR 'sinunase':ti,ab,kw |
58970 |
|
#4 |
'chlorhexidine'/exp OR chlorhexidin*:ti,ab,kw OR '1, 1 hexamethylenebis [5 (para chlorophenylbiguanide) ]':ti,ab,kw OR '1, 1` hexamethylenebis [5 (4 chlorophenyl) biguanide]':ti,ab,kw OR '1, 1` hexamethylenebis [5 (para chlorophenylbiguanide) ]':ti,ab,kw OR '1, 6 bis (n5 para chlorophenyl n1 diguanido) hexane':ti,ab,kw OR '1, 6 bis [n1 (para chlorophenyl) n5 biguanido] hexane':ti,ab,kw OR '1, 6 di (4` chlorophenyldiguanido) hexane':ti,ab,kw OR 'ay 5312':ti,ab,kw OR 'ay5312':ti,ab,kw OR 'bidex':ti,ab,kw OR 'boston conditioning lotion':ti,ab,kw OR 'chlorhex':ti,ab,kw OR 'chlorhexidin*':ti,ab,kw OR 'chlorhexidine':ti,ab,kw OR 'chlorhexidine chlorhydrate':ti,ab,kw OR 'chlorhexidine dihydrochloride':ti,ab,kw OR 'chlorhexidine glutamate':ti,ab,kw OR 'chlorhexidine hydrochloride':ti,ab,kw OR 'chlorohex':ti,ab,kw OR 'chlorohexidine':ti,ab,kw OR 'chlorohexidine acetate':ti,ab,kw OR 'chlorohexydine':ti,ab,kw OR 'clohexidine':ti,ab,kw OR 'clorhexidine':ti,ab,kw OR 'compound 10040':ti,ab,kw OR 'hexamethylene 1, 6 bis [1 (5 para chlorophenyl) biguanide]':ti,ab,kw OR 'lisium':ti,ab,kw OR 'nibitane':ti,ab,kw OR 'nolvasan':ti,ab,kw OR 'nolvascin':ti,ab,kw OR 'rotersept':ti,ab,kw OR 'sterilon':ti,ab,kw OR 'tubilicid':ti,ab,kw OR 'tubulicid':ti,ab,kw OR 'umbipro':ti,ab,kw |
24342 |
|
#3 |
'voriconazole'/exp OR '2 (2, 4 difluorophenyl) 3 (5 fluoro 4 pyrimidinyl) 1 (1h 1, 2, 4 triazol 1 yl) 2 butanol':ti,ab,kw OR '2 (2, 4 difluorophenyl) 3 (5 fluoropyrimidin 4 yl) 1 (1h 1, 2, 4 triazol 1 yl) butan 2 ol':ti,ab,kw OR 'syp 1018':ti,ab,kw OR 'syp1018':ti,ab,kw OR 'uk 109496':ti,ab,kw OR 'uk109496':ti,ab,kw OR 'vfend':ti,ab,kw OR 'voriconazol*':ti,ab,kw OR 'zp 059':ti,ab,kw OR 'zp059':ti,ab,kw |
23455 |
|
#2 |
'natamycin'/exp OR natamycin*:ti,ab,kw OR 'a 5283':ti,ab,kw OR 'a5283':ti,ab,kw OR 'cl 12, 625':ti,ab,kw OR 'cl 12625':ti,ab,kw OR 'cl12, 625':ti,ab,kw OR 'cl12625':ti,ab,kw OR 'miconacina':ti,ab,kw OR 'myprozine':ti,ab,kw OR 'natacyn':ti,ab,kw OR 'natadrops':ti,ab,kw OR 'natomycin*':ti,ab,kw OR 'nisporil':ti,ab,kw OR 'pimafucin':ti,ab,kw OR 'pimaricin*':ti,ab,kw OR 'synogil':ti,ab,kw |
2864 |
|
#1 |
'keratomycosis'/exp OR keratom?cosis:ti,ab,kw OR ((keratitis NEAR/5 (fungal OR fungus OR mycotic)):ti,ab,kw) OR ('keratitis'/exp/mj AND (fungal:ti,ab,kw OR fungus:ti,ab,kw OR mycotic:ti,ab,kw)) |
3723 |
|
# |
Searches |
Results |
|
15 |
13 or 14 |
42 |
|
14 |
(10 and 12) not 13 = RCT |
36 |
|
13 |
10 and 11 = SR |
6 |
|
12 |
(exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf.) not (animals/ not humans/) |
1360221 |
|
11 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
553691 |
|
10 |
7 or 9 |
518 |
|
9 |
limit 8 to (english language or dutch) |
324 |
|
8 |
1 and 5 |
374 |
|
7 |
limit 6 to ((english language or dutch) and yr="2015 -Current") |
271 |
|
6 |
1 and (2 or 3 or 4) |
615 |
|
5 |
exp Amphotericin B/ or 'amphotericin*'.ti,ab,kf. |
25851 |
|
4 |
exp Chlorhexidine/ or chlorhexidin*.ti,ab,kf. |
13720 |
|
3 |
exp Voriconazole/ or 'voriconazol*'.ti,ab,kf. |
7783 |
|
2 |
exp Natamycin/ or 'natamycin*'.ti,ab,kf. or natamycin*.ti,ab,kf. or pimaricin*.ti,ab,kf. |
1239 |
|
1 |
(keratom?cosis or (keratitis adj5 (fungal or fungus or mycotic))).ti,ab,kf. or (exp keratitis/ and (fungal or fungus or mycotic).ti,ab,kf.) |
2645 |
