Behandelduur van orale bètablokkers bij infantiele hemangiomen
Uitgangsvraag
Welke factoren bepalen de duur van behandeling met orale bètablokkers?
Aanbeveling
Individualiseer de (duur van de) behandeling van IH met systemische bètablokkers afhankelijk van de indicatie voor behandeling, behandelrespons en risicofactoren voor recidiefgroei.
Houd bij het bepalen van de behandelduur rekening met de volgende risicofactoren voor het ontstaan van recidiefgroei; staken behandeling onder de leeftijd van 12 maanden, het vrouwelijk geslacht, diepe en gemengde IH en een segmentaal patroon van het IH.
Start behandeling met een bètablokker in de groeifase van het IH, dus voor de leeftijd van 2-4 maanden en maak rond de leeftijd van 12 maanden de balans op om te kijken of er al kan worden afgebouwd of gestopt. Onderstaande afwegingen spelen daarbij een rol:
- Bestaat het risico van de behandelindicatie nog (bijvoorbeeld in het geval van ulceratie)? Indien dit niet het geval is, overweeg dan de behandeling te staken.
- Is er een risico op onacceptabele hergroei (bijvoorbeeld bij een visusbedreigend IH of een IH van de luchtwegen)? Overweeg langer door te behandelen of langzamer af te bouwen.
- Is het cosmetisch resultaat een reden om de behandeling langer voor te zetten? Dit dient in goed overleg met ouders te worden bepaald.
Overweeg de behandeling met systemische bètablokkers bij infantiele IH met verhoogd risico op recidiefgroei af te bouwen in plaats van abrupt te staken.
Overwegingen
Hergroei van een IH na adequate behandeling met bètablokkers wordt gezien bij ongeveer 25% van de behandeltrajecten. [Ahogo 2013, Abarzua-araya 2014, Shah 2016] Het is de vraag of langdurige behandeling om hergroei te voorkomen altijd geïndiceerd is en kan worden verantwoord. Om deze afweging te maken is het allereerst van belang te kijken naar de risico’s van het continueren van de behandeling met bètablokkers voor het kind tegenover de potentiële risico’s die een onvoldoende behandeld IH kan geven. Tijdig starten met orale bètablokkerbehandeling, in de groeifase van het IH, is zoals over het algemeen wordt verondersteld van belang om groei te remmen en complicaties en mogelijk restafwijkingen te voorkomen. In de fase van afbouw en stop van een bètablokker spelen vaak andere motieven een rol dan bij deze keuze om te starten. Waar in de beginfase het conserveren van functionaliteit een hoofdreden was voor behandeling, verschuift dat in de loop van het proces vrijwel altijd ook gedeeltelijk naar een cosmetische reden. Deze verschuiving van motieven hoeft niet problematisch te zijn, zolang die motieven expliciet worden gemaakt. Bij sommige IH kan er sprake blijven van een relatief harde medische indicatie om behandeling te continueren (of herstarten); voorbeelden hiervan zijn perioculaire IH (nieuwe visusbedreiging), pre-auriculaire IH met langdurige groeifase en IH in luiergebied met kans op recidief ulceratie. Maar de keuze om dóór te gaan met behandelen of te herstarten met orale betablokkers ligt ook regelmatig buiten het direct medisch domein. Over het algemeen kunnen ouders hierover wél echt een goede afweging maken en wordt de keuze om de behandeling te continueren gemaakt aan de hand van shared decision making. Ook in deze gevallen is monitoring van belang.
Onderbouwing
Achtergrond
Behandelduur is, in de opgebouwde praktijkervaring, méér maatwerk dan de behandelduur van 6 maanden die in de RCTs van Abarzua-Araya et al., Léauté-Labrèze et al. en Hogeling et al. als behandelperiode is onderzocht. [Abarzua-Araya 2014, Léauté-Labrèze 2015, Hogeling 2011] De behandeling wordt in de praktijk over het algemeen gestopt tussen de leeftijd van 12-18 maanden; meestal wordt rond de leeftijd van 1 jaar van het kind de balans opgemaakt over het effect van behandeling en een plan gemaakt voor het vervolgtraject (afbouw en stop van orale bètablokker). Behandelduur is afhankelijk van de behandelindicatie; korter bij ulceratieve (maar inmiddels genezen) IH en langer bij een peri-oculair IH waar geen hergroei kan worden getolereerd. Het afbouwen van bètablokkers is feitelijk niet nodig. Hergroei van een IH na adequate bètablokkerbehandeling is beschreven tot ± 25% van de casus. Dit leidt er toe dat het medicament bij sommige patiënten wel langzamer wordt afgebouwd en in een lagere dosis wordt gecontinueerd tot de leeftijd van 1,5-2 jaar zodat de kans op hergroei afneemt. [Shah 2016]
Conclusies / Summary of Findings
In enkele van de geïncludeerde studies wordt bij een behandelduur met oraal propranolol van langer dan 6 maanden een hoger succespercentage en een lagere recidiefkans na stop van propranolol beschreven. Verlenging van de behandelduur tot de leeftijd van maximaal 12 maanden oud zou tot een klinisch relevant hoger succespercentage kunnen leiden. [Baselga 2018] Een behandelduur van 12 maanden is volgens Giachetti et al. geassocieerd met een significant lagere recidief-kans dan een behandelduur van minder dan 8 maanden [Giachetti 2014] Als er wordt gekeken naar type IH, wordt beschreven dat superficiële IH mogelijk een langere behandelduur nodig hebben in vergelijking met diepe en gemengde IH. [Castaneda 2016]
Het beschreven recidiefpercentage na behandeling met oraal propranolol gedurende 6 maanden lag rond de 25.3%. [Ahogo 2013, Shah 2016] Dit is nagenoeg gelijk aan het recidiefpercentage van 26% uit de RCT van Abarzua-Araya et al. [Abarzua-araya 2014]
Met een recidiefpercentage van 6% werd in de studie van Shehata et al. een gemiddeld lagere (late) recidiefkans dan andere studies op gezien wat mogelijk gerelateerd is met de langere behandelduur van gemiddeld 10 maanden. [Shehata 2013]
In de studie van Hong et al. werd bij kinderen met IH in het hoofdhalsgebied de behandeling met oraal propranolol 2 mg/kg/dag in 3 dosis gestopt zonder recidiefgroei op een gemiddelde leeftijd van 12 maanden. [Hong 2013]
De beschreven risicofactoren waarbij mogelijk een hogere kans op recidief-groei bestaat of waar mogelijk een indicatie voor een langere behandelduur is, richtten zich met name op leeftijd, geslacht, lokalisatie, type en patroon van het IH.
Er werd een toegenomen risico op recidief gezien bij meisjes ten opzichte van jongens. Het risico op recidief was verhoogd bij kinderen met IH in de hoofd-hals regio, er was een verhoogd risico op recidief bij IH met een diepe component en segmentale IH waren geassocieerd met een negenvoudige toename van recidief. Ook Wedgeworth et al. vonden een hoger risico op recidiefgroei in segmentale IH. [Ahogo 2013, Wedgeworth 2016]
Shehata et al. beschreven een verlengde proliferatiefase na de leeftijd van 15 maanden oud en zagen een verhoogd risico op recidiefgroei bij gelokaliseerde, kleine IH met een een diepe component. [Shehata 2013]
Leeftijd als risicofactor voor recidiefgroei werd in de studies op verschillende manieren onderzocht, er werd gekeken naar de leeftijd van het starten van behandeling waarbij Castaneda et al. beschrijven dat het starten van behandeling met oraal propranolol onder de leeftijd van 5 maanden een beter resultaat geeft en tot een kortere behandelduur leidt dan wanneer de behandeling na de leeftijd van 5 maanden werd gestart. [Castaneda 2016]
Kinderen waar de propranolol gestaakt werd vóór de leeftijd van 9 maanden oud hebben de grootste kans op recidiefgroei in vergelijking met een referentiegroep van kinderen waarbij propranolol gestaakt werd tussen de leeftijd van 12 en 15 maanden oud met een OR van 2.4. [Shah 2016]
Shah et al. beschrijven in hun studie dat afbouwen van de behandeling met oraal propranolol een significant lagere kans op recidiefgroei gaf dan wanneer abrupt werd gestopt met propranolol. [Shah 2016]
Samenvatting literatuur
Er werden 8 studies geïncludeerd op basis van de vooraf opgestelde inclusiecriteria. Er was veel aan te merken op de kwaliteit van deze studies. De studies kenden een retrospectieve, niet vergelijkend-observationele onderzoeksopzet wat een hoog risico op verschillende vormen van bias meebrengt (waaronder selectiebias, confounding by indication en reportingbias). Hierdoor zou de kwaliteit van bewijs van de studies als zeer laag uitkomen.
Vanwege dit hoge risico op bias en methodologische en klinische heterogeniteit zijn de studies kwalitatief beschreven. Bevindingen uit de observationele studies worden hieronder kort toegelicht. Voor gedetailleerde karakteristieken en resultaten zie de evidence tabellen.
Ahogo et al. vergelijken in een retrospectieve, observationele studie verschillende factoren die mogelijk geassocieerd zijn met het risico op recidiefgroei van IH bij kinderen die behandeld werden met systemisch propranolol. In totaal werden er 158 kinderen geïncludeerd waarvan 40 (25.3%) kinderen een recidief van hun hemangioom hadden. Hiervan werden er 19 (12%) als ‘major relapse’ gezien en opnieuw behandeld met propranolol. Major relapse is gedefinieerd als recidiefgroei, geassocieerd met toename van kleur en/of ulceratie van het IH waarvoor herbehandeling nodig was. De overige 21 patiënten met ‘minor relapse’ (geïsoleerde milde toename van kleur van het IH zonder indicatie voor herbehandeling) werden alleen gemonitord. In logistische regressieanalyses werden leeftijd, geslacht, lokalisatie, type en distributie van het IH, de propranolol dosis en behandelduur met elkaar vergeleken. De mediane leeftijd bij start van behandeling was 3 (range 1-5) maanden en de mediane behandelduur was 6 maanden (range 3-12). De mediane tijd tussen staken van behandeling en het optreden van recidief was 1.65 (range 0.5-5) maanden. Er was een toegenomen risico op recidief bij meisjes ten opzichte van jongens (OR 2.91, 95% CI; 1.19 tot 7.12, P =0.02). Het risico op recidief was verhoogd bij kinderen met IH in de hoofd-hals regio (OR 3.62, 95% CI; 1.41 tot 9.30, P =0.007). In de multivariate analyse bleken type IH en de verdeling ervan onafhankelijke factoren voor recidief te zijn; segmentale IH waren geassocieerd met een negenvoudige toename van hergroei (OR 9.14, 95% CI; 2.62 tot 31.85, P =0.0005) en er was een verhoogd risico op recidief bij IH met een diepe component (OR 22.4, 95% CI; 4.47 tot 112.27, P <0.0002). [Ahogo 2013] De retrospectieve, ‘single center’, niet vergelijkende studieopzet is een beperking van deze studie.
In een fase III studie door Baselga et al. werd de effectiviteit en veiligheid van behandeling met systemisch propranolol gedurende een initiële behandelperiode (ITP) van minimaal 6 maanden tot een maximale duur tot de leeftijd van 12 maanden oud geëvalueerd. In totaal werden er 45 patiënten geïncludeerd en behandeld met propranolol 3 mg/kg/dag in 2 doses.
Bij 21 patiënten (47%) werd na een ITP van 6 maanden een succesvolle behandeling bereikt, aan het einde van de ITP(er werd maximaal behandeld tot de leeftijd van 12 maanden bereikt was) waren dit 34 patiënten (76%). Van de succesvol behandelde patiënten trad bij 11 (32%) personen binnen drie maanden na stop van de behandeling recidiefgroei op. Hiervan werden 8 (24%) patiënten opnieuw behandeld, 7 van deze patiënten bereikte opnieuw succes. [Baselga 2018] Vanwege de kleine studiepopulatie, ongecontroleerde studieopzet en het feit dat de ITP aan de hand van het effect van de behandeling werd bepaald wordt deze studie als lage kwaliteit van bewijs gewaardeerd.
Castaneda et al. beschrijven in een prospectief observationeel onderzoek de resultaten van de effectiviteit en bijwerkingen van behandeling met systemisch propranolol bij kinderen tussen de leeftijd van 3 en 12 maanden. In totaal werden 31 patiënten met een gemiddelde dosis van 1,5 (range 0.5 – 2.5) mg/kg/dag gedurende de gemiddelde behandelduur van 10.5 maanden (range 7-14) geïncludeerd. In totaal was 96% van de patiënten tevreden met de behandeling, met minimaal merkbare resterende laesies. Bij 6% van de patiënten werden de restlaesies nabehandeld met lokaal 0.5% timolol gel. Bij één patiënt trad na het staken van behandeling van 7 maanden een recidief op. Patiënten met IH in het hoofd-hals gebied bereikten een tevredenstellend resultaat na gemiddeld 9.4 maanden, voor patiënten met een IH elders op het lichaam was dit na gemiddeld 10.7 maanden. Kinderen bij wie de behandeling onder de leeftijd van 5 maanden werd gestart hadden een beter resultaat en kortere behandelduur dan kinderen waarbij de behandeling na de leeftijd van 5 maanden werd gestart; de gemiddelde behandelduur was respectievelijk 8.2 (±1.5 SD) en 11.05 (±1.2 SD) maanden (p =0.004). Analyse naar het type IH gaf aan dat superficiële laesies een langere behandelduur vereisten dan diepe en gemengde IH met een gemiddelde behandelduur van 11.05 (±2.1 SD) en 8.6 (±1.1 SD) maanden, respectievelijk (p =0.025). [Castaneda 2016] De kleine studiepopulatie en niet vergelijkende studieopzet zijn beperkende factoren van deze studie.
In een retrospectieve cohortstudie van Giachetti et al. wordt de frequentie van recidiefgroei van IH na een lange behandelduur (>8 maanden) met oraal propranolol vergeleken met een korte behandelduur (≤8 maanden). Recidiefgroei was gedefinieerd als herhaling van de complicatie die leidde tot de indicatie om te behandelen of als er een toename in dikte van meer dan 50% ten opzichte van het laatste meetpunt optrad. De gemiddelde behandelduur in de korte behandelgroep was 4.5 (range 3-8) maanden. Recidiefgroei werd in de korte behandelgroep bij 9 van de 10 (90%) patiënten gezien binnen 4 (range 0.5-4) maanden na staken van behandeling. Voor de lange behandelgroep was de gemiddelde behandelduur 11.8 (range 11-13) maanden. In deze groep trad bij 1 van de 20 (5%) patiënten recidief op, dit gebeurde 2 maanden na staken van behandeling. Vergelijking van de groepen laat zien dat behandeling van ±12 maanden geassocieerd is met een significant lager recidief kans (5%) dan behandeling < 8 maanden (95%) (OR= 18.0, 95% CI; 2.6 tot 123). [Giachetti 2014] In deze retrospectieve studie met kleine studiepopulatie werden de patiënten sequentieel toegewezen aan de korte of lange behandelgroep. Er was geen sprake van randomisatie. Dit alles werd als hoge risk of bias en dus een lage kwaliteit van bewijs beoordeeld.
De retrospectieve review van Hong et al. heeft als doel te bepalen bij welke behandelduur en op welke leeftijd behandeling met oraal propranolol succesvol gestaakt kan worden bij kinderen met IH in het hoofd-hals gebied. In totaal werden er 45 kinderen geïncludeerd, waarvan 17 (38%) kinderen naast oraal propranolol 2 mg/kg/dag in 3 dosis adjuvant behandeld werden met prednisolon en daarom geëxcludeerd worden voor deze uitgangsvraag. Van de 28 kinderen die alleen met propranolol behandeld werden, had 22 (79%) duidelijke verbetering of complete response. De gemiddelde leeftijd van staken van propranolol was 11.8 (range 8-15) maanden met een gemiddelde behandelduur van 6.5 (range 3-11) maanden. Er werden geen recidieven gezien gedurende de gemiddelde follow-up periode van 19.9 (range 10-28) maanden. [Hong 2013] De retrospectieve, ongecontroleerde studieopzet, kleine studiepopulatie waarvan een 38% adjuvante behandeling kreeg zijn beperkingen van deze studie.
Shah et al. beschreven retrospectief een cohort van 997 patiënten met IH die gedurende gemiddeld 12 (± SD 5.6) maanden behandeld werden met oraal propranolol om de voorspellers van recidiefgroei te identificeren. De incidentie van recidiefgroei was 25.3% (231 van 912), waarvan 191 (82.6%) patiënten opnieuw een bepaald type behandeling nodig had. De gemiddelde behandelduur bij patiënten met recidiefgroei was 11.4 maanden (mediaan: 10; IQR 7-14.5). De gemiddelde leeftijd op het moment van start van de recidiefgroei was 17.1 maanden (mediaan: 15; IQR 11-21). De kans op recidiefgroei was het grootst (OR: 2.4; 95% CI: 1.3-45) in groep kinderen waarbij propranolol gestaakt werd voor de leeftijd van 9 maanden in vergelijking met de groep kinderen waarbij propranolol gestaakt werd tussen de leeftijd van 12-15 maanden (controlegroep). De kans op recidiefgroei was ook hoger wanneer propranolol werd gestaakt tussen de leeftijd van 18 maanden en >24 maanden vergeleken met de controlegoep. Daarnaast gaf het stoppen van de behandeling met propranolol zonder afbouwen een significant verhoogd risico op recidiefgroei. Van de patiënten waar de medicatie werd afgebouwd had 25% (148/586) recidiefgroei, vergeleken met 36.6% (41 van 112) waar abrupt werd gestopt met propranolol (p =0.01). Andere significante risicofactoren op recidiefgroei waren het vrouwelijk geslacht (p =0.03) en diepe IH (p <00.1). [Shah 2016] De retrospectieve, ongecontroleerde studieopzet is een beperking van deze studie.
In de retrospectieve review van Shehata et al. werd onderzocht wat de frequentie en geassocieerde factoren zijn die kunnen leiden tot verlate recidiefgroei na een succesvolle behandeling met oraal propranolol. Er werden in totaal 212 IH-patiënten behandeld met oraal propranolol. In deze review werden alleen studies met patiënten geïncludeerd die gedurende tenminste 6 maanden behandeld waren en waarbij na staken van de behandeling ná de leeftijd van 15 maanden een recidief op trad. Recidief werd gedefinieerd als aangetoonde hergroei van tenminste 25% van het hemangioom waaronder verandering in kleur of volume, de aanwezigheid van functionele beperking of ulceratie. In totaal werden 13 (6%) van de 212 patiënten als recidief afgegeven. De gemiddelde behandelduur van de 13 patiënten met recidief was 10.3 ± 3.3 maanden, de gemiddelde tijd zonder behandeling tot aan recidiefgroei was 5.3 ± 3.2 maanden. De gemiddelde leeftijd op het moment van recidief was 20.7 ± 3.7 maanden oud. Recidiefgroei na een eerder succesvolle behandeling met propranolol duidde op een verlengde proliferatiefase van het IH (zelfs na de leeftijd van 15 maanden). Dit kwam voornamelijk voor bij gelokaliseerde, kleine IH met een diepe component. [Shehata 2013] In deze retrospectieve, niet vergelijkende studieopzet worden slechts de karakteristieken van 13 (6%) patiënten met recidief beschreven. Gegevens van de niet-recidief groep zijn niet beschikbaar in deze publicatie.
Wedgeworth et al. beschreven de resultaten van de PITCH (Propranolol In the Treatment of Complicated Hemangiomas) taskforce. De studie cohort bevat 1097 kinderen die met oraal propranolol behandeld werden. De mediane behandelduur was 32 weken (range 2-184). Van de 1097 kinderen trad recidiefgroei op bij 154 (14%) patiënten na het staken van behandeling. De mediane leeftijd waarop behandeling werd gestaakt was in de recidief groep 52 weken (IQR: 40-64); dit is lager dan 56 weken (IQR 42-72) in de niet recidief groep. Dit verschil was echter niet statistisch significant (p =0.08).
De risicoreductie voor recidief was in vergelijking met kinderen in andere kwartielgroepen voor leeftijd het meest opvallend bij kinderen met een langere behandelduur, waarbij de behandeling gestaakt werd bij de leeftijd van ≥70 weken oud (OR 0.58, 95% CI 0.34-0.99, p = 0.048); tot 40 weken oud (OR 1, referentiegroep); 40-54 weken (OR 0.83, 95% CI 0.50-1.37, p =0.46) en 54-70 weken (OR 0.90, 95% CI 0.55–1.48, p =0.68; Ptrend < 0.001).
De mediane behandelduur voor segmentale IH was 45 weken (range 8–139) ten opzichte van 32 weken voor de hele groep. Twee-en-dertig procent van de patiënten (19) met een segmentaal IH had recidiefgroei, in vergelijking met 13.1% bij focale IH (gecorrigeerde OR 3.33, 95% CI 1.85–6.01, P < 0.001). [Wedgeworth 2016]
De retrospectieve studieopzet met het daarbij optredende risico op rapportagebias is een beperking van de studie.
Zoeken en selecteren
Voor uitgangsvragen 4 en 5 werd een systematische zoekstrategie uitgevoerd in de elektronische databases Embase en Medline. De zoekstrategie is toegevoegd als de zoekverantwoording. Een overzicht is te lezen in de verantwoording, onderdeel werkwijze.
De resultaten van de search werden door drie auteurs (CvdV, MdG en MR) onafhankelijk beoordeeld. Voor de beantwoording van de uitgangsvraag 5 werd geselecteerd op studies over de behandelduur van bètablokkers. Andere inclusiecriteria zijn: humane studies, Nederlands- en Engelstalige studies, publicatiedatum van maximaal 20 jaar oud, N ≥10 patiënten. Als exclusiecriteria werden aangehouden: vergelijking met lokale middelen, vergelijking met systemische corticosteroïden, studies die geen spreidingsmaten rapporteerden.
Er werden in totaal 461 studies gevonden op basis van de algemene zoekstrategie. Op basis van screening op titel en abstract werden 89 studies geïncludeerd. Na full tekst screening werden er voor uitgangsvraag 4 in totaal 3 studies geïncludeerd, voor uitgangsvraag 5 werden er 8 studies meegenomen in een algemene beschrijving. Specifieke redenen voor exclusie zijn benoemd in de tabel in de evidence tabellen.
Vanwege het ontbreken van RCTs over optimale behandelduur werden voor de beantwoording van deze uitgangsvraag ook observationele studies geïncludeerd en uitgewerkt in een overzicht van de karakteristieken en resultaten zie de evidence tabellen.
Referenties
- Abarzua-Araya A, Navarrete-Dechent CP, Heusser F, et al. Atenolol versus propranolol for the treatment of infantile hemangiomas: a randomized controlled study. Journal of the American Academy of Dermatology 2014;70(6):1045-9.
- Ahogo CK, Ezzedine K, Prey S, et al. Factors associated with the relapse of infantile haemangiomas in children treated with oral propranolol. British Journal of Dermatology 2013;169(6):1252-6.
- Baselga E, Dembowska-Baginska B, Przewratil P, et al. Efficacy of propranolol between 6 and 12 months of age in high-risk infantile hemangioma. Pediatrics 2018;142(3) doi: 10.1542/peds.2017-3866
- Castaneda S, Garcia E, De la Cruz H, et al. Therapeutic Effect of Propranolol in Mexican Patients with Infantile Hemangioma. Drugs Real World Outcomes 2016;3:25-31.
- Giachetti A, Garcia-Monaco R, Sojo M, et al. Long-term treatment with oral propranolol reduces relapses of infantile hemangiomas. Pediatric Dermatology 2014;31(1):14-20.
- Hogeling M, Adams S, Wargon O. A randomized controlled trial of propranolol for infantile hemangiomas. Pediatrics 2011;128(2):e259-66.
- Hong P, Tammareddi N, Walvekar R, et al. Successful discontinuation of propranolol for infantile hemangiomas of the head and neck at 12 months of age. International Journal of Pediatric Otorhinolaryngology 2013;77(7):1194-7.
- Léauté-Labréze C, Hoeger P, Mazereeuw-Hautier J. A Randomized Controlled Trial of Oral Propranolol in Infantile Hemangioma. Journal of Vascular Surgery 2015;62(2):518-19. doi: 10.1016/j.jvs.2015.06.197
- Shah SD, Baselga E, McCuaig C, et al. Rebound Growth of Infantile Hemangiomas After Propranolol Therapy. Pediatrics 2016;137(4)
- Shehata N, Powell J, Dubois J, et al. Late rebound of infantile hemangioma after cessation of oral propranolol. Pediatric Dermatology 2013;30(5):587-91.
- Wedgeworth E, Glover M, Irvine AD, et al. Propranolol in the treatment of infantile haemangiomas: lessons from the European Propranolol In the Treatment of Complicated Haemangiomas (PITCH) Taskforce survey. British Journal of Dermatology 2016;174(3):594-601.
Evidence tabellen
|
Study reference
|
Study characteristics |
Patient characteristics1 |
Intervention (I) |
Comparison / control (C) 2
|
Follow-up |
Outcome measures and effect size 3 |
Comments |
|
Ahogo, 2013 To compare factors associated with the risk of relapse in children with IH treated with oral propranolol.
|
Type of study: retrospective observational study
Setting: monocentric
Country: France
Source of funding: none
|
N total at baseline: 158 Relapse (R+): 40 (25.3%) No relapse (R-): 118 (74.7%)
Important prognostic factors1: Median age at treatment initiation: 3.00 months (range 1–5). R+: ≤8 wks 16 (40%) > 8 wks 24 (60%) R-: ≤8 wks 48 (40.7%) > 8 weeks 70 (59.3%)
Sex: R+: fem. 33 (82%) R-: fem. 73 (61.9%)
IH location: R+:: Head&Neck: 34 (85%) Trunk: 2 (5%) Limbs 1 (2%) Genital/perineal 3 (8%) R- Head&Neck: 72 (61.0%) Trunk: 20 (16.9%) Limbs 14 (11.9%) Genital/perineal 12 (10.2%)
Type of IH: R+ Superficial/cutaneous: 10 (26%) Mixed: 22 (56%) Subcutaneous: 7 (18%) R- Superficial/cutaneous: 86 (72.9%) Mixed: 92 (24.6%) Subcutaneous: 3 (2.5%)
Distribution: R+ Segmental: 14 (35%) Nonsegmental: 26 (65%) R- Segmental: 5 (4.2%) Nonsegmental: 113 (95.8%)
Inclusion criteria: The files of all patients attending the vascular clinic of the national reference centre for rare skin diseases of the University Hospital of Bordeaux between 1 June 2008 and 31 December 2011, with an initial confirmed diagnosis of IH, were reviewed. Exclusion criteria: Patients with < 6 months of follow-up. Patients who were aged > 5 months at the initiation of oral propranolol were excluded to avoid bias due to spontaneous regression. |
Oral propranolol (1–3 mg /kg-1 per day) Dosage (table 1): 1 mg kg-1 per day R+: 4 (10%) R-: 21 (17.8%)
2 mg kg-1 per day R+: 33 (82%) R-: 84 (71.2%)
3 mg kg-1 per day R+: 3 (8%) R-: 13 (11.0%)
Duration of treatment The median duration of treatment was 6.00 months (range 3–12). > 6 months R+: 12 (30%) R-: 28 (23.7%) ≤ 6 months R+: 28 (70%) R-: 90 (76.3%)
|
None
A minor relapse was defined as an isolated mild recoloration of the IH that did not need retreating, whereas regrowth associated with recoloration and/or ulceration of the IH was considered as a major relapse that needed to be retreated. |
Length of follow-up: - |
19/40 relapses (12% of n=158) were classified as major relapse and were subsequently retreated, whereas 21/40 were classified as minor relapse and were only monitored. The median delay between treatment interruption and relapse was 1.65 months (range 0.5–5), with relapses occurring in 31/40 children (75%) < 2 months after stopping treatment. Table 2 univariate: there was an increased risk of relapse in girls compared with boys (OR 2.91, P = 0.02). risk of relapse was increased in children with IHs located on the head and neck area vs. other locations (OR 3.62, P = 0.007) No significant difference for the risk of relapse between the different propranolol dosages. Similarly, patients with treatment initiation before vs. after the age of 8 weeks did not differ with respect to the risk of relapse. Table 3 multivariate: type of IH and its distribution were found to be independent factors associated with relapse: segmental IHs were associated with a ninefold increase of relapse (OR 9.14, P = 0.0005). There was an increased risk of relapse in IHs with a deep component (OR 22.40, P < 0.0002). |
|
|
Baselga, 2018
Long term treatment success and reinitiation. |
Type of study: Single arm, open label phase 3 study
Setting: multicenter
Country: Spain and Poland
Source of funding: Funded by the Institut de Recherche Pierre Fabre (dermatology). |
N total at baseline: 45
Important prognostic factors1: Mean age ± SD: 91.9 days ±38
Sex: Girls: 33 of 45; 73%)
IH location: Facial: 35 of 45; 78%
Type of IH: Localized: 28 of 45; 62% Segmental: 2 of 45; 4% Indeterminate: 7 of 45; 16%
Inclusion criteria: Eligible participants were male and female infants aged 35 to 150 days (corrected age for premature infants) with high-risk IH in the proliferative phase. High-risk IHs were defined as those that were either life-threatening, at risk for functional impact (in the following locations: periorbital, nasal, labial, laryngo- tracheal, or limb joints), disfiguring (IH diameter >5 cm or in the following locations: glabella, nasal, philtrum, central chin, central cheek, or labial with mouth deformities), or ulcerated nonresponsive to standard wound care measures.
Exclusion criteria: having a congenital haemangioma; Kasabach-Merritt syndrome and posterior fossa, haemangioma, arterial lesions, cardiac abnormalities and/or aortic coarctation, and eye abnormalities syndrome; asthma; bronchospasm; hypoglycemia; hyperkaliemia; and bradycardia and previous haemangioma treatment |
Oral propranolol twice daily (3 mg/kg per day).
The study consisted of an initial treatment period (ITP), a follow-up, and a retreatment period. During the ITP, patients received oral propranolol for a minimum of 6 months. If treatment success was not achieved by month 6, treatment was continued (continuation period) until success or up to 12 months of age. Patients who achieved success in the ITP were managed for 3 months with no treatment. If rebound growth occurred within the follow-up period, treatment was reinitiated at the investigator’s discretion until success for 6 months maximum.
|
none
|
Length of follow-up: 6- 12 months treatment period, 3 months with no treatment follow up
N=43 (95.5%) completed the study (the ITP) 2 patients were prematurely withdrawn during the ITP. (1 patient for lack of efficacy and 1 patient because of the parent and/or guardian’s decision)
N=34 (75.5%) entered the follow-up period. N=8 (17.8%) entered the retreatment period.
The PP population* consisted of 40 patients, 5 patients in the FAS (full analysis set) were excluded for major protocol deviations.
*The FAS included all patients who received at least 1 dose of study treatment. The PP set included all patients in the FAS with no major protocol deviation or other source of bias and with a minimal treatment exposure of 6 months.
|
After the ITP, success was achieved by 34 patients (76%; 95% CI 61.7% -86.3%).
Sustained success (first visit for which success was obtained and maintained at each scheduled sub-sequent visit) from day 1 up to the end of follow-up was reported in 23 patients (51%), with a median time to success of 290 days (range of 64 to 307 days).
Of the 34 patients who achieved treatment success during the ITP, 11 had rebound growth, 8 of whom were judged by the investigator as requiring retreatment. By the end of the retreat-ment period, 7 of the 8 patients had achieved success. The duration of initial treatment did not appear to influence whether patients required retreatment; of the 8 patients who were retreated, 5 had completed the minimum 6 months only, and 3 had continued until 12 months of age. Investigators continued treatment in 9 patients without success, with Hemangiol or off-label propranolol, but this being out of the framework of the study, no data on the duration of treatment or outcome were collected.
|
The primary end point was treatment success (yes or no) at the end of the ITP.
Secondary end points included treatment success (yes or no) after 6 months of treatment and at each visit throughout the study, time (in days) to first sustained success from day 1 up to the end of the study, reinitiation of treatment (reinitiation or no reinitiation), QoL (SF-36 and HFB questionnaires), and the assessment of safety (primarily, AEs). |
|
Castaneda, 2016
Effect in relation to location type and onset of treatment |
Type of study: open prospective observational study
Setting:
Country: Mexico
Source of funding: No sources of funding were used to assist in the preparation of this study. |
N total at baseline: 31
Important prognostic factors1: age ± SD: 5.6 months (± 2.7 SD)
Sex: Male: 11 (36%) Female: 20 (64%)
Type of IH: Surface: 17 (54.8%) Deep: 6 (19.4%) Mixed: 8 (25.8%)
IH location: Head and neck: 25 (66%) Trunk: 7 (18%) Extremities: 6 (16%)
Inclusion criteria: Outpatients with ages ranging from 3 to 24 months of age who had been clinically diagnosed with hemangioma in the initial or proliferative phase were eligible for treatment. Indications for treatment were functional impairment, ulceration, rapid growth, and esthetic complications. All patients included in the study had no previous history of treatment with any drug or any other therapy |
Oral solution of propranolol in doses ranging from 0.5 to 2.5 mg/kg/day.
|
none
|
Length of follow-up: 20 months
Loss-to-follow-up: unknown
|
The duration of treatment was variable, with treatment courses being shorter for patients with IH located in the head and neck. Therapy was completed when the patient had a satisfactory response.
In patients with IH located in the head and neck area, a satisfactory response was reached on average in 9.4 months, whereas for patients with IH located on the trunk and/or extremities a satisfactory response was reached in an average of 10.7 months.
Children who started treatment at less than 5 months of age had better responses and a shorter duration of treatment than those who started after 5 months of age. The mean durations of treatment were 8.2 (±1.5 SD) and 11.05 (±1.2 SD) months, respectively (paired Student’s test, p = 0.004).
For the type of IH, the one-way ANOVA indicated that superficial lesions had greater duration than deep and mixed IH with a mean of 11.05 (±2.1 SD) and 8.6 (±1.1 SD) months, resp. (p = 0.025).
Regrowth A female patient (3.2%) with an IH located on her head presented regrowth after discontinuation of the treatment at 7 months, later resuming therapy with a dosage of 2 mg/kg/day for 3 months until responding with total resolution of the IH. |
In 17 cases (55 %), the IH was in the initial and/or in the proliferative phase.
The clinical response to propranolol was classified as either satisfactory or absent. A satisfactory response was considered when there was a greater than 80 % reduction in the coloration and hemangioma size, with minimal visible lesions at the end of therapy, such as telangiectasias. It was classified as absent when the effect was slow, with little evidence of a decreasing IH. Therefore, treatment was considered successful in this study when a satisfactory response was obtained, taking into account the measurements of hemangioma, serial photographs, and visible clinical effect, as subjectively assessed by two observers. After reaching a satisfactory therapeutic response, the dose was gradually decreased by half every 2 weeks until the therapy was completed. |
|
Giachetti, 2014
to compare the frequency of relapses in long-erm OP treatment with that of short-term OP treatment. |
Type of study: Retrospective cohort study
Setting: outpatient setting, except for premature infants, who were admitted
Country: Argentina
Source of funding: |
N total at baseline: 30 Intervention: 20 Control: 10
Important prognostic factors1: For example age ± SD: I: 0.5-6 months C: 2-14 months
Sex: unknown
Type of IH: I: Deep 8 (40%) Combined 11 (55%) Superficial and hepatic 1 (5%) C: Deep 5 (50%) Combined 5 (50%)
IH location: I: Head/neck: 7 (70%) Trunk 1 (10%) Genital: 2 (20%) C: Head/neck: 18 (90%) Extremity: 1 (5%) (hip) Multiple: 1 (5%)
Inclusion criteria: We collected data from all patients younger than 18 months old who had been treated at our Vascular Anomalies Center with OP because of functional impairment, ulceration, or disfigurement caused by an IH.
Exclusion criteria: - |
Oral propranolol (OP) treatment of longer than 8 months.
OP (propranolol hydrochloride) was started at 1 mg/kg/day in three divided doses every 8 hours for 1 week and increased to 1.5 to 4 mg/kg/day afterward. The dosage increases were based on clinical response and ultrasound findings.
|
Oral propranolol (OP) treatment of 8 months or less.
The OP dosage was 1.5 to 2 mg/kg/day in all patients, except for two patients in the long treatment group—patients 17 and 18, premature twins who did not respond to the medication until they received 4 mg/kg/day |
Length of follow-up: The patients were followed for at least 12 months after discontinuing the treatment. (range 12-27 months after discontinuing).
Loss-to-follow-up: -
|
The duration of therapy for the short treatment group (C) was from 3 to 8 months (average 4.5 mos). IH relapse was observed within 4 months (range 0.5–4 mos) after stopping treatment in 9 of the 10 (90%) patients in this group.
The duration of treatment for the long treatment group (I) was from 11 to 13 months (average 11.8 mos), and only 1 patient of the 20 (5%) showed relapse 2 months after finishing OP treatment.
Comparison of the results between groups showed that 12 months of treatment is associated with a significantly lower rate of relapse (5%) than treatment of less than 8 months (95%) (OR = 18, 95% CI 2.6, 123). |
The treatment modalities (long or short) were sequential, and there was no preestablished randomization of patients treated for the short or longer time. |
|
Hong, 2013
to determine the duration of treatment and age at which propranolol may be successfully discontinued in children with infantile hemangiomas of the head and neck. |
Type of study: Retrospective review
Setting:
Country: Canada and USA
Source of funding: |
N total at baseline: 45
Important prognostic factors1: age (mean): 3.5 months (range, 2 weeks–5.5 months)
Sex: 27 girls (60%) 18 boys (40%)
IHs location: Head and neck 100%
Type of IH: Deep: 8 (18%) Superficial 6 (13%) Both: 31 (69%)
Inclusion criteria: Patients (consecutive) who underwent propranolol treatment for head and neck His from Jan 2008 to Dec 2011 at the authors’ institutions.
Exclusion criteria: Children still taking propranolol, those not treated with propranolol as their primary therapy and children with lesions outside head and neck were excluded. |
Propranolol 2 mg/kg/day divided every 8 h.
Depending on the response, propranolol was continued to age 10–12 months (the time that lesions would theoretically be entering the involutional phase). The medication was tapered down over two weeks with regular observational monitoring.
|
None.
|
Length of follow-up: 19.9 months (range, 10–28 months).
|
38 patients (84%) experienced either resolution or marked improvement with propranolol therapy, 7 patients (16%) had some improvement. In all patients with combined lesions, the deep portion responded before the superficial part.
The mean age at discontinuation of propranolol was 11.8 months of age (range, 8–15 months) with a mean treatment duration of 6.5 months (range, 3–11 months). No recurrences were noted over a mean follow-up period of 19.9 months (range, 10–28 months).
|
17 patients received adjuvant therapy (oral prednisolone (3mg/kg/day): Of the children who received adjuvant therapy, 94% (16 of 17) experienced resolution or marked improvement and one (6%) demonstrated some improvement. Of the 28 children who received propranolol alone, 22 (79%) had marked improvement or complete resolution. |
|
Shah. 2016
to identify predictors for rebound growth. |
Type of study: Retrospective cohort study
Setting: multicenter
Country: North America and Europe
Source of funding: Supported by the University of California at San Francisco Pediatric Dermatology research fund. |
N total at baseline: 997
Important prognostic factors1: Mean age at initiation ± SD: 5.64 ± 6.80 (months)
Sex: Male 225 (23.0%) Female 753 (76.8%)
Location IHs: Head/Neck 83.9% Other: 16.1%
Type of IH: Superficial 25.4% Deep 19.2% Combined: 54.2%
Localized: 79.2% Segmental 17.8% Indeterminate 21.5%
Inclusion criteria: (1) patients who completed therapy that had a course of at least 3 months on propranolol and (2) patients with ongoing therapy at the time of enrollment whose course of propranolol was at least 6 months.
Exclusion criteria: (1) patients >3 years of age at time of propra-nolol initiation, (2) patients who were non-compliant with therapy, (3) in-sufficient patient follow-up, and (4) nonresponders to propranolol therapy.
|
Patients treated with propranolol.
All: Maximum dose of propranolol, mg/kg per day ±SD: 1.95 ± 0.48 (range: 0.5–4 mg/kg per day) With a mean total duration of 12.0 ± SD 5.6 months. The maximum dose of propranolol was nearly identical to that of those who experienced rebound growth (0.76–4 mg/kg per day). Patients remained at their maximum dose for a mean duration of 7.02 ± SD 4.29 months. There was no difference in duration for those patients treated primarily for ulceration compared with those treated for other indications (P =.94).
|
None.
|
Length of follow-up: unknown
|
The overall incidence of rebound growth was 25.3% (231 of 912 patients, excluding the 68 patients who were receiving the full dose of propranolol at the time of the study). Of the 231 patients with rebound growth, 191 (82.6%) required some type of therapeutic modification. Major rebound growth was noted in 143 of 231 patients (61.9%), minor rebound in 88 patients (38.1%). The mean duration of treatment before rebound growth was 11.4 months (median: 10 months; IQR: 7–14.5 months). The mean age at first episode of rebound growth was 17.1 months (median: 15 months; IQR: 11–21 months).
Compared with those who discontinued propranolol between 12 and 15 months of age (reference group), the odds of rebound were highest for those who stopped propranolol before the age of 9 months (OR: 2.4; 95% CI: 1.3 to 4.5). The ORs (95% CI) of rebound were 2.0 (1.1 to 3.4; P =.02), 1.7 (0.82 to 3.6; P =.15), and 2.5 (1.5 to 4.3; P <.001) when propranolol was discontinued between 18 and 21 months, at 21–24 months, and >24 months, respectively, when compared with the reference group. Discontinuation of propranolol without tapering had a significantly increased risk of rebound growth by univariate analysis. Of those patients who were tapered off the medication, 25.3% (148/586) developed rebound growth compared with 36.6% (41 of 112) who abruptly discontinued propranolol (P =.01). |
Also univariate and multivariate analysis of predictive factors for rebound growth where carried out: Univariate: Predictive factors for rebound growth included head and neck location (P =.005) and segmental distribution (P =.03). Segmental IHs were more likely to have rebound growth (OR: 1.5; 95% CI: 1.1 to 2.2; P =.03) compared with localized IHs. Deep and mixed IHs were more likely to rebound (ORs: 2.5 [95% CI: 1.6 to 3.9; P <.001] and 1.6 [95% CI: 1.1 to 2.4; P =.02], respectively) compared with superficial IHs. Segmental IHs located on the head and neck were more likely to undergo rebound growth compared with localized IHs on the body (OR: 2.5; 95% CI: 1.4 to 4.4; P =.001). Girls were more likely to develop rebound growth (OR: 1.7; 95% CI: 1.2 to 2.5; P =.007).
Multivariate: Deep IHs were 3.3 times more likely to develop rebound growth (OR: 3.3; 95% CI: 1.9 to 6.0; P <.001) compared with superficial IHs, and combined or mixed IHs with both superficial and deep components were 2.4 times more likely to develop rebound growth (OR: 2.4; 95% CI: 1.5 to 4.0; P <.001). Girls were 1.7 times more likely to develop rebound growth (OR: 1.7; 95% CI: 1.1 to 2.6; P =.03). Other factors such as size, segmental distribution, location, and duration of therapy were no longer statistically significant.
|
|
Shehata, 2013
to determine the frequency and associated factors leading to late regrowth after successful treatment at an age when the proliferative phase has usually ceased. |
Type of study: Retrospective chart review
Setting: singlecenter
Country: Canada
Source of funding: |
N total at baseline: 212 à 13 patients with rebound growth.
Inclusion criteria: treatment with propranolol for an IH for at least 6 months; cessation of treatment at the age of 15 months or older, an age when further proliferation is unusual; and clinical photographs or radiologic imaging to support the observation of rebound.
Exclusion criteria: age of 2 years or older at treatment initiation with propranolol, insufficient patient information, and early cessation of treatment (<3 months). |
Treatment with propranolol
The mean dose of propranolol was 2.6 mg/kg/day (range 2-3 mg/kg/day).
|
None.
|
Length of follow-up: Up to 3 years.
|
In total 13 (10 female, 3 male) of 212 patients (6%) were reported to experience clear-cut-rebound.
The locations of the IHs were: head and neck 11 (84%), trunk 2 (15.3%). All were mixed or deep lesions, 12 localized and 1 segmental. The average age was 5.3 ±3.9 months at initiation of treatment and 15.4 ± 3.5 months at the end of treatment. The mean duration of active treatment with propranolol was 10.3 ± 3.3 months, and the mean time off treatment before regrowth was 5.3 ± 3.2 months. The mean age at rebound was 20.7 ± 3.7 months. (table 1) Regrowth mainly involved the deeper component of the IH.
In the 212 patients treated with propranolol with a follow-up of up to 3 years, 98% had a good to excellent response. |
Only the results of the rebound patients are described. |
|
Wedgeworth, 2016
i) to ascertain patterns of propranolol prescribing in Europe, (ii) to collect data on the safety and efficacy of oral propranolol, and (iii) to help inform the formulation of treatment guidelines as well as the design of future interventional studies. |
Type of study: ? retrospective?
Setting: multicenter
Country: Eight European countries (Denmark, Germany, Ireland, Italy, the Netherlands, Spain, Sweden, and the U.K.)
Source of funding: This study had no specific funding. |
N total at baseline: 1079 Rebound: 154 No rebound: 942
Important prognostic factors1: Age (in weeks): Rebound: 16 (range 9-28) No rebound: 17 (range 12-28)
Sex: Female 76.1%
Type of IH: Focal 92.9%
Inclusion criteria: only patients who had completed propranolol therapy for an IH.
Exclusion criteria: ?? |
Treatment with propranolol
|
None.
|
Length of follow-up: ?
|
Rebound growth occurred in 14.1% upon stopping, of whom 53.9% were restarted and treatment response was recaptured in 91.6% of cases.
The median age when treatment was stopped was lower [52 weeks, interquartile range (IQR) 40–64] in the rebound growth than the 56 weeks (IQR 42–72) in the non-rebound growth group, this difference was not statistically significant (P = 0.08, Table 1). The rebound growth risk reduction was most noticeable in the children who were aged ≥ 70 weeks when treatment was stopped (OR 0.58, 95% CI 0.34–0.99, P = 0.048), compared with children in the other age quartiles: up to 40 weeks (OR 1, reference group), 40– 54 weeks (OR 0.83, 95% CI 0.50–1.37, P = 0.46) and 54–70 weeks (OR 0.90, 95% CI 0.55–1.48, P = 0.68; Ptrend <0.01). |
|
Summary of Findings tabellen GRADE
Propranolol 2mg/kg/day versus placebo
|
Propranolol 2 mg/kg/day compared to placebo for hemangioma |
||||||
|
Patient or population: hemangioma Setting: Intervention: propranolol 2 mg/kg/day Comparison: placebo |
||||||
|
Outcomes |
Anticipated absolute effects* (95% CI) |
Relative effect |
№ of participants |
Certainty of the evidence |
Comments |
|
|
Risk with placebo |
Risk with propranolol 2 mg/kg/day |
|||||
|
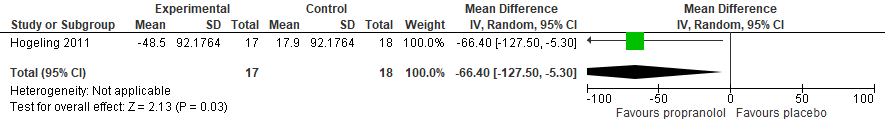
Hemangioma change in volume |
The mean hemangioma change in volume was +17.9 % |
MD 66.4 % lower |
- |
39 |
⨁⨁◯◯ |
Propranolol 2 mg/kg/day appears to result in a large percentage reduction in hemangioma volume when compared with placebo at 12 weeks of treatment duration. |
|
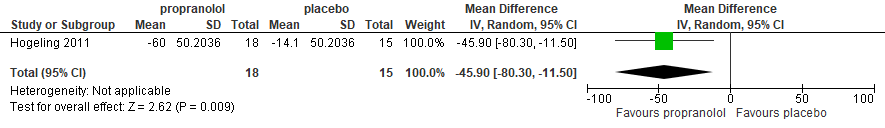
Hemangioma reduction |
The mean hemangioma reduction was -14.1 % |
MD 45.9 % lower |
- |
39 |
⨁⨁◯◯ |
Propranolol 2 mg/kg/day appears to result in a large percentage reduction in hemangioma volume when compared with placebo at 24 weeks of treatment duration. |
|
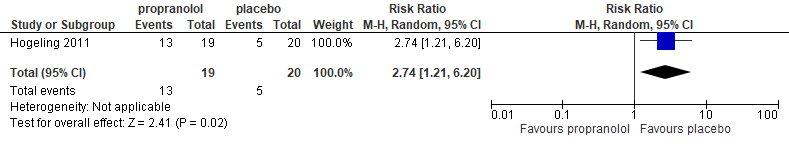
Number of adverse event that occured during treatment |
25 per 100 |
69 per 100 |
RR 2.74 |
39 |
⨁⨁◯◯ |
Propranolol 2 mg/kg/day may increase the number of adverse events that occured during treatment considerably when compared with placebo. |
|
Rebound growth - not measured |
Rebound was not formally assessed as part of the study by Hogeling et al. A mild rebound growth of IHs (with increased redness or slight increase in volume) was noted on cessation of propranolol. Rebound was more noticeable in the children younger than 1 year. |
- |
- |
We are uncertain about the effect of propranolol 2 mg/kg/day on rebound growth when compared with placebo. No data available. |
||
|
Quality of life - not measured |
No study addressed this outcome. |
- |
- |
We are uncertain about the effect of propranolol 2 mg/kg/day on quality of life when compared with placebo. No data available. |
||
|
*The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). |
||||||
|
GRADE Working Group grades of evidence
Explanationsa. Downgraded by two levels for imprecision (low number of participants en low number of events). |
||||||
Propranolol 3mg/kg/day versus placebo
|
Propranolol 3 mg/kg/day compared to placebo for hemangioma |
||||||
|
Patient or population: hemangioma Setting: Intervention: propranolol 3 mg/kg/day Comparison: placebo |
||||||
|
Outcomes |
Anticipated absolute effects* (95% CI) |
Relative effect |
№ of participants |
Certainty of the evidence |
Comments |
|
|
Risk with placebo |
Risk with propranolol 3 mg/kg/day |
|||||
|
Clearance as assessed by physician (complete or nearly complete resolution) follow up: 12 weeks - not measured |
No study addressed this outcome. |
- |
- |
We are uncertain about the effect of propranolol 3mg/kg/day on clearance when compared with placebo at follow-up 12 weeks. No data available. |
||
|
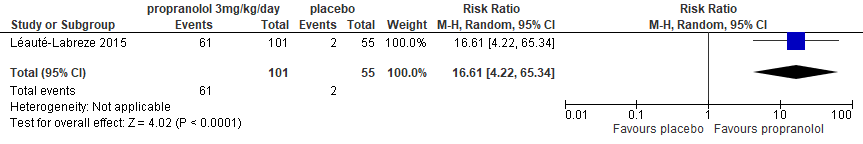
Clearance as assessed by physician (complete or nearly complete resolution) |
4 per 100 |
60 per 100 |
RR 16.61 |
156 |
⨁⨁⨁⨁ |
Propranolol 3 mg/kg/day likely results in a large reduction in clearance as assessed by physician when compared with placebo at follow up 24 weeks. |
|
Rebound growth - not measured |
No study addressed this outcome. |
- |
- |
We are uncertain about the effect of propranolol 3 mg/kg/day on rebound growth when compared with placebo. No data available. |
||
|
Proportion of patients with one or more adverse event that occured during treatment |
76 per 100 |
96 per 100 |
RR 1.26 |
156 |
⨁⨁⨁◯ |
Propranolol 3 mg/kg/day increases proportion of patients with one or more adverse event that occured during treatment probably slightly when compared with placebo. |
|
Quality of life - not measured |
No study addressed this outcome. |
- |
- |
We are uncertain about the effect of propranolol 3 mg/kg/day on quality of life when compared with placebo. No data available. |
||
|
*The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). |
||||||
|
GRADE Working Group grades of evidence |
||||||
Explanations
a. Downgraded by one level for imprecision (the confidence interval crosses the limits of clinical relevant)
Propranolol versus atenolol
|
Propranolol compared to atenolol for hemangioma |
||||||
|
Patient or population: hemangioma Setting: Intervention: propranolol Comparison: atenolol |
||||||
|
Outcomes |
Anticipated absolute effects* (95% CI) |
Relative effect |
№ of participants |
Certainty of the evidence |
Comments |
|
|
Risk with atenolol |
Risk with propranolol |
|||||
|
Proportion patients with complete resolution due to treatment follow up: 3 months - not measured |
No study addressed this outcome. |
- |
- |
We are uncertain about the proportion of patients with complete resolution towards propranolol 2mg/kg/day when compared with atenolol 1mg/kg/day at 3 months follow up. No data available. |
||
|
Proportion patients with complete resolution due to treatment |
54 per 100 |
60 per 100 |
RR 1.11 |
23 |
⨁⨁◯◯ |
The evidence is insufficient to identify an effect in response towards the Propranolol 2 mg/kg/day or the Atenolol 1 mg/kg/day group or to be excluded. There may not be a difference between the groups. |
|
Rebound growth (regrowth) |
15 per 100 |
56 per 100 |
RR 3.67 |
23 |
⨁⨁◯◯ |
The evidence is insufficient to identify an effect on rebound growth towards the Propranolol 2 mg/kg/day or the Atenolol 1 mg/kg/day group or to be excluded. There may not be a difference between the groups. |
|
Proportion of patients with one or more adverse event that occured during treatment - not reported |
There was no significant adverse event in any group of treatment during the 6-month follow-up. The number of adverse events per group are unknown. |
- |
- |
We are uncertain about the proportion patients with an adverse event during treatment with propranolol or atenolol. No data available. |
||
|
Quality of life - not measured |
No study addressed this outcome. |
- |
- |
We are uncertain about the quality of life after use of propranolol when compared with atenolol. No data available. |
||
|
*The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). |
||||||
|
GRADE Working Group grades of evidence |
||||||
Explanations
a. Downgraded by two levels for imprecision (low number of participants en low number of events).
Forest plots bètablokkers
Propranolol 2 mg/kg/day
Hemangioma change in volume 12 weeks
Hemangioma change in volume 24 weeks
Proportion of patients with one or more adverse event that occured during treatment
Propranolol 3 mg/kg/day
Clearance as assessed by physician: complete or nearly resolution
Proportion of patients with one or more adverse event that occured during treatment

Propranolol vs atenolol
Proportion patients with complete resolution due to treatment

Rebound growth

Risk of bias geïncludeerde studies
Bron: Cochrane review Novoa et al. 2018
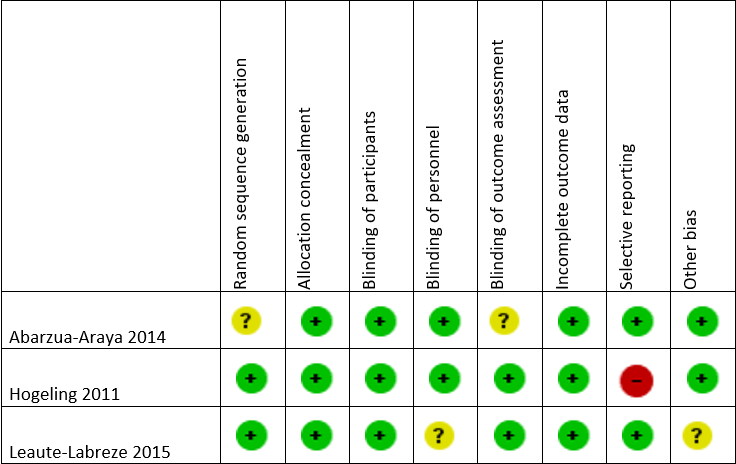
|
Abarzua-Araya 2014 |
||
|
Bias |
Authors’ judgement |
Support for judgement |
|
Random sequence generation (selection bias) |
Unclear risk |
Quote: “Patients who met inclusion criteria were randomised by simple randomisation (...).” Page 1046 Comment: There was insufficient information to rate this item as low or high risk of bias |
|
Allocation concealment (selection bias) |
Low risk |
Quote: “Allocation concealment was respected.” Page 1046 Comment: Authors reported information about allocation concealment |
|
Blinding of participants (Performance bias) |
Low risk |
Quote: “The drugs were similar in aspect and the patients and main investigators were blind.” Page 1046 Comment: Authors reported information about adequate blinding of participants and personnel |
|
Blinding of personnel (performance bias) |
Low risk |
Quote: “The drugs were similar in aspect and the patients and main investigators were blind.” Page 1046 Comment: Authors reported information about adequate blinding of participants and personnel |
|
Blinding of outcome assessment (detection bias) All outcomes |
Unclear risk |
There was insufficient information to rate this item as low or high risk of bias |
|
Incomplete outcome data (attrition bias) All outcomes |
Low risk |
No children were lost at follow-up. |
|
Selective reporting (reporting bias) |
Low risk |
Selective reporting of information was not detected. |
|
Other bias |
Low risk |
No other biases were detected. |
|
Hogeling 2011 |
||
|
Bias |
Authors’ judgement |
Support for judgement |
|
Random sequence generation (selection bias) |
Low risk |
Quote: “Patients were enrolled in the trial by study physicians and randomised into 4 groups using minimization by the clinical trials pharmacist. The study physician telephoned the clinical trials pharmacist who then assigned sequence of randomisation.” Page 260 Comment: Authors reported information about adequate random sequence generation |
|
Allocation concealment (selection bias) |
Low risk |
Quote: “Patients were enrolled in the trial by study physicians and randomised into 4 groups using minimization by the clinical trials pharmacist. The study physician telephoned the clinical trials pharmacist who then assigned sequence of randomisation.” Page 260 Comment: Authors reported information about adequate allocation concealment |
|
Blinding of participants (Performance bias) |
Low risk |
Quotes: “Participants, caregivers, and physicians were blinded to group status.” Page 260 “The placebo oral solution had a similar taste and smell and an identical dispensing bottle.” Page 260 Comment: Authors reported information about adequate blinding of participants |
|
Blinding of personnel (performance bias) |
Low risk |
Quotes: “Participants, caregivers, and physicians were blinded to group status.” Page 260 “The placebo oral solution had a similar taste and smell and an identical dispensing bottle.” Page 260 Comment: Authors reported information about adequate blinding of personnel |
|
Blinding of outcome assessment (detection bias) All outcomes |
Low risk |
Quote: “The IH colour (redness or blueness) and elevation were assessed by the blinded investigator and were given scores by the investigators.” Page 261 Comment: Authors reported information about adequate blinding of outcome assessment |
|
Incomplete outcome data (attrition bias) All outcomes |
Low risk |
5% of children were lost at follow-up. Page 261 |
|
Selective reporting (reporting bias) |
High risk |
All outcomes were predefined and reported. However, information about variance of information (standard deviations) associated to mean estimation were omitted |
|
Other bias |
Low risk |
No other biases were identified. |
|
Leaute-Labreze 2015 |
||
|
Bias |
Authors’ judgement |
Support for judgement |
|
Random sequence generation (selection bias) |
Low risk |
Quote: “Patients were assigned to treatment through an interactive voice-response system, with the use of block randomisation stratified according to age group (35 to 90 days vs. 91 to 150 days) and hemangioma location (facial vs. non-facial) and applied in a 2:2:2:2:1 ratio (propranolol at 1 mg per kilogram per day for 3 months, propranolol at 1 mg per kilogram per day for 6months, propranolol at 3mg per kilogram per day for 3 months, propranolol at 3 mg per kilogram per day for 6 months, and placebo, respectively).” Page 736 Comment: Authors reported information about adequate random sequence generation |
|
Allocation concealment (selection bias) |
Low risk |
Quote: “Patients were assigned to treatment through an interactive voice-response system, with the use of block randomisation stratified according to age group (35 to 90 days vs. 91 to 150 days) and hemangioma location (facial vs. non-facial) and applied in a 2:2:2:2:1 ratio (propranolol at 1 mg per kilogram per day for 3 months, propranolol at 1 mg per kilogram per day for 6months, propranolol at 3mg per kilogram per day for 3 months, propranolol at 3 mg per kilogram per day for 6 months, and placebo, respectively).” Page 736 Comment: Authors reported information about adequate allocation concealment |
|
Blinding of participants (Performance bias) |
Low risk |
Quote: “Different concentrations of propranolol were used (1.25, 2.50, or 3.75 mg per millilitre) in order to administer the same volume to each patient and thereby maintain blinding; patients assigned to 3-month propranolol regimens received placebo for the second 3 months.” Page 737 Comment: Authors reported information about adequate blinding of participants |
|
Blinding of personnel (performance bias) |
Unclear risk |
There was insufficient information to assess this item as low or high |
|
Blinding of outcome assessment (detection bias) All outcomes |
Low risk |
Quote: ”Primary efficacy was assessed by centralized evaluation of standardized digital photographs (taken by investigators at each visit) by two independent, trained, validated readers who were unaware of the study-group assignments, with adjudication for discrepancies; inter-reader and intra- reader reliability were assessed.” Page 737 Comment: Authors reported information about adequate blinding of outcome assessment |
|
Incomplete outcome data (attrition bias) All outcomes |
Low risk |
The percentage lost at follow-up was between 1% and 4%, respectively (intention-to-treat analysis with overrun) |
|
Selective reporting (reporting bias) |
Low risk |
All outcomes were predefined and reported |
|
Other bias |
Unclear risk |
Quote: “The sponsor (Pierre Fabre Dermatologie) was involved in the study design in collaboration with three of the academic authors and was responsible for trial management, analysis and interpretation of data, and the decision to submit the manuscript for publication.” Page 736 Comment: The industry sponsor was involved in the analysis and interpretation of the data, as well as the decision to submit the manuscript for publication. It is unclear what effect this may have on the study results |
Exclusietabel
|
Titel (jaar) |
Exclusie reden |
|
Alexopoulos (2018) |
Ongecontrolleerd/vergelijkend |
|
Al-Jazaeri (2017) |
Prospectief, niet gecontrolleerd. |
|
Anonymous (2017) |
Geen studie, boek |
|
Bagazgoitia (2011) |
Retrospectief, gem. behandelduur 12 weken. |
|
Bayart (2015) |
Beschrijvende studie |
|
Bayart (2017) |
Retrospectief |
|
Bonifazi (2018) |
Onjuiste studiepopulatie |
|
Buckmiller (2010) |
Retrospectief case series, ongecontrolleerd |
|
Celik (2012) |
Ongecontroleerde studie |
|
Chang (2016) |
Prospectief ongecontrolleerd |
|
Chinnadurai (CADTH) |
Geen studie, boek |
|
Chinnadurai (2016) |
Meta-analyse geen eigen data. |
|
Chu (2014) |
Retrospectief |
|
Dalby (2013) |
Review, geen eigen data |
|
de Graaf (2013) |
Retrospectieve vergelijking, niet gerandomiseerd |
|
El-Essawy (2011) |
Prospectieve case series. Niet gecontrolleerd |
|
Elluru (2015) |
Retrospectieve review |
|
Fernandez-Pineda (2016) |
Review, geen originele data. |
|
Fuchsmann (2011) |
Retrospectieve studie |
|
Ge (2016) |
Retrospectief, ongecontrolleerd |
|
Georgountzou (2012) |
Prospectief, ongecontrolleerd |
|
Gunturi (2013) |
Literatuur review, geen eigen data. |
|
Hassan (2014) |
Prospectief klinische studie |
|
Hoeger (2015) |
Consencus aanbevelingen van een expert groep |
|
Holmes (2011) |
Prospectief, ongecontrolleerd |
|
Hutchinson (2019) |
Review, geen eigen data. |
|
Jacobson (2014) |
Case-report met literatuuroverzicht |
|
Ji (2016) |
Prospectief, ongecontroleerd |
|
Kagami (2018) |
Case series, niet vergelijkend |
|
Kaneko (2017) |
open-label phase III study, ongecontroleerd |
|
Kim (2018) |
Retrospectief, cohort studie |
|
Koka (2018) |
Case series, niet vergelijkend |
|
Korownyk (2014) |
Literatuur overzicht |
|
Lahrichi (2018) |
Prospectief, geen spreidingsmaten in resultaten |
|
Laranjo (2014) |
Prospectief, ongecontroleerd |
|
Leaute-Labreze (2016) |
Systematische review, geen eigen data |
|
Leaute-Labreze (2013) |
< 6 maanden follow up |
|
Leaute-Labreze (2015) |
Abstract in ander tijdschrift van geincludeerde studie |
|
Li (2016) |
prospectieve klinische studie, willekeurige toewijzing |
|
Li (2015) |
Meta-analyse; betablokker vs prednisolon |
|
Liu (2015) |
Meta-analyse |
|
Lou (2014) |
Meta-analyse, propranolol vs corticosteroiden |
|
Lv (2012) |
Case series, ongecontroleerd |
|
Mahadevan (2011) |
Propranolol vs corticosteroïden |
|
Marqueling (2013) |
Systematische review |
|
Menezes (2011) |
Propranolol vs prednisolon |
|
Nelson (2011) |
Ongecontroleerde studie |
|
Ng (2016) |
Retrospectieve studie ongecontroleerd. |
|
Novoa (2018) |
Cochrane review, beschrijvend |
|
Novoa (2018) |
Dubbel met Novoa 2018 |
|
Park (2014) |
Retrospectieve observationele studie, ongecontroleerd |
|
Peridis (2011) |
Meta-analyse, propranolol vs corticosteroiden |
|
Phillips (2017) |
Expressie beta-adrenerge receptoren |
|
Porubanova (2015) |
Retrospectieve review, ongecontroleerd |
|
Raphael (2016) |
Review van de literatuur |
|
Raphael (2011) |
Case report, N=2 |
|
Rork (2018) |
Reactie op een reactie. |
|
Rouhana (2015) |
Literatuur review |
|
Ruitenberg (2016) |
Retrospectieve studie, ongecontroleerd |
|
Sagi (2014) |
Retrospectieve, vergelijkende studie. Ongecontroleerd |
|
Schupp (2011) |
Case series |
|
Solman (2018) |
Guideline |
|
Solman (2014) |
Retrospectieve case review, ongecontrolleerd |
|
Sondhi (2013) |
Open trial |
|
Spiteri Cornish (2011) |
Systematische review |
|
Szychta (2014) |
Niet gerandomiseerde, vergelijkende?? cohort studie |
|
Takechi (2018) |
Pharmacokinetiek en dynamiek |
|
Tan (2014) |
Dubbel met Tan 2015 |
|
Tan (2015) |
Case series |
|
Tan (2011) |
Case series |
|
Vercellino (2013) |
Report case series, ongecontroleerd |
|
Vlastarakos (2012) |
Meta-analyse propranolol en prednisolon |
|
Wang (2018) |
Systematische review |
|
Xiao (2013) |
Case series, ongecontroleerd |
|
Xue (2016) |
Retrospectieve studie, ongecontroleerd |
|
Zaher (2011) |
Ongecontroleerde studie |
|
Zhang, Wu et al. (2017) |
Retrospectieve review, ongecontroleerd |
|
Zvulunov (2011) |
Retrospectieve studie, ongecontroleerd |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 19-04-2021
Beoordeeld op geldigheid : 11-01-2021
Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update).
De Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) is regiehouder van deze richtlijnen eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn(modules). De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door arts-onderzoekers van de NVDV en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Deze richtlijn over infantiele hemangiomen is een document met aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het vaststellen van goed medisch handelen. De richtlijn geeft aanbevelingen voor de diagnostiek, behandeling en follow-up van patiënten met een infantiel hemangioom.
Doelgroep
De richtlijn is bestemd voor alle zorgverleners die betrokken zijn bij de zorg voor patiënten met infantiele hemangiomen zoals dermatologen, kinderartsen, plastisch chirurgen, kinderchirurgen, KNO-artsen, radiologen, oogartsen, pathologen, huisartsen en jeugdartsen. Voor (de ouders van) patiënten zal aparte informatie worden opgesteld, beschikbaar via de website van de NVDV (www.nvdv.nl) en www.thuisarts.nl.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met infantiele hemangiomen en patiëntenvertegenwoordiger(s) vanuit Hevas (zie hiervoor het overzicht van de werkgroepleden de tabel hieronder). Wetenschappelijke verenigingen zoals NVK, NVPC, NVVH, NVKNO, NOG, NVvR, NVVP, NHG, NVZA en de AJN en stakeholders zoals VIG, NVZ, V&VN, NFU, ZN, ZiNL en de patiëntenfederatie werden voor de knelpunten analyse en commentaarronde uitgenodigd.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroepleden – versie 2020
|
Werkgroeplid |
Affiliatie en vereniging |
|
Mw. Dr. C.J.M. van der Vleuten, dermatoloog, (voorzitter) |
Radboudumc, Nijmegen, NVDV |
|
Dhr. Z. Çiftçi, arts-onderzoeker (secretaris) (vanaf februari 2020) |
Bureau NVDV, Utrecht, NVDV |
|
Mw. C.T. van den Bosch, patientvertegenwoordiger |
Bestuur HEVAS |
|
Dhr. Dr. C.C. Breugem, plastisch chirurg |
Amsterdam UMC, NVPC |
|
Dhr. L.M.A. Favié, ziekenhuisapotheker |
UMC Utrecht, NVZA |
|
Dhr. S.W. Genders, oogarts (vanaf september 2019) |
LUMC, Amsterdam UMC, NOG |
|
Mw. Dr. M. de Graaf, dermatoloog |
UMC Utrecht, NVDV |
|
Dr. J.J.E. van Everdingen, dermatoloog n.p. |
Directeur NVDV |
|
Mw. Dr. D.J.J. Hermans, dermatoloog |
Jeroen Bosch ziekenhuis, NVDV |
|
Mw. M.F. Hofhuis, arts-onderzoeker (secretaris) (tot november 2019) |
Bureau NVDV, Utrecht, NVDV |
|
Dhr. T. Boere, arts-onderzoeker (secretaris) (tot februari 2020) |
Bureau NVDV, Utrecht, NVDV |
|
Dhr. Dr. J. Honings, KNO-arts / Hoofd-hals chirurg |
Radboudumc, NVKNO |
|
Mw. Prof. Dr. C.M.A.M. van der Horst, plastisch chirurg |
Amsterdam UMC, NVPC |
|
Mw. M.P. Jongma, patientvertegenwoordiger |
Bestuur HEVAS |
|
Mw. K. Kamphuis – van Ulzen, radioloog |
Radboudumc, NVvR |
|
Dhr. Dr. P.C.J. de Laat, kinderarts |
Erasmus MC, NVK |
|
Mw. M. Marinkovic, oogarts (tot september 2019) |
LUMC, NOG |
|
Mw. Dr. E. Mendels, dermatoloog |
Erasmus MC, NVDV |
|
Mw. M. Mul, huisarts n.p. |
NHG |
|
Mw. Dr. M.F. Raphael, kinderarts-oncoloog |
Amsterdam UMC, NVK |
|
Dhr. Dr. B.H. Verhoeven, kinderchirurg |
Radboudumc, NVVH |
|
Dhr. A.C. van der Wal, patholoog |
Amsterdam UMC, NVVP |
|
Ondersteuning werkgroep |
Affiliatie en vereniging |
|
Mw. I. Tissen, jeugdarts |
AJN |
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben bij aanvang van en na het afronden van de richtlijn schriftelijk verklaard of zij in de laatste 3 jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen is hieronder opgenomen. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van de NVDV.
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van de Nederlandse Vereniging voor Dermatologie en Venereologie.
|
Werkgroeplid |
Nevenfunctie |
Gemelde belangen (firma en activiteit) |
Ondernomen actie (indien van toepassing) |
|
Dr. C.J.M. van der Vleuten, dermatoloog, (voorzitter) |
Geen |
Consultatie/advisering Pierre Fabre |
Treedt terug in de rol van voorzitter, indien er in de werkgroep discussie is over onderwerpen die gerelateerd zijn aan het advies wat gegeven wordt aan Pierre Fabre. |
|
Dhr. Z. Çiftçi, arts-onderzoeker (secretaris) |
Geen |
Geen |
Geen |
|
Dhr. T. Boere, arts-onderzoeker (secretaris) |
Geen |
Geen |
Geen |
|
Mw. C.T. van den Bosch, patientvertegenwoordiger |
Geen |
Geen |
Geen |
|
Dhr. Dr. C.C. Breugem, plastisch chirurg |
Geen |
Geen |
Geen |
|
Dhr. L.M.A. Favié, ziekenhuisapotheker |
Geen |
Geen |
Geen |
|
Dhr. S.W. Genders, oogarts |
Geen |
Geen |
Geen |
|
Mw. Dr. M. de Graaf, dermatoloog |
Geen |
Geen |
Geen |
|
Dr. J.J.E. van Everdingen, directeur NVDV, dermatoloog n.p. |
Geen |
Geen |
Geen |
|
Mw. Dr. D.J.J. Hermans, dermatoloog |
Geen |
Geen |
Geen |
|
Mw. M.F. Hofhuis, arts-onderzoeker (secretaris) |
Geen |
Geen |
Geen |
|
Dhr. Dr. J. Honings, KNO-arts |
Geen |
Geen |
Geen |
|
Mw. Prof. Dr. C.M.A.M. van der Horst, plastisch chirurg |
Geen |
Geen |
Geen |
|
Mw. M.P. Jongma, patientvertegenwoordiger |
Geen |
Geen |
Geen |
|
Mw. K. Kamphuis – van Ulzen, radioloog |
Geen |
Geen |
Geen |
|
Dhr. Dr. P.C.J. de Laat, kinderarts |
Geen |
|
|
|
Mw. M. Marinkovic, oogarts |
Geen |
Geen |
Geen |
|
Mw. Dr. E. Mendels, dermatoloog |
Geen |
Geen |
Geen |
|
Mw. M. Mul, huisarts |
Geen |
Geen |
Geen |
|
Mw. Dr. M.F. Raphael, kinderarts |
Geen |
Geen |
Geen |
|
Dhr. Dr. B.H. Verhoeven, kinderchirurg |
Geen |
Geen |
Geen |
|
Dhr. A.C. van der Wal, patholoog |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er is aandacht besteed aan het patiëntenperspectief door deelname van de patiëntenvereniging Hevas (Nederlandse ouder- en patiëntenvereniging voor hemangiomen en vasculaire malformaties) in de richtlijnwerkgroep. Zij zijn inhoudelijk betrokken geweest bij het opstellen van de projectaanvraag en in de richtlijnwerkgroep. De conceptrichtlijn is tevens voor commentaar en autorisatie voorgelegd aan patiëntenvereniging Hevas.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn(module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren, zoals de invoering van nieuwe systemische middelen. Omdat er mogelijk een grote maatschappelijke impact te verwachten zou zijn bij een grote toename in het gebruik van propranolol (Hemangiol) werd er in 2020 een doorrekening van de gewijzigde kosten bij integrale implementatie van de richtlijn gerealiseerd in een zogenaamde Budget Impact Analyse (BIA). De volledige rapportage is opgenomen in de separate bijlage ‘Budget impact analyse’.
Werkwijze
De werkgroep Infantiele Hemangiomen heeft in 2018-2021 de vraag- en doelstellingen van deze richtlijn met elkaar afgestemd en uitgewerkt. De ontwikkeling van deze richtlijn is gebaseerd op het ‘consensusdocument voor de behandeling van infantiele hemangiomen’ welke in 2017 werd vastgesteld door 4 samenwerkende (door de minister van VWS erkende) expertisecentra[1] op het gebied van aangeboren vaatafwijkingen samen met patiëntenvereniging Hevas. [Consensusdocument 2017] Naast de 4 expertisecentra zijn er nog enkele andere ziekenhuizen in Nederland waar multidisciplinaire teams (met onder andere dermatologen, (plastisch) chirurgen, kinderartsen en radiologen) zorg leveren aan kinderen met infantiele hemangiomen.
Hieronder wordt de werkwijze van de richtlijn 2021 verder toegelicht.
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. [Medisch Specialistische Richtlijnen] Dit rapport is gebaseerd op het AGREE II-instrument (Appraisal of Guidelines for Research & Evaluation II), dat een internationaal breed geaccepteerd instrument is. [Brouwers 2010] Voor een stap-voor-stapbeschrijving hoe een evidence-based richtlijn tot stand komt, wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften maar wetenschappelijk onderbouwde en breed gedragen inzichten en aanbevelingen waaraan zorgverleners zouden moeten voldoen om kwalitatief goede zorg te verlenen. Aangezien richtlijnen uitgaan van ‘gemiddelde patiënten’, kunnen zorgverleners in individuele gevallen zo nodig afwijken van de aanbevelingen in de richtlijn. Afwijken van richtlijnen is, als de situatie van de patiënt dat vereist, soms zelfs noodzakelijk. Een richtlijn beschrijft wat goede zorg is, ongeacht de financieringsbron (Zorgverzekeringswet (Zvw), Wet langdurige zorg (Wlz), Wet maatschappelijke ondersteuning (Wmo), aanvullende verzekering of eigen betaling door de cliënt/patiënt). Opname van een richtlijn in een register betekent dus niet noodzakelijkerwijs dat de in de richtlijn beschreven zorg verzekerde zorg is. Informatie over kosten zoals beschreven in de richtlijn is gebaseerd op beschikbare gegevens ten tijde van schrijven.
Knelpuntenanalyse
In de eerste vergadering zijn knelpunten en wensen ten aanzien van de richtlijn geïnventariseerd door de werkgroepleden.Tevens zijn er knelpunten aangedragen door de betrokken verenigingen NVK, NOG, NVvH, NVKNO, NVvP, NVPC, NVvR, patiëntenvereniging Hevas, NVZA, VIG en ZN in een knelpuntenanalyse.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep uitgangsvragen opgesteld. Per uitgangsvraag zijn klinisch relevante uitkomstmaten opgesteld, waarbij zowel naar gewenste als ongewenste effecten is gekeken (op bladzijde 18 staat een overzicht van de uitgangsvragen en uitkomstmaten). De werkgroep heeft deze uitkomstmaten gewaardeerd volgens hun relatieve klinisch belang bij de besluitvorming rondom aanbevelingen.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen is aan de hand van specifieke zoektermen een systematische zoekstrategie uitgevoerd in (verschillende) elektronische databases Embase en MEDLINE. In eerste instantie is gezocht naar studies met de hoogste mate van bewijs. De aldus gevonden studies zijn per uitgangsvraag door twee tot drie werkgroepleden/auteurs van de modules (CvdV, EM, PdL, DH, MdG, MR en CvdH) onafhankelijk van elkaar geselecteerd op basis van titel en abstract en vooraf opgestelde selectiecriteria. Bij discrepantie is een derde persoon gevraagd (MH). De beoordeling en uiteindelijke selectie op basis van volledige tekst is gedaan door arts-onderzoeker(s) van de NVDV. De geselecteerde studies zijn gebruikt om de uitgangsvraag te beantwoorden. De zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de zoekverantwoording.
Kwaliteits beoordeling individuele studies
De beoordeling van de kwaliteit van het wetenschappelijk bewijs/onderzoeksgegevens is in de richtlijn tot stand gekomen met de GRADE-methode.
Bij de GRADE-methode (Grading Recommendations Assessment, Development and Evaluation) worden individuele studies systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB)-tabellen, deze zijn op te vragen via de NVDV. Hiervoor is gebruikgemaakt van de Cochrane risk of bias tool. [Higgins 2011]
Tabel 1 geeft een kort overzicht van de indeling van methodologische kwaliteit van individuele studies volgens GRADE. Een volledige uitleg over de GRADE-methode valt buiten het bestek van deze richtlijn, zie hiervoor het ‘GRADE handbook’. [Schünemann 2013, https://www.gradeworkinggroup.org/]
Tabel 1. Indeling van kwaliteit van wetenschappelijk bewijs volgens GRADE
|
GRADE-systeem |
||
|
Kwaliteitsindeling bewijs |
|
|
|
|
|
|
|
|
|
|
|
|
Startkwalificatie |
- Gerandomiseerd onderzoek = hoog - Observationele studie = laag |
|
|
Factoren die de kwaliteit van bewijs kunnen verlagen* |
- Ernstige of zeer ernstige beperkingen in de kwaliteit van de studie - Indirectheid van het bewijs - Belangrijke inconsistentie tussen studies - Imprecisie - Grote kans op ‘publicatiebias’ |
|
|
Factoren die de kwaltiteit van bewijs kunnen verhogen** |
- Sterk bewijs voor een associatie – significant relatief risico van > 2 (< 0,5) gebaseerd op consistent bewijs uit twee of meer observationele studies, zonder plausibele ‘confounders’ (+1) - Zeer sterk bewijs voor een associatie – significant relatief risico van > 5 (< 0,2) gebaseerd op direct bewijs zonder belangrijke bedreigingen voor de validiteit (+2) - Bewijs voor een dosis respons gradiënt (+1) - Alle plausibele ‘confounders’ zonder het effect te hebben verminderd (+1) |
|
* Elk criterium kan de kwaliteit verminderen met 1 stap of bij zeer ernstige beperkingen met 2 stappen.
** Verhogen kan alleen indien er geen beperkingen zijn t.a.v. de studiekwaliteit, imprecisie, inconsistentie, indirectheid en publicatiebias
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde studies zijn overzichtelijk weergegeven als ‘karakteristieken en resultaten van geïncludeerde studies’ in de evidence tabellen. De belangrijkste bevindingen uit de literatuur met betrekking op de vooraf opgestelde uitkomstmaten zijn beschreven in de samenvatting van de literatuur.
Formuleren van conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methode. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten werden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overige overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn met behulp van de GRADE-methodiek gebaseerd op het beschikbare wetenschappelijke bewijs, de belangrijkste overige overwegingen en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht of het niveau van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling.
Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling beschreven (zie de bijlage ‘Kennislacunes’).
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren zijn verzameld in een commentaarformulier/tabel en besproken met de werkgroep. Naar aanleiding van de commentaren is de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn is aan de betrokken (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd ter autorisatie en door hen geautoriseerd dan wel geaccordeerd. Zie daarvoor paragraaf ‘Autorisatie’.
Literatuur
- Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
- Consensusdocument voor de behandeling van infantiele hemangiomen, HEVAS. 5 juli 2017
- Higgins JPT, Green S (editors). Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [updated March 2011]. The Cochrane Collaboration, 2011. Available from http://www.handbook.cochrane.org.
- Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit.. Online beschikbaar op http://richtlijnendatabase.nl/ Laatst geraadpleegd op [DATUM geraadpleegd voor concepttekst]
- Van Everdingen JJE, Burgers JS, Assendelft WJJ, et al. Evidence-based richtlijnontwikkeling. Bohn Stafleu Van Loghum 2004.
- Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from.
[1] Het Radboudumc te Nijmegen, het Amsterdam UMC/Emmakinderziekenhuis te Amsterdam, het ErasmusMC/Sophia Kinderziekenhuis te Rotterdam en het UMCU/Wilhelmina Kinderziekenuis te Utrecht.
Zoekverantwoording
Voor uitgangsvraag 1,2 en 3 werd gebruik gemaakt van het ‘Consensusdocument voor de behandeling van infantiele hemangiomen’ hetgeen in 2017 werd vastgesteld door 4 samenwerkende (door de minister van VWS erkende) expertisecentra op het gebied van aangeboren vaatafwijkingen samen met patiëntenvereniging Hevas. De tekst uit het consensusdocument werd aangevuld met informatie uit het overzichtsartikel van Leaute-Labreze et al. uit de Lancet 2017 en de ‘Clinical Practice Guideline for the Management of Infantile Hemangiomas’ van de Amercian Academy of Pediatrics van Krowchuk et al. uit 2019. Voor uitgangsvraag 4 en 5 werd op 7 janurai een systematische zoekstrategie uitgevoerd in de elektronische databases Embase en Medline. Voor de volledigheid werd er op 4 en 6 februari 2019 aanvullend voor uitgangsvraag 1, 2 en 3 ook een systematische zoekstrategie uitgevoerd in dezelfde elektronische databases, Embase en Medline. De zoekstrategie is toegevoegd als bijlage. De zoekactie voor uitgangsvraag 4 en 5 is met behulp van de PICO-systematiek opgebouwd. De onderdelen van de PICO werden geformuleerd op basis van de uitgangsvraag.
|
P |
Kind met gediagnostiseerd infantiel hemangioom onder behandeling met systemische bètablokker |
|
I |
Behandelduur aangepast op indicatie en locatie van IH |
|
C |
Behandeling gedurende 6 maanden |
|
O |
Gewenst klinisch effect met minste risico en belasting voor het kind |
|
Database(s): Medline, Embase |
Datum: 07-01-2019 |
|
Periode: > 1982 |
Talen: Engels |
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
|
1 exp Hemangioma/ or (hemangiom* or haemangiom*).ti,ab,kw. (39625) 2 exp Infant/ or "Infant, Newborn"/ or (infancy or infantile or juvenile).ti,ab,kw. (1178827) 3 1 and 2 (7976) 4 exp *Propranolol/ or propranolol.ti,ab,kw. (34419) 5 exp ATENOLOL/ or atenolol.ti,ab,kw. (8011) 6 4 or 5 (40656) 7 3 and 6 (860) 8 limit 7 to (english language and yr="1982 -Current") (775) 9 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (379930) 10 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1817368) 11 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (3099959) 12 8 and 9 (48) 13 8 and 10 (107) 14 8 and 11 (277) 15 12 or 13 or 14 (351)
= 351 (349 uniek) |
461 |
|
Embase (Elsevier) |
('hemangioma'/exp OR hemangioma*:ab,ti OR haemangioma*:ab,ti)
AND ('infancy'/exp OR infant*:ab,ti OR infancy:ab,ti OR juvenile:ab,ti)
AND ('propranolol'/exp OR 'atenolol'/exp OR propranolol:ab,ti OR atenolol:ab,ti)
AND ([english]/lim AND [1982-2019]/py NOT 'conference abstract':it)
Gebruikte filters:
Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it
Observationeel onderzoek: 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti)
= 347 (346 uniek) |
