Aanvullend onderzoek bij infantiele hemangiomen
Uitgangsvraag
Wanneer is aanvullend onderzoek aangewezen en voor welk aanvullend onderzoek kan het beste worden gekozen?
Aanbeveling
IH worden in het algemeen klinisch gediagnosticeerd. Bij twijfel over de diagnose IH is Doppler of echo-Doppler de eerste diagnostische stap. Daarnaast kan met echografie de diepte en grootte van een IH tot op zekere hoogte geëvalueerd worden.
Mocht er na echografie nog steeds twijfel zijn over de bevindingen, overweeg dan een MRI-scan als gevoeligere diagnostische techniek.
Een patiënt met een IH met risico op complicaties of een voor IH verdachte afwijking met atypisch beloop moet worden doorverwezen naar een expertisecentrum of multidisciplinair team met specialisten met ervaring met IH om te bepalen of er een indicatie is voor specifieke diagnostische maatregelen.
Overweeg histopathologisch onderzoek (pas na MRI) indien er onderscheid gemaakt moet worden tussen een atypisch IH en andere (maligne) tumoren; bij IH is de glut-1 kleuring altijd positief.
Verricht in het geval van 10 of meer cutane IH bij kinderen jonger dan 6 maanden echografie van de lever (en gehele abdomen) om hepatische en/of viscerale IH uit te sluiten.
Verricht bij de diagnose van grote of multifocale (intra-hepatische) IH zo vroeg mogelijk een screening op hypothyreoidie.
Bij verdenking op het PHACES syndroom is een MRI/MRA geïndiceerd voor evaluatie van het hoofdhalsgebied (inclusief de aortaboog en brachiocephale takken). Verwijs deze kinderen daarnaast naar een kindercardioloog voor echocardiografie vanwege mogelijke cardiale afwijkingen en naar een oogarts om visuele complicaties uit te sluiten.
Bij patiënten met een risico of verdenking op het LUMBAR-syndroom kunnen spinale echo-Doppler en echo-Doppler van het abdomen en bekken worden gebruikt voor een eerste screening. Ook hier geldt; mocht er na een echografie nog steeds twijfel zijn over de bevindingen, overweeg dan een MRI-scan als gevoeligere diagnostische techniek.
Verwijs kinderen met volumineuze IH naar een kindercardioloog voor echocardiografie vanwege het verhoogde risico op high output hartfalen.
Verwijs kinderen met perioculaire IH en/of intraorbitale IH altijd naar een oogarts vanwege het risico op amblyopie, om visuele complicaties uit te sluiten en ook om te bepalen of er een behandelindicatie is. Een pupil bedekkende ptosis als gevolg van een perioculair IH is reden tot verwijzing op korte termijn.
Onderbouwing
Achtergrond
De meeste IH kunnen in het algemeen eenvoudig worden onderscheiden van andere (vasculaire) tumoren of vaatmalformaties door het typische groei- en regressiepatroon van IH. Toch bestaan er in de neonatale fase een aantal andere snelgroeiende tumoren die erg kunnen lijken op het IH. Het is van belang om het veel voorkomende IH te onderscheiden van andere benigne of maligne afwijkingen, die soms zeldzaam zijn, zodat tijdig het juiste beleid wordt gekozen. In deze module geven wij een overzicht van de diagnostische middelen die hierbij ingezet kunnen worden.
Daarnaast kan in het geval van specifieke IH verder aanvullend onderzoek geïndiceerd zijn. Ook dit wordt uitgewerkt in deze module.
Samenvatting literatuur
Onderstaande tekst is een overzicht van de bestaande literatuur over de indicatie en het type aanvullend onderzoek bij IH. Dit is aangevuld met ervaringen en aanbevelingen vanuit de klinische praktijk.
Differentiaal diagnose
Dankzij het karakteristieke klinisch beloop van IH, kan de diagnose vaak op basis van anamnese en lichamelijk onderzoek (zie algemene inleiding) gesteld worden. In een klein percentage (<5%) is er sprake van een atypische presentatie of beloop. Hierbij is aanvullend onderzoek aangewezen om te differentiëren tussen andere benigne of maligne tumoren of vaatmalformaties. Zie tabel 1 voor een overzicht van de differentiaal diagnose van IH. [Consensusdocument 2017]
Tabel 1. Differentiaal diagnose IH
|
Aanwezig bij- of ontstaan direct na geboorte |
Ontstaan na geboorte |
|
Congenitaal hemangioom (RICH, NICH of PICH) |
Granuloma telangiectaticum/ pyogenicum |
|
Kaposiform hemangioendothelioma of tufted angioma |
Vaatmalformatie (veneus, lymfatisch of gemengd) |
|
Capillaire malformaties (wijnvlek) |
Kaposiform hemangioendothelioma of tufted angioma |
|
Vaatmalformatie (veneus, lymfatisch of gemengd) |
Maligne tumoren (sarcoom, lymfoom, cutane lokalisatie van neuroblastoom of leukemie) |
|
Overig: hamartoom, myofibromatosis, dermoidcyste, teratoom, sarcoom (fibrosarcoom), neuroblastoom, leukemie (‘blueberry muffin baby’), langerhanscelhistiocytose |
Overig: hamartoom, benigne tumoren (pilomatrixoma, Spitz naevus, myofibromatosis, neurofibroom, granuloma faciale, myxoom, lipoblastoom), langerhanscelhistiocytose |
(Consensusdocument 2017)
Aanvullend onderzoek
IH worden over het algemeen klinisch gediagnosticeerd. Beeldvorming of ander aanvullend onderzoek zijn in het algemeen niet geïndiceerd. Er zijn echter een aantal uitzonderingen. Als er twijfel is over de diagnose vanwege een afwijkende verschijningsvorm of een atypisch beloop kan verder onderzoek nodig zijn. Maar ook wanneer de diagnose IH al gesteld is, maar het type mogelijk complicaties of associaties met zich meebrengt, waarvoor verder onderzoek moet worden verricht.
Belastend aanvullend onderzoek dient te worden geïndiceerd en uitgevoerd in een expertisecentrum door een multidisciplinair team. [Consensusdocument 2017, Leaute-Labreze 2017]
Aanvullend onderzoek bij twijfel over de diagnose IH:
Beeldvormend onderzoek
Echo-Doppler/duplex
Doppler onderzoek of echografie met Doppler (Duplex) door een ervaren kinderradioloog met expertise op dit gebied is de eerste diagnostische stap wanneer er twijfel bestaat over de diagnose IH. Voordelen van echografie zijn de veiligheid en de patiëntvriendelijkheid. Daarnaast kan het zonder sedatie worden uitgevoerd en vereist het geen blootstelling aan ioniserende straling. Bij duplex-onderzoek verschijnen de meeste IH als een goed gedefinieerde massa met vasculaire kenmerken met een hoge flow, zonder arterioveneuze shunting (een uitzondering hierop zijn hepatische IH, die wel arterioveneuze shunting kunnen vertonen). Deze kenmerken kunnen veranderen naarmate een IH in regressie gaat en uit meer vet- en bindweefsel bestaat met een mindere vascularisatie. Het nadeel van echografie is dat het onderzoeker afhankelijk is en dus door een ervaren specialist dient te worden uitgevoerd. Ook is het zo dat bewegingen van een kind de Doppler meting verstoren, waardoor het kan gebeuren dat er geen betrouwbare meting van de flow komt.
MRI/MRA
MRI/MRA (Magnetic Resonance Imaging/Angiografie) is een beeldvormingstechniek die geschikt is om de weke delen, organen en onderliggende structurele afwijkingen te definiëren, waarbij zonodig intraveneus contrast kan worden gebruikt om vasculaire en goed-doorbloede componenten te beoordelen.
MRI is geschikt om te differentiëren tussen maligne weke delen tumoren, vasculaire malformaties en IH. MRA kan met en zonder intraveneus contrast. Hiermee kan de vasculaire anatomie in beeld worden gebracht. Dit kan helpen om te differentiëren tussen vasculaire tumoren zoals IH en andere weke delen tumoren. Ook shunting kan hiermee worden getoond.
MRI maakt geen gebruik van ioniserende straling maar kan, gezien de duur van het onderzoek, wel sedatie vereisen.[Krowchuk 2019] Neonaten kunnen soms worden ingebakerd of in hun slaap worden gescand, zodat er zonder sedatie toch geen bewegingsstoringen zijn in het onderzoek. Een MRI/MRA wordt alleen op indicatie verricht in gespecialiseerde centra (speciale MRI protocollen met dynamische series). Men dient rekening te houden met de duur van het onderzoek, omdat langdurige sedatie of herhaalde blootstelling aan anesthetica en sedativa bij kinderen de ontwikkeling van de hersenen negatief kan beïnvloeden. [Krowchuk 2019]
Voor meer informatie over anesthesie bij kinderen (en eventuele schade aan de ontwikkeling van de hersenen) verwijzen we naar de richtlijn ’Anesthesie bij kinderen’ (https://www.richtlijnendatabase.nl/richtlijn/anesthesie_bij_kinderen)
CT
Er is zelden indicatie voor het verrichten van een CT bij kinderen met verdenking IH. CT maakt gebruik van ioniserende straling, waarvan bekend is dat dit schadelijk effect heeft juist op jonge kinderen. CT met intraveneus contrastmiddel kan gebruikt worden voor beeldvorming van de vaten en shunting (IH in de lever) maar heeft weinig onderscheidend vermogen in de wekedelen en organen.
Laryngoscopie
Wanneer er verdenking bestaat op een IH in de luchtwegen, bijvoorbeeld vanwege een stridor bij een neonaat van tussen de 6-12 weken, kan de afwijking door een KNO-arts meestal worden vastgesteld door een wakkere flexibele laryngoscopie. Een subglottisch IH ligt doorgaans submucosaal, waardoor het als een submucosale massa oogt, vaak zonder de karakteristieke rode verkleuring. Echter kan het in de praktijk lastig zijn om alleen met wakkere flexibele scopie een volledig en goed beeld van de subglottis te krijgen. In dat geval kan een onderzoek onder narcose noodzakelijk zijn.
Laryngoscopisch beeld van een subglottisch hemangioom
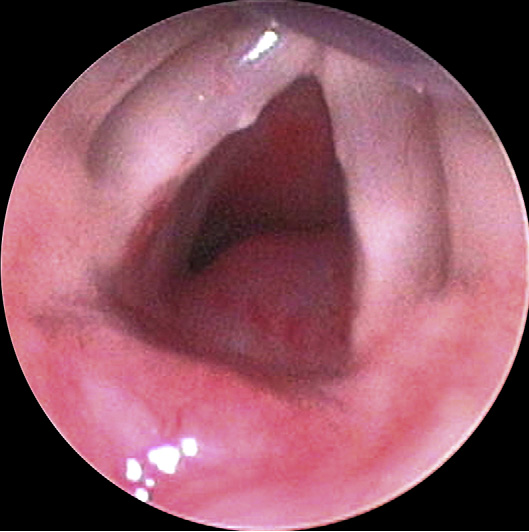
Bron: O-Lee, T.J., & Messner, A.H. (2008). Subglottic hemangioma. Otolaryngologic clinics of North America, 41 5, 903-11, viii-ix. https://www.semanticscholar.org/paper/Subglottic-hemangioma.-O-Lee-Messner/13e25e7eb826f491d04fb667d22a2e193421ab26
Histopathologisch onderzoek
Aanvullende diagnostiek middels een biopsie is maar zelden noodzakelijk als diagnosticum bij IH. In sommige gevallen kan, pas na een MRI, een biopsie worden verricht om onderscheid te maken tussen atypische IH en andere (maligne) tumoren zoals genoemd in de differentiële diagnose; het heeft de voorkeur dit in een expertisecentrum te doen. Glut-1 immunohistochemische kleuring kan helpen bij het aantonen dan wel uitsluiten van IH; dit is een marker die altijd positief is bij IH en niet bij vasculaire malformaties. [Consensusdocument 2017]. Sommige andere vasculaire (maligne) tumoren kunnen overigens wel glut-1 positief zijn, maar kunnen met andere markers gedifferentieerd worden van een IH[van Vugt 2017]
Proefbehandeling
Indien er niet gewacht kan worden op bovenstaand aanvullend onderzoek kan in het geval van levens- of functiebedreigende IH een proefbehandeling met systemische bètablokkers gestart worden. Dit is bijvoorbeeld aan te raden bij twijfel over een subglottisch IH bij een stridoreus kind.
Aanvullend onderzoek bij een (vastgesteld) IH:
Bloedonderzoek
Stollingsonderzoek
Bij IH zijn géén stollingsproblemen beschreven en is er dus geen indicatie voor stollingsonderzoek.[Consensusdocument 2017][ISSVA-classificatie]
Aanvullend onderzoek bij verschillende lokalisaties, types of patronen van IH
Grote, volumineuze IH
Echocardiografie kan worden gebruikt om cardiale insufficiëntie, cardiale afwijkingen of afwijkingen van de aorta op te sporen. Het wordt aanbevolen om een consult bij een kindercardioloog met echocardiografie te overwegen bij kinderen met volumineuze IH vanwege het verhoogde risico op high output hartfalen. [Consensusdocument 2017, Garzon 2016] Ook dient er te worden overwogen om zo vroeg mogelijk een TSH screening te verrichten vanwege het risico op consumptieve hypothyreoïdie.(zie tevens ook hieronder bij ‘Hepatische IH/multifocale IH)[Consensusdocument 2017]
Hepatische IH/ multifocale IH
Meerdere studies hebben de associatie tussen multipele cutane IH met hepatische (en/of viscerale) IH aangetoond. Het screenen van deze groep op hepatische IH middels een abdominale echo verkleint de kans op potentieel ernstige gevolgen die met hepatische IH gepaard kunnen gaan, zoals (consumptieve) hypothyreoïdie en toegenomen cardiale belasting, door tijdige inzet van behandeling en een nauwlettende follow-up. Echografie door een ervaren kinderradioloog met kennis van vaatmalformaties heeft een gevoeligheid van 95% voor het detecteren van hepatische IH.[Krowchuk 2019, Horii 2011] Echografie van de lever (en gehele abdomen) dient te worden verricht in geval van 10 of meer cutane IH bij kinderen jonger dan 6 maanden om viscerale IH (diffuse neonatale hemangiomatosis versus benigne cutane hemangiomatosis) uit te sluiten. [Consensusdocument 2017, Vredenborg 2013]
Consumptieve hypothyreoïdie is een complicatie die bij ongeveer 5% van de hepatische IH voorkomt. Wanneer bij kinderen grote of multifocale (intra-hepatische) IH worden gediagnosticeerd is het vanwege het risico op hypothyreoïdie aan te bevelen om zo vroeg mogelijk een TSH screening te verrichten.[Consensusdocument 2017]
Cerebrale IH
Multifocale cutane IH zijn in zeer zeldzame gevallen beschreven met asymptomatische cerebrale IH. De lage prevalentie van intracraniële IH en het asymptomatische beloop maken dat routinematige screening met echografie van de hersenen bij kinderen met multifocale IH zonder neurologische symptomen niet geïndiceerd is.
Perioculaire en Intraorbitale IH
Perioculaire en intraorbitale IH kunnen de visus bedreigen en amblyopie, astigmatisme of strabisme veroorzaken. Kinderen met perioculaire IH, intraorbitale IH of risico op PHACES syndroom moeten verwezen worden naar de oogarts/ orthoptist om amblyopie, astigmatisme, anisometropie of geassocieerde anomalieën uit te sluiten. Een pupil bedekkende ptosis als gevolg van een perioculair IH is reden tot verwijzing op korte termijn.[Dubois 2006]
PHACES/ LUMBAR/ Dysraphisme
Beeldvorming is ook geïndiceerd bij verdenking op geassocieerde structurele afwijkingen, zoals bij kinderen die risico lopen op het PHACES- of LUMBAR-syndroom. Deze kinderen hebben in geval van PHACES doorgaans grote (>5 cm diameter of > 22 cm2 oppervlakte) segmentale IH van het gelaat / de hoofdhuid en in geval van LUMBAR segmentale IH van het perineum, bilspleet of lumbosacrale midline (> 2,5 cm); dit kan voorkomen met of zonder IH op de onderste extremiteiten.
Bij verdenking PHACES is een consult bij een kindercardioloog met echocardiografie geïndiceerd, vanwege mogelijke cardiale afwijkingen, idealiter vóór aanvang van (bètablokker) behandeling. [Consensusdocument 2017, Garzon 2016] Bij deze kinderen is een MRI/MRA geïndiceerd voor verdere evaluatie van het hoofd/halsgebied (inclusief de aortaboog en brachiocephale takken). MRI/MRA kunnen ook worden gebruikt om intracraniële, cerebrovasculaire of spinale afwijkingen uit te sluiten en zijn dus geschikt om, met en zonder contrast, het PHACES syndroom te detecteren. [Krowchuk 2019, Bracken 2011, Garzon 2016]
Bij een segmentaal, sacraal IH in de midline kan echografie voldoende zijn om spinaal dysraphisme (SD) uit te sluiten. Vóór de leeftijd van 2-3 maanden is echografie een nog betrouwbaar uit te voeren onderzoek, daarna is vaak een MRI geïndiceerd [Consensusdocument 2017].
Ook bij patiënten met een risico op LUMBAR-syndroom kan spinale echografie (voor een gecorrigeerde leeftijd < 3 maanden) en Doppler echografie van de buik en het bekken worden gebruikt voor een eerste screening op afwijkingen. Uiteindelijk zal MRI hiervoor echter een beter inzicht in de afwijkingen geven. Als er bijvoorbeeld ondanks een niet-afwijkende echo nog steeds een hoog vermoeden blijft voor spinale afwijkingen (bijvoorbeeld door bijbehorende kenmerken van SD), is MRI een gevoeliger diagnostische techniek (zie ook paragraaf MRI/MRA). [Krowchuk 2019]
Samenvatting
De diagnose IH kan over het algemeen op basis van het klinisch beeld en typische beloop worden gesteld zonder aanvullend onderzoek. Bij subcutane IH kan een Doppler of echo-Doppler (duplex) onderzoek het onderscheid maken tussen IH en vaatmalformaties of andere ruimte innemende processen. Om onnodige belasting te voorkomen wordt geadviseerd om verder aanvullend onderzoek (MRI onder narcose of histopathologisch onderzoek) alleen op indicatie te laten verrichten en bij voorkeur in (of na overleg met) een expertisecentrum.
Zoeken en selecteren
Voor deze uitgangsvraag werd gebruik gemaakt van het ‘Consensusdocument voor de behandeling van infantiele hemangiomen’ hetgeen in 2017 werd vastgesteld door 4 samenwerkende (door de minister van VWS erkende) expertisecentra op het gebied van aangeboren vaatafwijkingen samen met patiëntenvereniging Hevas. De tekst uit het consensusdocument werd aangevuld met informatie uit het overzichtsartikel van Leaute-Labreze et al. uit de Lancet 2017 en de ‘Clinical Practice Guideline for the Management of Infantile Hemangiomas’ van de American Academy of Pediatrics van Krowchuk et al. uit 2019. Voor de volledigheid werd er op 6 februari 2019 aanvullend voor uitgangsvraag 2 een systematische zoekstrategie uitgevoerd in de elektronische databases Embase en Medline. De zoekstrategie is toegevoegd als de zoekverantwoording.
De resultaten van de search werden door twee auteurs (DH en PdL) onafhankelijk beoordeeld. In 1e instantie werd voor de beantwoording van uitgangsvraag 1 geselecteerd op vooraf opgestelde selectiecriteria; prospectieve studies, RCTs, systematische reviews en relevante observationele studies, niet gerandomiseerde studies en retrospectieve studies, N ≥10 patiënten, publicatiedatum van maximaal 20 jaar oud, humane studies, Nederlands- en Engelstalige studies, infantiele hemangiomen incl. PHACES, LUMBAR, Spinal dysraphysm.
Als exclusie criteria werden aangehouden: case reports, case series, studies over NICH/RICH/PICH, dubbele publicaties.
Er werden in totaal 498 studies gevonden op basis van de algemene zoekstrategie.
Voor uitgangsvraag 2 werden vervolgens op basis van bovenstaande screening op titel en abstract 70 studies geïncludeerd. Uit de selectie van andere uitgangsvragen en na het nalopen van referenties uit de literatuur werden nog 18 studies geïncludeerd op titel en abstract. Na full tekst screening werden er voor uitgangsvraag 2 in totaal 32 studies meegenomen. In de literatuurlijst onderaan deze module worden de gebruikte studies vermeld.
Referenties
- American Society of Anesthesiologists. ASA response to the FDA med watch warning - December 16, 2016. 2016. Available at: https:// www.asahq.org/ advocacy- and- asapac/ fda- andwashington-alerts/ washington- alerts/2016/ 12/ as- a- response- to- the- fda- medwatch. Accessed September 10, 2018
- Bauland CG, Smit JM, Ketelaars K et al. Management of haemangiomas of infancy: A retrospective analysis and a treatment protocol. Scandinavian Journal of Plastic and Reconstructive Surgery and Hand Surgery. 2009 42:2, 86-91
- Boulouis G, Gangouloff-Ros V, Boccara O et al. Aterial Spin-Labeling to Discriminate Pediatric Cervicofacial Soft-Tissue Vascular Anomalies. AJNR Am J Neuroradiol 38:633-38 Mar 2017
- Bracken J, Robinson I, Snow A et al. PHACE syndrome: MRI of intracerebral vascular anomalies and clinical findings in a series of 12 patients. Pediatr Radiol (2011) 41:1129-1138
- Chern JJ, Kirkman JL, Shannon CN, Tubbs RS, Stone JD, Royal SA, et al. Use of lumbar ultrasonography to detect occult spinal dysraphism: Clinical article. Journal of Neurosurgery: Pediatrics. 2012;9(3):274-9.
- de Graaf M, Pasmans SG, van Drooge AM, et al. Associated anomalies and diagnostic approach in lumbosacral and perineal haemangiomas: case report and review of the literature. Journal of plastic, reconstructive & aesthetic surgery: JPRAS. 2013;66(1):e26-28.
- Drolet BA, Chamlin SL, Garzon MC, et al. Prospective study of spinal anomalies in children with infantile hemangiomas of the lumbosacral skin. The Journal of pediatrics. 2010;157(5):789-794.
- Dubois J, Milot J, Jaeger BI, et al. Orbit and eyelid hemangiomas: is there a relationship between location and ocular problems? Journal of the American Academy of Dermatology. 2006;55(4):614-619.
- Friedland R, Ben Amitai D, Zvulunov A. Screening for Brain Involvement in Infants with Multifocal Cutaneous Infantile Hemangiomas. Dermatology. 2018;233(6):435-40.
- Garzon MC, Epstein LG, Heyer GL, et al. PHACE Syndrome: Consensus-Derived Diagnosis and Care Recommendations. The Journal of pediatrics. 2016;178:24-33 e22.
- Glick ZR, Frieden IJ, Garzon MC, Mully TW, Drolet BA. Diffuse neonatal hemangiomatosis: an evidence-based review of case reports in the literature. Journal of the American Academy of Dermatology. 2012;67(5):898-903.
- Guggisberg D, Hadj-Rabia S, Viney C, Bodemer C, Brunelle F, Zerah M, et al. Skin markers of occult spinal dysraphism in children: a review of 54 cases. Archives of Dermatology. 2004;140(9):1109-15.
- Haggstrom AN, Skillman S, Garzon MC, et al. Clinical spectrum and risk of PHACE syndrome in cutaneous and airway hemangiomas. Archives of otolaryngology--head & neck surgery. 2011;137(7):680-687.
- Hevas. Consensusdocument voor de behandeling van infantiele hemangiomen. 5 juli 2017
- Horii KA, Drolet BA, Frieden IJ, et al. Prospective study of the frequency of hepatic hemangiomas in infants with multiple cutaneous infantile hemangiomas. Pediatric dermatology. 2011;28(3):245-253.
- Iacobas I, Burrows PE, Frieden IJ, et al. LUMBAR: association between cutaneous infantile hemangiomas of the lower body and regional congenital anomalies. J Pediatr. 2010;157(5):795–801.e1–e7
- Ke Y, Hao R, He Y. The value of color Doppler imaging and intralesional steroid injection in pediatric orbital capillary hemangioma Journal of the Chinese Medical Association 77(2014)258e264
- Kern S, Niemeyer C, Darge K, Merz C, Laubenberger J, Uhl M. Differentiation of vascular birthmarks by MR imaging. An investigation of hemangiomas, venous and lymphatic malformations. Acta Radiologica. 2000;41(5):453-7.
- Krowchuk DP, Frieden IJ, Mancini AJ, et al. Clinical Practice Guideline for the Management of Infantile Hemangiomas. Pediatrics. 2019;143(1):e20183475
- Leaute-Labreze C, Harper JI, Hoeger PH. Infantile haemangioma. Lancet. 2017.
- Mamlouk MD, Hess CP. Arterial spin-labeled perfusion for vascular anomalies in the pediatric head and neck. Clinical Imaging 40 (2016) 1040-1046
- Neudorfer M, Leibovitch I, Stolovitch C, Kessler A, Dray JP, Hermush V, et al. Intraorbital and periorbital tumors in childrendvalue of ultrasound and color Doppler imaging in the differential diagnosis. Am J Ophthalmol 2004;137:1065e72.
- O TM, Alexander RE, Lando T, et al. Segmental hemangiomas of the upper airway. The Laryngoscope. 2009;119(11):2242-2247.
- Orlow SJ, Isakoff MS, Blei F. Increased risk of symptomatic hemangiomas of the airway in association with cutaneous hemangiomas in a “beard” distribution. The Journal of pediatrics. 1997;131(4):643-646.
- Parhizkar N, Manning SC, Inglis Jr AF, Finn LS, Chen EY, Perkins JA. How airway venous malformations differ from airway infantile hemangiomas. Archives of Otolaryngology - Head and Neck Surgery. 2011;137(4):352-7.
- Rialon KL, Murillo R, Fevurly RD, et al: Impact of screening for hepatic hemangiomas in patients with multiple cutaneous infantile hemangiomas. Pediatr Dermatol 2015; 32:808–812.
- Schumacher WE, Drolet BA, Maheshwari M, Horii KA, Nopper AJ, Newell BD, et al. Spinal dysraphism associated with the cutaneous lumbosacral infantile hemangioma: UA neuroradiological review. Pediatric Radiology. 2012;42(3):315-20.
- Spierer O, Neudorfer M, Leibovitch I, Stolovitch C, Kessler A. Colour Doppler ultrasound imaging findings in paediatric periocular and orbital hemangiomas. Acta Ophthalmol 2012;90:727e32.
- Teo EL, Strouse PJ, Hernandez RJ. MR imaging differentiation of soft-tissue hemangiomas from malignant soft-tissue masses. AJR American Journal of Roentgenology. 2000;174(6):1623-8.
- US Food and Drug Administration. FDA drug safety communications: FDA review results in new warnings about using general anesthetics and sedation drugs in young children and pregnant women. 2016. Available at: www.fda.gov/downloads/Drugs/DrugSafety/UCM 533197.pdf. Accessed September 10, 2018
- Vergine G, Marsciani A, Pedini A, et al. Efficacy of propranolol treatment in thyroid dysfunction associated with severe infantile hepatic hemangioma. Horm Res Paediatr. 2012;78(4):256-260.
- Vredenborg AD, Janmohamed SR, de Laat PC, et al. Multiple cutaneous infantile haemangiomas and the risk of internal haemangioma. The British journal of dermatology. 2013;169(1):188-191.
- Van Vugt L, Van der Vleuten C, Flucke U, et al. The utility of GLUT1 as a diagnostic marker in cutaneous vascular anomalies: a review of literature and recommendations for daily practice. Pathology in Research and Practice. 2017;
- Weber FC, Greene AK, Adams DM, Liang MG, Alomari MH, Voss SD, et al. Role of imaging in the diagnosis of parotid infantile hemangiomas. International Journal of Pediatric Otorhinolaryngology. 2017;102:61-6.
Evidence tabellen
Exclusietabel
|
Titel (jaar) |
Exclusie reden |
|
Wright and Wycoco (2017) |
potential marker of PHACES |
|
Albanese, Mohandas et al. (2018) |
N<10 |
|
Allen, Sandquist et al. (2003) |
geen full tekst |
|
Bayer, Frommelt et al. (2013) |
PHACE syndroom beschrijving --> UV 1 of 3? |
|
Bittles, Sidhu et al. (2005) |
NICH (n=2) |
|
Canty, Horii et al. (2014) |
kans/epidemiologie hepatische hemangiomen bij cutane hemangiomen |
|
Coats, Paysse et al. (1999) |
N<10, case report |
|
De Graaf, Knol et al. (2014) |
geen primaire diagnostiek, signalering complicaties |
|
Dêbska-Rutkowska, Kwast et al. (2017) |
slechts 3 hemangiomen |
|
Eivazi, Wiegand et al. (2010) |
geen diagnostische gegevens |
|
Furuta, Shimose et al. (2017) |
geen full tekst |
|
Garcia-Romero, Chakkittakandiyil et al. (2014) |
follow-up propranolol, beloop |
|
Gorincour, Kokta et al. (2005) |
NICH/RICH |
|
Grantzow, Schmittenbecher et al. (2008) |
guideline management, geen diagnostiek |
|
He and Huang (2017) |
follow-up lokaal timolol |
|
Horii, Drolet et al. (2010) |
risico van grote hemangiomen op hepatische hemangiomen |
|
Hughes, Hill et al. (2004) |
prevalentie hepatische hemangiomen --> UV 1 of 3? |
|
Judd, Chapman et al. (2007) |
N<10 |
|
Kutz, Aranibar et al. (2015) |
follow-up propranolol |
|
Leng, Wang et al. (2008) |
slechts 5 hemangiomen |
|
Lope, Hutcheson et al. (2010) |
slechts 4 hemangiomen |
|
Lotfinia, Sayahmeli et al. (2014) |
slecht enkele hemangiomen, dysraphina |
|
Miller and Frieden (2005) |
geen full tekst |
|
North, Waner et al. (2000) |
reeds in review van Vught |
|
O'Neill, Gallegos et al. (2017) |
MRI voor diagnostiek occult spinal dysraphisme |
|
Prada, Mortera et al. (2010) |
N<10 |
|
Robertson, Kimble et al. (2016) |
follow-up propranolol |
|
Rossler, Rothoeft et al. (2011) |
N<10 |
|
Rozylo-Kalinowska, Brodzisz et al. (2002) |
slechts 7 hemangiomen, doppler ultrasonography |
|
Sardana, Gupta et al. (2009) |
slechts 5 hemangiomen, dysraphisme |
|
Schicchi, Tagliati et al. (2018) |
slechts 5 hemangiomen, MRI |
|
Shi, Song et al. (2014) |
follow-up propranolol |
|
Siegel, Tefft et al. (2012) |
risico op stroke bij PHACES --> UV 1 of 3? |
|
Sleep, Fairhurst et al. (2002) |
N<10 |
|
Sodhi, Bartlett et al. (2011) |
beschrijvende studie |
|
Steiner, McCoy et al. (2018) |
beschrijvende studie, PHACES spectrum evt. uv 1 of 3? |
|
Stockman, Boralevi et al. (2007) |
complicaties bij lumbosacrale hemangiomen (ulceratie) --> UV 1 of 3? |
|
Talaat, Elbasiouny et al. (2012) |
follow-up propranolol |
|
Tobouti, Olegário et al. (2017) |
niet alleen hemangiomen |
|
Tortora, Severino et al. (2017) |
N<10 |
|
Tubbs, Wellons et al. (2004) |
geen diagnostische interventie onderzocht |
|
Verity, Restori et al. (2006) |
klinisch beloop --> UV 1 of 3 |
|
Vilanova, Barceló et al. (2004) |
beschrijvende studie |
|
Visscher, Burkes et al. (2016) |
beloop en behandelrespons metingen |
|
Waelti, Rypens et al. (2018) |
RICH |
|
Wu, Liu et al. (2012) |
niet alleen hemangiomen |
|
Yang, Jiang et al. (2011) |
geen full tekst |
|
Yilmaz, Kozakewich et al. (2014) |
Geen infantiele hemangiomen |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 19-04-2021
Beoordeeld op geldigheid : 11-01-2021
Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update).
De Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) is regiehouder van deze richtlijnen eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn(modules). De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door arts-onderzoekers van de NVDV en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Deze richtlijn over infantiele hemangiomen is een document met aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het vaststellen van goed medisch handelen. De richtlijn geeft aanbevelingen voor de diagnostiek, behandeling en follow-up van patiënten met een infantiel hemangioom.
Doelgroep
De richtlijn is bestemd voor alle zorgverleners die betrokken zijn bij de zorg voor patiënten met infantiele hemangiomen zoals dermatologen, kinderartsen, plastisch chirurgen, kinderchirurgen, KNO-artsen, radiologen, oogartsen, pathologen, huisartsen en jeugdartsen. Voor (de ouders van) patiënten zal aparte informatie worden opgesteld, beschikbaar via de website van de NVDV (www.nvdv.nl) en www.thuisarts.nl.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met infantiele hemangiomen en patiëntenvertegenwoordiger(s) vanuit Hevas (zie hiervoor het overzicht van de werkgroepleden de tabel hieronder). Wetenschappelijke verenigingen zoals NVK, NVPC, NVVH, NVKNO, NOG, NVvR, NVVP, NHG, NVZA en de AJN en stakeholders zoals VIG, NVZ, V&VN, NFU, ZN, ZiNL en de patiëntenfederatie werden voor de knelpunten analyse en commentaarronde uitgenodigd.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroepleden – versie 2020
|
Werkgroeplid |
Affiliatie en vereniging |
|
Mw. Dr. C.J.M. van der Vleuten, dermatoloog, (voorzitter) |
Radboudumc, Nijmegen, NVDV |
|
Dhr. Z. Çiftçi, arts-onderzoeker (secretaris) (vanaf februari 2020) |
Bureau NVDV, Utrecht, NVDV |
|
Mw. C.T. van den Bosch, patientvertegenwoordiger |
Bestuur HEVAS |
|
Dhr. Dr. C.C. Breugem, plastisch chirurg |
Amsterdam UMC, NVPC |
|
Dhr. L.M.A. Favié, ziekenhuisapotheker |
UMC Utrecht, NVZA |
|
Dhr. S.W. Genders, oogarts (vanaf september 2019) |
LUMC, Amsterdam UMC, NOG |
|
Mw. Dr. M. de Graaf, dermatoloog |
UMC Utrecht, NVDV |
|
Dr. J.J.E. van Everdingen, dermatoloog n.p. |
Directeur NVDV |
|
Mw. Dr. D.J.J. Hermans, dermatoloog |
Jeroen Bosch ziekenhuis, NVDV |
|
Mw. M.F. Hofhuis, arts-onderzoeker (secretaris) (tot november 2019) |
Bureau NVDV, Utrecht, NVDV |
|
Dhr. T. Boere, arts-onderzoeker (secretaris) (tot februari 2020) |
Bureau NVDV, Utrecht, NVDV |
|
Dhr. Dr. J. Honings, KNO-arts / Hoofd-hals chirurg |
Radboudumc, NVKNO |
|
Mw. Prof. Dr. C.M.A.M. van der Horst, plastisch chirurg |
Amsterdam UMC, NVPC |
|
Mw. M.P. Jongma, patientvertegenwoordiger |
Bestuur HEVAS |
|
Mw. K. Kamphuis – van Ulzen, radioloog |
Radboudumc, NVvR |
|
Dhr. Dr. P.C.J. de Laat, kinderarts |
Erasmus MC, NVK |
|
Mw. M. Marinkovic, oogarts (tot september 2019) |
LUMC, NOG |
|
Mw. Dr. E. Mendels, dermatoloog |
Erasmus MC, NVDV |
|
Mw. M. Mul, huisarts n.p. |
NHG |
|
Mw. Dr. M.F. Raphael, kinderarts-oncoloog |
Amsterdam UMC, NVK |
|
Dhr. Dr. B.H. Verhoeven, kinderchirurg |
Radboudumc, NVVH |
|
Dhr. A.C. van der Wal, patholoog |
Amsterdam UMC, NVVP |
|
Ondersteuning werkgroep |
Affiliatie en vereniging |
|
Mw. I. Tissen, jeugdarts |
AJN |
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben bij aanvang van en na het afronden van de richtlijn schriftelijk verklaard of zij in de laatste 3 jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen is hieronder opgenomen. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van de NVDV.
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van de Nederlandse Vereniging voor Dermatologie en Venereologie.
|
Werkgroeplid |
Nevenfunctie |
Gemelde belangen (firma en activiteit) |
Ondernomen actie (indien van toepassing) |
|
Dr. C.J.M. van der Vleuten, dermatoloog, (voorzitter) |
Geen |
Consultatie/advisering Pierre Fabre |
Treedt terug in de rol van voorzitter, indien er in de werkgroep discussie is over onderwerpen die gerelateerd zijn aan het advies wat gegeven wordt aan Pierre Fabre. |
|
Dhr. Z. Çiftçi, arts-onderzoeker (secretaris) |
Geen |
Geen |
Geen |
|
Dhr. T. Boere, arts-onderzoeker (secretaris) |
Geen |
Geen |
Geen |
|
Mw. C.T. van den Bosch, patientvertegenwoordiger |
Geen |
Geen |
Geen |
|
Dhr. Dr. C.C. Breugem, plastisch chirurg |
Geen |
Geen |
Geen |
|
Dhr. L.M.A. Favié, ziekenhuisapotheker |
Geen |
Geen |
Geen |
|
Dhr. S.W. Genders, oogarts |
Geen |
Geen |
Geen |
|
Mw. Dr. M. de Graaf, dermatoloog |
Geen |
Geen |
Geen |
|
Dr. J.J.E. van Everdingen, directeur NVDV, dermatoloog n.p. |
Geen |
Geen |
Geen |
|
Mw. Dr. D.J.J. Hermans, dermatoloog |
Geen |
Geen |
Geen |
|
Mw. M.F. Hofhuis, arts-onderzoeker (secretaris) |
Geen |
Geen |
Geen |
|
Dhr. Dr. J. Honings, KNO-arts |
Geen |
Geen |
Geen |
|
Mw. Prof. Dr. C.M.A.M. van der Horst, plastisch chirurg |
Geen |
Geen |
Geen |
|
Mw. M.P. Jongma, patientvertegenwoordiger |
Geen |
Geen |
Geen |
|
Mw. K. Kamphuis – van Ulzen, radioloog |
Geen |
Geen |
Geen |
|
Dhr. Dr. P.C.J. de Laat, kinderarts |
Geen |
|
|
|
Mw. M. Marinkovic, oogarts |
Geen |
Geen |
Geen |
|
Mw. Dr. E. Mendels, dermatoloog |
Geen |
Geen |
Geen |
|
Mw. M. Mul, huisarts |
Geen |
Geen |
Geen |
|
Mw. Dr. M.F. Raphael, kinderarts |
Geen |
Geen |
Geen |
|
Dhr. Dr. B.H. Verhoeven, kinderchirurg |
Geen |
Geen |
Geen |
|
Dhr. A.C. van der Wal, patholoog |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er is aandacht besteed aan het patiëntenperspectief door deelname van de patiëntenvereniging Hevas (Nederlandse ouder- en patiëntenvereniging voor hemangiomen en vasculaire malformaties) in de richtlijnwerkgroep. Zij zijn inhoudelijk betrokken geweest bij het opstellen van de projectaanvraag en in de richtlijnwerkgroep. De conceptrichtlijn is tevens voor commentaar en autorisatie voorgelegd aan patiëntenvereniging Hevas.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn(module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren, zoals de invoering van nieuwe systemische middelen. Omdat er mogelijk een grote maatschappelijke impact te verwachten zou zijn bij een grote toename in het gebruik van propranolol (Hemangiol) werd er in 2020 een doorrekening van de gewijzigde kosten bij integrale implementatie van de richtlijn gerealiseerd in een zogenaamde Budget Impact Analyse (BIA). De volledige rapportage is opgenomen in de separate bijlage ‘Budget impact analyse’.
Werkwijze
De werkgroep Infantiele Hemangiomen heeft in 2018-2021 de vraag- en doelstellingen van deze richtlijn met elkaar afgestemd en uitgewerkt. De ontwikkeling van deze richtlijn is gebaseerd op het ‘consensusdocument voor de behandeling van infantiele hemangiomen’ welke in 2017 werd vastgesteld door 4 samenwerkende (door de minister van VWS erkende) expertisecentra[1] op het gebied van aangeboren vaatafwijkingen samen met patiëntenvereniging Hevas. [Consensusdocument 2017] Naast de 4 expertisecentra zijn er nog enkele andere ziekenhuizen in Nederland waar multidisciplinaire teams (met onder andere dermatologen, (plastisch) chirurgen, kinderartsen en radiologen) zorg leveren aan kinderen met infantiele hemangiomen.
Hieronder wordt de werkwijze van de richtlijn 2021 verder toegelicht.
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. [Medisch Specialistische Richtlijnen] Dit rapport is gebaseerd op het AGREE II-instrument (Appraisal of Guidelines for Research & Evaluation II), dat een internationaal breed geaccepteerd instrument is. [Brouwers 2010] Voor een stap-voor-stapbeschrijving hoe een evidence-based richtlijn tot stand komt, wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften maar wetenschappelijk onderbouwde en breed gedragen inzichten en aanbevelingen waaraan zorgverleners zouden moeten voldoen om kwalitatief goede zorg te verlenen. Aangezien richtlijnen uitgaan van ‘gemiddelde patiënten’, kunnen zorgverleners in individuele gevallen zo nodig afwijken van de aanbevelingen in de richtlijn. Afwijken van richtlijnen is, als de situatie van de patiënt dat vereist, soms zelfs noodzakelijk. Een richtlijn beschrijft wat goede zorg is, ongeacht de financieringsbron (Zorgverzekeringswet (Zvw), Wet langdurige zorg (Wlz), Wet maatschappelijke ondersteuning (Wmo), aanvullende verzekering of eigen betaling door de cliënt/patiënt). Opname van een richtlijn in een register betekent dus niet noodzakelijkerwijs dat de in de richtlijn beschreven zorg verzekerde zorg is. Informatie over kosten zoals beschreven in de richtlijn is gebaseerd op beschikbare gegevens ten tijde van schrijven.
Knelpuntenanalyse
In de eerste vergadering zijn knelpunten en wensen ten aanzien van de richtlijn geïnventariseerd door de werkgroepleden.Tevens zijn er knelpunten aangedragen door de betrokken verenigingen NVK, NOG, NVvH, NVKNO, NVvP, NVPC, NVvR, patiëntenvereniging Hevas, NVZA, VIG en ZN in een knelpuntenanalyse.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep uitgangsvragen opgesteld. Per uitgangsvraag zijn klinisch relevante uitkomstmaten opgesteld, waarbij zowel naar gewenste als ongewenste effecten is gekeken (op bladzijde 18 staat een overzicht van de uitgangsvragen en uitkomstmaten). De werkgroep heeft deze uitkomstmaten gewaardeerd volgens hun relatieve klinisch belang bij de besluitvorming rondom aanbevelingen.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen is aan de hand van specifieke zoektermen een systematische zoekstrategie uitgevoerd in (verschillende) elektronische databases Embase en MEDLINE. In eerste instantie is gezocht naar studies met de hoogste mate van bewijs. De aldus gevonden studies zijn per uitgangsvraag door twee tot drie werkgroepleden/auteurs van de modules (CvdV, EM, PdL, DH, MdG, MR en CvdH) onafhankelijk van elkaar geselecteerd op basis van titel en abstract en vooraf opgestelde selectiecriteria. Bij discrepantie is een derde persoon gevraagd (MH). De beoordeling en uiteindelijke selectie op basis van volledige tekst is gedaan door arts-onderzoeker(s) van de NVDV. De geselecteerde studies zijn gebruikt om de uitgangsvraag te beantwoorden. De zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de zoekverantwoording.
Kwaliteits beoordeling individuele studies
De beoordeling van de kwaliteit van het wetenschappelijk bewijs/onderzoeksgegevens is in de richtlijn tot stand gekomen met de GRADE-methode.
Bij de GRADE-methode (Grading Recommendations Assessment, Development and Evaluation) worden individuele studies systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB)-tabellen, deze zijn op te vragen via de NVDV. Hiervoor is gebruikgemaakt van de Cochrane risk of bias tool. [Higgins 2011]
Tabel 1 geeft een kort overzicht van de indeling van methodologische kwaliteit van individuele studies volgens GRADE. Een volledige uitleg over de GRADE-methode valt buiten het bestek van deze richtlijn, zie hiervoor het ‘GRADE handbook’. [Schünemann 2013, https://www.gradeworkinggroup.org/]
Tabel 1. Indeling van kwaliteit van wetenschappelijk bewijs volgens GRADE
|
GRADE-systeem |
||
|
Kwaliteitsindeling bewijs |
|
|
|
|
|
|
|
|
|
|
|
|
Startkwalificatie |
- Gerandomiseerd onderzoek = hoog - Observationele studie = laag |
|
|
Factoren die de kwaliteit van bewijs kunnen verlagen* |
- Ernstige of zeer ernstige beperkingen in de kwaliteit van de studie - Indirectheid van het bewijs - Belangrijke inconsistentie tussen studies - Imprecisie - Grote kans op ‘publicatiebias’ |
|
|
Factoren die de kwaltiteit van bewijs kunnen verhogen** |
- Sterk bewijs voor een associatie – significant relatief risico van > 2 (< 0,5) gebaseerd op consistent bewijs uit twee of meer observationele studies, zonder plausibele ‘confounders’ (+1) - Zeer sterk bewijs voor een associatie – significant relatief risico van > 5 (< 0,2) gebaseerd op direct bewijs zonder belangrijke bedreigingen voor de validiteit (+2) - Bewijs voor een dosis respons gradiënt (+1) - Alle plausibele ‘confounders’ zonder het effect te hebben verminderd (+1) |
|
* Elk criterium kan de kwaliteit verminderen met 1 stap of bij zeer ernstige beperkingen met 2 stappen.
** Verhogen kan alleen indien er geen beperkingen zijn t.a.v. de studiekwaliteit, imprecisie, inconsistentie, indirectheid en publicatiebias
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde studies zijn overzichtelijk weergegeven als ‘karakteristieken en resultaten van geïncludeerde studies’ in de evidence tabellen. De belangrijkste bevindingen uit de literatuur met betrekking op de vooraf opgestelde uitkomstmaten zijn beschreven in de samenvatting van de literatuur.
Formuleren van conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methode. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten werden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overige overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn met behulp van de GRADE-methodiek gebaseerd op het beschikbare wetenschappelijke bewijs, de belangrijkste overige overwegingen en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht of het niveau van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling.
Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling beschreven (zie de bijlage ‘Kennislacunes’).
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren zijn verzameld in een commentaarformulier/tabel en besproken met de werkgroep. Naar aanleiding van de commentaren is de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn is aan de betrokken (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd ter autorisatie en door hen geautoriseerd dan wel geaccordeerd. Zie daarvoor paragraaf ‘Autorisatie’.
Literatuur
- Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
- Consensusdocument voor de behandeling van infantiele hemangiomen, HEVAS. 5 juli 2017
- Higgins JPT, Green S (editors). Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [updated March 2011]. The Cochrane Collaboration, 2011. Available from http://www.handbook.cochrane.org.
- Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit.. Online beschikbaar op http://richtlijnendatabase.nl/ Laatst geraadpleegd op [DATUM geraadpleegd voor concepttekst]
- Van Everdingen JJE, Burgers JS, Assendelft WJJ, et al. Evidence-based richtlijnontwikkeling. Bohn Stafleu Van Loghum 2004.
- Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from.
[1] Het Radboudumc te Nijmegen, het Amsterdam UMC/Emmakinderziekenhuis te Amsterdam, het ErasmusMC/Sophia Kinderziekenhuis te Rotterdam en het UMCU/Wilhelmina Kinderziekenuis te Utrecht.
Zoekverantwoording
Voor uitgangsvraag 1,2 en 3 werd gebruik gemaakt van het ‘Consensusdocument voor de behandeling van infantiele hemangiomen’ hetgeen in 2017 werd vastgesteld door 4 samenwerkende (door de minister van VWS erkende) expertisecentra op het gebied van aangeboren vaatafwijkingen samen met patiëntenvereniging Hevas. De tekst uit het consensusdocument werd aangevuld met informatie uit het overzichtsartikel van Leaute-Labreze et al. uit de Lancet 2017 en de ‘Clinical Practice Guideline for the Management of Infantile Hemangiomas’ van de Amercian Academy of Pediatrics van Krowchuk et al. uit 2019. Voor uitgangsvraag 4 en 5 werd op 7 janurai een systematische zoekstrategie uitgevoerd in de elektronische databases Embase en Medline. Voor de volledigheid werd er op 4 en 6 februari 2019 aanvullend voor uitgangsvraag 1, 2 en 3 ook een systematische zoekstrategie uitgevoerd in dezelfde elektronische databases, Embase en Medline. De zoekstrategie is toegevoegd als bijlage. De zoekactie voor uitgangsvraag 4 en 5 is met behulp van de PICO-systematiek opgebouwd. De onderdelen van de PICO werden geformuleerd op basis van de uitgangsvraag.
|
Database(s): Medline, Embase |
Datum: 06-02-2019 |
|
Periode: > 1982 |
Talen: Engels |
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
1982 – februari 2019
|
1 exp Hemangioma/ or (hemangiom* or haemangiom*).ti,ab,kw. (39731) 2 (infancy or infantile or juvenile).ti,ab,kw. (143226) 3 exp Infant/ or "Infant, Newborn"/ (1086097) 4 2 or 3 (1182322) 5 1 and 4 (8002) 6 exp *diagnostic imaging/ or exp Diagnosis, Differential/ or exp tomography, emission-computed/ or diagnos*.ti. or tomograph*.ti,ab,kw. or mri.ti,ab,kw. or mra.ti,ab,kw. or 'echograph*'.ti,ab,kw. or echo.ti,ab,kw. or imaging.ti,ab,kw. or doppler.ti,ab,kw. or flowmet*.ti,ab,kw. or sonograph*.ti,ab,kw. or ultrasonograph*.ti,ab,kw. or angiograph*.ti,ab,kw. (2445222) 7 5 and 6 (2132) 8 limit 7 to (english language and yr="1982 -Current") (1555) 9 exp *Propranolol/ or propranolol.ti,ab,kw. or exp ATENOLOL/ or atenolol.ti,ab,kw. (40710) 10 8 not 9 (1459) 11 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (384137) 12 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1827927) 13 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (3121146) 14 10 and 11 (39) 15 10 and 12 (38) 16 10 and 13 (388) 17 14 or 15 or 16 (429)
= 429 (426 uniek) |
498 |
|
Embase (Elsevier) |
('hemangioma'/exp OR hemangioma*:ab,ti OR haemangioma*:ab,ti)
AND ('infancy'/exp OR infant*:ab,ti OR infancy:ab,ti OR juvenile:ab,ti)
AND ('differential diagnosis'/exp OR diagnos*:ti OR 'computer assisted tomography'/exp OR tomograph*:ab,ti OR 'ct/mri':ab,ti OR mri:ab,ti OR mra:ab,ti OR 'echography'/exp OR 'echograph*':ab,ti OR echo:ab,ti OR 'nuclear magnetic resonance imaging'/exp OR imaging:ab,ti OR doppler:ab,ti OR flowmet*:ab,ti OR sonograph*:ab,ti OR ultrasonograph*:ab,ti OR angiograph*:ab,ti)
AND [english]/lim AND [1982-2019/py NOT 'conference abstract':it
NOT ('propranolol'/exp OR 'atenolol'/exp OR propranolol:ab,ti OR atenolol:ab,ti)
Gebruikte filters:
Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it
Observationeel onderzoek: 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti)
= 132 (132 uniek) |
